ライゾデグ配合注 フレックスタッチ
ライゾデグ配合注 ペンフィル
2.7.6 個々の試験のまとめ
ノボ ノルディスク ファーマ株式会社
目次
ページ目次
...
2.7.6 個々の試験のまとめ...
2.7.6 個々の試験のまとめ ...
2.7.6.1 NN1250-1992...
2.7.6.1 NN1250-1992 ...
2.7.6.2 NN5401-1980...
2.7.6.2 NN5401-1980 ...
2.7.6.3 NN5401-1985...
2.7.6.3 NN1250-1985 ...
2.7.6.4 NN1250-1988...
2.7.6.4 NN1250-1988 ...
2.7.6.5 NN1250-3769...
2.7.6.5 NN1250-3769 ...
2.7.6.6 NN5401-1981...
2.7.6.6 NN5401-1981 ...
2.7.6.7 NN5401-1982...
2.7.6.7 NN5401-1982 ...
2.7.6.8 NN1250-1989...
2.7.6.8 NN1250-1989 ...
2.7.6.9 NN1250-1990...
2.7.6.9 NN1250-1990 ...
2.7.6.10 NN1250-1994...
2.7.6.10 NN1250-1994 ...
2.7.6.11 NN1250-1995...
2.7.6.11 NN1250-1995 ...
2.7.6.12 NN1250-3762...
2.7.6.12 NN1250-3762 試験...
2.7.6.13 NN5401-1788...
2.7.6.13 NN5401-1788 ...
2.7.6.14 NN5401-1790...
2.7.6.14 NN5401-1790 ...
2.7.6.15 NN5401-1983...
2.7.6.15 NN5401-1983 ...
2.7.6.16 NN1250-1996...
2.7.6.16 NN1250-1996 ...
2.7.6.17 NN5401-1959...
2.7.6.17 NN5401-1959 ...
2.7.6.18 NN5401-3539...
2.7.6.18 NN5401-3539 ...
2.7.6.19 NN5401-1977...
2.7.6.19 NN5401-1977 ...
Page 2 of 22042
11
11
23
23
29
29
34
34
39
39
43
43
47
47
53
53
58
58
63
63
68
68
73
73
77
77
82
82
88
88
95
95
100
100
105
105
110
110
116
116
2.7.6.20 NN5401-3857...
2.7.6.20 NN5401-3857 ...
2.7.6.21 NN1250-1991...
2.7.6.21 NN1250-1991 ...
2.7.6.22 NN1250-1993...
2.7.6.22 NN1250-1993 ...
2.7.6.23 NN1250-3678...
2.7.6.23 NN1250-3678 ...
2.7.6.24 NN5401-1718 (Part1)...
2.7.6.24 NN5401-1718(Part 1)...
2.7.6.25 NN5401-1718 (Part2)...
2.7.6.25 NN5401-1718(Part 2)...
2.7.6.26 NN5401-1719...
2.7.6.26 NN5401-1719 ...
2.7.6.27 NN5401-1738 (Part1)...
2.7.6.27 NN5401-1738(Part 1)...
2.7.6.28 NN5401-1738 (Part2)...
2.7.6.28 NN5401-1738(Part 2)...
2.7.6.29 NN5401-1740...
2.7.6.29 NN5401-1740 ...
2.7.6.30 NN5401-1978...
2.7.6.30 NN5401-1978 ...
2.7.6.31 NN1250-1876...
2.7.6.31 NN1250-1876 ...
2.7.6.32 NN1250-1987...
2.7.6.32 NN1250-1987 ...
2.7.6.33 NN1250-3538...
2.7.6.33 NN1250-3538 ...
2.7.6.34 NN5401-3570...
2.7.6.34 NN5401-3570 試験...
2.7.6.35 NN5401-3597...
2.7.6.35 NN5401-3597 ...
2.7.6.36 NN5401-3896...
2.7.6.36 NN5401-3896 ...
2.7.6.37 NN5401-1791...
2.7.6.37 NN5401-1791 ...
2.7.6.38 NN5401-1792...
2.7.6.38 NN5401-1792 ...
2.7.6.39 NN5401-3590...
2.7.6.39 NN5401-3590 ...
2.7.6.40 NN5401-3592...
2.7.6.40 NN5401-3592 ...
2.7.6.41 NN5401-3593...
2.7.6.41 NN5401-3593 ...
2.7.6.42 NN5401-3594...
Page 3 of 2204122
122
128
128
133
133
138
138
143
143
148
148
153
153
158
158
164
164
169
169
176
176
181
181
185
185
190
190
196
196
206
206
232
232
259
259
270
270
282
282
292
292
302
302
312
2.7.6.42 NN5401-3594 試験...
2.7.6.43 NN5401-3645...
2.7.6.43 NN5401-3645 ...
2.7.6.44 NN1250-1835...
2.7.6.44 NN1250-1835 ...
2.7.6.45 NN1250-1836...
2.7.6.45 NN1250-1836 ...
2.7.6.46 NN1250-3569...
2.7.6.46 NN1250-3569 ...
2.7.6.47 NN1250-3579...
2.7.6.47 NN1250-3579 ...
2.7.6.48 NN1250-3580...
2.7.6.48 NN1250-3580 ...
2.7.6.49 NN1250-3582...
2.7.6.49 NN1250-3582 ...
2.7.6.50 NN1250-3583...
2.7.6.50 NN1250-3583 ...
2.7.6.51 NN1250-3585...
2.7.6.51 NN1250-3585 ...
2.7.6.52 NN1250-3725...
2.7.6.52 NN1250-3725 ...
2.7.6.53 NN1250-3586...
2.7.6.53 NN1250-3586 ...
2.7.6.54 NN1250-3668...
2.7.6.54 NN1250-3668 ...
2.7.6.55 NN1250-3672...
2.7.6.55 NN1250-3672 ...
2.7.6.56 NN1250-3718...
2.7.6.56 NN1250-3718 ...
2.7.6.57 NN1250-3724...
2.7.6.57 NN1250-3724 ...
2.7.6.58 NN1250-3770...
2.7.6.58 NN1250-3770 ...
2.7.6.59 NN1250-3839...
2.7.6.59 NN1250-3839 ...
2.7.6.60 NN1250-3765...
2.7.6.60 NN1250-3765 ...
2.7.6.61 有害事象に関する一覧(NN1250-3585) ...
表
2.7.6.61 -1 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3585 試験) ...
表
2.7.6.61 -2 有害事象により治験を中止した被験者の有害事象一覧 - 安全性解析対
象(3585 試験) ...
表
2.7.6.61 -3 死亡例及び因果関係が否定できない重篤な有害事象、その他検討すべ
き有害事象の叙述(3585 試験) ...
Page 4 of 2204312
322
322
332
332
341
341
351
351
360
360
369
369
378
378
387
387
397
397
424
424
455
455
480
480
490
490
498
498
506
506
514
514
523
523
530
530
538
538
588
592
表
2.7.6.61 -4 死亡、その他の重篤な有害事象及び他のいくつかの重要な有害事象の
叙述(英語版)(3585 試験) ...
Serious Adverse Events ...
Withdrawals due to Adverse Events...
Other Significant Adverse Events...
Medication Errors ...
2.7.6.62 有害事象に関する一覧(NN1250-3725) ...
表
2.7.6.62-1 重篤な有害事象が報告された被験者の有害事象一覧- 安全性解析対象(
3725 試験)...
表
2.7.6.62 -2 有害事象により治験を中止した被験者の有害事象一覧- 安全性解析対
象(3725 試験)...
表
2.7.6-62-3 死亡例及び因果関係が否定できない重篤な有害事象、その他検討すべ
き有害事象の叙述(3585/3725 試験) ...
表
2.7.6-62-4 死亡、その他の重篤な有害事象及び他のいくつかの重要な有害事象の
叙述(英語版)(3585/3725 試験) ...
Subject No. 101001, Case No. 310733...
Subject No. 101001, Case No. 311561...
Subject No. 102004, Case No. 308421...
Subject No. 102009,Case No. 309787...
Subject No. 103001, Case No. 305828...
Subject No. 104004, Case No. 311260...
Subject No. 104007,Case No. 307638...
Subject No. 105008, CaseNo. 312488...
Subject No. 105008, Case No. 313947...
Subject No. 105019, Case No. 311014...
Subject No. 105020, Case No. 316508...
Subject No. 106011, Case No. 309109...
Subject No. 106011, Case No. 310390...
Subject No. 106021, Case No. 311599...
Subject No. 107002, Case No. 305749...
Subject No. 107013, Case No. 307983...
Subject No. 108006, Case No. 312569...
Subject No. 108009, Case No. 310463...
Subject No. 108010, Case No. 312709...
Subject No. 109001, Case No. 307655...
Subject No. 109014, Case No. 313881...
Subject No. 110002, Case No. 306619...
Subject No. 113005, Case No. 310132...
Subject No. 113007, Case No. 311798...
Subject No. 114001, Case No. 313941...
Subject No. 115001, Case No. 310874...
Subject No. 207009, Case No. 310460...
Subject No. 209004, Case No. 311643...
Subject No. 209005, Case No. 309284...
Page 5 of 2204
652
653
674
653
656
746
746
847
857
971
974
975
976
978
979
980
982
983
984
986
987
988
990
991
993
994
995
997
998
1000
1001
1002
1003
1005
1006
1007
1008
1011
1012
Subject No. 209006, Case No. 311137...
Subject No. 402004, Case No. 309327...
Subject No. 403002, Case No. 314845...
Subject No. 403005, Case No. 311256...
Subject No. 405003, Case No. 309542...
Subject No. 405005 Case No. 314312...
Subject No. 407002, Case No. 313830...
Subject No. 407007, Case No. 313534...
Subject No. 408002, Case No. 310976...
Subject No. 408005, Case No. 311509...
Subject No. 410003, Case No. 310948...
Subject No. 410003, Case No. 312927...
Subject No. 410003, Case No. 316924...
Subject No. 411003, Case No. 316499...
Subject No. 412001, Case No. 306315...
Subject No. 412001, Case No. 311094...
Subject No. 412003, Case No. 309942...
Subject No. 413002, Case No. 312489...
Subject No. 413003, Case No. 308323...
Subject No. 413004, Case No. 313703...
Subject No. 413006, Case No. 314939...
Subject No. 501005, Case No. 314330...
Subject No. 503002, Case No. 310934...
Subject No. 503003, Case No. 308290...
Subject No. 508004, Case No. 309481...
Subject No. 601005, Case No. 311918...
Subject No. 603008, Case No. 310476...
Subject No. 603008, Case No. 324347...
Subject No. 603011, Case No. 318621...
Subject No. 700002, Case No. 307982...
Subject No. 101002, Case No. 315905...
Subject No. 101005,Case No. 319258...
Subject No. 101005, Case No. 319954...
Subject No. 105003, Case No. 325770...
Subject No. 107002, Case No. 316281...
Subject No. 107011, Case No. 319775...
Subject No. 108010, Case No. 320237...
Subject No. 109002, Case No. 320156...
Subject No. 110004, Case No. 325433...
Subject No. 111002, Case No. 321237...
Subject No. 111007, Case No. 318520...
Subject No. 114001, Case No. 324737...
Subject No. 115004, Case No. 319880...
Subject No. 115009, Case No. 316425...
Subject No. 209004, Case No. 319394...
Page 6 of 2204
1015
1017
1019
1020
1022
1024
1026
1027
1028
1029
1031
1033
1034
1035
1037
1038
1039
1041
1042
1044
1045
1047
1048
1049
1051
1052
1053
1055
1057
1058
1059
1062
1064
1066
1068
1069
1071
1073
1075
1076
1078
1080
1082
1084
1085
Subject No. 209006, Case No. 321535...
Subject No. 401007, Case No. 326604...
Subject No. 403002, Case No. 318254...
Subject No. 404007, Case No. 323116...
Subject No. 408001, Case No. 319345...
Subject No. 410003, Case No. 320182...
Subject No. 410003, Case No. 327652...
Subject No. 412001, Case No. 323615...
Subject No. 413002, Case No. 320858...
Subject No. 503002, Case No. 321462...
Subject No. 505001, Case No. 322614...
Subject No. 507002, Case No. 317826...
Subject No. 508004, Case No. 317191...
Subject No. 508006, Case No. 322391...
Subject No. 700005, Case No. 319071...
Subject No. 108010...
Subject No. 109011...
Subject No. 709004...
Subject No. 108006...
Subject No. 505001...
Subject No. 103005...
Subject No. 103011...
Subject No. 105016...
Subject No. 106025...
Subject No. 108004...
Subject No. 412001...
Subject No. 103004...
2.7.6.63 有害事象に関する一覧(NN1250-3586) ...
表
2.7.6.63 -1 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3586 試験) ...
表
2.7.6.63 -2 有害事象により治験を中止した被験者の有害事象一覧 - 安全性解析対
象(3586 試験) ...
表
2.7.6.63 -3 死亡例及び因果関係が否定できない重篤な有害事象、その他検討すべ
き有害事象の叙述(3586 試験) ...
表
2.7.6.63 -4 死亡、その他の重篤な有害事象及び他のいくつかの重要な有害事象の
叙述(英語版)(3586 試験) ...
Deaths ...
Serious Adverse Events ...
Withdrawals due to Adverse Events...
Other Significant Adverse Events...
Medication Errors ...
2.7.6.64 有害事象に関する一覧(NN5401-1983) ...
表 2.7.6.64 -1 有害事象により治験を中止した被験者の有害事象一覧 - 安全性解析対
象(1983 試験) ...
Page 7 of 22041087
1090
1092
1093
1095
1097
1099
1100
1103
1105
1106
1109
1110
1112
1114
1117
1117
1117
1117
1118
1119
1119
1119
1119
1119
1120
1121
1123
1123
1131
1133
1152
1163
1153
1155
1161
1175
1184
1184
2.7.6.65 有害事象に関する一覧(NN5401-3570) ...
表
2.7.6.65 -1 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3570 試験) ...
表
2.7.6.65 -2 死亡、その他の重篤な有害事象の叙述(英語版)(3570 試験)...
Serious Adverse Events ...
2.7.6.66 有害事象に関する一覧(NN5401-3597) ...
表 2.7.6.66 - 1 重篤な有害事象が報告された被験者の有害事象一覧(安全性解析対象
(3597 試験) ...
表 2.7.6.66 - 2 有害事象により治験を中止した被験者の有害事象一覧(安全性解析対
象(3597 試験) ...
表
2.7.6.66 -3 死亡例及び因果関係が否定できない重篤な有害事象、その他検討すべ
き有害事象の叙述(3597 試験) ...
表
2.7.6.66 -4 死亡、その他の重篤な有害事象及び他のいくつかの重要な有害事象の
叙述(英語版)(3597 試験) ...
Deaths ...
Serious Adverse Events ...
Withdrawals due to Adverse Events...
Other Significant Adverse Events...
Medication Errors ...
2.7.6.67 有害事象に関する一覧(NN5401-3896) ...
表
2.7.6.67 - 1 重篤な有害事象が報告された被験者の有害事象一覧安全性解析対象(
3896 試験)...
表
2.7.6.67 – 2 有害事象により治験を中止した被験者の有害事象一覧安全性解析対
象(3896 試験)...
表
2.7.6.67 - 3 死亡例及び因果関係が否定できない重篤な有害事象、その他検討すべ
き有害事象の叙述(3896 試験) ...
表
2.7.6.67 - 4 死亡、その他の重篤な有害事象及び他のいくつかの重要な有害事象の
叙述(英語版)(3896 試験)...
Subject 402003, Case 335918...
Subject 402005, Case 335507...
Subject 402008, Case 326287...
Subject 402009, Case 328041...
Subject 408002, Case 322302...
Subject 410002, Case 330087...
Subject 407002, Case 328848...
Subject 421002, Case 322701...
Subject 429003, Case 327245...
Subject 429003, Case 328613...
Subject 433008, Case 329999...
Subject 435002, Case 332933...
Subject 437002, Case 322886...
Subject 437006, Case 335114...
Subject 437008, Case 335116...
Subject 439004, Case 328308...
Page 8 of 22041186
1186
1187
1188
1191
1191
1214
1219
1252
1280
1253
1254
1271
1253
1314
1314
1318
1320
1330
1331
1332
1333
1334
1335
1336
1337
1338
1339
1340
1341
1342
1343
1344
1345
1346
Subject 440004, Case 327248...
Subject 440005, Case 334254...
Subject 445001, Case 327251...
Subject 446002, Case 334695...
Subject 447007, Case 327247...
Subject 447009, Case 334701...
Subject 402005 ...
Subject 405009 ...
Subject 410002 ...
Subject 419002 ...
Subject 419007 ...
Subject 430004 ...
Subject 431009 ...
Subject 435002 ...
Subject 437002 ...
Subject 440005 ...
Subject 447007 ...
2.7.6.68 有害事象に関する一覧(日本人を含まない臨床試験)...
表 2.7.6.68-1 重篤な有害事象が報告された被験者で発現した有害事象一覧(1959 試
験)
...
表 2.7.6.68-2 重篤な有害事象が報告された被験者で発現した有害事象一覧(1982 試
験)
...
表 2.7.6.68-3 重篤な有害事象が報告された被験者で発現した有害事象一覧(1987 試
験)
...
表 2.7.6.68-4 重篤な有害事象が報告された被験者で発現した有害事象一覧(1993 試
験)
...
表 2.7.6.68-5 重篤な有害事象が報告された被験者で発現した有害事象一覧(1994 試
験)
...
表 2.7.6.68-6 重篤な有害事象が報告された被験者で発現した有害事象一覧(1995 試
験)
...
表 2.7.6.68-7 重篤な有害事象が報告された被験者で発現した有害事象一覧(3538 試
験)
...
表 2.7.6.68-8 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(1835 試験) ...
表 2.7.6.68-9 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(1836 試験) ...
表 2.7.6.68-10 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(1791 試験) ...
表 2.7.6.68-11 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(1792 試験) ...
表 2.7.6.68-12 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3668 試験) ...
表 2.7.6.68-13 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3770 試験) ...
Page 9 of 22041347
1349
1350
1351
1352
1353
1357
1355
1355
1356
1356
1355
1355
1356
1356
1355
1356
1359
1359
1360
1361
1362
1363
1364
1365
1366
1369
1371
1373
1374
1386
表 2.7.6.68-14 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3579 試験) ...
表 2.7.6.68-15 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3580 試験) ...
表 2.7.6.68-16 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3582 試験) ...
表 2.7.6.68-17 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3583 試験) ...
表 2.7.6.68-18 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3672 試験) ...
表 2.7.6.68-19 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3718 試験) ...
表 2.7.6.68-20 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3724 試験) ...
表 2.7.6.68-21 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3590 試験) ...
表 2.7.6.68-22 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3592 試験) ...
表 2.7.6.68-23 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3593 試験) ...
表 2.7.6.68-24 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3594 試験) ...
表 2.7.6.68-25 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3594/3645 試験)...
表 2.7.6.68-26 重篤な有害事象が報告された被験者の有害事象一覧 - 安全性解析対象
(3839 試験) ...
Page 10 of 22041415
1506
1524
1788
1915
1938
1958
1968
1982
2016
2025
2086
2204
2.7.6
個々の試験のまとめ
被験薬の表記について 本Module では被験薬の「インスリン デグルデク(略号:IDeg)」及びインスリン デクルデクとイ ンスリン アスパルト(略号:IAsp)を配合した「インスリン デグルデク/インスリン アスパルト(略 号:IDegAsp)」を、以下に示すように治験総括報告書で用いた名称で表記した。 被験薬 本Module における表記IDeg insulin 454(I454)、SIBA 又は IDeg
IDegAsp SIAM、SIAC 又は IDegAsp
試験ID について 開発フェーズの後期に実施された臨床試験では、IDeg を用いた試験は「NN1250」に 4 桁の固有番号 を、IDegAsp を用いた試験は「NN5401」に 4 桁の固有番号を付した試験番号で識別される。しかし、 開発フェーズの初期に実施された臨床試験においては、検討している薬剤がIDeg 又は IDegAsp のいず れであっても、すべて「NN5401」に 4 桁の固有番号を付した試験番号が使用された(例:NN5401-1788)。 有害事象に関して 各臨床試験において、有害事象のコーディングにはICH 国際医薬用語集(MedDRA)のその時点で の最新版を用いた(9.0 版~14.0 版)。日本人を含む臨床試験で有害事象のコーディングに用いられた MedDRA バージョンは、10.0 版(1788 試験)、10.1 版(1790 試験)、12.0 版(3570 試験)、13.1 版 (1983 試験、1996 試験、3585 試験、3586 試験及び 3597 試験)及び 14.0 版(3585/3725 試験及び 3896 試験)であった。また、原著は英語であったため、日本語翻訳にあたって、すべての日本人を含む臨 床試験(3585/3725 試験及び 3896 試験を除く)には MedDRA/J 13.1 版を用いた。3585/3725 試験及び 3896 試験には MedDRA/J 14.0 版を用いた。 有害事象に関する一覧(重篤な有害事象が報告された被験者で報告された有害事象一覧、有害事象 が原因で治験を中止した被験者で報告された有害事象一覧ならびに死亡及び重篤な有害事象の叙述一 覧)は、2.7.6.61 より示した。 Page 11 of 2204
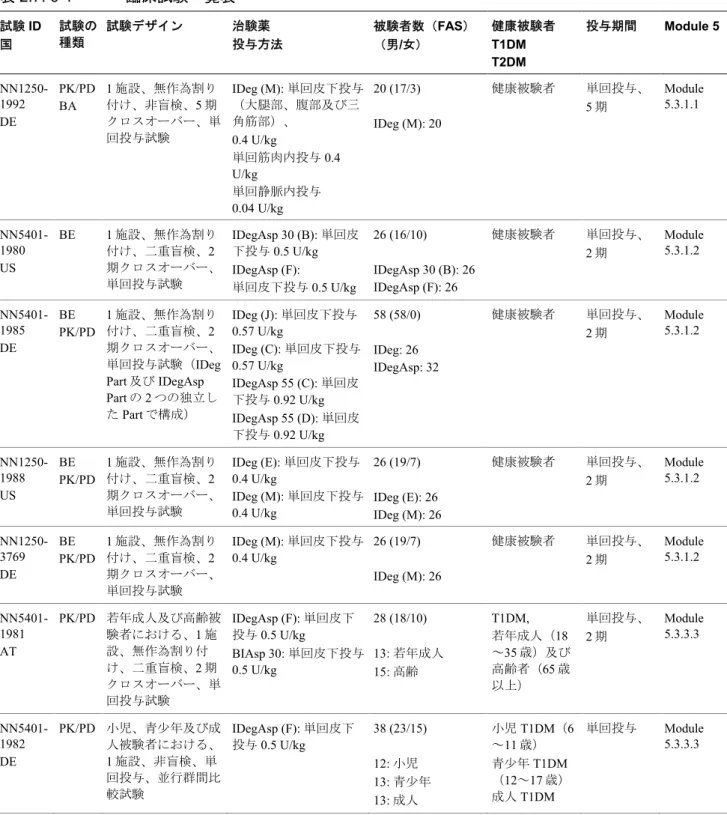
表2.7. 6-1 臨床試験一覧表 試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN1250-1992 DE PK/PD BA 1 施設、無作為割り 付け、非盲検、5 期 クロスオーバー、単 回投与試験 IDeg (M): 単回皮下投与 (大腿部、腹部及び三 角筋部)、 0.4 U/kg 単回筋肉内投与0.4 U/kg 単回静脈内投与 0.04 U/kg 20 (17/3) IDeg (M): 20 健康被験者 単回投与、 5 期 Module 5.3.1.1 NN5401-1980 US BE 1 施設、無作為割り 付け、二重盲検、2 期クロスオーバー、 単回投与試験 IDegAsp 30 (B): 単回皮 下投与0.5 U/kg IDegAsp (F): 単回皮下投与0.5 U/kg 26 (16/10) IDegAsp 30 (B): 26 IDegAsp (F): 26 健康被験者 単回投与、 2 期 Module 5.3.1.2 NN5401-1985 DE BE PK/PD 1 施設、無作為割り 付け、二重盲検、2 期クロスオーバー、 単回投与試験(IDeg Part 及び IDegAsp Part の 2 つの独立し たPart で構成) IDeg (J): 単回皮下投与 0.57 U/kg IDeg (C): 単回皮下投与 0.57 U/kg IDegAsp 55 (C): 単回皮 下投与0.92 U/kg IDegAsp 55 (D): 単回皮 下投与0.92 U/kg 58 (58/0) IDeg: 26 IDegAsp: 32 健康被験者 単回投与、 2 期 Module 5.3.1.2 NN1250-1988 US BE PK/PD 1 施設、無作為割り 付け、二重盲検、2 期クロスオーバー、 単回投与試験 IDeg (E): 単回皮下投与 0.4 U/kg IDeg (M): 単回皮下投与 0.4 U/kg 26 (19/7) IDeg (E): 26 IDeg (M): 26 健康被験者 単回投与、 2 期 Module 5.3.1.2 NN1250-3769 DE BE PK/PD 1 施設、無作為割り 付け、二重盲検、2 期クロスオーバー、 単回投与試験 IDeg (M): 単回皮下投与 0.4 U/kg 26 (19/7) IDeg (M): 26 健康被験者 単回投与、 2 期 Module 5.3.1.2 NN5401-1981 AT PK/PD 若年成人及び高齢被 験者における、1 施 設、無作為割り付 け、二重盲検、2 期 クロスオーバー、単 回投与試験 IDegAsp (F): 単回皮下 投与0.5 U/kg BIAsp 30: 単回皮下投与 0.5 U/kg 28 (18/10) 13: 若年成人 15: 高齢 T1DM, 若年成人(18 ~35 歳)及び 高齢者(65 歳 以上) 単回投与、 2 期 Module 5.3.3.3 NN5401-1982 DE PK/PD 小児、青少年及び成 人被験者における、 1 施設、非盲検、単 回投与、並行群間比 較試験 IDegAsp (F): 単回皮下 投与0.5 U/kg 38 (23/15) 12: 小児 13: 青少年 13: 成人 小児T1DM(6 ~11 歳) 青少年T1DM (12~17 歳) 成人T1DM 単回投与 Module 5.3.3.3 Page 12 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN1250-1989 SK PK 1 施設、非盲検、単 回投与、並行群間比 較試験 IDeg (M): 単回皮下投与 0.4 U/kg 24 (8/16) 6: 正常な肝機能を 有する被験者 6: 軽度の肝障害を 有する被験者 6: 中等度の肝障害 を有する被験者 6: 重度の肝障害を 有する被験者 重症度の異な る肝障害を有 する被験者及 び正常な肝機 能を有する被 験者(肝障害 を有する被験 者では糖尿病 の併発は可) 単回投与 Module 5.3.3.3 NN1250-1990 HU PK 1 施設、非盲検、単 回投与、並行群間比 較試験 IDeg (M): 単回皮下投与 0.4 U/kg 30 (15/15) 6: 正常な腎機能を 有する被験者 6: 軽度の腎障害を 有する被験者 6: 中等度の腎障害 を有する被験者 6: 重度の腎障害を 有する被験者 6: 末期腎疾患を有 する被験者 重症度の異な る腎障害を有 する被験者及 び正常な腎機 能を有する被 験者 単回投与 Module 5.3.3.3 NN1250-1994 AT PK/PD 若年成人及び高齢被 験者における、1 施 設、無作為割り付 け、二重盲検、2 期 クロスオーバー、反 復投与試験 IDeg (M): 1 日 1 回皮下 投与(計6 回)0.4 U/kg IGlar: 1 日 1 回皮下投与 (計6 回)0.4 U/kg 27 (13/14) 13: 若年成人 14: 高齢 T1DM, 若年成人(18 ~35 歳)及び 高齢者(65 歳 以上) 6 日間、 2 期 Module 5.3.3.3 NN1250-1995 DE PK 小児、青少年及び成 人被験者における、 1 施設、無作為割り 付け、二重盲検、2 期クロスオーバー、 単回投与試験 IDeg (M): 単回皮下投与 0.4 U/kg IGlar: 単回皮下投与 0.4 U/kg 37 (20/17) 12: 小児 13: 青少年 12: 成人 小児T1DM(6 ~11 歳) 青少年T1DM (12~17 歳) 成人T1DM 単回投与、 2 期 Module 5.3.3.3 NN1250-3762 US PK/PD 3 つの異なる民族/ 人種における、1 施 設、無作為割り付 け、二重盲検、2 期 クロスオーバー、反 復投与試験 IDeg (M): 1 日 1 回皮下 投与(計6 回)0.6 U/kg IDet: 1 日 1 回皮下投与 (計6 回)0.6 U/kg 63 (37/26) 18: アフリカ系アメ リカ人 22: ヒスパニック 23: コーカシアン T2DM 6 日間、 2 期 Module 5.3.3.3 NN5401-1788 DE PK/PD 日本人被験者におけ る、1 施設、無作為 割り付け、二重盲 検、プラセボ対照、 単回投与、並行群間 比較試験 IDeg (B): 単回皮下投与 0.3、0.6、1.2 U/kg IDegAsp 50 (A): 単回投 与0.9 U/kg. 32 (32/0) IDeg (B): 16 IDegAsp 50 (A): 8 プラセボ: 8 健康被験者 単回投与 Module 5.3.4.1 Page 13 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN5401-1790 JP PK/PD 日本人被験者におけ る、1 施設、無作為 割り付け、二重盲 検、プラセボ対照、 反復投与、並行群間 比較試験 IDeg (D): 1 日 1 回皮下 投与(計6 回)0.1 U/kg IDeg (E): 1 日 1 回皮下 投与(計6 回)0.1 U/kg IDegAsp 30 (B): 1 日 1 回皮下投与(計6 回) 0.1 U/kg IDegAsp 45 (B): 1 日 1 回皮下投与(計6 回) 0.1 U/kg 32 (32/0) IDeg: 12 IDegAsp: 12 プラセボ: 8 健康被験者 6 日間 Module 5.3.4.1 NN5401-1983 JP PK/PD 1 施設、無作為割り 付け、二重盲検、2 期クロスオーバー試 験 IDegAsp (F): 単回皮下 投与0.5 U/kg BIAsp 30: 単回皮下投与 0.5 U/kg 21 (11/10) IDegAsp (F): 21 BIAsp 30: 21 T1DM 単回投与 2 期 Module 5.3.4.2 NN1250-1996 JP PK/PD 日本人被験者におけ る、1 施設、無作為 割り付け、二重盲 検、2 期クロスオー バー、反復投与試験 IDeg (M): 1 日 1 回皮下 投与(計6 回)0.4 U/kg IDet: 1 日 1 回皮下投与 (計6 回)0.4 U/kg 22 (14/8) IDeg (M): 22 IDet: 22 T1DM 6 日間 2 期 Module 5.3.4.2 NN5401-1959 DE PK/PD 1 施設、無作為割り 付け、二重盲検、単 回投与、不完備型ブ ロック法、多期クロ スオーバー試験 単回皮下投与: 1) IDegAsp 30 (B): IAsp 0.28 U/kg + IDeg 0.64 U/kg 2) IAsp 0.28 U/kg + IDeg (E) 0.64 U/kg 3) IDegAsp 40 (C): IAsp 0.28 U/kg + IDeg 0.64 U/kg) 4) IAsp 0.28 U/kg + IDeg (D) 0.63 U/kg 5) IDegAsp 45 (B): IAsp 0.41 U/kg + IDeg 0.51 U/kg 6) IAsp 0.41 U/kg + IDeg (E) 0.51 U/kg 7) IDegAsp 55 (C): IAsp 0.41 U/kg + IDeg 0.51 U/kg 8) IAsp: 0.41 U/kg + IDeg (D) 0.51 U/kg 9) BIAsp 30: 0.64 U/kg 55 (49/6) 1) 23 2) 21 3) 29 4) 29 5) 19 6) 19 7) 24 8) 27 9) 24 T1DM 単回投与 4 期 Module 5.3.4.2 NN5401-3539 DE PK/PD 1 施設、無作為割り 付け、二重盲検、不 完備型ブロック法、 4 期クロスオーバー 試験 IDegAsp (F): 単回皮下 投与0.4、0.6、0.8 U/kg BIAsp 30: 単回皮下投与 0.4、0.6、0.8 U/kg 33 (28/5) IDegAsp (F): 33 BIAsp 30: 33 T1DM 単回投与 4 期 Module 5.3.4.2 Page 14 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN5401-1977 DE PK/PD 1 施設、無作為割り 付け、非盲検、単回 投与、3 期クロスオ ーバー試験 IDegAsp (F): 単回皮下 投与0.5 U/kg IDeg (M): 単回皮下投与 0.5 U/kg IAsp: 単回皮下投与 0.5 U/kg s.c. 27 (24/3) IDegAsp (F): 27 IDeg (M): 27 IAsp: 27 T1DM 単回投与 3 期 Module 5.3.4.2 NN5401-3857 DE PK/PD 1 施設、無作為割り 付け、非盲検、単回 投与、3 期クロスオ ーバー試験 IDegAsp (F): 単回皮下 投与0.5 U/kg IDeg (M): 単回皮下投与 0.5 U/kg IAsp: 単回皮下投与 0.5 U/kg 27 (26/1) IDegAsp (F): 27 IDeg (M): 27 IAsp: 27 T1DM 単回投与 3 期 Module 5.3.4.2 NN1250-1991 DE PK/PD 1 施設、無作為割り 付け、二重盲検、並 行群間比較試験 IDeg (M): 1 日 1 回皮下 投与(計12 回)0.4 U/kg IGlar: 1 日 1 回皮下投与 (計12 回)0.4 U/kg 54 (48/6) IDeg (M): 27 IGlar: 27 T1DM 12 日間 Module 5.3.4.2 NN1250-1993 DE PK/PD 1 施設、無作為割り 付け、二重盲検、反 復投与、不完備型ブ ロック法、2 期クロ スオーバー試験 IDeg (M): 1 日 1 回皮下 投与(計8 回)0.4、 0.6、0.8 U/kg IGlar: 1 日 1 回皮下投与 (計8 回)0.4、0.6、 0.8 U/kg 66 (55/11) IDeg (M): 66 IGlar: 66 T1DM 8 日間 2 期 Module 5.3.4.2 NN1250-3678 AT PK/PD 1 施設、無作為割り 付け、二重盲検、反 復投与、2 期クロス オーバー試験 IDeg (M): 1 日 1 回皮下 投与(計8 回) 0.4 U/kg. IDeg (P): 1 日 1 回皮下 投与(計8 回) 0.4 U/kg 33 (31/2) IDeg (M): 33 IDeg (P): 33 T1DM 8 日間 2 期 Module 5.3.4.2 NN5401-1718 DE PK/PD Part 1: 1 施設、無作為割り 付け、二重盲検、プ ラセボ対照、単回投 与、用量漸増試験 Part 2: 1 施設、無作為割り 付け、二重盲検、単 回投与、2 期クロス オーバー試験 Part 1: IDeg (A): 単回皮下投与 0.3、0.6、1.2、2.4、 3.6 U/kg Part 2, T1DM: IDeg (A): 単回皮下投与 0.88 U/kg NPH: 単回皮下投与 0.4 U/kg Part 2, T2DM: IDeg (A): 単回皮下投与 1.32 U/kg NPH: 単回皮下投与 0.6 U/kg Part 1: 健康被験者: 40 (40/0) IDeg (A): 30 Placebo: 10 Part 2: T1DM: 12 (12/0) IDeg (A): 12 NPH: 12 T2DM: 12 (12/0) IDeg (A): 12 NPH: 12 健康被験者, T1DM T2DM Part 1: 単回投与 Part 2: 単回投与 2 期 Module 5.3.4.2 Page 15 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN5401-1719 DE PK/PD 1 施設、無作為割り 付け、二重盲検、単 回投与、用量反応、 6 期クロスオーバー 試験 T1DM: IDeg (B): 単回皮下投与 0.43, 0.87, 1.73 U/kg IGlar: 単回皮下投与 0.3, 0.6, 1.2 U/kg T2DM: IDeg (B): 単回皮下投与 0.58, 1.17, 2.33 U/kg IGlar: 単回皮下投与 0.4, 0.8, 1.6 U/kg T1DM: 20 (20/0) IDeg (B): 20 IGlar: 20 T2DM:20 (20/0) IDeg (B): 20 IGlar: 20 T1DM T2DM 単回投与 6 期 Module 5.3.4.2 NN5401-1738 DE PK/PD 1 施設、無作為割り 付け、二重盲検、不 完備型ブロック法、 多期クロスオーバー 試験 Part 1: DegAsp 30 (A): 単回皮 下投与0.97 U/kg, IDegAsp 40 (A): 単回皮 下投与0.95 U/kg, IDegAsp 50 (A): 単回皮 下投与0.95 U/kg IDeg (B) + IAsp: 単回皮 下投与0.96 U/kg IDeg (C) + IAsp: 単回皮 下投与0.96 U/kg BIAsp 30: 単回皮下投与 0.64 U/kg Part 2: IDegAsp 40 (A): 単回皮 下投与1.2 U/kg IDegAsp 50 (A): 単回皮 下投与1.2 U/kg BIAsp 30: 単回皮下投与 0.8 U/kg Part 1: 38 (38/0) (T1DM) Part 2: 21 (21/0) (T2DM) T1DM T2DM Part 1: 単回投与 5 期 Part 2: 単回投与 3 期 Module 5.3.4.2 NN5401-1740 DE PK/PD 1 施設、非盲検、反 復投与試験 Part 1: IDeg (B): 1 日 1 回皮下 投与(計6 回)0.4 U/kg Part 2: IDeg (B): 1 日 2 回皮下 投与(計6 回)0.8 U/kg Part 3: IDeg (C): 1 日 1 回皮下 投与(計6 回)0.8 U/kg 36 (36/0) Part 1: 12 (12/0) Part 2: 12 (12/0) Part 3: 12 (12/0) T1DM 6 日間 Module 5.3.4.2 NN5401-1978 DE PK/PD 1 施設、無作為割り 付け、二重盲検、単 回投与、不完備型ブ ロック法、クロスオ ーバー試験 IDegAsp (F): 単回皮下 投与0.4、0.6、0.8 U/kg BIAsp 30: 単回皮下投与 0.4、0.6、0.8 U/kg 39 (32/7) IDegAsp (F): 39 BIAsp 30: 39 T2DM 単回投与 4 期 Module 5.3.4.2 Page 16 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN1250-1876 DE PK/PD 1 施設、無作為割り 付け、二重盲検、反 復投与、不完備型ブ ロック法、2 期クロ スオーバー試験 IDeg (E): 1 日 1 回皮下 投与(計8 回)0.28、 0.57、0.85 U/kg IGlar: 1 日 1 回皮下投与 (計8 回)0.2、0.4、 0.6 U/kg 63 (54/9) IDeg (E): 63 IGlar: 63 T1DM 8 日間 2 期 Module 5.3.4.2 NN1250-1987 DE PK/PD 1 施設、無作為割り 付け、二重盲検、反 復投与、不完備型ブ ロック法、2 期クロ スオーバー試験 IDeg (M): 1 日 1 回皮下 投与(計6 回)0.4、 0.6、0.8 U/kg IDeg (P): 1 日 1 回皮下 投与(計6 回)0.6 U/kg 49 (40/9) IDeg (M): 49 IDeg (P): 16 T2DM 6 日間 2 期 Module 5.3.4.2 NN1250-3538 AT PK/PD 1 施設、無作為割り 付け、二重盲検、反 復投与、2 期クロス オーバー試験 IDeg (M): 1 日 1 回皮下 投与。個々のBasal イ ンスリン必要量の80% (計4 回)及び個々の Basal インスリン必要量 の3 倍(1 回) IGlar: 1 日 1 回皮下投 与。個々のBasal イン スリン必要量の80% (計4 回)及び個々の Basal インスリン必要量 の3 倍(1 回) 28 (20/8) IDeg: (M): 28 IGlar: 28 T1DM 5 日間 2 期 Module 5.3.4.2 NN5401-3570 JP 有効性 安全性 多施設、無作為割り 付け(1:1)、非盲 検、実薬対照 (BIAsp 30)、並行 群間比較試験 IDegAsp 30 (B): 1 日 2 回皮下投与 BIAsp 30: 1 日 2 回皮下 投与 65 (42/23) (安全性解析対 象) IDegAsp 30 (B): 33 BIAsp 30: 32 T2DM 6 週間 Module 5.3.5.1. NN5401-3597 JP, KR, HK, MY, TW 有効性 安全性 多施設、Pan-Asian、 無作為割り付け (2:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDegAsp (F): 1 日 2 回皮 下投与 BIAsp 30: 1 日 2 回皮下 投与 ± Met 経口投与 +BHI 30 皮下投与(事 後調査期間) 422 (230/192) IDegAsp (F): 280 BIAsp 30: 142 T2DM 26 週間 Module 5.3.5.1 NN5401-3896 JP 有効性 安全性 多施設、無作為割り 付け(1:1)、非盲 検、treat-to-target、 実薬対照(IGlar)、 2 群並行群間比較試 験 IDegAsp (F): 1 日 1 回皮 下投与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 ± -GI 経口投与 ± Pio 経口投与 296 (189/107) IDegAsp (F): 147 IGlar: 149 T2DM 26 週間 Module 5.3.5.1 Page 17 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN5401-1791 FR; DE; NO; RO; ES 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、3 群 並行群間比較試験 IDegAsp 30 (B): 1 日 1 回皮下投与 IDegAsp 45 (B): 1 日 1 回皮下投与 IGlar: 皮下投与 + Met 経口投与 178 (115/63) IDegAsp 30 (B): 59 IDegAsp 45 (B): 59 IGlar: 60 T2DM 16 週間 Module 5.3.5.1 NN5401-1792 FI; FR; DE; PL; ES 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1:1)、非盲検、 treat-to-target、実薬 対照(BIAsp 30)、 3 群並行群間比較試 験 IDegAsp 30 (B): 1 日 2 回皮下投与 IDegAsp 45 (B): 1 日 2 回皮下投与 BIAsp 30: 1 日 2 回皮下 投与 + Met 経口投与 182 (97/85) IDegAsp 30 (B): 61 IDegAsp 45 (B): 59 BIAsp 30: 62 T2DM 16 週間 Module 5.3.5.1 NN5401-3590 AT, IN, KR, PL, RU, ES, TR, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDegAsp (F): 1 日 1 回皮 下投与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 + NPH 皮下投与(事後 調査期間) 529 (261/268) IDegAsp (F): 266 IGlar: 263 T2DM 26 週間 Module 5.3.5.1 NN5401-3592 AU, DK, FI, IN, MY, PL, SE, TW, TH, TR, 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(BIAsp 30)、 2 群並行群間比較試 験 IDegAsp (F): 1 日 2 回皮 下投与 BIAsp 30: 1 日 2 回皮下 投与 ± Met 経口投与 ± DPP-4 経口投与 ± Pio 経口投与 446 (248/198) IDegAsp (F): 224 BIAsp 30: 222 T2DM 26 週間 Module 5.3.5.1 NN5401-3593 HR, FR, IN, PL, ZA, KR, SE, TR, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDegAsp (F): 1 日 1 回皮 下投与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 ± DPP-4 経口投与 ± Pio 経口投与 463 (262/201) IDegAsp (F): 230 IGlar: 233 T2DM 26 週間 Module 5.3.5.1 NN5401-3594 AU, DK, PL, FR, IL, RO, RU, GB, US 有効性 安全性 多施設、多国籍、無 作為割り付け (2:1)、非盲検、 treat-to-target、実薬 対照(IDet)、2 群 並行群間比較試験 IDegAsp (F): 1 日 1 回皮 下投与(いずれかの食 事時)+ IAsp 皮下投与 (IDegAsp を投与しな い食事時) IDet: 1 日 1 回又は 2 回 皮下投与+ IAsp 皮下投 与(食事時) 548 (272/276) IDegAsp (F): 366 IDet: 182 T1DM 26 週間 Module 5.3.5.1 Page 18 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN5401-3645 (NN5401 -3594 の 延長試 験) AU, DK, PL, FR, IL, RO, RU, GB, US 有効性 安全性 多施設、多国籍、非 盲検、treat-to-target、実薬対照 (IDet)、2 群並行 群間比較試験 IDegAsp (F): 1 日 1 回皮 下投与(いずれかの食 事時)+ IAsp 皮下投与 (IDegAsp を投与しな い食事時) IDet: 1 日 1 回又は 2 回 皮下投与+ IAsp 皮下投 与(食事時) 376 (172/204) (延長試験対象集 団) IDegAsp (F): 254 IDet: 122 T1DM 26 週間 (NN5401-3594 の期間 を含め52 週 間) Module 5.3.5.1 NN1250-1835 AU, DE, NO, SE, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、3 群 並行群間比較試験 IDeg (D): 1 日 1 回皮下 投与 IDeg (E): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与 + IAsp 皮下投与(食事 時) 178 (106/72) IDeg (D): 60 IDeg (E): 59 IGlar: 59 T1DM 16 週間 Module 5.3.5.1 NN1250-1836 CA, IN, ZA, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1:1:1)、非盲 検、treat-to-target、 実薬対照(IGlar)、 4 群並行群間比較試 験 IDeg (D): 1 日 1 回皮下 投与 IDeg (E): 1 日 1 回皮下 投与 IDeg (D): 週 3 回皮下投 与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 245 (137/108) IDeg (D): OD 61 IDeg (E): OD 60 IDeg (D): 3TW 62 IGlar: 62 T2DM 16 週間 Module 5.3.5.1 NN1250-3569 JP 有効性 安全性 多施設、無作為割り 付け(1:1)、非盲 検、実薬対照 (IDet)、並行群間 比較試験 IDeg (E): 1 日 1 回皮下 投与 IDet: 1 日 1 回皮下投与 + IAsp 皮下投与(食事 時) 65 (43/22) (安全性解析対 象) IDeg (E): 33 IDet: 32 T1DM 6 週間 Module 5.3.5.1 NN1250-3579 AT, BE, CA, CZ, DK, FI, FR, DE, NO, RS, ES, US 有効性 安全性 多施設、多国籍、無 作為割り付け (3:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDeg (M): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与 + Met ± DPP-4 経口投与 + NPH 皮下投与(事後 調査期間) 1030 (638/392) IDeg (M): 773 IGlar: 257 T2DM 52 週間 Module 5.3.5.1 Page 19 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN1250-3580 AR, CA, IN, MX, ZA, TR, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(シタグリプチ ン)、2 群並行群間 比較試験 IDeg (M): 1 日 1 回皮下 投与 シタグリプチン: 1 日 1 回経口投与 + Met、SU/glin、Pio (いずれかを1 剤又は 2 剤)経口投与 447 (262/185) IDeg (M): 225 シタグリプチン: 222 T2DM 26 週間 Module 5.3.5.1 NN1250-3582 BG, DE, HK, IE, IT, RO, SK, RU, ZA, ES, TR, US 有効性 安全性 多施設、多国籍、無 作為割り付け (3:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDeg (M): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与 + IAsp 皮下投与(食事 時) ± Met 経口投与 ± Pio 経口投与 992 (538/454) IDeg (M): 744 IGlar: 248 T2DM 52 週間 Module 5.3.5.1 NN1250-3583 FR, DE, RU, GB, ZA, US 有効性 安全性 多施設、多国籍、無 作為割り付け (3:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDeg (M): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与 + IAsp 皮下投与(食事 時) + NPH 皮下投与(事後 調査期間) 629 (368/261) IDeg (M): 472 IGlar: 157 T1DM 52 週間 Module 5.3.5.1 NN1250-3585 BR, FI, IN, IT, JP, GB, MK 有効性 安全性 多施設、多国籍、無 作為割り付け (2:1)、非盲検、 treat-to-target、実薬 対照(IDet)、2 群 並行群間比較試験 IDeg (M): 1 日 1 回皮下 投与 IDet: 1 日 1 回(必要な 場合は1 日 2 回)皮下 投与 + IAsp 皮下投与(食事 時) + NPH 皮下投与(事後 調査期間) 455 (236/219) IDeg (M): 302 IDet: 153 T1DM 26 週間 Module 5.3.5.1 NN1250-3725 (NN125 0-3585 の延長 試験) BR, FI, IN, IT, JP, GB, MK 有効性 安全性 多施設、多国籍、非 盲検、treat-to-target、実薬対照 (IDet)、2 群並行 群間比較試験 IDeg (M): 1 日 1 回皮下 投与 IDet: 1 日 1 回(必要な 場合は1 日 2 回)皮下 投与 + IAsp 皮下投与(食事 時) + NPH 皮下投与(事後 調査期間) 370 (188/182) (延長試験対象集 団) IDeg (M): 248 IDet: 122 T1DM 26 週間 (NN1250-3585 の期間 を含め52 週 間) Module 5.3.5.1 Page 20 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN1250-3586 HK, JP, MY, KR, TH, TW 有効性 安全性 多施設、Pan-Asian、 無作為割り付け (2:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、2 群 並行群間比較試験 IDeg (M): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与
± Met ± SU/Glin ±α-GI 経口投与 + NPH 皮下投与(事後 調査期間) 435 (233/202) IDeg (M): 289 IGlar: 146 T2DM 26 週間 Module 5.3.5.1 NN1250-3668 IN, MY, TW, HU, MK, RS, FI, NO, GB, AR, MX, ZA, RU, IL 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、3 群 並行群間比較試験 IDeg (M): Flex(投与間 隔が8~40 時間のフレ キシブルな1 日 1 回) 皮下投与 IDeg (M): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与
± Met ± SU/Glin ± Pio 経 口投与 + NPH 皮下投与(事後 調査期間) 687 (370/317) IDeg (M) Flex: 229 IDeg (M): OD 228 IGlar: 230 T2DM 26 週間 Module 5.3.5.1 NN1250-3672 CA, FR, IE, RU, ZA, UA, GB, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、並行 群間比較試験 IDeg (P): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 ± DPP-4 経口投与 + NPH 皮下投与(事後 調査期間) 457 (243/214) IDeg (P): 228 IGlar: 229 T2DM 26 週間 Module 5.3.5.1 NN1250-3718 BG, CA, FR, NL, RO, US, HU 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、並行 群間比較試験 IDeg (P): 週 3 回皮下投 与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 ± DPP-4 経口投与 467 (267/200) IDeg (P): 233 IGlar: 234 T2DM 26 週間 Module 5.3.5.1 NN1250-3724 CA, CZ, IL, SK, ZA, GB, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、並行 群間比較試験 IDeg (P): 週 3 回皮下投 与 IGlar: 1 日 1 回皮下投与 + Met 経口投与 ± DPP-4 経口投与 459 (261/198) IDeg (P): 229 IGlar: 230 T2DM 26 週間 Module 5.3.5.1 Page 21 of 2204
試験ID 国 試験の 種類 試験デザイン 治験薬 投与方法 被験者数(FAS) (男/女) 健康被験者 T1DM T2DM 投与期間 Module 5 NN1250-3770 BE, DE, NO, PL, GB, US 有効性 安全性 多施設、多国籍、無 作為割り付け (1:1:1)、非盲検、 treat-to-target、実薬 対照(IGlar)、3 群 並行群間比較試験 IDeg (M): Flex(投与間 隔が8~40 時間のフレ キシブルな1 日 1 回) 皮下投与 IDeg (M): 1 日 1 回皮下 投与 IGlar: 1 日 1 回皮下投与 + IAsp 皮下投与(食事 時) + NPH 皮下投与(事後 調査期間) 493 (284/209) IDeg (M) Flex: 164 IDeg (M) OD: 165 IGlar: 164 T1DM 26 週間 Module 5.3.5.1 NN1250-3839 US 有効性 安全性 IGlar1 日 1 回投与か らIDeg 週 3 回投与 への切り替えを検討 した、多施設、treat-to-target、非対照(1 群)試験 IGlar: 1 日 1 回皮下投与 IDeg (P): 週 3 回皮下投 与 Met 経口投与 SU/glin 経口投与 Pio 経口投与 α-GI 経口投与 (いずれの併用も可) 129 (86/43) IGlar: 143 (allocated) IDeg (P): 129 T2DM 16 週間 (IGlar4 週 間、IDeg12 週間) Module 5.3.5.2 NN1250-3765 US 有効性 安全性 1 施設、無作為割り 付け(1:1)、二重 盲検、シングルダミ ー、クロスオーバー 試験 IDeg (P): 1 日 1 回皮下 投与 IDeg (P): 週 3 回皮下投 与 +IAsp 皮下投与(食事 時) 18 (12/6) IDeg (P) OD: 18 IDeg (P) 3TW: 18 T1DM 7 日間 2 期 Module 5.3.5.4
Country code:AU =オーストラリア、AT =オーストリア、AR =アルゼンチン、BE =ベルギー、BG =ブルガリア、BR =ブラジル、CA = カナダ、CZ =チェコ、DE =ドイツ、DK =デンマーク、ES =スペイン、FI =フィンランド、FR =フランス、GB =イギリス、HK =香港、 HR =クロアチア、HU =ハンガリー、IE =アイルランド、IL =イスラエル、IN =インド、IT =イタリア、JP =日本、KR =韓国、MK =マケ ドニア、MX =メキシコ、MY =マレーシア、NL =オランダ、NO =ノルウェー、PL =ポーランド、RO =ルーマニア、RS =セルビア、RU =ロシア、SE =スウェーデン、SK =スロバキア、TH =タイ、TR =トルコ、TW =台湾、UA =ウクライナ、US =米国、ZA =南アフリカ 略号:BA =バイオアベイラビリティ、BE =生物学的同等性、PK =薬物動態、PD =薬力学的作用、IAsp =インスリン アスパルト、IDeg =インスリン デグルデク、IDegAsp =インスリン デグルデク/インスリン アスパルト、IDet =インスリン デテミル、IGlar =インスリン グ ラルギン、T1DM =1 型糖尿病患者、T2DM =2 型糖尿病患者、Flex = IDeg のフレキシブルな投与、Met =メトホルミン、SU =スルホニル レア薬、U =単位、Glin =グリニド薬、α-GI =-グルコシダーゼ阻害薬、DPP4 =ジペプチジルペプチダーゼ-4 阻害薬、Pio =ピオグリタゾ ン、OD =1 日 1 回投与、3TW =週 3 回投与
注:IDeg に続く文字(B)はインスリン デグルデクの製剤 B を示す。IDegAsp に続く文字(A)はインスリン デグルデク/インスリン アスパルトの製剤A を示す。IDegAsp に続く数字〔IDegAsp 30(A)、IDegAsp 45(B)等〕はインスリン製剤の中のインスリン アス パルトの容量の比率(vol%)を示す。
2.7.6.1 NN1250-1992
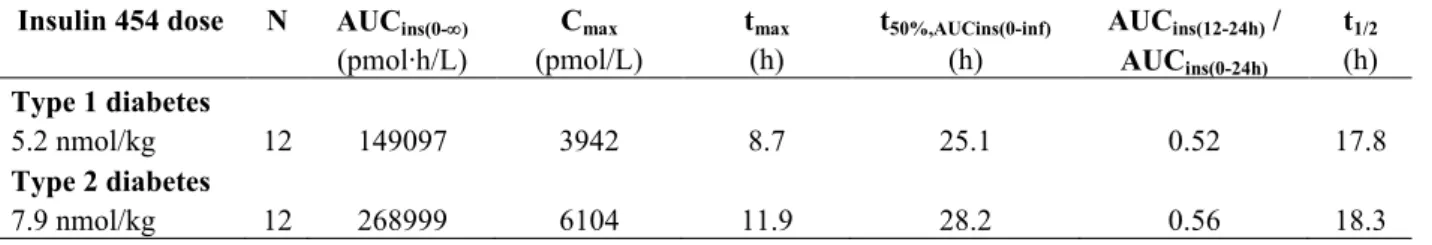
2.7.6.1.1 臨床試験概要 治験の標題: 健康被験者を対象とした、NN12501〔インスリン デグルデク(IDeg)の旧名称〕を異なる投与経路で投与 したときの薬物動態及び薬力学的作用の特性の比較試験 治験責任医師名: 治験実施施設: Germany 公表文献(引用文献): なし(総括報告書完成時) 治験期間: 2010 年 6 月 23 日~2010 年 10 月 29 日 開発のフェーズ: 第1 相 目的: 主要目的: 健康被験者を対象として、大腿部、腹部及び三角筋部単回皮下投与後の IDeg の全身吸収量〔投与後 0~120 時間における血清中 IDeg 濃度推移曲線下面積(AUCIDeg,0-120h,SD)に基づく〕を投与部位間で比較す
る。 副次的目的:
大腿部、腹部及び三角筋部単回皮下投与後の IDeg の薬物動態及び薬力学的作用プロファイルの特性を検 討する。
大腿部単回皮下投与後及び大腿部筋肉内単回投与後の IDeg の全身吸収量(AUCIDeg,0-120h,SDに基づく)を
投与経路間で比較する。 大腿部筋肉内単回投与後の IDeg の薬物動態及び薬力学的作用プロファイルの特性を検討する。 大腿部、腹部及び三角筋部単回皮下投与後及び大腿部筋肉内単回投与後の IDeg の絶対的バイオアベイラ ビリティを推定する。 大腿部、腹部及び三角筋部単回皮下投与後、大腿部筋肉内単回投与後及び静脈内単回投与後の IDeg の短 期安全性及び忍容性を評価する。 治験方法: 本治験は、健康被験者を対象とした、IDeg を異なる投与経路で投与したときの薬物動態及び薬力学的作用 の特性を検討する、1 施設、無作為割り付け、非盲検、5 期クロスオーバー試験であった。被験者は、来院 間隔を設けた5 回の投与来院に 5 回の単回投与(大腿部皮下投与/腹部皮下投与/三角筋部皮下投与/大腿 部筋肉内投与/静脈内投与)を受けるよう無作為割り付けされた。本治験は、7 回の来院により構成された 〔スクリーニング来院(来院1)、5 回の投与来院(来院 2~6)及び事後調査来院(来院 7)〕。各投与来 院には、治験薬投与後にグルコースクランプ(皮下投与及び筋肉内投与の場合は24 時間クランプ、静脈内 投与の場合は12 時間クランプ)が実施された。被験者は、治験薬の皮下及び筋肉内投与後 48 時間入院し、 投与後72、96 及び 120 時間に薬物動態評価のための採血を行うため、24 時間の間隔で再来院した。被験者 は、治験薬の静脈内投与後30 時間入院した。投与来院間には、13~21 日間の wash-out 期間を設け、最終投 与来院と事後調査来院の間には、皮下投与及び筋肉内投与の場合は7~21 日間、静脈内投与の場合は 4~21 日間の間隔をそれぞれ設けた。各被験者の治験期間は、合計59~127 日間であった。 1:NN1250 は、インスリン デグルデク(IDeg)の旧称である。 Page 23 of 2204
計画及び解析された被験者数:
計18 例の被験者が治験を完了するよう計画された。22 例がスクリーニングを受け、20 例が無作為割り付け
され治験薬の投与を受けた。無作為割り付けされた20 例を最大の解析対象集団〔full analysis set(FAS)〕
及び安全性解析対象集団に含めた。 診断及び主要な組入れ基準: 年齢18 歳以上 55 歳以下、BMI(kg/m2)18.0 以上 27.0 以下の健康被験者男女。 主な除外基準は、過去1 ヵ月以内に血液又は血漿献血を実施した被験者、スクリーニング前 3 ヵ月に 500 mL を超える血液又は血漿献血を実施した被験者、スクリーニング前 3 週間に医師が処方した医薬品ならび に市販薬、非常用ビタミン剤及び漢方薬/薬用植物製剤を含む一般用医薬品を使用した被験者及び喫煙者 であった。 被験薬、用量及び投与方法、ロット番号: IDeg:3 mL Penfill®カートリッジ(100 単位/mL) 0.4 単位/kg の治験薬を皮下及び筋肉内投与ならびに の治験薬を静脈内投与した。静脈内投与で は投与量が少ないため、 になるよう された。 ロット番号:XCQ0001 投与期間: 来院間隔を設けた5 回の投与来院において、5 回の単回投与(大腿部皮下投与/腹部皮下投与/三角筋部皮 下投与/大腿部筋肉内投与/静脈内投与)が実施された。 対照薬、用量及び投与方法、ロット番号: 本治験において対照薬は使用しなかった。 評価基準:有効性 薬物動態 皮下投与、筋肉内投与及び静脈内投与後の血清中 IDeg 濃度 薬力学的作用 グルコース注入速度(GIR) 血清中 Cペプチド濃度 評価基準:安全性 有害事象 安全性に関する臨床検査項目 身体所見 バイタルサイン 心電図 低血糖 注射部位の局所忍容性 統計手法: 薬物動態及び薬力学的作用の解析はFAS に基づき実施された。FAS には無作為割り付けされたすべての被 験者を含めた。安全性の解析は安全性解析対象集団に基づき実施した。安全性解析対象集団には、少なく とも1 回の治験薬の投与を受けたすべての被験者を含めた。 プライマリーエンドポイントの解析 プライマリーエンドポイントは、AUCIDeg,0-120h,SDである。
AUCIDeg,0-120h,SDは、IDeg 濃度推移曲線下面積(AUCIDeg,SD)として、観測値及び実測時間(投与後0~120 時
間)に基づき線形台形法によって算出した。欠測値は線形補間を用いて補間した。補間できない場合又は
最終測定時点(tz:定量が可能であった最終観測時点)より後のすべての値が測定下限値を下回る場合、
AUCIDeg,0-120h,SDの代わりにAUC0-tzを用いた。tzより後に欠測値がある場合、該当するIDeg 濃度推移プロフ
ァイルから適切に終末相の傾きを算出できる場合は外挿した。外挿可能か否かは、盲険下でのデータレビ ューにて決定した。
単回皮下投与後及び筋肉内単回投与後のAUCIDeg,0-120h,SDならびに静脈内単回投与後のAUCIDeg,0 30h,SDを一括
してAUCIDeg,0-t,SDと表記した。対数変換したAUCIDeg,0-t,SDを、治療(大腿部皮下投与/腹部皮下投与/三角
筋部皮下投与/筋肉内投与/静脈内投与)及び時期(1 期/2 期/3 期/4 期/5 期)を固定効果、被験者を 変量効果とした分散分析で解析した。不等分散の可能性を考慮し、誤差項は治療に依存するものとした。 このモデルを用いて、皮下投与の3 つの投与部位間の比を 95%信頼区間とともに算出した。 薬物動態に関するセカンダリーエンドポイントの解析 IDeg 単回投与後の個々の IDeg 濃度推移曲線より算出される薬物動態に関するセカンダリーエンドポイント は以下のとおりであった。 単回投与後の AUCIDeg,SD〔投与後0~120 時間(筋肉内投与のみ)、0~30 時間(静脈内投与のみ)、0~ 24 時間(皮下投与及び筋肉内投与のみ)、0~12 時間(静脈内投与のみ)及び 0~無限大時間〕 単回投与後の最高血清中 IDeg 濃度(Cmax,IDeg,SD)(皮下投与及び筋肉内投与のみ) 単回投与開始時直後の血清中 IDeg 濃度(C0,IDeg,SD)(静脈内投与のみ)(対数変換後、線形回帰によっ て外挿した値をもとのスケールに戻す) 単回投与後の Cmax,IDeg,SD到達時間(tmax,IDeg,SD)(皮下投与及び筋肉内投与のみ)
単回投与後の Onset of appearanceIDeg,SD(治験薬投与開始時から血清中IDeg 濃度が最初に 100 pmol/L を超
えるまでの時間:線形補間法による)(皮下投与及び筋肉内投与のみ)
単回投与後の終末相の消失半減期(t1/2,IDeg,SD)
単回投与後の IDeg の平均滞留時間(MRTIDeg,SD)
単回投与後の IDeg の平均吸収時間(MATIDeg,SD)(皮下投与及び筋肉内投与のみ)
血管外投与経路での単回投与後の IDeg の見かけの血清クリアランス(CL/FIDeg,SD)(皮下投与及び筋肉 内投与のみ) 単回投与後の IDeg の血清クリアランス(CLIDeg,SD)(静脈内投与のみ) 血管外投与経路での単回投与後の IDeg の終末相で推定された見かけの分布容積(Vz/FIDeg,SD)(皮下投与 及び筋肉内投与のみ) 単回投与後の IDeg の終末相で推定された分布容積(Vz,IDeg,SD)(静脈内投与のみ) 大腿部単回皮下投与後及び大腿部筋肉内単回投与後のIDeg の全身吸収量を比較するため、大腿部筋肉内単 回投与後のAUCIDeg,0-120h,SDをプライマリーエンドポイントと同様の方法で解析した。大腿部単回皮下投与及 び大腿部筋肉内単回投与間でAUCIDeg,0-120h,SDを比較した。比を95%信頼区間とともに推定した。 Cmax,IDeg,SDをプライマリーエンドポイントと同様の方法で解析したが、皮下投与及び筋肉内投与のみを治療 としてモデルに含めた。皮下投与の3 つの投与部位間ならびに大腿部皮下投与及び大腿部筋肉内投与間に ついて、それぞれ比を95%信頼区間とともに示した。 大腿部、腹部及び三角筋部単回皮下投与後及び大腿部筋肉内単回投与後のIDeg の絶対的バイオアベイラビ リティを推定するために、AUCIDeg,0-inf,SDをプライマリーエンドポイントと同様の方法で解析した。皮下投 与と静脈内投与の比及び筋肉内投与と静脈内投与の比について、用量で調整した比を95%信頼区間ととも に推定し、絶対的バイオアベイラビリティとして示した。その他のすべての薬物動態に関するセカンダリ ーエンドポイントについては、投与経路別に記述統計量で要約した。 薬力学的作用に関するセカンダリーエンドポイントの解析
薬力学的作用に関するセカンダリーエンドポイント:単回投与後のGIR 推移曲線下面積(AUCGIR,SD)〔投
与後0~24 時間(皮下投与及び筋肉内投与のみ)及び 0~12 時間(静脈内投与のみ)〕、最大 GIR
(GIRmax,SD)及びGIRmax,SD到達時間(tGIRmax,SD)
単回皮下投与後、筋肉内単回投与後及び静脈内単回投与後の薬力学的作用プロファイルを評価するため、 すべての薬力学的作用に関するセカンダリーエンドポイントについて、投与経路別に記述統計量で要約し た。 安全性に関するエンドポイント 安全性に関するエンドポイントは、有害事象、安全性に関する臨床検査項目、身体所見、バイタルサイ ン、心電図、低血糖及び注射部位の局所忍容性である。
治験薬投与下で発現した有害事象(Treatment Emergent Adverse Events、以下、有害事象とする)は、治験薬
の投与開始から最終投与の7 日後までに発現した事象と定義した。治験薬投与下で発現した低血糖(以 下、低血糖とする)は、治験薬の投与開始から最終投与の7 日後までに発現した事象と定義した。すべて の安全性に関するエンドポイントについて、一覧表を作成し、記述統計量で要約した。 被験者背景: 無作為割り付けされ、治験薬の投与を受けた20 例のうち、17 例(85%)が男性で 3 例(15%)が女性であ った。被験者の多くは白人であった。平均年齢は37.4 歳、平均 BMI は 24.1 kg/m2であった。 有効性の結果及び結論: IDeg の単回投与後-皮下投与 薬物動態に関するエンドポイント プライマリーエンドポイント(AUCIDeg,0-120h,SD)は、大腿部への皮下投与と比較し腹部又は三角筋部への 皮下投与で6~7%大きく、統計的な有意差がみられたが、腹部及び三角筋部への投与間に統計的な有意 差はなかった。 Cmax,IDeg,SDは、大腿部への皮下投与と比較し腹部又は三角筋部への皮下投与で23~27%高く、統計的な有 意差がみられたが、腹部及び三角筋部への投与間に統計的な有意差はなかった。 ——————————————————————————————————————————————— Mean ratio 95% CI ———————————————————————————————————————————————
AUCIDeg,0-120h,SD(pmol*h/L)
s.c. abdomen/thigh 1.07 [1.03; 1.11] s.c. deltoid/thigh 1.06 [1.01; 1.10] s.c. abdomen/deltoid 1.01 [0.96; 1.06] Cmax,IDeg,SD(pmol/L) s.c. abdomen/thigh 1.23 [1.07; 1.42] s.c. deltoid/thigh 1.27 [1.08; 1.49] s.c. abdomen/deltoid 0.97 [0.84; 1.12] ———————————————————————————————————————————————
The endpoints are log-transformed and analysed using an ANOVA model with treatment and period as fixed effects, subject as random effect, and with different error-terms for each treatment.
ANOVA: analysis of variance, AUC: area under the curve, Cmax: maximum observed concentration, CI: confidence interval, IDeg: insulin degludec,
i.m.: intramuscular, s.c.: subcutaneous, SD: single dose
皮下投与したときの薬物動態プロファイルの全般的な形状は 3 つの投与部位で同様であった。投与後 30
~40 時間までの血清中 IDeg 濃度推移プロファイルは、大腿部への皮下投与と比較し腹部又は三角筋部へ
の皮下投与で高い値で推移した。いずれの投与部位への皮下投与でも、血清中IDeg は多くの被験者で測
定期間の終了(投与後120 時間)まで検出された。
薬物動態に関するセカンダリーエンドポイントで得られた結果は、AUCIDeg,0-120h,SD及びCmax,IDeg,SDの解析
結果を反映するものであった。 薬力学的作用に関するエンドポイント
AUCGIR,024h,SD及びGIRmax,SDの幾何平均に基づく血糖降下作用は、大腿部、腹部及び三角筋への皮下投与
で同じ範囲内であった(記述統計量に基づく)。 皮下投与したときの GIR 推移プロファイルの全般的な形状は 3 つの投与部位で同様であった。いずれの 投与部位への皮下投与でも、血糖降下作用の持続時間はすべての被験者で24 時間を越えていた。 IDeg の単回投与後-筋肉内投与及び皮下投与の比較 薬物動態に関するエンドポイント AUCIDeg,0-120h,SDに基づく総曝露量は、大腿部への皮下投与後と比較し筋肉内投与で7%高く、統計的な有 意差がみられた。 Cmax,IDeg,SDは、大腿部への皮下投与と比較し筋肉内投与で58%高く、統計的な有意差がみられた。 ——————————————————————————————————————————————— Mean ratio 95% CI ———————————————————————————————————————————————
AUCIDeg,0-120h,SD(pmol*h/L)
i m/s.c. thigh 1.07 [1.02; 1.13]
Cmax,IDeg,SD(pmol/L)
i m./s.c thigh 1.58 [1.36; 1.84]
———————————————————————————————————————————————
The endpoints are log-transformed and analysed using an ANOVA model with treatment and period as fixed effects, subject as random effect, and with different error-terms for each treatment.
ANOVA: analysis of variance, AUC: area under the curve, Cmax: maximum observed concentration, CI: confidence interval, IDeg: insulin degludec,
i.m.: intramuscular, s.c.: subcutaneous, SD: single dose
薬物動態に関するセカンダリーエンドポイントで、大腿部への皮下投与及び筋肉内投与で得られた結果
は、AUCIDeg,0-120h,SD及びCmax,IDeg,SDの解析結果を支持するものであった。
皮下投与後と比較し筋肉内投与後の血清中 IDeg 濃度推移プロファイルは、投与後 30~35 時間までは高
い値で、投与後40 時間以降では低い値で推移した。血清中 IDeg は、皮下投与では多くの被験者で測定
期間の終了(投与後120 時間)まで検出されたが、筋肉内投与では投与後 72 時間までであった。
薬力学的作用に関するエンドポイント
AUCGIR,024h,SD及びGIRmax,SDの幾何平均の推定値に基づくIDeg の血糖降下作用は、大腿部への皮下投与
と比較し筋肉内投与で大きかった(記述統計量に基づく)。 投与後 3~4 時間以降、スムージング化した平均 GIR 推移プロファイルは、24 時間グルコースクランプ 施行中、大腿部への皮下投与と比較し筋肉内投与で大きい値で推移した。全般的に、血糖降下作用は薬 物動態プロファイルを反映したものであったが、投与経路間の違いは薬物動態プロファイルと比較し GIR 推移プロファイルでより小さかった。いずれの投与経路でも、血糖降下作用の持続時間はすべての 被験者で24 時間を越えていた。 IDeg の単回投与後-静脈内投与と筋肉内投与ならびに皮下投与の比較 静脈内投与において希釈の手法が適切でなかったため、IDeg の絶対的バイオアベイラビリティは算出で きなかった。 安全性の結果及び結論: IDeg を投与された被験者で 20 例(40%)中 8 例に計 14 件の有害事象が報告された〔腹部への皮下投与 後で4 例(20%)4 件、三角筋への皮下投与後で 4 例(20%)4 件、大腿部への筋肉内投与後で 3 例 (15.8%)4 件、大腿部への皮下投与後及び静脈内投与後で各 1 例 1 件〕。5 つの治療間で有害事象の分 布に大きな違いはなかった。 重度の有害事象はなく、大部分の有害事象(10 件)は軽度に分類された。1 件の軽度の頭痛及び 1 件 の軽度の下痢(いずれも同一の被験者で発現)は、治験薬との因果関係が「あり」と判定された。当 該被験者は有害事象より回復した。 最も多く報告された有害事象は頭痛(3 例 6 件)及び鼻咽頭炎(2 例 3 件)であった。その他のすべて Page 27 of 2204