CTD 第2部
2.6 非臨床試験の概要文及び概要表
2.6.6 毒性試験の概要文
用語及び略語一覧
AST Aspartate aminotransferase アスパラギン酸アミノトランスフェラ ーゼ
AUC(INF) Area under the serum concentration vs. time from 0 to infinity 0 時間から無限時間までの血清中濃度 曲線下面積
AUC(TAU) Area under the serum concentration vs. time during a specified interval 1 投与間隔における血清中濃度曲線下 面積
BMS Bristol-Myers Squibb ブリストル・マイヤーズ スクイブ BrdU Bromodeoxyuridine ブロモデオキシウリジン
CHO Chinese hamster ovary チャイニーズハムスター卵巣 CL Total body clearance 全身クリアランス
Cmax Maximum serum concentration 最高血清中濃度 CMV Cytomegalovirus サイトメガロウイルス DNA Deoxyribonucleic acid デオキシリボ核酸 DSG Deoxyspergualin デオキシスパガリン EBV Epstein Barr Virus エプスタインバーウイルス F0 Parental generation 親世代
F1 First generation 第一世代
GLP Good Laboratory Practice 医薬品の安全性に関する非臨床試験の 実施の基準
HGPRT Hypoxanthine guanine phosphoribosyl-transferase ヒポキサンチングアニンホスホリボシ ルトランスフェラーゼ
HMW High molecular weight 高分子種
HSV Herpes simplex virus 単純ヘルペスウイルス
ICH
International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use
日米EU 医薬品規制調和国際会議
IFN Interferon インターフェロン Ig Immunoglobulin 免疫グロブリン IL Interleukin インターロイキン
KLH Keyhole limpet hemocyanin キーホールリンペットヘモシアニン LCV Lymphocryptovirus リンホクリプトウイルス
MCP-1 Monocyte chemoattractant protein-1 単球遊走活性化因子-1 MLV Murine leukemia virus マウス白血病ウイルス MMTV Mouse mammary tumor virus マウス乳癌ウイルス MRT Mean residence time 平均滞留時間 MTD Maximum tolerance dose 最大耐量
NK Natural killer ナチュラルキラー NOAEL No-observable-adverse-effect level 無毒性量
NOEL No-observable-effect level 無作用量
PALS Periarteriolar lymphatic sheath 動脈周囲リンパ鞘 PBS Phosphate buffered saline リン酸緩衝生理食塩液
PCR Polymerase chain reaction ポリメラーゼ連鎖反応 PE40 Pseudomonas exotoxin 緑膿菌外毒素
PK Pharmacokinetic 薬物動態 qd Dosed once daily 1 日 1 回投与 qm Dosed once monthly 月 1 回投与
q“n”dדm” Every n days for m doses “n”日に 1 回、計“m”回投与 qw Dosed once weekly 週 1 回投与
qwדm” Dosed once weekly for m doses 週1 回、計“m”回投与 RA Rheumatoid arthritis 関節リウマチ
S9
Liver fraction that contains a high concentration of cytochrome P450 metabolic enzymes
チトクロームP450 を高濃度に含有する 肝臓のS9 分画
SAA Serum amyloid A 血清アミロイドA SRBC Sheep erythrocyte ヒツジ赤血球 SV40 Simian Papovavirus サルパポバウイルス t1/2 Half-life time 消失半減期
TK Toxicokinetics トキシコキネティクス Tmax Time of occurrence of Cmax Cmax に到達する時間 TNF Tumor necrosis factor 腫瘍壊死因子
目 次
1
まとめ
... 9
2
単回投与毒性試験... 17
2.1 サルにおける単回静脈内投与探索毒性試験(GLP 不適合)... 17 2.2 サルにおける単回静脈内投与毒性及びトキシコキネティクス試験(GLP 適合) ... 173
反復投与毒性試験... 19
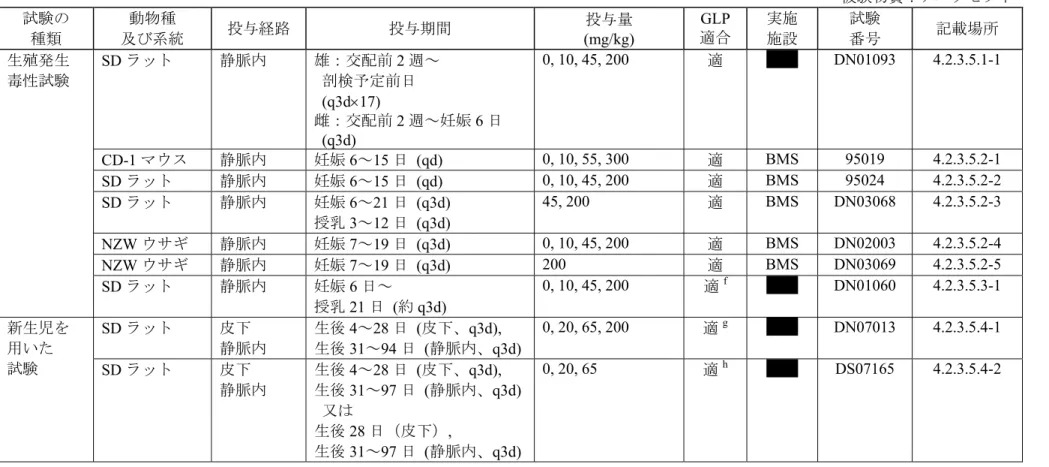
3.1 マウス... 19 3.1.1 マウスにおける6 ヵ月間間歇(qw×26)皮下投与毒性試験(GLP 適合)... 19 3.2 ラット... 20 3.2.1 ラットにおける2 週間間歇(q2d×7)皮下/静脈内投与毒性及び トキシコキネティクス試験(GLP 適合)... 20 3.2.2 ラットにおける3 ヵ月間間歇(q3d)静脈内投与免疫毒性試験(GLP 適合) ... 22 3.3 サル... 23 3.3.1 サルにおける1 ヵ月間間歇(q2d×15)静脈内投与毒性試験(GLP 適合)... 24 3.3.2 Belatacept(BMS-224818)のサルにおける 6 ヵ月間間歇(qw×26)静脈内投与 毒性及びトキシコキネティクス試験(GLP 適合)... 25 3.3.3 サルにおける1 年間間歇(qw×52)静脈内投与毒性及びトキシコキネティクス 試験(GLP 適合) ... 264
遺伝毒性試験... 29
4.1 In Vitro 試験... 29 4.1.1 ネズミチフス菌及び大腸菌を用いる復帰突然変異試験(GLP 適合)... 29 4.1.2 CHO/HGPRT 哺乳類細胞を用いる遺伝子突然変異試験(GLP 適合) ... 29 4.1.3 初代培養ヒトリンパ球を用いる細胞遺伝学的試験(GLP 適合)... 295
がん原性試験... 31
5.1 マウスにおける皮下投与がん原性試験(GLP 適合)... 316
生殖発生毒性試験... 36
6.1 受胎能及び着床までの初期胚発生に関する試験... 36 6.1.1 ラットにおける受胎能及び着床までの初期胚発生に関する静脈内投与試験 (GLP 適合) ... 36 6.2 胚・胎児発生に関する試験... 37 6.2.1 マウスにおける胚・胎児発生に関する静脈内投与試験(GLP 適合)... 37 6.2.2 ラットにおける胚・胎児発生に関する静脈内投与試験(GLP 適合)... 37 6.2.3 妊娠及び授乳ラットにおける静脈内投与トキシコキネティクス試験(GLP 適合) ... 38 6.2.4 ウサギにおける胚・胎児発生に関する静脈内投与試験(GLP 適合)... 386.2.5 妊娠ウサギにおける13 日間静脈内投与トキシコキネティクス試験(GLP 適合) ... 39 6.3 出生前及び出生後の発生並びに母体の機能に関する試験... 39 6.3.1 ラットにおける出生前及び出生後の発生並びに母体の機能に関する 静脈内投与試験(GLP 適合)... 39 6.4 新生児を用いた試験... 40 6.4.1 新生児ラットを用いた3 ヵ月間皮下/静脈内投与毒性試験(GLP 適合)... 40 6.4.2 新生児ラットを用いた3 ヵ月間間歇(q3d)皮下/静脈内投与免疫毒性試験 (GLP 適合) ... 44
7
局所刺激性試験
... 49
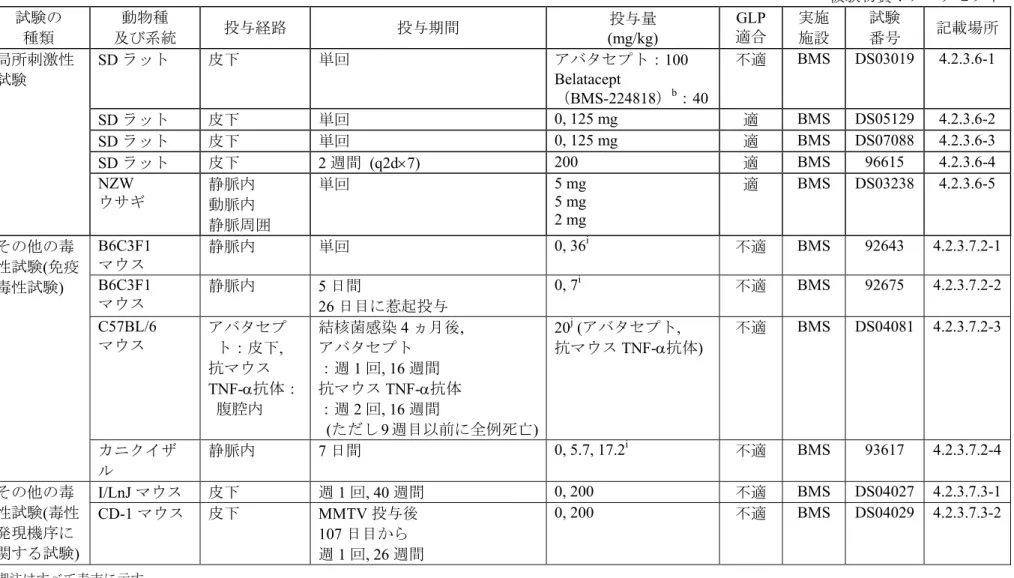
7.1 ラット... 49 7.1.1 ラットにおける単回皮下投与局所刺激性比較試験(GLP 不適合)... 49 7.1.2 ラットにおける単回皮下投与局所刺激性試験Ⅰ(GLP 適合)... 50 7.1.3 ラットにおける単回皮下投与局所刺激性試験Ⅱ(GLP 適合)... 50 7.1.4 ラットにおける2 週間間歇(q2d×7)皮下投与局所刺激性及び トキシコキネティクス比較試験(GLP 適合)... 51 7.2 ウサギ... 51 7.2.1 ウサギにおける単回静脈内、動脈内及び静脈周囲投与刺激性試験(GLP 適合) .... 518
その他の毒性試験... 53
8.1 免疫原性試験... 53 8.2 免疫毒性試験... 53 8.2.1 マウスにおける単回静脈内投与免疫調節作用検討試験(GLP 不適合)... 54 8.2.2 マウスにおける5 日間静脈内投与免疫毒性試験-Ex vivo 試験(GLP 不適合) ... 54 8.2.3 結核菌慢性感染モデルマウスにおける感染再燃検討試験(GLP 不適合)... 55 8.2.4 サルにおける7 日間静脈内投与試験(GLP 不適合)... 56 8.3 毒性発現機序に関する試験... 57 8.3.1 I/LnJ マウスにおける 9 ヵ月間間歇(qw×40)皮下投与検討試験 -MMTV による乳腺腫瘍発生に及ぼすアバタセプトの影響(GLP 不適合)... 57 8.3.2 CD-1 マウスにおける 6 ヵ月間間歇(qw×26)皮下投与検討試験 -MMTV 特異抗体応答に及ぼすアバタセプト投与の影響(GLP 不適合)... 58 8.3.3 BMS-191352 のイヌにおける 2 週間間歇(q3d×5)静脈内投与抗原性及び薬物 動態試験-デオキシスパガリン及びアバタセプト併用投与の影響(GLP 適合) .... 59 8.3.4 サルの腎移植モデルにおけるアバタセプト、BMS-202448 及び BMS-224819 の 反復静脈内併用投与試験-病理組織学的検査(GLP 不適合)... 60 8.4 不純物の毒性試験... 61 8.4.1 マウスにおける単回静脈内投与探索毒性試験(GLP 不適合)... 618.4.2 サルにおける単回静脈内投与試験(GLP 不適合)... 62 8.4.3 サルにおける単回静脈内投与試験(GLP 不適合)... 62 8.4.4 高分子種(HMW)の製剤規格を担保するための非臨床試験成績 ... 63 8.5 生物活性/薬効に関する試験... 64 8.5.1 マウスにおける7 週間間歇(qw×7)皮下投与薬物動態/薬力学試験 (GLP 不適合) ... 64 8.5.2 ウサギにおける単回静脈内投与薬効及び薬物動態試験(GLP 不適合)... 65 8.5.3 サルにおけるアバタセプト及びbelatacept(BMS-224818)の単回静脈内投与 薬効比較試験(GLP 不適合)... 66 8.5.4 カニクイザルにおける反復静脈内投与薬効試験(GLP 不適合)... 66 8.6 製剤比較試験... 67 8.6.1 マウスにおける単回静脈内投与比較試験(GLP 不適合)... 67 8.6.2 サルにおける単回静脈内投与薬物動態比較試験(GLP 適合)... 67 8.6.3 サルにおける単回静脈内投与薬物動態比較探索試験(GLP 不適合)... 68 8.6.4 サルにおける単回静脈内投与比較試験(GLP 適合)... 69 8.6.5 サルにおける単回静脈内投与薬物動態比較試験(GLP 不適合)... 70 8.6.6 サルにおける単回静脈内投与薬物動態比較試験(GLP 不適合)... 71 8.6.7 サルにおける単回静脈内投与薬物動態比較試験(GLP 不適合)... 71 8.6.8 サルにおける単回静脈内投与比較試験(GLP 適合)... 72
9
考察及び結論... 74
10
参考文献
... 85
表一覧
表 1-1: 毒性試験一覧... 10 表 3-1: 反復投与毒性試験におけるマウスの曝露量とヒトの曝露量の比較... 19 表 3-2: 反復投与毒性試験におけるラットの曝露量とヒトの曝露量の比較... 22 表 3-3: 反復投与毒性試験におけるサルの曝露量とヒトの曝露量の比較... 24 表 3-4: サルのアバタセプト1 年間投与毒性試験における試験開始前のウイルス陽性数... 27 表 5-1: がん原性試験におけるマウスの曝露量とヒトの曝露量の比較... 32 表 5-2: がん原性試験におけるマウスのリンパ腫発生率 (%) ... 32 表 5-3: BMS 社及び CRL 社で実施した過去の試験及び文献における CD-1 マウスの リンパ腫発生率 (%)... 33 表 5-4: がん原性試験におけるマウスの乳腺腺腫及び腺癌発生率 (%) ... 34 表 5-5: BMS 社及び CRL 社で実施した過去の試験及び文献における CD-1 マウスの 乳腺腺腫及び腺癌発生率 (%) ... 34 表 6-1: 生殖発生毒性試験におけるラット及びウサギの曝露量とヒトの曝露量の比較... 36 表 6-2: 各サブグループの評価項目... 41 表 6-3: 新生児毒性試験における生後28 及び 88 日のラットの曝露量とヒトの曝露量の 比較... 42 表 6-4: 各コホートにおける評価項目... 45 表 6-5: 新生児毒性試験における生後28 及び 88 日のラットの曝露量とヒトの曝露量の 比較... 46 表 7-1: 製剤... 49 表 8-1: 高分子種の安全域... 64 表 8-2: サルにおけるアバタセプト曝露量... 69 表 8-3: アバタセプトのPK パラメータの概要a... 73 表 8-4: アバタセプトのPK パラメータの統計学的解析結果a... 73 表 9-1: マウス、ラット及びサルの曝露量とヒトの曝露量の比較... 741 まとめ
アバタセプト(BMS-188667)は、ヒト CTLA-4 の細胞外ドメインとヒト免疫グロブリン(Ig) G1 の Fc ドメイン(ヒンジ-CH2- CH3 ドメイン)より構成された遺伝子組換え可溶性融合蛋白で ある。ヒトIgG1 領域では、補体結合反応を低下させるために、ヒンジ領域に変異を含んでいる。 アバタセプトは関節リウマチ(RA)を適応症の一つとして開発された薬剤で、抗原提示細胞表面 のCD80 及び CD86 に結合し、これらの分子と T 細胞表面の共刺激分子である CD28 との結合を 阻害することでT 細胞の活性化を調節する。アバタセプトの臨床推奨用量は、体重 60 kg 未満の 患者では500 mg、体重 60~100 kg の患者では 750 mg、体重が 100 kg を超える患者では 1000 mg で、これを初回投与後、2 週、4 週、その後 4 週毎に静脈内投与する。臨床用量 10 mg/kg におけ るRA 患者での曝露量は約 50000 μg·h/mL である。 ヒトにアバタセプトを静脈内投与した場合の安全性を担保するための非臨床毒性試験として、 一連のin vitro 試験並びにマウス、ラット及びサルを用いた in vivo 試験を実施した。アバタセプ トは、これらの動物種に対し薬理作用を示すことが確認されている。毒性試験として、サルの単 回投与毒性試験、マウス(最長6 ヵ月間)・ラット(最長 3 ヵ月間)・サル(最長 1 年間)の反復 投与毒性試験、in vitro 遺伝毒性試験、がん原性試験、生殖発生毒性試験、新生児を用いた毒性試 験、局所刺激性試験及び免疫毒性試験を実施し、単回又は反復投与毒性試験の一環として免疫毒 性、免疫原性及び局所刺激性についても検討した。また、アバタセプトを用いた毒性発現機序に 関する試験、不純物の毒性試験、生物活性/薬効に関する試験及び製剤比較試験も実施した。さ らに、アバタセプトを長期間投与した場合の安全性を担保するために、サルを用いた belatacept (BMS-224818)の 6 ヵ月間投与毒性試験も実施した。なお、belatacept は、CD80/86 結合ドメイ ン内の2 個のアミノ酸残基がアバタセプトと異なり、アバタセプトと比較し霊長類の CD86 に対 する結合能が高く、薬理活性が上昇している。 RA 患者におけるアバタセプトの安全性を担保するための毒性試験の種類を表 1-1 及び毒性試 験概要表 2.6.7.1-1 に示す。なお、主要な毒性試験は適切な試験計画の下、「医薬品の安全性に関 する非臨床試験の実施の基準」(GLP)に準拠して実施した。表 1-1: 毒性試験一覧 試験の種類/投与期間 投与経路 試験系 単回投与毒性 静脈内 サル 反復投与毒性 2 週間 皮下、静脈内 ラット 1 ヵ月間 静脈内 サル 3 ヵ月間 静脈内 ラット 6 ヵ月間 皮下 マウス 静脈内 サル[Belatacept (BMS-224818)]a 1 年間 静脈内 サル 遺伝毒性 復帰突然変異 In vitro ネズミチフス菌、大腸菌 HGPRT 遺伝子突然変異 In vitro CHO 細胞 染色体異常 In vitro 初代培養ヒトリンパ球 がん原性 長期投与 皮下 マウス 生殖発生毒性 受胎能及び初期胚発生 静脈内 ラット 胚・胎児発生 静脈内 マウス、ラット、ウサギ 出生前及び出生後の発生 静脈内 ラット 新生児毒性 皮下/静脈内 ラット 局所刺激性 皮下 ラット 静脈内、動脈内、静脈周囲 ウサギ その他の毒性 免疫毒性 静脈内 マウス、サル 毒性発現機序 静脈内 マウス、イヌ、サル 不純物の毒性 静脈内 マウス、サル 生物活性/薬効 静脈内 マウス、ウサギ、サル 製剤比較 静脈内 マウス、サル a Belatacept(BMS-224818)は CD80/86 結合ドメイン内の 2 個のアミノ酸残基がアバタセプトと異なり、アバタ セプトと比較し霊長類のCD86 に対する結合能が高く、薬理活性が上昇している。 サルを用いた試験では、アバタセプトを最高投与量100 mg/kg で単回静脈内投与、最高投与量 50 mg/kg で 2 日に 1 回 30 日間もしくは週 1 回 1 年間反復静脈内投与しても、本薬投与に関連し た明らかな毒性はみられなかった。反復投与毒性試験で薬理作用に起因する可逆的な変化として、 血清IgG 量の軽微な減少(IgM 及び IgA 量には変化なし)、脾臓あるいはリンパ節で胚中心の機 能低下を反映した胚中心の数及び直径の軽度から中等度減少(1 年間投与試験)がみられた。サ ルの末梢血細胞及びリンパ系組織には、増殖性病変、前がん病変又は腫瘍性病変は認められなか った。1 年間投与毒性試験では、8 週の休薬期間終了後に T 細胞依存性抗原キーホールリンペッ トヘモシアニン(KLH)の免疫により明らかな抗体産生が認められ、全投与量で免疫機能の活性
が確認された。試験開始前のウイルス検査で全動物が1 種類又は複数のウイルス[サルリンホク リプトウイルス(RhLCV)、ヘルペス B ウイルス、サルサイトメガロウイルス(RhCMV)、サル パポバウイルス(SV40)]に感染していたことが確認されたが、アバタセプトを 1 年間投与して もウイルス感染を示す臨床徴候はみられなかった。1 年間投与毒性試験の無毒性量は 50 mg/kg[血 清中濃度曲線下面積(AUC)換算で、臨床用量 10 mg/kg を月 1 回投与したヒト(RA 患者)での 曝露量の9.5 倍の曝露量に相当]と推定された。 アバタセプトよりも薬理作用が強いbelatacept をサルに最高投与量 50 mg/kg で週 1 回 6 ヵ月間 静脈内投与しても、アバタセプトと同様に投薬に関連した明らかな毒性はみられなかった。全投 与量で薬理作用に起因する可逆的な変化として、血清IgG 量の軽微な減少(IgM 及び IgA 量には 変化なし)、脾臓あるいはリンパ節で胚中心の機能低下を反映した胚中心の数及び直径の軽微から 軽度減少がみられた。いずれの動物の末梢血細胞及びリンパ系組織にも、増殖性病変、前がん病 変又は腫瘍性病変は認められなかった。8 週の休薬期間終了後に KLH の免疫により明らかな抗体 産生が認められ、全投与量で免疫機能の活性が確認された。Belatacept の 6 ヵ月間投与試験での無 毒性量は50 mg/kg(臨床用量でのヒトの曝露量の 13.5 倍の曝露量)と推定された。 アバタセプトをマウスに週1 回 26 週間皮下投与すると、投与量 200 mg/kg まで忍容性が認めら れた。投与量65 及び 200 mg/kg で薬理作用に起因する可逆的な変化として、血清 IgG 量の一過性 の減少、雄で脾臓のB 細胞比率の低下並びに B 細胞及び T 細胞の幼若化反応(ex vivo 試験)の抑 制がみられた。また、病理組織学的変化として、腎臓で軽度な慢性多巣性炎、リンパ球浸潤及び 尿細管上皮細胞の変性を伴う巨大核の発現頻度及び程度の上昇がみられたが、臨床病理学的パラ メータには変化がみられず、腎機能に対する影響は認められなかった。腎臓でみられたこれらの 変化は、自然発症性かつ加齢性病変の悪化によるものと考えられ、ヒトとの関連性はほとんどな いと考えられた。本試験での無作用量は20 mg/kg(臨床用量でのヒトの曝露量の 0.9 倍の曝露量)、 無毒性量は200 mg/kg(臨床推奨量でのヒトの曝露量の 4.7 倍の曝露量)と推定された。 アバタセプトをラットに 2 日に 1 回計 7 回(q2d×7)静脈内又は皮下投与すると、いずれの投 与経路でも投与量200 mg/kg まで明らかな毒性はみられなかったが、投与終了時に血清 IgG 量及 び IgA 量の軽微な減少が認められた(IgM 量には変化なし)。皮下投与によるバイオアベイラビ リティは41%(200 mg/kg)~63%(10 mg/kg)であった。 マウス及びサルとは異なり、ラットでは最長3 ヵ月間のアバタセプト投与で免疫に関連した変 化が認められた。アバタセプトをラットに3 日に 1 回 3 ヵ月間静脈内投与すると、投与量 65 mg/kg 以上で、末梢血中のT 細胞及びヘルパーT 細胞数の増加及び制御性 T 細胞数の減少、血清 Ig 量の 減少、T 細胞依存性抗体応答の低下、胸腺及び脾臓重量の増加、脾臓で辺縁帯拡大及び動脈周囲 リンパ鞘(PALS)の発達並びにリンパ節で傍皮質領域拡大及び胚中心数の減少等の免疫学的パラ メータの変化が認められた。さらに、アバタセプト投与により自己免疫に起因した変化と考えら れる甲状腺及び膵島でのリンパ球浸潤がみられ、ハーダー腺及び前立腺では単核細胞浸潤及び炎 症の発現頻度が顕著に増加した。本試験の投与量では十分な薬理活性が示されていることから、 これらの変化の発現頻度及び程度には概して用量依存性はみられなかった。本試験では無毒性量 は推定できなかったが、アバタセプトをマウスで6 又は 20 ヵ月間及びサルで 1 年間まで長期間投
与しても、自己免疫の徴候は認められなかった。さらに、海外の臨床試験では、アバタセプトを ヒト(成人RA 患者)に最長 8 年間投与しても、自己免疫の発現頻度増加は現時点で認められて いない(5.3.5.3-7.2, 5.3.5.3-7.3)。また、腎移植患者を対象とした 2 つの海外臨床試験で belatacept を他の免疫調節性の薬剤と併用投与した患者においても、シクロスポリンを投与した患者と比較 して制御性 T 細胞数減少はみられていない 1),2)。以上、成熟ラットで認められた変化より、理由 は不明であるが、マウス、サル及びヒトと比較してラットは CD28 阻害作用に対して種特異的な 感受性を有することが示唆された。 ネズミチフス菌及び大腸菌を用いる復帰突然変異(Ames)試験では、代謝活性化系[チトクロ ームP450 を高濃度に含有する肝臓の S9 分画(S9)]の有無にかかわらずアバタセプトは変異原 性を示さなかった。チャイニーズハムスター卵巣/ヒポキサンチングアニンホスホリボシルトラ ンスフェラーゼ(CHO/HGPRT)細胞を用いる遺伝子突然変異試験においても、S9 の有無にかか わらずアバタセプトは変異原性を示さなかった。また、初代培養ヒトリンパ球に対しても、S9 の 有無にかかわらずアバタセプトは染色体異常誘発性を示さなかった。すべての遺伝毒性試験は、 「日米 EU 医薬品規制調和国際会議(ICH)ガイドライン」で推奨されている最高濃度又は溶解 可能な最高濃度で実施した。 がん原性試験では、アバタセプトをマウスに投与量20, 65 及び 200 mg/kg で週 1 回、雄には最 長84 週間、雌には最長 88 週間皮下投与した。各投与量における曝露量は、臨床用量でのヒトの 曝露量のそれぞれ0.8, 1.9 及び 3.0 倍に相当する。全投与量で抗薬物抗体(薬物特異抗体)の産生 抑制がみられたことから、持続的な免疫抑制作用が発現していたと考えられる。全投与量でリン パ腫、中・高投与量の雌で乳腺腫瘍の発生率が上昇した。マウスでは、レトロウイルス[マウス 白血病ウイルス(MLV)及びマウス乳癌ウイルス(MMTV)]が、それぞれリンパ腫及び乳腺腫 瘍を誘発することが知られている。本試験で使用した CD-1 マウスのゲノム中にはポリメラーゼ 連鎖反応(PCR)法により内在性 MLV の DNA が検出され、乳腺腫瘍の透過型電子顕微鏡検査及 び免疫組織化学的検査により MMTV の存在が確認された。これらの成績から、アバタセプト投 与群のマウスにおけるリンパ腫及び乳腺腫瘍の発生率上昇は、長期にわたる免疫抑制作用により これら特定のウイルスに対する免疫監視機構が低下したことと関連しているという仮説が裏付け られた。一連の遺伝毒性試験でアバタセプトが遺伝毒性を示さなかったことからも、この仮説の 正当性が支持された。なお、6 ヵ月間投与毒性試験と同様に本薬投与に関連した非腫瘍性病変と して、全投与量で腎臓尿細管上皮細胞での巨大核の発現頻度及び程度の上昇がみられた。 上記の仮説を裏付けるために、MMTV に対して強い中和抗体産生能を有し、乳腺腫瘍の発生を 予防することが知られている I/LnJ 近交系マウスを用いて乳腺腫瘍の発生機序を検討するための 試験を実施した。アバタセプトはMMTV 感染後の MMTV 特異抗体産生亢進を抑制したが、MMTV の感染力を抑制して乳腺腫瘍の発生を予防するのに必要な低レベルの MMTV 中和抗体までは抑 制しなかった。さらに、がん原性試験で使用したCD-1 マウスを用いた試験では、MMTV 感染後 の MMTV 抵抗性において重要な機構であることが知られている IgG2a アイソタイプ応答を含む MMTV に特異的な機能性抗体応答が数例のマウスで認められ、この抗体応答はアバタセプト投与 後に減弱した。これらの試験成績から、がん原性試験では対照群と比較してアバタセプト投与に
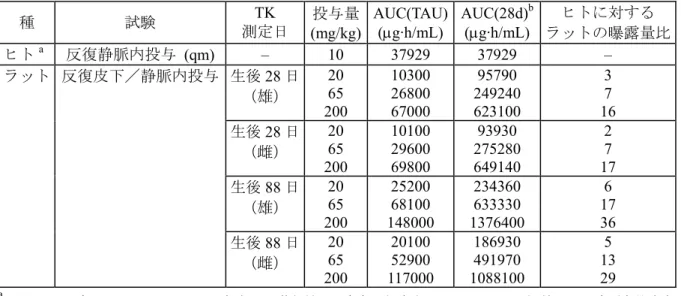
より MMTV に対する免疫監視機構が低下し、その結果乳腺腫瘍の発生率が上昇したという仮説 が裏付けられた。 ラットの受胎能及び着床までの初期胚発生に関する試験では、アバタセプトを3 日に 1 回静脈 内投与すると、投与量200 mg/kg(臨床用量でのヒトの曝露量の 11 倍の曝露量)まで雌雄の生殖 能及び初期胚発生に及ぼす影響は認められなかった。胚・胎児発生に関する試験では、アバタセ プトをラット及びマウスにそれぞれ最高投与量200 及び 300 mg/kg で連日、ウサギに最高投与量 200 mg/kg で 3 日に 1 回静脈内投与しても、いずれの動物種でも本薬投与の影響はみられなかっ た(ラット及びウサギの曝露量は、ヒトの曝露量のそれぞれ30 及び 29 倍であったが、マウスの 曝露量は測定しなかった)。これらの試験では、静脈内投与が可能な最大投与液量に基づいて投与 量を設定した。アバタセプトは試験に用いたいずれの動物種においても、母動物又は胚・胎児に 毒性を発現しなかった。ラット及びウサギを用いた試験では、アバタセプトの胎盤通過が確認さ れた(マウスでは胎盤通過は確認しなかった)ことから、アバタセプトを投与された母動物由来 の胎児はアバタセプトに曝露されていたと考えられる。ラットの出生前及び出生後の発生並びに 母体の機能に関する試験では、母動物(F0)にアバタセプトを3 日に 1 回静脈内投与すると、母 動物では投与量200 mg/kg(臨床用量でのヒトの曝露量の 11 倍の曝露量)まで、出生児(F1)で は45 mg/kg(臨床用量でのヒトの曝露量の 3 倍の曝露量)まで本薬投与の影響はみられなかった。 投与量200 mg/kg では、本薬投与に関連する F1雌ラットの変化として、KLH に対する T 細胞依 存性抗体応答の亢進(対照群の9 倍)及び 1 例で中等度のびまん性甲状腺炎が認められた。これ らの所見は片性(雌)又は1 例の動物(雌)に限定された変化であり、その他の免疫学的パラメ ータ[脾臓リンパ球のフェノタイプ、血清Ig 量及び抗核抗体産生]には影響がみられなかった。 新生児ラットの毒性試験では、アバタセプトを生後4 日から生後 94 日まで 3 日に 1 回皮下/静 脈内投与しても、投与量200 mg/kg まで神経行動学的影響及び生殖機能に対する影響は認められ なかった。しかし、全投与量(20 mg/kg 以上)で瀕死状態又は死亡に至る感染症が低頻度で発現 し、薬理作用による免疫抑制に起因する変化と考えられた。また、全投与量で末梢血中のT 細胞 及びヘルパーT 細胞数の増加及び制御性 T 細胞数の減少、血清 Ig 量の減少、T 細胞依存性抗体応 答の低下、胸腺及び脾臓重量の増加、脾臓で辺縁帯拡大及び PALS の発達並びにリンパ節で傍皮 質領域拡大及び胚中心数の減少等の免疫学的パラメータの変化が認められた。さらに、アバタセ プト投与により自己免疫に起因すると考えられる甲状腺及び膵島のリンパ球浸潤並びにハーダー 腺及び前立腺での単核細胞浸潤及び炎症の顕著な発現頻度増加がみられ、これらの変化の発現頻 度及び程度に概して用量依存性は認められなかった。3 ヵ月の休薬期間終了後、ほとんどの免疫 学的パラメータの変化は完全に回復又は回復傾向を示したが、ハーダー腺及び前立腺では単核細 胞浸潤の発現頻度の増加が引き続き認められ、甲状腺及び膵島ではリンパ球浸潤の進行がみられ た。また、投薬期間終了時には観察されなかった精嚢の単核細胞浸潤が休薬期間終了時に認めら れた。 投与量20 mg/kg(感染症、免疫学的パラメータに及ぼす影響及び炎症に関する最小作用量)及 び 200 mg/kg(神経行動及び生殖機能に関する無作用量)での生後 88 日のラットの全身曝露量 (AUC)は、若年性 RA(若年性特発性関節炎及び若年性関節リウマチ)患者にアバタセプトを
月1 回 10 mg/kg 投与した場合の AUC 予測値の 95%点(37929 μg·h/mL)のそれぞれ約 5~6 倍及 び29~36 倍に相当する(海外臨床試験 IM101-033)。 新生児ラットを用いた毒性試験での変化の原因を調べるために、再度新生児ラットの毒性試験 を実施した。本試験では生後早期(生後4~28 日)のアバタセプト曝露が免疫系の変化にどの程 度関与するのかを検討するために生後4 日又は 28 日に投与を開始し、さらに感染症が免疫学的パ ラメータに与える影響を検討するために、より厳密に微生物管理された施設(標準的なケージで はなくマイクロアイソレーター内で飼育)で試験を実施した。本試験においても、初回の新生児 ラット試験と類似した変化が認められたことから、アバタセプトは投与開始日齢とは関係なく投 与量20 及び 65 mg/kg でリンパ系組織を含む免疫学的パラメータの変化及び非リンパ系器官での 炎症に関与していると考えられた。投与量65 mg/kg では尾の感染症が低頻度で認められた。これ らの試験成績より、新生児ラットで認められた免疫学的パラメータの変化は感染症に起因した二 次的変化ではないこと、より厳密に微生物管理した条件下で試験を実施すると初回の新生児ラッ ト試験と比較して感染症の発現頻度及び程度が低くなることが確認された。アバタセプトを最長 3 ヵ月間投与した成熟ラットでは、新生児ラットで認められた変化のうち感染症以外のすべての 変化が認められた。アバタセプトをマウスに最長20 ヵ月間及びサルに最長 1 年間、また belatacept をサルに最長6 ヵ月間投与しても同様の変化は認められず、さらに海外の臨床試験では、アバタ セプトをヒトに最長8 年間(5.3.5.3-7.2, 5.3.5.3-7.3)、belatacept と他の免疫調節性薬剤とを最長 5 年間併用投与しても、現時点までに投薬に関連した自己免疫の亢進を示唆する徴候は認められて いないことから、これらの変化はラットに特異的な変化と考えられた。以上より、成熟ラットで 感染症が発症しなかったことを除いて、新生児及び成熟ラット間でアバタセプトが免疫系に及ぼ す影響に明らかな差異は認められないことが示された。新生児ラットでの日和見感染症に対する 感受性上昇は、メモリー応答が確立される前にアバタセプトに曝露されたことと関連していると 考えられた。 ヒト融合蛋白であるアバタセプトは、マウス、ラット、イヌ及びサルに免疫原性を示し、これ らの動物のいずれにも抗アバタセプト抗体(アバタセプト特異抗体)が産生された。しかし、ア バタセプト特異抗体はほとんどが回復期間中にのみ検出されたことから、アバタセプトの血清中 濃度が免疫抑制作用を示す濃度以下に低下するまでアバタセプト特異抗体は産生されないことが 示唆され、アバタセプトは各動物種で自己抗体の産生を抑制するものと考えられた。アバタセプ ト特異抗体が産生されると薬物の血中消失速度は増加したが、いずれの試験でも投与期間中の曝 露量は維持されていた。アバタセプトの曝露が持続している場合、いずれの動物においてもアバ タセプト特異抗体の発現と急性又は標的器官の毒性との関連性は認められなかった。しかし、マ ウス及びイヌで血液中にアバタセプト特異抗体が検出されたことは、アバタセプトを静脈内に惹 起投与した後に毒性徴候(過敏反応)が観察されたことと関連していると考えられた。 市販されている他の RA 治療薬[腫瘍壊死因子(TNF)阻害作用を有する蛋白製剤]は潜伏性 の結核菌が活性化するリスクの上昇に関連があると考えられているが、アバタセプトはこれらの 治療薬とは異なる作用機序を有している。結核菌の潜在感染を再燃させる慢性感染モデルマウス にアバタセプトを投与しても、結核菌の慢性感染を抑制又は制御する宿主の防御能は損なわれな
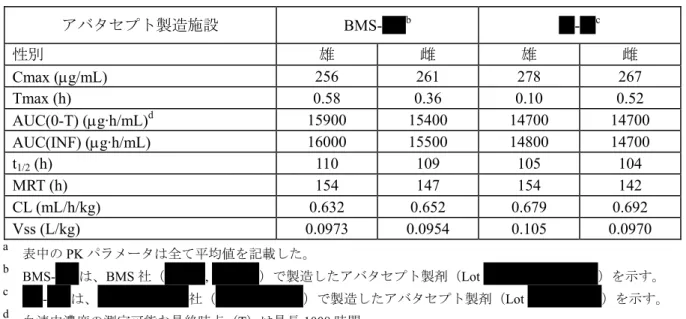
かった。 アバタセプトを臨床試験開始時に予想された注射液の最高濃度(10 mg/mL)でウサギに静脈内、 静脈周囲又は動脈内投与しても、明らかな刺激性変化はみられなかった。サルの反復静脈内投与 試験では、上記の注射液の予想最高濃度よりも高い濃度(25~31 mg/mL)でも、投与部位に明ら かな刺激性変化は認められなかった。マウスの反復皮下投与試験並びにラットの単回及び反復皮 下投与試験では、100 mg/mL の濃度まで投与部位に明らかな刺激性変化は観察されなかった。 アバタセプトをマウス及びサルに単回静脈内投与し、初期の製造工程による原薬の不純物[X XXXXXXXXXXXXXXXXXX]又はシリコーンコーティングシリンジ内での保存による凝集物含 有アバタセプトがヒスタミン遊離、補体活性化、サイトカイン遊離又は急性期反応を誘発する可 能性について検討するための試験を実施した。その結果、いずれの試験でも臨床的に意義のある メディエータ/蛋白の増加は認められなかった。 アバタセプトの高分子種(HMW)の安全性の特徴を明らかにするために、サルの単回及び反 復投与試験を実施した。サルの試験における投与量に基づいて適切な安全域を設定し、アバタセ プトのHMW の規格値を面積百分率で原薬では Xx%以下、製剤では xx%以下とした。 アバタセプトの製造工程の変更による同等性/同質性を薬物動態(PK)、免疫原性、生物活性 あるいは安全性プロファイルから明らかにする目的で、サルを用いた数種類の単回投与試験を実 施した。その結果、アバタセプトを用いたいずれの試験においても、異なる製造工程(プロセス A~F)間の同等性/同質性が確認された。 以上のように、広範囲な非臨床毒性試験を実施し、アバタセプトの安全性について検討した。 アバタセプトは、サルの単回投与毒性試験では投与量100 mg/kg まで良好な忍容性を示した。主 要な反復投与毒性試験では、薬理作用に起因する可逆的な変化としてマウス及びサルの血清Ig 量 の軽微な減少、雄マウスで脾臓のB 細胞比率の低下並びに B 細胞及び T 細胞の幼若化反応(ex vivo 試験)の抑制、サルの脾臓あるいはリンパ節で胚中心の機能低下を反映した胚中心の細胞数及び 直径の軽度から中等度の減少がみられた。投与期間が最長1 年間のいずれの反復投与毒性試験に おいても、これらの免疫学的パラメータの変化と関連する感染の臨床徴候は観察されなかった。 アバタセプトをマウスに長期間反復投与すると、腎臓尿細管上皮細胞における巨大核の発現頻度 及び程度の上昇がみられたが、サルではこのような変化は認められなかった。マウスの6 ヵ月間 投与毒性試験における腎臓の病理組織学的変化に関する無作用量は20 mg/kg(臨床用量でのヒト の曝露量の 0.9 倍の曝露量)と推定されたが、より長期間アバタセプトを投与したマウスのがん 原性試験では20 mg/kg 以上の全投与量で腎臓の病理組織学的変化が認められた。腎臓尿細管上皮 細胞における巨大核の発現頻度及び程度の上昇は腎機能の悪化を伴わず、マウスの自然発症性か つ加齢性病変の悪化によるものと考えられたが、ヒトとの関連性はほとんどないと考えられた。 また、無毒性量は200 mg/kg(臨床用量でのヒトの曝露量の 4.7 倍の曝露量)と推定された。ラッ トでは、新生児及び成熟ラットに最長3 ヵ月間アバタセプトを投与すると、特異的な免疫学的パ ラメータの変化、感染症(新生児ラット)及び特定の器官への影響(甲状腺及び膵島での炎症) が認められ、炎症は休薬期間中にも進行した。しかし、マウス、サル及びヒトでは、アバタセプ トあるいは belatacept を長期間投与しても自己免疫の亢進を示唆する徴候は認められていないこ
とから、原因は不明であるが、ラットで認められたこれらの変化から、マウス、サル及びヒトと 比較してラットはCD28 阻害作用に対して種特異的な感受性を示すことが示唆された。マウスの がん原性試験では、投与量20 mg/kg(臨床用量でのヒトの曝露量の 0.8 倍の曝露量)以上でリン パ腫、投与量65 mg/kg(臨床用量でのヒトの曝露量の 1.9 倍の曝露量)以上で乳腺腫瘍の発生率 が上昇した。マウスでは、MLV 及び MMTV がそれぞれリンパ腫及び乳腺腫瘍を誘発することが 知られており、がん原性試験で使用したマウスからこれらのウイルスが検出された。全投与量で 薬物特異抗体の産生が抑制されたことから、持続的な免疫抑制作用が発現していたと考えられた。 また、アバタセプトは一連のin vitro 遺伝毒性試験で遺伝毒性を示さなかったことから、アバタセ プト投与群のマウスにおけるリンパ腫及び乳腺腫瘍の発生率上昇は、長期にわたる免疫抑制作用 によりこれら特定のウイルスに対する免疫監視機構が低下したことと関連しているという仮説が 裏付けられた。サルを用いたbelatacept の 6 ヵ月間投与毒性試験又はアバタセプトの 1 年間投与 毒性試験では、リンパ腫やその他の固形癌又はリンパ系組織の過形成等の前がん病変は認められ なかった。受胎能、胚・胎児発生並びに出生前及び出生後の発生に対する影響について検討した 生殖発生毒性試験では、本薬投与に関連するF1ラットの変化として、高投与量群の雌ラットでT 細胞依存性抗体応答が9 倍亢進し、雌 1 例で甲状腺炎がみられた。これらの変化とヒトとの関連 性は不明であるが、これらの変化は臨床用量でのヒトの曝露量の11 倍の曝露量で発現し、3 倍の 曝露量では影響はみられなかった。局所刺激性試験、免疫毒性試験及びその他の毒性試験では、 アバタセプトをヒトに投与する場合の安全性上特段の懸念は認められなかった。 以上より、広範囲に実施した非臨床安全性試験成績から、アバタセプトを臨床用量でヒトに投 与する場合の安全性は担保できると考えられた。
2 単回投与毒性試験
アバタセプトをサルに投与量10~100 mg/kg で単回静脈内投与した。GLP に準拠して実施した サルの単回投与毒性試験の成績は、アバタセプトを静脈内投与した場合の急性毒性の特徴を把握 し、ヒトに過量投与した場合に適切な臨床情報を提供するための参考になると考えられた。2.1
サルにおける単回静脈内投与探索毒性試験(GLP 不適合)
探索毒性試験では、アバタセプトをサルに単回静脈内投与した場合の急性毒性及び遅延毒性に ついて検討した。アバタセプトを溶媒(25 mM リン酸ナトリウム、50 mM 塩化ナトリウム)に溶 解し、カニクイザル雄1 例に投与量 90 mg/kg で単回静脈内投与した(表 2.6.7.5-1 毒性試験概要 表、4.2.3.1-1)。投与後 14 日間毎日、動物の毒性徴候、一般状態及び行動の変化を観察した。評 価項目は、投与後64 日目までの体重・摂餌量測定、臨床病理学的検査、末梢血リンパ球フェノタ イプ解析(CD20, CD2, CD4 及び CD8)とし、実験に供したサルは 64 日目に飼育集団に戻した。 観察期間中、毒性徴候は観察されなかった。なお、最初の14 日間の観察期間に軽度の食欲不振 を示したが、体重には影響はみられず、その後実施した単回投与毒性試験では食欲不振は認めら れなかった。臨床病理学的変化として、15~42 日目にリンパ球数の減少(投与前値の 50%未満) が認められたが、リンパ球数は背景値の範囲内であった。さらに、64 日目に細胞傷害性 T 細胞(CD8 陽性リンパ球)比率の上昇と関連して、循環血液中のT 細胞比率の明らかな上昇が認められたが、 その後実施した単回及び反復投与毒性試験ではこれらの所見がみられなかったことから、本薬投 与に関連した変化ではないと考えられた。2.2
サルにおける単回静脈内投与毒性及びトキシコキネティクス試験(GLP 適合)
アバタセプトをサルに単回投与した場合の毒性、トキシコキネティクス(TK)及び免疫原性に ついて検討するために、本薬を1 群当たり雌雄各 2 匹のカニクイザルに、投与量 10, 33 及び 100 mg/kg で単回静脈内投与した(表 2.6.7.5-1 毒性試験概要表、4.2.3.1-2)。対照群の動物には、溶 媒(25 mM リン酸ナトリウム、50 mM 塩化ナトリウム)を投与液量 3.2 mL/kg で投与した。投与 量10 又は 33 mg/kg では投与後 42 日目までの TK 及び免疫原性のみを評価し、投与量 100 mg/kg では単回投与毒性を14 日間連日観察した後、剖検に供した。評価項目は毒性徴候・行動の観察、 体重・摂餌量・体温測定、リンパ球フェノタイプ解析、リンパ球幼若化反応(ex vivo 試験)、血 清総Ig 量測定、アバタセプト特異抗体検査、臨床病理学的検査、器官重量測定、肉眼病理検査及 び病理組織学的検査とした。 投与量10 又は 33 mg/kg では、投与量に比例した全身曝露量[AUC 及び最高血清中濃度(Cmax)] の増加がみられ、性差は認められなかった。アバタセプト特異抗体産生前の消失半減期(t1/2)は 投与量10 及び 33 mg/kg で類似していたが、アバタセプト特異抗体存在下では薬物消失速度が増 加した。アバタセプト特異抗体は、投与量10 mg/kg の 4 例中 2 例及び投与量 33 mg/kg の 4 例中 3 例のサルで42 日目までに検出された。 投与量100 mg/kg では、本薬投与に関連した変化はみられず、14 日目の剖検時までにはアバタセプト特異抗体は検出されなかった。 以上より、アバタセプトをサルに投与量100 mg/kg で単回投与しても明らかな毒性はみられな かったが、全身曝露量は投与量に比例して増加した。アバタセプト特異抗体はアバタセプトの血 清中濃度が比較的低いサルで検出され、抗体価の有意な上昇がみられたサルでは血液からのアバ タセプトの消失速度が増加した。アバタセプトに対する抗体応答が比較的遅かったことは、本薬 の作用機序と一致し、アバタセプトが自己抗体応答を抑制することが示唆された。概略の致死量 は100 mg/kg を超えると推定された。
3 反復投与毒性試験
マウス、ラット及びサルを用いて反復投与毒性試験を実施した。マウスの6 ヵ月間皮下投与毒 性試験は、マウスのがん原性試験の用量設定及び臨床試験で長期投与する場合の安全性を担保す る目的で実施した。また、ラットの2 週間静脈内/皮下投与毒性試験は、臨床試験で皮下投与す る場合の安全性を担保する目的で実施した。新生児ラットを用いた毒性試験で認められた変化を 詳細に検討するために、成熟ラットにおける3 ヵ月間静脈内投与免疫毒性試験を実施した。サル の1 ヵ月間及び 1 年間投与毒性試験は、それぞれ臨床試験で 1 ヵ月間及び長期投与時の安全性を 担保する目的で実施した。さらに、長期投与時の安全性を担保するために、サルで belatacept を 用いた6 ヵ月間投与毒性試験を実施した。 主要な反復投与毒性試験は、適切な試験計画の下、GLP 及び ICH ガイドラインに準拠して実施 し、アバタセプトの全身曝露量、動物における毒性プロファイル及びヒトのリスク評価並びにマ ウス及びサルでは本薬投与に関連した変化の回復性について検討した。3.1
マウス
マウスの 6 ヵ月間皮下投与毒性試験における定常状態でのアバタセプトの平均全身曝露量(1 週間のAUC)を表 3-1 に示す。マウスの全身曝露量の増加割合は用量比を下回った。なお、曝露 量は雌雄でほぼ同程度であったことから、表には雌雄を合算したAUC を示す。 表 3-1: 反復投与毒性試験におけるマウスの曝露量とヒトの曝露量の比較 種 試験 投与量 (mg/kg) AUC(TAU) (μg·h/mL) AUC(30d)b (μg·h/mL) ヒトに対するマウスの 曝露量比 ヒトa 反復静脈内投与 (qm) 10 50102 50102 – マウス 6 ヵ月間皮下投与 (qw) 20 65 200 10033 29581 54478 43142c 127198c 234255c 0.9 2.5 4.7 a 定常状態の AUC(海外臨床試験 IM101-100) b 30 日間の AUC c 1 ヵ月間の曝露量を算出するために、AUC(TAU) [TAU = 168 時間(7 日間)]を 4.3 倍した。なお、曝露量は 26 回目の投与後に測定した。 出典:5.3.5.1-2, 4.2.3.2-1 3.1.1 マウスにおける6 ヵ月間間歇(qw×26)皮下投与毒性試験(GLP 適合) アバタセプトを1 群当たり雌雄各 20 匹のマウスに、投与量 20, 65 及び 200 mg/kg で週 1 回 6 ヵ 月間皮下投与した(表2.6.7.7-1 毒性試験概要表、4.2.3.2-1)。対照群の動物には、溶媒(4%マル トース、10 mM リン酸ナトリウム、20 mM 塩化ナトリウム)を投与液量 10 mL/kg で投与した。 別途、1 群当たり雌雄各 9 匹のマウスにアバタセプトを投与量 20, 65 及び 200 mg/kg として同一 スケジュールで投与し、1 及び 26 回目の投与後の TK を測定した。評価項目は生死・臨床徴候・行動観察、体重・摂餌量・摂水量測定、理学検査、臨床病理学的検査、免疫学的検査(脾臓のリ ンパ球フェノタイプ解析、ex vivo でのリンパ球幼若化反応、血清 Ig 量測定、アバタセプト特異抗 体検査を含む)、器官重量測定、肉眼病理検査及び病理組織学的検査とした。毒性評価に供したマ ウスは、1 群当たり雌雄各 15 匹を 6 ヵ月の投与期間終了時、残りの動物を 4 ヵ月の休薬期間終了 時に剖検した。 皮下投与後のアバタセプトの吸収時間は長くなり、最高血清中濃度到達時間(Tmax)は 6~24 時間の範囲であった。Cmax 及び AUC 値は用量比を下回って増加し、週 1 回の反復投与によりわ ずかな蓄積がみられた。低投与量群で検出された薬物特異抗体存在下でも、本薬の消失速度には 変化はみられなかった。 試験期間中に本薬投与に関連した死亡例はみられず、いずれの投与量でも臨床病理学的パラメ ータ又は肉眼病理所見には本薬投与に関連した変化は認められなかった。投与量 65 及び 200 mg/kg では、6 ヵ月の投与期間終了時に雄で脾臓 B 細胞比率の低下(約 61~85%)並びに B 細胞 及びT 細胞の幼若化反応(ex vivo 試験)の抑制が、また血清 IgG 量の群平均値において一過性の 減少が認められたが、4 ヵ月の休薬期間終了時までには回復した。これらの変化は、本薬の作用 機序に起因する所見と考えられた。投与量20 mg/kg では、本薬投与に関連した器官重量及び病理 組織学的変化はみられなかった。6 ヵ月の投与期間終了後、投与量 65 又は 200 mg/kg で器官重量 の変化として、脾臓重量の増加及び胸腺重量の減少がみられたが、これらの変化には回復傾向が みられた。これらの投与量では本薬投与に関連した腎臓の病理組織学的変化として、軽度の慢性 多巣性炎、リンパ球浸潤及び尿細管上皮細胞変性を伴う概して可逆的な巨大核の発現頻度及び程 度の上昇が認められた。腎臓の所見はマウスにおける自然発症性かつ加齢性病変の悪化であり、 腎機能に対する影響は認められず、ヒトとの関連性はほとんどないと考えられた。Ki67 核抗原を マーカーとして検討した結果、対照群及び投薬群のマウスから採取した乳腺組織では上皮細胞の 増殖活性が上昇しなかったことから、本試験では発がん性の初期徴候はみられなかった。 以上より、アバタセプトをマウスに週1 回 6 ヵ月間皮下投与すると、全身曝露量は用量依存的 に増加したが、その増加割合は用量比を下回り、全投与量で忍容性が認められた。投与量65 及び 200 mg/kg では、概して可逆的な腎臓の加齢性病変の悪化がみられたが、腎機能には影響は認め られなかった。これらの結果から、アバタセプトをマウスに週1 回 26 週間皮下投与した場合の無 毒性量は、200 mg/kg(臨床用量でのヒトの曝露量の 4.7 倍の曝露量)と推定された。
3.2
ラット
3.2.1 ラットにおける 2 週間間歇(q2d×7)皮下/静脈内投与毒性及びトキシコキネティクス 試験(GLP 適合) アバタセプトをラットに皮下又は静脈内に投与した場合の反復投与による毒性、単回及び反復 投与時のTK 及び免疫原性について比較検討するために、本薬を 2 日に 1 回計 7 回、1 群当たり 雌雄各5 匹のラット 3 群に投与量 0, 80 及び 200 mg/kg(溶媒:20%マルトース、100 mM リン酸 ナトリウム、200 mM 塩化ナトリウム)で皮下投与、1 群当たり雌雄各 5 匹のラット 2 群に投与量 0 及び 200 mg/kg(溶媒:5%マルトース、25 mM リン酸ナトリウム、50 mM 塩化ナトリウム)で静脈内投与した(表 2.6.7.7-2 毒性試験概要表、4.2.3.2-2)。評価項目は生死・臨床徴候・行動観 察、体重・摂餌量・摂水量測定、理学検査、臨床病理学的検査、免疫学的検査(血清Ig 量及びア バタセプト特異抗体産生を含む)、器官重量測定、肉眼病理検査及び病理組織学的検査とした。別 途、単回及び反復投与によるTK 及び免疫原性について検討するために、アバタセプトを 1 群当 たり雌雄各3 匹のラット 8 群に投与量 10, 80 及び 200 mg/kg で皮下又は静脈内投与し、63 日目ま で血清サンプルの評価を行った。なお、毒性評価に用いたラットは15 日目に剖検した。 単回静脈内投与時の全身曝露量(Cmax 及び AUC)は投与量に比例して増加し、t1/2は投与量の
増加に伴い延長した。単回皮下投与により、Cmax 及び AUC は投与量に比例して増加し、Tmax は延長した(36~48 時間)。反復静脈内又は皮下投与により、アバタセプトの蓄積(3~5 倍)が みられた。皮下投与によるバイオアベイラビリティは、63%(投与量 10 mg/kg)~41%(投与量 200 mg/kg)であった。 皮下及び静脈内投与のいずれでも、単回又は反復投与により低投与量群でアバタセプト特異抗 体が検出された。典型的な免疫原性蛋白で予想されるより抗体応答が遅延したことは、本薬の薬 理作用と一致していた。反復投与群で単回投与群よりもアバタセプト特異抗体応答の発現が遅れ たことは、投与期間の長さ及び反復投与によるアバタセプトの蓄積によるものと考えられた。皮 下投与群で静脈内投与群よりも薬物特異抗体応答の発現頻度及び程度が上昇したことは、皮下投 与では血清中のアバタセプト濃度が低く、皮下投与による抗原提示がより有効であった可能性が あると考えられた。これらの試験成績から、アバタセプトの血清中濃度が免疫抑制作用を示す濃 度を下回ると、アバタセプトはラットに対し免疫原性を示すことが示唆された。 投与量80 又は 200 mg/kg で皮下投与及び投与量 200 mg/kg で静脈内投与すると、本薬投与に関 連した臨床病理学的変化として血清コレステロール・塩素・ナトリウム濃度の上昇が認められた。 血清アスパラギン酸アミノトランスフェラーゼ(AST)及びクレアチンキナーゼの減少もみられ たが、生物学的意義は低いと考えられた。さらに、アバタセプトを皮下投与すると、ヘマトクリ ットの軽微な低下、フィブリノーゲンの増加(投与量200 mg/kg)及び血清アルブミンの減少(投 与量80 mg/kg 以上)が認められた。投与量 200 mg/kg で反復静脈内又は皮下投与すると、14 日目 に血清IgG 及び IgA 量の減少がみられた(IgM 量には変化なし)。これらの Ig 量の減少は、皮下 投与群及び静脈内投与群でほぼ同程度であり、薬理作用に起因する変化と考えられた。本薬投与 に関連した器官重量の変化、肉眼病理学的変化及び病理組織学的変化はみられなかった。病理組 織学的に、対照群を含む皮下投与群の動物で投与部位の軽微から軽度の皮下出血及び軽微から中 等度の炎症が観察された。 以上より、アバタセプトをラットに2 日に 1 回計 7 回静脈内又は皮下投与しても、投与量 200 mg/kg まで薬物投与に関連した肉眼病理学的変化又は病理組織学的変化はみられなかった。総合 的に判断して、皮下投与による投与部位の変化は耐容可能と考えられた。アバタセプトはいずれ の投与経路においても免疫原性を示し(皮下投与でより強い影響がみられた)、血清中の薬物濃度 が免疫抑制作用を示す濃度を下回ると免疫原性を有することが示された。本試験における無毒性 量は200 mg/kg と推定された。
3.2.2 ラットにおける3 ヵ月間間歇(q3d)静脈内投与免疫毒性試験(GLP 適合) 新生児ラットの毒性試験(4.2.3.5.4-1)で認められた免疫学的パラメータの変化と比較するため に、成熟ラットにアバタセプトを3 日に 1 回 3 ヵ月間静脈内投与し、アバタセプトの免疫系に及 ぼす影響及び3 ヵ月の休薬期間終了後の回復性について検討した(表 2.6.7.7-6 毒性試験概要表、 4.2.3.2-6)。しかし、13 週目の初めに対照群を含む全群で投薬に関連しない足蹠の病変が認めら れたことから、休薬期間を3 ヵ月から 2 ヵ月に短縮したため、免疫系における変化の回復性につ いては十分に評価できなかった。1 群当たり雌雄各 20 匹の成熟ラットに、本薬を投与量 65 及び 200 mg/kg、投与液量 5 mL/kg で静脈内投与した。対照群の動物には溶媒として生理食塩液を投与 液量5 mL/kg で投与した。評価項目は生死、TK(5 及び 13 週目)、臨床徴候観察、体重・摂餌量 測定、理学検査(神経及び呼吸機能検査を含む)、免疫学的検査[末梢血リンパ球フェノタイプ解 析、血清Ig 量測定及び免疫原性検査(5, 8, 13,17 及び 21 週目)]、臨床病理学的検査、肉眼病理検 査及び病理組織学的検査とした。1 群当たり雌雄各 10 匹を 3 ヵ月の投与期間終了時(14 週目)に 剖検し、残りの動物(1 群当たり雌雄各最大 10 匹)は 2 ヵ月の休薬期間終了時(21 週目)に剖検 した。 投与量65~200 mg/kg では、曝露量(AUC0-72h)は用量比を下回って増加した(表 3-2)。5 週 目の曝露量は13 週目の曝露量と同等であったことから、アバタセプトは蓄積しないことが示唆さ れたが、雄の曝露量は一貫して雌の曝露量より高かった(1.4~1.7 倍)。休薬期間中の薬物濃度も 雌より雄で高く、21 週目では雌と比較して雄で最大 6 倍高い濃度を示した。この結果は、雌の t1/2 が8 日であるのに対し、雄では 9~10 日と雌よりやや長いことによるものと考えられた。さらに、 アバタセプト特異抗体(免疫原性)が投薬群のラットで17 週目から検出された。血清中の薬物濃 度の低下に伴って免疫原性の発現頻度が増加したが、薬物特異抗体による t1/2 への影響は認めら れなかった。 表 3-2: 反復投与毒性試験におけるラットの曝露量とヒトの曝露量の比較 投与量(mg/kg) 65 200 評価項目 週 雄 雌 雄 雌 5 1860 1500 3530 3180 Cmax (μg/mL) 13 1750 1350 10400 3270 5 44600 (8.3)a 27500 (5.1) a 82600 (15.3) a 60900 (11.3) a AUC0-72 h (μg·h/mL) 13 39000 (7.2) a 25000 (4.6) a 92700 (17.2) a 63900 (11.9) a a ラットのAUC0-72 hを9.3 倍[1 ヵ月間(28 日間)の曝露量]した後、アバタセプトを投与量 10 mg/kg で月 1 回(28 日に 1 回)投与した RA 患者の曝露量(AUC:50102 μg·h/mL)で除して、ヒトに対する曝露量比を算 出した。 出典:5.3.5.1-2, 4.2.3.2-6 いずれの投与量においても、投薬に関連した死亡例、臨床徴候、体重及び摂餌量の変化は認め られなかった。また、アバタセプトはラットにおいて65 mg/kg 未満の投与量で十分な薬理作用を
示すことから、アバタセプト投与による免疫学的パラメータに及ぼす影響には雌雄いずれにおい ても概して用量依存性は認められなかった。投薬に関連した変化として、投薬期間中及び休薬期 間中に末梢血T 細胞フェノタイプの変化が認められた。末梢血 T 細胞フェノタイプの変化として、 総リンパ球数の増加と関連するT 細胞総数の増加が認められ、これは主にヘルパーT 細胞(CD4 陽性CD8 陰性)数の増加による変化であった(対照群と比較して 1.32~2.01 倍)。その他の末梢 血T 細胞フェノタイプの変化としては、制御性 T 細胞(CD4 陽性 CD25 陽性 Foxp3 陽性)数の減 少が認められた(対照群と比較して0.23~0.60 倍)。総リンパ球数の増加と関連して、好塩基球数 及び総白血球数の軽微な増加が認められることがあった。細胞傷害性 T 細胞(CD4 陰性 CD8 陽 性)に及ぼす影響は認められなかった。 アバタセプトの薬理作用に起因するその他の影響として、14 及び 21 週目に血清 IgG 量の減少 (対照群と比較して0.07~0.30 倍)による血清グロブリン量の減少が認められたが、血清 IgM 量 には変化はみられなかった。アバタセプト特異抗体は投薬期間中(5, 8 及び 13 週目)には検出さ れなかったが、休薬期間中(17 及び 21 週目)にアバタセプト特異抗体発現動物数が投与量に反 比例して増加し、また血清中アバタセプト濃度の低下に伴い増加した。このことは、アバタセプ トの薬理作用による免疫抑制に関連した所見と考えられたが、投薬期間中及び投薬期間終了直後 においては血清中の高濃度のアバタセプトがアバタセプト特異抗体の検出を妨げていた可能性も 否定できない。 血液学的/免疫学的パラメータの変化に伴い、14 及び 21 週目にリンパ系器官及び非リンパ系 器官で病理組織学的変化が認められた。リンパ系器官では、いずれの投与量でも投薬に関連した 組織学的変化として、1)脾臓及び腸間膜/下顎リンパ節で胚中心の減少(数及び大きさ)を特徴 とするB 細胞領域の縮小及び 2)脾臓で PALS の発達及び腸間膜/下顎リンパ節で傍皮質領域拡 大を伴うT 細胞領域拡大の発現頻度増加がみられた。これらの変化は、上述のように血清 IgG 量 の減少及び末梢血ヘルパーT 細胞数の増加と一致していた。また、非リンパ系器官では、全投与 量で甲状腺及び膵島のリンパ球性炎(総発現頻度として、甲状腺:6%、膵島:18%)が 14 週目 よりも21 週目で高い発現頻度で認められ、自己免疫の所見と一致していた。膵島炎で雌より雄で 強い影響がみられたことを除き、これらの非リンパ系器官での変化の発現頻度及び程度は用量及 び性別に概して依存しなかった。 以上より、投与量65 mg/kg 以上(13 週目の AUC:25000 μg·h/mL 以上)で、リンパ系器官の変 化を含む免疫学的パラメータの変化及び非リンパ系器官で自己免疫様の炎症が認められた。いず れの投与量でも薬理作用が十分に示されることから、これらの変化の発現頻度及び程度に概して 用量依存性は認められなかった。休薬期間を3 ヵ月から 2 ヵ月に短縮し、薬理作用を示す濃度の アバタセプトが17 及び 21 週目(雄)の血清中にも存在したため、これらの所見の回復性を検討 することはできなかった。したがって、投薬に関連した変化は休薬期間中も概して継続するか、 進行したため、本試験では無毒性量は推定できなかった。
3.3
サル
サルの1 年間投与試験で得られた定常状態でのアバタセプトの平均全身曝露量(1 週間の AUC)を表 3-3 に示す。アバタセプトの全身曝露量は投与量に比例して増加し、反復投与により軽微か ら中等度の蓄積が認められた。なお、曝露量は雌雄で同程度であったことから、表には雌雄を合 算したAUC を示す。 表 3-3: 反復投与毒性試験におけるサルの曝露量とヒトの曝露量の比較 種 試験 投与量 (mg/kg) AUC(TAU) (μg·h/mL) AUC(30d) b (μg·h/mL) ヒトに対するサルの 曝露量比 ヒトa 反復静脈内投与 (qm) 10 50102 50102 – サル 1 年間静脈内投与 (qw) 10 22 50 22092 47253 110127 94996c 203188c 473546c 1.9 4.1 9.5 a 定常状態の AUC(海外臨床試験 IM-101-100) b 30 日間の AUC c 1 ヵ月間の曝露量を算出するために、AUC(TAU)(TAU = 7 日間)を 4.3 倍した。なお、曝露量は 52 回目の投 与後に測定した 出典:5.3.5.1-2, 4.2.3.2-5 3.3.1 サルにおける1 ヵ月間間歇(q2d×15)静脈内投与毒性試験(GLP 適合) アバタセプトをカニクイザルに1 ヵ月間間歇投与(q2d×15)した場合の毒性並びに休薬期間中 のアバタセプトの遅延毒性、TK 及び免疫原性について検討するために、本薬を 1 群当たり雌雄 各3 匹のカニクイザルに、投与量 10, 22.4 及び 50 mg/kg で 2 日に 1 回 1 ヵ月間静脈内投与した(表 2.6.7.7-3 毒性試験概要表、4.2.3.2-3)。対照群の動物には、溶媒(25 mM リン酸ナトリウム及び 50 mM 塩化ナトリウムを含む溶液)を投与液量 1.6 mL/kg で投与した。評価項目は生死・臨床徴 候観察、体重・摂餌量・体温測定、理学検査(神経及び呼吸器機能検査を含む)、眼科学的検査、 心電図検査(心拍数測定を含む)、血圧測定、器官重量測定、肉眼病理検査及び病理組織学的検査 とした。TK 測定(初回及び 15 回目の投与後)、臨床病理学的検査、免疫学的検査(リンパ球フ ェノタイプ解析、血清Ig 量測定、ex vivo でのリンパ球幼若化反応及び免疫原性検査を含む)のた めに採血した。1 群当たり雌雄各 2 匹を 1 ヵ月の投与期間終了時に剖検した。対照群及び高投与 量群の残りの動物は6 週の休薬期間終了時に剖検し、低・中投与量群の残りの動物は 11 週の休薬 期間終了時に剖検した。 アバタセプトの血清中濃度は用量依存的に増加した。投与期間終了時のCmax は 1 日目の Cmax の1.6~2.0 倍高値を示したことから、反復投与によるアバタセプトの蓄積が示唆された。アバタ セプト特異抗体は、血清中からの薬物消失速度が増加した投与終了後6~9 週目まで検出されなか った。 本薬投与に関連した臨床徴候はみられなかった。対照群と比較し、中投与量群の3 例中 1 例及 び高投与量群の3 例中 2 例の雄で休薬期間を含む試験期間中に摂餌量の減少がみられたが、摂餌 量の減少は体重には影響を及ぼさなかった。いずれの投与量においても、本薬投与に関連した臨 床病理学的変化、肉眼病理学的変化及び病理組織学的変化はみられず、器官重量の変化も認めら
れなかった。
試験期間中にみられた免疫学的影響は、アバタセプトの薬理作用と一致していた。1 ヵ月の投 与期間終了時に血清IgG 量の用量依存的で軽微な減少がみられた(IgM 及び IgA 量には変化なし) が、休薬期間中に回復した。アバタセプト特異抗体価は投薬期間中には上昇しなかったが、低投 与量群の2 例及び中投与量群の 1 例でアバタセプトの血清中濃度が免疫抑制作用を示す濃度を下 回ったと推測される投与終了後6~9 週目にアバタセプト特異抗体が検出された。 以上より、アバタセプトをサルに投与量50 mg/kg まで 2 日に 1 回 1 ヵ月間投与しても、投薬に 関連した毒性学的に意義のある変化はみられなかった。血清IgG 量の可逆的で軽微な減少は本薬 の薬理作用と関連しており、臨床的意義は低いと考えられた。アバタセプト特異抗体は投与終了 後6~9 週目までは検出されなかった。これらの抗体存在下では血清中からの薬物消失速度が増加 した。本試験における無毒性量は50 mg/kg と推定された。 3.3.2 Belatacept(BMS-224818)のサルにおける 6 ヵ月間間歇(qw×26)静脈内投与毒性及び トキシコキネティクス試験(GLP 適合) Belatacept は、CD80/86 結合ドメイン内の 2 つのアミノ酸残基がアバタセプトと異なることで、 アバタセプトよりも霊長類のCD86 に対する結合能が高く、生物活性が顕著に向上した薬剤であ る。Belatacept を 1 群当たり雌雄各 5 匹のカニクイザルに、投与量 10, 22 及び 50 mg/kg で週 1 回 6 ヵ月間静脈内投与した(表 2.6.7.7-4 毒性試験概要表、4.2.3.2-4)。対照群の動物には、注射用 生理食塩液を投与した。評価項目は臨床徴候観察、体重・摂餌量・体温測定、理学検査(神経系 及び呼吸器系機能の検査を含む)、眼科学的検査、心電図検査(心拍数測定を含む)、血圧測定、 臨床病理学的検査、免疫学的検査[末梢血及び脾臓リンパ球フェノタイプ解析、免疫原性及び血 清中Ig 量・ヒスタミン・補体 C3a・TNF-α・インターロイキン-6(IL-6)量の測定を含む]、器官 重量測定、肉眼病理検査及び病理組織学的検査とした。さらに、1, 12 及び 26 回目の投与後に、 TK 測定用に採血した。1 群当たり雌雄各 3 匹の動物を 6 ヵ月の投与期間終了時に剖検し、残りの 動物は回復性及び遅延毒性を検討するために 3 ヵ月の休薬期間終了時に剖検した。2 ヵ月間休薬 した後、すべてのサルをKLH で免疫し、免疫機能への影響を明らかにするために KLH 特異抗体 応答について検討した。 Belatacept の全身曝露量は用量依存的に増加し、性差はみられなかった。また、belatacept の t1/2 から予想されるように、78 日目までに定常状態に達した。 臨床徴候、体温変化、体重・摂餌量の変化、心電図変化、末梢血又は脾臓リンパ球のフェノタ イプに belatacept 投与に関連した変化はみられなかった。血清 IgG 量の軽微で可逆的な減少が認 められたが、4, 8 及び 25 週目の投与直後にはヒスタミン・補体 C3a・IL-6・TNF-α 量の変化はみ られなかった。また、belatacept 投与に関連した臨床病理学的パラメータ及び肉眼病理学的変化は みられなかった。投与終了時に、全投与量のリンパ節及び脾臓で胚中心の活性低下を反映した非 用量依存的な胚中心の軽微から軽度の萎縮がみられた。休薬期間終了時には、剖検1 ヵ月前に KLH で免疫した動物の胚中心における萎縮はみられず、投薬群の胚中心は対照群と同程度であった。2 ヵ月間の休薬後に KLH の免疫により明らかな抗体産生がみられ、免疫系の機能的回復が確認さ
![表 1-1: 毒性試験一覧 試験の種類/投与期間 投与経路 試験系 単回投与毒性 静脈内 サル 反復投与毒性 2 週間 皮下、静脈内 ラット 1 ヵ月間 静脈内 サル 3 ヵ月間 静脈内 ラット 6 ヵ月間 皮下 マウス 静脈内 サル[Belatacept (BMS-224818)] a 1 年間 静脈内 サル 遺伝毒性 復帰突然変異 In vitro ネズミチフス菌、大腸菌 HGPRT 遺伝子突然変異 In vitro CHO 細胞 染](https://thumb-ap.123doks.com/thumbv2/123deta/8616131.940182/10.892.109.789.187.843/静脈内皮下静ラット静脈内ラット静脈内静脈内ネズミチフス遺伝子.webp)