サノフィ株式会社
アレグラドライシロップ
5%
2.7.1 生物薬剤学試験及び関連する分析法
目
次
2.7.1 生物薬剤学試験及び関連する分析法 ...1 目 次 ...2 表 目 次 ...3 図 目 次 ...3 略号と用語の定義...4 1 背景及び概観...5 1.1 アレグラドライシロップ製剤の開発過程...5 1.2 ヒト血漿中濃度測定法...5 2 個々の試験結果の要約...6 2.1 生物学的同等性試験 (BEQ10716 試験) ...6 3 全試験を通しての結果の比較と解析...10 参 考 文 献...11 4 付録...12表
目 次
表 1 - アレグラドライシロップ 5%とアレグラ錠 30 mg の生物学的同等性試験の概要 ...7 表 2 - 日本人健康成人男性被験者にアレグラドライシロップ 5% 0.6 g 及びアレグラ錠 30 mg を クロスオ ーバー法により投与したときの薬物動態パラメータ(BEQ10716 試験) 平均 ± 標準偏差 (幾何平均)[変動係 数%]...8 表 3 - 日本人健康成人男性被験者にアレグラドライシロップ 5% 0.6 g 及びアレグラ錠 30 mg を クロスオ ーバー法により投与したときのCmax 及び AUC0-48 の幾何平均の比の点推定値及び 両側 90%信頼区間 (BEQ10716 試験) ...8図
目 次
図 1 - 日本人健康成人男性被験者にアレグラドライシロップ 5% 0.6 g 及びアレグラ錠 30 mg を クロスオ ーバー法により投与したときの平均血漿中フェキソフェナジン濃度推移 (BEQ10716 試験、アレグラドラ イシロップ 72 名、アレグラ錠 30 mg 71 名、Mean + SD)...7略号と用語の定義
AUC: 無限時間まで外挿した血漿中薬物濃度―時間曲線下面積 AUC0-48: 投与後0時間から 48時間までの血漿中薬物濃度から台形法により求めた血漿中薬物 濃度―時間曲線下面積 AUClast: 投与後0 時間から定量限界を超えた濃度が得られた最終時点までの血漿中薬物濃度 から台形法により求めた血漿中薬物濃度―時間曲線下面積 Cmax: 最高血漿中薬物濃度 MRT: 平均滞留時間 t1/2z: 終末相の消失半減期 tmax: 最高血漿中薬物濃度到達時間1
背景及び概観
1.1
アレグラドライシロップ製剤の開発過程
アレグラドライシロップ製剤の開発に際しては、低年齢の小児が服用しやすいよう、原薬である フェキソフェナジン塩酸塩が 、また、顆粒状で水に懸濁させて服用 することが可能である製剤を目指した。 アレグラドライシロップ製剤が市販されているアレグラ錠と生物学的に同等であることを確認す るため、日本人健康成人男性被験者を対象としてアレグラドライシロップ5% 0.6 g(試験製剤、フ ェキソフェナジン塩酸塩30 mg を含有)のアレグラ錠 30 mg(標準製剤)に対する生物学的同等性 試験(BEQ10716 試験)を実施した。 生物学的同等性試験に用いたドライシロップ製剤は小児通年性アレルギー性鼻炎患者及び小児ア トピー性皮膚炎患者における試験(SFY10717 試験及び SFY10718 試験)に用いたドライシロップと 同一バッチのものであり、市販予定製剤と同一処方の製剤である。1.2
ヒト血漿中濃度測定法
健康成人を対象とした生物学的同等試験(BEQ10716 試験)、小児通年性アレルギー性鼻炎患者 を対象とした安全性及び有効性並びに薬物動態試験(SFY10717 試験)、及び小児アトピー性皮膚 炎患者を対象とした安全性及び有効性並びに薬物動態試験(SFY10718 試験)における血漿中フェ キソフェナジン濃度は、バリデートされた方法により測定した。固相抽出法を用いてヒト血漿50 µL (BEQ10716 試験) 又は 25 µL(SFY10717、SFY10718 試験)からフェキソフェナジンを抽出し、 LC/MS/MS(液体クロマトグラフィー/タンデム型質量分析計)に注入した。定量範囲は血漿 50 µL では0.500~500 ng/mL、血漿 25 µL では 1.000~1000 ng/mL であり、真度(mean % difference)はそ れぞれ0.62%~5.92%及び-4.51%~4.37%、精度(CV%)はそれぞれ 2.50%~6.64%及び 4.03%~12.92% であった。[添付資料 4.2.2.1]2
個々の試験結果の要約
2.1
生物学的同等性試験 (BEQ10716 試験)
[添付資料5.3.1.2-1] 日本人健康成人男性被験者72 名(21~45 歳)を対象とし、アレグラドライシロップ 5% 0.6 g (試 験製剤)を投与したときとアレグラ錠30 mg(標準製剤)を投与したときのフェキソフェナジンの 薬物動態を比較し、生物学的同等性を検討した。本治験は非盲検、ランダム化、2 投与順序、2 剤 2 期クロスオーバー法で実施し、各投与の間に少なくとも7 日間の休薬期間を設けた。試験方法及び 評価方法は後発医薬品の生物学的同等性試験ガイドライン(平成9 年 12 月 22 日医薬審第 487 号、 平成18 年 11 年 24 日薬食審査発第 1124004 号)に従った(表 1 )。 72 名の被験者が本治験に参加したが、そのうち 1 名は第 1 期の投与(アレグラドライシロップ) 7 日後に急性上気道炎を発症したため、第 2 期の投与(アレグラ錠 30 mg)を受けずに治験を終了し た。第1 期に得られた薬物動態データは解析に含めた。 試験製剤及び標準製剤の血漿中フェキソフェナジン濃度を図 1 に示した。薬物動態パラメータを 表 2に、Cmax 及び AUC0-48 の幾何平均の比(試験製剤/標準製剤)の点推定値及び両側 90%信頼 区間を表 3 に示した。表 1 - アレグラドライシロップ 5%とアレグラ錠 30 mg の生物学的同等性試験の概要 試験番号 (実施国) 実施期間 試験の目的 試験 デザイン 対象被験者 被験者数 平均年齢 (範囲) 製剤 投与量 [Batch No.] 添付資料 BEQ10716 (日本) 年 月~ 年 月 アレグラドライ シロップ5%と アレグラ錠30 mg の生物学的 同等性の検討 非盲検 ランダム化 2 投与順序 2 剤 2 期 クロスオーバー 単回投与 健康成人男性 72 名 29.2 歳 (21-45) 試験製剤: アレグラドライシロップ5% 0.6 g (フェキソフェナジン 塩酸塩30 mg 含有)1 包 標準製剤: アレグラ錠30 mg (フェキ ソフェナジン塩酸塩30 mg 含有) 1 錠 5.3.1.2-1 図 1 - 日本人健康成人男性被験者にアレグラドライシロップ 5% 0.6 g 及びアレグラ錠 30 mg を クロスオーバー法により投与したときの平均血漿中フェキソフェナジン濃度推移 (BEQ10716 試験、アレグラドライシロップ 72 名、アレグラ錠 30 mg 71 名、Mean + SD) Nominal Time (h) 0 8 16 24 32 40 48 M ean ( + SD ) P las m a Fex of en adi ne C onc ent rat io n (ng/ mL ) 0 20 40 60 80 100 120 140 160 180
Dry syrup formulation of fexofenadine HCl 30 mg Marketed Allegra 30 mg tablet
Source = PKS Study : BEQ10716; Scenario: P-D-A-EV-OD-E01, Version 1 Date/Time = / /20 11:32:34 AM Nominal Time (h) 0 8 16 24 32 40 48 M ean ( + SD ) P las m a Fex of en adi ne C onc ent rat io n (ng/ mL ) 0 20 40 60 80 100 120 140 160 180
Dry syrup formulation of fexofenadine HCl 30 mg Marketed Allegra 30 mg tablet
Source = PKS Study : BEQ10716; Scenario: P-D-A-EV-OD-E01, Version 1 Date/Time = / /20 11:32:34 AM
表 2 - 日本人健康成人男性被験者にアレグラドライシロップ 5% 0.6 g 及びアレグラ錠 30 mg を クロスオーバー法により投与したときの薬物動態パラメータ(BEQ10716 試験)
平均 ± 標準偏差 (幾何平均)[変動係数%]
PK parameters Dry syrup formulation of fexofenadine HCl 30 mg Marketed Allegra 30 mg tablet
N 72 71 Cmax 128 ± 61.5 127 ± 57.7 (ng/mL) (116) [47.9] (116) [45.5] AUC0-48 773 ± 271 783 ± 271 (ng•h/mL) (730) [35.0] (739) [34.6] AUClast 771 ± 271 781 ± 272 (ng•h/mL) (728) [35.2] (737) [34.8] AUC 785 ± 274 796 ± 274 (ng•h/mL) (742) [35.0] (752) [34.4] tmaxa 1.50 2.00 (h) (0.75 - 6.00) (0.50 - 4.00) λz 0.0834 ± 0.0278 0.0794 ± 0.0278 (1/h) (0.0787) [33.3] (0.0747) [34.9] MRT 8.12 ± 1.37 8.34 ± 1.68 (h) (8.02) [16.9] (8.19) [20.1] t1/2z 9.34 ± 3.29 9.90 ± 3.81 (h) (8.80) [35.3] (9.28) [38.4] a Median (Min-Max)
Source = PKS Study : BEQ10716; Scenario: P-D-A-EV-OD-E01, Version 1 Date/Time = / /20 11:32:34 AM
表 3 - 日本人健康成人男性被験者にアレグラドライシロップ 5% 0.6 g 及びアレグラ錠 30 mg を
クロスオーバー法により投与したときのCmax及びAUC0-48 の幾何平均の比の点推定値及び
両側90%信頼区間(BEQ10716 試験)
Parameter Comparison Estimate 90% CI
Cmax A / B 1.01 (0.93 to 1.09)
AUC0-48 A / B 0.99 (0.94 to 1.05)
A: Dry syrup formulation, B: Marketed Allegra tablet
PGM=PRODOPS/M016455/BEQ10716/CSR/REPORT/PGM/pk_beq10716.sas OUT=REPORT/OUTPUT/pk_BA_k_t_2_i.rtf ( 20 - 13:57)
日本人健康成人男性被験者において、Cmax 及び AUC0-48 の幾何平均の比(試験製剤/標準製剤)
の両側90%信頼区間(点推定値)はそれぞれ 0.93~1.09 (1.01)及び 0.94~1.05(0.99)であった。
いずれのパラメータの両側90%信頼区間も生物学的同等性の基準範囲 0.80~1.25 内に含まれ、アレ
グラドライシロップ5% 0.6 g は市販アレグラ 30 mg 錠と生物学的に同等であると判断された。
なお、参考パラメータであるAUClast 、AUC、tmax 、Kel ( λz) 、MRT についても両製剤間で
3
全試験を通しての結果の比較と解析
参
考 文 献
4
付録
サノフィ株式会社
アレグラドライシロップ
5%
2.7.2 臨床薬理試験
目 次
2.7.2 臨床薬理試験 ...1 目 次 ...2 表 目 次 ...4 図 目 次 ...4 略号と用語の定義...5 1 背景及び概観...6 1.1 成人における薬物動態と薬力学...6 1.2 7~11 歳及び 12~15 歳の小児における薬物動態と薬力学 ...6 1.3 生後6 ヵ月~2 歳未満(0.5~1 歳)及び 2~6 歳の小児における薬物動態...7 2 個々の試験結果の要約...9 2.1 小児における薬物動態/母集団薬物動態...9 2.1.1 外国人2~5 歳小児被験者における薬物動態試験(I1114 試験、参考資料) ...9 2.1.2 外国人0.5 ~2 歳未満小児被験者における薬物動態(T1123 試験、参考資料)...9 2.1.3 外国人2~5 歳小児アレルギー性鼻炎患者における薬物動態試験(I1005 試験、参考資料) ...10 2.1.4 日本人小児患者(0.5~11 歳)における血漿中濃度(SFY10717 試験/SFY10718 試験、評 価資料)...10 3 全試験を通しての結果の比較と解析...13 3.1 乳幼児における日本人と外国人との体重の比較...133.2 小児における母集団薬物動態解析...15 3.2.1 母集団薬物動態解析対象例の被験者背景...15 3.2.2 外国人小児患者(0.5~12 歳)における母集団薬物動態の検討(B2002PPK0279、参考資 料)...16 3.2.3 日本人小児患者(0.5~11 歳)における母集団薬物動態の検討(POH0273 試験、評価資料) ...18 3.3 小児患者における薬物動態...19 3.3.1 乳幼児患者(0.5~6 歳)における薬物動態 ...19 3.3.2 小児患者(7~11 歳)における薬物動態 ...19 4 特別な試験...20 参 考 文 献...21 5 付録...22
表 目 次
表 1 - 0.5~6 歳の小児を含む臨床薬理試験の一覧表 ...8 表 2 - 0.5~6 歳における臨床薬理試験の薬物動態パラメータの要約(平均値±SD) ...12 表 3 - 6 歳以下の日本人及び米国人男子乳幼児の体重(kg、パーセンタイル値) ...13 表 4 - 6 歳以下の日本人及び米国人女子乳幼児の体重(kg、パーセンタイル値) ...14 表 5 - POH0273 の薬物動態解析対象例における被験者背景一覧 ...15 表 6 - B2002PPK0279 の薬物動態解析対象例における被験者背景一覧...16 表 7 - 外国人の母集団薬物動態解析より得られた薬物動態パラメータ(平均値(CV%)、B2002PPK0279) 及び比例換算より得られる各用量の推定Cmax...17 表 8 - 日本人の母集団薬物動態解析より得られた薬物動態パラメータ、平均値(CV%)(POH0273) ...18図
目 次
図 1 - 日本人小児のアレルギー性鼻炎患者及びアトピー性皮膚炎患者における血漿中濃度 ...11略号と用語の定義
略号 英語:日本語
BSA Body surface area:体表面積
1
背景及び概観
1.1
成人における薬物動態と薬力学
日本人及び外国人健康成人男子にフェキソフェナジン塩酸塩を単回経口投与したとき、血漿中フェ キソフェナジン濃度の推移パターンは類似していた。また、日本人及び外国人健康成人男子にフェ キソフェナジン塩酸塩を単回経口投与した試験から得られた血漿中フェキソフェナジン濃度データ
をもとにNONMEM プログラムを用いて PPK 解析を行った。算出された日本人の AUC及びCmax は
外国人に比べて約20~35%大きかったが、対象となった被験者の体重は日本人に比べ外国人のほう が約30%重く、この薬物動態パラメータの違いの要因は体重による影響が示唆された[初回申請(鼻 炎・蕁麻疹)概要297~298 頁、393 頁]。 日本人及び外国人健康成人にフェキソフェナジン塩酸塩を単回経口投与したときのヒスタミン皮内 反応に対する抑制効果を検討した試験データをもとに、Sigmoid-Emax モデルを用いて被験者ごとの 血漿中フェキソフェナジン濃度-反応曲線を推定した。その結果、被験者間のばらつきは大きかっ たものの、中央値を用いて推定したモデルにおいて、日本人及び外国人成人の皮膚膨疹及び紅斑に 対するEC50は近い値を示した[初回申請(鼻炎・蕁麻疹)概要393~394 頁]。
1.2 7~11 歳及び 12~15 歳の小児における薬物動態と薬力学
12~15 歳の日本人小児にフェキソフェナジン塩酸塩 60 mg を投与したときの薬物動態プロファイル は、日本人成人に 60 mg を投与したときと類似していることが示された。また、6~11 歳の日本人 小児の体格は、同年代の外国人小児と同程度であることから、6~11 歳の日本人小児にフェキソフ ェナジン塩酸塩 30 mg を投与したときの薬物動態プロファイルは、同年代の外国人小児に 30 mg を 投与したときと類似していると考えられた[小児適応拡大CTD Module 2.5]。 6~11 歳の日本人小児にフェキソフェナジン塩酸塩 30 mg を、12~15 歳の小児にフェキソフェナジ ン塩酸塩 60 mg を投与したとき、30 mg 投与群における血漿中濃度及び AUC の平均値は、60 mg 投 与群に比べてやや低い値を示したが、臨床効果に影響を与えるほど大きなものではないと考えられ た[小児適応拡大CTD Module 2.5]。 7~12歳の外国人アレルギー性鼻炎患者にフェキソフェナジン塩酸塩 30 mg、60 mgを単回経口投与、 及び6~11 歳の外国人アレルギー性鼻炎患者にフェキソフェナジン塩酸塩 15 mg、30 mg、60 mg を 単回経口投与したとき、皮膚膨疹及び紅斑に対する抑制効果は、その反応が小さく、またばらつき も大きかったためフェキソフェナジン塩酸塩の薬力学の定量的な評価を行うことは困難であったが、 ヒスタミン(高濃度)誘発時のフェキソフェナジン塩酸塩の皮膚膨疹及び紅斑に対する抑制効果は、 30 mg 投与群と 60 mg 投与群では同程度であった[小児適応拡大CTD Module 2.5]。上記に示した通り、成人並びに 12~15 歳および 7 歳~11 歳の小児でのフェキソフェナジン塩酸塩 の薬物動態については過去の承認申請時の資料概要に示している。また、2.7.1に示したように、今 回の申請剤型であるアレグラドライシロップ 5%はアレグラ錠 30 mg との生物学的同等性が確認さ れた。したがって、成人及び7 歳以上の小児にアレグラドライシロップ 5%の適応が可能となる。
1.3
生後
6 ヵ月~2 歳未満(0.5~1 歳)及び 2~6 歳の小児における薬物動態
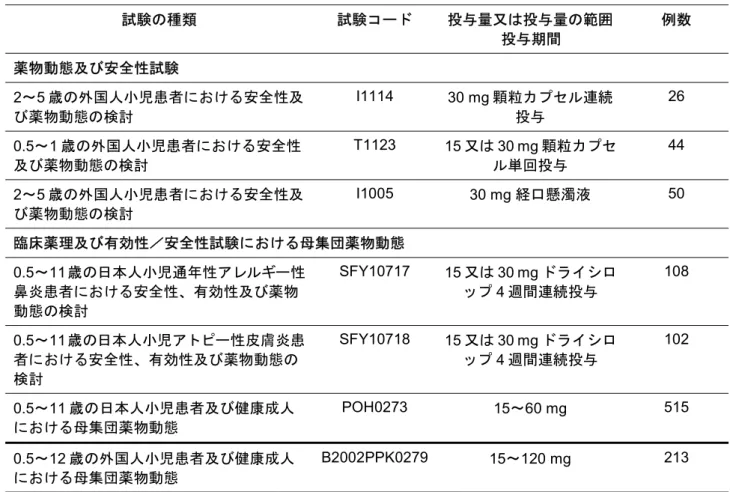
0.5~6 歳の小児におけるフェキソフェナジンの薬物動態については、国内外において表 1 に示した 試験が実施されている。なお、これらの試験では異なる製剤が用いられているが、これらの製剤と錠剤 との生物学的同等性は確認されている。 0.5~12歳の外国人小児患者における母集団薬物動態において得られたフェキソフェナジンのみかけ の経口クリアランス(CL/F)は、0.5~1 歳(体重 10.5 kg 以下)で 14.9 L/h、0.5~1 歳(体重 10.5 kg 以上)で23.6 L/h、及び 2 歳~5 歳で 34.3 L/h であり、推定される曝露量(Cmax、AUC)は成人と類 似していた。このことから、0.5~1 歳(体重 10.5 kg 以下)では 15 mg が、2 歳~6 歳(体重 10.5 kg 以上)では30 mg が、適切な用量であると推定された。 今回、0.5 歳~11 歳の日本人小児患者を対象とし、アレグラドライシロップ 5%を用いた SFY 10717 及び SFY10718 試験においてフェキソフェナジンの血漿中濃度を測定した。この 2 試験の結果と POP6485 試験(7 歳以上の日本人)及び J002 試験(日本人成人)の結果を用い、母集団薬物動態解 析を実施した。0.5~1 歳にフェキソフェナジン塩酸塩 15 mg、及び 2~6 歳(体重 10.5 kg 以上)に フェキソフェナジン塩酸塩 30 mg を投与したときの CL/F は、それぞれ(平均値、以下同様)15.6 L/hr、 29.9 L/hr であった。また、AUC は 1090 ng・hr/mL 及び 1060 ng・hr/mL、Cmaxは130 ng/mL 及び 157 ng/mL であり、成人の結果(AUC:1110 ng・hr/mL、Cmax:175 ng/mL)と類似していた。このことから、 0.5~1歳及び 2~6歳の小児アレルギー性鼻炎及びアトピー性皮膚炎患者にアレグラドライシロップ 5%をそれぞれフェキソフェナジン塩酸塩として 15 mg 及び 30 mg を投与したときの曝露量は成人に 60 mg を投与したときと類似し、用量として適切であると考えられた。表 1 - 0.5~6 歳の小児を含む臨床薬理試験の一覧表 試験の種類 試験コード 投与量又は投与量の範囲 投与期間 例数 薬物動態及び安全性試験 2~5 歳の外国人小児患者における安全性及 び薬物動態の検討 I1114 30 mg 顆粒カプセル連続 投与 26 0.5~1 歳の外国人小児患者における安全性 及び薬物動態の検討 T1123 15 又は 30 mg 顆粒カプセ ル単回投与 44 2~5 歳の外国人小児患者における安全性及 び薬物動態の検討 I1005 30 mg 経口懸濁液 50 臨床薬理及び有効性/安全性試験における母集団薬物動態 0.5~11歳の日本人小児通年性アレルギー性 鼻炎患者における安全性、有効性及び薬物 動態の検討 SFY10717 15 又は 30 mg ドライシロ ップ4 週間連続投与 108 0.5~11歳の日本人小児アトピー性皮膚炎患 者における安全性、有効性及び薬物動態の 検討 SFY10718 15 又は 30 mg ドライシロ ップ4 週間連続投与 102 0.5~11 歳の日本人小児患者及び健康成人 における母集団薬物動態 POH0273 15~60 mg 515 0.5~12 歳の外国人小児患者及び健康成人 における母集団薬物動態 B2002PPK0279 15~120 mg 213
2
個々の試験結果の要約
個々の試験の要約一覧を表 2 に示す。
2.1
小児における薬物動態/母集団薬物動態
2.1.1 外国人 2~5 歳小児被験者における薬物動態試験(I1114 試験、参考資料)
[添付資料5.3.3.1-1:I1114 Clinical Study Report K2000CLN0016]] [添付資料 5.3.3.1-2:I1114 Clinical Study Report K2000CLN0032] [添付資料 5.3.3.1-3:I1114 Clinical Study Report Amendment CPH-B-2003-0287]
外国人2~5 歳(2 歳以上 6 歳未満)小児被験者を対象としてフェキソフェナジン塩酸塩 30 mg(顆 粒)を初日に1 日 1 回経口投与し、その後 1 日 2 回 4~7 日間経口投与して薬物動態を検討した。21 名のデータを用いてノンコンパートメントモデルにより解析した結果、AUC の平均値は 632.97 ng・ h/mLであり、CL/Fは 52.41 L/hであった。血漿中フェキソフェナジンは tmax 1.49 hで Cmax146.86 ng/mL に達し、測定可能であった最終2 時点から求めた最終相の半減期は 7.56 h と推定された。 治験を完了した25 名を用いて母集団薬物動態解析を行い、共変量としては年齢、体重、身長、体表 面積、BMI、性別、人種、併用薬及び合併症を検討した。その結果、体表面積が CL/F の共変量とし て挙がり、体表面積増加に伴い CL/F が増加することが示唆された。年齢は有意な共変量ではなか った。またフェキソフェナジン塩酸塩30 mg 反復投与時の薬物動態は単回投与時と比較して有意な 変化はなかった。
2.1.2 外国人 0.5 ~2 歳未満小児被験者における薬物動態(T1123 試験、参考資料)
[添付資料5.3.3.1-4:T1123 Clinical Study Report K2001CLN0020] [添付資料 5.3.3.1-5:T1123 Clinical Study Report Amendment CPH-B-2003-0290] 外国人 0.5~2 歳未満の外国人小児被験者 44 名を対象として、フェキソフェナジン塩酸塩 15 あるい は30 mg (顆粒)を単回投与した時の薬物動態を検討した。フェキソフェナジンは速やかに吸収さ れ、約1 時間で最高血漿中濃度(15 mg で 168.69 ± 69.99、30 mg で 328.95 ± 224.30 ng/mL)に達し た後、2 相性に消失した。24 時間までの限られた採血時点から算出した半減期は 15 mg 及び 30 mg で それぞれ6.19 ± 1.65 h 及び 7.38 ± 5.12 h であった。AUC は 15 mg 投与時で 804.29 ± 340.06 ng・h/mL、 30 mg 投与時で 1660.31 ± 909.60 ng・h/mL であった。30 mg 投与時の Cmax、AUC は 15 mg 投与時の 約2 倍であり、CL/F はいずれの投与量でも約 22 L/h であった。
2.1.3 外国人 2~5 歳小児アレルギー性鼻炎患者における薬物動態試験(I1005 試験、参考資料)
[添付資料 5.3.3.2-1]
外国人2~5 歳の外国人小児アレルギー性鼻炎患者 50 名を対象にフェキソフェナジン塩酸塩 30 mg
(経口懸濁液)を単回経口投与した時の薬物動態を検討した。Cmax及びAUClastはそれぞれ 224 ng/mL
(39.3%CV)及び 898 ng・h/mL(34.3%CV)であった。また tmaxの中央値は1h であった。いずれの 被験者についてもt1/2、AUC 及び CL/F は算出しなかった。
2.1.4 日本人小児患者(0.5~11 歳)における血漿中濃度(SFY10717 試験/SFY10718 試験、
評価資料)
[添付資料5.3.5.2-1] [添付資料5.3.5.2-2] 日本人小児患者に、フェキソフェナジン塩酸塩として0.5~1 歳では 15 mg、2~11 歳では 30 mg(10.5 kg 未満には 15 mg)のアレグラドライシロップ 5%を反復投与したときの Cmax及びトラフ付近の血 漿中濃度を図 1 に示す。0.5~1 歳に 15 mg 及び 2~6 歳に 30 mg(10.5 kg 未満には 15 mg)を投与し たときの血漿中濃度の分布は、既に承認されている7~11 歳に 30 mg を投与したときの血漿中濃度 の分布に類似していた。また、2~6 歳で 15 mg を投与した 1 名の被験者(体重 10.0 kg)は 2~6 歳 に30 mg を投与した群の中央からやや低位に位置した。図 1 - 日本人小児のアレルギー性鼻炎患者及びアトピー性皮膚炎患者における血漿中濃度 1 10 100 1000 0 4 8 12 16 20 24 28 時間 (hr) 血漿 中濃 度 ( ng/ m L) 7~11歳 (30 mg) 2~6歳 (30 mg) 2~6歳 (15 mg) 0.5~1歳 (15 mg)
2.7.2 臨床薬理試験 アレグラドライシロップ5% 表 2 - 0.5~6 歳における臨床薬理試験の薬物動態パラメータの要約(平均値±SD) 試験番号 対象 年齢 (歳) 例数 投与量 (mg) AUC(0-∞) (ng・hr/mL) Cmax (ng/mL) tmax (hr) t1/2 (hr) CL/F (L/hr) SFY10717/ SFY10718 日本人小児 0.5~12~6 55 80 15 30 1090 ± 501* 1060 ± 258* 130 ± 53* 157 ± 46* 2.7* 1.9* 91.5 ± 24.0* 39.7 ± 9.58* 15.6 ± 4.7* 29.9 ± 7.2* T1123 外国人小児 0.5~1 21 23 15 30 1660.31 ± 909.60 804.29 ± 340.06 328.95 ± 224.30 168.69 ± 69.99 1.10 1.10 6.19 ± 1.65 7.38 ± 5.12 21.70 ± 12.47 21.94 ± 11.73 I1114 外国人小児 2~5 21 30 632.97 146.86 1.49 7.56 52.41 I1005 外国人小児 2~5 50 30 898 224 1.0 - - *:母集団薬物動態解析(POH0273)より引用
3
全試験を通しての結果の比較と解析
3.1
乳幼児における日本人と外国人との体重の比較
表 3 及び表 4 に 6 歳以下の各年齢層における日本人及び米国人男子及び女子の体重を示す。 表 3 - 6 歳以下の日本人及び米国人男子乳幼児の体重(kg、パーセンタイル値) 日本人a 米国人b 歳 ヵ月 10th 中央値(50th) 90th 10th 中央値(50th) 90th 6 7.10 8.16 9.39 7.04 8.16 9.48 7 7.36 8.45 9.67 7.47 8.64 10.02 8 7.61 8.70 9.92 7.87 9.08 10.51 9 7.82 8.93 10.15 8.22 9.48 10.96 10 8.02 9.13 10.36 8.54 9.84 11.36 0 11 8.21 9.33 10.57 8.83 10.16 11.73 0 8.39 9.51 10.77 9.10 10.46 12.07 1 8.55 9.68 10.95 9.34 10.73 12.37 2 8.69 9.85 11.18 9.56 10.98 12.65 3 8.84 10.03 11.39 9.76 11.21 12.91 4 8.99 10.22 11.61 9.95 11.42 13.15 5 9.16 10.41 11.83 10.13 11.62 13.37 6 9.31 10.59 12.04 10.29 11.80 13.58 7 9.47 10.77 12.26 10.44 11.98 13.78 8 9.62 10.94 12.46 10.59 12.14 13.97 9 9.75 11.10 12.65 10.73 12.30 14.15 10 9.90 11.28 12.87 10.86 12.45 14.33 1 11 10.03 11.43 13.05 10.99 12.60 14.50 0~5 10.59 12.07 13.81 11.33 12.93 15.08 2 6~11 11.46 13.01 14.97 12.02 13.83 15.95 0~5 12.28 13.97 16.14 12.93 14.95 17.35 3 6~11 13.09 14.92 17.33 13.95 15.80 18.26 0~5 13.90 15.90 18.60 14.70 17.01 19.70 4 6~11 14.72 16.91 19.93 15.35 17.92 20.98 0~5 15.56 17.96 21.38 16.22 19.16 22.34 5 6~11 16.32 18.93 22.85 17.12 20.25 24.04 0~5 17.14 19.87 24.67 17.69 21.32 25.51 6 6~11 - - - 19.05 22.11 27.67a: 厚生労働省 平成 12 年 乳幼児身体発育調査報告書. 2001(1)より抜粋
b: Kuczmarski RJ, et al. 2000 CDC Growth Charts for the United States: methods and development. Vital Health Stat 11. 2002;246:1-190(2)より抜粋
表 4 - 6 歳以下の日本人及び米国人女子乳幼児の体重(kg、パーセンタイル値) 日本人a 米国人b 歳 ヵ月 10th 中央値(50th) 90th 10th 中央値(50th) 90th 6 6.62 7.54 8.67 6.41 7.45 8.61 7 6.85 7.82 8.98 6.82 7.90 9.11 8 7.05 8.05 9.22 7.20 8.31 9.57 9 7.22 8.26 9.42 7.55 8.69 10.00 10 7.40 8.46 9.64 7.87 9.04 10.40 0 11 7.59 8.67 9.85 8.17 9.37 10.76 0 7.79 8.88 10.06 8.44 9.67 11.10 1 7.97 9.07 10.30 8.70 9.94 11.42 2 8.14 9.26 10.51 8.93 10.20 11.71 3 8.31 9.45 10.74 9.15 10.45 11.99 4 8.48 9.65 10.97 9.36 10.67 12.26 5 8.65 9.84 11.19 9.55 10.89 12.51 6 8.82 10.04 11.42 9.73 11.09 12.75 7 8.97 10.22 11.63 9.90 11.28 12.98 8 9.14 10.40 11.85 10.07 11.46 13.20 9 9.28 10.57 12.05 10.22 11.64 13.42 10 9.44 10.76 12.28 10.37 11.81 13.63 1 11 9.60 10.95 12.51 10.51 11.97 13.84 0~5 10.07 11.53 13.26 10.77 12.36 14.51 2 6~11 10.95 12.51 14.51 11.79 13.38 15.65 0~5 11.78 13.49 15.72 12.35 14.40 17.12 3 6~11 12.62 14.49 16.97 13.27 15.31 17.92 0~5 13.46 15.50 18.27 14.15 16.44 19.73 4 6~11 14.29 16.52 19.62 14.63 17.24 20.65 0~5 15.10 17.55 21.09 15.65 18.48 22.68 5 6~11 15.93 18.62 22.84 16.85 19.80 25.25 0~5 16.71 19.69 24.64 17.35 20.64 25.40 6 6~11 - - - 17.92 21.55 27.67 a: 厚生労働省 平成 12 年 乳幼児身体発育調査報告書. 2001(1)より抜粋
b: Kuczmarski RJ, et al. 2000 CDC Growth Charts for the United States: methods and development. Vital Health Stat 11. 2002;246:1-190(2)より抜粋
男子乳幼児の各年齢層の体重の中央値は、いずれも米国人が日本人よりやや重いがその差は小さく、 お互いの90 パーセンタイル値の範囲に入っていた。これは女子乳幼児においても同様であった。こ のことから、6 歳以下において日本人及び米国人乳幼児に大きな体重差はないと考えられた。 日本人の男女乳幼児の体重表における2~2.5 歳の 10%タイル値がそれぞれ 10.59 及び 10.07kg と 10.5 kg 付近の値であることから、この年齢層では 10.5 kg 以下の乳幼児は 10%程度存在すると推定され た。また2.5 歳以上の年齢層では 10%タイル値が 10.95kg 以上となり、10.5 kg 以下の乳幼児はほと んどいないと推定された。このことから2~6 歳で 10.5 kg 以下である乳幼児の割合は、0.5 歳ごとの 年齢層における人口構成があまり変わらないとすると、全体の約 1%に相当し非常に低い割合であ ると推定された。
3.2
小児における母集団薬物動態解析
3.2.1 母集団薬物動態解析対象例の被験者背景
母集団薬物動態解析に用いた日本人(POH0273)及び外国人(B2002PPK0279)の被験者背景を表 5 及び表 6 に示す。 表 5 - POH0273 の薬物動態解析対象例における被験者背景一覧表 6 - B2002PPK0279 の薬物動態解析対象例における被験者背景一覧 日本人患者の0.5~1 歳及び 2~6 歳(SFY10717/SFY10718)の平均体重は 9.25 kg 及び 17.3 kg、並び に外国人患者の0.5~1 歳(T1123)及び 2~5 歳(I1114)の平均体重は 11.1 kg 及び 16.3 kg であり、 両試験の各年齢層の平均体重は類似していた。
3.2.2 外国人小児患者(0.5~12 歳)における母集団薬物動態の検討(B2002PPK0279、参考
資料)
[添付資料5.3.3.5-1] 0.5 歳以上の外国人小児に対する推奨用量を検討するために、成人及び 0.5 歳以上の小児における母 集団薬物動態解析(B2002PPK0279)を PJPR0015 試験、PJPR0025 試験、PJPR0026 試験、PJPR0029 試験、PJPR0037 試験、PJPR0094 試験、I1114 試験及び T1123 試験データを用いて実施した。解析に は77名の小児患者及び 136名の成人被験者から得られた血漿中フェキソフェナジン濃度値を用いた。 母集団解析により、共変量として被験者背景因子をモデルに組み入れた結果、CL/F の変動要因とし て体重及び年齢の影響が示唆された。 母集団解析より得られた個別の推定パラメータの要約を表 7に示す。2~5 歳小児の個別の推定値に 基づくCL/F の平均推定値は 34.3 L/h で、6~12 歳の小児(30.1 L/h)よりやや高く(14%)、成人(53.6L/h)より低かった(約 36%)。一方、 2~5 歳に 30 mg を投与したとき Cmaxの推定値はおよそ154 ng/mL(換算値)であり、6~12 歳に 30 mg、及び成人に 60 mg を投与したときの Cmaxの推定値(153 及び156 ng/mL、換算値)と差はなかった。これらの結果から、2~5 歳の小児に 30 mg 1 日 2 回投 与したときの Cmax及び全般的な曝露の程度は、成人に 60 mg を 1 日 2 回投与したとき及び 6~12 歳の小児に30 mg を 1 日 2 回投与したときと同程度であると推定された。 0.5~1 歳の小児での個別の推定値に基づく CL/F は平均すると成人より 61%低かった。この年齢の 小児を体重10.5 kg で層別したところ、クリアランスの推定値は 10.5 kg 以下の小児では 14.9 L/h(変 動係数26%、N=13)、10.5 kg を超える小児では 23.6 L/h(変動係数 42%、N=29)となった。低体 重層及び高体重層の推定値は成人に比べ72%及び 56%低かった。したがって、フェキソフェナジン 塩酸塩を体重10.5 kg 以下の小児に 15 mg 1 日 2 回、体重 10.5 kg を超える小児に 30 mg 1 日 2 回投与 した場合、成人に60 mg 1 日 2 回投与した場合と類似した曝露が得られると推定された。 表 7 - 外国人の母集団薬物動態解析より得られた薬物動態パラメータ(平均値(CV%)、B2002PPK0279) 及び比例換算より得られる各用量の推定Cmax 用量 (mg) 年齢 例数 Cmax* (ng/mL) CL/F (L/h) (ng/mL) Cmax** 15 0.5~1 歳 42 783.9 (43) 20.9 (45) 147 2~5 歳 21 411.0 (25) 34.3 (25) 154 30 6~12 歳 14 408.9 (36) 30.1 (27) 153 60 成人 136 208.0 (32) 53.6 (34) 156 *:80 mg 投与としたときの推定値 **:80 mg 投与としたときの推定 Cmax を各用量で比例換算したときの推定 Cmax 成人では日本人及び外国人の有効性及び安全性が類似しておりブリッジングが成立していること(初 回申請時)、7~15 歳の小児における至適用量が日本人と外国人で同じであること(小児適応拡大 申請時)、米国では0.5~1 歳には 15 mg 1 日 2 回投与、2~11 歳には 30 mg 1 日 2 回投与で承認され 広く使用されていること、乳幼児の体格は日本人と米国人で類似していることから(表 3、表 4)、 日本人小児における臨床試験の用量設定が海外小児のデータから推定可能と考えた。外国人での母 集団薬物動態解析の結果と海外での承認用量から、日本人小児における推奨用量は、0.5~1 歳又は 体重10.5 kg 以下では 15 mg、2~6 歳及び体重 10.5 kg を超える小児では 30 mg と考えられたことか ら、これらの用量を用いて国内臨床試験を実施した。
3.2.3 日本人小児患者(0.5~11 歳)における母集団薬物動態の検討(POH0273 試験、評
価資料)
[添付資料5.3.3.5-2] SFY10717、SFY10718 2 試験から得られた、210 名血漿中濃度値 381 点に、過去に実施された POH0199 試験(POP6485 試験に J002 を併合した試験データ)305 名の血漿中濃度値 699 点を併合して、母集 団薬物動態解析を行った。フェキソフェナジンの消失プロファイルは2-コンパートメントモデルに あてはまった。共変量として、被験者背景因子(体重、身長、年齢、性)および臨床検査値(クレ アチニンクリアランス、総ビリルビン、アスパラギン酸アミノトランスフェラーゼ、アラニンアミ ノトランスフェラーゼ、アルカリフォスファターゼ、乳酸脱水素酵素、総タンパク)、ならびに試 験の因子として試験および用量をモデルに組み入れて検討した結果、CL/F の変動要因として BSA (体表面積)及び年齢(月齢)の影響がみられ、最終モデルに組み入れた。 得られた最終母集団モデルを用い、ベイズ推定法により求めた個別の薬物動態パラメータの平均値 の要約を表 8に示す。フェキソフェナジン塩酸塩として0.5~1 歳の小児に 15 mg 及び 2~6 歳の小 児(10.5 kg を超える)に 30 mg のアレグラドライシロップ 5%を投与したときの AUC 及び Cmaxは それぞれ1090 ng・h/mL 及び 130 ng/mL、並びに 1060 ng・h/mL 及び 157 ng/mL であり、いずれも成人 に60 mg を投与したときの AUC 及び Cmax(1110 ng・h/mL 及び 175 ng/mL)と同程度であった。こ のことから、0.5~1 歳及び 2~6 歳の小児アレルギー性鼻炎及びアトピー性皮膚炎患者にアレグラド ライシロップ5%をそれぞれフェキソフェナジン塩酸塩として 15 mg 及び 30 mg 投与したときの曝 露量は、成人に60 mg を投与したときと類似していると考えられた。 表 8 - 日本人の母集団薬物動態解析より得られた薬物動態パラメータ、平均値(CV%)(POH0273) 用量 (mg) 年齢 例数 AUC (ng・h/mL) Cmax* (ng/mL) CL/F* (L/h) 0.5~1 歳 55 1090 (46.2) 130 (40.9) 15.6 (29.9) 15 2~6 歳 1 703 100 21.3 2~6 歳 80 1060 (24.3) 157 (29.3) 29.9 (24.0) 30 7~11 歳 173 710 (19.8) 114 (22.4) 43.9 (19.8) 12~15 歳 97 1150 (23.0) 189 (19.4) 54.5 (21.0) 60 成人 109 1110 (28.2) 175 (18.1) 57.8 (24.9) *:原著の appendix より抽出3.3
小児患者における薬物動態
3.3.1 乳幼児患者(0.5~6 歳)における薬物動態
母集団薬物動態解析より求められた 0.5~1 歳の日本人及び外国人小児患者の CL/F の推定値は、そ れぞれ15.6 及び 20.9 L/h であり、大きな差は見られなかった(表 8、表 7)。またCmaxの推定値は それぞれ130 及び 147 ng/mL(換算値)と類似しており、日本人と外国人で差はなかった。2~6 歳 においても同様に、CL/F の推定値はそれぞれ 29.9 及び 34.3 L/h、Cmaxの推定値はそれぞれ157 及び 154(換算値)ng/mL と大きな差は見られなかった。これらのことから、今回適応追加の年齢層であ る0.5~1 又は 2~6 歳の日本人小児にアレグラドライシロップ 5%をそれぞれフェキソフェナジン塩 酸塩として15 又は 30 mg 投与したときの薬物動態プロファイルは、同年齢層の外国人小児にフェキ ソフェナジン塩酸塩を15 又は 30 mg を投与したときと類似していると考えられた。 なお、SFY10718 試験において、2~6 歳で体重が 10.5 kg 以下の被験者が 1 名含まれ、アレグラドラ イシロップ5%をフェキソフェナジン塩酸塩として 15 mg 投与した。1 名の結果しかないため明確に 判断はできないが、この被験者の血漿中濃度は2~6 歳に 30 mg を投与した群の中央からやや低位に 位置しており(図 1)、AUC 及び Cmaxの推定値は703 ng・h/mL 及び 100 ng/mL と、30 mg 投与群の 平均値(それぞれ1060 ng・h/mL 及び 157 ng/mL)よりやや低い値であった(表 8)。仮にこの症例 に30 mg を投与したときの AUC 及び Cmaxは約2 倍になると推定されるが、これらの値(それぞれ 1406 ng・h/mL 及び 200 ng/mL)は 2~6 歳に 30 mg を投与したときのばらつきの範囲内に入ると類推 された。また、日本人における2~6 歳の体重の分布(表 3、表 4)より10.5 kg 以下の割合は 1%程 度と推定され、頻度が非常に低かった。これらのことから、2~6 歳で「体重が 10.5 kg 以下の患者 には15 mg 投与」の除外基準は、頻度が非常に低いこと、及び 1 名であるが 30 mg を投与してもば らつきの範囲内であると類推できることから、「10.5 kg 以下の場合」の除外基準を削除して差し支 えないと判断した。但し、未熟児等で体重が極端に小さい場合は適宜増減を考慮する必要があると 考えられる。3.3.2 小児患者(7~11 歳)における薬物動態
7 歳以上の小児に対する適応拡大承認申請(2006 年)において、アレルギー性鼻炎患者及びアトピ ー性皮膚炎患者を対象としたケトチフェンフマル酸塩対照、無作為化二重盲検並行群間比較試験 (O3101 試験及び O3102 試験)の結果から、7~11 歳の小児における推奨用量は 30 mg 1 日 2 回とさ れた。 また、BEQ10716 試験において、アレグラドライシロップ 5%をフェキソフェナジン塩酸塩として 30 mg 投与したとき、市販のアレグラ錠 30 mg と生物学的に同等であることが示された。したがっ て、日本人の7~11 歳の小児におけるアレグラドライシロップ 5%の推奨用量も、フェキソフェナジ ン塩酸塩として30 mg とすることが適当である。4
特別な試験
参
考 文 献
1. 厚生労働省. 表 1 一般調査および病院調査による体重の 3、10、25、50、75、90 および 97 パー
センタイル値 年・月・日齢別、性別. In: 平成 12 年 乳幼児身体発育調査報告書. 2001. [添付資料
5.4-9]
2. Kuczmarski RJ, Ogden CL, Guo SS, Grummer-Strawn LM, Flegal KM, Mei Z, et al. 2000 CDC Growth Charts for the United States: methods and development. Vital Health Stat 11. 2002;246:1-190. [添付資料 5.4-10]
5
付録
サノフィ株式会社
アレグラドライシロップ
5%
2.7.3 臨床的有効性
目
次
2.7.3 臨床的有効性...1 目 次 ...2 表 目 次 ...4 図 目 次 ...4 略号と用語の定義...5 1 背景及び概観...6 1.1 緒言...6 1.2 試験の方法...6 1.2.1 試験の目的...6 1.2.2 試験のデザイン...7 1.2.3 有効性評価及びパラメータ...7 1.2.4 データ解析の考察...7 2 個々の試験結果の要約...8 2.1 日本人0.5~11 歳小児通年性アレルギー性鼻炎における無対照試験(SFY10717 試験)...8 2.2 日本人0.5~11 歳小児アトピー性皮膚炎における無対照試験(SFY10718 試験)...9 3 全試験を通しての結果の比較と解析...12 3.1 試験対象集団...12 3.1.1 患者の内訳...12 3.1.2 試験対象集団の人口統計学的特性及びその他の特性...123.2 全有効性試験の結果の比較検討...13 3.2.1 アレルギー性鼻炎...13 3.2.2 蕁麻疹...15 3.2.3 皮膚疾患(湿疹・皮膚炎、皮膚そう痒症、アトピー性皮膚炎)に伴うそう痒...17 3.3 部分集団における結果の比較...19 4 推奨用法・用量に関する臨床情報の解析...20 5 効果の持続、耐薬性...21 参 考 文 献...22 6 付録...23
表
目 次
表 1 - 日本人 0.5~11 歳小児を対象とした臨床試験一覧表 ...8 表 2 - 3 鼻症状合計スコア変化量(SFY10717 試験、mITT 集団) ...9 表 3 - 主要かゆみスコア変化量(SFY10718 試験、mITT 集団)...10 表 4 - 7PM Reflective TSS の用量別スコア変化量(PJPR0023、0024 試験、ITT 集団) ...14 表 5 - 3 症状合計スコア変化量(O3101 試験、PPS) ...15 表 6 - 各投与群の 4 週間の平均かゆみスコア(MPS)の変化量(PJPR0039 試験及び PJPR0067 試験、 ITT 集団) ...16 表 7 - 投与前後の平均かゆみスコア(J3105 試験、FAS) ...17 表 8 - 平均かゆみスコア変化量(O3102 試験、PPS) ...18図
目 次
該当なし。略号と用語の定義
BID: bis in die(1 日 2 回)
FAS: full analysis set(最大の解析対象集団)
ICH: International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use(日米 EU 医薬品規制調和国際会議)
ITT: intent-to-treat
mITT: modified intent-to-treat
MPS: mean pruritis score(平均かゆみスコア)
PPK: population pharmacokinetics(母集団薬物動態)
PPS: per protocol set(治験計画適合集団)
SD: standard deviation(標準偏差)
SE: standard error(標準誤差)
1
背景及び概観
1.1
緒言
フェキソフェナジン塩酸塩は、7~11 歳の小児に対して、国内で実施された小児通年性アレルギー 性鼻炎及びアトピー性皮膚炎を対象とした第3 相比較試験(O3101 試験及び O3102 試験)の結果に 基づき、「アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症、アトピー性皮膚 炎)に伴うそう痒」を効能・効果とし、「フェキソフェナジン塩酸塩として1 回 30 mg 1 日 2 回投 与」を用法・用量として既に承認されている。 本薬において既承認の成人及び7 歳以上の小児と本申請の対象となる 0.5~6 歳の乳幼児では、対 象疾患の経過が類似しており、治療結果の比較が可能であると推定できるため、ICH E11 に基づいた 「小児集団における医薬品の臨床試験に関するガイダンス(平成12 年 12 月 15 日医薬審 第 1334 号 別添)」に従って、成人及び7 歳以上の小児から 6 歳以下の乳幼児への有効性の外挿が可能であると 考えた([Module 2.5.1.2.5])。アレルギー疾患の臨床評価は主に患者日誌を用いた自覚症状に対する 評価を用いているため、今回の適応拡大の対象となる乳幼児での有効性評価は困難である。そのため、 患者自身ではなく保護者による日誌を用い、アレルギー性鼻炎及び小児における代表的な皮膚疾患で あるアトピー性皮膚炎に対する有効性を参考データとして評価することとした(SFY10717 試験及び SFY10718 試験)。また、成人及び 7~11 歳のデータの 0.5~6 歳への外挿可能性を確認するために、 ドライシロップ製剤でも7~11 歳の小児に過去の試験と同様な効果が得られ、さらに 6 歳以下の小児 でも同様の効果があるかを補足的に確認することとした。1.2
試験の方法
有効性を主要目的とした試験は実施していない。本項では、副次目的として0.5~11 歳の小児に対 する有効性データを収集したSFY10717 試験及び SFY10718 試験の方法について述べる。1.2.1 試験の目的
0.5~11 歳の小児通年性アレルギー性鼻炎(SFY10717 試験)及び小児アトピー性皮膚炎 (SFY10718 試験)患者でのフェキソフェナジン塩酸塩(ドライシロップ)1 回 15 mg 又は 30 mg 1 日 2 回投与の 4 週間の有効性を副次目的として検討するために実施した。1.2.2 試験のデザイン
SFY10717 試験及び SFY10718 試験は、日本で実施した 4 週間投与及び 8 週間延長投与による第 III
相、多施設共同、非盲検、無対照試験である。最長9 日間のスクリーニング期(SFY10717 試験)又
は1 週間のスクリーニング期(SFY10718 試験)、4 週間の主要投与期、8 週間の延長投与期、及び投
与後観察期(治験薬最終服薬後3~5 日)の 4 期で構成された。
1.2.3 有効性評価及びパラメータ
4 週間の有効性を評価するため、SFY10717 試験では「全観察期間(Day 2 から Day 28±3)を通し
ての患者日誌による3 鼻症状合計スコア及び各鼻症状スコアのベースライン(Day -1)からの変化量
(2 ~11 歳の患者)」、SFY10718 試験では「全観察期間(Day 2 から Day 28±3)を通しての患者日
誌(顔面及び頭部及びおむつ部位を除く被験部位)による主要かゆみスコアのベースラインからの変 化量(ベースライン=本登録日直前3 日間の平均主要かゆみスコア)」を評価項目とした。患者日 誌は、保護者が被験者から症状についての話をよく聞くとともに被験者の状態を把握し記入すること とした。
1.2.4 データ解析の考察
有効性を評価するデザインの試験ではないため、検定は実施せず、全観察期間を通してのスコア 及びスコアのベースラインからの変化量を記述的に要約した。2
個々の試験結果の要約
表 1 - 日本人 0.5~11 歳小児を対象とした臨床試験一覧表 試験番号 添付資料番号 目的 デザイン及び 対照の種類 被験薬 投与方法 被験者数 対象 投与期間 SFY10717 5.3.5.2-1 5.3.3.5-2* 安全性 有効性 PPK 多施設共同、 非盲検、無対 照試験 0.5-1 歳: 15 mg ドラ イシロップ BID 2-11 歳: 30 mg ドラ イシロップBID 計:109 15 mg: 7 30 mg: 102 0.5-11 歳 アレルギー 性鼻炎 4 週間 (12 週 間) SFY10718 5.3.5.2-2 5.3.3.5-2* 安全性 有効性 PPK 多施設共同、 非盲検、無対 照試験 0.5-1 歳: 15 mg ドラ イシロップBID 2-11 歳: 30 mg ドラ イシロップBID 計:103 15 mg: 50 30 mg: 53 0.5-11 歳 アトピー性 皮膚炎 4 週間( 12 週間 ) PPK=母集団薬物動態、BID=1 日 2 回、投与経路=経口、試験の進行状況=完了、報告書の種類=完全な報告書 *SFY10717/SFY10718/POP6489/J002 試験の母集団薬物動態解析報告書2.1
日本人
0.5~11 歳小児通年性アレルギー性鼻炎における無対照試験(SFY10717 試験)
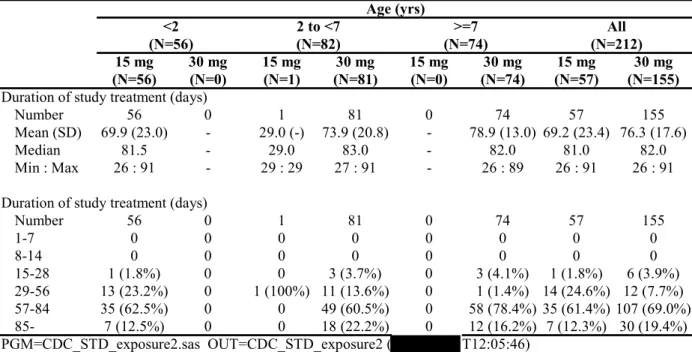
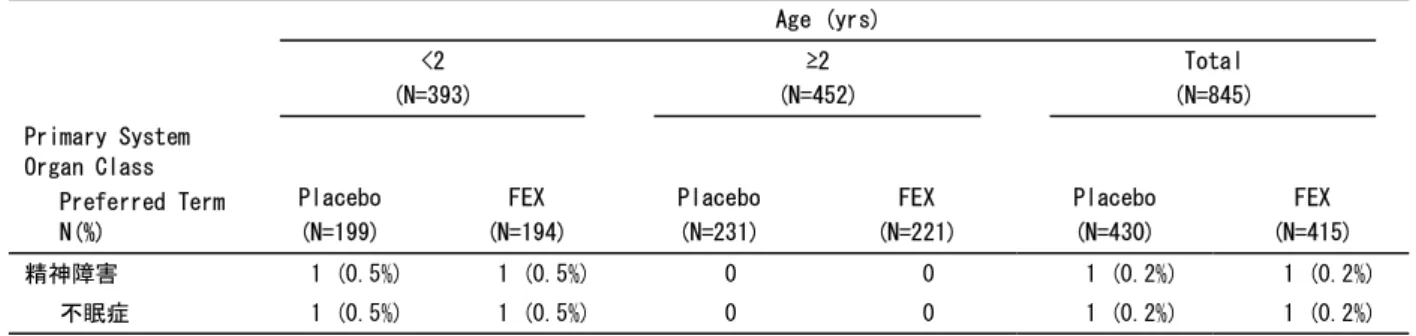
[添付資料5.3.5.2-1] 日本人小児(0.5~11 歳)の通年性アレルギー性鼻炎患者(目標被験者数約 100 名)を対象に、本 剤の安全性を検討するため、多施設共同、非盲検、無対照試験を実施した。用法・用量は、本剤をフ ェキソフェナジン塩酸塩として15 mg(0.5~1 歳又は 2 歳以上で体重 10.5 kg 以下)、30 mg(2~11 歳かつ体重10.5 kg を超える)1 日 2 回(朝・夕)経口投与、投与期間は 4 週間(安全性評価のため +8 週間)とした。 本登録109 名の全例 109 名(0.5~1 歳 7 名、2~6 歳 51 名及び 7~11 歳 51 名)が安全性解析対象集 団及び有効性のmITT 集団であった。 有効性評価項目である2~11 歳の患者の鼻アレルギー日記から得られる 3 鼻症状(くしゃみ、鼻汁、 鼻閉)合計スコア変化量(投与前値[本登録の前日]から全評価期間[本登録日より2 日目から 28 日目±3 日]の 1 日あたりの平均スコアの変化量 ± SD)は、mITT 集団において-1.78 ± 1.88 であった。表 2 - 3 鼻症状合計スコア変化量(SFY10717 試験、mITT 集団) Age (years)
<2 2 to <7 >=7 All
Total score of 3 symptoms (N=7) (N=51) (N=51) (N=109) Baseline Number - 51 51 102 Mean (SD) - 5.7 (1.3) 6.2 (1.4) 5.9 (1.3) Median - 6.0 6.0 6.0 Min : Max - 3 : 8 4 : 9 3 : 9 Treatment period Number - 51 51 102 Mean (SD) - 4.07 (1.86) 4.26 (1.61) 4.16 (1.73) Median - 4.00 4.39 4.04 Min : Max - 1.0 : 8.5 0.6 : 7.5 0.6 : 8.5
Change from baseline
Number - 51 51 102 Mean (SD) - -1.63 (1.99) -1.92 (1.77) -1.78 (1.88) Median - -1.87 -2.16 -1.94 Min : Max - -6.3 : 3.5 -5.5 : 2.0 -6.3 : 3.5 95% CI for mean - (-2.19 to -1.07)(-2.42 to -1.42)(-2.15 to -1.41) 本剤投与4 週間の有害事象は、63.3%(69/109 名)に認められたが、死亡、重篤な有害事象及び有 害事象による中止例は認められなかった。副作用は、傾眠0.9%(1/109 名)のみであった。投与 12 週間でも同様であった。有害事象と判断された臨床検査値は、投与12 週間で白血球数減少 0.9% (1/109 名)に認められたが、治験薬との因果関係は否定された。 0.5~11 歳の小児通年性アレルギー性鼻炎患者に対して、フェキソフェナジン塩酸塩(ドライシロ ップ)1 回 15 mg 又は 30 mg を 1 日 2 回投与したときの安全性及び忍容性は良好であり、小児通年性 アレルギー性鼻炎の症状の改善が確認された。
2.2
日本人
0.5~11 歳小児アトピー性皮膚炎における無対照試験(SFY10718 試験)
[添付資料5.3.5.2-2] 日本人小児(0.5~11 歳)のアトピー性皮膚炎患者(目標被験者数約 100 名)を対象に、本剤の安 全性を検討するため、多施設共同、非盲検、無対照試験を実施した。用法・用量は、本剤をフェキソ フェナジン塩酸塩として15 mg(0.5~1 歳又は 2 歳以上で体重 10.5 kg 以下)、30 mg(2~11 歳かつ 体重10.5 kg を超える)1 日 2 回(朝・夕)経口投与、投与期間は 4 週間(安全性評価のため+8 週間)とした。スクリーニング期(1 週間)及び主要投与期の観察期間中(4 週間)は、0.1%ヒドロコ ルチゾン酪酸エステル軟膏を塗布した(スクリーニング期及び投与2 週間は用法を変更しない)。 本登録103 名の全例 103 名(0.5~1 歳 49 名、2~6 歳 31 名及び 7~11 歳 23 名)が安全性解析対象 集団及び有効性のmITT 集団であった。 有効性評価項目であるかゆみ日誌から得られる主要かゆみスコア変化量(投与前値[本登録日直 前3 日間の平均]から全評価期間[本登録日より 2 日目から 28 日目±3 日]の 1 日あたりの平均値 スコアの変化量 ± SD)は、mITT 集団において-0.46 ± 0.53 であった。 表 3 - 主要かゆみスコア変化量(SFY10718 試験、mITT 集団) Age (years) <2 2 to <7 >=7 All
Main itching scores (N=49) (N=31) (N=23) (N=103)
Baseline Number 49 31 23 103 Mean (SD) 1.96 (0.52) 2.09 (0.71) 2.26 (0.54) 2.06 (0.59) Median 2.00 2.00 2.00 2.00 Min : Max 0.7 : 3.0 0.7 : 3.7 1.3 : 3.7 0.7 : 3.7 Treatment period Number 49 31 23 103 Mean (SD) 1.50 (0.67) 1.58 (0.74) 1.87 (0.56) 1.60 (0.68) Median 1.48 1.64 2.00 1.66 Min : Max 0.1 : 2.9 0.0 : 3.3 0.3 : 2.8 0.0 : 3.3 Change from baseline
Number 49 31 23 103 Mean (SD) -0.46 (0.55) -0.51 (0.54) -0.39 (0.47) -0.46 (0.53) Median -0.41 -0.55 -0.34 -0.40 Min : Max -1.7 : 0.9 -1.6 : 0.4 -1.2 : 0.4 -1.7 : 0.9 95% CI for mean (-0.62 to -0.30)(-0.71 to -0.31)(-0.59 to -0.19)(-0.56 to -0.36) 本剤投与4 週間の有害事象は、56.3%(58/103 名)に認められたが、死亡例及び有害事象による中 止例は認められなかった。また、重篤な有害事象は、1 名(肺炎)に認められ、因果関係は否定され た。副作用は、白血球数減少1.0%(1/103 名)のみであった。有害事象と判断された臨床検査値は副 作用の白血球数減少のみであった。投与12 週間でも同様であった。 以上より、フェキソフェナジン塩酸塩ドライシロップは投与4 週間では十分な安全性を示し、投与 12 週間でも長期安全性を示した。本試験では本剤の使用経験が少ない 0.5~1 歳及び 2~6 歳の小児ア トピー性皮膚炎患者を対象に、それぞれ15 mg、及び 30 mg のフェキソフェナジンを投与したが、7
~11 歳の小児アトピー性皮膚炎患者を対象に 30 mg のフェキソフェナジンを投与した場合と比較し て安全性における新たな問題点は認められなかった。また、小児アトピー性皮膚炎患者を対象とした
フェキソフェナジン塩酸塩(ドライシロップ)1 回 15 mg 又は 30 mg を 1 日 2 回投与したときの 4 週
3
全試験を通しての結果の比較と解析
抗ヒスタミン作用を主とする薬剤については、薬理学的に「アレルギー性鼻炎、蕁麻疹、皮膚疾 患(湿疹・皮膚炎、皮膚そう痒症、アトピー性皮膚炎)に伴うそう痒」への有効性が認められると考 えられること、本薬は成人及び7 歳以上の小児の本適応症に対してすでに承認されており、乳幼児の 本適応症との病態的な差がないと考えられること、乳幼児では鼻症状及びそう痒などの自覚症状を適 切に評価することができず、検証的な臨床試験を実施することは困難であると考えられることなどか ら、本薬を検証的な試験を実施せずに7 歳以上の小児及び成人で確認されている有効性を外挿して 0.5~6 歳の本適応症患者に使用しても差し支えないものと考える。 以下に、副次目的で収集した参考データとなるが、アレルギー性鼻炎及び小児における代表的な 皮膚疾患であるアトピー性皮膚炎を対象としたSFY10717 試験及び SFY10718 試験の有効性に関する 成績を示す。3.1
試験対象集団
3.1.1 患者の内訳
SFY10717 試験では、本登録 109 名の全例 109 名(0.5~1 歳 7 名、2~6 歳 51 名及び 7~11 歳 51 名)が安全性解析対象集団及び有効性のmITT 集団であった。 SFY10718 試験では、本登録 103 名の全例 103 名(0.5~1 歳 49 名、2~6 歳 31 名及び 7~11 歳 23 名)が安全性解析対象集団及び有効性のmITT 集団であった。3.1.2 試験対象集団の人口統計学的特性及びその他の特性
SFY10717 試験では、本剤をフェキソフェナジン塩酸塩として 15 mg(0.5~1 歳又は 2 歳以上で体 重10.5 kg 以下)投与されたのは 7 名、30 mg(2~11 歳で体重 10.5 kg を超える)は 102 名であった。 SFY10718 試験では、本剤をフェキソフェナジン塩酸塩として 15 mg(0.5~1 歳又は 2 歳以上で体 重10.5 kg 以下)投与されたのは 50 名、30 mg(2~11 歳で体重 10.5 kg を超える)は 53 名であった。3.2
全有効性試験の結果の比較検討
アレグラ錠60 mg の審査において、国内の用量検索試験の結果、及び用量検索試験結果を踏まえ て外挿可能と判断された海外の臨床試験結果から、成人のアレルギー性鼻炎及び蕁麻疹に対する本薬 の有効性・安全性が確認されたと判断された。また、7~15 歳の小児適応拡大の審査において、国内 外の臨床試験の結果から、本薬においてもケトチフェンフマル酸塩に劣らない程度の有効性は認めら れていると判断された。同じ投与期間では国内外で有害事象発現率に大きな差はなかった。 本薬において既承認の成人及び7 歳以上の小児と本申請の対象となる 6 歳以下の乳幼児では、対象 疾患の経過が類似しており、治療結果の比較が可能であると推定できるため、ICH E11 ガイドライン 「小児集団における医薬品の臨床試験に関するガイダンスについて」を参照し、7 歳以上の小児から 6 歳以下の乳幼児への有効性の外挿が可能であると考えた。3.2.1 アレルギー性鼻炎
米国において成人季節性アレルギー性鼻炎に対する推奨用量を検討するため、プラセボ対照二重 盲検用量比較試験が秋季(主抗原:ブタクサ)に2 試験行われた(初回申請(鼻炎・蕁麻疹)概要 PJPR0023 及び PJPR0024、計 1,160 名)。本薬 1 回 40、60、120、240 mg 及びプラセボを 1 日 2 回、2 週間投与し、有効性の主要評価項目は患者日誌による合計症状スコア(くしゃみ、鼻汁、鼻・口蓋・ 喉のかゆみ、眼のかゆみ・流涙・眼の充血)の投与前後の変化量とした。本薬は全ての用量でプラセ ボに比し症状スコアの有意な減少を示した。60 mg 以上の用量では初回投与後から症状スコアの有意 な減少を示したが、40 mg の効果発現は遅かった。60 mg の症状スコアの変化量は 120 mg 及び 240 mg と差がなかった。以上により海外での臨床推奨用量は 1 回 60 mg 1 日 2 回とされた。 米国及びカナダにおいて成人春季季節性アレルギー性鼻炎(主抗原:草、木)を対象とし、本薬 (1 回 60 mg 1 日 2 回)とロラタジン(1 回 10 mg 1 日 1 回)の 2 週間投与の二重盲検比較試験を 2 試 験実施した(初回申請(鼻炎・蕁麻疹)概要PJPR0054 及び PJPR0056、計 901 名)。合計症状スコ アの減少は両群間に差はなく、前記試験と同程度の変化量であった。 カナダにおいて成人通年性アレルギー性鼻炎(主抗原:ハウスダスト、カビ他)673 名を対象とし て、本薬1 回 60 mg 1 日 2 回及び 1 回 120 mg 1 日 1 回 4 週間投与を二重盲検法によりプラセボ投与と 比較した(初回申請(鼻炎・蕁麻疹)概要PJPR0057)。プラセボと比較して、60 mg 1 日 2 回投与で は症状スコアが有意に減少したが、120 mg 1 日 1 回投与では有意差がみられなかった。 以上の成績から、本薬1 回 60 mg 1 日 2 回投与は、各種抗原による成人アレルギー性鼻炎に対し有 用であると考えられた([初回申請(鼻炎・蕁麻疹)概要312 頁])。表 4 - 7PM Reflective TSS の用量別スコア変化量(PJPR0023、0024 試験、ITT 集団) ANCOVA p 値 試験 投与群 症例数 観察期間 投与期間 (2週間) 変化量 用量線形性 対プラセボ プラセボ 141 8.88±0.14 7.35±0.19 -1.56±0.20 - PJPR0023 60mg 141 8.81±0.14 6.25±0.21 -2.64±0.20 0.0001 n=570 120mg 144 8.96±0.15 6.54±0.22 -2.41±0.20 0.0026 240mg 144 8.82±0.15 6.31±0.22 -2.58±0.20 0.0036 0.0003 プラセボ 137 8.66±0.13 7.54±0.19 -1.21±0.18 - PJPR0024 40mg 135 8.69±0.16 6.93±0.21 -1.86±0.18 0.0087 n=545 60mg 138 8.72±0.14 6.93±0.19 -1.86±0.18 0.0075 120mg 135 8.61±0.15 6.59±0.21 -2.11±0.18 0.0005 0.0002 平均±SE 初回申請(鼻炎・蕁麻疹)概要438 頁 表ト-126 7PM Reflective TSS の用量別スコア変化量 (ITT) (PJPR0023、 0024) 日本人小児(7~15 歳)の通年性アレルギー性鼻炎患者(目標被験者数各群 70 名、計 140 名)を 対象に、本薬の有効性と安全性を検討するため、ケトチフェンフマル酸塩を対照とした無作為化二重 盲検並行群間比較試験が実施された([小児適応拡大CTD Module 2.7.6.2.6]、O3101 試験)。用法・用 量は、本薬30 mg(7~11 歳)、60 mg(12~15 歳)若しくはケトチフェンフマル酸塩ドライシロッ プ1g(7~15 歳)を 1 日 2 回(朝食後・就寝前)経口投与、投与期間は 4 週間と設定された。 主要評価項目である鼻アレルギー日記から得られる3 症状(くしゃみ、鼻汁、鼻閉)合計スコア変 化量(投与前値〔割付け日前日〕から投与期間の1 日あたりの平均値スコアの変化量)は、PPS にお いて本薬群-2.06±0.19、ケトチフェン群-1.83±0.20 で、両群間の差の点推定値は-0.227、95%片側信 頼区間の上限値は0.172 であり 、事前に設定した非劣性限界値 0.9 を下回ったことから、本薬群のケ トチフェン群に対する非劣性が検証された。
表 5 - 3 症状合計スコア変化量(O3101 試験、PPS) 投与群 MDL 16,455A 群 ケトチフェン群 解析結果a) 症例数 64 63 登録/割付け日前日 の3 症状合計スコア 6.09±0.20 6.10±0.19 治験薬投与期間の3 症状合計スコア 4.04±0.19 4.27±0.22 変化量 -2.06±0.19 -1.83±0.20 差の点推定値: -0.227 95%片側信頼限界上限: 0.172 (非劣性限界=0.9) 交互作用 投与前値×投与群:0.5242 年齢層×投与群:0.7023 (平均値±SE) a)割付け日前日の 3 症状合計スコア、年齢層(7~11 歳、12~15 歳)及び投与群を含む共分散分析モデル 小児適応拡大CTD 505 頁 表 2.7.6-44 3 症状合計スコア変化量(PPS:O3101 試験) 日本人小児(0.5~11 歳)の通年性アレルギー性鼻炎患者を対象とした SFY10717 試験は、有効性 を検証する試験ではなかったが、フェキソフェナジン塩酸塩はアレルギー性鼻炎症状を改善した (2.1項)。3 鼻症状合計スコア変化量は、-1.78 であり(表 2)、O3101 試験の-2.06 と大きな差はな かった。 0.5~6 歳の小児においても、抗ヒスタミン作用を主とする薬剤については、薬理学的にアレルギー 性鼻炎への有効性が認められること、本薬は成人及び7~15 歳の小児アレルギー性鼻炎に対して既に 承認されており、0.5~6 歳の小児アレルギー性鼻炎との病態的な差がないと考えられること ([Module 2.5.1.2.1])、7~15 歳の小児におけるアレルギー性鼻炎に対する有効性及び安全性は確認 されていること、低年齢の小児ではアレルギー性鼻炎の自覚症状スコアによる有効性評価が適切に実 施できず、検証的な臨床試験を実施することは困難であると考えられることなどから、検証的な臨床 試験を実施せずに7 歳以上の小児及び成人で確認されている有効性を外挿して本剤を 0.5~6 歳の小 児アレルギー性鼻炎患者に適応しても差し支えないものと考える。
3.2.2 蕁麻疹
米国及びカナダにおいて、慢性蕁麻疹に対する推奨用量を検討するため、本薬1 回 20、60、120、 240 mg 及びプラセボ 1 日 2 回、4 週間投与した二重盲検用量比較試験が 2 試験実施された(初回申請 (鼻炎・蕁麻疹)概要PJPR0039、PJPR0067、計 892 名)。有効性の評価指標は患者日誌による症状 スコア(かゆみ及び膨疹)の投与前後の変化量とした。本薬は全ての用量でプラセボに比し、主要評 価項目であるかゆみ症状スコアの有意な減少を示し、60 mg 以上の 3 用量の減少効果は 20 mg に比し 有意に大きく、3 用量間には差がなかった。本試験の結果、60 mg 以上の有効性及び安全性に差がなかったことから、臨床推奨用量は1 回 60 mg 1 日 2 回とされた([初回申請(鼻炎・蕁麻疹)概要312 頁])。 表 6 - 各投与群の 4 週間の平均かゆみスコア(MPS)の変化量(PJPR0039 試験及び PJPR0067 試験、 ITT 集団) 検定 p 値 試験番号 投与群 症例数 投与前 投与期間 (4 週間) 変化量 用量線形性 対プラセボ プラセボ 79 2.13±0.10 1.62±0.10 -0.40±0.08 - 20mg 90 1.80±0.09 1.13±0.09 -0.68±0.08 0.0098 60mg 90 1.86±0.10 0.90±0.08 -1.00±0.08 0.0001 0.0001 120mg 77 1.94±0.10 1.07±0.09 -0.84±0.08 0.0001 PJPR0039 n=418 240mg 82 1.91±0.08 0.83±0.08 -1.08±0.08 0.0001 プラセボ 90 1.92±0.09 1.43±0.08 -0.47±0.07 - 20mg 91 1.85±0.10 1.00±0.07 -0.88±0.07 0.0001 60mg 86 1.98±0.10 0.86±0.08 -1.07±0.07 0.0001 0.0001 120mg 89 2.04±0.09 0.88±0.07 -1.07±0.07 0.0001 PJPR0067 n=439 240mg 83 1.81±0.08 0.69±0.07 -1.18±0.07 0.0001 平均±SE 初回申請(鼻炎・蕁麻疹)概要423 頁 表ト-112 各投与群の 4 週間の平均かゆみスコア(MPS)の変化量(ITT) (PJPR0039、0067) 7~15 歳の小児適応拡大の審査において、抗ヒスタミン作用を主とする薬剤については、薬理学的 にも蕁麻疹への有効性は認められること、本薬は成人の蕁麻疹に対して既に承認されており、小児蕁 麻疹との病態的な差がないと考えられること、小児における皮膚疾患の代表であるアトピー性皮膚炎 に対する有効性及び安全性は確認されていること、小児では蕁麻疹患者が少なく、検証的な臨床試験 を実施することは困難であると考えられることなどから、本薬を小児蕁麻疹患者に適応しても差し支 えないものと判断された。 0.5~6 歳の小児においても、抗ヒスタミン作用を主とする薬剤については、薬理学的に蕁麻疹への 有効性が認められること、本薬は成人及び7~15 歳の小児蕁麻疹に対して既に承認されており、0.5 ~6 歳の小児蕁麻疹との病態的な差がないと考えられること([Module 2.5.1.2.2])、7~15 歳の小児に おける皮膚疾患の代表であるアトピー性皮膚炎に対する有効性及び安全性は確認されていること、小 児では蕁麻疹患者が少なく、検証的な臨床試験を実施することは困難であると考えられることなどか ら、本剤を0.5~6 歳の小児蕁麻疹患者に適応しても差し支えないものと考える。