1
腎細胞がんの細胞レベルにおける CRIM1 膜タンパク質の解析
岩手医科大学大学院薬学研究科 医療薬学専攻博士課程
小笠原 信敬
2
略語一覧
BPB;Bromophenol blue
BMP-4;Bone morphogenetic protein 4 BSA;Bovine serum albumin
cDNA;Complementary DNA
CRIM1;Cysteine-rich motor neuron 1 CT;Computed tomography
DTT;Dithiothreitol
EMT;Epithelial-mesenchymal transition FAK;Focal adhesion kinase
FBS;Fetal bovine serum IFN-α;Interferon-alpha IL-2;Interleukin-2
INT;2-(p-iodophenyl)-3-(p-nitrophenyl)-5-phenyl tetrazolium chloride irAE;Immune-related adverse event
MMP;Matrix metalloproteinase
mTOR;Mechanistic target of rapamycin MZF1;Myeloid zinc finger 1
PBS;Phosphate buffered saline
PD-1;Programmed cell death protein 1
RT-PCR;Reverse transcription polymerase chain reaction SDS;Sodium dodecyl sulfate
siRNA;Small interfering RNA
TNF-α;Tumor necrosis factor-alpha VEGF;Vascular endothelial growth factor ZEB-1;Zinc finger E-box-binding homeobox 1
3
目 次
【要 旨】・・・・・・・・・・・・・・・・・・・・・・・・P4
【序 論】・・・・・・・・・・・・・・・・・・・・・・・・P5
【材料と方法】・・・・・・・・・・・・・・・・・・・・・・P7 ヒト腎がん細胞の培養とTNF-α,G6001処理
siRNAの細胞への導入 細胞からのタンパク質調製 Western blotting
細胞増殖アッセイ ソフトアガーアッセイ 遊走能試験
浸潤能試験 定量的RT-PCR 統計解析
【結 果】・・・・・・・・・・・・・・・・・・・・・・・・P12
CRIM1の発現消失は,細胞増殖に影響しない
CRIM1の発現消失は,細胞の遊走能と浸潤能の増加を導く
CRIM1の発現消失は,E-cadherin,claudin-1,リン酸化型FAKの発現を変 化させる
E-cadherin mRNA発現およびE-cadherinの転写調節因子に対するCRIM1 発現消失の効果
CRIM1の発現消失は細胞外基質やE-cadherinの分解に関与し,転移浸潤と 関連性が深い金属依存性酵素MMPsのmRNA発現を誘導する
TNF-α刺激によってCRIM1の発現が減少する
【考 察】・・・・・・・・・・・・・・・・・・・・・・・・P23
【参考文献】・・・・・・・・・・・・・・・・・・・・・・・P27
【謝 辞】・・・・・・・・・・・・・・・・・・・・・・・・P34
4
【要 旨】
CRIM1は,細胞増殖に関連すると報告されている膜タンパク質である.腎が
ん細胞でも発現しているが,その増殖および悪性度への寄与は未だ不明である.
本研究では,CRIM1の発現消失が腎がん細胞の性質にどのような影響を与える かについて研究を行った.CRIM1の発現消失は細胞の増殖能および足場非依存 的増殖には影響を与えなかったが,創傷治癒試験および浸潤アッセイにより,
遊走能や浸潤能を上げることが明らかとなった.遊走および浸潤に関与する因 子の発現解析では,細胞接着因子であるE-cadherinの明らかな低下と,転移性 がん細胞での増加が認められるclaudin-1の増加が認められた.さらに,細胞の 遊走能を上げる FAK(接着斑キナーゼ)のリン酸化が亢進する傾向が認められ た.加えて,がん細胞の浸潤性にとって必須であると共に,E-cadherin を分解 することが知られているプロテアーゼの MMP2およびMMP9 の増加が認めら れた. E-cadherinの転写抑制因子であるSnail, Slug, そしてZEB-1の発現増 加が認められ,mRNAレベルでもE-cadherinは減少した.これらのことから,
E-cadherin は mRNA の発現抑制とタンパク分解の促進の両方の理由で減少し ていることが推察された.一方,腎がん細胞の腫瘍壊死因子(TNF-α)処理に よって上皮間葉転換(EMT)を引き起こすと,CRIM1 の発現が低下すること も示された.したがって,CRIM1の存在は様々なEMT関連因子の発現制御に 必要であり,CRIM1はEMTの調節を介して腎がん細胞の遊走および浸潤を抑 制している可能性がある.
5
【序 論】
CRIM1(cysteine-rich motor neuron 1)は,運動神経組織の発生に関与する 膜タンパク質として同定された1,2).膜1回貫通型のタンパク質で,名称のとお りシステインが豊富な領域が存在し,長い細胞外ドメイン(アミノ酸934個)と短 い細胞内ドメイン(アミノ酸76個)を持つ特徴的な構造を有している(図1).組 織での発現解析では,主に胎盤や腎臓で高発現が認められた1-4).また,CRIM1 遺伝子の欠損マウスにおける実験から,CRIM1は腎臓の正常発生に必要な因子 であることが明らかにされた 5,6) .三次元培養法を用いた解析からは,CRIM1 は血管内皮細胞の増殖に必要な因子であり,内皮細胞による管腔形成にも必要 なことが明らかとされた7,8) .さらに,細胞外ドメインでは,VEGF(vascular endothelial growth factor)やBMP-4(bone morphogenetic protein 4)などの 因子と結合することも報告され,血管新生時のVEGFの活性制御や臓器形成期 における BMP-4 の活性制御に関与することが示唆されてきた 9,10) .我々は近
年CRIM1が腎がん細胞でも高発現していることを明らかにしてきたが(未発表
データ),その役割は不明である.
図1 CRIM1の構造1)
腎細胞がんは,尿細管を発生母地とし,腎がん全体の90~95%を占める.本 邦では増加傾向にあり,好発年齢は50歳代後半で,男女比は2:1である.腎が ん全体で2013年の罹患数は24,865人,2016年の死亡数は9,350人であった11) . 一般的に進展は緩やかであるが,特徴的な自覚症状はない.近年では検診での CT,超音波の普及で偶然に発見される機会が増えているものの,30%は骨や脳,
肺に遠隔転移を起こしてから発見される.
上皮間葉転換(Epithelial-mesenchymal transition; EMT)は,がんが転移
6
を開始する際に起こり,具体的には上皮細胞がその細胞極性や周囲細胞との細 胞接着機能を失い,遊走,浸潤能を得ることで間葉系の細胞へと変化する現象
である 12,13) .EMT 発生時には,細胞接着分子である E-cadherin の減少や,
N-cadherinの増加が起こる.また,E-cadherinの転写抑制因子である,Snail, Slug,ZEB-1 の発現が増加する.加えて,間葉系細胞に特有の中間径フィラメ ントであるvimentinの増加,カドヘリンを細胞質に定着させるβ-cateninの減 少が起こる 12-15).さらにまた,細胞接着を介した接着点からのシグナル伝達に 関与する接着斑キナーゼ(focal adhesion kinase; FAK)の活性化と,タイトジ ャンクションの形成に関与している claudin-1 の誘導が起こる 16-19).そして,
金属依存性タンパク質分解酵素であり細胞外基質の分解に関わる MMP2 や MMP9 の発現も誘導される 20-22).このように,EMT に関与するタンパク質に ついて多くのことが報告され,これらタンパク質の発現変化は,EMT発生の指 標として利用されている.
本研究では,siRNA の導入により CRIM1 の発現を消失させた腎がん細胞を 用いて,遊走能や浸潤能およびEMTの発生指標タンパク質の発現解析を行うこ とによって,CRIM1の腎細胞がんの悪性化への関連性について検討を行った.
7
【材料と方法】
ヒト腎がん細胞の培養とTNF-α,GM6001処理
ヒ ト 腎 尿 細 管 由 来 が ん 細 胞 で あ る ACHN は ,American Type Culture Collection から入手した.細胞に添付されたプロトコールに従い,10%の濃度 でウシ胎仔血清(FBS)を添加したRPMI1640培地(Invitrogen)でCO2イン キュベータ中(37℃,5%CO2)にて培養を行った.組換えヒトTNF-αはWako から入手し,薬剤処理を 48 時間行った.MMP2 および MMP9 阻害剤である GM6001はMerck Milliporeから入手し,薬剤処理を48時間行った.
siRNAの細胞への導入
CRIM1発現のノックダウンに使用したsiRNA(small interfering RNA)お よび陰性対象のsiRNAはInvitrogen社から入手した.細胞への導入実験操作は 試薬に添付されたプロトコールに従い,Felgnerらの論文23)で示された方法を参 考に実施した.ACHN細胞を3.5 cmプレートに5×105 cells ずつ蒔きこみ,
Lipofectamine RNAiMax(Invitrogen)を用いて,CRIM1 siRNA(siCRIM1) または陰性対象siRNA(siNeg)を導入した.細胞の密度を揃えるために,siRNA 導入後48時間で細胞を集め,細胞数を揃えて蒔き直し,実験を行った.
細胞からのタンパク質調製
実験操作は,以前に発表された杉山らの論文 24)を参考に,一部試薬を変更し て行った.対数増殖期の培養ACHN細胞をPBS(-)(137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.76 mM KH2PO4)で洗浄後に 1.2×SDS-Sample Buffer DB(-)(60 mM Tris-HCl, 2.4% SDS, 12% グリセロール)を加え,セルスクレイパ ーで剥離した.回収した可溶化液を超音波粉砕後に加熱(95℃, 3分)し,さら に遠心(15,000 rpm, 4℃, 10分)し,上清をタンパク質定量後,DTTとBPB を所定の濃度(DTT:12 mM, BPB: 0.012%)になるように加え,Western blotting に用いた.
8
Western blotting
実験操作は,以前に発表された杉山らの論文 24)を参考に,一部を変更して行 った.タンパク質サンプルを,SDSを含んだ10%または14%ポリアクリルアミ ド ゲ ル を 用 い て 電 気 泳 動 を 行 っ た 後 , イ モ ビ ロ ン-P メ ン ブ レ ン (Merck Millipore)に転写した.メンブレンを3%BSA-PBS(-)で1時間ブロッキングを 行い,次いで1%BSA-PBST(0.05%Tween20含有 PBS(-))で希釈した一次抗 体と共に4℃,12時間反応させた.1%BSA-PBSTで2000倍に希釈した二次抗 体と室温で 1 時間反応させた後,発光試薬(Western Lightning Plus-ECL; PerkinElmer)と反応させ,LAS-4000mini(FUJI FILM)で発光画像を撮影 した.各バンドの強度は,Multi GAUGE version 3.0 software(FUJI FILM) により定量化した.
一次抗体はCRIM1(WH0051232M1, 6E4, Sigma)×1000希釈,E-cadherin
(#3195, CST J)×2000希釈,N-cadherin(#13116, CST J)×2000希釈,
vimentin(#5741, CST J)×2000希釈,β-catenin(#8480, CST J)×2000 希釈,claudin-1(#13255, CST J)×2000希釈,phosphorylated FAK; pFAK
(#07-012, Upstate)×2000希釈,FAK(#05-537, Upstate)×2000希釈,β -actin(A1978, Sigma)×1000希釈を使用した.
細胞増殖アッセイ
細胞増殖は,cell counting kit-8(Dojindo)を用いて評価した.基本的な実験 操作は試薬に添付されたプロトコールに従い実施した. siCRIM1またはsiNeg を導入後48時間経過したACHN細胞から細胞懸濁液を調製し,96穴プレート に5×103 cellsで1サンプルあたり3穴に蒔き込んだ.37℃,5%CO2で培養後 24 時間,48時間,72時間後に10 μLのcell counting kit-8 溶液を加えて2 時間染色し,マイクロプレートリーダー infinite F500(TECAN)を用いて,
450 nmにおける吸光度を測定した.
ソフトアガーアッセイ
実験操作は,杉山らの発表論文24)を参考に,一部を変更して行った.siCRIM1 または siNeg を導入後 48 時間経過した ACHN 細胞を,10%FBS-RPMI1640 培地を含む 0.33% noble agar(DIFCO)と懸濁させ,10%FBS を含む 0.5%
9
noble agarを入れた3.5 cmプレート4枚に2×103 cells/プレートの割合で乗せ 固 化 し , 21 日 間 培 養 し た . 形 成 さ れ た コ ロ ニ ー を 0.25%INT ; 2-(p-iodophenyl)-3-(p-nitrophenyl)-5-phenyl tetrazolium chloride(Sigma)で37℃,
24時間染色し,直径が0.07 mmを超えるコロニー数を計数した.
遊走能試験
遊走能を調べるため,Hanらの論文25)で示された方法を参考に創傷治癒試験を行 った.3.5cmプレートに飽和密度状態になったsiCRIM1またはsiNegを導入し たACHN細胞を,ブルーチップで直線的にスクラッチを行い剥がした(図2上). 固定した4視野において0時間と24時間後のスクラッチの幅を測定し,計算式
(図2下)に当てはめて数値化した.
図 2 創傷治癒試験における計算式
浸潤能試験
浸潤能を調べるために,マトリゲルを用いたtrans well invasion assayを行 った.基本的な実験操作は試薬に添付されたプロトコールに従い,Albini ら 26) および Wu らの論文 21)で示された方法も参考に実施した. siCRIM1 または siNegを導入したACHN細胞5×10 4 cellsを無血清RPMI1640培地に懸濁し,
マトリゲル(Corning)でコーティングされた細胞培養インサート(8 µm孔径 ; Thermo Fisher Scientific)に入れた(図3).これを,10%FBS-RPMI1640培 地を添加した 24 穴プレートに入れた.24 時間培養後,非浸潤細胞を綿棒で除
10
去し,浸潤した細胞を4%パラホルムアルデヒドで固定後,ギムザ染色液で染色 した.細胞培養インサート中の膜について無作為に 4 箇所選択し,顕微鏡下で 撮影後,浸潤した細胞を計数した.
図 3 浸潤能試験の概要
定量的RT-PCR
基本的な実験操作は試薬に添付されたプロトコールに従って実施した.
RNeasy Mini Kit(Qiagen)を用いてsiCRIM1またはsiNegを導入したACHN 細胞からRNAを単離した. THUNDERBIRD SYBR qPCR RT Set(TOYOBO Lifescience)を用いてcDNAを合成し,7900HT Fast Real-Time PCR System
(Thermo Fisher Scientific)でPCRを行った.各アッセイの特異性は,PCR 産物の解離曲線分析によって確認した.検証する遺伝子毎に 3 サンプルを用意 し,遺伝子発現レベルはβ-actinの発現レベルで補正した.
PCRには以下のプライマーを使用した.
E-cadherin(forward): 5’-CAGAAAGTTTTCCACCAAAG-3’
(reverse): 5’-AAATGTGAGCAATTCTGCTT-3’
Snail(forward): 5’-CCCCAATCGGAAGCCTAACT-3’
(reverse): 5’-GCTGGAAGGTAAACTCTGGATTAGA-3’
Slug(forward): 5’-TGTTGCAGTGAGGGCAAGAA-3’
(reverse): 5’-GACCCTGGTTGCTTCAAGGA-3’
11
ZEB-1(forward): 5’-GCCAATAAGCAAACGATTCTG-3’
(reverse): 5’-TTTGGCTGGATCACTTTCAAG-3’
MMP2(forward): 5’-TTGATGGCATCGCTCAGATC-3’
(reverse): 5’-TTGTCACGTGGCGTCACAGT-3’
MMP9(forward): 5’-GCAAGCTGGACTCGGTCTTT-3’
(reverse): 5’-TGGCGCCCAGAGAAGAAG-3’
β-actin(forward): 5’-TCATGAAGTGTGACGTGGACATC-3’
(reverse): 5’-CAGGAGGAGCAATGATCTTGATCT-3’
統計解析
定量的なデータは平均値±標準偏差の形で表示した.2 群間の比較には Mann-Whitney U検定を行い,危険率5%未満を有意水準とした.
12
【結 果】
CRIM1 の発現消失は,細胞増殖に影響しない.
CRIM1 の mRNA に対する siRNA をリポフェクション法により腎がん細胞 ACHN に導入し,48 時間後に蒔き換えたのち,経時的に CRIM1 の発現を Western blotting法により調べた.その結果,CRIM1タンパク質は消失し,こ の状態は蒔き換え後 72 時間まで持続した(図 4-A).通常培養条件下での細胞 増殖について,72時間まで経時的に解析したところ,siRNA導入によりCRIM1 タンパク質の発現が消失した細胞の増殖は,陰性対照のsiRNA(siNeg)を導入し た細胞と比べて,ほとんど同じであった(図 4-B).また,ソフトアガー上での 増殖についても解析した.CRIM1 発現消失細胞のソフトアガー上での増殖は,
陰性対照と比べてほとんど同じであり,変化がなかった(図 4-C).これらのこ とは,CRIM1は腎がん細胞の増殖制御への寄与が少ないことを示している.
図4 ACHN細胞の増殖におけるCRIM1の発現消失の影響
(A)siCRIM1を導入したACHN細胞のwestern blotting .CRIM1に対するsiRNA
(siCRIM1)および陰性対照のsiRNA(siNeg)をリポフェクション法により腎がん細 胞ACHNに導入し,48時間後,3.5 cmプレートに5×105 cellsで蒔きかえた.タンパ ク質調製によって得られたサンプル30μgを使用し,CRIM1に対する一次抗体を用い たwestern blotting を行った.内部標準としてβ-actinを検出し補正した.(B)細胞
13
増殖アッセイ.siCRIM1 および siNeg を導入後 48 時間経過した ACHN 細胞を,96 穴プレートに5×103 cellsで蒔きこんだ.Cell counting kit-8を用いて細胞を染色し,
450nmにおける吸光度を測定した.独立した実験を3回実施し,データは平均値±標
準偏差の形で表示した.(C)ソフトアガーアッセイによる足場非依存的増殖能の解析.
siCRIM1 および siNeg を導入後 48 時間経過した ACHN 細胞を,10%FBS を含む 0.33% noble agarと懸濁させ,3.5 cmプレートに2×103 cellsで蒔きこみ,21日間培 養した.形成されたコロニーを0.25% INTで染色し,直径が0.07 mmを超えるコロニ ー数を計数した.独立した実験を3回実施し,データは平均値±標準偏差の形で表示し た.
14
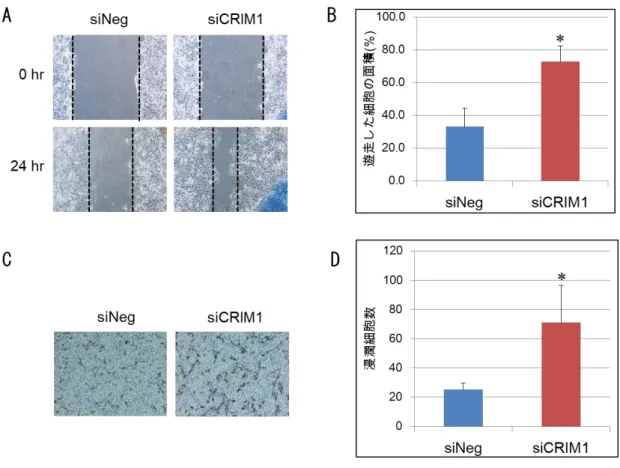
CRIM1 の発現消失は,細胞の遊走能と浸潤能の増加を導く.
細胞の遊走能について創傷治癒試験で調べたところ,CRIM1の発現が消失し たACHN腎がん細胞では陰性対照に比較して,遊走細胞によるスクラッチ部位 の面積占有率が約30%から約70%に変化し,単位時間における遊走の程度が亢 進していることが判明した(図 5-A,B).また,細胞の浸潤能について,マトリ ゲルを用いたtrans well invasion assayで解析したところ,CRIM1の発現が消 失したACHNでは,マトリゲル層を浸潤して膜の反対側に突き抜けてくる細胞 の数が 2 倍以上増えていることが判明した(図 5-C,D).これらの結果から,
CRIM1は細胞の遊走能や浸潤能を抑制している可能性が示唆された.
図5 細胞の遊走能,浸潤能へのCRIM1の関与
(A)CRIM1 の発現消失は,創傷治癒試験における細胞の遊走を促進した.3.5cm プ レートに飽和密度状態になった siCRIM1またはsiNegを導入したACHN細胞を,ス クラッチを行い剥がした.スクラッチを行った後に遊走してくる細胞の代表的な顕微鏡 写真を示した.(B) 24 時間後までに遊走で埋められた細胞の面積(%)を計算した.
独 立 し た 実 験 を 3 回 実 施 し , デ ー タ は 平 均 値 ± 標 準 偏 差 の 形 で 表 示 し た
(Mann-Whitney U検定.*,P< 0.05).(C) CRIM1の発現消失は,細胞の浸潤能
15
を促進した.siCRIM1またはsiNegを導入したACHN細胞5×104 cellsを,マトリゲ ルでコーティングされた孔径8μmの細胞培養インサートに入れた.細胞培養インサー トのマトリゲル被覆層を浸潤して通り抜けてくる細胞をギムザ染色液で染色した.浸潤 細胞の代表的な顕微鏡写真を示した.(D)無作為に選択した顕微鏡視野(倍率×100) において,24 時間以内にマトリゲル層を通り抜けてくる浸潤細胞数を計数した.独立 した実験を3回実施し,データは平均値±標準偏差の形で表示した(Mann-Whitney U 検定.*,P< 0.05).
16
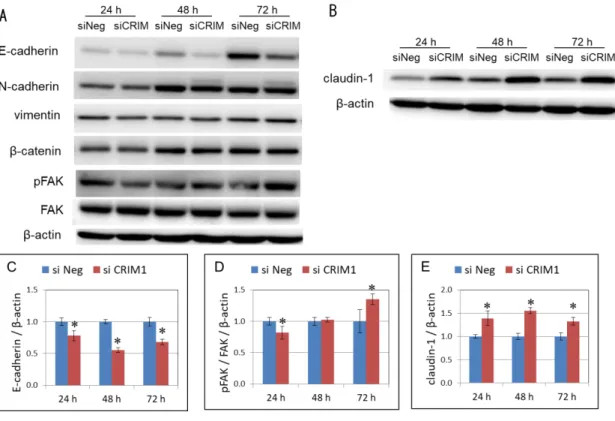
CRIM1 の発現消失は,E-cadherin,claudin-1,リン酸化型FAKの発現を変化 させる.
CRIM1 の発現を消失させた ACHN 細胞において,細胞運動や接着に関連す
る因子の発現変化を解析した.CRIM1 の発現が消失した ACHN では,陰性対 照 siRNA を 導 入 し た 陰 性 対 照 の 細 胞 に 比 較 し て , 細 胞 接 着 分 子 で あ る E-cadherinタンパク質の発現が低下していた(図6-A,C).さらに面白いことに,
TNF-α の 刺 激 に よ り 細 胞 遊 走 能 が 亢 進 す る と き に 発 現 上 昇 が 見 ら れ る claudin-1の発現がCRIM1の発現消失により亢進していることが判明した(図 6-B,E).一方,E-cadherin と細胞内で連携しているβ-catenin や,EMT が発 生し細胞の運動性が亢進した場合に高発現するN-cadherinとvimentinの発現 は変化していなかった.細胞の遊走能と関連性が深いリン酸化型FAK(pFAK) の発現を調べたところ,CRIM1 の発現が消失した ACHN では,陰性対照に比 較して,FAK に対する pFAK の量的な比率が増加する傾向が認められた(図 6-A,E).これらのことから,CRIM1がE-cadherinの発現を維持することで細 胞同士の接着を保持している可能性や,claudin-1 の発現や FAK のリン酸化を 抑制することで細胞の運動性を抑制している可能性が示唆された.
図6 細胞運動や接着に関連する因子に対するCRIM1の関与
siCRIM1を導入したACHN細胞のwestern blotting .siCRIM1またはsiNegを導
17
入したACHN細胞を,48時間後,3.5 cmプレートに5×105 cellsで蒔きかえた.タン パク質調製によって得られたサンプル30μgを,Aは10%,Bは14%のSDS-ポリア クリルアミドゲルに乗せ電気泳動を行った.CRIM1,E-cadherin,N-cadherin, vimentin,β-catenin,claudin-1,リン酸化型FAK(pFAK),FAKに対する一次抗体 を使用した.内部標準としてβ-actin を検出し補正した.各バンドの強度は,Multi GAUGE version 3.0 software(FUJI FILM)により定量化した.独立した実験を3回 実施した.
E-Cadherin,pFAK/FAK,そしてclaudin-1の定量データをC-Eに示した.データ は平均値±標準偏差の形で表示した(Mann-Whitney U検定.*,P< 0.05.各時間の siNegに対する比較).
18
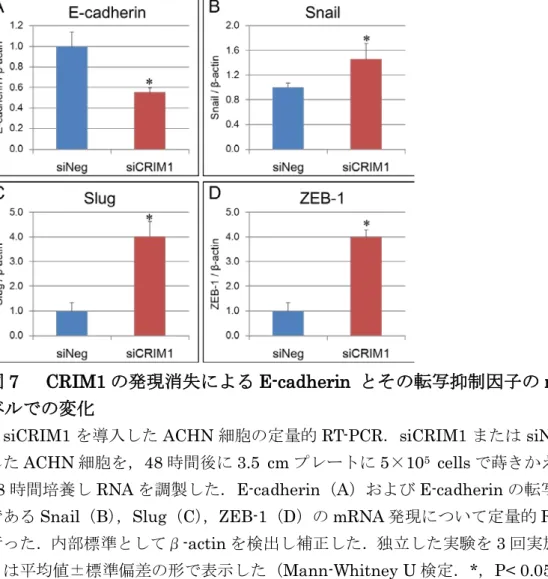
E-cadherin mRNA発現およびE-cadherinの転写調節因子に対するCRIM1発 現消失の効果
CRIM1の発現が消失したACHN細胞におけるE-cadherinタンパク質の減少 が,mRNA レベルでの発現変化によるものかについて調べるために,定量的 RT-PCRを行った.その結果,CRIM1の発現が消失した腎がん細胞では,陰性 対照のsiRNAを導入した細胞と比較して,E-cadherin mRNAの発現量が減少 していた(図7-A).さらに,E-cadherin遺伝子の発現抑制に関わる Snail,Slug, ZEB-1の発現を解析したところ,CRIM1の発現消失に伴いこれらすべての因子 の発現亢進が認められた(図7-B-D).
図7 CRIM1の発現消失によるE-cadherin とその転写抑制因子のmRNAレ ベルでの変化
siCRIM1を導入したACHN細胞の定量的RT-PCR.siCRIM1またはsiNegを導入 したACHN細胞を,48時間後に3.5 cmプレートに5×105 cellsで蒔きかえ,さらに 48時間培養しRNAを調製した.E-cadherin(A)およびE-cadherinの転写抑制因子 であるSnail(B),Slug(C),ZEB-1(D)のmRNA発現について定量的RT-PCRを 行った.内部標準としてβ-actinを検出し補正した.独立した実験を3回実施し,デー タは平均値±標準偏差の形で表示した(Mann-Whitney U検定.*,P< 0.05).
19
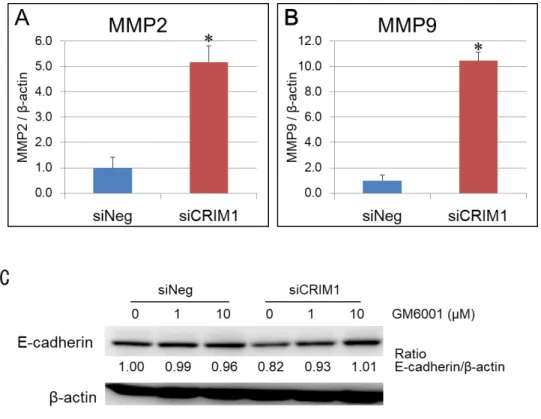
CRIM1 の発現消失は細胞外基質やE-cadherinの分解に関与し,転移浸潤と関 連性が深い金属依存性酵素MMPsのmRNA発現を誘導する
図5 に示したように,CRIM1の発現消失は,腎がん細胞ACHNの転移浸潤 能を亢進させた.そこで,転移浸潤に関与する代表的なタンパク質分解酵素で ある MMPs の発現について解析した.CRIM1 の発現が消失した腎がん細胞で は,MMP2 と MMP9 の mRNA の発現量が亢進していることが判明した(図 8-A,B).このことは,CRIM1はMMPの発現抑制を介して腎がん細胞の転移浸 潤能を抑える可能性があることを示唆している.また,MMP2 や MMP9 は,
E-cadherin の分解にも関与する事が報告されているため,MMP2とMMP9の 選択的阻害剤であるGM6001を用いて,E-cadherinタンパク量の減少にMMP2 や MMP9 が関与するかについて検討した.CRIM1 の発現が消失した細胞に GM6001を処理すると,その処理濃度に依存してE-cadherinのタンパク質量が 回復した(図8-C).陰性対照のsiRNAを導入した細胞のE-cadherinのタンパ
ク質量は GM6001 処理によってほとんど変化がなかった.これらの結果は,
CRIM1の発現消失によるE-cadherinタンパク質の減少がmRNA合成低下とタ ンパク質の分解促進の両方の理由で発生している可能性を示唆している.
図8 CRIM1発現消失時のE-cadherinタンパク質分解へのMMPsの関与
20
(A,B) siCRIM1を導入したACHN細胞の定量的RT-PCR.siCRIM1またはsiNeg を導入したACHN細胞を,48時間後に3.5 cmプレートに5×105 cellsで蒔きかえ,
48時間培養した.MMP2(A)およびMMP9(B)のmRNA発現について定量的RT-PCR を行った.独立した実験を3回実施し,データは平均値±標準偏差の形で表示した
(Mann-Whitney U検定.*,P< 0.05).(C)CRIM1の消失に伴うE-cadherinのタ ンパク発現減少は,MMP阻害剤であるGM6001処理により抑制された.siCRIM1ま たはsiNegを導入したACHN細胞を,48時間後に3.5 cmプレートに5×105 cellsで 蒔きかえた.GM6001もしくはDMSOを加え,さらに48時間培養し,タンパク質調 製で得られたサンプル30μgを,E-cadherinに対する一次抗体を使用してwestern blottingを行った.内部標準としてβ-actinを検出し補正した.バンドの強度は,Multi GAUGE version 3.0 software(FUJI FILM)により定量化した.独立した実験を3回 実施した.
21
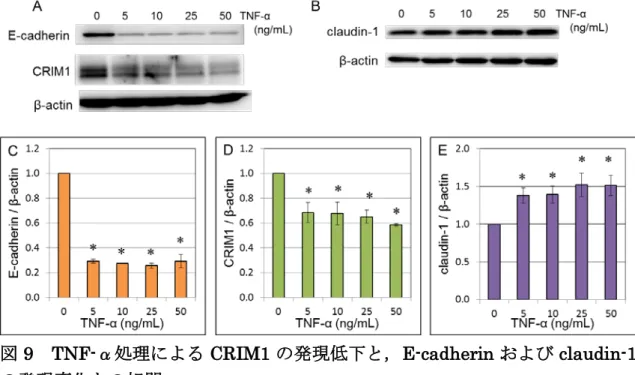
TNF-α刺激によってCRIM1の発現が減少する.
腎がん細胞では炎症性サイトカインである TNF-αの刺激により,E-cadherin の発現が低下することおよび細胞の遊走能や浸潤能が亢進することが報告され
ている21,27) . また,大腸がん細胞ではTNF-αの刺激によってclaudin-1の発
現が上昇することが報告されており,EMT発生に関与していると考えられてい
る18,19) .TNF-αによる刺激状態下でのCRIM1 の発現をwestern blottingで
解析した.その結果 E-cadherin および CRIM1 の発現は,TNF-αで刺激した ACHN細胞中で低下することが明らかとなった(図9-A,C,D).さらに,claudin-1 の発現は,TNF-αで刺激したACHN細胞中で増加した(図9-B,E).これらの ことから,CRIM1が生理的な刺激に応じて発現を変化させることや,これまで 細胞の遊走能を亢進すると報告されてきたE-cadherinおよびclaudin-1の発現 変化とCRIM1の発現低下に相関性があることが判明し,CRIM1が生理的な条 件において,がん細胞の遊走能や浸潤能を抑制する役割を果たしている可能性 が強く考えられる.
図 9 TNF-α処理による CRIM1 の発現低下と,E-cadherin および claudin-1 の発現変化との相関
(A,B)様々な濃度で48時間のTNF-α処理を行ったACHN細胞のwestern blotting. タンパク質調製によって得られたサンプル30μgを,Aは10%,Bは14%のSDS-ポ リアクリルアミドゲルに乗せ電気泳動を行った. E-cadherin,CRIM1,claudin-1 に 対する一次抗体を使用した.内部標準としてβ-actinを検出し補正した.各バンドの強 度は,Multi GAUGE version 3.0 software(FUJI FILM)により定量化した.独立し
22 た実験を3回実施した.
E-cadherin,CRIM1,そしてclaudin-1の定量データをC-Eに示した.データは平 均値±標準偏差の形で表示した(Mann-Whitney U検定.*,P< 0.05.TNF-α未処理 に対する比較).
23
【考 察】
本研究は,腎がん細胞において細胞膜タンパク質であるCRIM1の発現を消失 させると,増殖制御には影響を与えずに細胞の運動性や浸潤能が亢進すること を明らかにした.また,CRIM1 の発現消失は,E-cadherin の発現低下,
claudin-1 の発現亢進,軽度ではあるが FAK のリン酸化亢進などを引き起こす ことも明らかとなった(図9).これらの結果からCRIM1は,EMT関連因子の 発現制御に関与し,EMTの調節を介してがんの悪性化に必要な細胞の遊走能お よび浸潤能を制御している可能性が強く考えられる.そして CRIM1 は,
E-cadherin の発現を維持することで細胞接着を強固にすると共に運動性を抑え,
安定した組織構造の形成に貢献していると考えられる.
図9 CRIM1の発現消失による各因子の動きとがんの進展への寄与
EMT は浸 潤,転 移な どが んの 悪性 化に 重 要な役 割を 担う 現象 であ り,
E-cadherin はEMTの発生に伴って発現が低下することが知られている12-15) .
CRIM1の発現消失はEMTの発生を導き,がんが浸潤や転移を起こすきっかけ
になると考えられる.
Claudin-1はタイトジャンクションの形成にかかわるタンパク質であるが,大
腸がんでは,その発現異常がタイトジャンクション形成不全を引き起こし,細 胞の運動性や転移性を上げることが報告されている28-30) .また,炎症性サイト カインであるTNF-αの刺激によって,claudin-1の発現が上昇し,EMT発生を 招くことも報告されており 18,19) ,claudin-1 はがんの悪性化のマーカーとして
24
注目されている.CRIM1がclaudin-1の発現制御に関与することから,CRIM1 の研究によりがんの悪性化に関する新しい知見が得られることが期待される.
FAK はリン酸化により活性化され,細胞の運動性を高める働きをすることが 報告されている16,17) .CRIM1の発現を消失させたACHN細胞におけるリン酸 化型FAKの割合は,再播種後24時間では低かったが,72時間で増加するとい う傾向が認められた.CRIM1 の発現消失により FAK のリン酸化が亢進すると すれば,通常CRIM1は,このFAKのリン酸化を抑えることで,細胞の運動性 を抑えていると考えられる. FAKは,がんの増殖や浸潤・転移に関与すること が多数報告され,FAKを標的とした抗がん薬が開発されつつある16,17,31,32) .従 って,FAK の活性制御への関与が考えられる膜タンパク質である CRIM1 の活 性を増加させる化合物は,新たながん治療薬として機能する可能性がある.FAK のリン酸化の増加については,傾向が認められるというレベルであるので,FAK 上に数カ所存在するリン酸化部位別のリン酸化状態の解析を行うことで,
CRIM1とFAKのリン酸化状態の変化について検討が必要と考えられる.
CRIM1の発現消失は,E-cadherin遺伝子の転写抑制因子12-15)である,Snail, Slug,ZEB-1 のmRNAの増加を誘導した.このことはCRIM1が,通常,Snail, Slug,ZEB-1 の遺伝子発現を抑制しており,その消失により抑制が解除され,
これら遺伝子の発現が誘導されたことを示唆している.膜タンパク質が遺伝子 の転写調節に関わる例としてNotchの例が報告されているが33,34) ,CRIM1が 同様の方法で遺伝子発現を抑制しているかについては,今後の研究での検討が 必要である.また,CRIM1の発現消失は,細胞外基質を分解し,がん細胞の浸 潤・転移能に深く関与するMMP2とMMP9のmRNAの増加を誘導し,CRIM1 ががん細胞の浸潤・転移能の抑制に係わっている可能性が示唆された.MMP2 とMMP9はE-cadherin の分解にも関与する事が知られているが22) ,CRIM1 発現消失によるE-cadherinの減少はMMP2とMMP9の阻害剤により抑制され た.これらのことは,CRIM1 の発現消失によるE-cadherinの減少は,mRNA レベルとタンパク質レベルの両方で制御されていることを示唆している.
CRIM1 と E-cadherin が直接結合するかについては不明だが,CRIM1 と E-cadherin それぞれがβ-catenin と連携していることが報告されており 35) , β-catenin を介して複合体を形成し,E-cadherinの安定性を保持している可能 性が考えられる.現在,酵母の2-ハイブリッドシステムを用いた方法で,CRIM1 の細胞内結合因子の探索を行い,33種の結合候補因子が得られており(杉山ら,
投稿準備中),これらの因子の研究によりこの可能性が証明されていくことが期 待される.
Snail,Slug,ZEB-1,MMP2,MMP9 の各遺伝子の上流に,共通の転写制 御因子の認識配列が存在するかについて,oPOSSUM システムを用いてデータ
25
ベース検索を行ったところ,全ての遺伝子上にMZF1(Myeloid zinc finger 1) の認識配列が存在することが明らかとなった.MZF1 は,大腸がん,乳がん,
肺がん,膀胱がんで高発現している一方で,グリオーマでは MZF1 の遺伝子欠 損が報告されており,現在のところ,がんの誘発と抑制の両方に関与すると考 えられている36) .また,がん細胞の遊走能,浸潤能,転移能の亢進に関与する 報告はあるものの,EMTへの関与については証明されておらず,子宮頸がんに おいて,MZF1はEMTよりむしろがん細胞のがん幹細胞化により浸潤・転移能 を獲得させるように働くことが報告されている37) .そのため,CRIM1 とMZF1 の関連性を研究することにより,EMT やがん幹細胞化のような,CRIM1 と MZF1 によるがんの悪性化につながる新たな細胞の状態変化制御システムの解 明が期待される.
肺がんや前立腺がんにおいてCRIM1がEMTの促進に関与するという報告が
ある38,39) .一方,本研究では,腎がん細胞におけるCRIM1の発現消失がEMT
の発生に関与することを明らかにした.これらの相反する結果はCRIM1の働き が,組織の種類により異なっている可能性を示唆している.CRIM1の細胞内結 合因子の解析により,CRIM1の組織依存的な働き方について明らかにできると 考えられる.
がん細胞に EMT を誘導する因子として TNF–αが知られている 21,27) . ACHN細胞にTNF–αを処理するとE-cadherinの発現低下,claudin-1の発現 増加と共にEMTが発生するが,この時,同時にCRIM1の発現が低下した.こ のことは,CRIM1の発現低下が生理的な条件下でのEMTの発生にも必要な因 子であることを示しており,CRIM1の活性調節を介してEMTの発生を制御す る方法は,がん治療の発展に寄与する可能性がある.
腎細胞がんの治療においては手術療法が最も有効とされ,対して化学療法や 放射線療法には効果を示しにくく,旧来は主に遠隔転移のある症例を対象に IFN-αや IL-2 などの細胞性免疫を増強するサイトカインによる治療が行われ てきたが,その効果は限定的であった 40,41) .2006 年以降から,複数のマルチ キナーゼ阻害薬および mTOR阻害薬が保険承認となり 42-47) ,さらに 2016 年 には抗PD-1モノクローナル抗体であるニボルマブが使用可能となった48) .こ れらの薬剤は,サイトカインによる治療の時代に比べて良好な治療成績が報告 されているものの,腎細胞がんにおける薬物療法の目的は未だ治癒ではなく延 命である.そして,自己免疫疾患関連副作用(immune-related Adverse Event;
irAE)を始めとする従来にない多様な副作用の発生により治療を離脱するケー
スも散見されており,副作用マネジメントの点からはまだまだ課題もある.
CRIM1の活性調節を介したEMTの制御を行うことができれば,遠隔転移の
抑制による術後の再発率低下や,既存の薬物療法および放射線療法の効果を高
26
める可能性も考えられる.今後,CRIM1 の発現を増加させる化合物や CRIM1 の活性を調節する低分子リガンドの探索を進めることで,がん治療における新 薬の開発促進につながることが期待される.
27
【参考文献】
1) Kolle G, Georgas K, Holmes GP, Little MH, Yamada T. CRIM1, a novel gene encoding a cysteine-rich repeat protein, is developmentally regulated and implicated in vertebrate CNS development and organogenesis. Mech Dev., 90, 181-193 (2000).
2) Lovicu FJ, Kolle G, Yamada T, Little MH, McAvoy JW. Expression of Crim1 during murine ocular development. Mech Dev. 94, 261-265 (2000).
3) Georgas K, Bowles J, Yamada T, Koopman P, Little MH. Characterization of Crim1 expression in the developing mouse urogenital tract reveals a sexually dimorphic gonadal expression pattern. Dev. Dyn., 219, 582-587 (2000).
4) Nyström J, Hultenby K, Ek S, Sjölund J, Axelson H, Jirström K, Saleem MA, Nilsson K, Johansson ME. CRIM1 is localized to the podocyte filtration slit diaphragm of the adult human kidney. Nephrol. Dial. Transplant., 24, 2038-2044 (2009).
5) Pennisi DJ, Wilkinson L, Kolle G, Sohaskey ML, Gillinder K, Piper MJ, McAvoy JW, Lovicu FJ, Little MH. Crim1KST264/KST264 mice display a disruption of the Crim1 gene resulting in perinatal lethality with defects in multiple organ systems. Dev. Dyn., 236, 502-511 (2007).
6) Wilkinson L, Gilbert T, Kinna G, Ruta LA, Pennisi D, Kett M, Little MH.
Crim1KST264/KST264 mice implicate Crim1 in the regulation of vascular endothelial growth factor-A activity during glomerular vascular development. J. Am. Soc. Nephrol., 18, 1697-1708 (2007).
7) Glienke J, Sturz A, Menrad A, Thierauch KH. CRIM1 is involved in endothelial cell capillary formation in vitro and is expressed in blood vessels in vivo. Mech. Dev., 119, 165-175 (2002).
8) Nakashima Y, Takahashi S. Induction of cysteine-rich motor neuron 1 mRNA expression in