目 的 進行胃癌の治療成績は手術・補助化学療法の発 達により近年改善されているが,未だ満足すべき 成績が得られていない病期もあり,今後の治療成 績向上の成否は術前化学療法(NAC)にあると考 える.当センターでは,浸潤型胃癌の臨床試験や 日常診療でBulky N2/N3症例に対してNACを施 行しているが,その適応の指標は必然的に術前に 得られる臨床病理学的因子となる. 今回われわれは,胃癌取扱い規約第14版1)を基 準に術前予後因子のカテゴリーを定義して生存転 帰への影響を評価し,NAC 適応の指標について 検討した. 第36回日本外科系連合学会学術集会シンポジウム6 連絡先 坂東悦郎 〒411-8777 静岡県駿東郡長泉町下長窪1007 静岡がんセンター胃外科 対象と方法 2002年10月から2011年1月に静岡がんセンター 胃外科にて外科手術を受けた胃癌のべ2,820例中, NACの対象となりえる80歳以下の初発で術前画 像診断上非治癒因子のないcurative intent症例 で,前治療歴のない2,307例を対象とした(残胃の 癌を除く). 臨床病理学的因子および治療法の記載は胃癌取 扱い規約第14版1)および胃癌治療ガイドライン第 3版2)に従った. 術前予後因子として①年齢(60以下vs 61-70 vs 71 以上),②性別(男性 vs 女性),③cN=CT上のリンパ 節転移個数(cN0 vs cN1[1-2個の転移] vs cN2/3 [3個以上の転移]),④cT=術前の上部消化管内視鏡 検査・造影検査・CTから判断された術前の深達度 (cT1/2 vs cT3 vs cT4),⑤組織型=内視鏡時の 生検診断(well differentiated/pap vs moderately differentiated vs undifferentiated/por),⑥腫瘍径 =術前の上部消化管内視鏡検査・造影検査で診断 内容要旨 目的:術前化学療法(NAC)の視点から,胃癌における術前の臨床病理学的予後因子を評価した. 方法:胃癌curative intent症例について,年齢,性別,cN(CT上のリンパ節転移個数),cT(術前 の深達度),組織型,腫瘍径,肉眼型,血清CEA,血清CA19-9の9個の術前予後因子を選択し,単変 量・多変量解析にて生存転帰への重みを評価した. 結果:単変量解析では性別を除く8個の因子が有意な予後因子となった(p<0.001).Cox回帰分析 にて全症例では腫瘍径,肉眼型,cN(各p<0.001),cT(p=0.002)が独立因子として選択されたが, R0達成症例では腫瘍径,肉眼型(各p<0.001)のみ独立因子として選択され,cN(p=0.094),cT (p=0.062)は選択されなかった. 結語: NAC適応の指標には,T,N以外に腫瘍径,肉眼型も考慮されるべきである. 索引用語:胃癌,術前化学療法,術前予後因子,根治可能症例
特集
各領域におけるネオアジュバントの位置付け―1
胃癌における術前予後因子の検討;術前化学療法の視点から
静岡がんセンター胃外科1),消化器外科2)坂東 悦郎
1)杉沢 憲彦
1)近藤 潤也
1)徳永 正則
1)谷澤 豊
1)川村 泰一
1)絹笠 祐介
2)金本 秀行
2)上坂 克彦
2)寺島 雅典
1)された径(80mm未満 vs 80mm以上),⑦肉眼型= 術前の上部消化管内視鏡検査・造影検査で診断さ れた肉眼型(Type 0 vs Type1/2 vs Type3/4), ⑧血清CEA (5.0ng/ml以 下 vs 5.1-9.9ng/ml vs 10.0ng/ml以上),⑨血清CA19-9 (37U/ml以下 vs 38-99U/ml vs 100U/ml以上)の9個を選択し,性 別を除く8個の因子は上記のごとく3カテゴリー 化した. Kaplan-Meier法3)により生存曲線を作成し,生 存率の比較はLog-rank検定を用いてp<0.05を有 意差ありとした.またCoxの比例ハザードモデル4) (変数減少法尤度比;αレベルは0.10に設定し0.10 以下の場合にのみ回帰モデルに算入されるように 設定した)にて独立予後因子を推定した(RR=Risk Ratio;相対危険度,95% CI=Confidence Interval; 信頼区間,1が範囲に含まれない場合に独立性あ りとみなした). 結 果 今回検討した患者背景をTable 1 に示す.年齢 の中央値は66歳(19-90),男女比は2.2:1であった. 最終的にR0手術を達成しえたのは2007例(86%) であった.
1 .
単変量解析 各術前予後因子について,生存曲線と5年生存 率を示す. ①年齢;71歳以上(N=724)の5年生存率は64%, 61-70歳(N=822)は79%,60歳以下(N=761)は 84%で有意差を認めた(p<0.001)(Fig. 1 ). ②性別;男性(N=1569)の5年生存率は76%,女 性(N=738)は77%で有意差はなかった(p=0.269) (Fig. 2 ). ③cN;cN2/3(CT上陽性とされたリンパ節転移 3個以上,N=415) の5年生存率は42%,cN1(同 1-2個,N=234)は58%,cN0(N=1,658)は88% で有意差を認めた(p<0.001)(Fig. 3 ). ④cT;cT4(N=731)の5年生存率は45%,cT3 (N=158)は64%,cT1/T2(N=1,418)は94%で Table 1 Patient CharacteristicSex D Male 1569 (68%) D1,D1+ 1295 (56%) Female 738 (32%) D2,D2+ 1012 (44%) Age pStage Median 66 (19-90) IA 1056 (45%) Mean±SD 66.0 ±11.2 IB 218 (10%) Operative Procedure IIA 208 (9%) Total 617 (27%) IIB 186 (8%) Proximal 134 (6%) IIIA 139 (6%) Distal 1402 (61%) IIIB 135 (6%) PPG 154 (7%) IIIC 90 (4%) Approach IV 275 (12%) Open 2117 (92%) R Laparoscopy 190 (8%) 0 2007 (86%) 1 151 (7%) 2 149 (7%)
Fig. 1 Survival Curves according to Age.
Fig. 2 Survival Curves according to Sex.
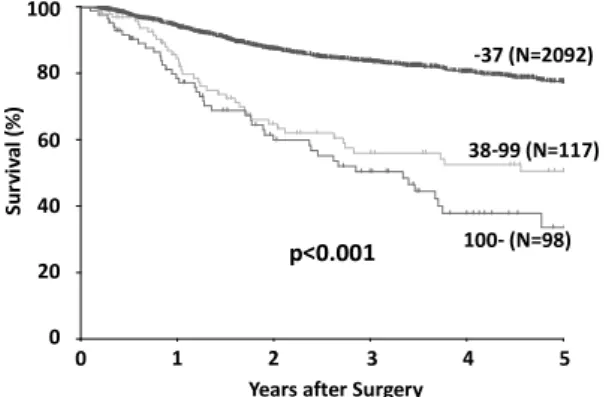
有意差を認めた(p<0.001)(Fig. 4 ). ⑤組織型;undifferentiated/por(N=1060)の5年 生存率は67%,moderately differentiated (N=719) は74%,well differentiated/pap (N=528)は84% で有意差を認めた(p<0.001)(Fig. 5 ). ⑥腫瘍径;80mm以上(N=227)の5年生存率 は24 %,40-79mmは68 %(N=767),40mm未 満 (N=1,313)は90% で有意差を認めた(p<0.001) (Fig. 6 ). ⑦肉眼型;Type3/ 4(N=592)の5年生存率は 42%,Type1/ 2(N=416)は63%,Type0(N= 1,299) は94 % で 有 意 差 を 認 め た(p<0.001) (Fig. 7 ). ⑧血清CEA;10.0ng/ml以上(N=144)の5年 生 存 率 は40 %,5.1-9.9ng/ml(N=176) は63 %, 5.0ng/ml以下(N=1,987)は77% で有意差を認め た(p<0.001)(Fig. 8 ). ⑨血清CA19-9;100U/ml以上(N=98)の5年 生存率は31%,38-99U/ml(N=117)は47%,37U/ ml以下(N=2092)は78% で有意差を認めた(p< 0.001)(Fig. 9 ).
2 .
多変量解析 ①Curative intent全症例 単変量解析で有意な予後因子となった性別以外 の8個の因子を共変量とし,Cox回帰分析にて予 後因子を推定したところ,最も予後に影響を与え る術前因子は腫瘍径で(p<0.001,Wald=52.087), 次いで肉眼型 (p<0.001,Wald=30.403),cN (p< 0.001,Wald=24.990),cT(p<0.001,Wald=11.334) であった.残りの5因子は独立予後因子とならな かった(Table 2 ). ②最終R0症例;N=2007 胃癌手術においては,術前に非治癒因子を画像 上認めなくても術中に指摘されることがしばしば あり,curative intent症例であっても実際に根治 切除ができる保証はない.そこで,最終的にR0手 Fig. 4 Survival Curves according to cT.Fig. 5 Survival Curves according to Histologic Type.
Fig. 6 Survival Curves according to Tumor Size.
Fig. 7 Survival Curves according to Macroscopic Type.
術を達成した症例について,同様のCox回帰分析 を施行した.最も予後に影響を与える術前因子は この検討でも腫瘍径で(p<0.001,Wald=26.994), 次いで肉眼型(p<0.001,Wald=19.903)であっ た.cN(p=0.094,Wald=4.776),cT(p=0.062, Wald=5.267)は残りの5因子とともに独立因子と ならなかった(Table 3 ). 考 察 進行胃癌の治癒には根治切除が唯一の手段であ り,わが国ではD2郭清を伴う胃切除術が標準術式 として行われてきた.さらなる治療成績向上のた めに大動脈周囲リンパ節郭清5)や左上腹部内臓全 摘術6)などの拡大根治切除が1970年代より一部先 進的施設で行われたが,JCOG(Japan Clinical Oncology Group)9501試験7)の結果が公表されて からは拡大手術も下火の傾向で,D2郭清が標準と いう考え方が一般通念となってきた. 根治切除不能あるいは再発症例に対しては抗癌 剤による化学療法が標準治療となる.5-FU持続点 滴が標準化学療法として施行されてきたが8),S-1 やイリノテカンなどが開発され1990年代後半から 使用されるようになり,JCOG9912試験9)によって S1が標準治療として確立された.しかし,S1+シ スプラチン(CDDP)の組み合わせでさらなる延 命効果があることがSPIRITS trial10)によって確立 され,現在の切除不能進行再発胃癌の標準治療は S1+CDDPとなっている.また,場合によっては 腹膜転移に対してタキサン系11),癌性骨髄炎の DICに対してメソトレキセート(MTX)12)を使用 することもある. 胃癌の補助化学療法の歴史は長いが,信頼でき る臨床試験として有効性を証明できたレジメンや 薬剤は長年存在せず,ガイドラインでも補助化学 療 法 は 研 究 的 治 療 と し て 行 う と さ れ て き た. ACTS-GC試験13)にて,pStage Ⅱ(pT1を除く)/Ⅲ 症例においてS1投与群が手術単独群に比して有 意に3年生存率が良好であることが示され,上記 StageでS1の約1年間の内服が標準治療としてガ イドラインの速報版に掲載された(第3版ガイド ライン13)では標準治療として明記されている).こ の結果が公表される以前は,当センターでもR0手 術の場合は高度進行癌であっても補助化学療法は 行わず経過観察を原則としてきたが,2007年以降 はStage Ⅱ/Ⅲ症例に対してS1による補助化学療 法を開始している. しかし,pStage Ⅲの生存率は補助化学療法で改 善はされたとはいえ,未だ満足すべき成績ではな く,今後の成績向上の鍵はNACにあると考える. NACはcurative intent ではあるが治癒率の低い 高度進行胃癌を対象としており,現在複数の臨床 試験が進められている. NACの優越性を示す臨床試験として,英国を中 心に行われたMAGIC trial14)がある.術前5-FU+ CDDP+エピルビシン(ECF療法)+切除+術後 ECF療法を手術単独群と比較すると,NAC群の無 増悪生存期間(Progression free survival=PFS) が手術単独群よりも有意に良好という結果であ る.手術単独群の5年生存率が25%程度とわが国 Fig. 8 Survival Curves according to Serum
Con-centration of CEA.
Fig. 9 Survival Curves according to Serum Con-centration of CA19-9.
に比べて低く,レジメンも馴染みの薄いもので一 概に比較すること困難であるが,刮目すべき試験 結果といえよう. 胃癌の予後因子としては,腫瘍の壁深達度15),リン パ節転移の解剖学的部位15),リンパ節転移個数16)17), リンパ節転移比率18)~20),遠隔転移15),腹腔内洗浄 細胞診21)22),腫瘍径23),肉眼型24)25),腫瘍占拠部位26)27), 年齢28)29),性別28),リンパ管侵襲30),静脈侵襲31), 組織型32),肉眼的漿膜浸潤径33),腫瘍マーカー (CEA/CA19-9)33)34),リンパ節郭清程度35)~37)など が報告されている.また,岡島ら38)の6,000例にお よぶ国立がん(研究)センター中央病院のデータ を基にした多変量解析(Stepwise法によるCoxの 比例ハザードモデル)によれば,胃癌の予後を最 も反映する因子はT,Nと報告されている.実際, わが国の胃癌取扱い規約やTNM分類でもT,N(お よびM)が病期分類の決定因子として用いられて いる. しかし,これら予後因子はいずれも術中あるい は術後初めて判明する病理学的所見によるものが ほとんどである.NACは必然的に術前に得られる 予後因子で適応が決定されるため,その指標にな る術前因子の予後への影響の評価が必要となる. 今回の検討では,T,Nよりも術前の腫瘍径や肉 眼型がより予後への影響が強いことが多変量解析 によって示された.カテゴリー分類の数や分類法 などで多変量解析の結果は左右されるため断定は 避けるべきであるが,既存の病理学的な予後因子 Table 2 Multivariate analysis using Cox Proportional Hazard Model identified
Indepen-dent Clinical Prognostic Factor (curative intent cases)
Factors Category Wald P RR 95%CI
Macroscopic type 30.403 <0.001 Type0 1 Type1,2 17.692 <0.001 3.086 1.825~5.218 Type3,4 28.591 <0.001 4.291 2.516~7.317 Tumor size 52.087 <0.001 1-39 1 40-79 2.165 0.141 0.796 0.587~1.079 80- 14.539 <0.001 1.944 1.381~2.736 cT 11.334 0.002 T1/2 1 T3 4.064 0.044 1.763 1.016~3.059 T4 10.798 <0.001 2.355 1.413~3.926 cN 24.990 <0.001 N0 1 N1 8.557 0.003 1.554 1.156~2.087 N2,3 24.643 <0.001 1.862 1.457~2.379 Table 3 Multivariate analysis using Cox Proportional Hazard Model identified Indepen-dent Clinical Prognostic Factor (Final R0 cases)
Factors Category Wald P RR 95%CI
Macroscopic type 19.093 <0.001 Type0 1 Type1,2 17.893 <0.001 3.371 1.920~5.920 Type3,4 16.774 <0.001 3.527 1.930~6.448 Tumor size 26.994 <0.001 1-39 1 40-79 6.246 0.012 0.604 0.406~0.897 80- 6.434 0.011 1.959 1.165~3.294 cT 5.267 0.062 T1/2 1 T3 5.050 0.025 2.003 1.093~3.670 T4 3.745 0.053 1.785 0.993~3.210 cN 4.766 0.094 N0 1 N1 4.115 0.043 1.543 1.015~2.348 N2,3 2.518 0.113 1.386 0.926~2.073
の解析とはやや異なった結果となった.JCOGに おいても,T,N以外の因子を指標とするNACの 第三相臨床試験(JCOG0501)が現在登録中で,試 験の内容は大型3型(80mm以上)・4型の浸潤性 胃癌を対象とし,標準治療群(手術+S1による術 後化学療法)と試験治療(S1+CDDP によるNAC+ 手術+S1による術後化学療法)を比較するもので, primary endpointは全生存率である.この試験は, 今回の検討で得られた腫瘍径,肉眼型をまさに適 格基準としている.今後は多施設の術前データを 集積し,より精度の高い術前予後因子を選定すべ きであろう. 今回の解析は,単一施設ではあるが症例数は十 分で信頼できるデータと確信するが,問題点とし て前述の術後化学療法の解析が不十分な点が挙げ られる.ACTS-GC試験後にS1による補助化学療 法を開始したため,S1治療群の経過観察期間は最 長4.5年,平均2年余りで,未だ生存転帰の解析は 難しく,信頼性も薄いと考えられる.将来的には, S1の生存転帰への影響について,術前の予後因子 別に解析したいと考えている. 高度リンパ節転移を伴う胃癌に対するNACの 第二相試験も登録が開始されている.この高度リ ンパ節転移とは,第2群リンパ節(胃癌取扱い規 約第13版39))に3cm以上のリンパ節が1個存在, もしくは1.5cm以上のリンパ節が少なくとも2個 隣接して存在,あるいは大動脈周囲リンパ節(第 3群リンパ節)に転移を疑うことで,これらは BulkyN2/3症例と称され,5年生存率は15%前後 といわれる予後不良の患者群である.これらに対 してイリノテカン(CPT11)とCDDPによるNAC の第二相試験(JCOG000240))が施行され,3年生 存率27%と比較的良好な成績が得られたが,3例 の治療関連死亡があり試験は中止された.続いて S1+CDDPによる第2相試験 (JCOG0405) が施行 され,現在最終成績の公表が待たれている.本治 療について,当センターでは中間発表の成績が良 好なことから,ガイドライン外の治療であるが日 常診療として行っている. 最後に,審査腹腔鏡はCTで診断されにくい腹膜 播種あるいは診断不可能な遊離癌細胞の診断に有 用という報告があり41),臨床試験登録の判定や NAC施行前の非治癒因子の判定に導入している 施設も多い.実際,前述のJCOG0501試験も審査 腹腔鏡を必須としている.当センターでは,3ポ ート法で現在70例余り施行しているが,合併症は 経験していない.低侵襲でR0手術可能症例の選択 に有用と考えるが,開腹時,腹腔鏡で発見されな かった腹膜播種を認めた症例もあり,今後の課題 といえよう.また,現実問題として全例に施行す ることは不可能で,NACの適応と審査腹腔鏡の適 応は一致させておく必要があると考えられる. 結 語 術前の深達度やリンパ節転移の量的な評価は予 後因子として重要であるが,NAC適応の指標に は,T,N以外に腫瘍径,肉眼型も考慮されるべき と考えられる.今後は術前因子をより包括的に考 慮した指標が必要で,術前予後因子のみで構成さ れたnomogram42)なども考えていきたいところで ある. 文 献 1) 日本胃癌学会編:胃癌取扱い規約.第14版,金原 出版,東京,2010 2) 日本胃癌学会編:胃癌治療ガイドライン.第3版, 金原出版,東京,2010 3) Kaplan EL, Meier P : Nonparametric estimation for incomplete observations. J Am Stat Assoc 53 : 457-481, 1958 4) Cox DR : Regression models and life tables. JR Stat Soc B 34 : 187-220, 1972 5) Yonemura Y, Segawa M, Matsumoto H, et al : Surgical results of performing R4 gastrectomy for gastric cancer located in the upper third of the stomach. Surg Today 24 : 488-493, 1994 6) Furukawa H, Hiratsuka M, Iwanaga TA rational technique for surgical operation on Borrmann type 4 gastric carcinoma : left upper abdominal evisceration plus Applebyʼs method. Br J Surg 75 : 116-119, 1988 7) Sasako M, Sano T, Yamamoto S, et al : D2 lymph- adenectomy alone or with para-aortic nodal dis-section for gastric cancer. N Engl J Med 31 : 453-462, 2008
8) Ohtsu A, Shimada Y, Shirao K, et al : Randomized
phase Ⅲ trial of fluorouracil alone versus fluoro-uracil plus cisplatin versus uracil and tegafur plus mitomycin in patients with unresectable, advanced gastric cancer : The Japan Clinical On-cology Group Study (JCOG9205). J Clin Oncol 21 : 54-59, 2003
9) Boku N, Yamamoto S, Fukuda H, et al : Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer : a randomised phase 3 study. Lancet Oncol 10 : 1063-1069, 2009
10) Koizumi W, Narahara H, Hara T, et al : S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial) : a phase Ⅲ trial. Lancet Oncol 9 : 215-221, 2008 11) Hironaka S, Zenda S, Boku N, et al :
Weekly pa-clitaxel as second-line chemotherapy for ad-vanced or recurrent gastric cancer. Gastric Cancer 9 : 14-18, 2006 12) Hironaka S, Boku N, Ohtsu A, et al : Sequential methotrexate and 5-fluorouracil therapy for gas- tric cancer patients with bone metastasis. Gas-tric Cancer 3 : 19-23, 2000 13) Sakuramoto S, Sasako M, Yamaguchi T, et al : Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med 357 : 1810-1820, 2007 14) Cunningham D, Allum WH, Stenning SP, et al : MAGIC Trial Participants. Perioperative chemo- therapy versus surgery alone for resectable gastro-esophageal cancer. N Engl J Med 355 : 11-20, 2006 15) Maruyama K, Gunvén P, Okabayashi K, et al : Lymph node metastases of gastric cancer. Gen-eral pattern in 1931 patients. Ann Surg 210 : 596-602, 1989
16) Adachi Y, Kamakura T, Mori M, et al : Prognostic significance of the number of positive lymph nodes in gastric carcinoma. Br J Surg 81 : 414-416, 1994
17) Fujii K, Isozaki H, Okajima K, et al : Clinical evaluation of lymph node metastasis in gastric cancer defined by the fifth edition of the TNM classification in comparison with the Japanese system. Br J Surg 86 : 685-689, 1999
18) Bando E, Yonemura Y, Taniguchi K, et al : Outcome of ratio of lymph node metastases in
gastric cancer. Ann Surg Oncol 91 : 1197-1201, 2002
19) Takagane A, Terashima M, Abe K, et al : Evaluation of the ratio of lymph node metastasis as a prognostic factor in patients with gastric cancer. Gastric Cancer 2 : 122-128, 1999 20) Yu W, Man K, Fan ST, et al : Comparison of five systems for staging lymph node metastasis in gastric cancer. Br J Surg 84 : 1305-1309, 1997 21) Bando E, Yonemura Y, Takeshita Y, et al :
Intraoperative lavage for cytological examina-tion in 1,297 patients with gastric carcinoma. Am J Surg 178 : 256-262, 1999 22) Benevolo M, Mottolese M, Cosimelli M, et al : Diagnostic and prognostic value of peritoneal immunocytology in gastric cancer. J Clin Oncol 16 : 3406-3411, 1998 23) Adachi Y, Oshiro T, Mori M, et al : Tumor size as a simple prognostic indicator for gastric carci-noma. Ann Surg Oncol 4 : 137-140, 1997 24) An JY, Kang TH, Choi MG, et al : Borrmann type Ⅳ : an independent prognostic factor for survival in gastric cancer. J Gastrointest Surg 12 : 1364-1369, 2008
25) Wang BB, Liu CG, Lu P, et al : Log-normal cen- sored regression model detecting prognostic fac-tors in gastric cancer : a study of 3018 cases. World J Gastroenterol 17 : 2867-2872, 2011 26) Wakatsuki K, Liu CG, Lu P, et al : Characteristics
of gastric cancer with esophageal invasion and aspects of surgical treatment. World J Surg 33 : 1446-1453, 2009
27) Z h a n g M , Z h u G Y , Z h a n g H F , e t a l : Clinicopathologic characteristics and prognosis of mucinous gastric carcinoma. J Surg Oncol 102 : 64-67, 2010
28) Bando E, Kojima N, Kawamura T, et al : Prognostic value of age and sex in early gastric cancer. Br J Surg 91 : 1197-1201, 2004 29) Smith DD, Schwarz RR, Schwarz RE. Impact of total lymph node count on staging and survival after gastrectomy for gastric cancer : data from a large US-population database. J Clin Oncol 23 : 7114-7124, 2005 30) Maehara Y, Oshiro T, Baba H, et al : Lymphatic invasion and potential for tumor growth and
metastasis in patients with gastric cancer. Sur-gery 117 : 380-385, 1995 31) Maehara Y, Ikeda Y, Miyazaki M, et al : Vascular invasion and potential for tumor angiogenesis and metastasis in gastric carcinoma. Surgery 128 : 408-416, 2000 32) Marrelli D, Pedrazzani C, Corso G, et al : Different pathological features and prognosis in gastric cancer patients coming from high-risk and low-risk areas of Italy. Ann Surg 250 : 43-50, 2009 33) Bando E, Kawamura T, Kinoshita K, et al :
Magnitude of serosal changes. J Am Coll Surg 91 : 1197-1201, 2003 34) Dilege E, Mihmanli M, Demir U, et al : Prognostic value of preoperative CEA and CA19-9 levels in resectable gastric cancer. Hepatogastroenterology 57 : 674-677, 2010 35) Songun I, Putter H, Kranenbarg EM, et al : Surgical treatment of gastric cancer : 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. Lancet Oncol 11 : 439-449, 2010 36) Wu CW, Hsiung CA, Lo SS, et al :
Nodal dissec-tion for patients with gastric cancer : a ran-domised controlled trial. Lancet Oncol 7 : 309-315, 2006 37) Miwa K, Miyazaki H, Sahara T, et al : Rationale for extensive lymphadenectomy in early gastric carcinoma. Br J Cancer 72 : 1518-1524, 1995 38) 岡島一雄:胃癌患者の予後因子―多変量解析によ る検討―.日外誌 30:700-11,1997 39) 日本胃癌学会編:胃癌取扱い規約.第13版,金原 出版,東京,1999 40) Yoshikawa T, Sasako M, Yamamoto S, et al : Phase Ⅱ study of neoadjuvant chemotherapy and extended surgery for locally advanced gas-tric cancer. Br J Surg 96 : 1015-1022, 2009 41) Hur H, Lee HH, Jung H, et al : Predicting factors of unexpected peritoneal seeding in locally ad-vanced gastric cancer : indications for staging laparoscopy. J Surg Oncol 102 : 753-757, 2010 42) Kattan MW, Karpeh MS, Mazumdar M, et al :
Postoperative nomogram for disease-specific survival after an R0 resection for gastric carci-noma. J Clin Oncol 21 : 3647-3650, 2003
Evaluation of Pre-operative Clinical Prognosticator in Gastric Cancer—from the
Viewpoint of Neoadjuvant Chemotherapy (NAC)—
Etsuro Bando
1), Norihiko Sugisawa
1), Junya Kondo
1), Masanori Tokunaga
1),
Yutaka Tanizawa
1), Taiichi Kawamura
1), Yusuke Kinugasa
2), Hideyuki Kanemoto
2),
Katsuhiko Uesaka
2), Masanori Terashima
1)Divisions of Gastric Surgery1) and Gastrointestinal Surgery2), Shizuoka Cancer Center Objective:The aim of this study is to evaluate the preoperative prognosticator for indication of neoad-juvant chemotherapy. Methods:Nine preoperative prognostic factors were selected. Univarite and multivariate survival analysis were performed. Results: In univariate analysis, sex lost prognostic significance. Multivariate analysis using Cox pro-portional hazard model identified that tumor size had the most effective factor for survival, followed by macroscopic type, cN(p < 0.001, respectively) and cT(p=0.002) in preoperative curative intent cas- es. However, in conclusive R0 cases (pathologic complete resection), cN and cT did not show prognos-tic independency, whereas tumor size and macroscopic appearance had predictive independency. Conclusion:In selecting patients for NAC, cT, cN adding tumor size and macroscopic type also should be included.