CTD 第 2 部
2.6 非臨床試験の概要文及び概要表
2.6.4 薬物動態試験の概要文
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 1
-目次
頁 表一覧... 2 図一覧... 3 略号及び用語の定義... 4 2.6.4.1 まとめ... 5 2.6.4.2 分析法... 6 2.6.4.3 吸収... 7 2.6.4.4 分布... 12 2.6.4.5 代謝... 16 2.6.4.6 排泄... 28 2.6.4.7 薬物動態学的相互作用... 29 2.6.4.8 その他の薬物動態試験... 31 2.6.4.9 考察及び結論... 31バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 2
-表一覧
頁 表2.6.4: 1 バニプレビル濃度分析法の真度及び精度... 7バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 3
-図一覧
頁 図2.6.4: 1 バニプレビルの化学構造... 6 図2.6.4: 2 ラットにバニプレビルの2 mg/kg を単回静脈内投与又は5 mg/kg を単回経口投与 したときの血漿中濃度―時間プロファイル... 8 図2.6.4: 3 イヌにバニプレビルの2 mg/kg を単回静脈内投与又は5 mg/kg を単回経口投与 したときの血漿中濃度-時間プロファイル... 10 図2.6.4: 4 サルにバニプレビルの2 mg/kg を単回静脈内投与又は5 mg/kg を単回経口投与し たときの血漿中濃度―時間プロファイル... 11 図2.6.4: 5 ラットにおけるバニプレビルの血漿及び肝臓中濃度... 14 図2.6.4: 6 イヌにおけるバニプレビルの血漿及び肝臓中濃度... 15 図2.6.4: 7 バニプレビルの推定代謝物... 18 図2.6.4: 8 無処置ラットにおける代表的な尿及び糞中代謝物プロファイル... 19 図2.6.4: 9 無処置ラットに[3H]バニプレビルの114 mg/kg を単回経口投与したときの血漿 中代謝物プロファイル(投与後4時間)... 20 図2.6.4: 10 無処置イヌにおける代表的な尿、糞及び血漿中代謝物プロファイル... 22 図2.6.4: 11 ヒト糞及び血漿における代表的な代謝物プロファイル... 24 図2.6.4: 12 ヒト、ラット、イヌ又はウサギの肝S9、もしくは、マウスの肝ミクロソームに おける[14C]バニプレビルの代表的代謝物プロファイル... 26バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 4
-略号及び用語の定義
略語 定義 バニプレビル Vaniprevir 開発番号:MK-7009、ADME Absorption, distribution, metabolism and excretion 吸収・分布・代謝・排泄 AUC Area under the drug concentration-time curve 薬物濃度-時間曲線下面積 BCRP Breast cancer resistance protein 乳癌耐性蛋白質
BDC Bile duct cannulation 胆管カテーテル
BLQ Below the lower limit of quantification 定量下限未満
BSEP Bile salt export pump 胆汁酸トランスポーター
CLb Blood clearance 血液クリアランス
CLp Plasma clearance 血漿クリアランス
Cmax Maximum drug concentration 最高薬物濃度
CYP Cytochrome P450 チトクロムP450
EDTA Ethylenediaminetetraacetic acid エチレンジアミン四酢酸
F Absolute oral bioavailability 絶対経口バイオアベイラビリティ
GLP Good laboratory practice 医薬品の安全性に関する非臨床試験の実施
基準
HPLC High performance liquid chromatography 高速液体クロマトグラフィ
HCV Hepatitis C virus C 型肝炎ウイルス
IC50 50% inhibitory concentration 50% 阻害濃度
ID Identification 同定番号
Ki Inhibition constant 阻害定数
Kinact Inactivation rate constant 不活性化速度定数
LC-MS Liquid chromatography-mass spectrometry 液体クロマトグラフィー-マススペクトロ メトリー法
LC-MS/MS Liquid chromatography-tandem mass spectrometry 液体クロマトグラフィ-タンデムマススペ クトロメトリー法
LIMS Laboratory information management system ラボラトリー情報管理システム LLC-PK Lilly laboratory cells-porcine kidney ブタ腎臓近位尿細管由来の上皮細胞株
LSC Liquid scintillation counting 液体シンチレーション計数法
MDCK Madin-Darby canine kidney イヌ腎臓尿細管上皮細胞由来の細胞株
MDR Multiple drug resistance protein 多剤耐性蛋白質
mRNA Messenger ribonucleic acid メッセンジャーリボ核酸
MRP Multidrug resistance-associated protein 多剤耐性関連蛋白質
MS Mass spectrometry 質量分析装置
NADPH β-nicotinamide adenine dinucleotide phosphate, reduced form
還元型ニコチンアミドアデニンジヌクレオ チドリン酸
ND Not detected 検出せず
NMR Nuclear magnetic resonance 核磁気共鳴
NS Not sampled 試料なし
NS3/4A Non-structural protein 3/4A 非構造蛋白質3/4A
OAT Organic anion transporter 有機アニオントランスポーター
OATP Organic anion transporting polypeptide 有機アニオン輸送ポリペプチド
OCT Organic cation transporter 有機カチオントランスポーター
PEG Polyethleneglycol ポリエチレングリコール
P-gp P-glycoprotein P-糖蛋白質
QWBA Quantitative whole body autoradiography 定量的全身オートラジオグラフィー
RNA Ribonucleic acid リボ核酸
RTV Ritonavir リトナビル
SD Standard deviation 標準偏差
SE Standard error 標準誤差
t1/2 Elimination half-life 消失半減期
Tmax Time to the maximum drug concentration 最高薬物濃度到達時間
UGT Uridine diphosphate -glucuronosyltransferase ウリジン二リン酸グルクロン酸転移酵素 Vdss Volume of distribution at steady state 定常状態分布容積
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 5 -2.6.4.1 まとめ バニプレビル(化学名:(5R,7S,10S)-10-(1,1-Dimethylethyl)-N-{(1R,2R)-1-[N-(cyclopropanesulfonyl) carbamoyl]-2-ethylcyclopropyl}-15,15-dimethyl-3,9,12-trioxo-2,3,5,6,7,8,9,10,11,12,14,15,16,17,18,19-he xadecahydro-2,23:5,8-dimethano-1H-benzo[n][1,10,3,6,12]dioxatriazacyclohenicosine-7-carboxamide [図 2.6.4: 1])は HCV NS3/4A セリンプロテアーゼの酵素活性を阻害する新規薬物であり、HCV 治療 薬として開発された。本項では、薬物の非臨床安全性評価のために選択した動物種であるラット、 イヌ、マウス及びウサギにおけるバニプレビルの吸収、分布、代謝及び排泄について述べる。ア カゲザルの血漿中薬物動態及び分布、並びに、チンパンジーの血漿中薬物動態も検討した。非臨 床薬物動態試験の概要一覧を[2.6.5.1 項]に示す。 非臨床薬物動態試験の結果から、ラット、イヌ及びサルにおけるバニプレビルのクリアランス は中程度から高度であり、血漿中半減期は短いことが示された。ラット、イヌ及びサルにおける 本薬の吸収は中程度であるが、バイオアベイラビリティは低かった(0%~12%)。ラット、イヌ、 サル及びチンパンジーに本薬を経口投与した場合、バイオアベイラビリティは低いものの、HCV 治療薬の標的臓器である肝臓への曝露は良好であった。肝臓の良好な曝露には、少なくとも一因 としてトランスポーターを介した肝取込みが寄与していると考えられる。ラットに[14C]バニプレ ビルを経口投与したときの放射能の分布は主に消化管及び肝臓に限局しており、すべての組織で7 日目までに定量下限未満となった。妊娠ラット及びウサギにおいて本薬の投与に由来する放射能 の胎盤通過性が認められ、授乳ラットでは乳汁移行性が確認された。ラット、イヌ、サル、チン バンジー、マウス、ウサギ及びヒトにおける蛋白結合率は高く(97.0%~99.5%)、血液/血漿中 濃度比はラット、イヌ及びヒトで0.7~0.8であった。ラット及びイヌにおけるバニプレビルの主 排泄経路は胆汁排泄であり、酸化的代謝物(約70%~75%)及び未変化体(約25%~30%)として 胆汁中に排泄された。無処置ラット及びイヌに[14C]バニプレビルを投与した際、投与放射能(未 変化体及び代謝物)のほぼすべてが投与後96時間以内に糞中に回収された。In vitro 及び in vivo で、バニプレビル分子構造中の脂肪族(ジメチルヘキサン又はトリメチル)部分、イソインドリ ン環、ビニルシクロプロピル部分やスルホンアミド部分が酸化された数種類の酸化的代謝物が生 成した。ヒト肝試料で同定した代謝物はすべて非臨床安全性試験に用いた動物種でも生成されて いた。ヒト肝ミクロソームによるバニプレビルの酸化的代謝のほとんどは CYP3A を介するもの であった。CYP1A2、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2B6、CYP3A 又は UGT1A1 に対するバニプレビルの可逆的阻害作用は強力ではなかった〔50%阻害濃度(IC50)≥19 μM〕。ま た、バニプレビルはCYP3A に対して弱い時間依存的な阻害作用を示した〔阻害定数(Ki)= 42 μM、 不活性化速度定数(Kinact)= 0.14 min-1〕。バニプレビルはヒト肝細胞とのインキュベーションによ り、弱いCYP3A 誘導作用を示した〔20 μM のバニプレビルは48時間で CYP3A4の mRNA を10 μM リファンピシンの12%~24%増加させた〕が、CYP1A2又は CYP2B6は誘導しなかった。バニプレ ビルは単離ヒト肝細胞に効率的に取り込まれた。バニプレビルは OATP1B1、OATP1B3及び P-gp の基質であることが示されたが、P-gp、BCRP、MRP2、MRP3及び MRP4に対して強力な阻害作 用は示さなかった(IC50 ≥8 μM)が、消化管でこれらのトランスポーターを阻害する可能性は否 定できない。
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 6 -バニプレビルはMDCKII-OATP1B1細胞へのピタバスタチン取込みを阻害し(IC50= 0.30 ± 0.01 μM)、MKCKII-OATP1B3細胞へのスルホブロモフタレイン取込みも阻害した(IC50 = 0.30 ± 0.02 μM)。また、バニプレビルは小胞膜で BSEP を阻害した(IC50= 1.30 ± 0.2 μM)。 バニプレビル (*は[3H]標識位置、#は[14C]標識位置を示す。) 図2.6.4: 1 バニプレビルの化学構造 2.6.4.2 分析法 薬物動態を評価した試験におけるバニプレビルの血漿及び肝臓中濃度の測定は、沈殿除蛋白又 は液-液抽出後、ネガティブ又はポジティブイオンモードでTurbo Ion Spray を用いた LC-MS/MS で実施した。定量下限は3~12 nM の範囲であった。生体試料又は HPLC 溶出液中の放射能は、直 接LSC により測定した(HPLC 溶出液はインライン型放射化学的フロー検出器で測定した)。[3H] バニプレビル又は[14C]バニプレビルの代謝物プロファイリングには放射能測定用検出器の付い た逆相HPLC を使用した。代謝物構造は MS 及び NMR による分析(M7、M8、M9、M10)又は 合成標品との比較( ;M10)により決定した。これら分析の詳細は各試験報告書を参 照のこと。 また、毒性試験で実施した薬物濃度評価の結果を一部、本項で記載した。これらの試験では、 GLP に従い、ラット及びイヌ血漿、並びにラット乳汁をそれぞれマトリックスとするバニプレビ ルの定量法をバリデートした。生体試料の定量範囲、真度及び精度、並びに安定性の結果を[表 2.6.4: 1]に示す。 血漿はTecan 社の Freedom 液体ハンドリング自動システムによる保持液抽出法、肝ホモジネー トは手動による液-液抽出法、乳汁は手動による希釈及びTecan 社の Freedom 液体ハンドリング 自動システムによる液-液抽出法によって、バニプレビル及び内標準物質 (バニプ
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 7 -50×4.6 mm HPLC カラムに注入し、以下のアイソクラティック条件を用い常温で HPLC 分析を実 施した。 流量 (mL/min) %A (0.1% ギ酸水溶液) %B (アセトニトリル) 1.0 35 65
カラムからの溶出液は、ネガティブイオンモードでTurbo Ion Spray を用い、多重反応モニタリ ングによるLC-MS/MS 法で測定した。バニプレビル濃度は、1/x2の二次回帰式を用いて算出した。 これら分析法の詳細は[4.2.2.1 項]に掲載する資料を参照のこと。 表2.6.4: 1 バニプレビル濃度分析法の真度及び精度 動物種 試料 抽出方法 線形範囲 (ng/mL) 真度 (%) 精度 (%) 生体試料の安定性 ラット 血漿 自動化した保持液抽出法 2.58~2010 95.0~103 0.485~5.74 約-70°C で425日間 ラット 血漿 (母・胎児†) 自動化した保持液抽出法 5.20~2030 96.9~104 0.781~7.88 約-70°C で73日間 ラット 乳汁 手動による希釈及び 自動化した保持液抽出法 5.00~2000 98.4~102 2.08~8.04 約-70°C で20日間 ウサギ 血漿 (母・胎児†) 自動化した保持液抽出法 5.20~2030 98.0~102 1.66~8.47 約-70°C で309日間 イヌ 血漿 自動化した保持液抽出法 2.52~1970 95.8~102 2.74~6.43 約-70°C で575日間 †胎児の血漿は母動物の血漿の検量線を用いて定量した。 2.6.4.3 吸収 2.6.4.3.1 ラット ラット(Sprague-Dawley)にバニプレビルの2 mg/kg を単回静脈内投与したときの血漿中バニプ レビル濃度は時間依存的に低下した[図2.6.4: 2]。バニプレビルの平均 CLpは74 mL/min/kg であり、 平均 CLbは106 mL/min/kg と推定された(血液/血漿比は[2.6.4.4.5 項]に記載)。したがって、ラ ットにおけるバニプレビルの高いクリアランスが明らかとなった。Vdss及びt1/2の平均値はそれぞ れ1.9 L/kg 及び0.9時間であった[2.6.5.2.1 項]。 バニプレビルの5 mg/kg を単回経口投与したときの吸収は速やかで、Tmaxは投与後0.5時間、Cmax は0.0~0.1 μM であり、F は0~5%であった[2.6.5.2.1 項]。無処置ラットに[14C]バニプレビルの 60 mg/kg を経口投与したとき、約33%が酸化型代謝物として糞中に回収されたことから[2.6.4.5.3 項]、バニプレビルの吸収は少なくとも中程度と考えられる。ラットにおける F が低値を示した原 因の一つとして、初回通過効果が挙げられる[資料4.2.2.2.1: PK003] [資料4.2.2.4.2: PK009]。
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 9 -バニプレビルの非線形動態及び肝抽出率の検討のため、ラットを用いた短時間(30分)注入に よる一連の静脈内及び門脈内投与試験が実施された[2.6.5.2.3 項]。低用量(0.2~1 mg/kg)におけ る平均肝抽出率は0.4であった。1~5 mg/kg の用量範囲で肝抽出率は0.4から0に低下したことから、 この用量範囲で肝抽出が飽和することが示唆された。この結果に一致して、静脈内投与したとき の血漿クリアランスは5 mg/kg における65 mL/min/kg から30 mg/kg における15 mL/min/kg に低下 した 。したがって、バニプレビルの全身曝露の上昇が用量比を上回る非線形性を示す原因の一つ として、肝クリアランスの飽和が考えられた[資料4.2.2.2.1: PK003]。 2.6.4.3.2 イヌ イヌ(ビーグル)にバニプレビルの2 mg/kg を単回静脈内投与したときの平均血漿中バニプレ ビル濃度推移を[図2.6.4: 3]に示す。CLp、Vdss及び t1/2の平均値はそれぞれ11 mL/min/kg、0.3 L/kg 及び1.2時間であった[2.6.5.3.1 項]。平均血液クリアランスは16 mL/min/kg と推定されたことから (血液/血漿比は[2.6.4.4.5 項]に記載)、イヌにおけるバニプレビルのクリアランスは中等度であ ることが明らかとなった。 バニプレビルの5 mg/kg を単回経口投与したときの吸収は速やかで、Tmaxは投与後1.3時間、Cmax は0.5 μM であり、F は12%であった[2.6.5.3.1 項]。無処置イヌに5 mg/kg を単回経口投与したとき、 投与後24時間までに投与した放射能の大部分が糞中に排泄された。この際、投与量の52%が酸化 型代謝物として糞中に回収されたことから[2.6.4.5.4 項]、イヌにおけるバニプレビルの吸収は適 度に良好と考えられる。F が低値を示した原因の一つとして、初回通過効果が大きいことが考え られる[資料4.2.2.2.1: PK003]。 イヌにバニプレビルの4用量(5、10、15及び30 mg/kg)を単回経口投与することにより、薬物 動態の用量依存性を検討した。血漿中バニプレビル濃度のAUC 及び Cmaxは用量比を上回って増 加する非線形性を示したことから、初回通過効果の飽和が示唆された[2.6.5.3.2 項] [資料4.2.2.2.1: PK003]。 雌雄イヌにバニプレビルの5/10、15又は45/30 mg/kg/日を1日1回25週間反復経口投与したときの 血漿中薬物動態を検討した[2.6.5.3.3 項]。雌雄イヌでバニプレビルの曝露は類似しており、性別 による影響は示されなかった。単回投与したときと同様、反復投与したときもバニプレビルの曝 露について用量比を上回る増加が認められた。クロスオーバー試験ではないが、単回投与時の薬 物動態[2.6.5.3.2 項]と比較して、対応する用量で反復投与した際には全身曝露の増加が認められ たことから、反復投与によるバニプレビルの蓄積が示唆された[資料4.2.3.2.10: TT 6060]。
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 12 -2.6.4.3.4 チンパンジー 雌雄各1例のチンパンジーにバニプレビルの10 mg/kg をチョコレートミルクで調製して単回経 口投与した際の薬物動態を検討した。2匹のチンパンジーの Tmaxはそれぞれ投与後2及び4時間、 Cmax はそれぞれ0.7及び1.1 μM、AUC はそれぞれ3.8及び6.5 μM•hr であった[2.6.5.5 項] [資料 4.2.2.2.1: PK003]。 2.6.4.3.5 ウサギ 雌ウサギ(3例)にバニプレビルの240 mg/kg を10% Tween に溶解して単回経口投与した際の薬 物動態を検討した。Cmax、Tmax及びAUC はそれぞれ、1.7 ± 0.2 μM、1.3 ± 0.6時間及び7.5 ± 1.6 μM•hr であった(算術平均±SD)[2.6.5.6 項] [資料4.2.2.2.3: PK007]。 2.6.4.4 分布 2.6.4.4.1 ラットにおける組織分布 アルビノラット(Sprague-Dawley)及び有色ラット(Long Evans)を用いて、QWBA によりバ ニプレビルの組織分布を検討したところ、有色ラットとアルビノラットでの結果は類似していた [2.6.5.7 項]。アルビノラットに[14C]バニプレビルの60 mg/kg を単回経口投与したところ、放射能 の分布は主として消化管及び肝臓に限られ、全身への広範な分布は認められなかった。胃及び食 道内容物、並びに、肝臓を除いて、組織中放射能濃度(ng 当量 バニプレビル放射能/g 組織)は 投与後4時間に最高値を示した。胃及び食道内容物、並びに、肝臓における放射能濃度は、投与後 2時間(最初の試料採取時間)に最高値を示した。最も放射能濃度が高かったのは、消化管内容物、 胆汁及び肝臓であり、その値は胆汁で492,000 ng/g、盲腸内容物で875,000 ng/g、食道内容物で 989,000 ng/g、大腸内容物で1,100,000 ng/g、肝臓で145,000 ng/g、小腸内容物で2,600,000 ng/g、胃 内容物で1,940,000 ng/g であった。消化管及び腎臓の組織、すなわち盲腸(17,000 ng/g)、腎臓 (10,600 ng/g)、腎皮質(12,300 ng/g)、小腸(24,700 ng/g)及び胃(11,700 ng/g)には低濃度の放 射能が観測された。全血中放射能濃度は投与後4時間に最高値8,910 ng/g を示した。脳組織(小脳 及び大脳)における放射能濃度は、いずれの時点でもBLQ(<244 ng/g)であった。 アルビノラット(Sprague-Dawley)及び有色ラット(Long Evans)のブドウ膜における放射能 濃度を比較した。投与後4時間に測定されたアルビノラット及び有色ラットのブドウ膜の放射能濃 度はそれぞれ1570及び339 ng/g であった。アルビノラット及び有色ラットのブドウ膜における放 射能濃度は類似し、かつ低いことから、バニプレビルはメラニンに結合しないことが示された。 すべての組織における放射能濃度は投与後168時間までには BLQ となった[資料4.2.2.3.9: PK020]。 投与後4時間における小腸及び肝臓の組織/血漿中放射能濃度比はそれぞれ1.8及び9.1であり、1 を上回った。血液/血漿中濃度比はいずれの時点でも約0.7であったことから、[14C]バニプレビル 由来放射能の分布は血球選択的ではないことが示された。血液/血漿中濃度比はin vitro で得られ たデータと一致するものであった[2.6.4.4.5 項] [資料4.2.2.3.1: PK001] [資料4.2.2.3.9: PK020]。 アルビノラットに[3H]バニプレビルの5 mg/kg を単回経口投与した探索的試験で組織分布を検
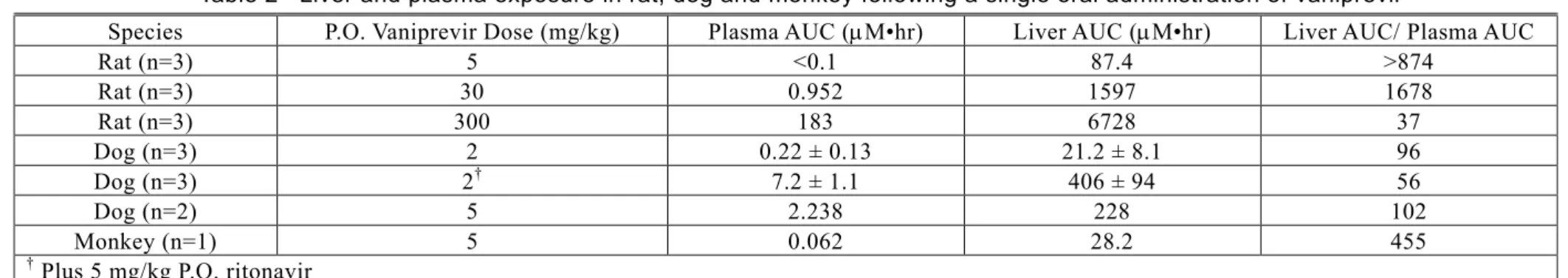
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 13 -討したところ、[14C]バニプレビルの60 mg/kg を単回経口投与した際に得られた結果と一致してい た。[3H]バニプレビルを用いた試験結果から、バニプレビルの分布は消化管組織に限局しており、 投与薬物に由来する物質が最も多くみられるのは肝臓であることが示された。[3H]バニプレビル を用いた試験で得られた肝臓試料をLC-MS を用いてプロファイリングしたところ、投与後4時間 には投与薬物に由来する物質の大部分が未変化体の形で存在することが明らかになった[資料 4.2.2.3.2: PK002] [資料4.2.2.3.9: PK020]。 2.6.4.4.2 ラット、イヌ、サル及びチンパンジーにおける肝臓への分布 ラット(Sprague-Dawley)、イヌ(ビーグル)又はサル(アカゲザル)にバニプレビルの5 mg/kg を単回経口投与、もしくは、チンパンジーに10 mg/kg を単回経口投与したときの血漿及び肝臓中 濃度データを[2.6.5.8 項]に要約する。また、ラット(Sprague-Dawley)に5、30及び300 mg/kg を 単回経口投与、又はイヌ(ビーグル)に2及び5 mg/kg を単回経口投与、もしくは、RTV との併用 によりイヌ(ビーグル)に2 mg/kg を単回経口投与したときの血漿及び肝臓中濃度データを[図 2.6.4: 5]及び[図2.6.4: 6]に示す。ラット、イヌ又はサルにバニプレビルの5 mg/kg を単回経口投与、 もしくはチンパンジーに10 mg/kg を単回経口投与したときの肝臓への曝露はいずれも良好であっ た(ラット、イヌ及びサルでは投与後2時間で3~35 μM、チンパンジーでは投与後12時間で31 μM) [2.6.5.8 項]。ラット、イヌ及びサルに5 mg/kg を単回経口投与したときの肝臓/血漿中 AUC 比は それぞれ>874、102及び455であった。非臨床動物種において低用量を投与した際のバニプレビル の肝臓への曝露は全身曝露(血漿)より100倍以上高かった。ラットにおける肝臓中曝露の増加は 5 mg/kg と30 mg/kg の用量間では用量比を上回ったが、30 mg/kg と300 mg/kg の用量間では用量比 を下回った。ラットにおいて30 mg/kg と300 mg/kg の用量間で肝臓中曝露の上昇が用量比を下回 ったことから、肝臓への取込みの飽和が示唆される。また、ラットでは、血漿中濃度の増加に応 じて肝臓/血漿中濃度比は減少し、肝臓/血漿中濃度比の範囲は血漿中濃度0.004 μM のときの約 4,000から血漿中濃度14 μM のときの16であった[図2.6.4: 5]ことからも、循環血中のバニプレビル 濃度の上昇とともに肝臓への取込みの飽和が示唆される。イヌにおける肝臓への曝露についても、 2 mg/kg と5 mg/kg の用量間で用量比を上回る増加がみられた[2.6.5.8 項]。ラット及びイヌにおけ るバニプレビルの肝臓への分布は高いものの、終末相において血漿及び肝臓中濃度-時間プロフ ァイルは平行して減少することから、終末相の肝クリアランスは終末相血漿クリアランスで説明 できることが示唆された[図2.6.4: 5] [図2.6.4: 6] [資料4.2.2.2.1: PK003] [資料4.2.2.3.4: PK014] [資料 4.2.2.3.5: PK015]。 併用薬存在下で、肝臓の曝露低下と、それに伴う全身曝露増加によりバニプレビルの有効性が 低下する可能性について検討するため、イヌにバニプレビル(2 mg/kg)と RTV(5 mg/kg)を併 用経口投与したときのバニプレビルの血漿及び肝臓中曝露量を測定した。当該試験で、バニプレ ビルの血漿及び肝臓中曝露量は、RTV との併用投与によりそれぞれ約30倍及び約20倍増加した [2.6.5.8 項]。取込みトランスポーター、排出トランスポーター、代謝が複合して関与するため、 当該試験デザインでは、バニプレビルとRTV の相互作用機序の解明や明確な分類を行うには不十 分であった。しかし、血漿及び肝臓中曝露量のいずれも同様の増加がみられたことから、バニプ
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 16 -定した[2.6.5.10 項]。本薬はマウス、ラット、ウサギ、イヌ、サル、チンパンジー及びヒトの血漿 蛋白に高い結合率を示した。結合率は試験したすべての動物種で同程度であり、マウス、ラット、 ウサギ、イヌ、サル、チンパンジー及びヒトにおける結合率(算術平均)はそれぞれ99.0%、99.5%、 99.0%、99.3%、98.5%、98.9%及び98.3%であった[2.6.5.10 項]。バニプレビル濃度(ラット及びイ ヌでは1~10 μM、サル及びヒトでは0.1~10 μM)に応じた血漿蛋白結合率の変化はみられなかっ た[資料4.2.2.3.1: PK001] [資料4.2.2.3.14: PK006] [資料4.2.2.3.15: PK008]。また、バニプレビル(検 討濃度:1~10 μM)はヒト血清アルブミン(検討濃度:40 mg/mL)及び α1-酸性糖蛋白(検討濃 度:1 mg/mL)のいずれにも結合することが確認された(結合率:それぞれ94.8%~95.9%及び55.2% ~66.6%)[資料4.2.2.3.16: PK027]。 また、別試験におけるバニプレビル濃度10 μM の検討で、肝機能障害患者の血漿蛋白結合率(軽 度:97.0%、中等度:97.3%、重度:97.5%)は健康被験者(97.3%)と同程度であった[資料4.2.2.3.7: PK017]。 2.6.4.4.5 In Vitro 全血/血漿比 抗凝固剤としてEDTA を含む新鮮全血中でバニプレビルをインキュベートすることにより、本 薬の血球移行性を検討した。平衡状態における血液/血漿中濃度比には、試験したバニプレビル 濃度との関連性はみられず、その平均はラット、イヌ及びヒトでそれぞれ0.7、0.7及び0.8であっ た[2.6.5.11 項]。これらのデータにより、ラット、イヌ及びヒトにおける血液クリアランスは血漿 クリアランスよりやや高いことが示された[資料4.2.2.3.1: PK001]。 2.6.4.5 代謝 2.6.4.5.1 マウスにおけるIn Vivo 代謝 マウス(ras トランスジェニック CB6F1;N=10)に[3H]バニプレビルの300 mg/kg を単回経口投 与し、その代謝を検討した[2.6.5.12 項]。経口投与後1又は6時間にマウスを屠殺し、尿、糞及び末 梢血を採取して代謝物プロファイリングを行った。尿は採取量が少なく、放射能が低レベルであ ったためプロファイリングは不可能であった。血漿及び糞中では、放射能の大部分が未変化体と して認められ、少量の酸化型代謝物(M6、M7、M8、M9及び M10)も検出された[図2.6.4: 7]。こ のデータにより、マウスにおけるバニプレビルの消失に酸化的代謝が寄与していることが示され た[資料4.2.2.3.14: PK006]。 2.6.4.5.2 ウサギにおけるIn Vivo 代謝 無処置のウサギ(ニュージランドホワイト;N=3)に[3H]バニプレビルの240 mg/kg を単回経口 投与し、その代謝を検討した[2.6.5.13 項]。平均血漿中曝露量(AUC)は7.5 μM•hr であった[2.6.4.3.5 項]。尿及び糞を投与後72時間まで採取したところ、投与放射能の平均回収率は67%であり、尿及 び糞中に投与量のそれぞれ0.5 ± 0.1%及び66.9 ± 14.1%が排泄された[2.6.5.13 項]。糞中に回収され た放射能は、未変化体(約75%)、並びに、いずれも酸化型代謝物の M6、M7、M8、M9及び M10 (合計約25%)であった[図2.6.4: 7]。ウサギの血漿及び尿中総放射能は非常に低レベルであった
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 17 -ため、代謝物プロファイリングは不可能であった。このデータにより、ウサギでバニプレビルは 適度に吸収され、その消失には酸化的代謝が寄与していることが示された[資料4.2.2.2.3: PK007]。 2.6.4.5.3 ラットにおけるIn Vivo 代謝 BDC 処置したラット(Sprague-Dawley)に[3H]バニプレビルの2 mg/kg を静脈内投与(N=2)、 又は無処置ラットに[14C]バニプレビルの60 mg/kg を経口投与(N=3)することにより in vivo 代謝 を検討した[2.6.5.14 項]。2 mg/kg を静脈内投与後72時間までの投与放射能の回収率(算術平均) は71.7%であり、尿、胆汁及び糞中にそれぞれ15.6%、52.1%及び4.2%が回収された。尿中に回収 された放射能は酸化型代謝物、胆汁中に回収された放射能は酸化型代謝物(約67%)及び未変化 体(約33%)であった。ラット胆汁中には複数の酸化型代謝物(M3、M6、M7、M7a、M8、M9 及びM10)が同定された[図2.6.4: 7]。したがって、ラットにおけるバニプレビルの主要消失経路 は代謝であることが確認された。無処置ラットに60 mg/kg を経口投与後240時間まで尿及び糞を 回収したところ、尿中には投与放射能の0.5 ± 0.5%、糞中には81.3 ± 6.7%が回収され、投与放射能 の総回収率は81.8 ± 6.3%であった[2.6.5.14 項]。放射能の大部分(74 ± 11%)は最初の24時間に糞 中に回収された[2.6.5.14 項]。無処置ラットから得られた代表的な尿及び糞中代謝物プロファイル を[図2.6.4: 8]に示す。尿中に回収された放射能は低レベルであったため、代謝物プロファイリン グは不可能であった。ラット糞中に回収された放射能は酸化型代謝物(約50%)及び未変化体(約 50%)であった[2.6.5.14 項]。ラット糞中に検出された酸化型代謝物は M6、M7、M8、M9及び M10であった[図2.6.4: 8]。ラット糞中には1種類のグルタチオン抱合体(M13)も検出された。ラ ット糞中にみられた各代謝物の割合を[2.6.5.14 項]に示す。全体的に見ると、経口投与された放射 能の約36%が代謝物として糞中に排泄されたことから、ラットにおけるバニプレビルの吸収は中 程度あることが示された。BDC 処置ラットを用いた静脈内投与試験において、バニプレビルは代 謝物のほか未変化体としても胆汁中に排泄されたことから、ラットに経口投与した際の実際の吸 収率は36%を超えることが予想される。[3H]バニプレビルの114 mg/kg を経口投与後1、4、8及び 24時間に採取した血漿中の代謝物プロファイルを検討した。投与後4時間血漿における代表的なク ロマトグラムを[図2.6.4: 9]に示す。循環血漿中には少量の酸化型代謝物(M6、M7、M8、M9、 M10及び M11)が検出された[図2.6.4: 9] [資料4.2.2.3.2: PK002] [資料4.2.2.4.2: PK009]。
M1, M2 M3
M14
M6, M7a
M13 M7
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 19 -尿中代謝物プロファイル(60 mg/kg [14C]バニプレビル経口投与後0~24時間) 糞中代謝物プロファイル(60 mg/kg [14C]バニプレビル経口投与後0~24時間) 図2.6.4: 8 無処置ラットにおける代表的な尿及び糞中代謝物プロファイル [2.6.5.14 項] [資料4.2.2.4.2: PK009] 0:00 10:00 20:00 30:00 40:00 50:00mm:ss 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 cps M13 M6 M7 M8 M9 M10 0:00 10:00 20:00 30:00 40:00 50:00mm:ss 0.0 20.0 40.0 60.0 80.0 100.0 120.0 140.0 160.0 cps [14C] バニプレビル
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 21 -イリングは不可能であった。糞中に回収された放射能は多種類の酸化型代謝物(M1、M2、M3、 M4、M5、M5a、M6、M7、M7a、M8、M9及び M10)、腸内で細菌によるアミド結合の還元によ り生成すると考えられる最終加水分解産物(M14)及び未変化体であった。糞中に回収された各 代謝物の割合を[2.6.5.15 項]に示す。量的には、糞中放射能の約71%が酸化型代謝物、約27%が未 変化体、約2%が加水分解産物 M14であった。無処置イヌにバニプレビルを経口投与後、大量の酸 化型代謝物が糞中に回収されたことから、イヌにおけるバニプレビルの吸収は良好であることが 示された。また、イヌにおけるバニプレビルの主要な消失の機序が酸化的代謝であることも明ら かとなった。血漿中の未変化体濃度及び総放射能濃度を測定した結果を[2.6.5.15 項]に示す。 LC-MS/MS で測定した血漿中バニプレビル濃度が[14C]バニプレビル放射能当量濃度とよく一致し ていることから、イヌにおける主要循環血漿中成分は未変化体である[2.6.5.15 項]。イヌ血漿中の 総放射能は非常に低レベルであったため、投与後1時間を除き、代謝物プロファイリングは不可能 であった。投与後1時間における血漿中代謝物プロファイリング[図2.6.4: 10]において、イヌ血漿 中に検出された放射能成分は未変化体のみであり、代謝物は検出されなかった[資料4.2.2.4.4: PK012] [資料4.2.2.5.1: PK021]。
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 25 -2.6.4.5.6 ヒト、ラット、イヌ、ウサギ及びマウスのIn Vitro 代謝 マウス(ras トランスジェニック CB6F1)、ラット、ウサギ、イヌ、アカゲザル及びヒトの in vitro 肝臓試料(S9、NADPH を添加したミクロソーム又は肝細胞)と共にバニプレビルをインキュベ ートした結果、酸化型代謝物のわずかな産生が認められた。ヒト肝S9では4種の微量代謝物(M7、 M8、M9及び M10)がみられた[図2.6.4: 12]。ラット肝 S9では微量の M10のみが生成し、イヌ肝 S9では代謝物は認められなかった[図2.6.4: 12]。雌ウサギ S9、マウス肝ミクロソーム及びマウス 肝細胞で、7種の微量酸化的代謝物(M3、M6、M7a、M7、M8、M9及び M10)がみられた[図2.6.4: 12]。バニプレビルをヒト肝細胞と共にインキュベートすると代謝物 M9及び M10が生成し、イヌ 肝細胞と共にインキュベートすると M8が生成した。バニプレビルをラット肝細胞と共にインキ ュベートしたときには代謝物はみられなかった。In vitro でみられた代謝経路は in vivo でみられた ものと一致しており、バニプレビルは主として酸化型代謝物を生成することが明らかになった[資 料4.2.2.3.1: PK001] [資料4.2.2.3.14: PK006] [資料4.2.2.3.15: PK008]。
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 26 -ヒト肝S9 ラット肝S9 図2.6.4: 12 ヒト、ラット、イヌ又はウサギの肝S9、もしくは、マウスの肝ミクロソーム における[14C]バニプレビルの代表的代謝物プロファイル [2.6.5.18 項] [資料4.2.2.3.1: PK001] [資料4.2.2.3.14: PK006] [資料4.2.2.3.15: PK008] 0:00 10 00 20:00 30 00 40:00 50:00 mm:ss 0.0 50.0 100.0 150.0 200.0 250.0 300.0 350.0 cps 0:00 10:00 20:00 30:00 40 00 50:00 mm:ss 0.0 50.0 100.0 150.0 200.0 250.0 300.0 350.0 cps M7 M8 M9 M10 M10 [14C] バニプレビル [14C] バニプレビル
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 29 -したときの総回収率は良好で(91.5%)、尿及び糞中にはそれぞれ投与量の0.78及び87.3%が回収さ れた[2.6.5.19 項]。放射能の主要排泄経路は胆汁中排泄であった[資料4.2.2.3.2: PK002] [資料 4.2.2.5.1: PK021]。 2.6.4.6.3 ウサギ 無処置の雌ウサギに240 mg/kg の[3H]バニプレビルを経口投与(N=3)し、尿及び糞を72時間採 取した。総投与量の67%が主として糞中に回収され、0.5%が尿中に回収された[2.6.5.19 項] [資料 4.2.2.2.3: PK007]。 2.6.4.6.4 ヒト 6名の健康男性被験者に[14C]バニプレビルの575 mg を液体充填カプセル製剤で経口投与し、尿、 糞及びトイレットペーパーを投与後168時間まで採取した。平均総回収率は投与量の約96%であり、 各個人の回収率は94.4%~97.4%の範囲であった[2.6.5.19 項]。最初の96時間における平均総回収 率は約94%であり、糞、尿及びトイレットペーパー中にはそれぞれ投与量の93.3%、0.4%、0.1% が回収された[資料4.2.2.5.2: PK022]。 2.6.4.6.5 ラットの乳汁中排泄 授乳ラットの乳汁中へのバニプレビルの排泄を検討するため、妊娠6日から授乳14日まで 180 mg/kg/日のバニプレビルを経口投与し、授乳14日における母動物の血漿及び乳汁中の未変化 体濃度を測定した[2.6.5.20 項]。母動物の血漿及び乳汁中濃度測定には、非絶食ラット4例から授 乳14日の投与8時間後に採取した試料を用いた。母動物におけるバニプレビルの平均乳汁/血漿中 濃度比は0.147であったことから、ラットにおけるバニプレビルの乳汁移行性が示された[資料 4.2.2.3.12: TT 7230]。 2.6.4.7 薬物動態学的相互作用 2.6.4.7.1 バニプレビルのCYP 基質としての評価 [3H]バニプレビル(1、10及び50 μM)の酸化的代謝への CYP 分子種の関与の可能性を、プール したヒト肝ミクロソームで CYP3A、CYP2D6又は CYP2C に対する阻害抗体を用いて検討した。 代謝物の定量は、ラジオクロマトグラムの代謝物ピークを積分することにより行った。その結果、 バニプレビルの酸化的代謝には主としてCYP3A が関与しており、CYP2D6又は CYP2C の明らか な寄与は認められなかった[資料4.2.2.3.1: PK001]。
2.6.4.7.2 ヒト肝ミクロソームにおけるCYP 及び UGT1A1の阻害
バニプレビルのCYP1A2、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2B6、CYP3A 及び UGT1A1 活性に対するプレインキュベーション非依存的阻害の可能性をヒト肝ミクロソームで検討した。 バニプレビルは陽性対照の阻害薬と比較して、CYP1A2、CYP2C8、CYP2C19又は CYP2D6に対し
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文
2.6.4 薬物動態試験の概要文 30
-て可逆的阻害を示さず(IC50>50 μM)、CYP3A(IC50= 19 μM)、CYP2C9(IC50= 26 μM)、CYP2B6 (IC50 = 51 μM)及び UGT1A1(IC50 = 19 μM)に対してわずかな阻害を示したのみであった [2.6.5.22 項]。バニプレビルは CYP3A に対して時間依存的な弱い阻害作用を示した(Ki= 42 μM、 Kinact= 0.14 min-1)[資料4.2.2.3.1: PK001] [資料4.2.2.4.3: PK010] [資料4.2.2.4.6: PK018]。 2.6.4.7.3 バニプレビルのCYP3A、2B6及び1A2の誘導作用の評価 バニプレビルのCYP3A、CYP2B6及び CYP1A2の誘導作用を初代培養ヒト肝細胞で評価した(ド ナー3名)。培養ヒト肝細胞で、バニプレビルは弱い CYP3A4の RNA 発現誘導作用を示したが (20 μM のバニプレビルによる平均誘導率は10 μM の濃度のリファンピシンの18%)、CYP3A 依 存性のテストステロン6β-水酸化活性を上昇させなかった。CYP3A 活性の上昇がみられなかった のは、バニプレビルによる可逆性/時間依存性の CYP3A 阻害が原因であると考えられる。予想 されたように、陽性対照のリファンピシン(10 μM)は、CYP3A4の RNA 発現及び酵素活性を誘 導した(それぞれ38~65倍及び5~16倍)。20 μM までの濃度のバニプレビルをヒト肝細胞とイン キュベーションしたとき、CYP2B6又は CYP1A2の mRNA 又は酵素活性の誘導はみられなかった。 誘導作用を示す陽性対照のフェノバルビタール(1000 μM)は、CYP2B6の mRNA を8~24倍、酵 素活性を8~11倍に誘導し、誘導作用を示す陽性対照のオメプラゾール(50 μM)は CYP1A2の mRNA を39~52倍、酵素活性を15~21倍に誘導した[資料4.2.2.3.1: PK001] [資料4.2.2.4.7: PK023]。 2.6.4.7.4 バニプレビルのトランスポーターの基質としての評価 バニプレビルのヒト肝細胞への時間及び温度依存的な取込みが認められた。バニプレビルのヒ ト肝細胞への取込み過程は飽和性(Km= 1 μM)のトランスポーター介在性輸送と非飽和性の受動 輸送から成るものであった。ヒト肝細胞データはOATP1B1及び OATP1B3発現 MDCK 細胞の輸送 特性に一致していたことから、バニプレビルはヒト肝取込みトランスポーターOATP1B1及び OATP1B3の基質であることが示された。また、バニプレビルはヒト肝排出トランスポーターであ る P-gp の基質であったが、BCRP の基質ではなかった[資料4.2.2.3.1: PK001] [資料4.2.2.3.13: PK025]。 2.6.4.7.5 バニプレビルのトランスポーター阻害作用の評価 バニプレビルはMDR1発現 LLC-PK1細胞で、P-gp 介在性ジゴキシン輸送を阻害した(IC50= 38 ± 17 μM)。また、バニプレビルは MDCKII-OATP1B1細胞への OATP1B1介在性ピタバスタチン取 込みを阻害し(IC50 = 0.30 ± 0.01 μM)、MDCKII-OATP1B3細胞へのスルホブロモフタレイン取込 みを阻害した(IC50 = 0.30 ± 0.02 μM)。また、膜小胞で、バニプレビルは BCRP 介在性のメトト レキサート輸送をIC5013.0 ± 2.5 μM で、BSEP 介在性のタウロコール酸の輸送を IC501.3 ± 0.2 μM で、MRP2介在性のエタクリン酸グルタチオン抱合体の輸送を IC50= 42.2 ± 5.8 μM で、MRP3介在 性のエストラジオール-17β-D-グルクロン酸の輸送を IC509.9 ± 1.8 μM で、MRP4介在性の葉酸の輸 送を IC50 8.0 ± 1.0 μM で阻害した[資料4.2.2.3.3: PK011] [資料4.2.2.3.6: PK016] [資料4.2.2.3.8: PK019] [資料4.2.2.3.10: PK024]。
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.4 薬物動態試験の概要文 2.6.4 薬物動態試験の概要文 31 -2.6.4.8 その他の薬物動態試験 その他の薬物動態試験は実施しなかった。 2.6.4.9 考察及び結論 バニプレビルは非臨床動物種で中程度から高いクリアランスを有する化合物であり、血漿中半 減期は短い。非臨床動物種における本薬の吸収は中程度あるが、バイオアベイラビリティは低い (0~12%)。バニプレビルをラット、イヌ、サル及びチンパンジーに経口投与したときの経口バ イオアベイラビリティは低いが、HCV 治療の標的器官である肝臓への曝露は良好であることが示 された。良好な肝曝露は、少なくとも一部は肝取込み活性によるものであると考えられる。ラッ トにバニプレビルを経口投与したときのバニプレビルの分布は主として消化管内容物及び肝臓に 限局しており、すべての組織で放射能が7日目までに定量下限未満となった。バニプレビルはラッ ト及びウサギの胎盤を通過し、授乳ラットの乳汁中にも排泄された。バニプレビルは非臨床試験 における動物種及びヒトの血漿蛋白に強く結合し(97.0~99.5%)、血球選択的な分布はみられな かった。バニプレビルはラット及びイヌでほとんどが糞中に(主に胆汁を介して)多種類の酸化 的代謝物(約70~75%)及び未変化体(約25~30%)として排泄された。非臨床安全性試験動物 種を用いて実施した試験で、これらの動物種(ラット、イヌ、マウス及びウサギ)はヒト肝画分 で同定されたすべての代謝物に曝露されることが示された。バニプレビルの酸化的代謝の大部分 はCYP3A を介するものである。また、バニプレビルは OATP1B1、OATP1B3及び P-gp の基質で もあることが判明し、CYP3A 又はこれらのトランスポーターを阻害することが知られている化合 物との薬物間相互作用を受ける可能性がある。バニプレビルは CYP3A を時間依存的に弱く阻害 したことから、主に CYP3A 代謝により消失する化合物に薬物間相互作用を引き起こす可能性が ある。さらに、バニプレビルはOATP1B1、OATP1B3及び BSEP を阻害することから、主要消失経 路がこれらのトランスポーターに依存する化合物との薬物間相互作用を引き起こす可能性もある。 バニプレビルは全身レベルで、その他の CYP、UGT1A1、P-gp、BCRP、MRP2、MRP3若しくは MRP4の阻害又は CYP3A、CYP1A2若しくは CYP2B6の誘導を介する薬物間相互作用は引き起こ さないと考えられるが、消化管で P-gp、BCRP、MRP2、MRP3及び MRP4を阻害する可能性は否 定できない。
CTD 第 2 部
2.6 非臨床試験の概要文及び概要表
2.6.5 薬物動態試験概要表
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表 2.6.5 薬物動態試験概要表 1
-目次
頁 略号及び用語の定義... 2 2.6.5.1 薬物動態試験:一覧表... 4 2.6.5.2 ラットにおける薬物動態... 7 2.6.5.3 イヌにおける薬物動態... 13 2.6.5.4 サルにおける薬物動態... 17 2.6.5.5 チンパンジーにおける薬物動態... 19 2.6.5.6 ウサギにおける薬物動態... 20 2.6.5.7 組織分布... 21 2.6.5.8 肝への分布... 32 2.6.5.9 妊娠動物での検討... 35 2.6.5.10 血漿蛋白への可逆的結合... 37 2.6.5.11 血球移行性... 40 2.6.5.12 マウスにおける in Vivo 代謝... 41 2.6.5.13 ウサギにおける in Vivo 代謝... 42 2.6.5.14 ラットにおける in Vivo 代謝... 43 2.6.5.15 イヌにおける in Vivo 代謝... 45 2.6.5.16 ヒトにおける in Vivo 代謝... 49 2.6.5.17 推定代謝経路... 53 2.6.5.18 In Vitro 代謝... 54 2.6.5.19 ラット、イヌ、ウサギ及びヒトにおけるマスバランス... 56 2.6.5.20 ラットにおける乳汁排泄... 58 2.6.5.21 CYP 基質としてのバニプレビルの評価 ... 59 2.6.5.22 ヒト肝ミクロソーム中の CYP 及び UGT1A1の阻害 ... 60 2.6.5.23 ヒト CYP(3A、2B6及び1A2)の誘導... 63 2.6.5.24 P-gp、OATP1B1、OATP1B3及び BCRP を介した輸送... 65 2.6.5.25 P-gp、OATP1B1、OATP1B3、BSEP、BCRP、MRP2、MRP3及び MRP4を介し た輸送への影響... 70バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表 2.6.5 薬物動態試験概要表 2
-略号及び用語の定義
略語 定義 バニプレビル Vaniprevir 開発番号:MK-7009、AMP Adenosine monophosphate アデノシン一リン酸
ATP Adenosine triphosphate アデノシン三リン酸
AUC Area under the drug concentration-time curve 薬物濃度-時間曲線下面積 BCRP Breast cancer resistance protein 乳癌耐性蛋白質
BDC Bile duct cannulation 胆管カテーテル
BLQ Below the lower limit of quantitation 定量下限未満
BSA Bovine serum albumin ウシ血清アルブミン
BSEP Bile salt export pump 胆汁酸トランスポーター
BSP Sulfobromophthalein sodium スルホブロモフタレイン
CLp Plasma clearance 血漿クリアランス
CYP Cytochrome P450 チトクロムP450
COV Covance Laboratories コバンスラボラトリー
DMSO Dimethylsulfoxide ジメチルスルホキシド
EDTA Ethylenediaminetetraacetic acid エチレンジアミン四酢酸
F Absolute oral bioavailability 絶対経口バイオアベイラビリティ
F Female 雌
GD Gestation day 妊娠期間
GI Gastrointestinal 胃腸の
GLP Good laboratory practice 医薬品の安全性に関する非臨床試験の実施
基準
HBSS Hank’s balanced salt solution ハンクス緩衝塩溶液
HEPES Hydroxyethyl piperazineethanesulfonic ヒドロキシエチル ピペラジンエタンスルホ ン酸
HPLC High performance liquid chromatography 高速液体クロマトグラフィー IC50 50% inhibitory concentration 50% 阻害濃度
IV Intravenous injection 静脈内投与
Ki Inhibition rate constant 阻害定数
Kinact Inactivation rate constant 不活性化速度定数
Km Michaelis constant ミカエリス定数
LC-MS Liquid chromatography-mass spectrometry 液体クロマトグラフィー-マススペクトロ メトリー法
LC-MS/MS Liquid chromatography-tandem mass spectrometry 液体クロマトグラフィー-タンデムマスス ペクトロメトリー法
LD Lactation day 授乳期間
LLC-PK Lilly laboratory cells-porcine kidney ブタ腎臓近位尿細管由来の上皮細胞株
LSC Liquid scintillation counting 液体シンチレーション計数法
M Male 雄
MAbs Monoclonal antibodies モノクローナル抗体
MDCK Madin-Darby canine kidney イヌ腎臓尿細管上皮細胞由来の細胞株
MDR Multiple drug resistance protein 多剤耐性蛋白質
mRNA Messenger ribonucleic acid メッセンジャーリボ核酸
MRL Merck research Laboratories メルクリサーチラボラトリー
MRP Multidrug resistance-associated protein 多剤耐性関連蛋白質
NA Not applicable 該当なし
β-NADP β-nicotineamide adenine dinucleotide phosphate, oxidized form
酸化型ニコチンアミドアデニンジヌクレオ チドリン酸
NADPH β-nicotinamide adenine dinucleotide phosphate, reduced form
還元型ニコチンアミドアデニンジヌクレオ チドリン酸
ND Not detected / Not detectable 検出せず
NMR Nuclear magnetic resonance 核磁気共鳴
NS Not sampled 試料なし
NS Not studied 検討しなかった
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表 2.6.5 薬物動態試験概要表 3
-略号及び用語の定義(続き)
略語 定義OAT Organic anion transporter 有機アニオントランスポーター
OATP Organic anion transporting polypeptide 有機アニオン輸送ポリペプチド
OCT Organic cation transporter 有機カチオントランスポーター
PBS Phosphate buffered saline リン酸緩衝生理食塩水
PEG Polyethleneglycol ポリエチレングリコール
P-gp P-glycoprotein P-糖蛋白質
P.O. Per os 経口投与
PK Pharmacokinetic(s) 薬物動態
QWBA Quantitative whole body autoradiography 定量的全身オートラジオグラフィー
RNA Ribonucleic acid リボ核酸
RTV Ritonavir リトナビル
SD Standard deviation 標準偏差
SEM Standard error of the mean 標準誤差
t1/2 Elimination half-life 消失半減期
TCA Taurocholic acid タウロコール酸
Tmax Time to the maximum drug concentration 最高薬物濃度到達時間
UDPGA Uridine diphosphate glucuronic acid ウリジン二リン酸グルクロン酸
UGT Uridine diphosphate -glucuronosyltransferase ウリジン二リン酸グルクロン酸転移酵素 Vdss Volume of distribution at steady state 定常状態分布容積
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 5
-2.6.5.1 薬物動態試験:一覧表(続き) Test Article: Vaniprevir
Type of Study Animal/Test System Method of
Administration
Testing Facility Location in CTD/Study Number 代謝
マウスにおける in vivo 代謝 Mouse P.O. MRL† 評価 [資料4.2.2.3.14: PK006]
ウサギにおける in vivo 代謝 New Zealand white rabbit P.O. MRL† 評価 [資料4.2.2.2.3: PK007]
ラットにおける in vivo 代謝 Rat P.O., IV MRL† 評価 [資料4.2.2.3.2: PK002]
評価 [資料4.2.2.4.2: PK009]
イヌにおけるin vivo 代謝 Dog P.O., IV MRL†
‡
評価 [資料4.2.2.3.2: PK002] 評価 [資料4.2.2.4.4: PK012] 評価 [資料4.2.2.5.1: PK021]
ヒトにおけるin vivo 代謝 Human P.O. ‡ 評価 [資料4.2.2.4.5: PK013]
評価 [資料4.2.2.5.2: PK022]
推定代謝経路 Mouse, Rat, Dog, Rabbit, Human P.O., IV MRL† 評価 [資料4.2.2.3.2: PK002]
評価 [資料4.2.2.3.14: PK006] 評価 [資料4.2.2.2.3: PK007] 評価 [資料4.2.2.4.2: PK009] 評価 [資料4.2.2.4.4: PK012] 評価 [資料4.2.2.4.5: PK013]
In vitro 代謝 Rat, Dog, Rabbit, Monkey, Human/liver S9, Hepatocytes
In vitro MRL† 評価 [資料4.2.2.3.1: PK001]
評価 [資料4.2.2.3.14: PK006] 評価 [資料4.2.2.3.15: PK008]
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 6
-2.6.5.1 薬物動態試験:一覧表(続き) Test Article: Vaniprevir
Type of Study Animal/Test System Method of
Administration
Testing Facility Location in CTD/Study Number 排泄
ラット、イヌ、ウサギ及びヒトでの 排泄
Rat, Dog, Rabbit, Human P.O., IV MRL†
‡ 評価評価 [資料4.2.2.3.2: PK002][資料4.2.2.2.3: PK007] 評価 [資料4.2.2.4.2: PK009] 評価 [資料4.2.2.4.4: PK012] 評価 [資料4.2.2.4.5: PK013] 評価 [資料4.2.2.5.1: PK021] 評価 [資料4.2.2.5.2: PK022] 乳汁排泄 Rat P.O. MRL† 評価 [資料4.2.2.3.12: TT 7230]§ 薬物相互作用
CYP 基質性 Human liver microsomes In vitro MRL† 評価 [資料4.2.2.3.1: PK001]
CYP 及び UGT1A1阻害 Human liver microsomes In vitro MRL† 評価 [資料4.2.2.3.1: PK001]
評価 [資料4.2.2.4.3: PK010] 評価 [資料4.2.2.4.6: PK018]
CYP3A、CYP2B6及び CYP1A2誘導 Human hepatocytes In vitro MRL†
‡ 評価評価 [資料4.2.2.3.1: PK001][資料4.2.2.4.7: PK023] P-gp、OATP1B1、OATP1B3及び BCRP を介した輸送 LLC-PK1 cells MDCKII cells Membrane vesicles In vitro MRL† 評価 [資料4.2.2.3.1: PK001] 評価 [資料4.2.2.3.13: PK025] P-gp、OATP1B1、OATP1B3、BSEP、 BCRP、MRP2、MRP3及び MRP4を 介した輸送への影響 LLC-PK1 cells LLC-MDR1 cells MDCKII cells Membrane vesicles In vitro MRL† 評価 [資料4.2.2.3.3: PK011] 評価 [資料4.2.2.3.6: PK016] 評価 [資料4.2.2.3.8: PK019] 評価 [資料4.2.2.3.10: PK024]
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表 2.6.5 薬物動態試験概要表 7 -2.6.5.2 ラットにおける薬物動態 2.6.5.2.1 単回静脈内及び経口投与後の薬物動態(ラット)
Test Article: Vaniprevir Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Rat Rat
Gender/Number of Animals: M/3 M/3
Feeding Condition: Fasted Fasted
Vehicle/Formulation: DMSO PEG400
Method of Administration: IV P.O.
Dose (mg/kg): 2 5
Sample: Plasma Plasma
Analyte: Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS PK Parameters (Mean SD): Total CLp(mL/min/kg) 74 ± 9 NA Vdss(L/kg) 1.9 ± 1.6 NA t1/2 (hr) 0.9 ± 0.7 NA AUC0-24hr(µM•hr) 0.6 ± 0.1 0.0~0.1 Cmax(µM) NA 0.0~0.1 Tmax(hr) NA 0.5 F (%) NA 0~5
NA: Not applicable
Additional Information: After IV dosing (2 mg/kg),the mean vaniprevir plasma clearance (CLp) was 74 mL/min/kg. The mean values for the volume of distribution at steady state (Vdss) and the elimination half-life (t1/2) in the terminal phase were 1.9 L/kg and 0.9 hr, respectively. After oral dosing (5 mg/kg), absorption was rapid with a maximal plasma concentration (Cmax) of 0.0 – 0.1M occurring at 0.5 hr postdose. The absolute oral bioavailability (F) was 0-5%. F was calculated using mean IV AUC0-2hrand the lowest and mean P.O. AUC0-2hr.
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 8
-2.6.5.2.2 単回経口投与後の薬物動態(ラット) Test Article: Vaniprevir
Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Rat Rat Rat Rat Rat
Gender/Number of Animals: M/3 M/3 F/3 M/3 F/3
Feeding Condition: Fasted Fasted Fasted Fasted Fasted
Vehicle/Formulation: PEG400 10%Tween 80 10% Tween 80 10% Tween 80 10% Tween 80
Method of Administration: P.O. P.O. P.O. P.O. P.O.
Dose (mg/kg): 5 30 30 100 100
Sample: Plasma Plasma Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters (Mean SD):
AUC0-24hr(µM•hr) 0.0~0.1 3.4 ± 1.6 2.5 ± 0.4 30 ± 9 34 ± 10
Cmax(µM) 0.0~0.1 1.7 ± 1.0 1.3 ± 0.2 6.2 ± 3.4 8.0 ± 1.1
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 9
-2.6.5.2.2 単回経口投与後の薬物動態(ラット)(続き) Test Article: Vaniprevir Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Rat Rat Rat Rat
Gender/Number of animals: M/3 F/3 F/3 M/3
Feeding Condition: Fasted Fasted Fasted Fasted
Vehicle/Formulation: 10% Tween 80 10%Tween 80 10% Tween 80 10% Tween 80
Method of Administration: P.O. P.O. P.O. P.O.
Dose (mg/kg): 300 300 500 500
Sample: Plasma Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters (Mean SD):
AUC0-24hr(µM•hr) 217 ± 143 272 ± 198 440 ± 450 604 ± 379
Cmax(µM) 18.5 ± 14.0 25.0 ± 24.6 28.5 ± 20.6 41.2 ± 23.7
Tmax(hr) 24 ± 0 11 ± 11 5.3 ± 1.2 18 ± 10
Additional Information: Following oral administration to rats at low dose (≤5 mg/kg P.O.), vaniprevir has poor oral plasma exposure and poor oral
bioavailability. At higher doses (>5 mg/kg P.O.), vaniprevir demonstrates non-linear pharmacokinetics in rats with greater than dose proportional increases in plasma exposure. No significant gender effect is observed.
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 10
-2.6.5.2.3 静脈内及び門脈内投与後の薬物動態(ラット) Test Article: Vaniprevir
Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Rat Rat Rat Rat
Gender/Number of Animals: M/3 M/3 M/3 M/3
Feeding Condition: Fasted Fasted Fasted Fasted
Vehicle/Formulation 25% hydroxypropyl-cyclodextrin 25% hydroxypropyl-cyclodextrin 25% hydroxypropyl-cyclodextrin 25% hydroxypropyl-cyclodextrin
Method of Administration: Portal vein IV Portal vein IV
Dose (mg/kg): 0.2 0.2 1.0 1.0
Sample: Plasma Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters (Mean ± SD):
AUC0-24hr(µM•hr): 0.013 ± 0.008 0.022 ± 0.013 0.18 ± 0.05 0.30 ± 0.03
Hepatic Extraction Ratio: 0.4 NA 0.4 NA
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 11
-2.6.5.2.3 静脈内及び門脈内投与後の薬物動態(ラット)(続き) Test Article: Vaniprevir Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Rat Rat Rat
Gender/Number of Animals: M/3 M/3 M/2
Feeding Condition: Fasted Fasted Fasted
Vehicle/Formulation 25% hydroxypropylcyclodextrin 25% hydroxypropylcyclodextrin 25% hydroxypropylcyclodextrin
Method of Administration: Portal vein IV IV
Dose (mg/kg): 5 5 30
Sample: Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters (Mean ± SD):
AUC0-24hr(µM•hr): 1.9 ± 0.3 1.7 ± 0.2 43
Hepatic Extraction Ratio: 0.0 NA NA
CLp(mL/min/kg): NA 65 ± 6 15
NA: Not applicable
Additional Information: At low doses (0.2 – 1 mg/kg) the hepatic extraction ratio was 0.4. The hepatic extraction ratio decreased from 0.4 to 0 in
the dose range of 1 to 5 mg/kg indicating that hepatic extraction saturates in this dose range. Consistent with this finding, the IV plasma clearance decreased from 65 mL/min/kg at 5 mg/kg IV to 15 mL/min/kg at 30 mg/kg IV with a non-linear increase in exposure (AUC) from 1.7 to 43M•hr, respectively.
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 12
-2.6.5.2.4 反復経口投与後の薬物動態(ラット) Test Article: Vaniprevir
Location in CTD/Study No.:
[資料4.2.3.2.5: TT 1004]
Species: Rat Rat Rat
Feeding Condition: Fed Fed Fed
Vehicle/Formulation 10% Tween 80 10% Tween 80 10% Tween 80
Method of Administration: P.O. P.O. P.O.
Dose (mg/kg): 60 120 360
Sample: Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters in Study Week 26 (Mean ± SEM):
Gender/Number of Animals: F/15 F/15 F/15 AUC0-24hr(µM•hr): 32.6 ± 3.92 209 ± 74.1 2350 ± 423 Cmax(µM): 13.6 ± 1.45 32.9 ± 10.7 123 ± 29.8 Tmax(hr): 2.0 2.0 4.0 Gender/Number of Animals: M/15 M/15 M/15 AUC0-24hr(µM•hr): 78.8 ± 22.8 209 ± 35.0 NA Cmax(µM): 37.3 ± 14.8 37.0 ± 16.0 NA Tmax(hr): 2.0 2.0 NA Gender/Number of Animals: F/M/30 F/M/30 F/15 AUC0-24hr(µM•hr): 55.7± 13.2 209 ± 37.6 2350 ± 423 Cmax(µM): 25.5 ± 8.50 34.9 ± 8.67 123 ± 29.8 Tmax(hr): 2.0 2.0 4.0
Additional Information: The exposures are greater than dose proportional following multiple oral administrations of vaniprevir to male and female
バニプレビル カプセル剤 2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表 2.6.5 薬物動態試験概要表 13 -2.6.5.3 イヌにおける薬物動態 2.6.5.3.1 単回静脈内及び経口投与後の薬物動態(イヌ)
Test Article: Vaniprevir Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Dog Dog
Gender/Number of Animals: M/3 M/3
Feeding Condition: Fasted Fasted
Vehicle/Formulation: DMSO PEG400
Method of Administration: IV P.O.
Dose (mg/kg): 2 5
Sample: Plasma Plasma
Analyte: Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS PK Parameters (Mean ± SD): AUC0-24hr(µM•hr): 4.1 ± 0.7 1.2 ± 0.4 CLp(mL/min/kg): 11 ± 2 NA Vdss(L/kg): 0.3 ± 0.1 NA t1/2(hr): 1.2 ± 0.0 NA Cmax(µM): NA 0.5 ± 0.2 Tmax(hr): NA 1.3 ± 0.6 F (%): NA 12 ± 2†
†Cross-over design, NA: Not applicable
Additional Information: Following IV administration at 2 mg/kg the means CLp, Vdssand t1/2 values were 11 mL/min/kg, 0.3 L/kg and 1.2 hr, respectively.
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 14
-2.6.5.3.2 単回経口投与後の薬物動態(イヌ) Test Article: Vaniprevir
Location in CTD/Study No.:
[資料4.2.2.2.1: PK003]
Species: Dog Dog Dog Dog
Gender/Number of Animals: M/3 M/2 M/F 2/2 M/1
Feeding Condition: Fasted Fasted Fasted Fasted
Vehicle/Formulation: PEG400 10% Tween 10% Tween 10% Tween
Method of Administration: P.O. P.O. P.O. P.O.
Dose (mg/kg): 5 10 15 30
Sample: Plasma Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters (Mean ± SD):
AUC0-24hr(µM•hr): 1.2 ± 0.4 1.5 19 ± 16 93
Cmax(µM): 0.5 ± 0.2 0.7 13 ± 12 14
Tmax(hr): 1.3 ± 0.6 1 1.0 ± 0.0 6
Additional Information: After a 5 mg/kg oral dose, vaniprevir was absorbed rapidly yielding a Cmaxof 0.5M at 1.3 hr postdose. The absolute oral bioavailability was 12%. Dose-dependent oral pharmacokinetics was evaluated after single dose administration of vaniprevir at four dose levels (5, 10, 15 and 30 mg/kg). Plasma AUC and Cmaxincreased non-linearly and greater than dose proportionally. The Tmaxincreased as the dose increased.
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 15
-2.6.5.3.3 反復経口投与後の薬物動態(イヌ) Test Article: Vaniprevir
Location in CTD/Study No.:
[資料4.2.3.2.10: TT 6060]
Species: Dog Dog Dog
Feeding Condition: Fed Fed Fed
Vehicle/Formulation 10% Tween 80 10% Tween 80 10% Tween 80
Method of Administration: P.O. P.O. P.O.
Dose (mg/kg): 5/10† 15 45/30‡
Sample: Plasma Plasma Plasma
Analyte: Vaniprevir Vaniprevir Vaniprevir
Assay: LC-MS/MS LC-MS/MS LC-MS/MS
PK Parameters in Study Week 25 (Mean ± SEM):
Gender/Number of Animals: F/4 F/4 F/4 AUC0-24hr(µM•hr): 18.9 ± 10.5 71.2 ± 11.9 816 ± 291 Cmax(µM): 6.24 ± 3.08 22.0 ± 2.96 85.2 ± 11.4 Tmax(hr): 1.0 ± 0.0 1.3 ± 0.3 1.3 ± 0.3 Gender/Number of Animals: M/4 M/4 M/4 AUC0-24hr(µM•hr): 12.9 ± 3.43 73.5 ± 22.5 631 ± 148 Cmax(µM): 4.96 ± 0.950 23.4 ± 6.40 83.5 ± 8.88 Tmax(hr): 1.0 ± 0.0 1.0 ± 0.0 1.5 ± 0.3 Gender/Number of Animals: F/M/8 F/M/8 F/M/8 AUC0-24hr(µM•hr): 15.9 ± 5.25 72.3 ± 11.8 723 ± 155 Cmax(µM): 5.60 ± 1.51 22.7 ± 3.27 84.3 ± 6.70 Tmax(hr): 1.0 ± 0.0 1.1 ± 0.1 1.4 ± 0.2
バニプレビル カプセル剤
2.6 非臨床試験の概要文及び概要表 2.6.5 薬物動態試験概要表
2.6.5 薬物動態試験概要表 16
-2.6.5.3.3 反復経口投与後の薬物動態(イヌ)(続き) Test Article: Vaniprevir Location in CTD/Study No.:
[資料4.2.3.2.10: TT 6060] †Dosage raised to 10 mg/kg/day after 6 weeks of dosing at 5 mg/kg/day.
‡Dosed at 45 mg/kg/day from Drug Day 1 to Drug Day 37 then 30 mg/kg/day from Drug Day 38 onwards.
Additional Information: After multiple oral dose administration to dogs, vaniprevir exposures were greater than dose proportional and similar in both
![Table 1 Concentrations of radioactivity in blood and tissues determined by whole-body autoradiography at specified times after a single oral administration of [ 14 C] vaniprevir to male nonpigmented rats (Group 1, 60 mg/kg)](https://thumb-ap.123doks.com/thumbv2/123deta/6519880.664701/55.1262.103.1144.261.690/concentrations-radioactivity-determined-autoradiography-specified-administration-vaniprevir-nonpigmented.webp)
![Table 2 Concentrations of radioactivity in blood and tissues determined by whole-body autoradiography at specified times after a single oral administration of [ 14 C] vaniprevir to male pigmented rats (Group 2, 60 mg/kg)](https://thumb-ap.123doks.com/thumbv2/123deta/6519880.664701/59.1262.98.1149.261.686/concentrations-radioactivity-determined-autoradiography-specified-administration-vaniprevir-pigmented.webp)