Title ニホンザルにおけるPTC苦味非感受性個体の発見とその適応的意義の解明( Dissertation_全文 )
Author(s) 橋戸(鈴木), 南美
Citation Kyoto University (京都大学)
Issue Date 2015-11-24
URL https://doi.org/10.14989/doctor.k19361
Right
Type Thesis or Dissertation
Textversion ETD
ニホンザルにおける PTC 苦味非感受性個体の
発見とその適応的意義の解明
Identification and adaptive evolution of
phenylthiocarbamide non-tasters
in Japanese macaques
京都大学霊長類研究所
Primate Research Institute, Kyoto University
橋戸(鈴木) 南美
Nami Hashido (Suzuki)
目次 学位論文要旨 ……….. 1 謝辞 ……….. 2 略語一覧表 ……….. 5 1. 研究全体の背景 ……….. 7 1.1. 哺乳類の味覚受容体の分子機構 ……….. 7 1.2. 哺乳類の味覚受容体の分子進化 ……….. 9 1.3. 苦味受容体遺伝子 TAS2R の種内多様性 ………….………. 10 1.4. ニホンザルの分布と遺伝的特性 ……….……. 12 1.5. ニホンザルの採食特徴 ……….. 13 1.6. 研究全体の目的 ……….……. 15 2. ニホンザルにおける PTC 苦味非感受性個体の発見 ……….. 16 2.1. 研究の概要 ……….. 16 2.2. 研究の背景 ……….. 17 2.2.1. TAS2R38 変異が引き起こす PTC 感受性の個体差 ……….. 17 2.2.2. 霊長類における TAS2R38 の分子進化 ………….………. 18 2.2.3. 研究の目的 ……….. 19 2.3. 研究の方法 ……….. 20 2.3.1. DNA サンプルの収集と DNA 抽出 ………….………. 20 2.3.2. TAS2R38 塩基配列シークエンスとハプロタイプ推定 …….. 21 2.3.3. TAS2R38 アリルの進化解析 ……….……. 22 2.3.4. 培養細胞を用いた苦味受容体 TAS2R38 の機能解析 …….. 22 2.3.5. リンゴ片を用いた定性的な PTC 苦味感受性評価 ……….. 24 2.3.6. 二瓶法による定量的な PTC 苦味感受性評価 ……….. 25 2.4. 研究の結果 ……….. 26 2.4.1. ニホンザル TAS2R38 の種内多様性 ………….………. 26 2.4.2. TAS2R38 開始コドン消失変異の発見 ………….………. 27 2.4.3. TAS2R38 アリルの受容体活性 ……….. 28
2.4.4. Mf-K アリルをもつ個体の PTC 感受性 ………….………. 29 2.5. 考察 ………….………...……….. 30 2.5.1. ニホンザルにおける PTC 苦味感受性変異の発見 ……….. 30 2.5.2. PTC 苦味感受性変異の拡散背景に対する仮説 ……….. 31 3. ニホンザル PTC 苦味感受性変異の急速な拡散 ………….………. 33 3.1. 研究の概要 ……….. 33 3.2. 研究の背景 ……….. 34 3.2.1. PTC 苦味感受性変異の進化的背景 ………….………. 34 3.2.2. 研究の目的 ……….. 35 3.3. 研究の方法 ……….. 35 3.3.1. 紀伊集団における TAS2R38 遺伝子周辺領域の配列解析 …….. 35 3.3.2. 紀伊集団および近隣 7 集団における非コード領域の配列解析 ….. 36 3.3.3. Mf-K アリル拡散のコンピューターシミュレーション …….. 37 3.4. 研究の結果 ……….. 37 3.4.1. 長距離ハプロタイプの同定による Mf-K アリルの由来の検証 …... 37 3.4.2. 紀伊集団の遺伝的特性 ……….……. 40 3.4.3. 紀伊集団における Mf-K アリルの急速な拡散 ……….. 42 3.5. 考察 ……….. 43 3.5.1. 偽遺伝子化に働いた正の自然選択 ………….………. 43 3.5.2. PTC 苦味感受性変異に働いた正の自然選択の要因 ……….. 44 4. 総合考察 ……….. 47 4.1. 研究全体の要約と意義 ……….……. 47 4.2. ニホンザル各集団および紀伊集団の集団背景 ……….. 48 4.3. ニホンザルの遺伝的多様性把握としての本研究の重要性 …….. 50 4.4. 霊長類における TAS2R38 種内変異の要因 ………….………. 53 4.5. 今後の研究の展望 ……….………. 56 5. 引用文献 ……….. 58 6. 表と図 ……….. 68
1 学位論文要旨 哺乳類は、舌で発現している味覚受容体で食物の栄養素や毒素の情報を得て 採食する。中でも食物中の毒性物質を検知する苦味受容体 TAS2R は生命維持に 重要である。進化の過程で柔軟に TAS2R のレパートリーを変化させることで、 生息環境に適応し、重要な苦味物質を検知してきたと思われる。このような長 期間での環境適応は、苦味受容体遺伝子 TAS2R の種間比較により明らかになっ たが、現在を含む短期間での環境適応を調べるためには、種内での多様性を明 らかにする必要がある。しかしながら TAS2R の種内での多様性はヒト、チンパ ンジーのみでしか明らかになっていない。本研究ではニホンザルを対象に TAS2R の種内多様性を調べ、生息環境との関連性を検討した。 はじめに、17 地域由来のニホンザル 597 個体を対象に、TAS2R の一つ TAS2R38 の配列を決定した。その結果、同定した 20 種類のアリル中に、開始コドンに変 異をもつアリル Mf-K を発見した。TAS2R38 は苦味物質 phenylthiocarbamide(PTC) を受容する。培養細胞を用いた受容体の機能解析および行動実験から、Mf-K ア リルでは PTC 苦味感受性が大きく低下していることが明らかになった。興味深 いことに、このアリルは 17 地域集団中、紀伊集団のみにみられ、紀伊集団では 3 割の頻度を示した。 次に、紀伊集団での Mf-K アリルの拡がりが適応的であったかどうかを検討し た。紀伊集団全 40 個体を対象に、TAS2R38 上流下流領域を含む約 10 kbp の配列 を決定した。また、紀伊集団と近隣 7 集団の非コード領域の配列解析、アリル 拡散のシミュレーションを行った。その結果、Mf-K は、正の自然選択の影響を 受けて紀伊集団で短期間に急速に拡散したことが示唆された。TAS2R38 は PTC の他に、アブラナ科や柑橘類の植物に含まれる苦味物質を受容する。これらの 植物の苦味を感じにくくなることがニホンザルの環境適応を醸成し、このアリ ルが紀伊集団に拡がる要因になったことが推察された。 現在認められる集団間や種間の遺伝的差異は、初めはすべて集団内での些細 な差であった。本研究で示した TAS2R38 の機能喪失による環境適応は、環境適 応の背景にある分子メカニズムを探る上で大きな手掛かりになると考えられる。
2 謝辞 本研究を進めるにあたって、京都大学霊長類研究所ゲノム進化分野の今井啓 雄准教授には指導教員として研究全体の指導をいただきました。同分野の平井 啓久教授、郷康広准教授(現・自然科学研究機構新分野創成センター)、松井淳 博士(現・東京大学農学生命科学研究科)、菅原亨博士、早川卓志助教(現・霊 長類研究所ワイルドライフサイエンス寄附研究部門)、伯川美穂氏には、実験、 解析、論文執筆の指導や研究内容のディスカッションなど、直接本研究に関わ っていただきました。第 3 章で示した進化的な解析については、総合研究大学 院大学の颯田葉子教授に実験・解析方法を教えていただき、さらには投稿論文 の構成にも深く関わっていただきました。他大学であるにも関わらず、丁寧に 指導していただき、深く感謝いたします。また本研究は、岐阜大学時代の学部 卒業研究として始まっており、伊藤慎一教授、村山美穂教授(現・京都大学野 生動物研究センター)、植田祐子氏には、研究生活の第一歩となる分子生物学実 験の手法を丁寧に指導していただきました。はじめに、日々の研究生活を支え てくださったこれらの皆様に感謝申し上げます。 本研究で解析した様々な集団由来のニホンザル DNA 試料の収集には実にたく さんの方々にご協力いただきました。下北集団は、むつ市、大間町、佐井村、 風間浦村、山崎秀春氏はじめ下北半島のニホンザル被害対策市町村等連絡会議 の保護管理専門員の皆様に収集していただいた試料を日本獣医生命科学大学の 羽山伸一教授、近江俊徳教授に提供していただきました。金華山集団は、京都 大学野生動物研究センターの風張喜子博士(現・北海道大学北方生物圏フィー ルド科学センター)、村山美穂教授、京都大学理学研究科の中川尚史教授、井上 英治講師(現・東邦大学理学部)、沼田集団は群馬県立自然史博物館の姉崎智子
3 博士、三重集団は NPO 法人サルどこネットの鈴木義久氏、六波羅聡氏、香美・ 高岡集団は四国自然史科学研究センターの谷地森秀二博士のご協力により試料 を提供していただきました。また、霊長類研究所で飼育されている集団は、人 類進化モデル研究センターの皆様、幸島集団は幸島調査隊 2007 の皆様のご協力 により試料を提供していただきました。霊長類研究所の渡邊邦夫教授、高井正 成教授、川本芳准教授には試料収集に関する情報をいただき、様々な団体や代 表者の方を紹介していただきました。ここでは代表者の方のお名前のみをあげ ましたが、実際に DNA 試料の収集およびニホンザルの飼育に関わってくださっ たすべての皆様に深くお礼申し上げます。 第 2 章で示した、培養細胞を用いた受容体機能解析実験については、東京大 学農学生命科学研究科の阿部啓子教授、三坂巧准教授、石丸喜朗准教授に実験 手法を教えていただき、計測設備等を使用させていただきました。実際の計測 実験や培養細胞の維持管理については同研究科の生物機能開発科学研究室の皆 様にご協力いただきました。ニホンザルに対する行動実験では、人類進化モデ ル研究センターの釜中慶朗氏に給水瓶の固定装置を作成していただき、難航し ていた給水瓶の設置に大いに協力していただきました。個体の飼育管理には人 類進化モデル研究センターの森本真弓氏をはじめセンターの皆様に携わってい ただきました。また、実験に使用した非感受性アリルのヘテロ接合個体は、ナ ショナルバイオリソースプロジェクトの「ニホンザル」より提供していただき ました。第 3 章でおこなった解析については、総合研究大学院大学先導科学研 究科の高畑尚之教授、桂有加子博士に解析手法を指導していただきました。ま た、柑橘類についての知識や苦味成分の分析については、近畿大学生物理工学 部仁藤伸昌教授、松川哲也講師、ニホンザルの採食生態に関しては霊長類研究 所の澤田晶子博士に多くの助言をいただきました。以上の皆様にご協力してい
4 ただき、様々な分野にわたる解析・実験を行うことができました。心よりお礼 申し上げます。なお、本研究は日本学術振興会特別研究員奨励費(12J04300)の ご支援をいただきました。深く感謝いたします。 最後に、出産・育児のための休学をはさんでの学位取得になりましたが、育 児と研究との両立を支えてくれ、いつも応援してくれた両親、夫、娘に心から 感謝いたします。
5 略語一覧表
bp base pair(塩基対)
DNA deoxyribonucleic acid(デオキシリボ核酸)
GPCR G protein-coupled receptor(G タンパク質共役受容体)
Mf Macaca fuscata(ニホンザルの学名)
MJ Median-joining(中央結合)
Mm Macaca mulatta(アカゲザルの学名)
PAV、AVI ヒト TAS2R38 のアリル名。PAV が感受性型、AVI が非感受性型 となっており、両者では以下の 3 つアミノ酸が異なる。
PAV 49: プロリン、262: アラニン、296: バリン AVI 49: アラニン、262: バリン、296: イソロイシン PCR Polymerase chain reaction(ポリメラーゼ連鎖反応) PTC Phenylthiocarbamide(フェニルチオカルバミド) SNV Single nucleotide variation(一塩基変異)
TAS1R* Taste receptor type 1(1 型味覚受容体) TAS2R* Taste receptor type 2(2 型味覚受容体)
*遺伝子を示す際はイタリック体、タンパク質を示す際は正体で表記する。 WT, TR, RC 第 2 章の機能解析実験で示した受容体・ポリペプチドのタイプ
WT wild type TR truncate type RC rescued type
7 1. 研究全体の背景 1.1. 哺乳類の味覚受容体の分子機構 ヒトを含む動物は摂取する食物から栄養をとることで、生命を維持させてい る。視覚、嗅覚、味覚、触覚など様々な感覚を用いて、摂取する食物の評価、 選択を行っているが、この中でも直接体内に取り入れる際に重要な情報を得る ものが、味覚である。哺乳類の味覚は、甘味、うま味、塩味、苦味、酸味の 5 つに分類される(Chandrashekar et al. 2006; Yarmolinsky et al. 2009)。甘味は糖、 うま味はアミノ酸や核酸、塩味は塩の味で、これらは生体維持に必須なシグナ ルとして認識され、嗜好性を示す。一方で、苦味や酸味は毒性物質や腐敗物の 検出の役割を担い、忌避性を示す。 味覚は、食物中の化学物質を受容することによって引き起こされる。口腔内 に取り込まれた食物は、舌上皮前部の茸状乳頭、後部の有郭乳頭、側部の葉状 乳頭、口蓋に存在する味蕾で受容される。1 つの味蕾は 50-100 個の味細胞で構 成されており、味細胞は形態的に I 型~IV 型の 4 種類に分類される。I 型細胞は 味細胞の支持細胞の役割をもち、IV 型細胞は I 型~III 型細胞の前駆細胞となる。 5 つの基本味のうち、甘味、うま味、苦味は II 型細胞が担い、酸味、塩味は III 型細胞が担っている。III 型細胞は、感覚ニューロンが直接的に接続しているた め、受容した化学物質の情報をそのまま延髄の孤束核に投射して酸味・塩味と して認識する。一方で、甘味、うま味、苦味を担う II 型細胞では感覚ニューロ ンが接続していないため、II 型細胞で受容された化学物質の情報は III 型細胞を 介して感覚ニューロンに情報を伝えていると考えらえている。 哺乳類において、5 つの基本味を認識するそれぞれの味覚受容体が近年明らか になってきた。塩味は、食塩などに含まれるナトリウムイオンがイオンチャネ ルを通過することにより起こり、この塩味の認識には ENaC と呼ばれるイオン
8
チャネルが関与していると考えられている(Heck et al. 1984; Chandrashekar et al. 2010)。酸味は水素イオンなどの陽イオンによって起こり、PKD2L1 と PKD1L3 が酸味の受容に関与していると考えられている(Huang et al. 2006; Ishimaru et al. 2006)。
一方、甘味、うま味物質の受容体は TAS1R 遺伝子ファミリー、苦味物質の受 容 体 は TAS2R 遺 伝 子 フ ァ ミ リ ー に コ ー ド さ れ て い る ( Adler et al. 2000; Chandrashekar et al. 2000; Hoon et al. 1999; Nelson et al. 2001; 2002)。どちらも G タ ンパク質共役型受容体(G protein-coupled receptor;GPCR)である。TAS1R には、
TAS1R1、TAS1R2、TAS1R3 の 3 種類あり、タンパク質に翻訳されたのち、TAS1R2
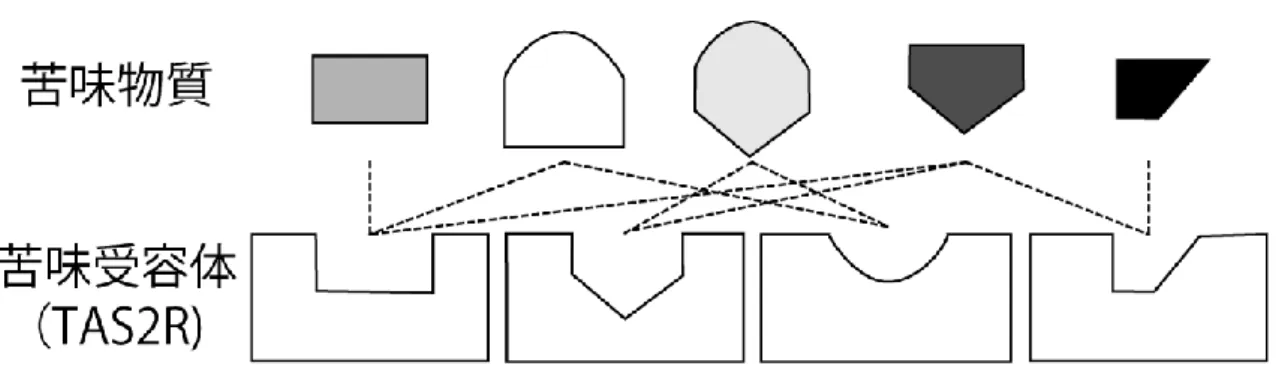
と TAS1R3 でヘテロダイマーを形成して甘味受容体となり、TAS1R1 と TAS1R3 のヘテロダイマーがうま味受容体となる。どちらも巨大な細胞外ループ構造を 持ち、この部分がそれぞれの物質の認識に重要な役割を持つ。もう一つの GPCR 型受容体をコードする苦味受容体遺伝子 TAS2R は重複遺伝子ファミリーであり、 ヒトでは 26 個の TAS2R をもつ。苦味物質は、アルカロイド、テルペノイド、フ ラボノイド、ペプチドなど実に多種多様である。ヒトでは、苦味物質と TAS2R の 関 係が 網羅 的 に調べ ら れて おり 、 TAS2R38 とフ ェ ニル チオカ ル バミ ド (phenylthiocarbamide; PTC)という人工苦味物質のように一対一の関係で受容す るものもあれば、カフェインのように 5 つの受容体が反応するものもある (Meyerhof et al. 2010)。また、TAS2R16 は β グルコピラノシド構造、TAS2R38 は N-C=S 構造を有する苦味物質を特異的に認識する受容体であると予測されて いる。このように、苦味物質と苦味受容体は多対多の関係性をもち、多岐にわ たる苦味物質を検知している(図 1)。
9 1.2. 哺乳類の味覚受容体の分子進化 ほとんどの哺乳類は 5 つの基本味を認識できると考えられているが、特殊な 食性をもつ動物では例外がいくつか知られている。肉食に特化したネコ科の動 物では、TAS1R2 の偽遺伝子化により、甘味受容体が機能せず、糖に対する嗜好 性を失っていることが知られている(Li et al. 2005)。一方で、ネコ科と比較的近 縁なジャイアントパンダ(Ailuropoda melanoleuca)では、甘味受容体は機能して いるが、うま味受容体に必要な TAS1R1 に偽遺伝子化が生じており、うま味を感 じることができない(Zhao et al. 2010)。これは、ジャイアントパンダが、最も 近縁種であるホッキョクグマ(Ursus maritimus)と分岐したのちに竹食に特化し たため、祖先で食していた肉に含まれるアミノ酸や核酸の味を感じる必要がな くなったことと関係すると考えられている。また、水棲哺乳類であるハンドウ イルカ(Tursiops truncatus)では、すべての TAS1R と TAS2R が偽遺伝子化してい るため、甘味、うま味、苦味を感じることができないことが明らかになってい る(Jiang et al. 2012; Kishida et al. 2015)。魚などの食物を咀嚼せずに丸飲みする ために、食物の味を認識せずに摂取することが関係していると示唆される。ハ ンドウイルカと同様に魚を丸のみするペンギン類もすべての TAS1R と TAS2R を 失っており、甘味、うま味、苦味を感じることができないことが最近明らかに なった(Zhao et al. 2015)。 ヒトは 26 個の TAS2R をもつが、マウスは 40 個、アフリカツメガエルは 51 個 と多くの TAS2R をもつ。一方で、ニワトリでは 3 個、フグでは 4 個と非常に少 なく、種によって遺伝子数が大きく異なる(Conte et al. 2003; Shi et al. 2003; Go 2006; Li and Zhang 2014; Hayakawa 2014)。TAS2R は染色体上に連続して並んでお り、不等相同組換えが起こりやすく遺伝子数が変わりやすいとされている。遺 伝子重複により生じた新しい遺伝子には、塩基置換の蓄積による別の機能の獲
10 得や、機能の冗長さによる偽遺伝子化が生じる。このようなメカニズムで、そ れぞれの動物は環境変化に合わせて忌避すべき毒性物質を受容するように TAS2R レパートリーを変化させて適応進化してきたと考えられている。霊長類 と齧歯類を含む分類群である真主齧類では、昆虫食者であった共通祖先が、そ れぞれの真主齧類系統に分岐した際に独立に TAS2R レパートリーを変化させる ことで、世界中に適応放散したことが示唆されている(Hayakawa et al. 2014)。 具体的には、体サイズの大型化とともに葉食を発達させたヒト上科と、オナガ ザル上科では、それぞれの分類群の共通祖先で独立に 8 個、10 個の TAS2R の増 加がみられ、この変化は他の分類群での変化と比べて劇的なものであった。こ の 2 つの上科における遺伝子重複は、葉に含まれる新規毒性物質の認識に対す る適応進化の結果と推察されている。このように TAS2R は進化の過程で、その 都度、生息環境に応じてレパートリーを変化させて、多数の苦味物質を検知で きるように適応進化してきたと推測できる。 1.3. 苦味受容体遺伝子 TAS2R の種内多様性 TAS2R は、種間でのレパートリー比較だけでなく、種内での多様性について
も広く調べられている(Wang et al. 2004; Kim et al. 2005; Sugawara et al. 2011; Hayakawa et al. 2012)。ヒトは 26 個の機能的な TAS2R をもつが、そのうち、TAS2R2、
TAS2R7、TAS2R45、TAS2R46 において偽遺伝子多型の存在が報告されている
(Wang et al. 2004; Go et al. 2005; Kim et al. 2005)。TAS2R2 をのぞくヒトの 25 個 の機能的な TAS2R の集団解析を行った研究では、ヒトの TAS2R は中立的にふる まう非コード領域と同程度の塩基多様度をもつことが示されている(Kim et al. 2005; Wang et al. 2004)。この理由には 2 つの解釈がなされている。一つは、TAS2R
11
は同義置換と同程度の非同義置換を蓄積していることから、機能的制約の緩和 (Relaxation of selective constraint)が生じているとする解釈である(Wang et al. 2004)。一つの味覚細胞には、多様な苦味物質を受容する多数の苦味受容体が発 現しており、お互いの機能を補償しあうために、それぞれの苦味受容体の機能 的制約の緩和が起きたと考えられている。また、ヒトで起きた植物食傾向から 肉食傾向への食性の変化によって苦味物質に触れる機会が減少したことや、火 を用いた調理による解毒技術の獲得が、こうした苦味受容体の機能的制約の緩 和に大きく関係していると考えられている。もう一つは、正の自然選択を受け て塩基多様度が高くなったとする解釈である(Kim et al. 2005)。TAS2R は塩基多 様度だけでなく、地域分化度も高い値を示した。つまり、それぞれの地域に適 応して積極的に TAS2R に変異を蓄積し、多様な苦味物質を受容できるように変 化したと考えられている。
チンパンジー(Pan troglodytes)においても 28 個の機能的な TAS2R の集団解 析が行われた(Sugawara et al. 2011; Hayakawa et al. 2012)。その結果、ニシチン パンジーの TAS2R は全体的に平衡選択を伴って塩基多様性が増加していたのに 対して、ヒガシチンパンジーでは、真猿類で増加した真猿類クラスターの TAS2R のみに浄化選択が働いていたことが明らかになった。すなわち、それぞれの亜 種に特異的に存在する食物レパートリーが異なる選択圧となって、それぞれの 亜種に特異的な TAS2R のレパートリーを生み出したことを示唆している。 以上のように、種内での TAS2R 多様性解析は、種間での TAS2R レパートリー 比較よりも、より短期間に集団内に生じた遺伝子の変化を明らかにすることが できるため、それぞれの種がどのように生息環境に適応してきたかを推測する 指標となる。
12 1.4. ニホンザルの分布と遺伝的特性 ニホンザル(Macaca fuscata)は日本の下北半島(北緯 41 度)から屋久島(北 緯 30 度)までほぼ満遍なく生息しており、ヒト以外では最も北に生息する霊長 類である(図 2)(Nakagawa et al. 2010)。ニホンザルは複数のオトナオス、複数 のオトナメスとそのコドモたちからなる複雄複雌の群れをつくって生活してい る。群れで生まれたコドモのうち、メスは生涯生まれた群れで過ごす母系社会 であり、オスは性成熟に達する頃に生まれた群れを出て他の群れに入る、また は単独で過ごすため、群れの中のオスの数はメスの数よりも少なく保たれてい る。このような群れは日本各地に約 3000 群存在し、総個体数では約 15 万 5 千 個体と推定されている(環境省自然環境局 2011)。日本各地の群れや群れの複 数の集合体である地域集団を対象にして、それぞれの集団の集団内および集団 間の遺伝的多様性を調べる系統地理学的な解析が、古くからおこなわれてきた (Nozawa 1972; Nozawa et al. 1982; 1991)。血液タンパク質多型による集団遺伝学 的な解析では、ニホンザルは他の種に比べて低変異性で、変異型は種全体に均 等には分布せず、一つの群れに特異的ではなく、隣接した複数の群れで共有さ れて、特定の地域に集中してあらわれる傾向を示した。この変異型の地域局在 性は、ニホンザルが隣接群間で頻繁に移出入を繰り返していることを示唆して いる(野澤 1991)。また、ミトコンドリア DNA を用いた遺伝的多様性や分子系 統関係の解析から、ニホンザルは東日本と西日本の個体群に大別でき、東日本 の集団では、1 万 5 千年前の最終氷期以降に、祖先集団から短期間に個体群サイ ズを拡大させているため、西日本の集団より多様性が低いことが示されている (Kawamoto et al. 2007)。 ニホンザルは、アカゲザル(Macaca mulatta)の一部がアジア大陸から日本列 島に侵入し、日本に定着した種で、ニホンザルとアカゲザルの種分岐は 31-88
13
万年前頃に起きたと考えられている(Marmi et al. 2004)。ニホンザルとアカゲザ ルはそれぞれの生息環境に適応し生息地を拡げた。その際に、遺伝子も環境に 適応させて変化したと考えられており、その例が、トル様受容体 (Toll-like receptor 2; TLR2)をコードしている遺伝子 TLR2 である(Takaki et al. 2012)。ト ル様受容体は、細胞表面に存在し、多様な病原体を感知する重要な役割をもつ。 アカゲザルでは、TLR2 遺伝子中に多数の非同義置換を蓄積していることから、 生息環境に存在する多様な病原体を感知できるように正の選択圧が働き、機能 が多様化したと考えられている。一方で、日本列島には熱帯熱マラリアなどの 病原体が存在していないため、ニホンザルでは TLR2 遺伝子には現在の機能を維 持させるような負の自然選択、すなわち浄化選択が働いており、この負の自然 選択が働いた結果ニホンザルの TLR2 の多様性は低くなっていると考えられて いる。ニホンザルは、日本列島の様々な環境に生息しており、特に、霊長類の 中でも寒冷地適応を果たした種で、-20 度にも達するような寒冷地でも生息して いる。こういった様々な環境に適応した背景に、ニホンザルの種内でも前述の ような遺伝子、特に環境中の病原体や刺激、採食食物中の有毒物質を感知する ような機能遺伝子に適応的な進化が生じているかもしれない。しかしながら、 ニホンザルの遺伝子の集団ごとの違いは、先に述べた血液タンパク質やミトコ ンドリア遺伝子の解析以降、ほとんど調べられていない。 1.5. ニホンザルの採食特徴 ニホンザルの採食生態については、1948 年に野生ニホンザル調査が始まって 以来、70 年近くにわたって日本の 49 地域で調査が行われてきており、それぞれ の生息地における採食品目リストも明らかになってきた(辻ら 2011; 2012)。ニ
14 ホンザルは、主に植物の果実や種子を食べており、果実食の食性をもつが、葉、 花、つぼみ、木の皮などの他の部位も採食する(Maruhashi 1980; 中川 1994; Tsuji 2010; 辻 2012)。また、植物以外にも、キノコや海藻、昆虫なども採食すること が知られている。食性には、地域間での差異があり、高緯度の地域では冬期に 樹皮や芽、草本類の採食がみられるが、低緯度地域ではこれらの採食はほとん どみられず、一年を通じて果実や葉が採食されている(Agetsuma and Nakagawa 1998)。これは、高緯度地域では低緯度地域に比べて果実の生産量が低く、利用 できる時期も短いことに起因すると考えられる。また、標高の違いによる食性 の違いもみられており、屋久島の高標高部では葉の採食割合が高いのに対して、 低標高部では果実類の採食割合が高い(Hanya et al. 2003)。このように、地域間 における食性の違いは、生息環境の植生の違いによる食物の利用可能度に起因 することが多いと考えられている。 一方で、必ずしも生息環境中の利用可能な植物のすべてを食べているわけで はなく、ある程度の食物選択をして採食を行っていると考えられている。植物 は、セルロース、リグニンなどの繊維、縮合性タンニンなどの難消化性の物質 や消化阻害物質、アルカロイドやテルペノイドなどの毒性物質を含み、これら の成分の含有量は植物間あるいは部位間で差異がみられる。霊長類は、これら の成分の摂取を最小限に抑えるように採食選択を行っていると考えられている (Glander 1982; 中川 1996)。ニホンザルでも、縮合性タンニンの含有量の少な い葉を選択して採食していることが報告されている(Hanya et al. 2011)。すなわ ち、食物の利用可能度だけではなく、植物に含まれる成分の差異も採食選択に 大きく関わっていることが示唆される。 近年では、人里近くに生息するニホンザルによる畑の農作物被害が増えてき ている(Agetsuma 2007; Suzuki and Muroyama 2010)。ニホンザルは、ミカン、ク
15 リなどの果実だけでなく、根菜、葉菜、イモ類、豆類、果実、キノコなど、ほ とんどの農作物を食べてしまうため、猿害として社会的問題が深刻になってき ている。 1.6. 研究全体の目的 哺乳類は、環境中に広く存在する多種の毒性物質を検知するために多様な苦 味受容体を持つ。苦味受容体遺伝子 TAS2R は、種類が多いため変異が蓄積しや すい遺伝子である。しかしながら、この「変化しやすさ」は、TAS2R の重要性 が低くなったことによる「機能的制約の緩和」によるものか、あるいは、TAS2R には重要な役割があり、より広範な苦味物質を受容できるように働く「正の自 然選択」によるものなのかは、曖昧なままである。これは、各動物種の認知能 力や生息環境、代謝能力など多様な要因が関わることが予測されるため、より 多様な種に着目して一つずつ丁寧に明らかにする必要があるが、現在のところ、 ヒトやチンパンジー以外の種ではほとんど明らかになっていない。そのため、 本研究では、古くからその採食特徴が明らかになっているニホンザルを対象に して TAS2R の種内多様性を調べることを計画した。 また、ニホンザルの採食選択に関する研究は、行動観察や栄養分析の面から 広く行われているが、食物の利用可能度や栄養成分の違いに着目するなど、採 食される植物側の違いに着目した研究がほとんどである。採食する側であるニ ホンザルの食物成分の認識能力の違い、例えば、味覚の違いについてはほとん ど議論が行われてこなかった。種内の味覚の多様性を明らかにすることで、ニ ホンザルの採食選択における採食者側のより能動的な意義を明らかにすること ができると期待される。
16 2. ニホンザルにおける PTC 苦味非感受性個体の発見 2.1. 研究の概要 動物にとって、食物中の毒性物質を検出する苦味感覚は非常に重要である。 霊長類は進化の過程で、苦味受容体遺伝子 TAS2R のレパートリーを変化させる ことで、生息環境、特に食物に適応してきたと思われる。しかしながら、種内 の TAS2R の多様性の調査は、これまでのところヒトとチンパンジーで行われた もののみであり、他の種については明らかになっていない。 本章では、TAS2R のひとつ TAS2R38 について、ニホンザルの 17 地域由来 597 個体を対象に多様性解析を行った。その結果、当該遺伝子領域中に 3 つの同義 置換、12 個の非同義置換を発見し、20 種類のアリルを同定した。これらの中に は、開始コドンに変異をもつアリル Mf-K が存在した。TAS2R38 は苦味物質 phenylthiocarbamide(PTC)を受容するので、Mf-K アリルの表現型を明らかにす るために、Mf-K アリルおよびアミノ酸が互いに異なる 4 種類のアリルを培養細 胞に発現させて機能解析を行った。同じ条件下で解析した 4 つのアリルのうち、 Mf-K アリルのみ PTC に反応性を示さなかった。また、このアリルをホモ接合で もつ個体では PTC 感受性が低下していることが行動実験から明らかになった。 以上の結果、ニホンザルでは、種内で PTC 苦味感受性に個体差が生じている ことが明らかになった。興味深いことは、Mf-K アリルが紀伊地方の集団のみで 発見され、かつ集団内では 3 割もの遺伝子頻度を示したことである。この非感 受性アリル Mf-K が紀伊地方で特異的に集団内に拡がり、維持されてきた過程に ついて、適応によるもの(正の自然選択)、偶然によるもの(中立)という二つ の可能性を仮定した。TAS2R38 はアブラナ科に含まれるグルコシノレートや柑 橘類に含まれるリモニンを受容するため、これらの植物との関与が示唆される。
17 2.2. 研究の背景 2.2.1. TAS2R38 変異が引き起こす PTC 感受性の個体差 1930 年代の初め、空気中に舞った PTC という物質に対して、同じ実験室内で 実験していた研究者二人が、「苦い」「苦くない」とそれぞれの感じ方に差を示 したことから、この物質の苦味感受性には個人差があるということが偶然発見 された(Fox 1932; Snyder 1931)。その後、この現象に興味を持った多くの研究者 によって、PTC の感受性の個人差について調査が進められてきた(Wooding 2006)。 チンパンジーに対しても PTC の感受性評価が行われ、チンパンジーでもこの苦 味物質の感受性に個体差があることが報告された(Fisher et al. 1939)。ヒトとチ ンパンジーの感受性個体、非感受性個体の比率が同程度であったため、この形 質はヒトとチンパンジーの共通祖先で生じたものであることが推測された。そ の後も、様々な霊長類種で PTC による苦味感受性評価が行われ、個体差がある 種、そうでない種が示され、またこの感受性差は遺伝する形質であることが示 された(Chiarelli 1963)。 2000 年に TAS2R が発見されたのち、この PTC を受容する受容体 TAS2R38 が 同定され、ヒトにおける PTC 感受性の個人差は TAS2R38 中の 3 つのアミノ酸の 違いによるものであることが発見された(Drayna et al. 2003; Kim et al. 2003)。こ の受容体中の 49、262、286 番目の 3 つのアミノ酸がプロリン(Pro)、アラニン (Ala)、バリン(Val)である受容体(PAV 型)は PTC に対して反応性を示す。 一方で、アラニン、バリン、イソロイシン(Ile)である受容体(AVI 型)では PTC に対して感受性が低い、もしくはないと考えられている(Bufe et al. 2005)。 その後、チンパンジーでの PTC 苦味感受性の個体差も TAS2R38 の変異によるも のであることが明らかになった(Wooding et al. 2006)が、チンパンジーの場合 は、通常の開始コドン ATG が苦味非感受性個体では AGG となっており、偽遺
18 伝子化が生じていた。培養細胞を用いた受容体機能解析実験や個体に対する行 動実験の結果、このアリルでは PTC 感受性が大きく低下していることが明らか になった。ヒトとチンパンジーの感受性差を引き起こす分子メカニズムが異な ることから、PTC 感受性の個体差はヒトとチンパンジーが分岐したのちにそれ ぞれの種で独立に生じたことが示唆された(Wooding et al. 2006)。 2.2.2. 霊長類における TAS2R38 の分子進化 比較ゲノム解析から、TAS2R38 は齧歯類および霊長類を含む真主齧類におい て、系統特異的な遺伝子重複がなく、種間で一対一のオーソログ関係にある保 存的な遺伝子であることが示されている(Hayakawa et al. 2014)。Hayakawa らの 解析で用いた霊長類 15 種では、アイアイが偽遺伝子化していることを除いて、 すべての種が配列上は機能的な TAS2R38 をもつことが明らかになっている。 Wooding(2011)は、ツパイを外群として 39 種の霊長類で TAS2R38 の全長配列 を決定した。ウーリーモンキー(Lagothrix lagotricha)、チュウベイクモザル(Ateles
geoffroyi)、スマトラオランウータン(Pongo pygmaeus abelii)の 3 種で偽遺伝子
変異が確認されたが、他の 36 種では機能的であると推測された。遺伝子領域中 の非同義置換数、同義置換数から算出した dN/dS値は 0.60 で、1 より有意に小さ い値を示したことから、TAS2R38 には浄化選択が働いており、霊長類の進化過 程の長期間にわたって保存的に進化してきたことが示唆された。一方で、領域 ごとに dN/dS値を算出すると、膜貫通領域、細胞内領域ではそれぞれ 0.55、0.51 であったのに対して、細胞外領域では 1.16 となっており、中立性から外れるこ とはなかったが、1 を超える高い値を示した。このことから、進化過程の比較的 最近の期間では、TAS2R38 の機能の多様化や、受容する物質の変化などが生じ ている可能性が推測されている(Wooding 2011)。
19
ヒトとチンパンジーの種内では、TAS2R38 塩基置換による PTC 苦味感受性の 変異が存在し、この変異はヒトでは世界の幅広い地域に拡がっており(Wooding et al. 2004)、チンパンジーにおいても、ニシチンパンジーで高い頻度を示してい る(Sugawara et al. 2011; Hayakawa et al. 2012)。もしかすると TAS2R38 は、現在 の霊長類種の共通祖先では重大な役割を持ち、進化過程の長い期間機能が保存 されてきたが、現在の霊長類種に分岐した以降は、その進化傾向が変わってき ているのかもしれない。 2.2.3. 研究の目的 以上のように、TAS2R の中でも TAS2R38 は、塩基置換と PTC 感受性変異が明 確に対応しているため、多くの研究者の興味をひき、TAS2R38 の多様性解析や PTC による味覚テストが広く行われてきた(Guo and Reed 2001; Kim and Drayna 2005; Wooding 2006; Feeney 2011)。味覚テストでは、ヒト、チンパンジー以外の 霊長類種でも、PTC 苦味非感受性個体の存在が示唆されているが(Chiarelli 1963)、 これらの種での TAS2R38 の塩基配列は調べられておらず、ヒト、チンパンジー 以外の種での TAS2R38 の多様性は明らかになっていない。TAS2R38 は霊長類の 進化の過程で長期間にわたって保存的な遺伝子であったにもかかわらず、ヒト やチンパンジーでは遺伝子変異により、苦味感受性に個体差が生じている。ヒ トやチンパンジー以外の霊長類種で TAS2R38 の多様性とその維持機構を明らか にすることは、TAS2R38 の分子進化を探るうえで非常に重要になる。 また、TAS2R38 は天然に含まれる苦味物質として、アブラナ科に含まれ N-C=S 構造を持つグルコシノレート(glucosinolate)という化合物やその派生物質、柑 橘類に含まれトリテルペンのひとつであるリモニン(limonin)を受容する (Wooding et al. 2010; Meyerhof et al. 2010)。ニホンザルはナズナなどの野生のア
20 ブラナ科植物や、タチバナ、ミカンなどの柑橘類も採食するため(辻ら 2011; 2012)、TAS2R38 の多様性と食性の関係を直接的に考察することが可能となる。 本章ではまず、様々な地域集団由来のニホンザルを対象に TAS2R38 の配列解 析を行い、ニホンザル種内での TAS2R38 の多様性を明らかにした。そのうえで TAS2R38 各アリルの表現型解析を行い、TAS2R38 の多様性と PTC 感受性との関 係を明らかにした。 2.3. 研究の方法 2.3.1. DNA サンプルの収集と DNA 抽出 試料として、日本の 17 地域由来のニホンザル 597 個体、インド・中国由来の アカゲザル 54 個体から抽出した DNA を用いた(図 2、表 1)。霊長類研究所で 飼育されているニホンザル 281 個体(高浜、地獄谷、波勝、滋賀、嵐山、箕面、 紀伊、若桜、小豆島集団)、アカゲザル 54 個体(中国、インド集団)について は 2008・2009 年、幸島に生息するニホンザル 81 個体については 2007 年の検診 時に採取された血液を試料として使用した。下北、沼田、岡崎、香美、高岡集 団、計 148 個体については、自治体の許可を得て有害駆除された個体の試料収 集、個体群管理を行っている機関の協力を得て試料を分与していただいた。三 重集団 78 個体については、ニホンザルの保護管理を行う団体が定期的に実施し ている個体群調査(計測、採血、発信機の装着など)の際に得られた血液を分 与していただいた。金華山集団 9 個体については、風張喜子博士(京都大学野 生動物研究センター)より個体同定済みのフンから抽出した DNA を提供いただ いた。
21
Japan)および DNeasy Blood & Tissue Kit(Qiagen, Hilden, Germany)を用いて DNA を抽出した。50 µL の Buffer ATE で溶出したのち、NanoDrop 1000(Thermo Fisher Scientific, MA USA)を用いて吸光度に基づく方法で DNA 濃度を測定した。
2.3.2. TAS2R38 塩基配列シークエンスとハプロタイプ推定
ニホンザルの TAS2R38 領域全長(1002 bp)を、上流および下流のノンコーデ ィング配列に相補的なプライマーを用いて PCR 増幅し、ダイレクトシークエン スを行った。プライマーは、アカゲザル全ゲノム配列(MGSC Merged 1.0/rheMac2) に基づいて Primer3Plus(http://www.bioinformatics.nl/primer3plus/)を利用して設 計した(表 2)。PCR のための酵素は ExTaq DNA polymerase(Takara Bio Inc., Shiga, Japan)を用いた。25 µL の混合液について、0.625 U の酵素と 2 mM の反応バッ ファー、0.2 mM の dNTP、各 0.2 mM のプライマー、1–10 ng の鋳型 DNA の組 成で反応を行った。反応条件は、はじめに 10 分間 94 ºC で変性し、その後、変 性 10 秒 94 ºC、アニーリング 30 秒 56 ºC、伸長 1 分 72 ºC、の条件で 35-40 サ イクル行い、最後に 10 分間 72 ºC で伸長を行った。1 %アガロースゲルを用い て、PCR 増幅産物 5 µL を 20 分間 100 V で電気泳動して、増幅された約 1 kbp の バンドを確認することで PCR 反応の成否を確認した。成功した残りの PCR 増幅 産物は ExoSAP-IT(Affymetrix Inc., Santa Clara, CA, USA)またはイソプロパノー ル沈殿法により精製した。最後に、BigDye Terminator v3.1 Cycle Sequencing Kit および 3130 Genetic Analyzer(Applied Biosystems, Foster City, CA, USA)を用いて 塩基配列の解析を行った。その際には、PCR 増幅に用いたプライマーおよび遺 伝子領域内部に作成したプライマーを用いた(表 2)。出力されたクロマトグラ ムは ATGC ソフトウェア(Genetyx Corporation, Tokyo, Japan)に取り込んで
22
PHASE v2.1 ソフトウェア(Stephens and Donnelly 2003; Stephens et al. 2001)を用 いてハプロタイプの再構築を行った。このとき、推定確率が 95 %より低い塩基 部位に関して、TOPO TA Cloning Kit(Invitrogen Corporation, CA, USA)を用いて クローニングベクターを作成し、ヒートショックで大腸菌に導入して、YTA 寒 天培地上でクローンに由来するコロニーを作成した。コロニーを直接鋳型とし て、M13 プライマーを用いて ExTaq 酵素で PCR 増幅し、上に示した塩基配列解 読法で各対立遺伝子の配列を決定した。
2.3.3. TAS2R38 アリルの進化解析
ニホンザル 597 個体の TAS2R38 遺伝子配列について、DnaSP v5.1(Librado and Rozas 2009)を用いて詳細な進化解析を行った。まず、TAS2R38 の遺伝子多様性 レベルを明らかにするために、塩基多様度π およびワッターソン θ(Nei and Li 1979; Watterson 1975)を計算した。そして中立性の検定を行うために、Tajima’s D (Tajima 1989)の値を算出した。そして TAS2R38 各アリル間の進化的な関係を 示すため、NETWORK v4.6 ソフトウェアを用いて中央結合(median-joining;MJ) ネットワークを構築した(Bandelt et al. 1999)。アウトグループとして、マント ヒヒ(Papio hamadryas)の配列(アクセッション番号 AY724835.1)を用いた。
2.3.4. 培養細胞を用いた苦味受容体 TAS2R38 の機能解析 決定した TAS2R38 の各アリルの PTC への反応性を明らかにするために、培養 細胞に各アリルを持つ受容体を発現させてカルシウムイメージング法により反 応性を計測する機能解析実験を行った(Sakurai et al. 2010)。ニホンザルの主要 なアリル Mf-A(最も高頻度のアリル)、Mf-B、Mf-C、Mf-K およびアカゲザル Mm-a の 5 つのアリルの反応性を測定した。まず、上記で作成したそれぞれのアリル
23
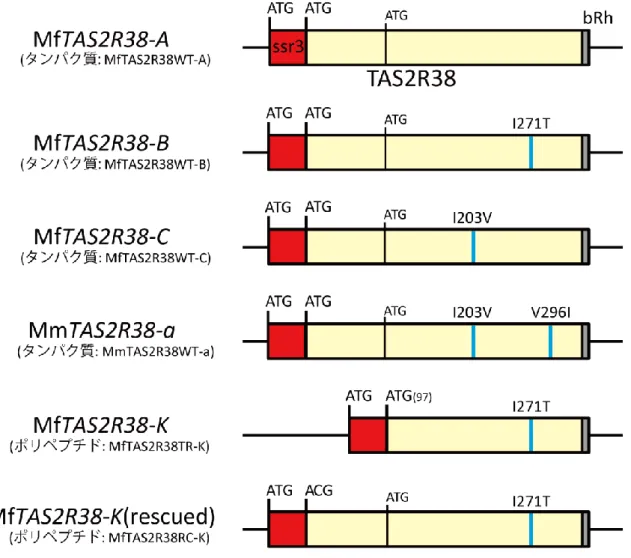
の PCR 増幅産物の遺伝子領域 3’末端側にウシロドプシン(bRh)C 末端の 8 ア ミノ酸配列を付加した。その後、bRh を付加した TAS2R38 フラグメント、ラッ トのソマトスタチン受容体(ssr)の 5’末端側 45 アミノ酸の二つの配列をライゲ ーションキット Geneart (Invitrogen)を用いて、pEAK10 発現ベクター(Edge Biosystems, Gaithersburg, MD, USA)に挿入した(図 3)。
TAS2R38 開始コドン変異はチンパンジーにおいても観察されているが、受容
体活性は下流の開始コドン(M97)から翻訳されてつくられる短いポリペプチド を用いて計測されている(Wooding et al. 2006)。本研究でもこの先行研究を参考 にして発現ベクターMfTAS2R38-K を作成した。この発現ベクターが生成するポ リペプチド(MfTAS2R38TR-K; truncate type)は、野生型アリルのタンパク質 (MfTAS2R38WT; wild type)に比べて初めの 96 アミノ酸分短くなっている。ま た、コントロールとして、遺伝子領域の上流に付加したソマトスタチン受容体 の開始コドン ATG から翻訳することが予想される MfTAS2R38-K(rescued)を作成 した。すべてのプラスミド全長配列の塩基配列を解読し、PCR 増幅の際のエラ ーがないことを確認した。G タンパク質ベクターは名古屋市立大学の植田教授 らの考案したキメラGα サブユニット Gα16gust44(Ueda et al. 2003)のベクター を東京大学の阿部啓子教授から分与していただき、発現実験に用いた。 受容体活性解析用の培養は、ヒト胎児腎細胞(HEK293T)を CO2インキュベ
ーター(37 ºC、CO2 5 %)内で 10 %ウシ胎児血清(Life Technologies, Grand Island,
NY)を加えた Dulbecco’s modified Eagle’s medium(DMEM; Sigma-Aldrich, Tokyo, Japan)培地を用いておこなった。HEK293T 細胞はデューク大学の松波宏明准教 授から分与していただいたものである。HEK293T 細胞を 35 mm ディッシュに 橎種し、その後、Lipofectamine 2000 (Invitrogen)を用いて、G タンパク質 Gα16gust44 の発現ベクターと、TAS2R38 の各発現ベクターを細胞に同時に遺伝
24
子導入した。遺伝子導入の 6 時間後に、細胞を 96-well lumox multiwell plate (SARSTEDT AG & Co., Nümbrecht, Germany)にまき直し、引き続き 18-20 時間 培養した。培養後、それぞれのウェルを HEPES バッファー(130 mM NaCl, 10 mM glucose, 5 mM KCl, 2 mM CaCl2, 1.2mM MgCl2, 10 mM HEPES, pH 7.4)で洗浄した
後、5 μM fluo-4 AM(Dojindo Laboratories, Kumamoto, Japan)を滴下した。プレ ートを 27 ºC 遮光下で 45 分間インキュベートした後に、FlexStation 3(Molecular Devices, Inc., Sunnyvale, CA, USA)を用いて蛍光強度の測定を 2 秒間隔で行った。 初めに 20 秒間ベースラインの測定をした後、HEPES バッファーに溶解させた PTC 溶液(Sigma-Aldrich, Tokyo, Japan)を滴下し、その後 100 秒間、蛍光強度を 測定した。
蛍光強度は F 値で示され、反応性は蛍光強度増加量を反応前蛍光強度で割っ たΔF/F 値 [ΔF/F = (F − F0)/F0] で評価した。独立した 3 回の実験で得られた
ΔF/F 値を、式 f(x) = Imin + [Imax − Imin/(1 + (x/EC50)h] で示される曲線に近似した。
このとき、PTC 濃度を x、半数効果濃度を EC50、h をヒル係数とした。R v2.14.0 ソフトウェア(http://www.r-project.org/)を用いて、非線形最小二乗法(Levenberg– Marquardt algorithm)により曲線近似およびパラメーターの推定を行った。 2.3.5. リンゴ片を用いた定性的な PTC 苦味感受性評価 TAS2R38 開始コドンに変異をもつニホンザルが、PTC の苦味を感じるかどう かを明らかにするために、先行研究を参考にしてリンゴ片を用いた行動実験を 行った(Chiarelli 1963;Wooding et al. 2006)。実験対象は個別ケージで飼育されて いるニホンザル 7 個体で、TAS2R38 の開始コドンが ATG(野生型)のホモ接合 型 4 個体(Mf-A/Mf-B 型 3 個体、Mf-D/Mf-F 型 1 個体)、ACG(変異型)ホモ接 合型 3 個体(Mf-K/Mf-K 型 3 個体)であった。リンゴ片(3 cm × 1 cm × 1 cm)を
25 250 mL の PTC 溶液 2.0 mM またはコントールの水道水に一晩浸しておいた。こ れらのリンゴ片どちらか一つを各個体のエサ箱に置いた。実験者のいる前では リンゴ片を食べない個体がいるため、実験者はリンゴを置いた直後に退出する。 2 分後に飼育室に入り、エサ箱の中や飼育室の床のリンゴの有無を確認し、記録 した。この時、残っているリンゴはサイズに応じ、摂食割合を 0、0.5、1 と記録 する。その後、先程のリンゴとは別の溶液に浸したリンゴを与え、同様に摂食 の有無を確認、記録した。ここまでを 1 試行とし、この試行を 10 試行繰り返し、 各リンゴに対する摂食割合を求めた。先に与えるリンゴの種類は固定せず、10 試行のうち流動的に変更して与えた。なお、実験中のサルの様子は固定ビデオ カメラにより録画した。 2.3.6. 二瓶法による定量的な PTC 苦味感受性評価 各遺伝子型をもつニホンザルの PTC 苦味感受性を定量的に評価するために、 霊長類研究所の個別ケージで飼育されているニホンザル 7 個体を対象に、二瓶 法による苦味感受性の評価を行った。7 個体中、4 個体は TAS2R38 開始コドン ATG のホモ接合型、1 個体は ATG、ACG のヘテロ接合型(Mf-B/Mf-K 型)、2 個 体は ACG のホモ接合型であった。これらのニホンザルは通常、自動給水設備に より給水されているが、実験中の 4 時間のみ給水設備の給水を止め、給水瓶に より十分量給水した。計測には 5 種類の濃度(1、10、100、250、1000 μM)の PTC 溶液を用いた。500 cc サル用給水瓶を二本用意し、片方には蒸留水、もう 一方には特定の濃度の PTC 溶液を 500 cc 入れ、これらの給水瓶を各個体のケー ジに固定した。4 時間後に各ボトルの残りの水の量を測定し、各溶液の飲水量を 記録した。1 日につき 1 試行のみ、各濃度について 6 試行ずつ行い、PTC 溶液の 左右の位置は各位置 3 回ずつランダムの順番で設置した。各濃度において、総
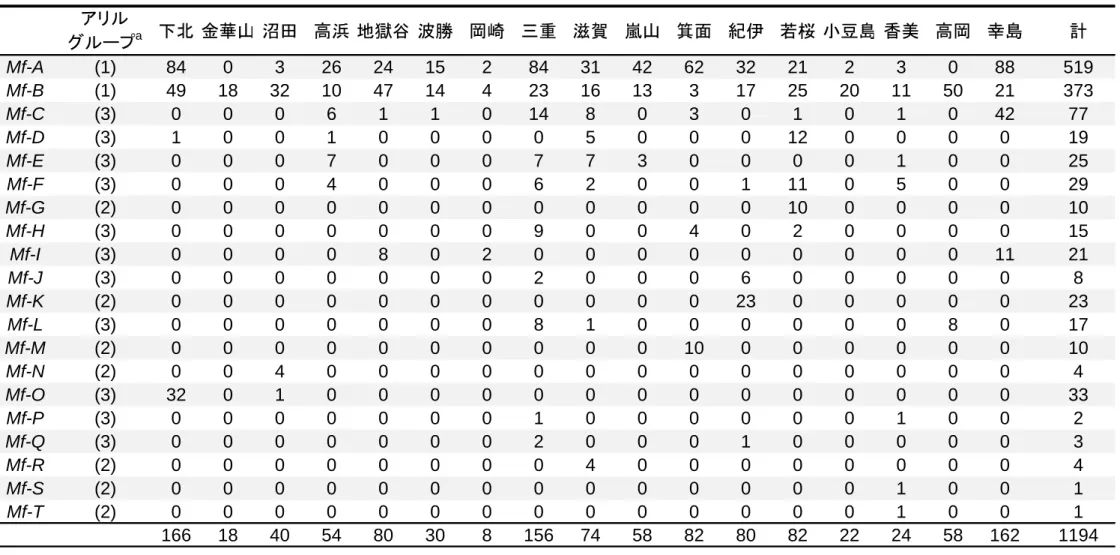
26 飲水量に対する PTC 溶液の飲水量の割合を求めた。この値の 6 試行の平均値に ついて、機能解析実験と同様に、式 f(x) = 0.5/[1 + (x/EC50)h] を用いて曲線近似お よびパラメーターの推定を行った。 2.4. 研究の結果 2.4.1. ニホンザル TAS2R38 の種内多様性 ニホンザル 597 個体、アカゲザル 54 個体について、1002 bp からなる TAS2R38 (同義置換サイト 239、非同義置換サイト 760、終止コドン 3)の塩基配列を決 定した。その結果、ニホンザルでは遺伝子領域中に 3 か所の同義置換、12 か所 の非同義置換を同定した。これらの同定した 15 か所の塩基置換サイトをもとに して 20 種類の TAS2R38 アリルが推定され、Mf-A~T と名付けた(表 3; なお、本 論文ではアリル名、ハプロタイプ名を示す際にはイタリック体を用いる)。これ らの 20 種類のアリルをアリルの地域分布に基づいて 3 つのグループに分けた (表 4)。一つ目は Mf-A と Mf-B のみを含むグループで、これらのアリルは多数 の集団で観察され、それぞれの集団内で高い頻度を示した。二つ目のグループ は、Mf-G、Mf-K、Mf-M、Mf-N、Mf-R、Mf-S、Mf-T の 7 つのアリルを含んだ。こ れらのアリルは地域特異的に一つの集団のみで観察された。これら以外の 11 ア リルは複数の集団で観察され、それぞれの集団では低い頻度を示した。 ニホンザルは 31-88 万年前という進化的には比較的最近にアカゲザルから分 岐した種であるため(Marmi et al. 2004)、これらの種間では遺伝子配列が似てお り、系統関係も複雑になっていることが予測される。そのため、アカゲザルで 決定した 10 アリル、ニホンザルの 20 アリルを用いて、進化的系統関係を示す MJ ネットワークを作成した(図 4)。予測通り両者のアリルは単系統にはならず、
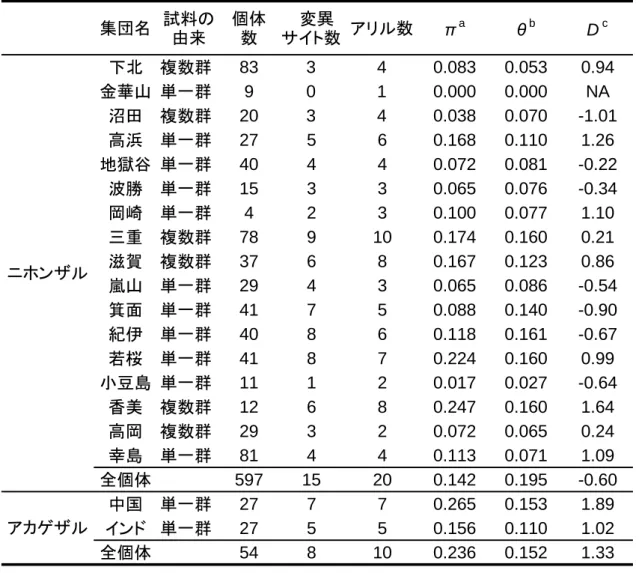
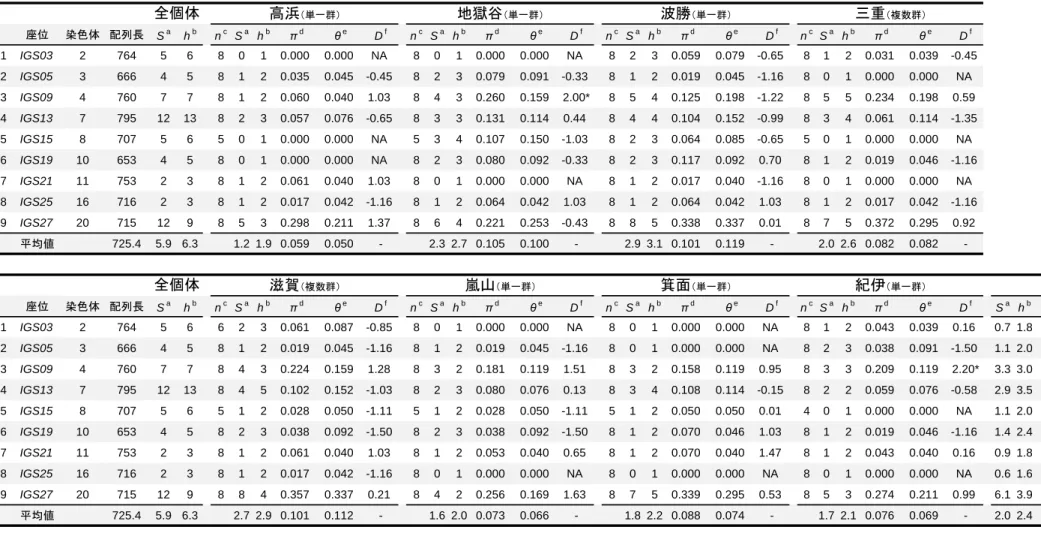
27 複雑に交わっており、ニホンザルのアリルはアカゲザル Mm-a アリルを挟むよう にして 2 つのクラスターを形成していた。しかし、ニホンザルとアカゲザルで 共有するアリルは存在しなかった。この図から、Mm-a を共通祖先アリルとして、 ニホンザルのアリルが生じ、そこから変異を蓄積してそれぞれのアリルを形成 したことが推測された。 TAS2R38 の多様性や自然選択の影響を把握するために、塩基多様度 π および Tajima’s D 値を算出した(表 5)。集団ごとのπ 値は、0 %(金華山)から 0.247 % (香美)と多様な値を示した。ニホンザル全個体での π は 0.142 %で、ヒトの
0.15 %と同程度の値であった(Kim et al. 2005)。Tajima’s D の値はそれぞれの集 団、ニホンザル全体でも有意な値ではなく、現在のデータからは、TAS2R38 の 中立性を否定する結果は得られなかった。
2.4.2. TAS2R38 開始コドン消失変異の発見
紀伊集団のみに存在したアリル Mf-K では開始コドン ATG に変異が生じてお り、ACG となっていた。同様の開始コドンの変異はチンパンジーの TAS2R38 で も観察されており、チンパンジーの場合は AGG となっていた(Wooding et al. 2006)。チンパンジーでは、開始コドン AGG のアリルをホモ接合で持つ個体は、 TAS2R38 のリガンドとなる苦味物質 PTC に対する苦味感受性が低下することが 示されている。そのため、ニホンザル TAS2R38 の Mf-K アリルも同様に苦味感受 性が低下していることが推測された。また、Mf-K アリルは、Mf-A と比較した時、 Mf-B と共通の塩基置換(T812C)をもっているため、ネットワーク解析では Mf-K は Mf-B から派生したアリルであることが示された(図 4)。そのため、この Mf-K アリルはアカゲザルのアリルとは独立しており、ニホンザルとアカゲザルが種 分岐したのちに、ニホンザルのみで生じたアリルであることが示唆された。
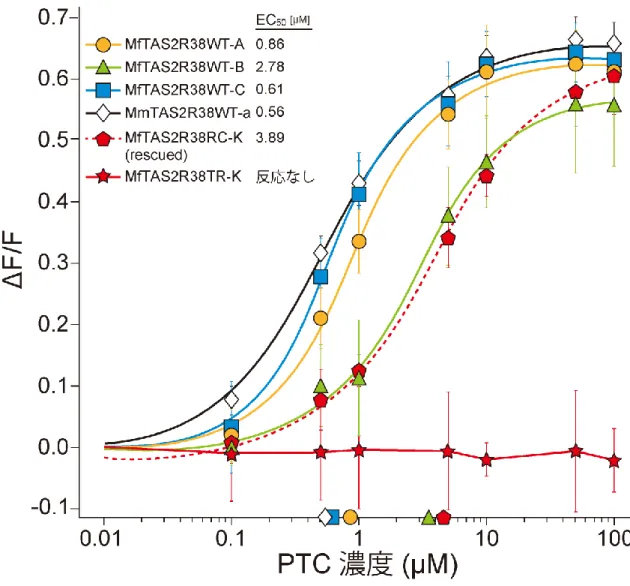
28 2.4.3. TAS2R38 アリルの受容体活性 TAS2R38 の各アリルがコードする受容体タンパク質の活性を調べるために、 培養細胞にそれぞれのアリルを発現させて受容体としての機能を測定した。こ の解析には、ニホンザルにおいて比較的高頻度でみられた 3 アリル(Mf-A、Mf-B、 Mf-C)、開始コドン消失変異をもつ Mf-K、アカゲザルの Mm-a の 5 種類のアリル の発現ベクターを作成して受容体タンパク質を発現させ(MfTAS2R38WT-A、-B、 -C、MfTAS2R38TR-K、MmTAS2R38WT-a)、PTC 溶液を用いて受容体活性を測 定した(図 5)。まず、開始コドンに生じた変異が受容体活性を変えるかどうか を調べた。その結果、333 アミノ酸からなる受容体を生成すると考えられる 4 種 類のアリル(Mf-A、Mf-B、Mf-C、Mm-a)を発現させた受容体はすべて PTC に 対して反応性を示した。一方で、開始コドンに生じた変異により、始めの 96 ア ミノ酸を失ったポリペプチド(MfTAS2R38TR-K)では PTC に対する反応を示さ なかった。Mf-K アリルの上流に開始コドンを付加させて生成させた受容体 (MfTAS2R38RC-K; rescued type)では PTC に対する反応性を示した。Mf-A、Mf-B、
Mf-C、Mm-a アリルは機能的な受容体をコードしているが、Mf-K アリルがコー ドするポリペプチドは受容体機能を持たなかった。以上の結果から、開始コド ン消失変異は受容体活性を消失させていることが示唆された。 次に、4 種類の機能的な受容体 MfTAS2R38WT-A、-B、-C、MmTAS2R38WT-a についての EC50値(半数効果濃度)を比較することで、アミノ酸置換が受容体 活性に与える影響を調べた。MfTAS2R38WT-A、-C、MmTAS2R38WT-a の 3 種類 のアリル間では EC50値に差が見られなかった。そのため 203 番目(Val203Ile) と 296 番目(Val296Ile)のアミノ酸置換は受容体活性に影響を及ぼしていないと 考えられる。一方で、MfTAS2R38WT-B の EC50値は上の 3 種類のアリルに比べ
29 て 3.2-5.0 倍高かった。また、通常の開始コドンの位置よりも上流に開始コドン を付加させて作成した MfTAS2R38RC-K の EC50値は MfTAS2R38WT-B と同程度 の値を示した。この両者のアリルは他のアリルと比較して 271 番目のアミノ酸 に同じ塩基置換(Ile271Thr)を持っている。以上のことから、この 271 番目の アミノ酸置換は TAS2R38 の受容体活性に若干の低下を引き起こすと考えられる。 2.4.4. Mf-K アリルをもつ個体の PTC 感受性 TAS2R38 遺伝子配列を決定したニホンザルを対象に、リンゴ片を用いた苦味 感受性の定性的な評価を行った(図 6)。水に浸したリンゴ(コントロール)と PTC 溶液に浸したリンゴを与え、それぞれのリンゴを食べた割合の平均値を比 較したところ、TAS2R38 開始コドン ATG のホモ接合型 4 個体では、コントロー ルのリンゴに対して PTC に浸したリンゴを食べた割合が有意に低かった(P < 0.05、ステューデント t 検定)。一方で、ACG のホモ接合型 3 個体では 2 種類の リンゴを食べた割合に有意な差が見られなかった(図 6B)。以上の結果から、 開始コドン消失変異は行動レベルでも PTC 感受性を低下させていることが明ら かになった。 次に、より定量的に開始コドン消失変異による苦味感受性低下を評価するた めに、TAS2R38 開始コドン ATG ホモ接合型 4 個体、ACG ホモ接合型 2 個体、 ATG/ACG ヘテロ接合型 1 個体を対象にして二瓶法による給水実験を行った(図 7)。PTC 溶液の飲水割合がチャンスレベルの半分である 0.25 になるときの PTC 濃度(半数効果濃度: EC50)を算出したところ、ATG ホモ接合型 4 個体の平均値
は 18.9 ± 22.1 µM であった。PTC 感受性を持つ個体の中でもこの濃度にばらつき (1.8~51.1 µM)が見られた結果は、ヒトを対象にした実験と同様の傾向であっ た(Wooding et al. 2010)。一方で、ACG ホモ接合型 2 個体の EC50値の平均値は
30 1542.1 ± 8.9 µM であり、これは ATG ホモ接合型個体よりも約 80 倍も高い値で あった。ATG/ACG ヘテロ接合型個体での EC50値は 179.2 µM であり、それぞれ のホモ接合型個体の平均値の中間的な値であり、この結果はヒトでの行動実験 結果と同様の傾向であった(Bufe et al. 2005)。 2.5. 考察 2.5.1. ニホンザルにおける PTC 苦味感受性変異の発見 ニホンザル 597 個体に対して TAS2R38 の配列を決定したことにより、開始コ ドンに生じた突然変異を発見した。その後の表現型解析により、この開始コド ンの変異は TAS2R38 の受容体活性を低下させており、この変異をホモ接合個体 で持つ個体は PTC 感受性が低下していることを明らかにした。 ネットワーク解析から、PTC 非感受性アリル Mf-K はニホンザルとアカゲザル が分岐した後に、ニホンザルで独立に生じたことが示唆された。また、Mf-K が 存在した紀伊地方では、ニホンザルとタイワンザル(Macaca cyclopis)の交雑種 が発見されている(川本ら 2001)。この外来種からの影響を把握するために、 以前、霊長類研究所で飼育されていたタイワンザルの試料を用いて TAS2R38 の 配列解析を行ったところ、タイワンザルの配列はアカゲザルのアリル Mm-b と一 致した(表 3、図 4)。タイワンザルの配列(Mm-b)と非感受性アリル Mf-K と は 5 つの塩基の違いがあるため、Mf-K がタイワンザル由来である可能性は非常 に低いと考えられた。 背景で示したヒトとチンパンジーに続いて、ニホンザルでも TAS2R38 の塩基 置換が PTC 感受性変異を引き起こしていることを発見した。霊長類の中で、3 種で独立に TAS2R38 の機能喪失が生じていることは大変興味深く、さらなる検
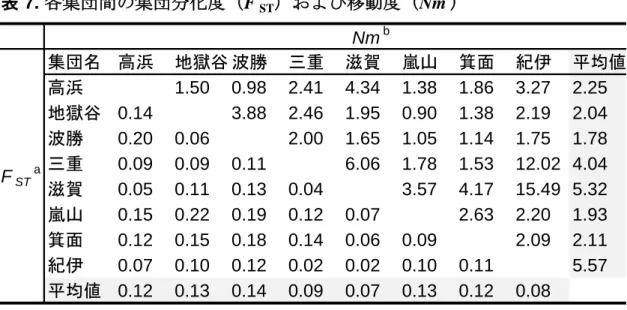
31 証が必要となる。この現象についてのより詳細な考察については、次章に示す。 2.5.2. PTC 苦味感受性変異の拡散背景に対する仮説 特定の地域集団のみで観察された集団特異的アリルは、祖先集団から分岐し た後にそれぞれの集団で生じたと考えられるため、どの集団でも低い頻度で維 持されていることが推測される。実際、これらのアリル頻度は、ニホンザル全 体で 1 %以下、それぞれの集団内でも 12 %以下と低い頻度を示した(表 3、4)。 しかしながら、PTC 非感受性アリルである Mf-K は紀伊集団内で 29 %の頻度を 示しており、他の集団特異的なアリルとは明らかに異なる分布を示した。 集団の中で偶然に機能を失った変異アリルが、淘汰されることなく集団中に 29 %という高頻度にまで拡散し、現在も維持されていることにはどのような背 景が影響しているのだろうか。可能性として 2 つの仮説が考えられる。まず一 つは、この非感受性アリルは、正の自然選択の影響を受けて集団中に拡がって 維持されているという可能性である。つまり、TAS2R38 の機能を喪失すること で、機能を保持している個体に比べて、利用できる採食品目数が増えるなどの 生存上の利点があったため、この非感受性アリルが拡散したという説である。 本来、苦味を感じることが毒性物質摂取を防ぐ大きな役割を果たしているが、 この場合では、苦味を感じられる利点よりも感じられない利点のほうが大きな 役割を果たしていると考えられる。二つ目の仮説として、この非感受性アリル は中立的に集団中に拡がったという可能性である。つまり、苦味を感じられな いということが利益も不利益も被ることがなかったため、淘汰されることも積 極的に拡散されることもなく、中立的にこのアリルが拡がったとする仮説であ る。 この二つの仮説を検証するために、Tajima’s D の値を算出し、中立性検定を行
32 ったが、現段階のデータセットにおいては、正の選択や平衡選択などの自然選 択の影響は認められず、中立性を否定することができなかった。つまり、前述 の 2 つの仮説のうち後者が支持された。しかし、ニホンザルにおける感受性変 異は紀伊地方で地域特異的にみられ、解析した他の 16 地域ではこの変異は見つ からなかった。この地方で PTC 苦味感受性変異が拡がり、維持されている背景 について、他の地域には存在しない地域特異的な要因が働いている可能性が考 えられる。そのため、次章で、この二つの仮説を検討する。
33 3. ニホンザル PTC 苦味感受性変異の急速な拡散 3.1. 研究の概要 第 2 章において、ニホンザルの苦味受容体遺伝子 TAS2R38 の多様性解析をし たところ、ニホンザルの紀伊集団のみに存在する TAS2R38 の非感受性アリル Mf-K を発見した。ヒトやチンパンジーでも同様に TAS2R38 変異により苦味感受 性に個体差が生じていることが報告されている。この変異は、ヒトでは世界の 様々な地域に存在しており、チンパンジーでもニシチンパンジーで広くみられ ている。このように同じ苦味受容体の機能が複数の霊長類種で多様化している 例は大変興味深く、その進化的な背景を探ることは重要である。 本章では、非感受性アリル Mf-K がどのようにして紀伊集団で拡がったのかを 明らかにすることを目的とした。はじめに、紀伊集団全 40 個体を対象に、 TAS2R38 上流下流領域を含む約 10 kbp の配列を決定した。その結果、40 個体が 保有する全 80 本の染色体のうち 23 本が非感受性アリルであり、その 23 本の非 感受性アリルは 10 kbp にわたって配列が完全に一致していたことから、このア リルは 13,000 年前以降に集団中に拡散したことが推測された。紀伊集団と近隣 7 集団の非コード領域の配列解析およびアリル拡散のシミュレーション解析の 結果、非感受性アリルの拡散は、紀伊集団の遺伝的特性、個体群動態および集 団間の移出入の程度から説明することはできず、中立的なアリルの拡散よりも はるかに短い時間で集団中に拡散したことが推測された。以上の結果から、非 感受性アリル Mf-K は正の自然選択の影響を受けて、紀伊集団で短期間に急速に 拡散したということが示唆された。 TAS2R38 は、アブラナ科や柑橘類の植物に含まれる苦味物質を受容する。こ れらの植物の苦味を感じにくくなることがニホンザルの環境適応を醸成し、こ のアリルが紀伊集団に拡がる要因になったことが推察された。