熊本大学学術リポジトリ
Kumamoto University Repository System
Title
強度変調放射線治療におけるフラットパネル検出器を用
いた多断面線量分布測定法の開発
Author(s)
中口, 裕二
Citation
Issue date
2014-03-25
Type
Thesis or Dissertation
URL
http://hdl.handle.net/2298/30501
Right
学位論文
Doctoral Thesis
強度変調放射線治療におけるフラットパネル検出器を用いた多断面線量
分布測定法の開発
(Development of multi-planar dose verification using a flat panel EPID for intensity-modulated radiation therapy)
中口 裕二
Yuji Nakaguchi
指導教員
荒木 不次男 教授
熊本大学大学院保健学教育部博士後期課程保健学専攻2014年3月
甲 中 表 紙
学位論文
Doctoral Thesis
論文題名 : 強度変調放射線治療におけるフラットパネル検出器を用いた多断面線量分布測定 法の開発( Development of multi-planar dose verification using a flat panel EPID for intensity-modulated radiation therapy) 著 者 名 : 中口 裕二 (単名) Yuji Nakaguchi 指導教員名 : 熊本大学大学院保健学教育部博士後期課程保健学専攻 荒木 不次男 教授 審査委員名 : 主 査 教授 村上 龍次 副 査 教授 白石 順二 副 査 教授 荒木 不次男 (署名の必要なし) 2014年3月
目 次
要旨………..….….……….….…...1 博士後期課程在籍中の論文一覧……….………….…….2 謝辞……….………..…....6 略語一覧……….………..…………7 第1章 序論 1.1 本研究の背景 1.1.1 がん治療と強度変調放射線治療……….………..8 1.1.2 強度変調放射線治療と品質保証………..……....12 1.1.3 求められる線量検証機器……….……….17 1.2 本研究の概要………...22 1.3 本研究の構成………..….….….23 第 2 章 IMRT 線量検証における 2 次元検出器間の精度比較 2.1 緒言………....….24 2.2 線量検証機器………..………....…...25 2.2.1 電離箱線量計とフィルム測定………..….…...25 2.2.2 2 次元検出器……….………..27 2.3 比較方法 2.3.1 2 次元検出器の物理特性………...….35 2.3.2 2 次元検出器を用いた IMRT 臨床例による線量検証比較………..…...35 2.4 結果 2.4.1 2 次元検出器の物理特性………..…..36 2.4.2 2 次元検出器を用いた IMRT 臨床例による線量検証比較………….….…….37 2.5 考察 2.5.1 2 次元検出器の物理特性……….……….….….41 2.5.2 2 次元検出器を用いた IMRT 臨床例による線量検証比較……….41 2.6 まとめ……….……42 第 3 章 透過型線量測定器を用いた IMRT 線量検証における精度 3.1 緒言……….………....43 3.2 比較方法 3.2.1 COMPASS のモデリング精度比較………...443.2.2 COMPASS を用いた MLC テストパターン, IMRT 臨床例による線量検証比較………..44 3.3 結果および考察 3.3.1 COMPASS のモデリング精度比較………...…..46 3.3.2 COMPASS を用いた MLC テストパターン, IMRT 臨床例による線量検証比較………..46 3.4 まとめ……….…....51 第 4 章 強度変調放射線治療におけるフラットパネル検出器を用いた多断面線量分布 測定法の開発 4.1 緒言……….………52 4.2 EPID での画像取得………..…..…...53 4.3 EPID 画像からの多断面の線量分布の取得………...53 4.4 比較方法 4.4.1 MLC テストパターンによる線量検証………..……..…57 4.4.2 IMRT 臨床例による線量検証比較……….……..58 4.5 結果 4.5.1 MLC テストパターンによる線量検証……….…...…59 4.5.2 IMRT 臨床例による線量検証比較……….….….62 4.6 考察…….………..………...…..….69 4.7 まとめ………...………...…..…...70 第 5 章 結論 5.1 研究成果の概要と結論 5.1.1 IMRT 線量検証における 2 次元検出器間の精度比較………….….….……....71 5.1.2 透過型線量測定器を用いた IMRT 線量検証における精度……….………….71 5.1.3 フラットパネル検出器を用いた多断面線量分布測定法の開発….………….72 5.2 今後の課題………..……,…..72 参考文献……….……..….….73
1
要 旨 【背景と目的】
近年,線量分布の有意性から強度変調放射治療(intensity-modulated radiation therapy; IMRT)が普及している.IMRT では計画線量の検証が必要不可欠であり,一般的に電離 箱線量計とフィルムによる測定が用いられる.しかし,線量検証に多大な労力と時間を 要し,IMRT 普及の障害になっている.このような状況で,様々な 2 次元検出器が使用 されているが,各 2 次元検出器固有の特性をよく理解して使用する必要がある.また, IMRT の普及には簡便で精度の高い線量検証システムが不可欠である.本研究では,効 率的で測定精度の高い多断面の線量分布測定法の開発を行い,臨床での有用性を示した. 【方 法】
最初に,半導体,電離箱,electric portal imaging device(EPID)を用いた 2 次元検出器 の線量特性として,線量直線性,線量率依存性,出力線量比の比較を行い,頭頸部 IMRT の臨床例 10 例を用いて線量検証の精度を比較した.次に,ビーム入射口に着脱可能な 透過型 2 次元電離箱検出器の詳細な線量特性を調べた.電離箱は検出器サイズが大きく 解像度が問題となるため,格子上の multileaf collimator(MLC)テストパターンや頭頸 部 IMRT の臨床例を用いて,解像度の線量分布への影響を他の 2 次元検出器やモンテカ ルロシミュレーション(MC)との比較から評価した.さらに,効率的な線量検証法を 目指し,EPID を用いて測定したフルエンスに幾何学的情報,出力線量比,散乱カーネ ル,絶対線量校正などの物理モデリングを加えることで,多断面の線量分布を取得する 方法を開発し,その線量特性を調べた.また,MLC テストパターンや頭頸部 IMRT の 臨床例を用いて,線量検証の精度を他の 2 次元検出器や MC と比較した. 【結果と考察】 各 2 次元検出器による線量特性の比較では,出力線量比で EPID は電離箱線量計に比 べて最大約 7%の過大評価となった.他の 2 次元検出器は 2%以内で一致した.臨床例 ではガンマ評価で若干差が生じた.これは,各 2 次元検出器の構造的な特徴に起因する. 透過型 2 次元電離箱検出器では,検出器の物理的な解像度はフィルムや EPID より低い が,MLC テストパターンや臨床例の線量分布の結果はフィルムや EPID と同等であった. 次に,EPID を用いた多断面線量分布は,MLC テストパターンと臨床例を用いた他の 2 次元検出器や MC との比較において 3%以内で一致した.臨床例では,ガンマ評価(3 mm/3%, 閾値 30%)で 90%以上のパス率であった. 【結 論】 本研究では,2 次元検出器の特性を明らかにし,EPID で測定したフルエンスを物理 モデリングによって吸収線量に変換し,EPID による線量分布測定を可能とした.また, 多断面の線量分布を取得する手法を開発し,EPID による多断面線量測定法を実現した. EPID を用いた IMRT の線量検証は,多大な労力と時間の低減が期待できる.
2
博士後期課程在籍中の論文一覧 筆頭論文 計 7 編 6 軸カウチの線量補正に関する検討 中口 裕二, 村上 龍次, 丸山 雅人, 筧 清孝, 永末 望, 荒木 不次男. 日本放射線技術学会雑誌. 2011;67(12):1592-7.Dose verification of IMRT by use of a COMPASS transmission detector.
Nakaguchi Y, Araki F, Maruyama M, Saiga S.
Radiol Phys Technol. 2012 Jan;5(1):63-70.
IMRT 線量検証における二次元検出器間の精度比較
中口 裕二, 荒木 不次男, 雑賀 俊二, 河野 友宏, 丸山 雅人, 筧 清孝, 永末 望, 橋田 昌弘.
日本放射線技術学会雑誌. 2012;68(4):443-52.
Image Guided Radiation Therapy における 6 軸位置補正法の検討 中口 裕二, 荒木 不次男, 河野 友宏, 丸山 雅人.
日本放射線技術学会雑誌. 2012;68(11):1492-8.
Real-time Position Management System を用いた呼吸同期による肺の体幹部定位放射線治 療の品質保証
中口 裕二, 荒木 不次男, 河野 友宏, 丸山 雅人. 日本放射線技術学会雑誌. 2012;68(11):1519-24.
Development of multi-planar dose verification by use of a flat panel EPID for intensity-modulated radiation therapy.
Nakaguchi Y, Araki F, Kouno T, Ono T, Hioki K.
Radiol Phys Technol. 2013 Jan;6(1):226-32.
最新の 80 対マルチリーフコリメータの物理特性 中口 裕二, 大野 剛, 荒木 不次男, 丸山 雅人. 日本放射線技術学会雑誌. 2013 Jul;69(7):778-83.
3
共著論文 計 10 編
Longitudinal changes over 2 years in parotid glands of patients treated with preoperative 30-Gy irradiation for oral cancer.
Tomitaka E, Murakami R, Teshima K, Nomura T, Nakaguchi Y, Nakayama H, Kitajima M, Hirai T, Araki Y, Shinohara M, Yamashita Y.
Jpn J Clin Oncol. 2011 Apr;41(4):503-7.
Recurrence patterns of glioblastoma treated with postoperative radiation therapy: relationship between extent of resection and progression-free interval.
Murakami R, Hirai T, Nakamura H, Furusawa M, Nakaguchi Y, Uetani H, Kitajima M, Yamashita Y. Jpn J Radiol. 2011 Dec 20. 通常照射法におけるセットアップエラーおよび体型変化が線量分布に及ぼす影響につ いての検討 日本放射線技術学会雑誌 辻田 直子, 山口 沙希, 村上 龍次, 服部 隆史, 丸山 雅人, 中口 裕二, 筧 清孝, 斉藤 哲雄, 手島 慶子. 日本放射線技術学会雑誌. 2011;67(12):1559-64.
FDG-PET/CT-based Gross Tumor Volume Contouring for Radiation Therapy Planning: An Experimental Phantom Study.
Toya R, Murakami R, Tashiro K, Yoshida M, Sakamoto F, Kawanaka K, Shiraishi S, Nakaguchi
Y, Tsujita N, Oya N, Tomiguchi S, Yamashita Y.
J Radiat Res (Tokyo). 2012 Mar 4.
位置照合用 Cone-beam CT を応用した適応放射線治療の検討
丸山 雅人,村上 龍次,中口 裕二,筧 清孝,竹永 枝里子,辻田 直子,大村 祐貴, 高田 橋司,横尾 崇幸,斉藤 哲雄,松山 知彦.
日本放射線技術学会雑誌. 2012;68(2):162-8.
Histopathological Changes in Parotid and Submandibular Glands of Patients Treated with Preoperative Chemoradiation Therapy for Oral Cancer.
Teshima K, Murakami R, Yoshida R, Nakayama H, Hiraki A, Hirai T, Nakaguchi Y, Tsujita N, Tomitaka E, Furusawa M, Yamashita Y, Shinohara M.
4
Image Guided Radiation Therapy(IGRT)における位置補正精度と患者スループットの装 置間比較 竹永 枝里子,中口 裕二,丸山 雅人,永末 望,筧 清孝,甲斐 祐大,河野 友宏, 佐々木 幹治,橋田 昌弘. 日本放射線技術学会雑誌. 2012;68(10):1327-32. 画像誘導放射線治療における kV-cone beam CT の 被ばく線量の評価 河野 友宏, 荒木 不次男, 中口 裕二, 大野 剛. 日本放射線技術学会雑誌. 2013 Jul;69(7):753-60. 複数の治療計画装置を用いた 前立腺 IMRT 計画の比較検討 佐々木 幹治, 生島 仁史, 中口 裕二, 岸 太郎, 木村 雅司, 坂東 良太, 笈田 将 皇. 日本放射線技術学会雑誌. 2013 Jul;69(7):761-72.
3D evaluation of 3DVH program using BANG3 polymer gel dosimeter. Watanabe Y, Nakaguchi Y.
5
本論文の主な内容を構成する論文 IMRT 線量検証における二次元検出器間の精度比較 中口 裕二, 荒木 不次男, 雑賀 俊二, 河野 友宏, 丸山 雅人, 筧 清孝, 永末 望, 橋田 昌弘. 日本放射線技術学会雑誌. 2012;68(4):443-52.Dose verification of IMRT by use of a COMPASS transmission detector.
Nakaguchi Y, Araki F, Maruyama M, Saiga S.
Radiol Phys Technol. 2012 Jan;5(1):63-70.
Development of multi-planar dose verification by use of a flat panel EPID for intensity-modulated radiation therapy.
Nakaguchi Y, Araki F, Kouno T, Ono T, Hioki K.
6
謝 辞 本研究を行うにあたり,終始熱心なるご指導とご鞭撻を賜りました熊本大学医学部保 健学科 荒木不次男教授に心から御礼申し上げます. また,今回の実験を行わせていただいき,小生の博士号取得を援助していただいた熊 本大学医学部附属病院のスタッフの方々をはじめ,本研究に協力いただいたすべての皆 様に深謝いたします.7
略語一覧
MC monte carlo simulation モンテカルロシミュレーション
IMRT intensity modulated radiation therapy 強度変調放射線治療 MLC multileaf collimator マルチリーフコリメータ TPS treatment planning system 放射線治療計画装置 3D-CRT three-dimensional conformal radiation therapy 3 次元原体放射線治療 QA quality assurance 品質保証
QC quality control 品質管理 SRS stereotactic radiosurgery 定位放射線手術 SRT stereotactic radiation therapy 定位放射線治療 SBRT stereotactic body radiation therapy 体幹部定位放射線治療 IGRT image guided radiation therapy 画像誘導放射線治療 AAPM American association of physicists in medicine 米国医学物理学会 CT computed tomography コンピュータ横断面撮像 DVH dose volume histogram 線量-体積ヒストグラム EPID electric portal imaging device
MU monitor unit モニターユニット DTA distance to agreement 距離差
aSi amorphous silicon アモルファスシリコン CU calibration unit
DD dose difference 線量差 Th threshold 閾値
TMR tissue maximum ratio 組織最大線量比
VMAT volumetric modulated arc therapy 回転強度変調放射線治療 SID source-imager-distance 線源検出器間距離 SSD source-surface-distance 線源表面間距離 SAD source-axis-distance 線源回転軸間距離
8
第1章 序 論
1.1 本研究の背景 1.1.1 がん治療と強度変調放射線治療(IMRT) 悪性新生物は,1981 年を境に我が国の死亡原因の第 1 位を占めており,厚生労働省 「人口動態統計月報年計」(1),図 1-1によれば,3 大死因とよばれる心疾患や脳血管疾 患と比較しても 2 倍以上の死亡数であり,2010 年には 35 万人に達し,総死亡数の約 30% を占めている. この悪性新生物に対する治療法には手術療法,放射線治療,化学療法などがあり,放 射線治療は,がん治療の大きな柱となっている.わが国における放射線治療患者数の推 移は急激に増加する傾向にあり,日本放射線腫瘍学会構造調査 2009(2),図 1-2によれ ば,この 10 年間で,全国の放射線治療施行症例数は,実患者数にして,年間 12 万人か ら 24 万人への増倍が報告されている. 図 1-1 主な死因の死亡数・死亡率(人口 10 万対).9
図 1-2 日本における放射線治療施行患者数の現状と将来推定. また,患者数の増倍の背景には,下記の要因が考えられる. (1)高齢化によるがんの罹患患者数自体の増加 (2)がんの予後向上に伴う複数回治療患者の増加 (3)がん診断の向上による放射線治療の対象となりやすい早期がんの増加 (4)高齢化による手術不適応がん患者の増加 (5)がん治療法の選択肢増加に対する患者自身による要求 (6)集学治療の普及 (7)がん治療後の機能形態温存の重視 (8)がん治療の低侵襲性の重視 (9)医療経済への関心の高まり 以上の因子が複合的に寄与して,爆発的な放射線治療患者の増加が起こっていると考え られている. この増大する放射線治療患者に対応して,直線加速器(リニアック),マルチリーフ10
コリメータ(multileaf collimator; MLC),放射線治療計画装置(treatment planning system; TPS)の線量計算精度,最適化計算精度などの向上により,高精度放射線治療といわれ る強度変調放射線治療法(intensity modulated radiation therapy; IMRT)が普及してきてい る.IMRT では,一般的な TPS を用いた 3 次元放射線治療(three-dimensional conformal radiation therapy; 3D-CRT)と比較し,病巣に対する線量分布の集中性を確保しつつ,リ スク臓器の保護が可能であり,従来の照射法に比べ,理想的な線量分布での治療が可能 である(3-8),図 1-3,1-4にそれぞれ示すように,ターゲットの形状が不整形で複雑な 場合,従来法の放射線照射法では,腫瘍周囲の正常組織や臓器にも腫瘍と同じ線量が照 射されてしまい,腫瘍制御率を高率に維持しながら合併症を低く抑えることが困難であ った.IMRT は,腫瘍のみに放射線を集中して照射できる革新的な照射技術であり,こ れにより合併症を軽減しながら根治性を高めるといった従来では実現不可能であった 放射線治療を可能とした. 図 1-3 従来の放射線治療と IMRT. IMRT では,各ビームにおいて同一ビーム内で線量強度の変調を行っている.各門の合 算では,ターゲットの形に合わせた線量分布が形成可能である. 従来の放射線治療(3D-CRT) 強度変調放射線治療(IMRT)
治療線量域
11
図 1-4 前立腺がんに対する従来の放射線治療(3D-CRT)と IMRT(臨床例). 標的以外の部位の線量,とくにリスク臓器の直腸線量が IMRT で 3D-CRT より低くなる. IMRT は,強度変調放射線治療における物理・技術的ガイドライン 2011(9)では下 記のように定義されている. IMRT とは,「リスク臓器等に近接する標的への限局的な照射において,空間的・時 間的に強度変調を施した線束を利用し,逆方向治療計画にてリスク臓器等を避けながら 標的形状と一致した最適な三次元線量分布を作成し治療する照射療法」と定義する.た だし,IMRT 照射技術の多様化に対応し,以下の照射方法を用いて照射した場合とする. (1) 3 種以上の強度変調を施した線束を利用し,3 方向以上の照射角度から照射する. (2)強度変調を施した線束を利用し,運動しながら照射する. (3)照射中心を持たない多数のナロービームを利用して,強度変調を行い集光的に照 射する また,IMRT の種類には (1)物理的補償フィルターを用いた方法 (2)MLC を用いた方法 (3)バイナリーコリメータを用いた方法 (4)ロボット型治療装置を用いた方法 などがあり,治療成績の向上が多数報告(3-8)されている.本邦では,(2)MLC を用 いた方法が多くの施設で行われており,本論文で取り扱う IMRT も全て,(2)MLC を 用いた方法での IMRT である.IMRT
3D-CRT
12
1.1.2 強度変調放射線治療と品質保証
放射線治療には,品質保証,管理(quality assurance, quality control; QA/QC)が必須で ある.適正な線量を適正な照射位置に投与するには,治療機器,治療手順の適正な QA/QC が必要となる.
放射線治療は,90 年代からコンピュータの発展とともに技術革新が進み,IMRT,定 位放射線治療(stereotactic radiosurgery,stereotactic body radiation therapy;SRS/SBRT), 画像誘導放射線治療(image guided radiation therapy; IGRT)を代表とする高精度放射線 治療が可能となってきた.一方で,放射線治療は,コンピュータ制御の依存度が高まり, 各過程のブラックボックス化・複雑化が顕著な状況である.このような高精度放射線治 療を取り巻く状況の中で安全を担保するために,精度管理に課せられる責務は大きい. 新しい技術に対するリスク対策,複雑化する医療の中でチーム医療としての連携,常に 変化する放射線治療に対しての柔軟な対応と論理的な考察が求められる.
1994 年に,米国医学物理学会(American Association of Physicists in Medicine; AAPM) から,包括的な放射線治療装置の精度管理に関するガイドライン,Task Group 40(TG-40) が刊行された(10).しかし,TG-40 発刊当時は,IMRT・SBRT・IGRT などの技術は存 在せず対応していない.長年,新しく開発される IMRT・SBRT・IGRT などの新技術の 精度管理は,施設独自で対応するしかない状態であった.2009 年には TG-142(11) が 刊行され,精度管理項目と許容値が照射技術別に整理され,より詳細で具体的なガイド ラインとなった.しかし,TG-142 も体系的にまとめられたガイドラインであるため, 各施設の状況に対応した具体的な精度管理法については記載されていない.そのため, 品質管理担当者を中心としたスタッフの尽力により,各施設において,各施設の責任の もと精度管理法が構築されているのが現状で,IMRT の QA のみならず,一般的な外部 放射線治療の QA/QC でさえ,時間的,技術的,人員配置の問題で十分に遂行できてい ないのが現状である. IMRT に関しては,これらのガイドラインをもとに QA を行ったとしても不十分で, IMRT 用に QA を行うことが推奨されている.IMRT の QA は多岐にわたり,実施すべ き項目として,強度変調放射線治療における物理・技術的ガイドライン 2011(9)では 下記の項目,内容を示している. 新規に放射線治療器を導入する施設の場合 ① 納入業者との IMRT システムの受け入れ試験の実施 ② 治療装置,治療計画装置の通常治療のためのコミッショニング (QA/QC のための基準値の取得,基本ビームデータの取得,治療計画装置への登録, ビームモデリング,線量検証) ③ MLC などの強度変調を施す機器に関する治療計画装置に登録すべきデータの取得 と検証
13
既に IMRT 実施可能なシステムを導入している施設で実施すべき事項 ① 治療装置の機器的特性の再コミッショニング ② 治療計画装置に登録してある基本ビームデータ,MLC に関する登録データの再コミ ッショニング ③ MLC などの強度変調を施す機器に関する治療計画装置に登録すべきデータの取得 と検証 さらに,技術面で下記の項目の整備が必要としている. ① IMRT 治療計画の習得 ② IMRT 線量検証法の確立 ③ IMRT 実施のための QA/QC 体制の構築 (役割,責任分担の確認,実施頻度の設定) ④ IMRT 実施のための施設独自の QA ガイドラインや QC マニュアル等の整備 特に②IMRT 線量検証法の確立は重要で,患者毎に行う必要がある.患者に対し最適 化した線量分布を直接測定することは不可能であるために,物理ファントムなどを用い て間接的な線量検証を行う(12).測定方法としては,電離箱線量計によるポイント測 定とフィルムによる 2 次元測定を組み合わせて,投与線量と線量分布の妥当性を評価す る. IMRT の線量検証とは,IMRT 治療計画の計算線量と測定線量が許容範囲内で一致す ることを確認,検証する行為である.線量検証は,評価点線量検証と線量分布検証に分 類される(3, 5).評価点線量検証では,絶対線量での評価可能な検出器を用いて評価点 の吸収線量が許容範囲内で一致していることを確認する.評価点とは照射される領域内 の任意の点を指し,実際に検証,測定を行う点である.線量分布検証では,相対線量(可 能であれば絶対線量)を評価可能な検出器を用いて,任意の評価面の吸収線量が許容範 囲内で一致することを 3 次元的に確認する. また,線量検証は照射方法の違いで全門検証と各門検証に分類される(5).全門検証 では,実際に患者に照射する状態で実施する.各門検証では,患者照射条件のガントリ 角度(コリメータ角度も含む場合もある)を 0 度として,各門毎に実施する.全門検証 は,標的やリスク臓器の線量評価が可能であり,ホットスポット,コールドスポットの 有無の確認ができるが,総合的な評価であるため,誤差が確認された場合,その原因の 特定が難しい.各門検証は,ファントム表面に対して線束が垂直入射するため計算精度, 測定精度ともに向上するが,ガントリ角度に依存して生じる線量誤差を検出できないな どの欠点がある. 推奨される線量検証は,電離箱線量計を用いた評価点線量検証とフィルムを用いた線14
量分布検証である.これらの測定器を用いた場合の線量検証項目を表 1-1 に示す.理 想的には全ての測定を行うが,人員,時間的制約等により,検証項目を省略する場合は 施設の IMRT 品質管理担当者(医学物理士や放射線治療品質管理士など)を中心に放 射線治療部門内での議論の上,承認された場合のみ容認される. 表 1-1 IMRT 線量検証項目 ◎ガイドライン推奨(9) ○十分な検討のもと省略可(9)線量検証時の一般的注意事項としては,IMRT の治療計画は照射条件(monitor unit: MU 値,線量率,幾何学的条件など)が変わることにより低 MU 値の照射精度,MLC 動作精度,幾何学的位置精度へ影響があるため(6-8),線量検証は実際に患者に照射す る条件で検証する必要がある.また,治療計画時と同様に線量検証においても治療寝台 による放射線の減弱に注意する必要がある. 次に,各測定における注意事項を記す. ① 電離箱線量計によるポイント測定 評価点線量検証では,複数の評価点を測定することが望ましい.評価点は臨床的に線 量を確認すべき標的やリスク臓器に対応する点,治療計画装置の線量計算精度を確認す べき点などを選択する. 評価点線量検証の測定器は電離箱線量計が推奨される.評価点は可能な限り線量が平 坦な領域に設定した上で標準測定法 12(13)に準じて電離電荷から水吸収線量を算出 する.水吸収線量校正定数が与えられていない電離箱線量計やその他の測定器を用いる 場合は,校正された電離箱線量計と比較校正(クロスキャリブレーション)して使用す る.測定器の設置位置精度は,±1 mm 以内であることが求められている.電離箱線量 計は,電離体積によってファーマ型(約 0.6 cm3) ,ミニ型(約 0.1 cm3) ,マイクロ型(約 0.01 cm3)に分類される.ファーマ型では指示値は安定しているが,電離体積が大きい ため線量が平坦な領域を選択することが困難な場合がある.マイクロ型は小型のため平 坦領域を選択することが容易であるが,指示値が小さく,また漏洩電荷の影響が大きい
15
ため(14)取り扱いに注意が必要である. 評価点線量検証では,ファントムに線量計を挿入した状態で撮像した CT 画像を利用 する方法を推奨している.使用するファントムの水等価性を考慮し,ファントムに対す る不均質補正を CT 値-相対電子濃度変換テーブルを利用して行うか,CT 値を利用せ ず,ファントムの相対電子濃度を直接入力して行う方法がある.計算線量の評価は,電 離箱の電離空洞体積を輪郭として抽出し,その平均線量を用いる(15-16).マイクロ型 電離箱線量計のように,TPS の計算グリッドと同じようなサイズの場合はこの限りでは ない. 各電離体積別の電離箱線量計を図 1-5に示す. (a) (b) (c) ② フィルムによる 2 次元測定 フィルムによる線量分布検証では,特性曲線を用いてフィルム濃度を線量に変換する. 解析時にフィルム上のアイソセンタ位置を同定できるように,測定時にフィルムへマー キングを行うなどの処置が推奨される.フィルムとファントム間の空気層が検証結果に 図 1-5 各電離箱線量計 (a)ファーマ形(約 0.6 cm3 ), (b)ミニ型(約 0.1 cm3 ) (c)マイクロ型(約 0.01 cm3 )16
大きな影響を与えるため,フィルムとファントムは密着させる工夫が必要である(17). 線量分布検証は,フィルムの特性,現像条件,スキャナの不確かさなどの様々な影響を 受けるため,相対線量による評価が一般的である.評価の際のノーマライズ点は,電離 箱測定であらかじめ絶対線量の偏差を明らかにしておく必要があり,高線量領域で,か つ線量勾配が小さい点とする.担当者間での測定・解析結果のばらつきを小さくするた め,施設ごとにフィルム測定の精度を明確にし,プロトコルを作成する. 現在,フィルムに代わる検出器として多くの 2 次元検出器(電離箱,半導体など)が 販売されているが,簡便な半面,検出器に特有の問題点を持っている. ③ ファントムの選択 理想的には,患者本人での測定であるが,実際には線量計を人体内に挿入することが 難しく,線量計が挿入可能な物理ファントムで行われている.MLC を用いた IMRT で は,MLC の動作の QA が重要であり,MLC の動作による線量分布の変化を精度よく捕 えるため,他の不確定度を無くす必要がある.このため一般的に,均質ファントムが用 いられる.TPS を用いて,患者の線量分布を測定可能なファントムに移し,そのファン トム上で線量分布を再計算させる.この時に,線量分布の変化も患者のものと比べて尐 ない必要があり,患者に近い形状のファントムが求められる.測定後に,線量が TPS と一致しない場合に,部位を同定し実際の患者への影響をついて検討する際に重要であ る.各 IMRT ファントムを図 1-6に示す. 図 1-6 各 IMRT 用ファントム17
1.1.3 求められる線量検証機器 2008 年に IMRT の保険収載が可能となり,従来法での照射に比べ高い保険点数が認 められた.さらに,2009 年には IMRT の保険適応が拡大され,どの部位であっても固 形がんに対して保険適応が認められた.これに伴って,2004 年の段階では,IMRT 実施 施設は十数施設であったが,現在では数十施設に拡大している.施行部位も,当初頭頸 部,前立腺に限られていたが,現在ではその線量分布の有意性から,あらゆる部位で施 行されている.放射線治療患者の増大と重なり,IMRT 患者はさらに増加している. また,本邦における IMRT も発展し,導入段階から普及の段階に入ってきて,より厳 しい線量制約で計画を行うようになってきた.これに伴い,より厳しい精度での IMRT の線量検証による QA が求められている. このような状況下で,従来法である電離箱線量計とフィルムによる線量検証法では対 応が難しくなっており,2 次元検出器の開発,普及が進んでいるものの,2 次元検出器 も検出器毎に特性を持っており,解像度や線量特性の面でフィルムに代わる 2 次元検出 器が存在しない. 本邦で求められる線量検証機器の条件を次に示す. ① 患者の線量検証時間の短縮 電離箱線量計とフィルムでの線量検証は,線量測定時間が長くかかり,IMRT 普及の 障害となっている.特に,フィルムによる測定は現像処理,読取り,解析と過程が複雑 で線量検証時間を長くしている.さらに,本邦では,フィルムレス化が進んでおりフィ ルムを使用することが困難になっている.図 1-7 にフィルム測定の過程を示す.また, 図 1-8にフィルム測定と他の検出器との線量検証時間の比較を示す. ② 正確な線量測定 フィルム測定はエネルギー,測定深,入射角度,線量率などに対する感度依存性を持 っており(18),正確な測定には経験が必要である.また,各 2 次元検出器も検出器の 種類によって,エネルギー,線量率,入射角度に感度依存性がある.したがって,簡便 かつ正確な測定が可能な検出器が望まれる. ③ 高解像度検出器 IMRT の線量分布は,急峻(図 1-9)で複雑なため解像度の高い検出器が必要である. 簡便性を考えると,従来のフィルム法に代わる同等の高解像度を持った 2 次元検出器の 開発が必要である. ④ 3 次元線量分布測定 治療線量は 3 次元分布(図 1-10)であるが,フィルムや 2 次元検出器では 2 次元の線 量分布しか取得できない.現状では,多断面での測定や測定断面の方向(横断面,矢状 断面,冠状断面)を組み合わせることで,3 次元線量分布の線量検証を行っている.理 想的には 3 次元測定が可能な検出器が望まれる.18
図 1-7 フィルムによる線量測定. 照射後,現像処理,読取り,解析と多くの過程を経て測定結果が得られる. 図 1-8 フィルム測定と ArcCHECK との線量検証時間の比較. (ArcCHECK は IMRT 用の 3 次元の半導体検出器である.) H our19
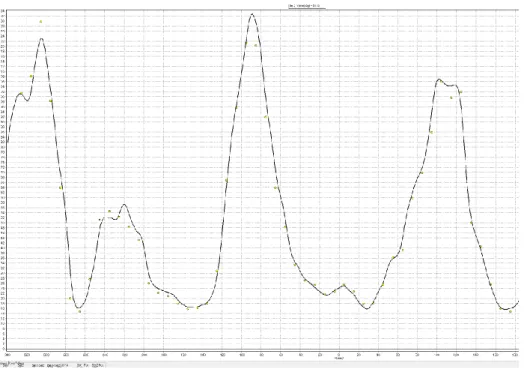
図 1-9 IMRT の線量プロファイル.
線量の変化が急峻である.この変化を測定できる検出器が必要となる.
図 1-10 IMRT の線量分布の例.
20
⑤ structure 別の線量評価
現在の線量検証機器は,測定範囲全体での線量評価である.実際には,ターゲット内 は高線量,正常組織は照射を可能な限り避けるため,structure 別に線量の精度を比較す ることが重要となる.structure 別に評価可能なシステムが望まれる.
⑥ dose volume histogram(DVH)の評価
DVH(図 1-11)は,関心領域(structure)における線量と体積の関係を示した線量評 価法である.TPS では DVH によって投与線量を決定している.IMRT の線量検証の測 定結果を DVH で評価出来れば,計画線量分布と直接な比較・評価が可能である. 図 1-11 IMRT の DVH.横軸が線量,縦軸が体積である. Structure 別の体積に対する線量が評価できる. ⑦ in vivo(モニタリング,人体)での評価 現在の線量検証は,ファントムでの評価であり,実際の治療中に治療ビームを用いた 線量検証が出来れば理想的である.そのような機器が開発されれば,モニタリングとい った新しい確実な線量検証法が確立される.
21
上記の項目が満たされる検出器が開発されれば,臨床における有用性は高く,多くの 患者が IMRT の恩恵を受けることが可能となる.現在のフィルムや電離箱線量計を用い た測定では,上記の条件を満たすのに限界があり,新たな線量検証機器が次々に開発さ れている(図 1-12).しかしながら,未だにフィルムや電離箱線量計での測定を行って いる施設が多い.これは,いずれの線量検証機器も特性を持っており,上記の条件を全 て満たす検出器が存在しないためである.いずれの線量検証機器も何らかの欠点を持っ ているのが現状である.理想の線量検証機器の開発が,IMRT の普及には不可欠である. 図 1-12 線量検証機器の進化. 電離箱測定器とフィルムによる測定から,正確な測定,簡便性を求めて 2 次元検出器が 開発され,更に,3 次元測定が可能な 3 次元測定器が登場した.高精度化する放射線治 療は,より正確な線量評価,評価法を要求し,各種解析機器,解析方法が提案されてい る.22
1.2 本研究の概要 近年,放射線治療においては,多くの治療部位で高精度放射線治療である IMRT が行 われるようになってきた.IMRT では MLC による複雑な照射野の組み合わせで線量投 与が行われるために,計画線量分布の線量検証が必要である.一般には,電離箱線量計 による絶対線量とフィルムによる線量分布の測定を組み合わせた線量検証が行われて いる.しかし,近年の放射線治療患者の増加に伴い,電離箱線量計とフィルムによる線 量検証は,多大な労力と時間が必要であり,短時間で効率的な線量検証システムが望ま れている.また,フィルム測定では多くの不確定要素が存在(17, 18)し,測定精度が 問題となる.さらに,わが国では多くの治療施設でフィルムレス化が進んでおり(19), フィルムに代わる線量分布検出器が必要となっている. このような状況において,近年,簡便にしかも精度良く測定可能な 2 次元検出器が多 く開発され,普及しつつある.2 次元検出器には,電離箱,半導体,フラットパネル型 半導体等を用いたものがあり,それぞれの有用性とその特徴が報告されている.しかし, 2 次元検出器による線量測定では,検出器特有の線量特性が存在するため,使用する際 は検出器の物理特性及び測定精度を検証した上で,自施設の求める線量検証の方法と精 度に最適なものを選択する必要がある.これまで,いろいろな 2 次元検出器を用いた同 一治療計画および条件での比較報告がなく,直接的な比較が出来ていない状況である. そこで,本研究では,①現在使用可能な 2 次元検出器の同一治療計画および条件での 比較,②透過型 2 次元検出器を用いた IMRT 線量検証の詳細な検証精度の比較,を行っ た.さらに,簡便で線量検証時間の短縮のために効率的な測定法を目指し,リニアック に付属した electronic portal imaging device(EPID)を用いて,測定したフルエンスに幾 何学的情報,出力線量比,散乱カーネル,絶対線量校正などの物理モデリングを加える ことで,③多断面の線量分布を取得する方法を開発し,その線量特性を調べ,臨床使用 での有用性を示した.23
1.3 本研究の構成 本論文は全 5 章より構成されている. 第 1 章では,本研究の背景,本研究の概要,本論文の構成について述べた. 第 2~4 章では,著者がこれまで研究してきた内容とその成果をまとめた. 第 2 章では,現在,使用可能な各 2 次元検出器の物理特性を測定し,臨床例を用いて 精度を比較した.2 次元検出器は,MapCHECK(Sunnuclear 社製),EPID(Varian 社製), EPIDose(Sunnuclear 社製),COMPASS(IBA 社製)を使用し,EDR2 film(Kodak 社製), Exradin A-14SL ion chamber(0.016 cc, Standard Imaging 社製)による測定と比較した.各 2 次元検出器の種類に応じた特徴を明らかにし,臨床における精度を示した. 第 3 章では,ビーム入射口に着脱可能な透過型 2 次元電離箱検出器である,COMPASS (IBA 社製)の詳細な線量特性を調べた.電離箱は検出器サイズが大きく解像度が問題 となるため,格子上の MLC テストパターンや頭頸部 IMRT の臨床例を用いて,解像度 の線量分布への影響を他の 2 次元検出器やモンテカルロシミュレーション(MC)との 比較から評価した.COMPASS の臨床における線量検証精度を物理的評価と臨床例にお ける評価から詳細に検証した. 第 4 章では,線量検証時間の短縮,高解像度の検出器の観点から 2 次元検出器である EPID を用いた線量測定の方法を開発した.EPID での問題点は,フルエンス測定であり, 線量測定ではないことである.そこで,EPID で得たデータをモデリングし,線量に変 換し,さらにモデリングのアルゴリズムを改良することで多断面の線量測定を可能とし た.開発した方法で,物理評価と臨床例での評価を行った. 第 5 章では,本研究のまとめと今後の課題について述べる.24
第 2 章 IMRT 線量検証における 2 次元検出器間の精度比較
2.1 緒言 近年,放射線治療においては,病巣に対する線量分布の集中性とリスク臓器の保護(20, 21)から,多くの治療部位で高精度放射線治療である IMRT が行われるようになってき た.IMRT には MLC や補償フィルターを用いた方法があるが,本邦では MLC を用いた IMRT が多くの施設で行われている.MLC による複雑な照射野の組み合わせで線量投与 が行われるために,計画線量分布の線量検証が必要(21)である.一般には,電離箱線 量計による絶対線量とフィルムによる線量分布の測定を組み合わせた線量検証(21)が 行われている. しかし,近年の放射線治療患者の増加に伴い,電離箱線量計とフィルムによる線量検 証は,多大な労力と時間が必要であり(21),短時間で効率的な線量検証システムが望 まれている.また,フィルム測定では多くの不確定要素が存在し(22),測定精度が問 題となる.さらに,わが国では多くの治療施設でフィルムレス化が進んでおり(19), フィルムに代わる線量分布測定器が必要となっている.このような状況において,近年, 簡便にしかも精度良く測定可能な 2 次元検出器が多く開発され,普及しつつある.2 次 元検出器には,検出器として電離箱(23, 24),半導体(25, 26),フラットパネル型半導 体(27, 28)等を用いたものがあり,それぞれの有用性とその特徴が報告されている. 2 次元検出器による線量測定では,検出器特有の線量特性が存在するため(29),使 用する際は検出器の物理特性及び測定精度を検証した上で,自施設の求める線量検証の 方法と精度に最適なものを選択する必要がある.一般的に,2 次元検出器の測定精度の 検証は,電離箱線量計とフィルムとの比較測定によって行われるが(12),2 次元検出 器間の線量検証の精度比較を行った報告は尐なく,十分な比較が行われていないのが現 状である.実際の使用においては,それぞれの 2 次元検出器の線量特性を考慮して適応 する必要がある.これらの 2 次元検出器の線量検証の精度を正確に検証するには,同一 治療計画装置による線量分布について,同一測定条件で比較する必要がある. 本研究は,電離箱,半導体及びフラットパネルからそれぞれ構成された 2 次元検出器 について,従来法である電離箱線量計とフィルムとの比較測定から基本的な線量特性と 臨床的な線量評価を行い,IMRT の線量検証における各 2 次元検出器の特徴を明確にす ることを目的とした.25
2.2 線量検証機器 2.2.1 電離箱線量計とフィルム測定 ①電離箱線量計による投与線量の検証 電離箱による線量測定では,電離放射線によって生成した電離箱空洞の電荷をブラッ グレイの原理(30)に基づいて吸収線量に変換され,簡便かつ精度の高い測定を提供す る.構造は,2 つの電極となる金属板によって挟まれ,空気(ガス)によって満たされ た容器からなる.電極間には電圧が印加されてはいるが,通常時に電流は流れない.電 離放射線がこの容器内に入ることでガスが電離され,電子が陽極に,陽イオンは陰極に 移動して電流が流れる.この電流は電位計によって測定される. 今回の検討では,0.016 cm3の容量のマイクロ型,A-14SL(Standard Imaging 社製)(図 2-1)電離箱線量計とファーマ型(0.6 cm3)を用いた.このマイクロ型電離箱は,当院 のリファレンス線量計である PTW-30013 0.6 cc(PTW 社製)と相互校正を行っている. また,当院のリファレンス線量計は,本邦の線量標準器と毎年校正されており,線量ト レーサビリティーが確立されている. 図 2-1 電離箱線量計(左)と電離箱線量計を配置したファントム(右). ②フィルムによる測定 フィルム測定には EDR2(Kodak 社製)を用いた.測定はアイソセンタ面で行い,測 定深と同じ深さで校正用のフィルム濃度と線量の特性曲線を取得した.校正用の照射野 は 6×6 cm2 で,吸収線量は電離箱線量計で測定した.0~500 MU まで 10 ステップで行26
った.フィルムは,DD-システム(R-tech 社製)で解析を行った.測定の際は,フィ ルムを solid water に密着し,ファントム間の隙間が生じないようにした(図 2-2).
(a) (b)
27
図 2-2 (a)フィルム, (b, c)照射後に現像したフィルム, (d, e)フィルムを配置し たファントム. 2.2.2 2 次元検出器 2 次元検出器には,検出器として電離箱(23, 24),半導体(25, 26),フラットパネ ル型半導体(27, 28)等を用いたものがあり,それぞれの有用性とその特徴が報告され ている.下記に今回の検討で用いた 2 次元検出器を示す. ① 透過型 2 次元電離箱検出器 電離箱を用いた 2 次元検出器には COMPASS(IBA 社製)を用いた.COMPASS の仕 様を次に示す.図 2-3は COMAPSS をリニアックに装着した様子である. COMPASS 検出器:透過型平行平板型電離箱 検出器サイズ:3.8 mmφ×2 mm 検出器間隔:6.5 mm(アイソセンタで 1 cm) 検出器数:1600 個 固有ビルドアップ:3.1 mm 水等価 COMPASS を用いた線量検証は,リニアックの照射口に COMPASS を装着して測定し(d) (e)
28
た IMRT フルエンス分布を用いて,フルエンス間での比較が可能である.さらに,フル エンスから線量分布を計算することができる.線量分布計算には,フルエンス分布から ファントム内の線量分布計算過程で,COMPASS のビームモデリングが必要となる.TPS とのフルエンス分布や線量分布の比較,ガンマ評価,DVH 解析等を行うことが出来る. COMPASS のワークフォローを図 2-4に示す. 図 2-3 COMPASS(IBA 社製)をリニアック照射口に取り付けた様子. リニアックの照射口のフルエンスを測定することによって線量検証を行う.フルエンス 間での比較,線量での比較が行える.29
図 2-4 COMPASS のワークフォロー.
TPS から DICOM で CT,PLAN,STRUCTURE,DOSE の情報を COMPASS に転送する. COMPASS で照射口のフルエンスが測定される. ② 半導体検出器を用いた 2 次元検出器 半導体検出器を用いた 2 次元検出器としては,MapCHECK(Sunnuclear 社製)を用い た MapCHECK での測定の様子を図 2-5に示す.また,図 2-6に MapCHECK での線量評 価の様子を示す. MapCHECK 検出器:n 型半導体検出器 検出器サイズ:0.8 cm3 検出器間隔:1 cm 検出器数:445 個 固有ビルドアップ:2 cm 水等価
30
多点測定を行うことによって 2 次元の線量分布測定を行う.検出器は中心部 10×10 cm 2 の領域は 1 cm 間隔で,それ以外は 2 cm 間隔で配置されている.最大 22×22 cm 2 までの照射野が測定可能である.検出器の上部は水等価厚で 2 cm で構成されており, Solid water を追加することで,任意の深さの線量が測定可能である.線量評価は,ガン マ評価と distance to agreement(DTA)評価が可能である.線量校正は,基準検出器に対 して絶対線量の値を持っており,その基準検出器と他の検出器は相対的な校正値を持っ ている.絶対線量での評価が可能である. 図 2-5 MapCHECK(Sunnuclear 社製). 445 個の半導体が 2 次元に配置されていて,多点測定を行うことによって,線量分布を 測定する.31
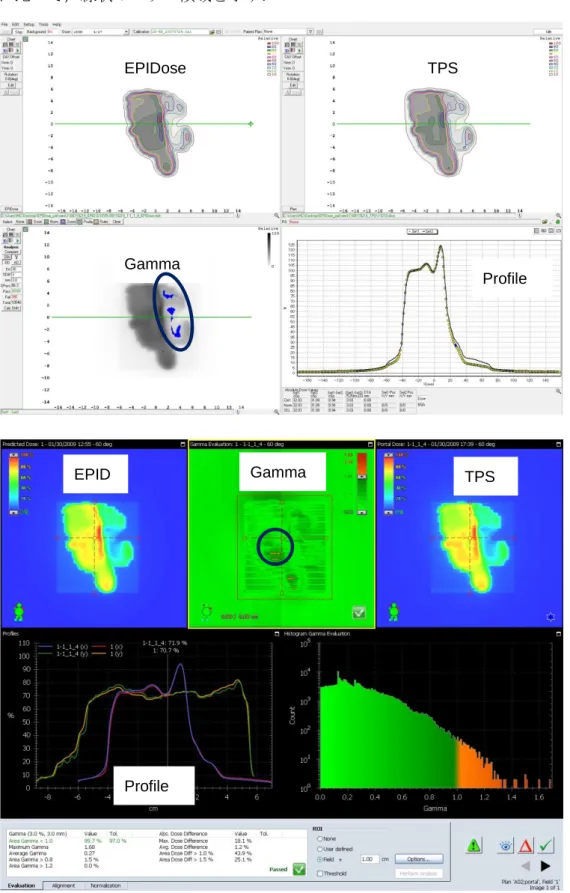
図 2-6 MapCHECK での線量分布比較.
上段左が測定値,右が TPS,中段がガンマ評価,下段が線量プロファイルである.
③ フラットパネル型半導体検出器を用いた 2 次元検出器
フラットパネル型半導体検出器として electronic portal imaging device(EPID, Varian 社 製)を用いた.
検出器:a-Si フォトダイオード
検出器サイズ:0.392 mm(マトリックスサイズ) 検出器数:1024×768 個(マトリック数)
固有ビルドアップ:銅板 1 mm
EPID は,銅板(1 mm),蛍光体(0.4 mm),aSi(amorphous silicon, 1.5 μm)フォト ダイオード,ガラス基板(1 mm)から構成されている.EPID に入射した MeV-X 線に よって銅板から散乱されたコンプトン電子が,蛍光体を発光させ,その光が a-Si フォト ダイオードで電気信号に変換されて画像データとして取得される.EPID 検出器の分解
32
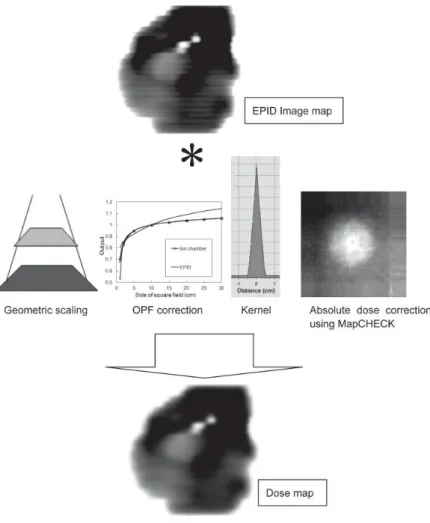
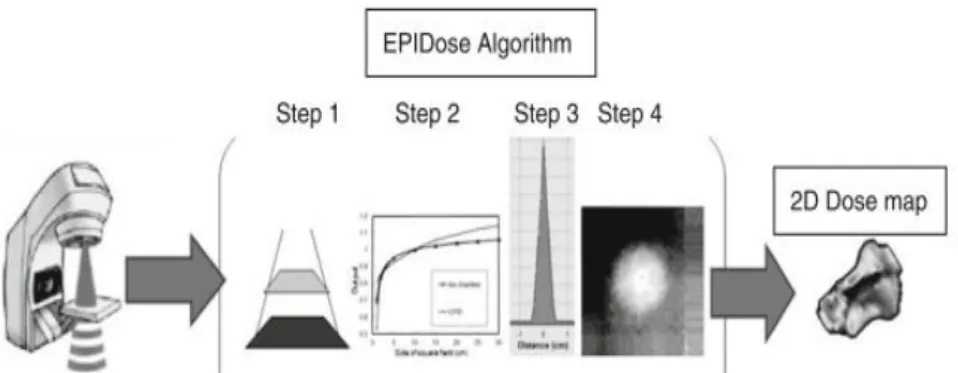
能は,マトリックスサイズに相当する 0.392 mm で,検出器数はマトリックス数の 1024 ×768 である.EPID の構造を図 2-7に示す. EPID は,高い解像度と広いダイナミックレンジを有している.しかも,リニアック に装備されている機器であり,簡便にセットアップが可能である.データは線量データ ではなく,画像データであるため,線量では評価できない.この画像データは,フルエ ンスと呼ばれ,ビームの強弱を表し吸収線量とは異なる事が報告されている(27, 28). EPID で測定されたフルエンス分布は,TPS で計算された患者治療計画のフルエンス分 布と比較・検証される.EPID での測定の様子を図 2-8に示す. 図 2-7 EPID の構造. ④ 線量変換ソフトEPIDose は MapCHECK に組み込まれているソフトウエアであり,EPID の画像デー タ(フルエンス分布)は,測定された幾何学的情報,ビームデータ情報,MapCHECK に よる線量測定情報をもとに作成した散乱カーネルを用いて吸収線量に変換される.図 2-9 に,EPIDose によるフルエンスから吸収線量変換の概念図とその変換過程をそれぞ れ図 2-10と図 2-11に示す. 図 2-8 EPID(Varian 社製). EPID はリニアック付属の装置で,セットアップが容易 である.
33
図 2-9 EPIDose によるフルエンスから吸収線量変換の概念図. EPID でのフルエンス分布を線量に変換し,TPS の線量と比較する.
図 2-10 EPID フルエンスを吸収線量に変換する過程.
34
表 2-1に今回使用した 2 次元検出器の物理特性を示す.各 2 次元検出器間の解像度や 検出器数等で違いがある.フィルムに代わる 2 次元検出器としては,高解像度が必要で ある.MapCHECK や COMPASS 等の半導体や電離箱線量計では,解像度や検出器数に 限界がある.EPID はフィルムと同等の高解像度である.しかし,EPID はフルエンス測 定なので吸収線量に変換する必要がある.EPIDose は EPID のフルエンスを吸収線量に 変換するソフトウェアである. 表 2-2に各 2 次元検出器の特徴を示す.検証時間は,フィルムが他の検出器に比べて 大幅に時間がかかり,EPID が最も簡便に行える.電離箱線量計と半導体検出器では, 検出器数に限界があり,フィルム,EPID の解像度には及ばない.EPID は吸収線量への 変換が必要なのを除けば,最も理想的な検出器である. 表 2-2 各 2 次元検出器の特徴.Method Efficiency Detector
resolution Detector density Measures dose
Film ×× ○ ○ ○ Ion chamber array ○ × × ○ Diode array ○ ○ × ○ EPID ◎ ○ ○ × 表 2-1 2 次元検出器の物理特性
35
2.3 比較方法
2 次元検出器の物理特性と臨床例における IMRT の 線 量 検 証 精 度 に つ い て,Clinac iX(Varian 社製)リニアックを用いて比較を行った.MLC は Millennium 120 (Varian 社製),使用エネルギーは 6 MV,15 MV,IMRT 照射法は sliding window 法 で行った. 2.3.1 2 次元検出器の物理特性 物理特性として,線量直線性,線量率依存性,出力係数の測定を行った.線量直線性 は,照射野 10×10 cm2で 1~300 MU の範囲で測定を行った.10 MU までは 1 MU ごと に,100 MU までは 10 MU ごとに,100 MU 以降は 50 MU ごとに測定を行った.線量率 依存性では照射野 10×10 cm2で 200 MU に設定した.基準検出器には,PTW30013-Farmer 型電離箱 0.6 cc(PTW 社製)を使用した.出力係数の測定では,照射野 1×1~30×30 cm 2で行い,5×5 cm2未満では Exradin A-14SL 円筒形電離箱 0.016 cm(Standard Imaging 3 社製)を,それ以上の照射野では PTW30013-Farmer 型電離箱 0.6 cm3をそれぞれ使用
した.電位計は,RAMTEC-1000Plus(東洋メディック社製)を用いた.すべての測定 は標準測定法 01 (13)にしたがって行った.測定深は,EPID 以外は 10 cm 深で測定 し,tissue maximum ratio(TMR)で最大深線量に変換した.MapCHECK では検出器上 部の水等価厚 2 cm に Solid Water RMI-457 ファントム(物理密度ρ=1.046 g/cm3,相対
電子濃度ρe=1.018,GAMMEX 社製)を 8 cm 厚付加して測定を行った.EPIDose と COMPASS では 10 cm 深の線量を,EPIDose は EPID のデータから COMPASS ではリニ アック照射口のフルエンス測定からそれぞれビームモデリングを行って算出した. EPID はファントムなどの散乱体は付加せず,検出器本体(水等価厚 2 cm)で測定した. EPID では測定単位が calibration unit(CU)であり,1 CU を 1 MU として測定した.
2.3.2 2 次元検出器を用いた IMRT 臨床例による線量検証比較
頭頸部領域における IMRT 7 門照射の 10 例について,2 次元検出器の線量検証精度の 比較を行った.TPS は Eclipse version 7.5(Varian 社製)を用いた.MapCHECK は,散 乱線による基板部の照射を最小限に抑えるために,付加的に固体ファントムは使用せず に測定した.EPID では,測定フルエンス分布と TPS 計算フルエンス分布で比較した. EPIDose では,EPID のフルエンス分布を固体ファントム内の線量分布に変換して TPS と比較した.また,COMPASS は通常,患者の体内の線量分布を評価する目的で使用さ れるが,他の検出器と比較条件を同一にするために固体ファントム内で線量分布を計算 した.ファントムには Solid Water RMI-457 を使用した.COMPASS では,6 MV でビー ムモデリングを行い,照射野は 20.8×25.5 cm2
の全頸部照射から,12.1×11.5 cm2の局所
への追加照射の計画で検証した.各門での線量検証は合計 70 門であった.線量分布評 価は,アイソセンタ面でのガンマ評価によるパス率で行った.線量勾配を考慮し,比較
36
的線量勾配の尐ないアイソセンタを評価点とした.また,ガンマ評価の判定基準は distance to agreement(DTA): 3 mm, dose difference(DD): 3%で行った.しきい値 (Threshold; Th)は,フィルムの低線量域での不確定性(17, 18)を考慮し 40%とした. ガンマ解析には,各 2 次元検出器の付属のソフトウエアを用いた.さらに,各 2 次元検 出器の線量分布は,Exradin A-14SL 円筒形電離箱 0.016 cm3(standard imaging 社製)と
フィルム EDR2(Kodak 社製)で比較した.なお,治療計画は診療の過程で過去に得ら れたデータであり,個人情報の保護や利益相反の管理を考慮し,倫理委員会の承認を得 て臨床的検討を実施した. 2.4 結果 2.4.1 2 次元検出器の物理特性 図 2-11に線量直線性を示す.各検出器は 6 MV,15 M ともに,5 MU 以上で 1%以内, 5 MU 未満では 2%以内で電離箱線量計の結果と一致した. 図 2-11 線量直線性,6 MV(左側)と 15 MV(右側). 図 2-12に線量率依存性を示す.線量率 100 MU/min で最も大きく,EPID で 1.35%, MapCHECK で 1.2%であった.COMPASS では 0.5%,ファーマ型電離箱線量計では線量 率依存性ほとんどなかった.
37
図 2-12 線量率依存性,6 MV(左側)と 15 MV(右側). 図 2-13に出力係数を示す.EPID を除く検出器では,照射野 1×1 cm2 以外で 1%以 内で一致した.EPID は 30×30 cm2の照射野で,他の検出器に対して約 10%の線量差で あった. 図 2-13 出力係数,6 MV(左側)と 15 MV(右側) 0.6 0.7 0.8 0.9 1 1.1 1.2 0 5 10 15 20 25 30 Ou t p u t fa c to rSize of square field (cm)
Ion chamber MapCHECK EPIDose EPID COMPASS 0.5 0.6 0.7 0.8 0.9 1 1.1 1.2 0 5 10 15 20 25 30 O u t p u t fa c to r
Size of square field (cm)
Ion chamber MapCHECK EPIDose EPID
38
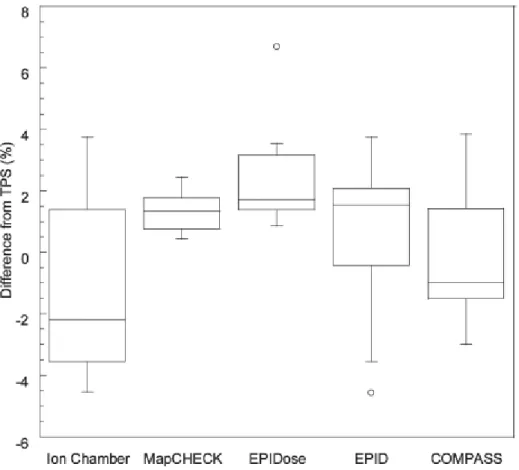
2.4.2 2 次元検出器を用いた IMRT 臨床例による線量検証比較 図 2-14に IMRT 症例におけるアイソセンタ線量の TPS との差を示す.MapCHECK は 中央値で 1.2%の差で TPS と最も一致し,バラツキも小さかった.電離箱線量計と COMPASS,EPID のバラツキは大きかった.しかし,すべての 2 次元検出器は,EPIDose の 1 例を除き 5%以内で TPS と一致した. 図 2-15に臨床例におけるガンマ評価によるパス率を示す. ガンマ評価では,EPIDose のパス率が中央値 99.6%で最もよく,次いで EPID, COMPASS, MapCHECK の順であった.EDR2 は他の検出器と比べ中央値が低く,バラ ツキが大きかった.すべての 2 次元検出器のパス率は 97%以上であった39
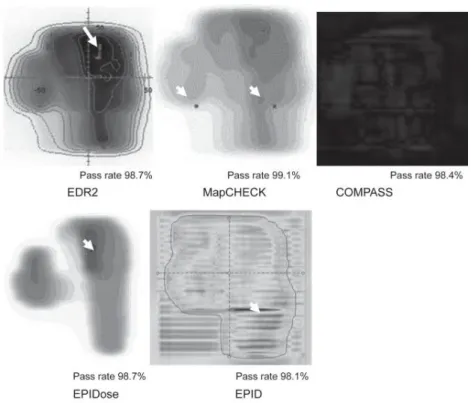
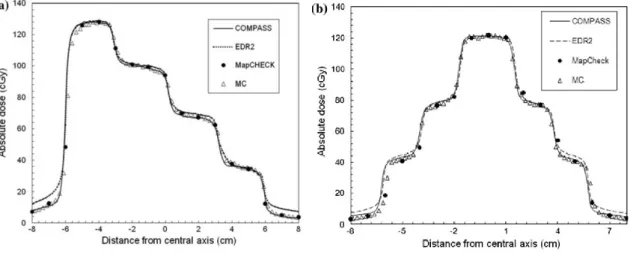
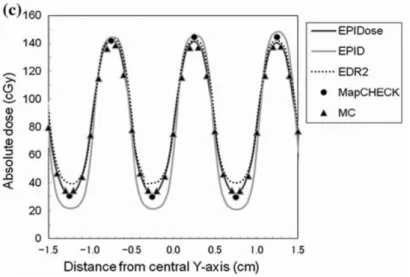
図 2-15 各 2 次元検出器のガンマ評価におけるパス率. ガンマ評価のパス率では,線量誤差の場所は同定できないため,図 2-16,2-17に IMRT 症例におけるガンマ評価マップを示す.図 2-16は照射野が 12.1×11.5 cm2の臨床例で, TPS に対するすべての 2 次元検出器のパス率は 98%以上であった.しかし,EPID では MLC リーフ間で過大評価である. 図 2-17には照射野が 20.8×25.5 cm2 の臨床例を示す.MapCHECK と EPIDose はよい 一致であった.COMPASS は照射野辺縁領域で誤差が大きくなった.EDR2 は低線量域 で誤差が見られ,EPID では各門で MLC リーフ間において過大評価であった.40
図 2-16 頸部 IMRT のガンマ評価(照射野;12.1×11.5 cm2).矢印はエラーを示す.
図 2-17 頸部 IMRT のガンマ評価(照射野;20.8×25.5 cm2)
41
2.5 考察 2.5.1 2 次元検出器の物理特性 本研究では,さまざまな種類の検出器で構成された 2 次元検出器の比較検討を行った. 物理特性において,EPID は線量率依存性と出力係数で電離箱線量計と差が生じた(図 2-12,図 2-13).しかし,臨床例による比較では,各検出器において,強度変調放射線 治療における物理・物理的ガイドラ 2011(9)に示されている許容値を超えるような差 は生じなかった. 線量直線性,線量率依存性,出力係数では,これまでの報告(25, 28, 29)とほぼ一致 した.線量直線性は検出器間の差はなく,線量率依存性は 15 MV, 100 MU/min,EPID で最大 1.35%であった.100 MU/min の使用頻度,ガイドライン(9)の許容値から臨床 上問題となる差ではないが,検出器の校正を 300 MU/min で行うことによって,線量率 が低線量率側,高線量率側どちらに変化しても,最大 0.7%の最小限の差にすることが できる.また,COMPASS は電離箱線量計であるため,各項目で依存性は最も尐なかっ た.出力係数は EPID を除いてよく一致した.EPID はフルエンス測定であるため線量 評価には適していない. 2.5.2 2 次元検出器を用いた IMRT 臨床例による線量検証比較 図 2-14 に示す臨床例における各門のアイソセンタ線量の比較では,電離箱線量計(A-14SL)と COMPASS,EPID でバラツキが大きかった.この原因は,COMPASS,電 離箱線量計(A-14SL)では電離箱の体積効果(12)が考えられる.この効果を尐なく するために電離体積の小さい電離箱を使用することが奨められている (12).また, EPID はフルエンス測定であるため TPS とのフルエンスでの比較であり,他の検出器と の直接的な線量比較はできない.MapCHECK は,半導体で検出器サイズが 0.8×0.8 mm2 と小さく,体積効果の線量影響がほとんどないのでアイソセンタ線量の評価に適してい る.しかし,エネルギー,照射野,測定深などの測定条件の違いによる依存性には注意 が必要である. 図 2-15におけるパス率の比較では,EDR2 はエネルギー,照射野,測定深などの測定 条件の違いによる依存性(22)のためバラツキが大きかった.EPIDose は EPID のフル エンスデータが線量に変換されているので,フィルムに近い分解能で,MapCHECK と ほぼ同等な測定精度であった. 図 2-16,図 2-17にガンマ評価のマップを示す.MapCHECK は TPS とよく一致するが, 検出器間隔が 1 cm と粗く,詳細な線量分布測定には適していない.また,COMPASS は大きな照射野の辺縁で誤差が大きく,電離箱の体積効果によって,線量変化が大きな 場所では誤差が大きくなる.EPIDose は分解能が高く,ダイナミックレンジも大きいこ とからフィルム以上に低線量から高線量まで精度よく評価でき,高いパス率が得られた. EPID は MLC リーフ間で TPS とのフルエンス分布の相違が見られるが,これは EPID の