ミリプラチン 製造販売承認申請
CTD 第 2 部
2.4 非臨床試験の概括評価
目次
2.4 非臨床試験の概括評価 2.4.1 非臨床試験計画概略...9 2.4.2 薬理試験 ...18 2.4.3 薬物動態試験...27 2.4.4 毒性試験 ...39 2.4.5 総括及び結論...48 2.4.6 参考文献一覧...61【本項における用語の説明】 用語 定義、読み替えなど ミリプラチン 化学名: (SP-4-2)-[(1R,2R)-Cyclohexane-1,2-diamine-N,N’]bis(tetradecanoato-O)platinum 化学式(分子量): C34H68N2O4Pt(763.99) 構造式: 懸濁用液 一般名: ヨード化ケシ油脂肪酸エチルエステル ミリプラチン 懸濁液 ミリプラチンをヨード化ケシ油脂肪酸エチルエステルに分散した懸濁液 ジノスタチン スチマラマー 化学名: (4S,6R,11R,12R)-11-[α-D-2,6-Dideoxy-2-(methylamino)galactopyranosyloxy]- 4-[(4R)-2-oxo-1,3-dioxolan-4-yl]-5-oxatricyclo[8.3.0.04,6]trideca-1(13),9-diene- 2,7-diyn-12-yl 2-hydroxy-7-methoxy-5-metylnaphthalene-1-carboxylate 平均分子量: 約15000 構造式: ジノスタチン スチマラマー 懸濁液 ジノスタチン スチマラマーをヨード化ケシ油脂肪酸エチルエステルに分散 した懸濁液 H2 N Pt N H2 H H O O O O H3C H3C
用語 定義、読み替えなど エピルビシン 塩酸塩 化学名: (2S,4S)-4-(3-Amino-2,3,6-trideoxy-α-L-arabino-hexopyranosyloxy) -1,2,3,4-tetrahydro-2,5,12-trihydroxy-2-hydroxyacetyl-7-methoxynaphthacene- 6,11-dione monohydrochloride 化学式(分子量): C27H29NO11・HCl(579.98) 構造式: シスプラチン 化学名: (SP-4-2)-Diamminedichloroplatinum 化学式(分子量): Cl2H6N2Pt(300.05) 構造式: シスプラチン 懸濁液 シスプラチンをヨード化ケシ油脂肪酸エチルエステルに分散した懸濁液 Pt(II) 脱離基が遊離した白金2 価錯体(白金系制癌剤の活性分子種) DACH-Pt(II) 担体配位子に (1R,2R)-1,2-Diaminocyclohexane を有し、脱離基が遊離した白金 2 価錯体((1R,2R)-1,2-Diaminocyclohexane 骨格を有する白金系制癌剤の活性分 子種) 構造式: H2 N Pt2+ N H2 H H O OH O OH OH COCH2OH O O NH2・HCl H H H OCH3 H CH3 HO NH3 Pt NH3 Cl Cl
用語 定義、読み替えなど DPC DACH-Pt(II)に塩素イオンが配位したもの。 生体内では、アミノ酸、たん白質又は核酸などの生体分子と非可逆的に結合 する前のDACH-Pt(II)は、高濃度に存在する塩素イオンが配位した DPC と して主に存在すると考えられたことから、薬理試験、薬物動態試験及び毒性 試験には活性体としてDPC を用いた。 化学名: Dichloro[(1R,2R)-1,2-cyclohexanediamine-N,N’]platinum 化学式(分子量): C6Cl2H14N2Pt(380.17) 構造式: DPCI DACH-Pt(II)に塩素イオンとヨウ素イオンが配位したもの。 化学名: Chloro[(1R,2R)-1,2-cyclohexanediamine-N,N’]iodo platinum 化学式(分子量): C6ClH14IN2Pt(471.62) 構造式: DPI DACH-Pt(II)にヨウ素イオンが配位したもの。 化学名:
[(1R,2R)-1,2-Cyclohexanediamine-N,N’]diiodo platinum 化学式(分子量): C6H14I2N2Pt(563.08) 構造式: カルボプラチ ン 化学名: cis-Diammine(1,1-cyclobutanedicarboxylato)-platinum (II) 化学式(分子量): C6H12N2O4Pt(371.25) 構造式: H2 N Pt N H2 H H Cl Cl H2 N Pt N H2 H H I Cl H2 N Pt N H2 H H I I NH3 Pt NH3 O O O O
用語 定義、読み替えなど
オキサリプラ チン
化学名:
(SP-4-2)-[(1R,2R)-Cyclohexane-1,2-diamine-κN, κN’][ethanedioato(2-)-κO1, κO2] platinum 化学式(分子量): C8H14N2O4Pt(397.29) 構造式: テトラプラチ ン 化学名:
Tetrachloro(d, l-trans)-1,2-diaminocyclohexaneplatinum (IV) 化学式(分子量): C6Cl4H14N2Pt(451.08) 構造式: マロナトプラ チン 化学名: (d, l-trans-1,2-Diaminocyclohexane)malonatoplatinum (II) 化学式(分子量): C9H16N2O4Pt(411.31) 構造式: NDDP 化学名: cis-Bis(neodecanoato)(trans-R,R-1,2-diaminocyclohexane)platinum (II) 化学式(分子量): C26H52N2O4Pt(651.78) 構造式:
Sub G1 画分 DNA ヒストグラム上で、G1 期の細胞よりも DNA 含量が少ない細胞画分 H2 N Pt N H2 H H O O O O H2 N Pt N H2 H H Cl Cl Cl Cl H2 N Pt N H2 H H O O O O H2 N Pt N H2 H H O O O O
【一般的略号】
略号 省略しない表現 日本語
ALT(GPT) Alanine aminotransferase アラニン・アミノトランスフェラーゼ ARG Autoradiography オートラジオグラフィー
ASA Active Systemic Anaphylaxis 能動的全身性アナフィラキシー AST(GOT) Aspartate aminotransferase アスパラギン酸アミノトランスフェラーゼ AUC Area under the plasma (serum) concentration-time curve 血漿(血清)中濃度時間曲線下面積 CYP Cytochrome P450 チトクロームP450
Cmax Maximum plasma (serum) concentration 最高血漿(血清)中濃度
DACH (1R, 2R)-1, 2-Diaminocyclohexane (1R, 2R)-1, 2-ジアミノシクロヘキサン DNA Deoxyribonucleic acid デオシキシリボ核酸
F1 First filial generation 第2 世代 GFR Glomerular filtration rate 糸球体濾過量
GM-CSF Granulocyte/Macrophage-Colony Stimulating Factor 顆粒球・マクロファージ-コロニー刺激因子 HPLC High performance liquid chromatography 高速液体クロマトグラフィー
IC50 50% inhibitory concentration 50%抑制濃度
IC90 90% inhibitory concentration 90%抑制濃度
ICP-MS Inductively coupled plasma- mass spectrometry 誘導結合プラズマ質量分析 IL-1β Interleukin-1β インターロイキン-1β IL-2 Interleukin-2 インターロイキン-2 IL-3 Interleukin-3 インターロイキン-3 IL-4 Interleukin-4 インターロイキン-4 IL-5 Interleukin-5 インターロイキン-5 IL-6 Interleukin-6 インターロイキン-6 INF-γ Interferon-γ インターフェロン-γ LC Liquid chromatography 液体クロマトグラフィー M/E 比 Myeloid/Erythroid ratio 顆粒球系細胞/赤芽球系細胞比 NADPH β-Nicotinamide adenine dinucleotide
phosphate, reduced form
還元型ニコチンアミドアデニンジヌ クレオチドリン酸
O/W Oil in water 水中油
PCA Passive Cutaneous Anaphylaxis 受身皮膚アナフィラキシー
Pt Platinum 白金
RANTES Regulated upon activation, normal T cells expressed and secreted -
TGF-β1 Transforming Growth Factor-β1 形質転換増殖因子-β1 TK Toxicokinetics トキシコキネティクス TNF-α Tumor Necrosis Factor-α 腫瘍壊死因子-α
略号 省略しない表現 日本語 TUNEL Terminal deoxynucleotidyl transferase-mediated dUTP-biotin
nick end labeling
Tmax Time of the occurrence of Cmax 最高血漿(血清)中濃度到達時間
dUTP Deoxyuridine 5’-triphosphate デオキシウリジン5’-3 リン酸 mRNA Messenger RNA メッセンジャーRNA
2.4.1 非臨床試験計画概略 2.4.1.1 薬理試験計画概略 肝臓は肝動脈より約25%、門脈より約 75%の二重の血液供給を受けている。それに対し、 肝細胞癌の腫瘍血管は腫瘍内で門脈枝の随伴を欠いており、腫瘍は肝動脈からほぼ 100% の血液供給を受けている文献1),2),3),4),5)。また、肝細胞癌の腫瘍血管(動脈)は他の動脈との 吻合を欠く終動脈の性格を有する。このため、腫瘍へ血液を供給する肝動脈内に油性造影 剤であるヨード化ケシ油脂肪酸エチルエステル(懸濁用液)を投与すると、懸濁用液は腫 瘍部位に選択的に移行して長期間滞留する文献1),6),7),8)。そこで、懸濁用液に制癌剤を溶解、 又は懸濁させ、腫瘍内に滞留している懸濁用液から制癌剤が徐々に放出されれば、腫瘍組 織を死滅させると同時に、正常組織への傷害を抑えることが可能となる。このような背景 から、ヨード化ケシ油脂肪酸エチルエステルを用いてジノスタチン スチマラマー、エピル ビシン塩酸塩、シスプラチンなどの制癌剤を肝動脈内に投与する肝動脈塞栓療法が、外科 的治療法や内科的局所療法で完全治癒を目指すことができない肝細胞癌患者の治療に広く 試みられてきた文献9),10),11),12),13),14),15),16),17)。これらの中で、現在、ヨード化ケシ油脂肪酸エチ ルエステルに懸濁して肝動脈内投与する制癌剤として承認されている薬剤は、ジノスタチ ン スチマラマーのみである。しかし、ジノスタチン スチマラマーには肝動脈における血 管障害の発現例が報告されている文献18),19),20)。従って、肝動脈塞栓療法の有用性を向上させ るためには、より安全に使用できる制癌剤の開発が必要と考えられた。 白金系制癌剤シスプラチンは、高い抗腫瘍活性と広い抗腫瘍スペクトラムを有する制癌 剤として広く使用されており文献21)、肝細胞癌に対しても肝動脈塞栓療法での使用経験があ り、良好な臨床成績を示すとの報告もある文献15)。しかし、シスプラチンは水溶性であるた めに、シスプラチンのヨード化ケシ油脂肪酸エチルエステル懸濁液(シスプラチン懸濁液) は物理的安定性が必ずしも優れていない文献22),23)。 そこで、脂溶性を高めた白金系制癌剤を開発し、肝動脈塞栓療法に適用することを考え た。図 2.4.1-1 に示すように、一般に、白金系制癌剤は、脱離基が遊離して DNA のグアニ ン基と結合し(白金-DNA アダクト形成)、細胞内伝達系を介してアポトーシスによる細胞 死を誘導する文献24)。従って、疎水性の高い脱離基が配位した白金錯体を選択し、抗腫瘍活 性を低下させることなく脂溶性を向上させれば、懸濁用液への親和性を改善した白金系制 癌剤を得ることができると考えられた。また、脱離基が遊離した活性分子種は生体内で求 核基を持つアミノ酸や蛋白質などと反応し速やかに不活化される文献25)。そのため、懸濁用 液から放出された活性分子種の作用部位は、投与部位近傍の腫瘍組織に限局されると考え られた。すなわち、疎水性の高い脱離基が配位し、懸濁用液への親和性が改善された白金 錯体であれば、腫瘍局所に懸濁用液とともに滞留することで腫瘍局所での効力は維持しつ つ、非腫瘍部への影響を抑えることができると考えられた。 ミリプラチンは、国立がんセンターの前田らによって見出された脂溶性白金錯体であり、 担体配位子に (1R, 2R)-1, 2-ジアミノシクロヘキサン(DACH)を、脱離基にミリスチン酸 を有する文献26)。ミリプラチンは懸濁用液への親和性が高く、抗腫瘍効果も良好であると報
告されている文献26)。実際に、製剤化したミリプラチンは懸濁用液を添加して振り混ぜるこ とで粒子が均一に分散した懸濁液(ミリプラチン懸濁液)を調製することができること (2.3.P(製剤).2.2.3.1 参照)、室温で少なくとも 24 時間は懸濁液中のミリプラチン含量が 低下しないこと(2.3.P(製剤).2.6.2 参照)、また、ミリプラチン懸濁液から水相へ白金成 分が緩やかに放出されることが確認された(2.3.P(製剤).2.2.3.2 参照)。 図 2.4.1-1 白金系制癌剤の作用機序(図 2.6.2.6-1 再掲) 肝動脈塞栓療法に用いる白金錯体としてのミリプラチンの効力を裏付ける試験として以 下の検討を行った。 ラット及びヒト肝癌細胞株に対するin vitro 細胞増殖抑制作用は、ミリプラチン懸濁液を 用いて検討した。油性の懸濁液を直接細胞に接触させないため、評価方法は、軟寒天層を 介して薬剤を作用させるコロニー法及び細孔を有する膜を介して薬剤を作用させるメンブ レン法を選択した。ミリプラチン懸濁液から放出される白金成分がin vitro 細胞増殖抑制作 用を示すことは、ラット及びヒト肝癌細胞株を用いてメンブレン法により確認した。ミリ プラチン懸濁液から放出される活性分子種は、他の白金系制癌剤と同様に、生体内では主 に塩素イオンが配位したDPC として存在すると考えられたため(2.6.4.5.2 及び 2.6.4.5.3 参 照)、DPC の in vitro 細胞増殖抑制作用も検討した。ミリプラチン、シスプラチン、ジノス タチン スチマラマーのラット及びヒト肝癌細胞株に対する in vitro 細胞増殖抑制作用の比 NH3 Pt NH3 Cl Cl H2 N Pt2+ N H2 H H H2 N Pt N H2 H H C13H27COO C13H27COO NH3 Pt2+ NH3 NH3 Pt NH3 O OC OC O H2 N Pt N H2 H H O OC OC O NH3 Pt NH3 H2 N Pt N H2 H H シスプラチン カルボプラチン オキサリプラチン ミリプラチン
脱離基
活性分子種
白金-DNAアダクト
DACH-Pt(II) Cl-が配位するとDPC Cl-が配位するとシスプラチンアポトーシス
較は、ヨード化ケシ油脂肪酸エチルエステルの各懸濁液を用いてコロニー法により行った。 ラット肝癌細胞株 AH109A 又はヒト肝癌細胞株 Li-7 移植ラット肝癌モデルにおける in vivo 細胞増殖抑制作用は、ミリプラチン懸濁液、シスプラチン懸濁液及びジノスタチン ス チマラマーのヨード化ケシ油脂肪酸エチルエステル懸濁液(ジノスタチン スチマラマー懸 濁液)を肝動脈内投与して比較した。両移植肝癌モデルにおいて、ミリプラチン懸濁液の in vivo 細胞増殖抑制作用の用量依存性を検討するとともに、臨床で使用される場合と同じ 薬剤濃度のミリプラチン懸濁液(20 mg/mL)、シスプラチン懸濁液(20 mg/mL)及びジノ スタチン スチマラマー懸濁液(1 mg/mL)を用いて、効力を比較した。なお、検討するに あたり、これらの移植肝癌モデルにおいて、移植腫瘍への血液供給が主に肝動脈からであ ること及び肝動脈内に投与された懸濁用液が腫瘍部位選択的に滞留することを検証し、こ れらの点において、両モデルがヒト肝細胞癌の病態を反映していることを確認した。 ミリプラチン懸濁液の肝動脈内投与後の肝臓内動態は、AH109A 株移植ラット肝癌モデ ルを用い、腫瘍部位の白金濃度、白金量の推移及びDACH 骨格を14C 標識したミリプラチ ン([14C]ミリプラチン)を用いたミクロオートラジオグラフィー(ミクロ ARG)による放 射能の分布から解析した。 ミリプラチンの作用機序が、他の白金系制癌剤と同様に、活性分子種を介することを確 認するため、in vitro 及び in vivo での白金-DNA アダクト形成作用とアポトーシス誘導作用 を検討した。 ミリプラチンの一般薬理試験として、種々の器官系に対する薬力学的作用を評価し、そ の結果を安全性薬理試験の評価資料とした。なお、ミリプラチンのin vivo 試験は、全身曝 露時の評価を目的として、ミリプラチンエマルション製剤(ミリプラチンをヨード化ケシ 油脂肪酸エチルエステルに懸濁した液を油相としたO/W エマルション製剤)を用いて、単 回静脈内投与で実施した。また、ミリプラチンの活性体であるDPC については、特に重要 な器官である中枢神経系(Irwin の症状観察)及び呼吸·循環器系(麻酔イヌ)に対する作 用に加え、ミリプラチンで評価した摘出器官も同様に評価した。DPC の in vivo 試験は、全 身曝露可能な単回静脈内投与(イヌ)又はその代替投与経路である単回皮下投与(ラット) で実施した。 薬理試験に関する申請データパッケージの概略を表 2.4.1-1 に示した。
表 2.4.1-1 薬理試験に関する申請データパッケージの概略 分類 試験の種類 評価項目 懸濁液によるin vitro 細胞増殖抑制作用 (コロニー法) 懸濁液によるin vitro 細胞増殖抑制作用 (メンブレン法) DPC の in vitro 細胞増殖抑制作用 in vitro 細胞増殖抑制作用 DPC の作用様式(AUC 依存性) 腫瘍への血液供給 懸濁用液の腫瘍組織滞留性 ミリプラチン懸濁液の用量依存性 シスプラチン懸濁液の用量依存性 ジノスタチン スチマラマー懸濁液の用 量依存性 in vivo 細胞増殖抑制作用 (AH109A 株移植ラット肝癌モ デル) 効力の比較試験 腫瘍への血液供給 ミリプラチン懸濁液の用量依存性 in vivo 細胞増殖抑制作用 (Li-7 株移植ヌードラット肝癌 モデル) 効力の比較試験 組織内白金量の経時変化 効力を裏付ける試験 AH109A 株移植ラット肝癌モデ ルでの肝臓内動態 [14C]ミリプラチンの組織分布 DNA アダクト形成量 in vitro アポトーシス誘導 DNA アダクト形成量 作用機序 in vivo アポトーシス誘導 ミリプラチンの一般薬理試験 一般症状・行動、中枢神経系、呼吸・循 環器系、自律神経系・平滑筋、消化器系、 泌尿器系、血液系に及ぼす影響 安全性薬理 活性体DPC の一般薬理試験 一般症状・行動、呼吸・循環器系、自律 神経系・平滑筋、血液系に及ぼす影響 2.4.1.2 薬物動態試験計画概略 薬物動態試験に関しては、臨床移行に先立ち、平成3 年 1 月 29 日付薬新薬第 6 号「薬 物動態試験ガイドライン」に則り、イヌにおけるミリプラチン懸濁液(ミリプラチンをヨ ード化ケシ油脂肪酸エチルエステルに分散した懸濁液)の肝動脈内投与試験及び全身曝露 での毒性評価を目的とした代替投与経路であるラットにおけるミリプラチンエマルション 製剤(ミリプラチンをヨード化ケシ油脂肪酸エチルエステルに懸濁した液を油相とした O/W エマルション製剤)を用いた静脈内投与試験を行った。イヌにおけるミリプラチン懸 濁液の肝動脈内投与試験では、原子吸光法により白金測定を行い、白金は肝臓に選択的に 到達して滞留すること、肝臓からの放出が極めて緩やかであり、血中濃度は定量限界未満 の低濃度で推移することを確認した。更にラットにおけるミリプラチンエマルション製剤 の静脈内投与試験では、毒性所見を動態面から裏付ける結果を得た。これらの結果から、 本剤の臨床移行の可否を判断した。その後に示された平成10(1998)年 11 月 13 日医薬審
第1019 号「医薬品の臨床試験のための非臨床安全性試験の実施時期についてのガイドライ ンについて」に照らしても、国内の臨床移行の妥当性に問題はないことを確認した。 申請に際しては、平成10(1998)年 6 月 26 日医薬審第 496 号「非臨床薬物動態試験ガ イドライン」に則り、必要な薬物動態試験を実施して申請データパッケージとした。 薬物動態試験に関する申請データパッケージの概略を表 2.4.1-2 に示した。 表 2.4.1-2 薬物動態試験に関する申請データパッケージの概略 分類 評価項目 投与方法 動物種 白金濃度測定法(ICP-MS)バリ デーション - ラット、イヌ 分析法 メタノール抽出方法 - ラット、イヌ 単回投与 肝動脈内 担癌ラット、イヌ エマルション製剤の吸収 静脈内 ラット 投与経路比較 肝動脈内、皮下、静脈内 ラット 吸収 反復投与 肝動脈内 イヌ 単回投与 肝動脈内 イヌ 肝臓内分布 肝動脈内 イヌ エマルション製剤の分布 静脈内 ラット 単回投与 皮下 ラット 分布 胎児移行 皮下 ラット in vivo 代謝 肝動脈内 イヌ in vitro 代謝 in vitro ラット、イヌ、ヒト 代謝 DPC の生成・消失 in vitro ラット、緩衝液 単回投与 肝動脈内 イヌ エマルション製剤の排泄 静脈内 ラット 単回投与 皮下 ラット 排泄 乳汁中移行 皮下 ラット 肝薬物代謝酵素系への影響 肝動脈内 ラット 薬物動態学的 相互作用 CYP 阻害 in vitro ヒト 肝障害、腎障害 肝動脈内 イヌ DPC の動態 皮下 ラット、イヌ ヨード化ケシ油脂肪酸エチル エステルのイヌ動態 肝動脈内 イヌ その他の薬物 動態試験 ヨード化ケシ油脂肪酸エチル エステルのラット動態 静脈内、皮下 ラット ミリプラチンは、ヨード化ケシ油脂肪酸エチルエステルに懸濁して肝動脈内投与するこ とにより、肝臓に選択的に到達して長期間滞留させ、滞留した局所で白金成分の放出を持 続させることを意図した薬剤である。この薬物動態学的特徴を評価するため、臨床と同じ 投与方法(大腿動脈からのカテーテル挿入による投与)が可能なイヌを用いて、長期間(3 ヵ月)にわたり基本動態の検討を行った。ラットについては、肝動脈内投与(開腹し、直
接肝動脈に投与)に加え、代替投与経路で実施した毒性試験に対応して、皮下投与及び静 脈内投与による基本動態の評価も行った。 測定は、白金錯体の曝露評価として広く用いられている白金を対象とし、ICP-MS 法 に より実施した。それに加え、DACH 骨格を14C 標識した[14C]ミリプラチンを使用して放射 能の測定も実施した。 シスプラチンやオキサリプラチン等の白金錯体は血中で蛋白に不可逆的に結合すること が知られているため文献27)、ミリプラチンの血中濃度測定においては、全身循環に移行した 総薬物量の指標としての血漿又は血清中総放射能又は白金濃度測定に加え、蛋白可逆結合 型成分及び蛋白非結合型成分が含まれるメタノール抽出画分放射能又は白金濃度、並びに 蛋白非結合型成分が含まれる限外濾過液中放射能又は白金濃度測定を行った。 また、ミリプラチン懸濁液は肝臓に長期間滞留したことから、安全性の観点から肝臓内 における放射能の分布形態を細胞レベルで評価した。 ミリプラチンの代謝消失過程は、in vivo で肝動脈内投与後のイヌ試料を分析するととも に、in vitro における血清との反応生成物の分析、並びに活性体である DPC の生成及び消 失に関する検討を行うことにより明らかにできると考えた。 [14C]ミリプラチン投与後の一部の生体試料(血漿、尿及び肝臓の代表的な時点)中ミリ プラチン未変化体及び活性体DPC 濃度の測定は、HPLC-放射線検出法により実施した。未 変化体は抗腫瘍活性を有していないこと、及び未変化体は、脱離基が生体成分と速やかに 置換するために血中濃度は極めて低いことから、詳細な血中濃度測定は実施しなかった。 また、活性体DPC の血中濃度も、in vivo 生体試料中ではいずれも検出限界未満と極めて低 かったため、詳細な血中濃度測定は実施しなかった。 毒性試験に対応して実施したDPC 投与時の動態試験は、ラット及びイヌを用いて皮下投 与することにより評価した。 溶媒であるヨード化ケシ油脂肪酸エチルエステル(懸濁用液)の動態は、125I 標識した 懸濁用液をイヌに臨床投与経路である肝動脈内投与し、また14C 標識した懸濁用液をラッ トに毒性試験の投与経路である皮下投与及び曝露比較のため静脈内投与を行い評価した。 2.4.1.3 毒性試験計画概略 ミリプラチンの毒性試験については、平成4 年 6 月 29 日付薬新薬第 43 号「新医薬品の 臨床評価に関する一般指針について」に則り、臨床試験への移行に際して必要な試験を実 施した。 また、承認申請に際しては、平成元年9 月 11 日付薬審 1 第 24 号「医薬品毒性試験法ガ イドライン」、平成5 年 8 月 10 日付薬新薬第 88 号「単回及び反復投与毒性試験ガイドライ ンの改正について」、平成9 年 4 月 14 日付薬審第 316 号「医薬品の生殖発生毒性試験に係 るガイドラインの改正について」、平成8 年 7 月 2 日付薬審第 443 号「トキシコキネティク ス(毒性試験における全身的暴露の評価)に関するガイダンスについて」、平成8 年 7 月 2
日付薬審第444 号「医薬品のための遺伝毒性試験の特定項目に関するガイダンスについて」、 平成11 年 11 月 1 日付医薬審第 1604 号「医薬品の遺伝毒性試験に関するガイドラインにつ いて」及び平成11 年 4 月 5 日付医薬審第 655 号「反復投与毒性試験に係るガイドラインの 一部改正について」に則り実施した試験(GLP 適用)を申請データパッケージとした。ま た、前期及び後期第II 相臨床試験で認められた好酸球数増加(2.7.4.4.2 参照)の機序解明 に関する探索的検討試験(GLP 非適用)については、参考データとした。 毒性試験に関する申請データパッケージの概略を表 2.4.1-3 に示した。 表 2.4.1-3 毒性試験に関する申請データパッケージの概略 試験分類 動物種及び試験略称 評価項目 イヌ単回(GLP)a) 毒性発現、TK 肝障害イヌ単回(GLP) 毒性発現、TK イヌ3 ヵ月反復(GLP) 毒性発現、TK 臨床投与経路にお ける一般毒性 イヌ12 ヵ月反復(GLP) 毒性発現、TK ラット、イヌ単回(GLP)a) 毒性発現、概略致死量 代替投与経路(静 注)における一般 毒性 ラット、イヌ1 ヵ月反復(GLP) a) 毒性発現、回復性 ラット単回(GLP) 毒性発現、TK、概略致死量 ラット1 ヵ月反復(GLP) 毒性発現、TK、回復性 代替投与経路(皮 下投与)における 一般毒性 ラット 6 ヵ月反復(GLP) 毒性発現、TK、回復性 ラット皮下投与受胎能及び胚・胎児 (GLP) 受胎能、胚・胎児への影響、TK ウサギ皮下投与胚・胎児(GLP) 胚・胎児への影響、TK 生殖発生毒性 ラット皮下投与生後(GLP) 母動物、出生児の発育・分化への影響、 TK 併用投与 ラット2 週間反復皮下(GLP) 6 種併用薬、毒性発現 モルモットASA(GLP)a) モルモットPCA(GLP) マウス-ラット PCA(GLP) ウサギASA、ウサギ-モルモット PCA(GLP) 抗原性の有無 抗原性 好酸球数増加に関する検討(GLP 非 適用:参考データ) 好酸球数増加、抗体産生 復帰突然変異(GLP)a) 染色体異常(GLP)a) 遺伝毒性 小核(GLP)a) 遺伝毒性の有無 ラット単回皮下(GLP) 毒性発現、TK、概略致死量 イヌ単回皮下(GLP) 毒性発現、TK ラット4 週反復皮下(GLP) 毒性発現、TK、回復性 ラット単回肝動注(GLP) 糖尿病様変化発現の検討、TK 活性体DPC の毒性 小核(GLP) 遺伝毒性の有無 a) 第 I 相臨床試験移行時の安全性評価に用いた試験
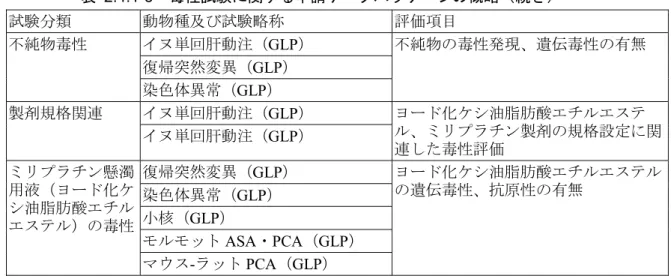
表 2.4.1-3 毒性試験に関する申請データパッケージの概略(続き) 試験分類 動物種及び試験略称 評価項目 イヌ単回肝動注(GLP) 復帰突然変異(GLP) 不純物毒性 染色体異常(GLP) 不純物の毒性発現、遺伝毒性の有無 イヌ単回肝動注(GLP) 製剤規格関連 イヌ単回肝動注(GLP) ヨード化ケシ油脂肪酸エチルエステ ル、ミリプラチン製剤の規格設定に関 連した毒性評価 復帰突然変異(GLP) 染色体異常(GLP) 小核(GLP) モルモットASA・PCA(GLP) ミリプラチン懸濁 用液(ヨード化ケ シ油脂肪酸エチル エステル)の毒性 マウス-ラット PCA(GLP) ヨード化ケシ油脂肪酸エチルエステル の遺伝毒性、抗原性の有無 ミリプラチン懸濁液は腫瘍近傍血管を目指した肝動脈内投与が適用されることから、本 剤の安全性評価は、1)腫瘍周辺の正常肝細胞(非腫瘍部肝組織)に対する影響、2)投与液 が漏洩したときの肝動脈周辺への影響、3)全身への影響について明らかにすることが必要 であると考えた。そこで、臨床投与経路である肝動脈内投与を実施し、更に、肝動脈内投 与では十分な全身曝露が期待できないため、代替投与経路(静脈内及び皮下)を用いて、 全身に対する影響を調べた。 肝動脈内投与については、臨床と同様のカテーテル挿入手技が実施可能で、X 線投影も 実施できるイヌで実施した。代替投与経路については、まず、静脈内投与を選択し、ミリ プラチンエマルション製剤を用いて、イヌ及びラットで1 ヵ月間までの短期毒性試験を実 施した。臨床移行においては、上述のイヌ単回肝動脈内投与試験、イヌ・ラット1 ヵ月間 静脈内投与試験、遺伝毒性試験並びにモルモット抗原性試験を実施してその安全性を評価 し、移行の可否を判断した。 長期の毒性試験については、投与局所への長期間高濃度曝露を達成する評価系として、 イヌでは臨床投与経路である肝動脈内投与で実施した。また、対象の肝細胞癌では慢性肝 炎や肝硬変を併発していることが多いため、肝障害を誘発したイヌについてもあわせて肝 動脈内投与による毒性を検討した。一方、ラットでは、上述のミリプラチンエマルション 製剤はエマルション製剤ビークル(ミリプラチンエマルション製剤と同一組成を持つ、ミ リプラチンを含まない製剤)の影響と考えられる血液循環障害を発現したため、長期毒性 評価には、より適切な第二の代替投与経路を検索した。臨床での投与形態を考慮したミリ プラチン懸濁液を用いて、腹腔内投与と皮下投与間での比較を行い、トキシコキネティク スの結果及び投与部位への影響を考慮して皮下投与を選択し、全身曝露での安全性評価を 実施することとした。なお、生殖発生毒性の評価についても皮下投与を選択した。 全身曝露の指標としては、活性発現に必要な白金を含む成分を測定した。血中総白金濃 度(蛋白結合型白金成分及び蛋白非結合型白金成分の両方を含む)を測定すると共に、蛋 白に不可逆的に結合した成分は抗癌剤としての生理活性を有しないと考えられるため、一
部の試験についてはこれらを除いた成分、すなわち、血中メタノール抽出画分白金濃度(蛋 白に可逆的に結合した白金成分及び蛋白非結合型白金成分を含む)を活性体DPC を含むと 考えられる画分として測定した。なお、ラット反復皮下投与試験(生殖発生毒性試験を含 む)においては、血中総白金濃度の消失を指標に、その投与間隔並びに試験条件を決定し た。 局所刺激性試験については、一般毒性試験の中で評価を実施した。 抗原性試験については、4 試験(GLP 試験)を実施し、臨床試験において有害事象とし て「好酸球百分率増加」が見られたため、好酸球数増加に関する機序検討も加えた。好酸 球数増加に関する検討については、探索的な内容であったためGLP で実施しなかった。 がん原性試験については、ミリプラチンは遺伝毒性が確認されているため、実施しなか った。 更に、活性体であるDPC については、全身曝露での安全性評価を実施するため、皮下投 与(一般毒性試験)及び腹腔内投与(遺伝毒性試験)を行い、DPC の毒性の質的把握を行 った。なお、DPC はミリプラチン懸濁液投与後、ミリプラチン懸濁液から生体中に放出さ れるが、蛋白などとの反応により速やかに消失し、循環血中では検出されないことから、 DPC 投与試験の曝露を元にした毒性の量的な把握は困難と判断し実施しなかった。一方、 本検討において糖尿病様変化が見られたことについては、後期第II 相臨床試験の治験計画 届における照会事項に対応して、ラットへのDPC 肝動脈内投与試験を実施して追加評価を 行った。 ミリプラチンの懸濁用液であるヨード化ケシ油脂肪酸エチルエステルの安全性評価につ いては、各種毒性試験の溶媒対照群で検討すると共に、抗原性試験及び遺伝毒性試験を実 施して評価した。 以上、ミリプラチンの安全性評価においては、局所投与(肝動脈内投与)であること、 活性体DPC が投与局所で放出されて薬理効果を示すと考えられることなどの特徴のほか、 対象が肝細胞癌患者であり、肝予備能への配慮が必要であること、また、がん患部の大き さに応じた液量が投与されること(投与液量が個々に設定されること)などの臨床適用上 の特殊性、更に、懸濁用液が油性溶媒であることなどの物性面での制約など、多面的な特 殊要因があることから、それらの特殊性を十分に考慮した評価系を選択し実施した。
2.4.2 薬理試験 2.4.2.1 効力を裏付ける試験 2.4.2.1.1 In vitro 細胞増殖抑制作用 ミリプラチンは、ヨード化ケシ油脂肪酸エチルエステルとの懸濁液として用いることか ら、in vitro 細胞増殖抑制作用の検討はミリプラチン懸濁液で行った。油性の懸濁液を直接 細胞に接触させないため、評価方法は軟寒天層を介して薬剤を作用させるコロニー法を選 択した。ミリプラチン懸濁液、シスプラチン懸濁液及びジノスタチン スチマラマー懸濁液 のラット肝癌細胞株AH109A に対する IC50は、それぞれ懸濁用液中の濃度として31、4.9 及び98 µg/mL であり、ヒト肝癌細胞株 HepG2 に対する IC50は、それぞれ1.9、3.3 及び 29 µg/mL であった。IC50を指標にコロニー形成抑制作用を比較すると、ミリプラチン懸濁液 はシスプラチン懸濁液とは明らかな差はなく、ジノスタチン スチマラマー懸濁液よりも強 い作用を示した(p<0.01)。 次に、ミリプラチン懸濁液のin vitro 細胞増殖抑制作用が、懸濁液から放出される白金成 分を介して発現することをより明確にするために、細孔を有する膜を介して懸濁液と細胞 培養液が接触するメンブレン法を用いて、ミリプラチン懸濁液及びシスプラチン懸濁液の in vitro 細胞増殖抑制作用を検討するとともに、その時の培地中白金濃度を測定した。シス プラチン懸濁液のAH109A 株、HepG2 株及びヒト肝癌細胞株 Li-7 に対する 7 日間薬剤接 触でのIC50は、それぞれ懸濁用液中の濃度として0.14、0.50 及び 0.52 µg/mL であった。ミ リプラチン懸濁液のIC50は、それぞれ0.89、2.6 及び 7.1 µg/mL であり、ミリプラチン懸濁 液はシスプラチン懸濁液の1/5~1/14 の in vitro 細胞増殖抑制作用を示した。また、いずれ の懸濁液の場合にも、薬剤処理濃度に依存して培地中白金濃度が増加し、培地中白金濃度 の増加に伴って、in vitro 細胞増殖抑制作用が強くなった。 以上のことから、ミリプラチンは、ヨード化ケシ油脂肪酸エチルエステルとの懸濁液と して用いた場合には、ラット及びヒト肝癌細胞株に対してin vitro 細胞増殖抑制作用を有す ることが示された。また、その作用は培地中への白金成分の放出を介して発現することが 示唆された。一方、水への溶解性が0.0026 mg/mL 未満と低いミリプラチンは(2.3.S.1.3.2 参照)、懸濁用液を用いない場合、AH109A 株、HepG2 株、Li-7 株及びヒト肝癌細胞株 HuH-7 のいずれに対しても、in vitro 細胞増殖抑制作用を示さなかった。これらのことから、未変 化体としてのミリプラチンではなく、ミリプラチンに由来する白金成分が、ミリプラチン 懸濁液から培地中へ放出され、in vitro 細胞増殖抑制作用が発現すると考えられた。 一般に、担体配位子にDACH 骨格を有する白金系制癌剤は、脱離基を遊離した活性分子 種(DACH-Pt(II))が白金-DNA アダクトを形成し、効力を発現する文献24)。図 2.4.1-1 に 示したオキサリプラチンを含めて、担体配位子にDACH 骨格を有するテトラプラチン、マ ロナトプラチン及びNDDP の場合には、求核置換反応により脱離基が遊離した活性分子種 は 、 培 地 中 や 生 体 内 等 で 塩 素 イ オ ン が 配 位 し た DPC と し て 存 在 す る文 献 27),28),29),30),31),32),33),34),35),36)。その後、DPC はアミノ酸配位体や蛋白結合体へと速やかに変換 されることが報告されている文献28),29),31),32),34)。白金系制癌剤の求核置換反応は、非酵素的な
物理化学的反応であるため、脱離基と置換する求核因子は様々であるが、生体内で高濃度 に存在する求核因子は塩素イオンであることから、アミノ酸、蛋白質又は核酸などの生体 分子と非可逆的に結合する前の活性分子種は、生体内では主に塩素イオンが配位したDPC として存在すると考えられた。 従って、ミリプラチン懸濁液から放出され、効力を発現する白金成分もまた、ミリスチ ン酸が脱離した活性分子種であることが予想された。実際に、ミリプラチン懸濁液をNaCl 含有水溶液や Earle 緩衝液(アミノ酸や蛋白質を含まないことを除き、組成は血清や培地 と類似した緩衝液)と混合し、懸濁用液から放出された成分を分析すると、DPC、DPCI (塩素イオンとヨウ素イオンが配位したDACH-Pt(II))又は DPI(ヨウ素イオンが配位し たDACH-Pt(II))が生成することが示されている(2.6.4.5.4 及び 2.6.4.5.3 参照)。更に、 ミリプラチン懸濁液をヒト、イヌ又はラットの血清と混合すると、いずれの場合にも反応 2 時間後において、蛋白結合体やアミノ酸配位体に加えて、DPC の生成が認められている (2.6.4.5.2 参照)。 以上の結果から、ミリプラチン懸濁液から放出され、アミノ酸、蛋白質又は核酸等の生 体分子と非可逆的に結合する前の活性分子種は、担体配位子にDACH を有する他の白金系 制癌剤と同様に、主に塩素イオンが配位したDPC として存在することが確認された。 そこで、in vitro でミリプラチン懸濁液からの放出成分として確認された DPC 及び DPI のin vitro 細胞増殖抑制作用と DPC の作用様式を検討した。AH109A 株、HepG2 株、HuH-7 株及びLi-7 株に対する 3 日間接触での in vitro 細胞増殖抑制作用の IC50は、シスプラチン では0.30~1.2 µg/mL、ジノスタチン スチマラマーでは 0.13~0.69 µg/mL であったのに対 し、DPC は 0.14~1.9 µg/mL、DPI は 0.83~6.5 µg/mL であり、DPC はシスプラチンやジノ スタチン スチマラマーと同程度の in vitro 細胞増殖抑制作用を示した。 更に、AH109A 株に対する IC90値と薬剤処理時間の相関を検討したところ、DPC はドキ ソルビシン塩酸塩やシスプラチンと同様に、ほぼ傾き-1 の直線に回帰できたことから、作 用様式はAUC 依存性であると考えられた。このことを更に確認するため、DPC の一括添 加から10 分割添加までの各条件で、AH109A 株に対する IC90を求め、IC90で添加した場合 の培地中DPC 濃度推移を、添加条件毎にシミュレートした。その結果、IC90でのDPC の AUC すなわち白金曝露量は、分割回数によらず、0.43~0.59 µg·hr/mL とほぼ一定であった。 更に、培地中濃度推移のシミュレート結果から、DPC は低濃度でも長時間作用することに より、in vitro 細胞増殖抑制作用を発現することが示唆された。 以上の結果から、ミリプラチン懸濁液から放出された活性分子種は、主にDPC として存 在し、DPC は白金曝露量に依存した in vitro 細胞増殖抑制作用を有することが確認された。 白金系制癌剤は生体内でアミノ酸や蛋白質などと反応し速やかに不活化される文献25)。実 際に、DACH 骨格を14C 標識した DPC([14C]DPC)を血清と混合すると、DPC は半減期 1 時間で消失することが示されている(2.6.4.5.4 参照)。一方、ミリプラチン懸濁液の in vitro 細胞増殖抑制作用を検討したメンブレン法において、IC50の薬剤処理濃度での7 日後の培 地中白金濃度は定量下限(0.04 µg/mL)をわずかに上回る 0.054 µg/mL と推定された。培地
中のアミノ酸や蛋白質などと未反応のDPC 濃度は総白金濃度よりも更に低く、定量限界未 満の低濃度であると考えられたため、ミリプラチン懸濁液から放出されるDPC の定量的な 解析及びin vitro 細胞増殖抑制作用への寄与を検討する試験は実施しなかった。 なお、後述するように、in vitro 細胞増殖抑制作用の検討と同様にメンブレン法を用いた 場合、ミリプラチン懸濁液で処理した細胞において、白金-DNA アダクトの形成及びアポ トーシスの誘導が示されている(2.4.2.1.4 参照)。このことは、in vitro において、他の白 金系制癌剤と同様の活性分子種がミリプラチン懸濁液から生成していることを裏付けるも のである。 2.4.2.1.2 In vivo 細胞増殖抑制作用 ミリプラチン懸濁液のin vivo 細胞増殖抑制作用は、ラット肝癌細胞株 AH109A 又はヒト 肝癌細胞株Li-7 を肝臓内に移植するラット移植肝癌モデルを用いて評価した文献37)。 最初に、AH109A 株移植ラット肝癌モデルが肝動脈塞栓療法に用いる薬剤の評価に適し ていることを確認するため、腫瘍組織への血液供給と懸濁用液の腫瘍滞留性を検討した。 その結果、本モデルでは、門脈内に投与されたX 線造影剤は正常肝組織全体に分布し腫瘍 組織にはほとんど分布しなかったのに対し、肝動脈内に投与されたX 線造影剤は腫瘍組織 に選択的に分布した。これらのことから、本モデルにおける腫瘍への血液供給は、主に肝 動脈からであることが確認された。続いて、懸濁用液を本モデルの肝動脈内に投与すると、 懸濁用液は投与1 週間後まで腫瘍部位選択的に滞留することが確認された。 以上の結果は、ヒトの正常肝組織への血液供給が門脈から約75%、肝動脈から約 25%の 割合であるのに対し、ヒト肝細胞癌組織への血液供給はほぼ 100%肝動脈からであること や文献 1),2),3),4),5)、肝動脈内に投与された懸濁用液がヒト肝細胞癌組織に選択的にかつ長期間 滞留すること文献1),6),7),8)とよく一致した。従って、腫瘍組織への血液供給及び懸濁用液の腫 瘍滞留性の観点からは、AH109A 株移植ラット肝癌モデルがヒト肝細胞癌の病態を反映し ており、本モデルは、肝動脈内投与によるミリプラチン懸濁液のin vivo 細胞増殖抑制作用 の評価に適していると考えられた。 そこで、本モデルを用いて、ミリプラチン懸濁液、シスプラチン懸濁液及びジノスタチ ン スチマラマー懸濁液の in vivo 細胞増殖抑制作用を、投与 1 週間後の腫瘍増殖率を指標 に比較した。 はじめにミリプラチン、シスプラチン及びジノスタチン スチマラマーの各懸濁液の in vivo 細胞増殖抑制作用について、各々の用量依存性を確認した。なお、懸濁用液に懸濁可 能なミリプラチンの最高濃度が20 mg/mL であったため、in vivo 細胞増殖抑制作用は、ミ リプラチン濃度20 mg/mL までの濃度範囲で検討した。ミリプラチン懸濁液群では、0.2、2 及び20 mg/mL の濃度範囲で用量依存的に腫瘍増殖率が低下し、懸濁用液群の腫瘍増殖率 273%に対し、ミリプラチン濃度 20 mg/mL では 79%と腫瘍増殖率が有意に低下した (p=0.0012)。同様に、シスプラチン懸濁液群では、5、10 及び 20 mg/mL の濃度範囲で用 量依存的に腫瘍増殖率が低下し、10 及び 20 mg/mL において腫瘍増殖率が有意に低下した
(それぞれp=0.0001 及び<0.0001)。ジノスタチン スチマラマー懸濁液群では、1、2 及び 5 mg/mL の濃度範囲で用量依存的に腫瘍増殖率が低下し、5 mg/mL において腫瘍増殖率が 有意に低下した(p=0.0039)。投与前後での体重変化を検討した結果、シスプラチン懸濁液 群では用量依存的に体重が減少し、懸濁用液群と比較して、シスプラチン濃度 10 mg/mL では明らかな減少は認められなかったが、20 mg/mL では有意に減少していた(p=0.0079)。 一方、ミリプラチン懸濁液群やジノスタチン スチマラマー懸濁液群では、懸濁用液群と比 較して、いずれの用量においても有意な減少は認められなかった。 次に、臨床で使用される場合と同じ薬剤濃度のミリプラチン懸濁液、シスプラチン懸濁 液及びジノスタチン スチマラマー懸濁液を用いて、in vivo 細胞増殖抑制作用を比較した。 局所療法である肝動脈塞栓療法では、主に腫瘍の大きさ、血流動態、肝障害の程度に応じ て投与液量が個別に調整される。そのため、局所における有効性の根拠となる薬剤曝露量 (投与量)は、懸濁用液中の薬剤濃度に依存すると考えられる。また、全身投与と異なり、 局所療法では投与量を規定するのに通常利用される最大耐量などの指標が得られないこと から、薬剤間の効力比較は、臨床で使用される場合と同じ薬剤濃度で行うのが適当と考え た。 前期及び後期第II 相臨床試験で用いたミリプラチン懸濁液の濃度は 20 mg/mL であり、 臨床で用いられているジノスタチン スチマラマー懸濁液の濃度は 1 mg/mL である文献10),11)。 また、シスプラチン懸濁液の場合には、20 mg/mL の濃度での治療経験が報告されている文 献15),23)。そこで、それぞれの懸濁用液中の薬剤濃度を「臨床用量」と定義し、この「臨床 用量」における各薬剤のin vivo 細胞増殖抑制作用について、AH109A 株移植ラット肝癌モ デルを用いて比較した。その結果、懸濁用液群では腫瘍増殖率が185%であったのに対し、 ミリプラチン懸濁液群及びシスプラチン懸濁液群の腫瘍増殖率はそれぞれ67 及び 33%と、 懸濁用液群と比較して腫瘍増殖率が有意に低下していた(ともに p<0.0001)。一方、ジノ スタチン スチマラマー懸濁液群の腫瘍増殖率は 175%で、懸濁用液群との差は認められな かった。また、体重変化については、比較したいずれの群間にも有意な差は認められなか った。なお、本モデルにおいて、薬剤投与を行わなかった無処置群の腫瘍増殖率は 213% であり、懸濁用液単独では、腫瘍増殖率に影響を与えないことが示された。 次に、ヒト腫瘍に対するミリプラチン懸濁液のin vivo 細胞増殖抑制作用を評価するため に、xenograft の手法を用いて、ヒト肝癌細胞株 Li-7 がヌードラットの肝臓内で増殖する移 植肝癌モデルを新たに作製した。本モデルについても、最初に腫瘍組織への血液供給を確 認した。その結果、門脈内に投与されたX 線造影剤は正常肝組織全体に分布し腫瘍組織に はほとんど分布しなかったのに対し、肝動脈内に投与されたX 線造影剤は腫瘍組織に選択 的に分布した。これらのことから、本モデルにおける腫瘍組織への血液供給も主に肝動脈 からであることが確認された。 そこで、Li-7 株移植ヌードラット肝癌モデルを用いて、ミリプラチン、シスプラチン及 びジノスタチン スチマラマーの各懸濁液の in vivo 細胞増殖抑制作用を、投与 2 週間後の
腫瘍増殖率を指標に比較した。 はじめに、ミリプラチン懸濁液のin vivo 細胞増殖抑制作用について、用量依存性を確認 した。ミリプラチン懸濁液群では、2、6 及び 20 mg/mL の濃度範囲で用量依存的に腫瘍増 殖率が低下し、懸濁用液群の腫瘍増殖率263 %に対し、ミリプラチン濃度 20 mg/mL では 161 %と腫瘍増殖率が有意に低下した(p=0.0011)。一方、懸濁用液群と比較して、いずれ の用量においても有意な体重減少は認められなかった。 次に、本モデルを用いて、ミリプラチン、シスプラチン及びジノスタチン スチマラマー の各懸濁液の「臨床用量」におけるin vivo 細胞増殖抑制作用を比較した。その結果、懸濁 用液群では腫瘍増殖率が 266%であったのに対し、ミリプラチン懸濁液群及びシスプラチ ン懸濁液群(ともに20 mg/mL)の腫瘍増殖率はそれぞれ 188 及び 118%であり、懸濁用液 群と比較して腫瘍増殖率が有意に低下していた(それぞれp=0.0410 及び 0.0002)。一方、 ジノスタチン スチマラマー懸濁液群(1 mg/mL)の腫瘍増殖率は 221%で、懸濁用液群の 腫瘍増殖率との差は認められなかった。また、体重変化については、比較したいずれの群 間にも有意な差は認められなかった。なお、薬剤投与を行わなかった無処置群の腫瘍増殖 率は308%であり、前記の AH109A 株移植ラット肝癌モデルの場合と同様に、本モデルに おいても、懸濁用液単独では腫瘍増殖率に影響を与えないことが示された。従って、両移 植肝癌モデルにおけるミリプラチン懸濁液のin vivo 細胞増殖抑制作用は、懸濁液中のミリ プラチンにより発現し、懸濁用液自体にはin vivo 細胞増殖抑制作用はないと考えられた。 以上のことから、AH109A 株移植ラット肝癌モデル及び Li-7 株移植ヌードラット肝癌モ デルにおいて、ミリプラチン懸濁液は体重減少を伴わない用量でin vivo 細胞増殖抑制作用 を有することが示された。また、両モデルにおいて「臨床用量」でのin vivo 細胞増殖抑制 作用を比較すると、ミリプラチン懸濁液の作用は、シスプラチン懸濁液とは明らかな差は なく、ジノスタチン スチマラマー懸濁液よりも強いことが示された。 2.4.2.1.3 移植ラット肝癌モデルでの肝臓内動態 ミリプラチン懸濁液の肝臓内での動態は、AH109A 株移植ラット肝癌モデルを用いて検 討した。 まず、正常肝組織と腫瘍組織における薬剤分布の指標として、投与直後と投与1 週間後 で組織内白金濃度の推移を検討した。ミリプラチン懸濁液(20 mg/mL)を肝動脈に投与し た場合、投与直後に正常肝組織で3.0 µg/g、腫瘍組織で 6.0 倍高い 18 µg/g であり、投与 1 週間後に正常肝組織で4.3 µg/g、腫瘍組織で 8.6 倍高い 37 µg/g であった。すなわち、組織 内白金濃度は、正常肝組織に比べて腫瘍組織の方が高かった。シスプラチン懸濁液(20 mg/mL)の場合、投与直後に正常肝組織で 4.4 µg/g、腫瘍組織で 2.2 倍高い 9.5 µg/g、投与 1 週間後に正常肝組織で 1.2 µg/g、腫瘍組織で 3.3 倍高い 4.0 µg/g であった。ミリプラチン 懸濁液と同様に、シスプラチン懸濁液の場合にも、白金成分は正常肝組織に比べて腫瘍組 織により高濃度に分布した。なお、投与直後及び投与1 週間後ともに、シスプラチン懸濁
液と比較してミリプラチン懸濁液の場合の方が腫瘍組織内白金濃度は高かった。 ミリプラチン懸濁液及びシスプラチン懸濁液の濃度が20 mg/mL である場合、投与 1 週 間後までにin vivo 細胞増殖抑制作用により腫瘍が縮小するため(表2.6.2.2-7 及び表 2.6.2.2-8 参照)、腫瘍組織内白金濃度を見かけ上高めてしまうと考えられた。そのため、腫瘍組織に おける薬剤分布の持続性は、組織内白金濃度ではなく組織内総白金量の推移を指標にした。 ミリプラチン懸濁液の場合、投与直後に18 µg、投与 1 週間後に 17 µg が分布しており、腫 瘍組織内総白金量はほとんど減少しなかった。一方、シスプラチン懸濁液では、投与直後 に9.6 µg、投与 1 週間後には 1/3 以下の 2.8 µg が腫瘍組織に分布していた。 以上の結果から、ミリプラチン懸濁液及びシスプラチン懸濁液を肝動脈内に投与すると、 肝動脈に支配される腫瘍組織に正常肝組織よりも白金成分が高濃度に分布することが確認 された。更に、ミリプラチン懸濁液では、組織に分布した白金成分が投与1 週間後までほ とんど減少することなく、組織への白金成分の分布がシスプラチン懸濁液の場合よりも持 続することが確認された。 次に、 [14C]ミリプラチン懸濁液(20 mg/mL)を肝動脈内投与し、ミクロ ARG により肝 臓内での放射能の分布を詳細に解析した。その結果、投与直後では、正常肝組織及び腫瘍 組織ともに、放射能は主として血管腔内を塞栓する形で局所的に分布していた。投与1 週 間後の腫瘍組織においては、投与直後と同様、比較的径の大きい血管腔内を塞栓している と推測される分布像が観察された。一方、投与1 週間後の正常肝組織又は正常肝組織と腫 瘍組織の境界部においては、炎症性の細胞浸潤が散見され、放射能がマクロファージ様細 胞中に取り込まれている像が観察された。 以上のように、AH109A 株移植ラット肝癌モデルにおけるミリプラチン懸濁液の肝臓内 動態を、放射能又は白金成分の分布として検討した結果、これらの分布が腫瘍組織におい て投与1 週間後まで維持されることが示された。[14C]ミリプラチン懸濁液をイヌに肝動脈 内投与した場合には、投与翌日から13 週間後まで主にミリプラチンが未変化体として肝臓 中に分布することがHPLC-放射線検出法により確認されていることから(2.6.4.5.1 参照)、 本モデルにおいて、投与1 週間後まで腫瘍組織に分布した白金成分もまた、主に未変化体 としてのミリプラチンであると考えられた。 ミリプラチン懸濁液から血清への放出をin vitro で検討したところ、血清へ放出されずに 懸濁用液中に残存した白金成分は、ほぼ全量が未変化体としてのミリプラチンであった (2.6.4.5.2 参照)。また、前記の[14C]ミリプラチン懸濁液を用いたイヌでの検討において、 投与1 日後での脂肪染色により放射能分布とほぼ同じ部位に油状物質の存在が示されてい る(2.6.4.4.2 参照)。これらのことから、主にミリプラチンが未変化体として懸濁用液と挙 動を共にすると推察された。AH109A 株移植ラット肝癌モデルにおいて、懸濁用液は投与 1 週間後まで腫瘍部位に分布していたことから、ミリプラチン懸濁液が腫瘍血管内腔に分 布し、懸濁用液中のミリプラチンは主に未変化体として存在していると推察された。 ミリプラチン懸濁液から放出される活性分子種は、生体内で主にDPC として存在すると 考えられたが、in vivo では検討を行ったいずれの試料からも DPC は検出されていない
(2.6.4.5.1 参照)。この理由は、ミリプラチン懸濁液からの白金成分の放出が緩やかである ことに加え、DPC が蛋白質やアミノ酸と結合し速やかに消失することにより(2.6.4.5.4 参 照)、生体中DPC 濃度が検出限界未満の極めて低濃度で推移するためであると考えられた。 しかし、DPC は白金曝露量に依存した in vitro 細胞増殖抑制作用を有していることから、 ミリプラチン懸濁液の効力と動態との関連は白金曝露量を基に考察した。メンブレン法に おいて、ミリプラチン懸濁液のIC50での培地中白金濃度は、薬剤添加1 週間後に 0.054 µg/mL と推定されたことから、放出速度が一定と仮定すれば、白金曝露量は4.5 µg·hr/mL(0.054 µg/mL×168 hr÷2)と計算された。一方、AH109A 株移植ラット肝癌モデルにおいて、ミリ プラチン懸濁液(20 mg/mL)を投与した場合、表 2.6.5.3-1 の血漿中総放射能濃度推移に基 づいて台形法により計算した血漿中白金曝露量は1.5 µg·hr/mL であった。局所投与である 肝動脈内投与では、末梢血中に比べて肝臓局所ではより高い(3 倍以上の)白金濃度推移 を示すと考えられたことから文献38),39)、腫瘍組織近傍での白金曝露量は、in vivo 細胞増殖抑 制作用を発現するのに十分な高さで推移していると推察された。更に、後述するように、 ミリプラチン懸濁液の投与により、腫瘍組織において白金-DNA アダクトの形成が示され ている(2.4.2.1.4 参照)。このことは、腫瘍局所において、活性分子種がミリプラチン懸濁 液から生成し、in vivo 細胞増殖抑制作用が発現していることを裏付けるものである。 従って、腫瘍組織選択的に滞留する懸濁用液の性質によって、肝動脈内に投与されたミ リプラチン懸濁液は腫瘍血管内腔に持続的に分布し、そこから放出される白金成分により in vivo 細胞増殖抑制作用を発現するものと推察された。 2.4.2.1.4 作用機序 シスプラチンを始めとする白金系制癌剤では、脱離基を遊離した活性分子種が白金-DNA アダクトを形成することにより細胞増殖抑制作用が発現し文献24),40)、白金系制癌剤による細 胞死の機構として、アポトーシス誘導が重要であると考えられている文献24)。 そこで、in vitro 細胞増殖抑制作用の検討と同様にメンブレン法を用いて、ミリプラチン の白金-DNA アダクト形成作用及びアポトーシス誘導作用を検討した。白金-DNA アダクト 形成作用は、薬剤処理後の細胞の DNA 画分に含まれる白金量を指標に検討した。その結 果、ミリプラチン懸濁液(100 µg/mL)及びシスプラチン懸濁液(15 µg/mL)で AH109A 株を3 日間処理した場合、DNA 画分に含まれる白金量は、それぞれ 509 及び 34.1 pg/µg DNA であった。従って、シスプラチンと同様に、ミリプラチンは白金-DNA アダクト形成作用 を有することが示された。 次に、アポトーシスが誘導された細胞の DNA ヒストグラムを解析した時に観察される subG1 画分を指標に、ミリプラチン懸濁液のアポトーシス誘導作用を検討した。懸濁用液 のみでAH109A 株を 3 日間処理した場合、sub G1 の比率は 7.4%であった。これに対し、 ミリプラチン懸濁液(100 µg/mL)及びシスプラチン懸濁液(15 µg/mL)の処理では、sub G1 の比率は、それぞれ42.1 及び 44.9%であった。従って、シスプラチンと同様に、ミリプラ チンはアポトーシス誘導作用を有することが示された。
なお、前述したように、ミリプラチン懸濁液のin vitro 細胞増殖抑制作用は、培地中への 白金成分の放出を介して発現することが示唆されている(2.4.2.1.1 参照)。また、in vitro の検討から、ミリプラチン懸濁液から放出された活性分子種は、生体内で主にDPC として 存在することが示されている(2.6.4.5.2、2.6.4.5.3 及び 2.6.4.5.4 参照)。 これらのことから、ミリプラチン懸濁液のin vitro 細胞増殖抑制作用は、放出された活性 分子種を介して発現すると考えられた。 In vitro において、ミリプラチンが白金-DNA アダクト形成作用やアポトーシス誘導作用 を有することが示されたため、AH109A 株移植ラット肝癌モデルを用いて、これらの作用 をin vivo で検討した。その結果、ミリプラチン懸濁液及びシスプラチン懸濁液(ともに 20 mg/mL)を投与した 3 日後の腫瘍組織において、DNA 画分に含まれる白金量は、それぞれ 61 及び 6.6 pg/µg DNA であった。同様に、投与 3 日後の肝臓切片を用いて TUNEL 染色に よりアポトーシス誘導を解析した。その結果、無処置又は懸濁用液の投与の場合と比較し て、ミリプラチン懸濁液又はシスプラチン懸濁液(ともに20 mg/mL)を投与した場合の腫 瘍組織では、DNA 断片化の指標である TUNEL 陽性細胞が増加した。従って、ミリプラチ ンは、in vitro だけでなく in vivo においても白金-DNA アダクト形成作用及びアポトーシス 誘導作用を有することが示された。
In vitro で観察された白金-DNA アダクト形成作用及びアポトーシス誘導作用が in vivo に おいても認められたことから、ミリプラチン懸濁液のin vivo 細胞増殖抑制作用は、腫瘍局 所で放出された活性分子種を介して発現すると考えられた。 2.4.2.2 ミリプラチン及び活性体 DPC の安全性薬理試験 ミリプラチンの単回静脈内投与での一般症状及び行動、中枢神経系、呼吸・循環器系、 自律神経系、消化器系、泌尿器系、血液系(溶血・凝固時間)及びin vitro での平滑筋、血 液系(血小板凝集)に及ぼす影響をそれぞれ検討した。また、活性体DPC の一般症状・行 動、呼吸・循環器系、自律神経系・平滑筋及び血液系に及ぼす影響をin vivo 又は in vitro で検討した。 ミリプラチンのin vivo 試験は、全身曝露時の評価を目的として、ミリプラチンエマルシ ョン製剤を用いて単回静脈内投与で実施し、in vitro 試験はミリプラチンの凍結乾燥製剤(エ タノールに用時溶解)を使用した。また、活性体DPC の in vivo 試験は DPC を媒体(DMSO 又は0.5%メチルセルロース水溶液)に溶解又は懸濁し、全身曝露可能な単回静脈内投与(イ ヌ)又はその代替投与経路である単回皮下投与(ラット)で実施し、in vitro 試験では DPC を媒体(DMSO)に溶解して使用した。 ミリプラチンエマルション製剤は、麻酔イヌの呼吸・循環器系に対し、呼吸数の増加及 び心拍数の増加作用を示した。中枢神経系に対し、正常ラットの体温を経時的に上昇させ、 投与6 時間後には投与前より約 2°C 上昇させた。これらの作用は一過性又は投与後 24 時 間には回復した。また、ラットで溶血作用や泌尿器系への影響が認められた。しかし、い
ずれの作用も同容量のエマルション製剤ビークルで同程度の作用が認められたことから、 当該ビークルに起因する作用と考えられた。その他の項目に対し、ミリプラチン又はミリ プラチンエマルション製剤は明らかな作用を示さなかった。 活性体DPC は麻酔イヌへの単回静脈内投与により、呼吸・循環器系に対し、収縮期血圧 の上昇、心拍数の増加、大腿動脈血流量の増加、心電図PR 間隔の短縮及び QTc の延長作 用を示したが、これらの変化はいずれも高用量群(3 mg/kg、i.v.)でのみ認められる一過 性の軽度な変化であった。また、呼吸数に対しては、4 例中 1 例で呼吸回数の増加が見ら れた。その他の項目に対し、活性体DPC は明らかな作用を示さなかった。 以上、ミリプラチンの静注用製剤であるミリプラチンエマルション製剤を用いた検討で、 体温上昇、呼吸数増加、心拍数増加、溶血及び尿量への影響が認められたが、いずれもエ マルション製剤ビークルに起因する作用であると考えられ、また、活性体DPC の作用につ いては高用量(3 mg/kg、i.v.)で認められる一過性の変化であったことから、ミリプラチ ン及び活性体DPC の種々の器官系に対する作用は、重篤な副作用を予測させる変化ではな いと考えられた。なお、エマルション製剤ビークルの作用については低容量(0.25 mL/kg) では影響を認めないか軽微であったこと、エマルション製剤ビークルの主成分であるヨー ド化ケシ油脂肪酸エチルエステルは既承認で臨床使用されており、その用法及び容量(6 mL/man = 0.12 mL/kg)の範囲内でミリプラチン懸濁液が適用されることを考え合わせると、 臨床において重篤な影響を及ぼす可能性は低いと考えられた。
2.4.3 薬物動態試験 2.4.3.1 試験方法と分析法 ミリプラチンの非臨床薬物動態試験では、毒性試験で用いた動物種であるラット(SD) 及びイヌ(ビーグル)、並びに薬効薬理試験で用いた担癌ラット(Donryu)を用いて評価 を行った。投与方法は、臨床に合わせ、ミリプラチン懸濁液の肝動脈内投与とした。イヌ では臨床と同様の方法の、大腿動脈からのカテーテル挿入により肝動脈に投与し、ラット 及び担癌ラットでは開腹し、直接肝動脈に投与した。ラットについては、全身曝露時の毒 性評価を目的として実施した代替投与経路である、ミリプラチン懸濁液の皮下投与及びミ リプラチンエマルション製剤の静脈内投与を行った。なお、全身曝露における毒性評価を 皮下投与で実施することの妥当性を検討するため、ミリプラチン懸濁液の皮下投与、肝動 脈内投与及び静脈内投与で曝露比較を行った。ミリプラチンの胎児乳汁移行性については、 生殖発生毒性試験に準じて妊娠ラット又は哺育中ラットに皮下投与することにより評価し た。 なお、ミリプラチン懸濁液の投与量は、各項で特に記載するものを除き、以下のとおり とした。すなわち、毒性試験で用いられた用量に合わせ、イヌの肝動脈内投与では2.4 mg/kg、 ラットの皮下投与では50 mg/kg、妊娠ラット又は哺育中ラットの皮下投与における投与量 では25 mg/kg とした。ラット及び担癌ラットの肝動脈内投与では、投与可能最大量の 0.4 mg/animal とした。ラットの静脈内投与についても、投与可能最大量である 20 mg/kg とし た。また、ラットの静脈内投与におけるミリプラチンエマルション製剤の投与量は、毒性 試験に準じ、10 mg/kg とした。 これら薬物動態試験では、14C 標識したミリプラチン(以下、[14C]ミリプラチン)を使 用した。測定法として、液体シンチレーション法による放射能測定に加え、ICP-MS 法を 用いて高感度で白金測定を行うことにより、投与後長期間にわたり白金成分の動態を追跡 した。 ミリプラチンの活性体であるDPC については、14C 標識した DPC(以下、[14C]DPC)を 使用し、毒性試験に準じてラット(SD)及びイヌ(ビーグル)を用いて皮下投与により評 価した。測定は液体シンチレーション法及びICP-MS 法により放射能測定及び白金測定を 行った。なお、DPC の投与量は、それぞれ毒性試験に準じ、ラットでは 0.5 mg/kg、イヌで は1.25 mg/kg とした。 また、溶媒であるヨード化ケシ油脂肪酸エチルエステル(懸濁用液)については、ミリ プラチンの毒性試験に準じて、イヌを用いて肝動脈内投与時の評価を行うとともに、ラッ トを用いて皮下投与時及び静脈内投与時の評価を行った。懸濁用液の標識体として、その 主構成成分であるリノール酸エチルヨウ化水素付加物の125I 標識体(イヌ)及び14C 標識 体(ラット)を使用した。懸濁用液の標識体として、ラットにおいては主構成成分である ヨード化リノール酸エチルの14C 標識体を使用したが、14CO2の排泄が認められたため、イ ヌにおいては125I 標識体に変更した。なお、懸濁用液の投与量は、ラット皮下投与及びイ ヌ肝動脈内投与では、それぞれ毒性試験に準じ20 mL/kg 及び 0.12 mL/kg とし、ラット静