学位論文
DoGtor’ s Thes i s
グリシンは唾液腺由来前駆細胞の細胞増殖および分化を制御する
(Glycine regulates the cell proliferation and differentiation of salivary gland-derived progenitor cells)
中村 恭子 Yasuko Nakamura
熊本大学大学院医学教育部博士課程臨床医科学専攻 小児科学
指導教員
遠藤 文夫 教授
熊本大学大学院医学教育部博士課程臨床医科学専攻 小児科学
2009年 3月
学位論文
Doctor’ s Thes i s
グリシンは唾液腺由来前駆細胞の細胞増殖および分化を制御する
(Glyc i ne regu l ates the cell proliferatien and different i at ion of
salivary gland-derived progenitor cells)
著者名= 中村 恭子
Yasuko Nakamura
指導教員名: 小児科学分野 担当教授 遠藤 文夫 教授
審査委員名: 幹細胞制御分野 分子病理学分野 消化器内科学分野 パターン形成分野
担当教授 担当教授 担当教授 担当教授
粂 昭苑
山本 哲郎 佐々木 裕 横内 裕二
授授授授 教教
教教2009年 3月
目次
1.要旨
2.学位論文の骨格となる発表論文、および過去の発表論文リスト
3.謝辞
4.略語一覧
5.図および図表の説明
6.研究の背景および目的
6一(1) はじめに
6一(2) アミノ酸の生理活性 6一(3) グリシン
6一(4) 唾液腺の構造と発生
6一(5) 唾液腺における組織障害モデルと組織幹細胞 6一(6) 本研究の目的
7.実験方法
7一(1)唾液腺由来前駆細胞の分離
3 【》一 幽1
4
似 μ 塵0 7σ 0◎ 0りP P μ μ
遭7 10
P0
P11621獄 降μ似臥 6 3 一り0謄0 ΩUり乙り轟 n∠μに μ
8
臥 2
7一(2)細胞培養
7一(3)アミノ酸培地の調整 7一(4)細胞増殖実験 7一(5)細胞分化実験
7一(6)細胞増殖シグナル阻害実験
7一(7)DNA濃度解析、サイタリン発現、およびアポトーシス解析 7一(8)培養細胞の免疫染色
7一(9) Reverse transcr iptase polymerase cha i n react i on ana l ys i s
7一(10)ウェスタンプロッティング解析 7一(11)唾液腺原基の組織培養
28
μ 0σ0ワリるりる似臥
30
R1
R132μμ臥μ
32 μ
り0』婚00り0μμ
8.実験結果 p. 37一一p. 67
8一(1)唾液腺由来前駆細胞の増殖における短期間グリシン添加の影響 8一(2)唾液腺由来前駆細胞の増殖における短期間グリシン除去の影響 8一(3)唾液腺由来前駆細胞の細胞周期、およびアポトーシスの検討 8一(4)内胚葉性がん細胞に対するグリシンの影響
8一(5)唾液腺由来前駆細胞における長期間グリシン添加・除去の影響 8一(6)立体培養を用いたマウス唾液腺由来前駆細胞の分化誘導にお けるグりシンの影響
8一(7)胎児唾液腺の分枝・分葉形成に対するグリシン添加の影響
p. 37
p. 38
p. 40
p. 41
p. 42
p. 43
p. 44
9.考察 p. 68-p. 77
2
9一(1)実験系
9一(2)細胞増殖・分化とグリシン 9一(3)唾液腺形成とグリシン
9一(4)EGF、細胞増殖シグナルとグリシン 9一(5)細胞周期とグリシン
9一(6)がん細胞とグリシン 9一(7)グリシンの細胞毒性、疾患
p. 68
p. 69
p. 71
p. 72
p. 74
p. 75
p. 76
10.結語 p. 78
11.参考文献 p. 79’一p. 83
1.要旨
【目的】アミノ酸は生体を構成するタンパク質の基質であるとともに、腸管再生、
増殖因子の分泌、タンパク質合成、細胞増殖など多様な生理学的活性をも っている。唾液腺は消化管系の中で最初の外分泌腺であり、アミノ酸を含 む栄養素に最初に暴露される臓器である。唾液腺から分泌される唾液の中 にはグリシンが多く含まれている。グリシンはもっとも単純な構造をもつ 非必須アミノ酸である。グリシンは糖原性アミノ酸、抑制性神経伝達物質 としての機能以外に口腔内抗菌作用、腫瘍増殖抑制作用、抗炎症作用、ヌ クレオチドの前駆物質として作用し、神経幹細胞の増殖分化への関与が示 唆されている。本研究では唾液腺由来組織前駆細胞、内胚葉系がん細胞お よび胎児唾液腺原基を用いた検討を行い、唾液腺における細胞増殖・分化 に対するグリシンの作用、そしてがん細胞における細胞増殖に対するグリ シンの作用を解明することを目的とする。
【方法】アミノ酸を1種類ずつ除去したアミノ酸除去培地(δ培地)および1種類ず つ添加したアミノ酸添加培地(÷培地)を用いてマウス唾液腺由来前駆細胞 (mSGP細胞)、マウス胎児繊維芽細胞またはヒト肝細胞セルライン(HepG2)
を培養し、細胞形態の観察・細胞増殖アッセイ(MTTアッセイ)による細胞 増殖の検討を行った。またグリシン添加培地を用いて、mSGP細胞の長期培 養を行い、免疫蛍光染色およびRT-PCRを用いてmSGP細胞の細胞分化につ いて検討した。加えて、フ群団サイトメトリー及びウェスタンブロッティ ングを用いてmSGP細胞の細胞増殖シグナルおよび細胞周期に対するグリシ ンの影響を検討した。更にグリシン添加培地を用いたマウス胎児唾液腺原 基(E13)の組織培養を行い、唾液腺形成に対するグリシンの影響について検 賦した。
【結果】グリシンの存在下ではmSGP細胞及びHepG2細胞の増殖が抑制された。一方、
グリシンを除去した場合、細胞増殖は促進された。グリシンの添加はmSGP 細胞の分化形態である細胞集塊や導管構造などの3次元構造の形成を促進 した。これらの3次元構造に一致して、未分化マーカーである細胞内ラミ ニンの発現が減弱し、分化マーカーであるサイトケラチン19の発現が増強 した。更に細胞周期解析の結果、グリシンはmSGP細胞の細胞周期の進行を S期で抑制した。またグリシン添加は細胞増殖シグナルにおけるp42/p44MAPK のリン酸化を抑制した。グリシンによる細胞増殖抑制作用はアポトーシスと 関連しなかった。唾液腺原基の組織培養では、グリシンの添加は分葉形成を 抑制し、導管の伸長を促進した。唾液腺原基におけるこれらの変化は、増殖 シグナル阻害剤を用いた場合にも認められた。
【考察】グリシンは組織前駆細胞であるmSGP細胞の細胞増殖を抑制し、導管上皮細 胞への分化を促進する作用をもつことが示された。またグリシンは細胞増
4
殖シグナルおよび細胞周期の進行に対して阻害的な作用を示した。組織培 養ではグリシンは唾液腺原基の分葉形成の抑制および導管伸長の促進を示 した。さらにグリシンは内胚葉系がん細胞、マウス胎児繊維芽細胞に対し て増殖の抑制を示した。これらの結果から、グリシンは組織前駆細胞の 増殖・分化における制御因子の一つである可能性が考えられた。更にグリ シンはがん細胞の増殖においても、組織前駆細胞とは異なるメカニズムを 介して制御因子として作用している可能性が考えられた。
【結語】グリシンは細胞増殖シグナルおよび細胞周期の進行の抑制を介して、組織前 駆細胞の増殖分化を制御している可能性がある。更にグリシンは、がん細胞 の増殖に対して抑制的に作用している。グリシンは、細胞の増殖分化におけ る制御因子の一つであると考えられる。
2.学位論文の骨格となる発表論文
および過去の発表論文リスト
参考論文
①関連論文
1. Nakmaura Y, Matsumoto S, Mochida T, Nakamura K, Takehana K, Endo F (2eO9)
Glycine regulates the cell proliferation and differentiation of salivary gland-derived progenitor. cells. Cell Tissue Research, in press.
6
3.謝辞
本研究を行うにあたり、全面的にご指導ご支援を頂きました熊本大学大学院 医学研究科小児科学分野 遠藤文夫教授に深く感謝いたします。
実験手法並びに培地そのほかのご提供のご協力を頂きました味の素医薬カン パニー、竹鼻 健司氏に慎んで御礼申し上げます。
大学院入学時より実験計画、手法など全面的にご指導いただきました熊本大 学大学院医学研究科小児科学分野 中村 公俊先生、松本 志郎先生に深く感 謝いたします。
貴重な唾液腺由来前駆細胞を快くご提供いただきました久富 雄一朗先生に 深く御礼申し上げます。
大学院生活を共に過ごし、またさまざまな場面でご助力頂きました佐藤 歩 先生、服部 希世子先生、上野 靖史先生、西原 卓宏先生、緒方 陽先生、
持田 太賀先生、福永 啓文先生、田尻 博子先生に感謝申し上げます。
また実験にあたり、ご協力いただきました技術補助員の皆様に感謝申し上げ
ます。
4.略語一覧
BCM : branched-cha i n am i no aG i d
mTOR : mamma l i an Ta rget of Rapamyc i n
elf4E : eukaryotic translation initiation factor 4E
4E-BP : eukaryot i c trans l at i on i n i t i at i on faGtor 4E一一b i nd i ng prote i n
GCS : G l yc i ne C l eavage systern
NKH : Non-ketoic hypergiycinemia
EGF : ep i derma l growth facter FGF : f i brob t ast gro“rth factor
MAPK : M i togen act i vated prote i n k i nase fami I y
PI3K : Phosphatidilinositot 3 kinase
SGP: sa I i vary g t and progen i tors
BrdU : bromodeexyur i d i ne AFP : a l phafeteprote i n
ALB : albumin
CK19 : cytokerat i n19
GAPDH : g l yceraldehydes一一3-phosphate dehydrogenase
8
5.図表および図表の説明
Table.1構造によるアミノ酸の分類 Table.2代謝経路によるアミノ酸の分類 Table.3既知のアミノ酸の生理活性 Table.4Glycineの細胞保護作用
Table.5神経前駆細胞におけるGlycineの作用 Table.6唾液腺由来前駆細胞と組織幹細胞
Table.7マウス唾液腺由来前駆細胞の分化誘導法 Table.8アミノ酸調整培地組成
Fig.1 Glycineの代謝経路
Fig.2神経伝達物質としてのGlycine Fig.3唾液腺の発生
Fig.4実験プロトコール
Fig.5マウス唾液腺由来前駆細胞 Fig.6細胞増殖に対するアミノ酸の影響
Fig.7マウス唾液腺由来前駆細胞の増殖に対する
短期間グリシン添加の影響 Fig.8マウス唾液腺由来前駆細胞の増殖に対する
短期間グリシン除去の影響 Fig. 9グリシン添加・除去によるmSGP細胞の増殖変化
Fig.10マウス胎児繊維芽細胞の増殖に対するグリシンの影響 Fig.11マウス唾液腺由来前駆細胞における細胞周期解析 Fig.12マウス唾液腺由来前駆細胞におけるアポトーシス解析 Fig.13 HepG2の細胞増殖に対するグリシン添加の影響 Fig.14 HepG2の細胞増殖に対するグリシン除去の影響 Fig.15 HepG2における細胞周期解析・アポトーシス解析 Fig.16マウス唾液腺由来前駆細胞に対する
長期間グリシン添加の影響 Fig.17スフェロイド培養におけるインスリン分泌の検討
Fig.18マウス唾液腺由来前駆細胞に対する
長期間グリシン除去の影響 Fig.19胎児唾液腺の分葉形成に対するグリシンの影響 Fig.20無血清培養および増殖シグナル阻害剤による
胎児唾液腺の分葉数の変化
6.研究の背景および目的
6一(1) はじめに
タンパク質は内臓や骨格筋、皮膚、毛髪などを構成するほか、血漿中のアルブミ ンやグロブリン、酵素やホルモンなどを形成し、生体内の様々な生理機能を担う物 質である。ヒトでは、生体を構成する体タンパク質は体重の約2096であるといわれ ている。この体タンパク質では絶えず合成と分解が行われており、休タンパク質の 分解によって得られるアミノ酸の85%は再び体タンパク質として再利用される。残 りの15%は遊離アミノ酸として生体内に存在し、エネルギー源やそのほかの生理活 性物質として利用される。成人の場合、通常1日に80~100gのタンパク質を摂取
している。これらのタンパク質は哺乳動物におけるアミノ酸の供給源となる。
アミノ酸はアミノ基(一NH,)とカルボキシル基←COOH)をもつ化合物の総称で、現 在、自然界には約700種類のアミノ酸が存在しているといわれている。そのうち、
タンパク質の構成成分となるものは20種類であり、その側鎖の構造や代謝経路に より分類がなされている(Table.1, Table.2)。
アミノ酸の歴史は1806年のアスパラギンの発見に始まる。1820年にはゼラチン からグリシンが分離され、その後1937年のスレオニンの発見に至るまで、主要な アミノ酸が次々と発見された。1902年にFiSGherによりポリペプチド説が提唱され ると、タンパク質の基本的構造としてのアミノ酸について研究が進められるように なった。1930年代に入ると、Roseらによるアミノ酸の栄養学的研究、 Krebs,
Henseleitらによるアミノ酸の生体内代謝に関する研究が展開され、必須アミノ酸 の概念の確立、尿素サイクルの提唱、アミノ基転移反応の発見など多くの重要な業 績が生まれた。1950年代にはPaulingがタンパク質のαヘリックスやβシート構造
を発見し、Nirenbergらにより遺伝情報とアミノ酸配列との関連性が明らかにされ た。その後1960年代から1970年代にかけて、アミノ酸分析法の開発や遺伝子工学
10
によるタンパク質やペプチドの精製法が発展し、タンパク質を主成分とする多くの 医薬品の開発が可能となった。現在では、多くのアミノ酸が栄養素としてのみなら ず医薬品や、食品添加物、化粧品、動物飼料などとして日常的に利用されるに至っ
ている。
6一(2) アミノ酸の生理活性
アミノ酸はタンパク質の構成成分や栄養素としてだけではなく、生体内において 様々な生理活性をもつ物質である。
哺乳類において、生体内に存在する主要なアミノ酸は20種類である。ヒトの体 内で“必須アミノ酸”といわれる9種類のアミノ酸(トイソロイシン、1一リジン、
1一メチオニン、1一フェニルアラニン、1一スレオニン、1一トリプトファン、1一バリン、
1・・一ヒスチジン、1一ロイシン)は生体内で生合成されず、食事から摂取されなけれ ば欠乏するため全身状態に影響を及ぼす。また、それ以外の11種類のアミノ酸(1一 グリシン、1一アラニン、1一困りン、1一システイン、1一グルタミン、1一グルタミ ン酸、1一アスパラギン、1一アスパラギン酸、1一チロシン、1一アルギニン、1一 プロリン)は生体内での生合成が可能であることから“非必須アミノ酸”と呼ばれ ている。これらの非必須アミノ酸のうち、1一アルギニン、1一グルタミン、グリシ ンは産生量が生民の要求量に足りない場合に外部からの摂取を必要とするため、準 必須アミノ酸といわれている(Table.1,2)。生体内に存在するこれらの遊離アミ
ノ酸が、生体の状況によっては重要な生理活性を持つ(下abIe.3)。
例えば、必須アミノ酸のうち、分岐鎖アミノ酸(1一バリン、1一ロイシン、1一イソ ロイシン:BCAA)は、運動や骨格筋の維持・増量において最も重要な働きを為して いる。A. L. GoIdbergらによると、分岐鎖アミノ酸は骨格筋のタンパク質合成を促進
し、タンパク質分解を抑制する生理活性を有することが示されており(Go Idberg and Chang 1978)、この作用を利用して術後侵襲期のタンパク質栄養状態を改善するた めに、輸液などに分岐鎖アミノ酸が多用されている(Okada, Mori et al.1988)。
また、分岐鎖アミノ酸は血漿中の遊離必須アミノ酸の4割を占めており、運動時に エネルギー源として利用される(Gamrin, Essen et al.1996)。これは、分岐鎖ア
ミノ酸の代謝酵素である分岐鎖アミノ酸トランスフェラーゼが筋肉内に多量に存 在していること、分岐鎖アミノ酸がグル:コースーアラニン回路を構成し血糖値の維 持に重要な役割を担っていることに由来している(Harper, MilIer et al.1984)。
運動時に、筋肉では解糖系を経てグルコースからピルビン酸を生じるが、分岐鎖ア ミノ酸は自身のアミノ基をピルビン酸に供与することにより糖原性アミノ酸であ る1一アラニンを生成する。このアラニンが筋肉から肝臓に移行して糖新生に利用さ れることにより持続的な糖の供給が維持されるのである(Harper, Miller et al。
1984)。ほかにも分岐鎖アミノ酸の一つである1一ロイシンは経ロ摂取により肥満抑 制効果やインスリン感受性改善作用などを示すことが報告されている(Zhang, Guo
et al. 2007).
非必須アミノ酸の中にも、生体維持に必要とされるアミノ酸が多数存在する。非 必須アミノ酸の一つである1一アルギニンは、生体で産生されたアンモ=.アの代謝排 泄経路である尿素サイクルの重要な構成要素である。L一アルギニンには内分泌系を 刺激し成長ホルモンをはじめとするさまざまなホルモンの分泌を刺激する作用が
あることが知られている(Ghigo, Bartolotta et al.1994)。例えば、6higoらはヒ トに成長ホルモン分泌放出ホルモンを前投与した条件下でアルギニンを経ロ投与 することにより、血中の成長ホルモン濃度が上昇することを示している。更にRees らはウサギを用いた実験から1一アルギニン投与により、NO産生が増加することを 報告している。1一アルギニンは㎜シンターゼの作用によりNOを産生することから、
Reesらの報告は1一アルギニンが内皮由来血管拡張因子のNO供与体として作用して いることを示している(Rees, Monkhouse et a l.1998)。 L一アルギニン由来のNO 産生は末梢血管の拡張をきたし血圧を降下させるため、1一アルギニンは高血圧の治 療に応用されている。またトアルギニンはポリアミンの合成促進を介して免疫を増 強する機能も有している(Reynolds, Daly et aI.1988;Peranzoni, Marigo et al.
12
2007)。このように1一アルギニンは重要な生理的作用を有するアミノ酸の一つであ り、血圧降下剤や内分泌疾患の診断などに臨床応用されている。骨格筋の遊離アミ ノ酸の約6割を占めるレグルタミンも、生体内で重要な役割をもつ非必須アミノ酸 である(Lacey and WiImore 1990)。生体内で最も早いタンパク質合成と細胞増殖が 行われている組織である小腸上皮では、供給されるアミノ酸の多くが管腔側からの 吸収に依存している(Drucker, Erlich et aI.1996)。吸収されるアミノ酸のうち、
特にグルタミン、グルタミン酸、アスパラギン酸は小腸上皮のエネルギー源として 大部分が消費される。Wilm。reらは、グルタミンの効果として①腸管及び唾液腺か らの表皮成長因子(EGF)分泌促進、②分泌されたEGFによる腸管免疫促進、③腸 管上皮の再生促進を報告している(Wi lmore, Smith et al.1988)。またOkabeらは、
1一グルタミンの投与がアスピリン大量投与後の消化管潰瘍の進行を抑制し、さらに 回復の促進に働くことを報告している(Okabe, Takeuch i et a l.1974;Okabe, Honda et al.1975)。このほかにも一部のアミノ酸はセロトニンやカテコールアミン、ヒ スタミンなど様々な生理活性物質の前駆体としての役割を担っており、生体機能を 維持する上で重要である。
細胞機能の維持においても、アミノ酸は重要である。たとえば、アミノ酸はmRNA の転写の調節やタンパク質合成、細胞の増殖・成長などに関与している。特に1一
ロイシンは細胞内のアミノ酸センサーと考えられているma㎜alian Target of Rapamyc i n(mTOR)の活性化物質として知られている。 mTORは細胞増殖シグナルの 一端を担うセリンスレオニンキナーゼのひとつである。1一ロイシンはmTORを刺激
し、その下流エフェクター一であるp70S6キナーゼを活性化させ、リボソームにおけ る細胞内タンパク質の翻訳を賦活化させる。また、量一ロイシンによるmTORの活性 化は、転写活性化因子であるeukaryotic translation initiation factor
4E(elf4E)一bindingprotein(4E・一BP)のリン酸化を介して細胞周期関連タンパクを始 めとするタンパク質の発現を制御することが知られている(Jefferson and Kimbal1 2001;Fingar, Riohardson et al.2004)。またmTORの活性化は細胞のアポトーシ
スの抑制、オートファジーによるタンパク分解の抑制などにも影響している。この ようなmTORの作用は、細胞の増殖に関与する他のシグナル経路と相互に作用し、
細胞の増殖、成長、生存を調節している。L一ロイシンに加えて、1一グルタミンもmTOR シグナル経路を介してラットの腸管上皮細胞の成長の制御に関与しているといわ れている(Nakajo, Yamatsuj i et al.2005)。ほかにも1一アラニンの初代培養肝細 胞におけるガラクトースアミン誘導性肝障害の改善作用(Maezono, Mawatar i et a l.
1996)、1一アルギニン除去による細胞周期阻害作用(Wheatley, Scott et al.2000)
などの報告がなされている。これらの報告はすなわち、アミノ酸が生体機能を臓器 レベル・細胞レベルで制御する生理活性因子であることを示している(Table.3)。
分類 アミノ酸(MW) 分子式 分類 アミノ酸(MW) 分子式
グリシン C2H5NO2
アラニン C3H7NO2
中性 Aミノ酸
バリン 鴻Cシン
C5H例NO2 b6H13閥02
芳香族ア
フェニル Aラニン
CgHl1NO2
イソロイシン C6H13NO2
ラ酸
チロシン CgH斜NO3
脂
セリン C3H7NO3
肪
族 スレオニン C4Hg閥03
アラ
塩基性 リジン C6H14閥202 酸 アミノ酸
アルギニン C6H14N402
異 プロリン C5HgNO2
アスパラギン酸 C4H7NO4 節環
酸性 アスパラギン C4H8N203 状ア トリプトファン C個H12閥202
アミノ酸 グルタミン酸 C5HgNO4
ラ
酸 ヒスチジン C6HgN302
グルタミン C5H10N203
含硫 システイン C3H7NO2S
アミノ酸 メチオニン C5H個髄02S
Table.1 構造によるアミノ酸の分類(太字は必須アミノ酸)
14
糖原性アミノ酸 ケト原性アミノ酸 糖原性ケト原性アミノ酸 グリシン アスパラギン酸
アラニン アスパラギン フェニルアラニン
セリン グルタミン酸 リジン
トリプトフ7ン スレオニン グルタミン
システイン アルギニン ロイシン チロシン
メチオニン ヒスチジン
イソロイシン
バリン プロリン
Table.2 代謝経路によるアミノ酸の分類
アミノ酸 In vivo study ln vitro study
8CAA
gb
戟EVal
h・Lou
骨格筋での
@タンパク質合成
^動時の血糖維持 ェ岬能・インスリン感受性
@ の改善
mTORを介した細胞内
@ タンパク合成賦活化 ラ胞増殖の制御
ラ胞の成長
ラ胞内オートファジーの制御
1・Gln 消化管潰瘍の修復促進
チ化管上皮再生促進
小腸上皮における 高sOR活性化の制御 ニ疫賦活作用
1・Glu 戟EA8P
興奮性紳経伝達物質 ー管上皮のエネルギー源
アポトーシス誘導
1・Ar9
ホルモン分泌の促進 ニ疫機能の賦活 穴ヌ拡張、血圧降下作用 Aンモニア代謝
細胞周期の調節
mO産生に伴う食細胞機能賦活 s細胞活性低下
1・Ala
急性肝障害の改善 Aルコール代謝の改善 怺i筋におけるグルコース・
Aラニンサイクルを介した血糖 ワ椿作用
ガラクトサミン障害性
@初代分離培養肝細胞
@ における細胞傷害抑制
Gly 抑制性紳経伝達物質
麹o内における抗菌作用 髜≡攝B抑制、抗炎症作用
アポトーシス抑制
a経幹細胞増殖・分化調節
Table.3既知のアミノ酸の生理活性
6一(3)グリシン
グリシン(C,H5NO,、分子量75.07)は生体内に存在するアミノ酸のなかで最も単 純な構造をもつ中性アミノ酸である。グリシンはヒトの非必須アミノ酸のひとつで あるが、ストレスなどで需要量が増えると生体内で不足するために準必須アミノ酸 と呼ばれている。グリシンは、生体内で糖原性アミノ酸としてピルビン酸を供給す るほか、筋肉の収縮に関与するクレアチンの母体として、また生体内の抗酸化物質 として重要なグルタチオンの前駆体、生体を構成するコラーゲンの構成成分、唾液 の主要な成分(Pobozy, Czarkowska et a l.2006)、ロ腔内細菌の共凝集抑制作用物 質(㎞ano, Fujiwara et al.1997)などとして機能する重要なアミノ酸である。
生体内におけるグリシンの主な代謝経路は、ミトコンドリアにおけるグリシン開 裂系(Glycine Cleavage system:GCS)とセリンヒドロキシメチルトランスフェラ ーゼの作用による1一セリンへの可逆的な変換経路の2つである(Fig.1)。グリシン はセリンヒドロキシメチルトランスフェラーゼにより1一セリンに変換され、糖原性 アミノ酸としてピルビン酸に変換されてエネルギー源として作用する。一方グリシ
ン開面心では、ミトコンドリア内に存在するグリシンシンターゼにより、グリシン は二酸化炭素とN5, NIO一言チレンテトラヒドロ葉酸(N5, NIO-THF)に可逆的に脱炭 酸される。このN5, NIO一メチレンテトラヒドロ葉酸はDNA合成時のプリンヌクレオ チド前駆物質として重要な物質である(Sakata, Owada et aI.2001)。
このようにグリシンはさまざまな生理活性をもつアミノ酸であるが、その中でも グリシンの生理的活性物質としての重要な役割は神経伝達物質としての役割であ る(Nguyen, Rigo et al.2001;Gundersen, Vaagenes et al.2005)。グリシンは 脊髄や脳幹部において、主要な抑制性神経伝達物質として機能している(Ghavan i n i,
Mathers et al.2005)。神経シナプスにおいて、前シナプス末端に存在するグリシ ン穎粒からシナプス間隙に放出されたグリシンは、後シナプス膜に存在する抑制性 グリシンレセプターに結合する。この抑制性グリシンレセプター(GlyR)は、マウ スの成休では3つのαサブユニットと2つのβサブユニット、マウスの胎児~新生
16
児では5つのαサブユニットから構成される5量体からなる1igand-gated ion channe lである(Lynch 2004)(Fig.2)。リガンドであるグりシンが結合すると、グ
リシンレセプターが活性化しC「チャンネルが開ロする。細胞外のCI一濃度は細胞内 に比較して高いため、陰性に荷電したCl一が神経細胞内に流入し、その結果、神経 細胞は過分極となり神経の興奮が抑制される(Gundersen, Vaagenes et a塵.2005)。
このような抑制性グリシンレセプターの発現は海馬や視床下部、脊髄に多く認めら れる(Aguayo, van Zundert et al.2004)。また、グりシンは抑制性伝達物質とし てだけでなく、興奮性アミノ酸であるグルタミン酸レセプターのNMDA(N-methy l D-asparate)レセプターにおいてCo-agon i stとしても作用し、その過剰な活性化
を調節している(Gundersen, Vaagenes et a l、2005)(Fig.2)。虚血や低酸素など のストレス下で生じるNMDAレセプターの過剰な活性は神経細胞のアポトーシスを 引き起こすため、グリシンはNMDAレセプターの活性調節を介して神経細胞のアポ トーシスを抑制する。このようなグリシンの作用は虚血時の神経細胞傷害に対して
有効と考えられている(Massey, Johnson et a l.2004;Liu, Wong et a l.2007;Oda,
Kure et a l. 2007).
神経伝達物質としてシナプス間隙中に放出されたグリシンは、前・後シナプス膜 およびシナプス周囲のダリア細胞の細胞膜に存在するグリシントランスポーター
(Glyτ)の作用により除去され、その濃度は一定に保たれている(Eu l enburg, Armsen et al.2005;Betz, Gomeza et al.2006)。これらのグリシンをリガンドとする受 容体やトランスポーターの機能異常は、統合失調症や驚愕症などといった神経疾患 の発症原因であるといわれており、これらの神経疾患の新たな治療ターゲットとし てグリシンレセプター、トランスポーター阻害剤やグリシンの応用が検討されてい
る(Ghavanini, Mathers et al.2005)。
神経系におけるグリシンの働きは神経伝達物質としての作用のみではない。哺乳 類では、神経発生過程において神経伝達物質がその分化に影響することが知られて いる(Nguyen, Rigo et al.2001)(Table.5)。近年、神経発生においてグリシン
が重要な役割をもつことが報告された. Nguyenらは神経幹細胞および神経前駆細胞 にグリシンレセプターが数多く発現していることを示した(Nguyen, Ma l grange et al.2002)。彼らの報告では、成体とは異なり、神経幹細胞・前駆細胞に存在する グリシンレセプターは、その活性化によりCl一チャンネルを介して細胞内のCl一イオ ンが細胞外に流出し、脱分極を生じさせること、これらの電位変化が、細胞増殖に 作用している可能性が示唆された(Zhang, Ikejima et al.2000;Nguyen, Rigo et al.2001;Nguyen, Ma lgrange et al.2002)。また、 Sakataら、 Ich inoheらは、
神経骨細胞・前駆細胞にグリシンの代謝経路として重要なグリシン丁丁酵素が多く 存在しており、これらの酵素の異常は非ケトーシス高グリシン血症(Non-keto i c hyperglyc i nem i a:NKH)を引き起こし、中枢神経系の奇形や重篤な神経障害をもた
らすことを示した(Sakata, Owada et al.2001;IGhinohe, Kure et a1.2004)。
前述したように、グリシン開門系では、その代謝過程でヌクレオチド前駆体である N5, NIO一メチレンテトラヒドロ葉酸が産生されることから、NKHにおける中枢神経の 形成異常はこの酵素の欠損に伴う神経幹細胞の増殖障害に起因すると考えられて いる。これらの報告は、哺乳類の神経発生において、グリシンが重要な役割を担っ ている可能性を示している。
グりシンのこのような生理活性作用は、神経系に限定されるものであろうか?
1999年にRoseらは、メラノーマを皮下移植したマウスと薬剤性肝腫瘍をきたした ラットに対してグリシンを経口摂取させ、その結果グリシンの投与によりこれらの
腫瘍の増大が抑制されることを報告した(Rose, Catt I ey et a l.1999;Rose, Madren et al.1999)。この報告の中で、彼らはin vivoでグリシンの経口投与により腫瘍 血管の増生が抑制されること、invitroで血管内皮細胞の増殖がグリシンの投与に より抑制されることを示した。また、Wheelerらは機能性グリシンレセプターが神 経細胞だけでなく、好中球や肝臓のKupffer細胞にも存在していること、これらの 細胞ではグリシンレセプターの活性化に伴うCl’一イオンの流入が、リポポリサッカ ライド(LPS)などの刺激に伴う細胞内へのCa2+流入を抑制し、その結果、 TNFαな
18
どのサイトカインの増加が抑制され、細胞のアポトーシスを抑制する可能性をもつ
ことを報告した(Whee l er, lkejerna et a 1.1999;Whee l er, Stach l ewitz et a 1.2000;
Qu, Ikejima et al.2002)(Table.4)。これらの報告から、グリシンは神経系だけ でなく様々な臓器の発生分化および細胞の増殖、再生、炎症反応の制御に対するレ ギュレーターとしての作用を持つ可能性が示唆されている。
PK)tcins in the t’(x)d 一
Glycine
一一
5.10-MTHF THF
s・・ine’噸馴・〃・yム臨熊鴨謡
tl’tul.!fel’ase
1 H.1+CO2+5.10-MTHF
Scrinc
やが ロ
ll晩 . G1-1pm・・・・…h・
il CH_㎜H←側・dcgmdalk珊of
二 1 糞 P「(、lcin~and
ph〔}~pholipids
Fig.1Glycine代謝経路
Schematic outline of the glycine metab◎lism. Glycine代謝経諮のシェーマ。 Glycineはserine hydroxymethyl transferaseの触媒作用によvJ Serineから合成されるか、もしくはアンモニア、酸 二酸化炭素、テトラヒドロ葉酸(tetrahydrofolate)から合成される。 Glycine合成の最終的な反応 はglycine synthetaseにより触媒される。 glycine synthetaseは肝臓におけるグリシン開裂系
(glycine cleavage system:GCS)を構成成分である。多くの場合、Glycineは食物を介して摂取 される。 THF:tetrahydrofolate;MTHF:methylene tetrahydrofolate.
(RY. Gundersen,Acta Anaesthesiol Scand 2005; 49: 1 10-1 1 16)
a b
園
くヨ ぎビらり
。”t @ (、。、,,、、n __猟∵叢
NMDA・rccLpt4t
R・St・、》n“PtiC m一”n¶
(RY. Gundersen,Acta Anaesthesiol Scand 2005;49:1108-1116)
Fig.2神経伝達物質としてのGlycine
[a】グリシンレセプター(GlyR)。成体ではGlyRは2つのβサブユ=ットと3つのαサブユニット、
アンカータンパクであるgephyrinから構成される。
Glycine,β一alanine, taurineがレセプターに結合すると、イオーンチャンネルが開ロする。細 胞
内へのCトの流入に伴って、細胞膜が過分極する。ストリキニーネはアンタゴニストとして作 用する。
[b】NMDAレセプターはGlutamateとGlycineの結合部位をもつ。 NMDARにGtycineが結合して いる場合、前シナプス穎粒よりGlutamateが放出されると、イオンチャンネルが開ロし、
NMDARは活性化される。 Glycineはトランスポーターを介してダリア細胞から放出され、取 り込まれる。.
Exa叩les ot cytoprdective effects of glycine.
BTain Heantcirculation Gl-tract
Liver
K耐ney
Protects against nevcond death alter ischaemic stroke RedLrces myocardiel hfatction size
Reduces injLry to the sman intesthes after warTTi ischaemiatepeffusiom PrO量㏄終}againS量gaS量riC UIOer
Reduces ethanol-induced gastric mecosal iajuty Protects hepatocytes against bypoxic injury
朧1器魏器書欝瓢瓢騨.・
Protects isolated proximal tubele cells against menadic}ne-nduced injuty i Protects against injLry caused by Cydosporine A
(RY. Gundersen,Aeta Anaesthesiol Scand 2005; 49: 1108-1116)
Table.4 Glycineの細胞保護作用 20
Glycit!e
C.ell gtnge Medeb’Techitiqties Results References
Neureblasts
GlioblRsts
Pε血ata1凱皿e!πob1謝s血situ=
PCfCal
P6≦7騨bi11“te揺1鱒P面oT o拠巳 n鞭。蝕sh頂vo a鑓d血si鋤:VIA E13-14血ce sp血I co■d netτoblasts in vitro: PCtCaf;”Vl.AtlSbie E・1 OT21 rar cereb・enar neErrella, 1 cultufes in v・itro:
PC謹血S孟u’工M)’Sb至0
1 eonatal fat spima1 cord astroc)tes,
olieecfendrocyte.s atad OPCs・ in situ:
PC,Sgingle-cell RT-PCR
New・bOm rat cortica1 OPC-s血vitro:
PC;tt瓜1~CaI
7無ri血e trig9¢rs血“rafd cu∬ents and indrrces me!nbtane depolarization.
Depeleriziition epens VGC・Cs arid elevates 血tracellu1ar calciuml concentrations Spontaneoi s Gl}rK activatien reduces鵬UfO皿ai dendritic bfanch塊
.md total dendritic 1ength
(}1yR ac電重v論t重on ilc■eases 1ヨ良工由e∫
ofpr血ay neu∫ites a皿(l tOta1 neUfite leロ9血
(矩}℃血eand L-sesine Pfomove蜘v3L aentlritogenesis and electroph}rsiologieal
develoP皿ent。fP眈i句eロeuron$血cu1嘘s
Expfession of fuictioaLil GlyR in g lial celis 題dp∫09㎝孟to鮒倉。畑acute$幽誠co■d slice・s
Expression off血ctioエza1(}lyBL
Strucniral and phafmacological diffefences from homologous neuronal GlyR.
G-fy.“cine mp.plicatic?n.induces rise
of臆ace1M瓢C混正CllMl
(血ough VGCC:sεmd glyc血ヒ官3nspo賃e】=s)
Flint et al. 1998
S・anes aud C・hokshi 1992・
Tapia et al. 2000
Fu皿IYI. et al.2〔}OO
K童。地。登e宅aL 1996;
Pastef et al. 199-5
Belachew et al. 1998a, 19gBb.
2・ OOO
(RY. Gundersen,Acta Anaesthesiol Scand 2005; 49: 1108一一M 16)
Table.5神経前駆細胞におけるGlycineの作用
(PC patch-ctamp, Cat catcium imaging, VtA video-analysis imaging,
Sbie survivat bioas$ay, lnSitu in situ hybridization, IM immunostainings)
6一一(4) 唾液腺の構造と発生
唾液腺は消化管における最初の外分泌器官であり、消化機能に重要な働きをもつ 臓器である。唾液腺から口腔内に分泌される唾液には唾液アミラーゼなどの消化酵 素に加え、グリシン、1一セリン、1一プロリン、1一グルタミンなどのアミノ酸や表皮 成長因子(ep i derma l growth factor:EGF)、神経成長因子(Nerve growth factor:
NGF)などの増殖因子が含有されており、ロ腔内抗菌作用、消化管上皮の再生に重
要な役割を担っている(Pobozy, Czarkowska et a l.2006)。
唾液腺は解剖的に大唾液腺と小唾液腺に分類され,大唾液腺には耳下腺、顎下腺 および舌下腺の3つがそれぞれ一対となって存在している。発生学的には耳下腺は 外胚葉に由来し、顎下腺および舌下腺は内胚葉に由来する(Williams, et a1.1989)。
マウスの場合、唾液腺の発生は胎生12日の原基形成に始まる。マウスロ蓋底にお いて肥厚したロ腔上皮は、次第に神経堤由来のロ腔粘膜下間葉組織内に侵入し、単
葉性の早期唾液腺原基となる(initial bud stage)。間葉組織内に侵入した上皮組 織の表面にはoleftが形成され分葉化が進み(cleft format i on)、胎生13.5日に3 個から5個の分葉をもつ顎下腺原基となる。原基の侵入によって形成された細胞索 は分枝形成(branoh i ng)と伸長(e longat ion)を繰り返し、胎生14日から15日 目に多門性構造をもつ組織となる(pseudoglandu Iar stage)。各分葉末梢部は拡張 し、将来的には分泌部である腺房となる。この時点での唾液腺は索状で分泌機能を 有しておらず、胎生16日目から出生までの間、分葉末梢部では早期腺房細胞が出 現し、分枝部に管腔が形成され(canalization stage)、出生以後成熟した唾液腺と なる(Jaskolland MelniGk 1999;Hoffman, Kidder et al,2002)(Fig. 3)。
唾液腺の形態発生には、唾液腺およびその周囲組織から分泌される成長因子の存 在が必要不可欠である。過去の報告では、唾液腺の発生分化の過程で観察される cleft formationとduct elongationには、表皮成長因子(epidemal growth
faGtor(EGF))や線維芽細胞成長因子(fibroblast growth faGtor(FGF)fami Iy)
の存在が必要であることが示されている(Mor ita and Nogawa 1999;Steinberg,
Myers et al.2005)。実際に、発生過程にある唾液腺原基の細胞表面には、 EGFレ セプターや各種のFGFレセプターが発生段階に応じて発現している(Jaskolland
Me l n i ck 1999)。このEGF、 FGFファミリーをリガンドとする増殖シグナル経路の下
流因子であるMitogen activated protein kinase family(MAPK)や
Phosphatyd i l i nos i to 13kinase(PI3K)が唾液腺発生における分葉形成、導管の伸 長の調節に重要な役割を担っている(Kash i mata, Sayeed et a l.2000;Kash i mata,
Sakagami et aL 2000;Larsen, Hoffman et al.2003)。さらにラミニンやフィブ ロネクチンなどの細胞外マトリックスの局在変化が、唾液腺発生における分葉形成 を誘導していることが報告されている(Sakai, Larsen et al。2003;Kadoya and Yamashina 2005;Larsen, Wei et al.2006)。このように、唾液腺の発生には増殖 因子をはじめとする多様な因子の関与が必要である。
22
a
b
雪
一 mesenchyme
endbud
epitheiium
n CI8i{ii)
basement membrane
E12.5 E13.0 Fig.3 唾液腺の発生
乙
([iSiillliii)
branching
E13.5
【a】マウス唾液腺におけるbranching morphogenesis。
【b】マウス胎児唾液腺発生のシェーマ。E12.5の唾液腺は単葉性原基である。
唾液腺上皮は間葉組織に覆われている。E13にbranchingが開始すると、
原基はcleftの形成、 duCt elongationにより分葉し、 E13.5旬14には生葉性 構造となる。
6一(5)唾液腺における組織障害モデルと組織幹細胞
肝臓や膵臓では、以前から組織修復時に細胞の供給源となる組繊幹細胞(adult tissue st㎝cells)の存在が提唱されてきた。肝臓の組織幹細胞は、1950年代に DNA合成阻害剤投与下での肝障害時に肝組織内に出現増殖する細胞群として分離さ れた(Farber 1956)。この細胞は閥/C比が大きく、旺盛な増殖力をもち、その形態
から肝卵形細胞(Hepat ic Ova 1 Ce l l s)と呼ばれている(Yasu i, Miura et a I.1997)。
肝卵形細胞はアルブミンなどの肝細胞分化マーカー、サイトケラチン19などの胆
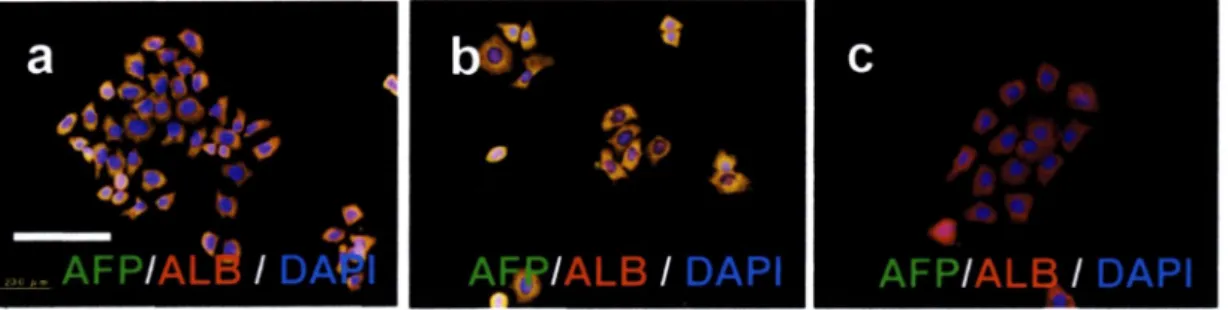
管上皮マーカー、alphafetoprote i n(AFP)などの肝芽細胞マーカーを発現している。
また移植実験では、この細胞が肝細胞と胆管上皮細胞の両方へ分化可能であること が、また高グルコース下での培養ではインスリン及びグルカゴン陽性細胞に分化誘 導可能であることが確認されている(Yang, Li et al.2002)。これらの結果から、
肝卵形細胞が多分化能をもつ組織幹細胞であると考えられている。膵臓においては、
銅欠乏食により組織障害が生ずると、間質内にサイトケラチン19陽性の上皮細胞 が出現・増殖し、管腔構造を形成する。このサイトケラチン19陽性上皮細胞は肝 臓に移植されると肝細胞に分化することが可能である。したがって、この膵上皮前 駆細胞(pancreaticepithelial progenitor Gells)は肝臓・膵臓に共通の前駆細 胞であると考えられている。
しかし、これらの組織幹細胞は、通常各々の組織においてごく微量にしか存在し ない。そして組織障害が生じた場合には、これらの組織幹細胞が増殖分化しその修 復に動員される。肝臓、膵臓に対し組織障害を誘発する方法の一つとして、総胆管・
主膵管を結紮する導管結紮法が挙げられる。ラットの総胆管結紮モデルでは胆管の 増生を認め、増生した上皮細胞の中にAFP陽性の組織幹細胞が存在することが分か
っている(Slott, Liu et al.1990)。また、ラットの膵管結紮モデルでは、結紮部 遠位の腺房細胞脱落と導管構造の増生、小ラ三島の増生を認め、導管を構成するサ イトケラチン20細胞および間質の一部にインスりン・グルカゴンを発現する組織
幹細胞が出現する(Wang, Kloppel et al.1995)。
唾液腺は、肝臓と同じように組織障害時に強い再生能力をしめす臓器の一つであ る。また膵臓と同じようにアミラーゼ産生機能を有し.EGFやNGFなどの内分泌機 能を併せ持つ臓器である。唾液腺においても、導管結紮法による組織障害モデルが 存在する。2003年に奥村ら、2004年に久富らは、ラット・マウスを用いて顎下腺 の導管結紮モデルを作成した(Okumura, Nakamura et a l.2003;Hisat㎝i, Okumura et al.2004)。主排泄管に結紮を施された唾液腺では、肝臓や膵臓と同じくアポト ーシスによる腺房細胞の脱落とともに、小型導管上皮細胞の増殖が起こる(duota l
24
proliferation)。この増生した小型導管上皮および間質内に、膵臓や肝臓と同様に 組織幹細胞が出現する。この導管結紮法を用いて、これまでに奥村、久富、松本ら
はラット、マウス、ブタの唾液腺から組織幹細胞を分離することに成功した
(Okumura, Nakamura et a l. 2003; H i satom i, Okumura et a l. 2004; Matsumoto,
Okumura et al.2007)。さらに、松本、佐藤らはそれぞれブタ、ヒトの唾液腺から 導管結紮を用いずに、組織幹細胞を分離することに成功した(Matsumoto, Okumura
et a l.2007;Sato, ekumura et a l.2007)。分離された唾液腺由来前駆細胞(sa t ivary
gland progenitors=SGPs)は自己増殖能および多分化能をもつ組織前駆細胞で、 in vivo, i n v i troでの分化誘導が可能である。マウス唾液腺由来のSGP細胞(mSGPs)
は、未分化マーカーとして。-kit, sca-1, AFP, CD49f,細胞内lamininを発現し、
培養条件によって特殊な3次元構造(ce11-cluster)を形成して分化し、肝臓細胞 や膵臓内分泌細胞、導管上皮細胞などに分化することができる(Okumura, Nakamura
et a l. 2003; H i satom i, Okumura et a l. 2004; Matsumoto, Okumura et a l. 2007;
Sato, Okumura et al.2007)(Table.6,7)。このような多分化能をもつ唾液腺前駆 細胞は、肝臓や膵臓をはじめとする再生医療や、細胞の分化増殖能の検討に有用で あると考えられている。
6一(6)本研究の目的
これまで行われてきた研究から、アミノ酸には細胞の増殖をはじめとする細胞 機能を調節する作用があり、in vivo, in vitroでその効果が報告されている。唾 液腺はアミノ酸をはじめとする多くの栄養素に暴露される臓器の一つであり、EGF やFGFなどの増殖因子を分泌する機能をもつ。更に、唾液腺には自己増殖能・多分 化能をもつ組織前駆細胞である唾液腺由来前駆細胞が存在する。また唾液腺から分 泌される唾液にはグリシンを始めとする大量のアミノ酸が含まれている。そして、
グリシンは細胞増殖時のDNA合成に際してヌクレオチドの前駆体として重要なアミ ノ酸で、神経幹細胞をはじめとする組織幹細胞の増殖分化に関与している可能性が
考えられている。これらの背景をもとに、今回私はマウス唾液腺由来前駆細胞
(mSGPs)を用いて、組織前駆細胞の増殖分化に対するアミノ酸の影響を、唾液に 多く含有されるグリシンに着目して検討した。そして、組織前駆細胞に対するグリ シンの作用を、内胚葉系がん細胞および唾液腺原基においても検討し、増殖分化に おける生理活性物質としてのグリシンの機能を明らかにすることを目的とした。
marker Sloml
垂窒盾№盾資ノor
潤怩P脇 intrao●lbr 8urね。● loc811za勧on d旧●r●而欲bn
MoO80
@SGP
CK19
kaminin
`FP
CD44+CD49c+
bD49f+CD51+
rca-1+C-k詮+
bD45一
Ducツ
垂?窒奄р浮モ狽≠
Hepatα理te c㏄ヒepi電heliaI
盾?撃h
oanαea髄C
?獅рnC巾e oell
Rat
rGP CK19
P.amhin
CD29+CD34令 bD49f+CD45一
Ductl
垂?窒奄р浮モ狽≠
Hepat〔x写te cuct epi電helial
盾?撃撃
oancneatic
?獅р盾モ窒奄獅?@celI
Swino
rGP
CK19 bK18
P-aminin
`FP
CD44+CD34c+
bD49f+Thy-1寺 b-kit+CD45一
Ductl 垂?ァductal
Hepa廿c oheno types oancrea噸C
?獅р盾モ窒奄獅?@celI
meural
@ohenotvoes
Human
@SGP
Laminin+ CD49f†,CD29 bD44, Thy-1+
bD104,CD34-
bD38一, Cd45一
DucV
垂?窒奄р浮モ狽≠
Panαeatic
?獅р盾モ窒奄獅?@cellS
gepatic oellS
Oval
モ盾撃
AFP
`Ibimin bK7, CK8,
bK18. CK19
CD34寺,’rhy-1寺 b-kit+, Sca-1+
bD45+, OV6+,
`6:
periportal
Hepa量呵e
oancrea cellS Wile ep鷺helial
盾?撃撃
Homato
Epoiotic Wtem cell
CD34+, Thy-1+
b-kit+, Sca-1+
kin一
Bone larrow
8bod ool15 ki》er ce闘5 o節α◎a価。
怩獅р盾ヲ蛯氏怩b◎115
moura100鱈8
lu8cb
e【do曾hのlhlαのlh
Table.6 唾液腺由来前駆細胞と組織幹細胞
26
form culture dif陀rentiation dif悟rentiatbnmarker
autonomOUS
モ?撃戟E・cbster
?b高≠狽奄盾
monolayer CK19 dud
?髄Fhelial
モ?撃撃r
matrigeI
bU忙ure 3-dimention Albumin
bK19 hepat㏄ytes
spherical
bU眈ure 3-dimention
Insulin
flucagon
pancreatic
?獅хtrine
モ?撃撃r
Table.7マウス唾液腺由来前駆細胞の分化誘導法
7.実験方法
7一(1)唾液腺由来前駆細胞の分離
mSGP細胞の分離は以前の報告に準じた(H i sat㎝1,0kumura et a l.2004)。概要 を以下に示す。5週令のオスのC57BL/6マウスをエーテル麻酔にて鎮静し、仰臥位 で固定した。頸部を正中切開し両側顎下腺を露出した。主導管を目視下に結紮し、
導管結紮術6日後に屠殺し、顎下腺を採取した。採取した顎下腺を1㎜片に細切し、
30m書のEGTA bufferに浸漬、37。C20分インキュベーートし、その後室温で1000rpm
5分間遠心した。ペレットを1.67mg/mL co l l agenase(lnv i trogen Corp),1.33mg/mL hya l uron idase(Nacalai Tesque Inc. Kyoto, Japan)を含有したdigest ion bufferと DMEM/F121:1(lnv i trogen Corp、1.67mg/mL D i spese(lnv i trogen Corp)を含有し
たd
ispersat i on bufferを用いて処理した。得られた細胞浮遊液をステンレスフィル ターでろ過し1000rpm 5分4。Cで遠心した。得られたペレットを10m lのDMEM/F12 に浮遊し洗浄後、10%Fetal Bovine Serumを含むWilliams’Medium E(GEBCO)に 懸濁し、細胞懸濁液とした。
7一(2)細胞培養
唾液腺由来前駆細胞(mSGP)の培養は以前の報告に準じた(H i satom i, Okumura et a l.
2004)。 100rrvn type l co l l agen coated d i sh(Asah i TeGhno G l ass,丁okyo, Japan)t二
mSGP細胞を1 × 106cells/100nvn dishの濃度で播種し、コントロール培地を用いて培
養した。培地交換は3日ごとに行った。コントロール培地はWilIiams’MediumEに
5% Feta l Bev i ne Serum (FBS), 20ng/mL mouse ep i derma l growth faGtor (CHEM!CON ),
10’6M dexamethasone (S i grnaChem i ca 1,St. Lo i s, MO), 100U/m 1 pen i c i l I i n
G,100Lt g/m 1 streptomyc i n (lnv i trogen Corp.),10rnM n i cot i nam i de(S i gma)
28