1産業医科大学第一内科学講座 2大分大学医学部総合内科学第一講座(膠原病内科)
特集免疫疾患の治療の進歩
総 説JAK 阻害薬の抗リウマチ作用
山 岡 邦 宏1,前 島 圭 佑2,久 保 智 史1,園本格士朗1,田 中 良 哉1Anti-rheumatic eŠect of JAK-inhibitors
Kunihiro YAMAOKA1, Keisuke MAESHIMA2, Satoshi KUBO1, Koshiro SONOMOTO1and Yoshiya TANAKA1 1The First Department of Internal Medicine, School of Medicine, University of Occupational
and Enviromental Health, Japan
2Department of Internal Medicine I, Faculty of Medicine, Oita University (Received January 10, 2012)
summary
Treatment of rheumatoid arthritis(RA) has dramatically developed with the use of biologics targeting in‰amma-tory cytokines. However, expense and parenteral use can cause issues in the initiation and continuation of the treat-ment. Therefore a new orally available anti-rheumatic drug has been long-awaited. Recently, small-molecule com-pounds targeting Janus kinase(JAK) has shown clinical e‹cacy similar to biologics in clinical trials for active RA. Among the JAK-inhibitors, new drug application for tofacitinib is concurrently under review in western and asian countries and is highly expected to become a new anti-rheumatic drug in the near future. In order to evaluate the mode of action, we utilized peripheral blood and synovium from RA patients. Proliferation and cytokine production of CD4+ T cell was prominently reduced and subsequently inhibited cartilage destruction by the synovium. Our result is in line with the inhibitory eŠect of tofacitinib on joint destruction in RA patients those who were treated with tofacitinib. Therefore, further clinical e‹cacy is expected in the in the long-term treatment with tofacitinib.
Key words―tyrosine kinase inhibitors; Janus kinase; rheumatoid arthritis
抄 録 関節リウマチ(RA)は炎症性サイトカインを標的とした生物学的製剤により飛躍的に進歩したが,投与経路, 経済的負担などの理由から治療導入または継続が困難なことがある.また,難治症例も存在し,経口投与可能な新 たな作用機序を有する抗リウマチ薬の開発が待たれている.最近になり,細胞質内チロシンキナーゼである Janus kinase(JAK)を阻害標的とした化合物が内服薬でありながら生物学的製剤に匹敵する効果を示すことが明らかと なり,現在複数の JAK 阻害薬の治験が進行中である.我々は,既に欧米と本国において承認申請が行われ,近い 将来に新規抗リウマチ薬として実臨床で用いられる事が期待される tofacitinib 投与前後の患者末梢血の変化と関節 滑膜組織を用いた検討を行い,CD4+ T 細胞のサイトカイン産生と増殖を抑制し,更に滑膜細胞の軟骨浸潤を抑 制することを明らかにした.この結果は,RA 患者において tofacitinib 投与により骨破壊抑制効果が見られたこと とも一致しており,今後の長期投与による更なる治療効果が期待される. は じ め に 関節リウマチ(RA)は原因不明の炎症性疾患で あり,tumor necrosis factor(TNF),インターロイ キン(IL)-6 や T 細胞共刺激分子を特異的に阻害す る生物学的製剤の登場により治療目標は症状の緩和 から低疾患活動性または寛解へと大きく進歩した. これまでに,6 つの生物学的製剤が本邦で承認され ているが,何れの製剤においても約 30の症例が 治療抵抗性を示す.また,静脈内投与または皮下投 与といった投与経路の煩雑さや経済的負担が原因と なって治療導入や継続が困難なことが少なくない. 慢性炎症病態である RA では長期投薬を余儀なくさ れることから生物学的製剤の治療効果に匹敵する経 口薬が待ち望まれてきた.RA の炎症病態において 炎症性サイトカインは重要な役割を担うが,細胞外 刺激であるサイトカインはその刺激を細胞内に伝達
図 1 サイトカインシグナル伝達における Jak-Stat シグナル伝達経路 (Yamaoka K. et al. 20041)引用改変) する目的に細胞表面上に発現する固有の受容体に結 合する.結合後,細胞質内において種々のチロシン キナーゼを活性化し,引き続き核内に移行して標的 遺伝子の転写制御を行う転写因子を活性化する.こ れにより,細胞外刺激であるサイトカインは細胞内 情報へと転換され,最終的には目的の遺伝子発現調 節を行う事でその生物活性を発揮する.この一連の 流れのなかにおいて,生物学的製剤は細胞外刺激の 細胞内情報への転換を阻害するべく,細胞外刺激を 特異的に阻害する薬剤である.一方,チロシンキ ナーゼは細胞質内において活性化され,以前よりリ ウマチ患者滑膜細胞において高発現していることが 知られており,阻害標的として高い注目を浴びてき た.数年前よりようやくチロシンキナーゼの中でも Spleen tyrosine kinase(Syk)または Janus kinase (JAK)を標的とした阻害薬の RA に対する高い治 療効果が明らかとなっている.Janus kinase(JAK) を介した経路を標的とした tofacitinib は,経口薬 でありながら RA に対して生物学的製剤に匹敵する 効果を有する事が臨床試験を通じて明らかとなって おり,2011 年 12 月には欧米と本邦においてほぼ同 時期に承認申請が行われたことが公表され,上市に 最も近いものである. Janus kinase JAK はサイトカイ ン受容体の直下 で活性化さ れ,シグナル伝達経路の最上流に位置し,細胞外か らの刺激を転写因子 Stat を介してサイトカインの 生 物 学 的 活 性 へ と 変 換 す る . JAK に は JAK1, JAK2, JAK3と Tyk2 が知られているが,これらは サイトカイン受容体を介して活性化されると,受容 体の細胞内部分をリン酸化し Stat 分子が SH2 ドメ インを介して結合可能とする.その結果,Stat 分子 はリン酸化され二量体を形成し核内へと移行するこ とで標的遺伝子の転写制御を行う(図 1)1).4 つの
JAK は 7 つ Stat 分子(Stat1, 2, 3, 4, 5a, 5b, 6)を 多様な組み合わせで活性化するが,いずれも免疫系 においては重要な役割を担うことがそれぞれの欠損 マウスの解析より明らかとなっている.JAK の活 性化パターンはおおまかに 3 つに分けられる.受容 体の一部として gp130 鎖を利用する IL-6 の様なサ イトカインは主に JAK1 を,commonb 鎖を受容体 の 一 部 と す る GM-CSF の 様 な も の は 主 に JAK2 を,そして commong 鎖を受容体に用いる IL-2 等 のサイトカインは JAK3 を活性化する.JAK の生 体内における発現パターンには大きな特徴がある. JAK1 と JAK2 は公汎に発現し,欠損マウスは致死 的であるのに対して,JAK3 は血球系細胞に発現が
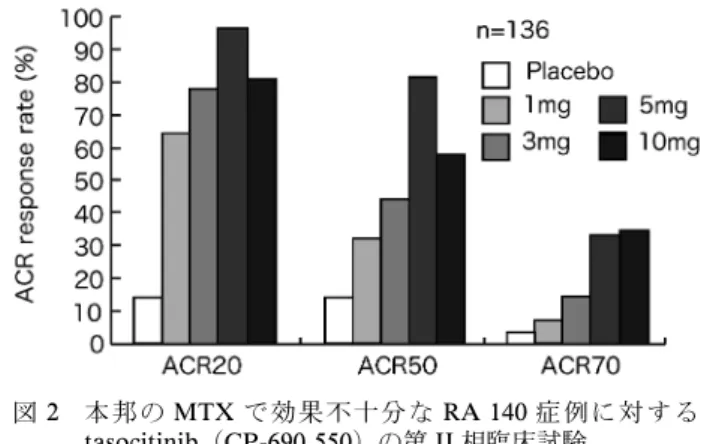
図 2 本邦の MTX で効果不十分な RA 140 症例に対する tasocitinib(CP-690,550)の第 II 相臨床試験
プラセボ,tasocitinib 1 mg, 3 mg, 5 mg, 10 mg を 1 日 2 回 経口 投与 し,12 週 後に ACR20, ACR50, ACR70 を評 価し
た.(Tanaka Y.6)より引用改変) 限局しており,その欠損・機能不全はそれを活性化 するサイトカイン(IL-2, -4, -7, -9, -15, -21)の機能 不全を招く.これらサイトカインはリンパ球の分 化・増殖に必須であるため,JAK3 の欠損・機能不 全はマウスとヒトいずれにおいても胎性致死には至 らないが,重症複合型免疫不全症を呈する.マウス は無菌特殊環境下であれば問題なく育つが,ヒトで は JAK3 の正常化を目的とした骨髄移植による治療 が長期生存には必須である. 関節リウマチにおける JAK-Stat サイトカインがその生物学的活性を発揮するには 受容体に結合後に活性化される JAK-Stat が必須で あることから,炎症性サイトカインの過剰産生を本 態とする RA における JAK-Stat の関与は以前より 指摘されてきた.Li らは Jak により活性化される 転写因子 Stat の RA 患者滑膜細胞における発現を 初めて報告し,その後,活動性 RA においては,変 形性関節症と脊椎関節症患者滑膜組織と比較して, JAK3, Stat1, Stat4と Stat6 が樹状細胞に限局して 発現上昇しており,治療により発現レベルが低下す ることから病因,または疾患活動性との関連が示唆 されてきた2,3).しかし,JAK はシグナル伝達の最 上流に位置し,その阻害は特異性が低い化合物の場 合には公汎な細胞内シグナルを過度に抑制すること になり,強い細胞毒性を有する可能性がある.で は,なぜ JAK が阻害標的になったのか.そもそも, tofacitinibは JAK のなかでも JAK3 にたいする特 異的阻害薬として開発されたものである.つまり, JAK3特異的阻害薬は血球系細胞(特にリンパ球系 細胞)にのみに作用する,副作用を最小限に抑えた 新規免疫抑制薬となると考えられた.しかし,多く の JAK3 阻害薬は特異性が低く,臨床試験が進まな い状態が続いていたが,2003 年に Changelian P. ら が発表した CP-690,550(tofacitinib)はそれまでの ものと比較して JAK3 に対する特異性が極めて高い ものとして発表された4).実際,動物を用いた移植 実験において,少ない副作用と高い生存率を実現 し,それまでに期待されていた JAK3 特異的阻害の 有用性が証明されている.しかし,ヒトゲノムに基 づいた kinome の網羅的解析結果から,tofacitinib は JAK1, JAK2 に対する阻害作用をも有し,必ず しも当初期待されていたほどの特異性を有さないこ とが明らかとなってきている5).そのため,in vivo では tofacitinib=JAK 阻害薬として機能している と考えられている.つまり,過去の化合物が低い特 異性のために臨床試験に至らなかったのに対して, tofacitinib の RA に対する高い有効性と少ない副作 用には適度な(非)特異性が重要であると指摘され ている. JAK阻害薬の抗リウマチ効果 1. Tofacitinib 移植実験の良好な結果から,腎移植患者における 移植片対宿主病と RA に対する臨床試験が行われた. 2006 年の米国リウマチ学会(ACR)では,既存の 抗リウマチ薬や生物学的製剤に抵抗性の RA 患者に 対して生物学的製剤に匹敵する高い治療効果が示さ れた.2008 年には,アンカードラッグであるメト トレキサート(MTX)に治療抵抗性を示した RA 患者約 500 例に tofacitinib を追加併用し 24 週投与 した結果,12 週目でおよそ 3 割が Disease Activity Score 28(DAS28)<2.6 の寛解基準に到達すること が示された.本邦では,2008 年から MTX 治療抵 抗性 RA 患者 140 例を対象に 12 週間の臨床試験第 II 相が行われ,投与開始 2 週目よりプラセボと有 意差をもって治療効果を認め,12 週目では 5 mg ま たは 10 mg の 1 日 2 回内服群の 3 割以上が ACR70 (米国リウマチ学会の指標で 70以上の改善)を達 成し,欧米における治療効果と同等もしくはそれ以 上であった6)(図 2).加えて,DAS28=5.1 を基準 に 2 群に分けた際に,低疾患活動性または寛解への 導入に DAS28≦5.1 では 10 mg が有効であること が明らかとなった.日本人における疾患活動性の違 いによる必要投与量と期待できる治療効果を示唆す る結果であった.重篤な有害事象は,心不全(10
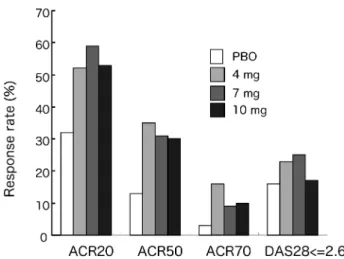
図 3 抗リウマチ薬が効果不十分な RA 127 症例に対する JAK1/2 阻害薬 LY3009104 の第 II 相臨床試験 プラセボ(PBO),LY3009104 4 mg, 7 mg, 10 mg を 1 日 1 回 経 口 投 与 し , 12 週 後 に ACR20, ACR50, ACR70 と
DAS28 寛解の到達率を評価した.(Greenwald ME et al11)よ り改変) mg),呼吸困難(同),大腿骨骨折(5 mg)などが 報告されたが,因果関係は不詳であった.有害事象 は,鼻咽頭炎,肝機能値異常,高脂血症,好中球減 少が見られたが,投与中止には至らず,欧米の結果 と類似したものであった.さらに重要な点は,2011 年米国リウマチ学会では,MTX 治療不応例 797 例 を対象とした tofacitinib(5 mg,10 mg,1 日 2 回 内服)プラセボ対照試験の 6 ヶ月目において,mo-diˆed total Sharp score(mTSS)による骨破壊の評 価では,10 mg 群において骨破壊抑制効果が初めて 確認された.同学会では,これまでの第 II/III 相無 作為化試験に参加した 3227 症例(tofacitinib 5 mg または 10 mg,単剤または MTX 併用下)の 36 ヶ 月に渡る長期継続試験において ACR 改善率と安全 性は短期試験のものと違いはなく,早期より見られ る治療効果は長期にわたり持続することも明らかと なった710). 2. LY3009104 生物学的製剤または抗リウマチ薬に不応性の関節 リウマチ患者に,抗リウマチ薬併用下にてプラセボ, 4 mg, 7 mg, 10 mg一日一回投与により,開始 2 週 目の早期より治療効果を認め,12 週目における ACR20(米国リウマチ学会の指標で 20以上の改 善)到達率と DAS28 を基準とした寛解率は用量に 関係なく同程度であった(図 3).24 週目まで改善 傾向は維持され,ACR20 到達率は上昇する傾向に あった.臨床試験参加以前の生物学的製剤の使用の 有無で ACR20 と ACR50 反応率に違いは見られな かった.副作用としては,頭痛,用量依存性のヘモ グロビン低下と HDL, LDL の上昇が見られていた が,プラセボと比較して目立ったものはあまり見ら れ ていなか った11).本化 合物は 治療 域で JAK1/ JAK2 は阻害するものの,同じ JAK ファミリーに 属する JAK3 と Tyk2 は阻害しないことが 2009 年 ACR で公表されている.しかし,その臨床効果が tofacitinibと類似していることと,tofacitinib が in vivo においては in vitro ほどの特異性を示さないこ とから,JAK 阻害薬として作用している可能性が 考えられる.現在,MTX に不応性の RA を対象と した第 II 相試験が欧米にて進行中である. こ れ ら に 加 え て , JAK1 特 異 的 阻 害 薬 で あ る GLPG0634, JAK2 特 異 的 阻 害 で あ る AC430, SB1578の関節炎モデル動物に対する有効性が発表 されており,それぞれ臨床試験が進行中である.こ れらの新たな薬剤の登場により RA 治療が新たな転 換期を迎えることが期待される. Tofacitinib の作用機序 Tofacitinibの RA における治療効果は同じ経口 内服薬である既存の抗リウマチ薬をはるかにしのぐ ものであるが,その詳細な作用機序については不明 な点が多い.Tofacitinib の非特異性は基礎的検討 で既に明らかとなっているが,RA 患者に投与した 際にも非特異性を示唆する現象が見られる.活動性 RA 患者への投与により,2 週目よりの早急な治療 効果が見られる一方で用量依存性の好中球減少がみ られている.一般的に活動性 RA では高度の炎症状 態に伴い IL-6 を介した好中球増加が見られ,炎症 制御に伴い減少する.つまり,tofacitinib に伴う好 中球減少は単純に RA の活動性制御に伴う変化とも 考えられる.しかし,JAK 阻害により最も影響を 受けると思われるリンパ球は臨床試験結果では患者 末梢血における変化は見られていない.事実,当科 における tofacitinib 投与症例の検討ではリンパ球 系細胞の実数と末梢血中の比率は何れも長期にわた って変化しないことを確認しておりリンパ球に対す るアポトーシスや分化抑制までの強い作用はないと 考えられる.更に,tofacitinib 投与後の急峻な炎症 所見の改善と比較して実際の関節炎の改善がやや遅 れる事(抗 IL-6 受容体抗体トシリズマブに類似 した臨床効果)からも早期においては炎症性サイト
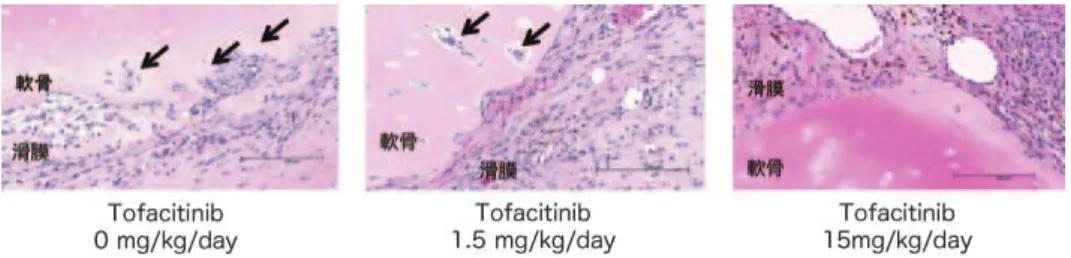
図 4 Tofacitinib による滑膜細胞の軟骨破壊抑制作用 関節置換術施行関節リウマチ患者より滑膜と軟骨を採取し,免疫不全マウスの背部皮下に移植し,Tofacitinib を表記の濃度で 4 週間投与後,移植組織を摘出し,病理学的評価を行った. 矢印は滑膜が軟骨内に浸潤している部位を示す. カインである IL-6 の産生と細胞内シグナル伝達を 抑制していると考えられる.IL-6 は細胞表面上の 受容体に結合後,JAK3 ではなく JAK1/JAK2 を介 したシグナル伝達を活性化するため,oŠ-target 効 果が主要な作用機序であると考えられる.一方で, 我々の RA 患者滑膜を用いた実験結果ではリンパ球 からのサイトカイン産生と増殖を何れも抑制してい たことから,JAK3 を介したリンパ球への直接作用 は有していると考えられる.この様に,基礎的検討 と臨床試験結果から JAK1/JAK2 への阻害作用を有 することは明らかである.このことは,tofacitinib が非血球系細胞に作用することを意味し,期待かつ 考慮されていたよりも複雑な作用機序を有すると考 えられ,現に RA 滑膜線維芽細胞に対する直接作用 が報告されている12). Tofacitinibの抗炎症作用 当科における tofacitinib 臨床試験において投与 開始早期からの臨床効果は JAK3 阻害のみでは説明 困難な現象であると考え,作用機序解明を目的に患 者検体を用いて解析を行った.その非特異的阻害作 用が明らかとなっているが,JAK3 に対する高い特 異性とリンパ球系細胞に対する作用を有すると考え られ,まずは tofacitinib 内服患者のリンパ球の解 析を行った.内服開始前と開始後 52 週目における 末梢血白血球分画のフローサイトメーターによる解 析では,臨床所見の結果と同様,リンパ球減少は見 られず内服開始直後の RA 活動性制御に伴い好中球 のみの減少を認め,CD4+または CD8+ T 細胞の 細胞数と分画に 52 週目まで 0 週と比較して有意な 減 少は 見ら れ なか った . しか し, 同 時に 行っ た CD4+ T 細胞の in vitro 刺激による増殖実験では 52 週目では内服開始前と比較して有意に増殖が抑 制されていた(投稿中).また,関節炎(滑膜炎) に対する直接作用を検討する目的で,関節置換術施 行患者より滑膜を採取し,CD4+細胞,CD14+単 球と滑膜線維芽細胞を分離した.CD4+ T 細胞に 対して tofacitinib は用量依存的に増殖を抑制し, IL-17 と IFN-g の産生も有意に抑制した.OŠ-target 効果の観点から,tofacitinib の滑膜線維芽細胞に対 する直接効果は興味深いが,我々の検討では,高濃 度の炎症性サイトカインを産生する RA 滑膜線維芽 細胞は,tofacitinib 添加による影響は見られなかっ た.しかし,インターフェロン(IFN)を介した IL-6, MMP-3産生抑制効果が報告されている12).
IFNは細胞内において JAK3 ではなく JAK1/JAK2 を介したシグナル伝達を活性化することから,前述 の臨床効果と共に,この報告は tofacitinib が JAK 阻害薬として JAK1/JAK2 をも阻害することを証明 している.我々はヒト滑膜炎を生体外で持続させる 目的に免疫不全(SCID)マウスに関節置換術施行 患者より採取した滑膜と軟骨を一塊にして移植し, 滑膜炎と滑膜細胞の軟骨浸潤を組織学的に観察した. Tofacitinib を投与しなかったマウスでは滑膜細胞 の強い軟骨浸潤と多数の IL-6 陽性細胞を認めたが, tofacitinib 濃 度 依 存 性 に 何 れ も 抑 制 さ れ た ( 図 4)13).この結果は臨床試験における骨破壊抑制効果 が確認された結果とも一致しており今後の更なる長 期投与における有用性を示唆するものであった14). 免疫疾患への応用 我々の実験結果からは自己反応性 T 細胞への阻 害作用が予想され,他の免疫関連疾患でも有効性を 発揮する可能性がある.現在,クローン病,潰瘍性 大腸炎,乾癬では臨床試験が進行している.本来の JAK3 に 対 す る 特 異 的 抑 制 作 用 に 着 目 す る と , JAK3 を必須とするサイトカインの中でもアレル ギーに深く関与する IL-4 に対する強い阻害作用は
興味深い.しかし,IL-4 阻害のみがアレルギー病 態の根本的な治療法になるとは考えにくく,他剤と の併用や投与方法の工夫が必要なのではないかと思 われる.一方で,tofacitinib は JAK3 以外をも阻害 する oŠ-target 効果を有することから,単剤での治 療効果も期待できるのではないかと思われる. 文 献
1) Yamaoka K, et al. : The Janus kinases(Jaks). Genome Biol 5 : 253, 2004.
2) Walker JG, et al. : Expression of Jak3, STAT1, STAT4, and STAT6 in in‰ammatory arthritis : unique Jak3 and STAT4 expression in dendritic cells in seropositive rheumatoid arthritis. Ann Rheum Dis 65 : 149156, 2006.
3) Li WQ, et al. : Oncostatin M-induced matrix metalloproteinase and tissue inhibitor of metal-loproteinase-3 genes expression in chondrocytes requires Janus kinase/STAT signaling path-way.J Immunol 166 : 34913498, 2001. 4) Changelian PS, et al. : Prevention of organ
al-lograft rejection by a speciˆc Janus kinase 3 in-hibitor.Science 302 : 875878, 2003.
5) Karaman MW, et al. : A quantitative analysis of kinase inhibitor selectivity. Nat Biotechnol 26 : 127132, 2008.
6) Tanaka Y, et al. : Phase II study of tofacitinib (CP-690,550) combined with methotrexate in patients with rheumatoid arthritis and an inade-quate response to methotrexate.Arthritis Care Res (Hoboken) 63 : 11501158, 2011.
7) Wollenhaupt J, et al. : Tofacitinib (CP-690, 550), an Oral Janus Kinase Inhibitor, in the Treatment of Rheumatoid Arthritis : Open-Label, Long-Term Extension Studies Up To 36 Months.Arthritis Rheum 63(Suppl 10) : S152 153, 2011.
8) Cohen S, et al. : Tofacitinib (CP-690,550), an Oral Janus Kinase Inhibitor : Analysis of Infec-tions and All-Cause Mortality across Phase 3 and Long-Term Extension Studies in Patients with Rheumatoid Arthritis Arthritis Rheum 63(Suppl 10) : S153, 2011.
9) Wollenhaupt J, et al. : Tofacitinib (CP-690, 550), An Oral Janus Kinase Inhibitor, in the Treatment of Rheumatoid Arthritis : Open-Label, Long-Term Extension Studies up to 36 Months.Arthritis Rheum 63 : S152153, 2011. 10) Cohen S, et al. : Tofacitinib(CP-690,550), An Oral Janus Kinase Inhibitor : Analysis of Infec-tions and All-Cause Mortality Across Phase 3 and Long-Term Extension Studies in Patients with Rheumatoid Arthritis. Arthritis Rheum 63 : S153, 2011.
11) Greenwald MW, et al. : A Randomized Dose-Ranging, Placebo-Controlled Study of INCB028050, a Selective JAK1 and JAK2 Inhibitor in Subjects with Active Rheumatoid Arthritis.Ann Rheum Dis abstract : 2010. 12) Rosengren S, et al. : The JAK inhibitor
CP-690,550 (tofacitinib) inhibits TNF-induced chemokine expression in ˆbroblast-like synov-iocytes : autocrine role of type I interferon. Ann Rheum Dis : 2011 in press.
13) Maeshima K, et al. : A JAK inhibitor tofacitinib regulates synovitis through inhibi-tion of IFN-g and IL-17 producinhibi-tion by human CD4+ T cells.Arthritis Rheum : 2011 in press. 14) D áesir áee vdH, et al. : Tofacitinib(CP-690,550), an Oral Janus Kinase Inhibitor, in Combination with Methotrexate Reduced the Progression of Structural Damage in Patients with Rheuma-toid Arthritis : a 24-Month Phase 3 Study.. Arthritis Rheum 63 : S10171018, 2011.