2.5 臨床に関する概括評価の目次 2.5.1 製品開発の根拠 ... 6 2.5.1.1 DME の疾患背景 ... 6 2.5.1.1.1 疫学 ... 6 2.5.1.1.2 DME の危険因子... 7 2.5.1.1.2.1 眼局所性因子 ... 7 2.5.1.1.2.2 全身性因子 ... 7 2.5.1.1.3 臨床的側面及び病態生理学 ... 8 2.5.1.1.4 自然経過 ... 9 2.5.1.1.5 症状及び診断 ... 9 2.5.1.2 DME の治療法 ... 10 2.5.1.2.1 レーザー光凝固術 ... 10 2.5.1.2.2 薬物療法 ... 11 2.5.1.2.2.1 ステロイド療法 ... 11 2.5.1.2.2.2 抗 VEGF 薬 ... 12 2.5.1.2.3 硝子体手術 ... 14 2.5.1.2.4 DME に対する新規治療の必要性... 15 2.5.1.3 VEGF Trap ... 15 2.5.1.3.1 薬理学的分類及び主な薬理作用 ... 15 2.5.1.4 臨床試験の主な科学的背景及び根拠 ... 16 2.5.1.4.1 DME の調節因子としての VEGF ... 16 2.5.1.4.2 VEGF Trap-Eye の臨床試験の根拠... 17 2.5.1.5 臨床開発プログラム ... 17 2.5.1.5.1 開発の経緯 ... 17 2.5.1.5.2 臨床データパッケージ ... 17 2.5.1.6 民族的要因の考察 ... 19 2.5.1.6.1 内因性要因 ... 19 2.5.1.6.1.1 有病率・危険因子 ... 19 2.5.1.6.1.2 薬物動態学的要因 ... 19 2.5.1.6.2 外因性要因 ... 19 2.5.1.6.2.1 民族的要因のまとめ ... 20 2.5.1.7 規制当局との協議 ... 20 2.5.2 生物薬剤学に関する概括評価 ... 21 2.5.3 臨床薬理に関する概括評価 ... 21
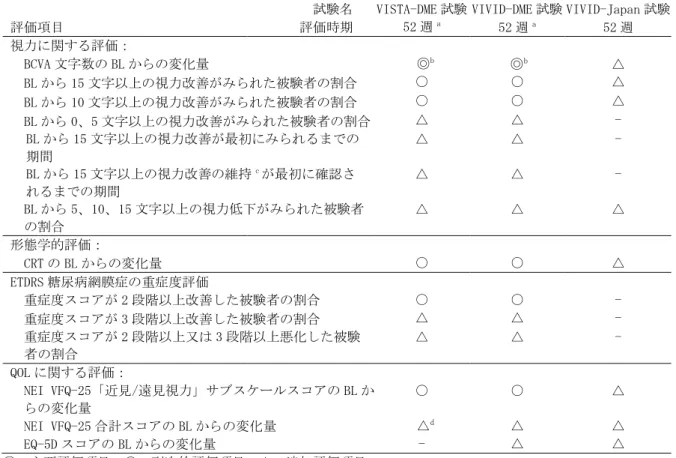
2.5.3.1 背景 ... 21 2.5.3.2 薬物動態 ... 21 2.5.3.3 薬力学 ... 22 2.5.3.4 免疫原性 ... 22 2.5.3.5 結論 ... 23 2.5.4 有効性の概括評価 ... 23 2.5.4.1 探索試験 ... 23 2.5.4.2 第Ⅲ相臨床試験の試験デザイン ... 25 2.5.4.3 第Ⅲ相臨床試験の成績 ... 29 2.5.4.3.1 被験者の内訳及び治療回数及びと人口統計学的特性及び その他の疾患特性 ... 29 2.5.4.3.2 VISTA-DME 試験及び VIVID-DME 試験の成績... 30 2.5.4.3.2.1 主要評価項目 ... 30 2.5.4.3.2.2 有効性の副次的評価項目 ... 31 2.5.4.3.2.3 有効性追加評価項目 ... 33 2.5.4.3.2.4 有効性の部分集団解析 ... 34 2.5.4.3.3 日本人集団の成績 ... 34 2.5.4.3.3.1 VIVID-DME 試験における日本人集団の成績 ... 34 2.5.4.3.3.2 VIVID-Japan 試験の成績... 38 2.5.4.4 有効性と推奨用法・用量の関係 ... 39 2.5.4.4.1 有効性と推奨用量の関係 ... 39 2.5.4.4.2 有効性と推奨用法の関係 ... 39 2.5.4.5 有効性の結論 ... 40 2.5.5 安全性の概括評価 ... 40 2.5.5.1 第Ⅰ相臨床試験:512 試験 ... 41 2.5.5.2 第Ⅱ相臨床試験:706 試験 ... 41 2.5.5.2.1 第Ⅲ相臨床試験:VISTA-DME 試験及び VIVID-DME 試験の 併合解析 ... 42 2.5.5.2.2 日本人集団での安全性 ... 47 2.5.5.2.2.1 国際共同臨床試験の VIVID-DME 試験における外国人集 団と日本人集団の比較 ... 47 2.5.5.2.2.2 VIVID-DME 試験の日本人集団と VIVID-Japan 試験並び に VTE 投与を受けた全日本人集団における安全性 ... 51 2.5.5.2.2.3 日本人集団における TEAE のまとめ ... 54 2.5.5.2.3 副作用 ... 54 2.5.5.3 臨床検査 ... 55 2.5.5.4 バイタルサイン及び心電図 ... 55
2.5.5.5 眼圧 ... 55 2.5.5.6 滲出型 AMD 患者及び CRVO 患者での第Ⅲ相臨床試験の併合 解析における TEAE との比較 ... 55 2.5.5.7 安全性のまとめ ... 56 2.5.6 ベネフィットとリスクに関する結論 ... 57 2.5.6.1 ベネフィット ... 57 2.5.6.2 リスク ... 58 2.5.6.3 バランス ... 60 2.5.6.3.1 ベネフィットリスクの抽出 ... 60 2.5.6.3.2 ベネフィットとリスクのバランス ... 60 2.5.6.4 考察 ... 61 2.5.6.5 結論 ... 61 2.5.7 参考文献 ... 62
略語一覧
略語 英語名称 日本語名称
ADA Anti-Drug Antibody 抗薬物抗体
AGEs Advanced Glycation Endproducts 糖化最終産物 AMD Age-related Macular Degeneration 加齢黄斑変性 ANCOVA Analysis of Covariance 共分散分析 APTC Anti-Platelet Trialist’s
Collaboration
-
ATE Arterial Thromboembolism 動脈血栓塞栓症 BCVA Best Corrected Visual Acuity 最高矯正視力
BL Baseline ベースライン
BMI Body Mass Index 体格指数
CHO Chinese Hamster Ovary チャイニーズハムスター卵巣
CI Confidence Interval 信頼区間
Cmax Maximum Concentration 最高血漿中濃度 CRT Central Retinal Thickness 中心網膜厚
CRVO Central Retinal Vein Occlusion 網膜中心静脈閉塞症 CSME Clinically Significant Macular
Edema
- CTD Common Technical Document - DCCT Diabetes Control and Complication
Trial
-
DME Diabetic Macular Edema 糖尿病黄斑浮腫 DRCRnet Diabetic Retinopathy Clinical
Research Network
- DRSS Diabetic Retinopathy Severity
Score
糖尿病網膜症重症度スコア EMA European Medicines Agency 欧州医薬品庁
EQ-5D Euro QOL-5 Dimensions Questionnaire
- ETDRS Early Treatment Diabetic
Retinopathy Study
糖尿病網膜症早期治療試験 FA Fluorescein Angiography 蛍光眼底造影検査
FAS Full Analysis Set 最大の解析対象集団
FDA Food and Drug Administration 米国食品医薬品局
GCP Good Clinical Practice 臨床試験の実施に関する基準
HbA1c Hemoglobin A1c ヘモグロビン A1c
ICH International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use
日米 EU 医薬品規制調和国際会議
Ig Immunogloblin 免疫グロブリン
IL Interleukin インターロイキン
略語 英語名称 日本語名称 IOP Intraocular Pressure 眼圧
IVT Intravitreal 硝子体内
JAN Japanese Accepted Name 医薬品一般的名称 KD Dissociation Constant 解離定数
LDL Low-density Lipoprotein 低比重リポ蛋白 LLOQ Lower Limit of Quantitation 定量下限 LOCF Last Observation Carried Forward -
LS mean Least Square mean 最小二乗平均 MCP-1 Monocyte Chemotactic Protein-1 単球遊走蛋白-1 MedDRA Medical Dictionary for Regulatory
Activities
国際医薬用語集
NA Not applicable 該当なし
NEI VFQ-25 National Eye Institute Visual Functioning Questionnaire-25
米国国立眼病研究所の 25 項目から なる視覚機能についてのアンケート
OC Observed Case 観察値
OCT Optical Coherence Tomography 光干渉断層撮影 OIR Oxygen-induced Retinopathy 酸素誘発虚血性網膜症
PD Pharmacodynamics 薬動力学
PK Pharmacokinetics 薬物動態
PlGF Placental Growth Factor 胎盤増殖因子 PMDA Pharmaceuticals and Medical
Devices Agency
医薬品医療機器総合機構
PPS Per Protocol Set 治験実施計画書適合解析対象集団
PRN As needed (pro re nata) 必要に応じ、随時
QOL Quality of Life 生活の質
RNA Ribonucleic Acid リボ核酸
SAE Serious Adverse Event 重篤な有害事象 SAF Safety Analysis set 安全性解析対象集団
SE Standard Error 標準誤差
TEAE Treatment-Emergent Adverse Event 試験治療下で発現した有害事象 TNF Tumor Necrosis Factor 腫瘍壊死因子
UKPDS United Kingdom Prospective Diabetes Study
-
VEGF Vascular Endothelial Growth Factor 血管内皮増殖因子 VEGFR Vascular Endothelial Growth Factor
Receptor
血管内皮増殖因子受容体
2.5 臨床に関する概括評価
2.5.1 製品開発の根拠
アフリベルセプト〔一般名 aflibercept(INN)/アフリベルセプト(遺伝子組換え)(JAN)、 以下、VEGF Trap〕は、米国 Regeneron Pharmaceuticals Inc.(以下、Regeneron 社)が開発し た血管内皮増殖因子(Vascular Endothelial Growth Factor: VEGF)を阻害する抗 VEGF 薬であ る。VEGF Trap 製剤は、硝子体内(Intravitreal: IVT)投与するために、VEGF Trap を等張の 液剤(VEGF Trap-Eye: VTE)として製剤化したものである。VTE は、Bayer HealthCare(以下、 BHC 社)及び Regeneron 社により眼科領域の適応症について共同開発が進められている。
「糖尿病黄斑浮腫(Diabetic macular edema: DME)」を予定効能・効果として臨床開発を行 い、VTE の有効性及び安全性を評価した。これらの結果に基づき、当該効能・効果に対して VTE の推奨用法・用量を設定し、製造販売承認事項一部変更承認申請を行うことは妥当と判断した。 その経緯及び根拠を以下に示す。 2.5.1.1 DME の疾患背景 2.5.1.1.1 疫学 糖尿病は、インスリン作用の不足に基づいて糖代謝、脂質代謝、蛋白代謝の変動が持続する疾 患で、耐糖能の低下・慢性の高血糖を基本的な特徴とする1)。2013 年時点で世界で 3 億 8,200 万 人が糖尿病を有していると推定されており、2035 年までに 5 億 9,200 万人が罹患すると予測さ れている2)。本邦における糖尿病患者は、厚生労働省による調査3), 4)(平成 20 年、23 年患者調 査の概況)によると、平成 17 年、20 年及び 23 年で、それぞれ 246.9 万人、237.1 万人及び 270.0 万人と近年増加傾向にある。また、本邦における糖尿病が強く疑われる人数を約 890 万人 とする報告もある5)。 糖尿病の代謝異常が長期間にわたって持続すると、特有の合併症(糖尿病網膜症、糖尿病腎症、 糖尿病神経障害)をきたしやすい。 糖尿病網膜症は、本邦における後天性視覚障害原因の上位を占めている6)。DME は、糖尿病網 膜症を基盤に生じる黄斑部の組織浮腫であり、糖尿病患者の失明原因として最も頻度が高く、ま た、糖尿病網膜症は先進国の労働人口における法的盲の最大の原因でもある7)。全糖尿病患者の 34.6%が糖尿病網膜症を、6.81%が DME を有するとされ、世界の糖尿病網膜症の患者数は約 9,300 万人、DME は 2,100 万人と推定されている8)。本邦においても糖尿病患者のうち、毎年約 3,000 人が糖尿病網膜症により失明していると言われている9)。疫学調査によると、日本人糖尿 病患者における糖尿病網膜症の有病率は、糖尿病罹病期間 10~14 年の場合、1 型糖尿病 79%、2 型糖尿病 44%と報告されている10)。2 型糖尿病における糖尿病網膜症の有病率は、罹病期間 5 年 で 10%、10 年で 30%、15 年で 50%、20 年で 70%と推定され、罹病期間の延長とともに累積発 症率も増加していく11)。また、糖尿病網膜症のうち、約 20%が DME を発症している12)ことから、 糖尿病患者の増加及び糖尿病罹病期間の延長に伴い、糖尿病網膜症のみならず、DME の累積発症 率の増加が本邦においても予測される。
糖尿病網膜症や DME を有する患者の増加には、高齢化による糖尿病患者の増加も影響も予想さ れる。加齢は糖尿病の危険因子の一つであり、平成 23 年国民健康・栄養調査においても、糖尿 病が強く疑われる者の割合は加齢とともに増加することが報告されている。本邦における平成 2 年度の 65 歳以上の人口比率が 12.1%であったのに対し、平成 24 年には 24.1%に増加している 13)。 また、2009 年に社団法人 日本眼科医会が発表した「視覚障害(ロービジョン:良い方の視 力 0.1 以上 0.5 未満と 失明:良い方の視力 0.1 以下 を合わせて視覚障害とする)がもたらす 社会損失額 8.8 兆円」14)によると、糖尿病網膜症は緑内障に次いで視覚障害の原因の第 2 位で あり、全体の 21%を占めている。本邦では、2007 年時点で 164 万人の視覚障害者が存在し、半 数は 70 歳以上である。高齢化に伴って、視覚障害者数は 2030 年までに 200 万人に達すると推定 されている。 以上より、糖尿病網膜症、またその一病態である DME が今後ますます増加していくことが懸念 される。 2.5.1.1.2 DME の危険因子 2.5.1.1.2.1 眼局所性因子 2.5.1.1.2.1.1 糖尿病網膜症 DME は糖尿病網膜症の一病態であるため、DME は糖尿病網膜症のいかなる病期においても発症 するが、DME の発症、進展は糖尿病網膜症の進展に強く相関する。したがって、糖尿病網膜症が DME の発症、進展の眼局所性因子と言える。DME の発症頻度は、軽度の非増殖網膜症において 3%であるが、中等度もしくは重度の非増殖網膜症では 38%に増加し、さらに増殖網膜症では 71%と急増する7)。よって、糖尿病網膜症の進展とともに DME を合併する頻度は高くなる。 2.5.1.1.2.1.2 サイトカイン 網膜血管の血管透過性亢進因子として、VEGF、TNFα、IL-1、IL-6、IL-8 などのサイトカイン が挙げられ15), 16), 17), 18), 19), 20), 21)、DME への関与が示唆されている。志村らは22)、嚢胞様浮腫と 漿液性剥離の両者を認めない DME 15 眼の硝子体中に高濃度の VEGF が検出されたと報告している。 Funatsu ら23)は、DME 患者の硝子体手術時の硝子体中の VEGF 濃度を測定したところ、VEGF 濃度は 高値で、蛍光眼底造影検査(Fluorescent Angiography: FA)において蛍光強度の低い DME より、 重度の DME であると考えられる蛍光強度の高い DME で有意に増加し、VEGF が血管透過性亢進に 関与していると報告している。また、VEGF は血管透過性亢進に関与するだけでなく、血管新生 を促進する。糖尿病に伴う高血糖状態、糖化最終産物 Advanced Glycation Products(AGEs)、 及び酸化ストレスなどにより VEGF の発現が亢進することが知られている17)。Lang ら24)は、糖尿 病網膜症では VEGF の発現やシグナル伝達の制御に異常が生じ、VEGF が血液網膜関門の破綻及び 黄斑浮腫の進展において中心的な役割を担う生理活性因子であると報告している。 2.5.1.1.2.2 全身性因子 糖尿病の 1 型、2 型にかかわらず、糖尿病網膜症を含めた糖尿病合併症の発症・進展において、 高血糖、糖尿病罹病期間、及び高血圧が主要な危険因子であることは、多くの報告で一貫してい
る。そのうち、高血糖はこれを是正することにより、糖尿病網膜症の発症や進展を遅らせること ができる25), 26), 27)。高血圧は、拡張期血圧が DME 発症の危険因子とされている28)。また、確かな エビデンスは得られていないものの、総コレステロール、中性脂肪及び LDL コレステロールの増 加により黄斑部の硬性白斑の集積や沈着がもたらされることから、高脂血症が糖尿病網膜症の悪 化の危険因子であると報告されている11)。これら危険因子は、糖尿病網膜症及び硬性白斑の原因 となる DME の発症・進展に対して相互に影響しながら促進的に作用している。 2.5.1.1.2.2.1 血糖コントロール
Wisconsin Epidemiologic Study of Diabetic Retinopathy では、30 歳未満で 1 型糖尿病を発 症した患者 520 例を 25 年間経過観察した29)。糖尿病網膜症の発症・進展は 83%であり29)、うち 増殖糖尿病網膜症は 42%にみられ29)、DME は 29%に認められたと報告されている29), 30)。同研究 において多変量解析を行ったところ、DME の発症に、ヘモグロビン A1c(HbA1c)が高値であるこ と 及 び 高 い 収 縮 期 血 圧 の 関 与 が 大 き い こ と が 報 告 さ れ て い る30)。 Diabetes Control and Complication Trial(DCCT)25)では、厳格な血糖コントロールを行った群では、従来の糖尿病治 療のみを行った群と比較して、糖尿病網膜症の発症は 76%、進展は 54%抑制され、DME は 23% の減少が見られた。DCCT の結果から、血糖コントロールの不良が糖尿病網膜症の危険因子であ ることが支持された。また United Kingdom Prospective Diabetes Study(UKPDS 33)27)におい て、通常の糖尿病治療のみを行った群に比較して厳格な血糖コントロールを加えた群では、糖尿 病網膜症の進展は 21%抑制されたと報告されている。また、2 型糖尿病の日本人患者を対象とし た Kumamoto Study26)でも、症例数は少ないものの、HbA1c 6.5%未満、空腹時血糖 110mg/dL 未 満であれば、糖尿病による微小血管合併症の発症、進展はほとんど見られないと報告している。 このように、厳格な血糖コントロールにより糖尿病網膜症の発症・進展が抑制可能であることは、 国内外の報告で一貫している。
2.5.1.1.2.2.2 高血圧
United Kingdom Prospective Diabetes Study(UKPDS 38)31)では、高血圧を合併した 2 型糖 尿病患者において、厳格な血圧コントロールを行っている群と血圧コントロールが不十分である 群を比較した。その結果、厳格な血圧コントロールを行っている群は、血圧コントロールが不十 分な群と比較し、2 段階以上の糖尿病網膜症の悪化の危険性が 34%、Early Treatment Diabetic Retinopathy Study(ETDRS)における 3 列以上の視力悪化の危険性が 47%減少したと報告され ている。 2.5.1.1.3 臨床的側面及び病態生理学 DME は糖尿病網膜症の一病態であり32)、糖尿病網膜症のいかなる病期においても発生する7)。 黄斑浮腫の基本病態は、網膜血管透過性が異常に亢進し、黄斑部に滲出液が貯留する状態である 33)。視機能を担う黄斑部の浮腫は、著しい視力低下に直結することから、できる限り早期に DME を発見し、有効な治療を開始する必要がある12)。
Diabetic Retinopathy Study (DRS)では、DME は黄斑中心から1乳頭径以内の網膜の肥厚とさ れ34)、形態学的分類である Bresnick の分類32)(局所性黄斑浮腫、びまん性黄斑浮腫)と ETDRS Research Group による Clinically significant macular edema(CSME)の定義35)(2.5.1.1.5参 照)が代表的であるが、臨床で治療法を検討する際には Bresnick の分類が一般的に使われてい る12)。
網膜血管内皮細胞(内血液網膜関門)と網膜色素上皮細胞(外血液網膜関門)の血液網膜関門 (blood-retinal barrier)機構が破綻すると、DME の網膜毛細血管の透過性が異常亢進し、黄 斑部に滲出液が貯留する36)。その破綻を誘導し、血管透過性を亢進する最も重要な分子と考えら れるのが、血管透過性因子として報告された VEGF である16)。VEGF は DME の病態生理に次のよう に関連している。本来、VEGF は、低酸素による発現の亢進が知られている37)。しかし、糖尿病網 膜症眼においては、明らかな血管閉塞、透過性亢進が起こる以前から、網膜血管周囲における VEGF の発現亢進が指摘されている17)。VEGF 発現亢進には、高血糖状態からもたらされるタンパ ク質の非酵素的糖化によって生じる糖化最終産物(AGEs)が一因となることが報告されている17)。 また、ストレプトゾトシン誘導の糖尿病モデルでも早期から網膜での VEGF 発現と血管透過性亢 進が起こることが報告された38)。糖尿病による血液網膜関門の破綻は VEGF を介する38), 39)との報 告もある。一方、糖尿病網膜症患者の網膜では VEGF が多く発現しているが、対照的に健常人の 網膜ではほとんど VEGF が発現していないことが報告されている37)。このことから、糖尿病発症 とともに、網膜では VEGF の発現亢進をきたし、さらに VEGF は糖尿病網膜症における黄斑浮腫の 内因性メディエーターとして血液網膜関門の機能変化に関与していると考えられる。また、近年、 VEGF が白血球の遊走を介して網膜に炎症を惹起する炎症性サイトカインとしても捉えられてい る15), 40)。糖尿病網膜症患者においては、硝子体内で IL-6、IL-8、MCP-1、及び VEGF が高値とな り、また VEGF が、炎症を介して血管新生を惹起する IL-8 にのみ強い相関を示したため、糖尿病 網膜症の病態に血管新生と炎症が関与していることが示唆されている15), 19), 40)。以上のことから、 DME の病態である血管透過性亢進及び糖尿病網膜症の進展に関与する血管新生や炎症を惹起する VEGF に対して、抗 VEGF 薬は、直接的に作用する薬物療法となることが期待されている。 2.5.1.1.4 自然経過 DME は、糖尿病網膜症の一病態として発症し32)、糖尿病患者における視力障害の主要な原因と なる。通常、網膜浮腫による肥厚が徐々に進行し、病変が黄斑部に及ぶと視力障害を生じる。 DME の発症、進展は糖尿病網膜症の進展と強く相関するが、糖尿病網膜症の初期段階においても DME が発症することがある。DME は、高血糖、高血圧、高脂血症などの全身性因子の改善により 変化はみられるが自然寛解することは、極めて稀である7)。また、中心窩に及ぶ DME が無治療で 放置された場合、29%が 3 年後に中等度(ETDRS チャートで 3 列)の視力低下をきたす。また、 視力が自然回復することも稀であり、ETDRS チャートで 3 列以上の視力改善が得られる頻度は 5%である7)。 2.5.1.1.5 症状及び診断 黄斑部は視機能全体に占める比重が高く、軽度の DME であっても著しい視力障害がみられ、特 にびまん性黄斑浮腫でそれが顕著である。 ETDRS では、DME は黄斑中心部から 1 乳頭径の範囲に網膜の肥厚あるいは硬性白斑が存在する 状態と定義されている7), 36)。また、ETDRS は、レーザー治療の適応となる病態としての CSME を 以下のいずれかと定義している35)。 黄斑中心より 500μm 以内の網膜の肥厚を認める場合 黄斑中心より 500μm 以内の硬性白斑が存在し、それに接した網膜の肥厚を認める場合 黄斑中心より 1 乳頭径以内に 1 乳頭径以上の網膜の肥厚を認める場合
また、DME は局所性黄斑浮腫とびまん性黄斑浮腫に大別される32)。局所性黄斑浮腫は、局在す る微小血管瘤からの漏出により、網膜の肥厚が局所性にみられる。FA は、微小血管瘤からの漏 出部位が明瞭に観察され、しばしば硬性白斑が漏出部位をリング状に取り囲む32)。びまん性黄斑 浮腫は、微小血管瘤の発症だけでなく毛細血管及び細動脈を広範囲に障害する。その結果、びま ん性に網膜毛細血管床が拡張し、透過性が亢進することで広範囲の網膜肥厚を特徴とする7)。し かし、臨床的には両者は明瞭に区分できないことも多く、種々の程度の混合がみられる7)。 これまでは、主に検眼鏡と FA によって、DME の診断が行われてきた。臨床現場では、非接触 型の倒像検眼鏡がしばしば用いられ、網膜浮腫が顕著な場合には特に有用である7)。しかし、早 期の網膜浮腫に対しては、接触型の検眼鏡がより感度が高いとされている。DME の診断において、 FA は血管漏出を定量的に評価しレーザー光凝固術で治療可能な病変を同定するのに有用である。 また、FA により、不良な視力予後と関連があるとされる中心窩無血管領域の拡大の有無を評価 することが可能である7)。
近年では、非侵襲的検査である OCT(Optical Coherence Tomography)の普及と進歩によって、 DME の定性化及び定量化が容易かつ高精度になってきている。また、OCT は、FA と同様に CSME の診断ができるだけでなく、網膜と硝子体の境界部が明瞭に描出可能であり、網膜硝子体牽引や 網膜前膜の同定が可能である7)。 2.5.1.2 DME の治療法 DME に対する治療にはレーザー光凝固術を含む外科的治療法と薬物療法があるが、世界的には、 レーザー光凝固術が第一選択となっている35)。また、DME の原因として後部硝子体や線維膜によ る網膜の機械的牽引が大きく関与している場合には、その牽引を解除する目的で硝子体手術が行 われる41)。近年、薬物による DME 治療が普及し始め、炎症性サイトカインのみならず VEGF の発 現抑制も期待されるステロイド薬が、テノン嚢下投与もしくは硝子体投与され、一定の成績を挙 げている。ステロイド徐放剤の硝子体留置インプラントも試みられている。さらに最も新しい薬 物療法として、抗 VEGF 療法が高い有効性と、ステロイド薬と比較した際の安全性の高さから、 世界的に徐々に普及し始め、欧米では承認薬として使用頻度が高まっている。しかし、これらの 薬物療法の有効性と安全性についての評価が十分に確立されている状況ではないため、多岐にわ たる治療選択肢の中から最も有効と考えられる治療法が単独もしくは併用療法として選択されて いる。 2.5.1.2.1 レーザー光凝固術 DME に対するレーザー光凝固術は 1970 年代から行われるようになった42)。レーザー光凝固術は、 発症早期に実施することで黄斑中心部を含む CSME に対し視力を温存させる効果があり、黄斑浮 腫や硬性白斑の軽減に有効な治療法であると報告35)されて以来、DME に対する標準治療として用 いられてきた。同報告によると、レーザー治療開始後 3 年目に 15 文字以上視力が低下した被験 者の割合は、早期にレーザー治療を実施しなかった群では 24%、早期にレーザー治療を実施し た群では 12%であり、早期治療により 15 文字以上の視力低下のリスクを半減させた。また、治 療前の視力が悪い(20/40 以下)患者では、早期の治療により 6 文字以上の視力改善がみられた 被験者の割合が多かったが、治療前の視力が良好である場合は、同様の視力の改善が得られにく かった。一方、レーザー光凝固術の副作用(網膜下線維増殖、凝固斑の進行性拡大など)も報告 43), 44), 45), 46)されており、より有効かつ安全なレーザー光凝固術が研究されている。
前述のように、ETDRS research group は、治療の対象となりうる黄斑浮腫として CSME を定義 した。判定は、検眼鏡による眼底検査により得られた所見に基づいてされる。実際の治療にあた っては、眼底検査に加え可能な限り FA を行い、治療可能な病変を確認した上で治療を行うこと が薦められている47)。治療可能な病変は以下のように定義されている。 1. 中心窩から 500μm 以上離れている境界明瞭な網膜の過蛍光点もしくは局所漏出点(毛細 血管瘤と思われる病変)で網膜浮腫や硬性白斑の原因となっているもの 2. 中心窩から 300~500μm にあり網膜浮腫や硬性白斑の原因になっている局所漏出領域(以 前のレーザー光凝固術の治療後も CSME が残存し、視力が 20/40 以下で、傍中心窩の毛細 血管網を破壊してしまうことがないと思われる場合) 3. 網膜のびまん性蛍光漏出領域(網膜内細小血管異常あるいはびまん性漏出のみられる毛細 血管網) 4. 正常な中心窩無血管領域を除く肥厚した網膜の無潅流領域 DME における局所浮腫とびまん性浮腫を区別することは必ずしも容易ではないが、レーザー光 凝固術に際しては、これらの浮腫の病態を正しく評価することが重要である。 DME に対するレーザー光凝固術は、直接凝固と格子状凝固に分類される。直接凝固は、漏出を 伴う毛細血管瘤(多くは輪状硬性白斑の中心に位置する)に焦点を合わせ、それを直接凝固閉塞 することによって、漏出を防ぎ浮腫及び硬性白斑を減少させるものである。網膜血管瘤からの漏 出を主体とする浮腫、すなわち局所浮腫が対象となる。また、格子状凝固は、網膜色素上皮層や 視細胞層を照射の目標に置き、そこに弱い熱傷を与えることで間接的に浮腫を消退させる方法で ある。漏出がびまん性で直接凝固の部位を特定できない浮腫、すなわち、びまん性浮腫が主な適 応となる。格子状光凝固は、きわめて繊細な治療法であり、目標とする網膜外層が選択的に障害 され、また凝固斑の大きさを超えて周囲に萎縮が広がらないように照射条件設定に配慮する必要 がある。直接凝固と格子状凝固は DME の病態により、単独または併用で使用される。 2.5.1.2.2 薬物療法 2.5.1.2.2.1 ステロイド療法 国内外で、ステロイドの浮腫軽減作用を期待して、トリアムシノロンアセトニドの IVT 投与及 びテノン嚢下投与が以前から行われている。本邦では、2012 年 11 月にトリアムシノロンアセト ニドの IVT 投与が DME に対して承認されている。海外では、ステロイド徐放剤の使用が報告され ているが、DME に対して現時点で承認されているものはない。 2.5.1.2.2.1.1 トリアムシノロンアセトニドの IVT 投与
米国の Diabetic Retinopathy Clinical Research Network(DRCRnet)において、DME を有す る患者 693 例を対象に、局所凝固と格子状凝固を組み合わせて行う modified ETDRS 法を用いた レーザー治療群、トリアムシノロンアセトニド 1mg、4mg を それぞれ IVT 投与する群の計 3 群を 比較した48), 49)。その結果、4 ヵ月目における BCVA 文字数の平均変化量はレーザー治療群 0 文字、 1mg 群 0 文字、4mg 群 4 文字の増加であり、4mg 群の視力が最も良好であった。しかし、1 年を経 過する頃から差がなくなり、2 年目ではレーザー治療群の視力がトリアムシノロンアセトニド投
与群を上回るようになり、トリアムシノロンアセトニド 1mg 群と 4mg 群もほとんど差がみられな くなった(1 年目における BCVA 文字数の平均変化量は、レーザー治療群 1 文字の増加、1mg 群 0 文字、4mg 群 0 文字であり、2 年目では、レーザー群 2 文字の増加、1mg 群 2 文字の減少、4mg 群 4 文字の減少、3 年目では、レーザー治療群 5 文字の増加、1mg 群 0 文字、4mg 群 0 文字であっ た)。これらの結果から、ステロイド療法は、治療開始後早期には有効性を示すが、経時的に効 果が減弱していくことが示唆された。なお、トリアムシノロンアセトニド投与群では、白内障手 術の実施頻度及び眼圧上昇の発現頻度が高いことが示された。2 年目において、10 ㎜ Hg 以上の 眼圧上昇の発現頻度は、レーザー治療群 4%、1mg 群 16%、4mg 群 33%、白内障手術が実施され た割合は、レーザー治療群 13%、1mg 群 23%、4mg 群 51%であった。 本邦では、2012 年 11 月に硝子体内注射用剤としてトリアムシノロンアセトニドが DME を効 能・効果として追加承認されている。 2.5.1.2.2.1.2 トリアムシノロンアセトニドのテノン嚢下投与 DRCRnet では、トリアムシノロンアセトニドのテノン嚢下投与の効果についても検討を行って いる。視力が 20/40 以上の比較的軽症の DME を有する被験者 109 例(129 眼)を以下の 5 群に割 り付け比較した50)。 黄斑部の局所レーザー治療 トリアムシノロンアセトニド 20mg 前部テノン嚢下投与 トリアムシノロンアセトニド 20mg 前部テノン嚢下投与の 4 週後に局所レーザー治療 トリアムシノロンアセトニド 40mg 後部テノン嚢下投与 トリアムシノロンアセトニド 40mg 後部テノン嚢下投与の 4 週後に局所レーザー治療 その結果、34 週目では、網膜厚及び視力の改善に関して、5 群間で明らかな差はみられなかっ た。一方、眼瞼下垂及び眼圧上昇は、レーザー治療群よりもテノン嚢下投与群で多くみられた。 これらの結果から、トリアムシノロンアセトニドのテノン嚢下投与は、比較的軽症の DME に対し ては、大きなベネフィットは期待できないと考えられる。しかしながら、テノン嚢下投与は IVT 投与に比べて投与手技が簡便であることもあり、国内外で広く実施されている。 2.5.1.2.2.1.3 ステロイド徐放剤 ステロイドの局所投与による効果の持続性には限界があることから、ステロイドが長期間にわ たって徐放される種々の硝子体内留置インプラントが開発されている51), 52), 53)。インプラント留 置後 6 ヵ月間の経過において、最高矯正視力(Best Corrected Visual Acuity: BCVA)は留置後 3 ヵ月目に、また中心窩網膜厚は留置後 1 ヵ月目に改善のピークがみられた。その後は留置後 6 ヵ月目にかけて緩やかに BCVA の悪化及び中心窩網膜厚の増加がみられている54)。現時点で、国 内外で DME に対して承認されているステロイド徐放剤はない。 2.5.1.2.2.2 抗 VEGF 薬 糖尿病網膜症は、長期間にわたる高血糖や酸化ストレス、慢性炎症などによる網膜血管障害で ある55)。この一連の過程で、VEGF をはじめとするサイトカインの発現が亢進し、血液網膜関門の
破綻により網膜浮腫が生じるとされる。したがって、抗 VEGF 療法により血液網膜関門の破綻を 抑制して DME を治療する試みが行われてきた。
2.5.1.2.2.2.1 ペガプタニブ
ペガプタニブナトリウム(以下、ペガプタニブ)は VEGF165に対する選択的阻害作用を有する RNA アプタマーである。DME を有する患者 317 例を対象とした第Ⅱ/Ⅲ相臨床試験(Macugen 1013 試験)56)では、ペガプタニブ 0.3mg を 6 週ごとに IVT 投与する群と偽注射群との比較を行った。 54 週目における 10 文字以上の視力改善がみられた被験者の割合は、ペガプタニブ群 36.8%、偽 注射群 19.7%であった。また、ベースラインからの視力の変化量は、54 週目では、ペガプタニ ブ群 5.2 文字の増加、偽注射群 1.2 文字の増加、102 週目では、ペガプタニブ群 6.1 文字の増加、 偽注射群 1.3 文字の増加であり、いずれもペガプタニブ群が偽注射群を上回っていた。 国内外において、ペガプタニブは、DME を効能・効果として承認されていない。 2.5.1.2.2.2.2 ベバシズマブ ベバシズマブは、抗 VEGF ヒト化モノクローナル抗体であり、眼科用製剤としては国内外でい ずれの適応症でも承認されておらず、DME に対しても適応外使用されている。ベバシズマブの臨 床成績を以下に記載した。 DME を有する患者 121 例を以下の 5 群に無作為割付けし、比較検討した57)。 A 群:ベースライン時に局所レーザー治療を実施 B 群:ベースライン時及び 6 週目にベバシズマブ 1.25mg を IVT 投与 C 群:ベースライン時及び 6 週目にベバシズマブ 2.5mg を IVT 投与 D 群:ベースライン時にベバシズマブ 1.25mg を IVT 投与し、6 週目に偽注射を実施 E 群:ベースライン時及び 6 週目にベバシズマブ 1.25mg を IVT 投与し、3 週目に局所 レーザー治療を実施 その結果、黄斑部網膜厚は、B 群及び C 群は A 群に比べて 3 週目において改善が認められたが、 6 週目以降 12 週目まではその改善度において A 群との明らかな差は認められなかった。視力に 関しては、B 群及び C 群は A 群に比べて 3 週目において 1 列の改善がみられ、12 週目まで視力の 改善が維持され、ベバシズマブの IVT 投与が DME に有効であることが示された。
また、ベバシズマブの IVT 投与とレーザー治療を比較した BOLT 試験では、DME を有する患者 80 例を以下の 2 群に無作為に割付けし、比較検討した58)。 ベバシズマブ群:ベバシズマブ 1.25mg を 6 週ごとに 3 回 IVT 投与し、その後は 6 週ごと に来院して OCT 所見に応じて随時投与を行う レーザー治療群:ベースライン時に modified ETDRS 法によるレーザー治療を受け、その 後は 16 週ごとに ETDRS のレーザー治療基準に従ってレーザー治療を行 う
その結果、治療開始 2 年後にベバシズマブ群では平均 8.6 文字の視力改善が得られたのに対し、 レーザー治療群では平均 0.5 文字の視力低下がみられた。このことから、ベバシズマブ IVT 投与 の長期的なベネフィットが示唆された。
2.5.1.2.2.2.3 ラニビズマブ
ラニビズマブは、ヒト化抗 VEGF モノクローナル抗体の Fab 断片であり、VEGF の血管透過性の 亢進作用及び血管新生作用を抑制する薬剤である。ラニビズマブは、DME を効能・効果として、 欧州では 0.5mg 用量、米国では 0.3mg 用量がそれぞれ承認されている。本邦では、ラニビズマブ 硝子体内注射液 2.3mg/0.23mL として市販されており、2012 年 3 月に DME に対する追加効能・効 果で承認事項一部承認申請が行われている(本邦での申請用量は 0.5mg)が、2013 年 12 月現在、 承認に至っていない。ラニビズマブの臨床成績を以下に記載した。 DME を有する患者 691 例 854 眼を対象に、レーザー単独治療群、ラニビズマブ 0.5mg IVT 投与 とレーザー治療を併用する群、ラニビズマブ 0.5mg IVT 投与と治療開始 24 週目以降にレーザー 治療を併用する群、トリアムシノロンアセトニド IVT 投与とレーザー治療を併用する群の計 4 群 に無作為割付けし、比較した59), 60)。その結果、1 年後の時点でラニビズマブ併用群ではレー ザー単独治療群に比べて有意な視力の改善を示し、その傾向は 2 年間持続することが示された (1 年目の BCVA 文字数の平均変化量は、ラニビズマブ 0.5mg IVT 投与とレーザー治療を併用す る群:9 文字の増加、ラニビズマブ 0.5mg IVT 投与と治療開始 24 週目以降にレーザー治療を併 用する群:9 文字の増加、レーザー単独治療群:3 文字の増加、トリアムシノロンアセトニド IVT 投与とレーザー治療を併用する群:4 文字の増加)。なお、トリアムシノロンアセトニド IVT 投与とレーザー治療を併用する群では、治療開始後 24 週目まで視力改善が認められたが、 治療開始 28 週目以降は経時的に視力低下をきたす症例がみられた59)。
RESTORE 試験では、DME を有する患者 345 例を対象に、ラニビズマブ 0.5mg IVT 単独投与群、 ラニビズマブ 0.5mg IVT 投与とレーザー治療を併用する群、レーザー単独治療群の計 3 群を比較 した61)。ラニビズマブは 4 週ごとに連続 3 回投与し、その後は再投与基準による PRN 投与が実施 された。その結果、ラニビズマブ単独あるいはレーザー治療を併用した群は、レーザー単独治療 群を上回る視力改善が得られた(1 ヵ月目から 12 ヵ月目までの BCVA 文字数の平均変化量は、ラ ニビズマブ 0.5mg IVT 単独投与群:6.1 文字の増加、ラニビズマブ 0.5mg IVT 投与とレーザー治 療を併用する群:5.9 文字の増加、レーザー単独治療群:0.8 文字の増加)。 また、RISE 試験及び RIDE 試験では、ラニビズマブ 0.3mg、0.5mg を毎月投与する群、偽注射 群の計 3 群を比較した62)。その結果、ラニビズマブ 0.3mg 及び 0.5mg で同程度の視力改善が得ら れることが示された。また、24 ヵ月目における 15 文字以上の視力改善が得られた被験者の割合 は、RISE 試験では、偽注射群 18.1%、ラニビズマブ 0.3mg 群 44.8%、ラニビズマブ 0.5mg 群 39.2%であり、RIDE 試験では、偽注射群 12.3%、ラニビズマブ 0.3mg 群 33.6%、ラニビズマブ 0.5mg 群 45.7%であった。 2.5.1.2.3 硝子体手術 硝子体切除術は、DME の他、硝子体出血、網膜剥離、黄斑の牽引、虹彩・隅角ルベオーシスな どに対しても実施される63)。DME では、主にびまん性浮腫が硝子体切除術の対象となる64)。びま ん性浮腫の原因には、血液網膜関門の破綻、黄斑上の硝子体皮質による牽引、硝子体皮質や内境 界膜への起炎性物質(VEGF やサイトカイン等)の貯留が考えられ、後部硝子体の黄斑部への異
常癒着の解除や起炎性物質を手術により除去することが、硝子体手術の主な奏効機序とされてい る65)。 しかし、硝子体切除術は効果的であると評価される一方、合併症が起こると失明につながる恐 れがある。そのため、硝子体切除時の合併症軽減を目的として、抗 VEGF 薬やステロイド剤を併 用する治療法の研究も進んでいる。 2.5.1.2.4 DME に対する新規治療の必要性 DME は、糖尿病網膜症において視力低下を引き起こす最も重要な病態である。DME に対する標 準治療として、レーザー光凝固術が用いられてきたが、視力の改善効果は不十分であることが示 されている66), 67)。トリアムシノロンアセトニドの IVT 投与あるいはテノン嚢下投与が、国内外 で使用されている。本邦では、DME の治療薬としてトリアムシノロンアセトニドの IVT 投与が承 認されているが、白内障手術頻度の増加や眼圧上昇のリスクが知られており、また、その長期的 な効果は十分でない48), 49)。DME に対して硝子体手術が黄斑浮腫の軽減に効果的であるが、視力 改善は得られにくいこととその侵襲性の高さから、他に有効な治療法がない場合に選択されるこ とが多い68)。
近年、欧米を中心に DME に対する抗 VEGF 薬の IVT 投与の有用性が示され、その視力改善効果 及び安全性の面から、新規療法の第一選択として推奨されつつある。
2.5.1.3 VEGF Trap
2.5.1.3.1 薬理学的分類及び主な薬理作用
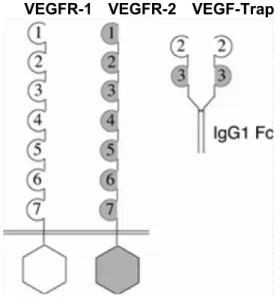
VEGF Trap は、新規の抗 VEGF 薬であり、ヒト VEGF 受容体(VEGFR-1)の第 2 免疫グロブリン (Ig)ドメイン及び VEGFR-2 の第 3 Ig ドメインをヒト IgG1 の Fc ドメインに直列に融合した水 溶性の組換えヒト融合たん白質である(図 2.5.1-1 参照)。VEGFR の細胞外領域を構成する 7 つ の Ig ドメインの中で、これらのドメインは両 VEGF 受容体がリガンドと結合する際の主要な役割 を担っている。
VEGFR-1 VEGFR-2 VEGF-Trap
VEGF Trap は、遺伝子組換えチャイニーズハムスター卵巣(CHO)K1 細胞で発現させ、培養液 中に分泌された VEGF Trap を分離・精製する製造工程により得られる。たん白質分子量 97 キロ ダルトン(kDa)の二量体の糖たん白質で、 %程度の糖鎖付加部分を含めると総分子量は約 115kDa である。
VEGF Trap は、VEGF の過剰発現と、その結果生じる、網膜における血管からの漏出性変化を特 徴とする眼内血管疾患に対する新規の治療薬として Regeneron 社で製造・開発され、BHC 社と共 同開発された。治療の標的組織である網膜及び脈絡膜付近で薬剤の濃度を最も高め、その一方で 全身曝露を最小限にするため、投与経路は IVT 投与とした。VEGF Trap-Eye の IVT 注射用製剤は、 原薬に IVT 注射用に適した添加剤を加えて調製した製剤であり、単回投与製剤としてバイアル 製剤及びプレフィルドシリンジ製剤がある。
VEGF Trap は VEGF-A のすべてのアイソフォームを阻害するようにデザインされ69)、既に市販さ れている他の抗 VEGF 薬であるラニビズマブ(遺伝子組換え)及びベバシズマブ(遺伝子組換 え)よりも VEGF-A に対して高い結合親和性を持つ。また、VEGF-B にも結合する。ヒト VEGF-A165 と結合する際の解離定数(KD)は 0.49pM、ヒト VEGF-A121では 0.36pM、ヒト VEGF-B では 1.92pM、 PlGF-2 では 38.9pM である69)。VEGF Trap の 1 モルはヒト VEGF-A165の 1 モルと結合する。VEGF Trap とリガンドのモル比は 1:1 以上で、受容体のシグナル伝達は完全に遮断される。
すなわち、VEGF Trap は、受容体デコイとして血中及び血管外の VEGF 又は PlGF-2 と結合し、 その生物学的作用を抑制する高親和性の特異的阻害薬である。
DME に対する VEGF Trap の効果は、糖尿病性網膜に発生する 2 つの主要な病理学的プロセス である網膜浮腫及び虚血性網膜血管新生を反映する動物モデルでの検討結果から示されている。 すなわち、ストレプトゾトシン誘発糖尿病ラットに VEGF Trap(3μg/eye)を単回硝子体内投与 すると、対照タンパク質のヒト免疫グロブリン G1(IgG1)の定常領域(Fc)を投与したもう一 方の眼と比較して、網膜血管透過性が正常化した〔滲出型加齢黄斑変性の承認申請書添付資料 (以下、AMD CTD)M2.6.2.2.2.4 参照〕。また、未熟児網膜症、増殖糖尿病網膜症及び網膜静脈 閉塞症などの虚血性網膜症にみられる新生血管と似た所見を生じる酸素誘発虚血性網膜症 (Oxygen-induced retinopathy:OIR)のマウスモデルでも、VEGF Trap(0.5 又は 0.24μg)の 単回硝子体内投与によって、病的な網膜血管新生の発現が抑制された(AMD CTD M2.6.2.2.2.5 参照)。これらの成績は、VEGF Trap が DME に対して有効であることを示唆するものである。
2.5.1.4 臨床試験の主な科学的背景及び根拠 2.5.1.4.1 DME の調節因子としての VEGF DME は、体液やリポタンパク等の巨大分子が網膜の毛細血管から血管外空隙へ異常な漏出を起 こすことが原因で発症する。その後、血管外空隙における膠質浸透圧が上昇する事により、その 空隙への水分の流入が起こる70)。網膜色素上皮は、正常な場合は、脈絡膜毛細血管から網膜に向 かう体液の流れに対する障壁として作用し、また、網膜から体液を積極的に汲み上げる。従って、 網膜色素上皮に異常が起これば、脈絡膜毛細血管からの体液の流入を増大させたり70)、あるいは 網膜からの正常な体液の流出を減少させるため、DME を助長する可能性がある。血液網膜関門が 崩壊するメカニズムは、網膜毛細血管及び網膜色素上皮レベルでは、オクルジンのような密着結 合構成蛋白の変化による可能性がある71)。DME においてこのようなメカニズムを誘導する最も重 要な因子と考えられているのが VEGF である(2.5.1.1.3参照)。
VEGF は、血管新生や血管透過性亢進を特徴とする糖尿病網膜症等の眼疾患においては、主要 な原因因子であると考えられている72), 73)。正常な霊長類の眼に VEGF を投与すると糖尿病網膜症 に極めてよく似た病態が誘発され、これには血管新生や網膜血管透過性の変化が伴う74), 75)。増 殖性糖尿病網膜症76)及び DME23)の患者より得た硝子体サンプルでは、VEGF の濃度が上昇していた。 動物モデルでは、VEGF を阻害すると、糖尿病で誘発された血管透過性亢進が低下した38)。 2.5.1.4.2 VEGF Trap-Eye の臨床試験の根拠 DME の発症、進展過程において、VEGF は血管透過性亢進、血管新生、炎症を惹起する重要な役 割を果たすと考えられており、抗 VEGF 薬は直接的に作用する薬物療法となることが期待されて いる。VEGF Trap は VEGF-A のすべてのアイソフォームを阻害するようにデザインされ69)、また、 VEGF-A に対して高い結合親和性を持つ。さらに、VEGF-B 及び PlGF とも結合する。これらの VEGF Trap 特有の結合特性により、VEGF Trap-Eye の IVT 投与によって、臨床上のベネフィット が得られる可能性があると期待され、DME を対象として臨床試験を実施し、DME の治療薬として 開発を進めることが妥当であると考えた。
2.5.1.5 臨床開発プログラム
2.5.1.5.1 開発の経緯
VTE の眼科領域における臨床開発は、Regeneron 社により、滲出型加齢黄斑変性(Age-related Macular Degeneration: AMD)を適応症として 2004 年から開始された。BHC 社は、Regeneron 社 との共同開発契約に基づき、2007 年より滲出型 AMD 患者を対象とした第Ⅲ相臨床試験を開始し た。VTE は、滲出型 AMD を適応症として 2011 年 11 月に米国で世界最初の承認を取得し、本邦で は 2012 年 9 月に「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」の効能・効果で承認を取得し た。 DME に対する臨床開発は、2004 年から開始され、国外第Ⅲ相臨床試験(VISTA-DME 試験)及び 日本を含む国際共同第Ⅲ相臨床試験(VIVID-DME 試験)は、共に 2011 年 5 月、国内第Ⅲ相臨床 試験(VIVID-Japan 試験)は 2012 年 1 月から開始した。 2.5.1.5.2 臨床データパッケージ 糖尿病黄斑浮腫を効能・効果とした臨床データパッケージを表 2.5.1-1 に示す。
有効性評価には、DME を有する患者を対象に VTE を IVT 投与した国外第Ⅰ相臨床試験(512 試 験)、国外第Ⅱ相臨床試験(706 試験)、国外第Ⅲ相臨床試験(VISTA-DME 試験)、国際共同第 Ⅲ相臨床試験(VIVID-DME 試験)及び国内第Ⅲ相臨床試験(VIVID-Japan 試験)を用いた。なお、 VIVID-Japan 試験は、DME を有する日本人患者における安全性評価を主目的としており、有効性 評価は、副次的目的として実施した。
安全性評価には、DME を有する患者を対象とした 512 試験、706 試験、VISTA-DME 試験、 VIVID-DME 試験及び VIVID-Japan 試験を用いた。また、DME を有する患者を対象に VEGF Trap を 静脈内に反復投与した国外第Ⅰ相臨床試験(307 試験)の成績も参照した。なお、ICH-E1 ガイド ライン〔「致命的でない疾患に対し長期間の投与が想定される新医薬品の治験段階において安全 性を評価するために必要な症例数と投与期間について」平成 7 年 5 月 24 日付薬審第 592 号〕に
則り、DME を有する日本人患者 100 例における本剤の長期(1 年間)安全性を包括的に評価する ため、VIVID-DME 試験及び VIVID-Japan 試験の日本人集団に対して併合解析を行った。
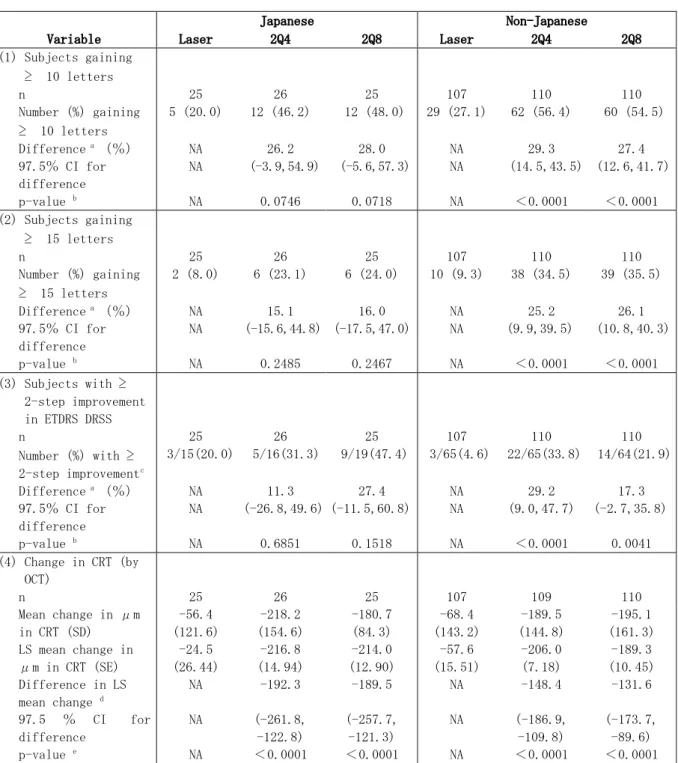
臨床薬理評価には、DME を有する患者における血漿中遊離型及び結合型 VEGF Trap の薬物動態 を評価するため、VEGF Trap の静脈内投与を検討した 307 試験、VTE の IVT 投与を検討した 512 試験、706 試験、VIVID-DME 試験及び VIVID-Japan 試験の成績を用いた。また、706 試験、 VIVID-DME 試験、VIVID-Japan 試験及び VISTA-DME 試験において抗 VEGF Trap 抗体の評価も行っ た。 表 2.5.1-1 臨床データパッケージ 試験番号 相 実施国 対象 試験の目的 投与方法 割付被験者数 資料区分 VGFT-OD-0307 (307 試験) 第Ⅰ相 米国 DME 安全性、 忍容性 VEGF Trap 4.0mg/mL を 0.3mg/kg の用量で 2 週間ごとに 4 回静脈内投与 VEGF Trap と同等の容量の 0.9%生理食塩水を 2 週間ごとに 4 回静脈内投与 計 9 参考資料a VGFT-OD-0512 (512 試験) 第Ⅰ相 米国 DME 安全性、 忍容性、 有効性 VTE 4mg を単回 IVT 投与 計 5 評価資料a VGFT-OD-0706 (706 試験) 第Ⅱ相 米国、カナダ、 オーストラリア DME 用量設定、 有効性、 安全性 0.5Q4 群:VTE 0.5mg を 4 週ごとに IVT 投与 2Q4 群:VTE 2mg を 4 週ごとに IVT 投与 2Q8 群:VTE 2mg を 4 週ごとに 3 回 IVT 投与 し、その後は 8 週ごとに IVT 投与 2PRN 群:VTE 2mg を 4 週ごとに 3 回 IVT 投与 し、その後は PRN 投与 レーザー治療群:1 週目に黄斑レーザー光凝 固術を実施。16 週目以降は、レーザー再治療 基準に従って黄斑レーザー光凝固術を実施 計 221 44 44 44 45 44 評価資料a VGFT-OD-1009 (VISTA-DME 試験) 第Ⅲ相 米国 DME 有効性、 安全性 2Q4 群:VTE 2 mg を 4 週ごとに IVT 投与 2Q8 群:VTE 2 mg を 4 週ごとに 5 回 IVT 投与 し、その後は 8 週ごとに IVT 投与 レーザー治療群:ベースライン時に黄斑レー ザー光凝固術を実施。12 週目以降はレーザー 再治療基準に従って、黄斑レーザー光凝固術 を実施 100 週目以降は VTE の再投与基準に 従って、VTE を IVT 投与 計 466 156 154 156 評価資料 91745 (VIVID-DME 試験) 第Ⅲ相 欧州、オーストラ リア、日本 DME 有効性、 安全性 VISTA-DME 試験と同じ(上記参照) 2Q4 群 2Q8 群 レーザー治療群 計 406(77b) 136(26b) 135(25b) 135(26b) 評価資料 15657 (VIVID-Japan 試験) 第Ⅲ相 日本 DME 有効性c、 安全性、 忍容性 VTE 2 mg を 4 週ごとに 5 回 IVT 投与し、その 後は 8 週ごとに 4 回 IVT 投与 計 73 評価資料
VTE: VEGF Trap-Eye(VEGF Trap-Eye の投与経路は、静脈内投与で行った 307 試験を除き、いずれも IVT 投与) DME: Diabetic Macular Edema(糖尿病黄斑浮腫)
PRN: As needed (pro re nata)(必要に応じて、随時)
a 本邦における滲出型 AMD 製造販売承認申請時、参考資料として提出 b 日本人被験者数
2.5.1.6 民族的要因の考察
国際共同第Ⅲ相臨床試験(VIVID-DME 試験)を実施するにあたり、民族的要因(内因性要因及 び外因性要因)について、以下の検討を行った。
2.5.1.6.1 内因性要因
2.5.1.6.1.1 有病率・危険因子
The Eye Diseases Prevalence Research Group によると77)、40 歳以上の糖尿病患者における DME の有病率は、白人のみを対象とした 4 試験では 1.2%~5.1%であり、ヒスパニック系を対象 とした 1 試験(8.9%)、及び黒人を対象とした 1 試験(8.6%)と比べて低かった。一方で、 Wong ら78)は、米国における 45 歳以上 85 歳以下の糖尿病患者における DME の有病率は 9.0%であ り、その内訳は、白人 2.7%、中国系 8.9%、黒人 11.1%、ヒスパニック系 10.7%であった。 本邦においては、糖尿病患者における糖尿病網膜症の有病率は、40 歳以上の地域住民全員を 対象とした久山町研究79)では 15.0%、35 歳以上の一般住民を対象とした舟形町研究では 23.0% であった80)。また、DME の糖尿病網膜症に占める割合が 20-30%程度であることより12), 78)、日本 人糖尿病患者における DME の有病率は、白人と同程度であると推測される。 海外においては、糖尿病網膜症の危険因子あるいは重症度に、血糖及び血圧のコントロール不 良が関連していることが報告されている81), 82)。本邦においても、糖尿病網膜症の危険因子とし て、高血糖や高血圧等の全身性因子が関与していることが報告されている。例えば、久山町研究 79)では、糖尿病罹病期間が長くなるほど、また HbA1c が上昇するほど糖尿病網膜症発症のリスク が増大すると報告している。また、Yoshida ら83)は、HbA1c、糖尿病罹病期間及び過去の BMI 値が 糖尿病網膜症の進展と関連することから、高血糖が最も重要な危険因子であると報告している。 一方、Okudaira ら84)は、拡張期高血圧と高い HbA1c 値が、糖尿病網膜症の進行に関連していたと 報告している。 糖尿病網膜症及び DME の有病率に関して、民族間で比較した報告は少なく、また研究報告ごと に対象患者、調査方法、疾患の定義及び調査時期が異なるため、複数の報告を用いて民族間の比 較を行うことは必ずしも容易ではない。しかし、これまでに得られた報告から、内因性要因に関 して日本人集団と外国人集団の間に明らかな違いはないと考えられた。 2.5.1.6.1.2 薬物動態学的要因 VTE は硝子体内に局所投与する薬剤であることから、作用は局所的に留まり、硝子体内濃度は 投与量に比例すると考えられる。また、タンパク製剤であるため、遺伝多型を有する薬物代謝酵 素による消失経路をたどらないことから、薬物動態学的な内因性要因による人種差の影響は受け にくいと考えられる。 2.5.1.6.2 外因性要因 現在、DME に対する統一された診断及び治療指針は国内外で存在しないが、DME に対するレー ザー光凝固術は 1985 年にその有効性が報告35)されて以来、国内外における標準治療として用い られてきた。ETDRS はレーザー治療の適応となる病態として CSME を定義し(2.5.1.1.5参照)、 我が国においても同基準に基づいたレーザー光凝固術が現在に至るまで実施されている。
近年では、国内外において従来からの治療法であるレーザー治療に加え、ステロイド剤による 薬物療法、硝子体手術及び抗 VEGF 薬の IVT 投与が実施されており、我が国では 2012 年にトリア ムシノロンアセトニドの IVT 投与製剤が承認されている。欧米諸国では抗 VEGF 薬のラニビズマ ブが DME を適応症として承認されているが、本邦の臨床現場でもベバシズマブが適応外使用され ている。抗 VEGF 療法は、国内外において、視力改善効果並びにその良好な安全性から、国内外 において、DME に対する治療法の有力な選択肢として徐々に普及し始めている。DME に対する新 たな治療アルゴリズムは、今後さらに臨床現場で検討されると考えられる。しかし、現時点では、 局所浮腫に対してはレーザー光凝固術を考慮し、びまん性浮腫に対してはレーザー光凝固術に加 えてステロイドあるいは抗 VEGF 薬の薬物療法を検討し、また、薬物療法でコントロールが困難 な場合、硝子体手術が行われることもある。このような DME に対する治療を含む医療環境に関し て、国内外で特に留意すべき違いはないと考えられる。 2.5.1.6.2.1 民族的要因のまとめ 日本人集団及び外国人集団における民族差を内因性及び外因性要因の側面から検討した。 国内外において、糖尿病網膜症が糖尿病の主要な合併症であることが報告され、人種及び地域 に関係なく高血糖及び高血圧が糖尿病網膜症の危険因子として指摘されている。本剤は、局所投 与(IVT 投与)であることから全身曝露量も極めて低く、薬物動態学的特性からも内因性要因に よる人種差は受けにくいと考えられる。また、DME に対する治療法として国内でも抗 VEGF 薬が 浸透しつつあり、その他の DME の治療法に関しても国内外で留意すべき差はないと考えられる。 したがって、内因性要因及び外因性要因に関して日本人集団と外国人集団の間に特記すべき重要 な違いはないと考えられた。 以上のことから、海外で得られた第Ⅱ相臨床試験(706 試験)までの結果に基づき、日本人患 者における本剤の有効性及び安全性について、DME を有する患者を対象とした国際共同第Ⅲ相臨 床試験(VIVID-DME 試験)に参加することにより検証及び評価が可能であると判断した。 2.5.1.7 規制当局との協議 DME に対する臨床開発計画は、BHC 社及び Regeneron 社により 2004 年から開始した。 米国においては、第Ⅲ相臨床試験(VISTA-DME 及び VIVID-DME 試験)の実施及び解析に関して 20 年に FDA から了承を得た。その後、20 年 月、 ことを了承した。欧州においても、国際共同第Ⅲ相臨床試験(VIVID-DME 試験)の相談を 20 年 月及び 20 年 月に EMA と実施した。その結果、検証的試験を 1 試験実施し有効性の主要評価を 52 週目とすることに加えて、有効性の評価項目や比較対照につ いても EMA から了承を得た。 本邦においては、DME を有する患者を対象とした臨床開発計画について、20 年 月に医薬 品医療機器総合機構との 相談を行い、VIVID-DME 試験の についての助言を得た。
2.5.2 生物薬剤学に関する概括評価
VTE の開発に際しては、2 種類の製剤処方(ITV-1 及び ITV-2)の硝子体内投与用製剤が開発 され、臨床試験に用いられた。DME を有する患者を対象とした第Ⅰ相臨床試験で使用した治験薬 は ITV-1 処方製剤であった。DME を有する患者を対象とした第Ⅱ相臨床試験及び第Ⅲ相臨床試験 で使用した治験薬は、本邦で市販中の「アイリーア硝子体内注射液 40mg/mL」と同一処方(ITV-2 処方)であった。また、網膜中心静脈閉塞症(Central retinal vein occlusion:CRVO)に伴 う黄斑浮腫の効能追加申請時の根拠資料とした第Ⅲ相臨床試験で使用したバイアル製剤及び中心 窩下脈絡膜新生血管を伴う加齢黄斑変性の承認申請時の根拠資料とした滲出型 AMD 患者を対象と した第Ⅱ相臨床試験及び第Ⅲ相臨床試験で使用したバイアル製剤とも同一処方であった。硝子体 内投与用製剤の処方(ITV-1 及び ITV-2)の特性は AMD CTD 3.2.P.2.2 に、処方の相違点の概要 は AMD CTD 2.7.1.1.3 に記載されている。
2.5.3 臨床薬理に関する概括評価
2.5.3.1 背景
滲出型 AMD 及び CRVO に伴う黄斑浮腫に対する VEGF Trap の PK(pharmacokinetics:PK)及び 薬力学(pharmacodynamics:PD)については、AMD CTD 及び CRVO に伴う黄斑浮腫の承認申請書 添付資料(以下、CRVO CTD と記載)にその考察を記載した(AMD CTD 2.7.2 及び CRVO CTD 2.7.2 参照)。滲出型 AMD 及び CRVO に伴う黄斑浮腫の臨床開発において収集されたデータから は、DME を有する患者における VEGF Trap の臨床薬理を理解する上での関連データが得られてい る。
DME を有する患者に IVT 投与後の VEGF Trap の PK 特性を明らかにし、滲出型 AMD 患者及び CRVO に伴う黄斑浮腫を有する患者(以下、CRVO 患者)より得られた結果と比較すること、並び に第Ⅲ相臨床試験の用量設定の根拠となる、IVT 投与の用量と PD 反応の関連を確認することを 目的として、DME を有する患者を対象とした VTE の臨床薬理学的検討を行った。このため、DME を有する患者における IVT 投与時の遊離型及び結合型 VEGF Trap の PK と全身曝露量を検討し、 VEGF Trap の眼に対する PD 作用と全身性の PD 作用について評価した。VEGF Trap の眼に対する PD 作用については、OCT による中心網膜厚(Central retinal thickness:CRT)測定値を用いて 評価した。VEGF Trap の全身性の PD 作用については、血圧をサロゲートマーカーとした。
2.5.3.2 薬物動態
DME を有する患者を対象とした複数の臨床試験において、IVT 投与後の遊離型 VEGF Trap 及び 結合型 VEGF Trap の血漿中濃度を測定し、滲出型 AMD 患者及び CRVO 患者より得られた結果と比 較した(2.7.2.3.1 参照)。DME を有する患者に VTE を IVT 投与後、VEGF Trap は緩やかに体循 環に移行し、体循環血中ではその大部分が安定で活性を有さない VEGF:VEGF Trap 複合体として 存在する。DME を有する患者を対象として頻回採血を行った PK サブスタディ(706.PK 試験)に おいて VTE 2mg(VEGF Trap として 2mg、以下同様)を IVT 投与したとき、血漿中遊離型 VEGF Trap 濃度は投与後 1 日目に最高血漿中濃度(Cmax)に達した。その後、血漿中遊離型 VEGF Trap 濃度は速やかに減少し、投与後 7 日目までに定量下限(lower limit of quantitation:LLOQ) を下回った(2.7.2.2.3.3参照)。DME を有する患者に IVT 投与後にみられた血漿中遊離型 VEGF Trap の平均 Cmax(32ng/mL)は、滲出型 AMD 患者及び CRVO 患者に IVT 投与後にみられた値(それ ぞれ 19ng/mL 及び 49ng/mL)と同様であった(表 2.7.2-4)。十分に低い血漿中濃度である場合
に予想されるように、血漿中遊離型 VEGF Trap 濃度は、用量に比例して増加した。なお、高用量 の VEGF Trap を静脈内投与した過去の臨床試験においては、血漿中遊離型 VEGF Trap が高濃度と なり、非線形 PK が認められている(AMD CTD 2.7.2.3.1 参照)。
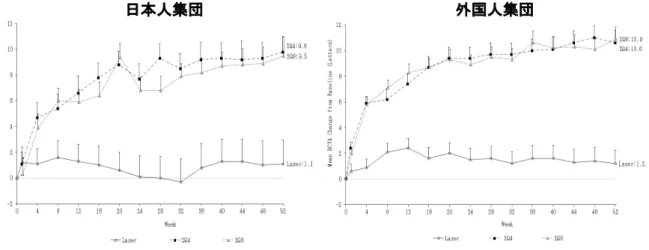
DME を有する患者を対象とした第Ⅲ相臨床試験(VIVID-DME 試験及び VIVID-Japan 試験)の全 被験者における少数時点採血より得られた血漿中遊離型 VEGF Trap 濃度について部分集団解析を 行ったところ、年齢、性別、体格指数(body mass index:BMI)、腎機能(投与前のクレアチニ ンクリアランス値又は透析歴を指標)、肝機能障害の有無(病歴に基づく)、HbA1c 及び地域 (日本と日本以外の国)のいずれの部分集団においても臨床的に重要な変化をもたらすものは認 められなかった(2.7.2.3.1.1参照)。また、VTE 2mg を 4 週ごとに投与又は VTE 2mg を 4 週ご とに 5 回投与し、その後は 8 週ごとに投与の投与レジメンに従って IVT 投与後の遊離型 VEGF Trap の全身曝露量は、いずれの部分集団においても非常に低く、各部分集団間で遊離型 VEGF Trap 濃度が LLOQ を上回った被験者数に大きな偏りはみられなかったことから、高い全身曝露量 を示す可能性のある注目すべき部分集団はないと考えられた。 2.5.3.3 薬力学
OCT により測定された CRT 及び視力の変化は、DME を有する患者の眼における抗 VEGF 療法の効 果を評価する再現性のよい指標であることが知られている85)。このため、第Ⅰ相臨床試験及び第 Ⅱ相臨床試験を通じて DME による網膜浮腫に対する効果を評価するために CRT を測定し、CRT の 測定値は第Ⅱ相臨床試験の有効性の主要評価項目であった視力(2.7.3 参照)と共に第Ⅲ相臨床 試験の用量設定の根拠とした(2.7.2.3.2及び2.7.2.3.3参照)。 VEGF の情報伝達経路を阻害する薬剤を投与した時に観察される収縮期及び拡張期血圧の上昇 は、全身に存在する内因性 VEGF が枯渇することにより引き起こされる。DME を有する患者を対 象とした第Ⅲ相臨床試験で用いた IVT 投与において認められる血漿中遊離型 VEGF Trap 濃度は、 内因性 VEGF との最大結合能の 2 分の 1 の濃度をはるかに下回る低い濃度であり、血圧への影響 はみられないと考えられた86), 87)。DME を有する患者を対象とした第Ⅰ相、第Ⅱ相及び第Ⅲ相臨 床試験では、収縮期及び拡張期血圧の上昇は観察されなかった(2.7.2.3.3.2 及び 2.7.2.3.3.3
参照)。以上のように、滲出型 AMD 患者及び CRVO 患者と同様に、DME を有する患者においても VTE 2Q4 及び 2Q8 の投与レジメンによる血圧への影響はみられないと考えられる。
2.5.3.4 免疫原性
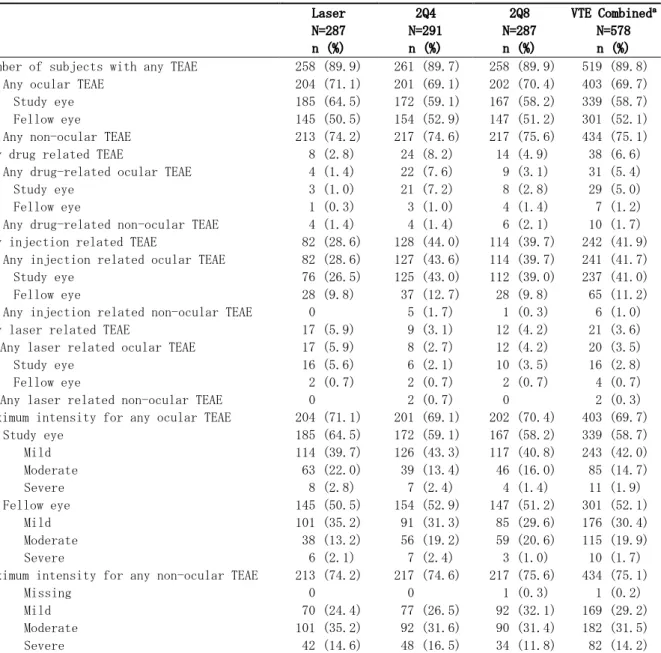
DME を有する患者を対象とした第Ⅲ相臨床試験(VISTA-DME 試験、DME 試験及び VIVID-Japan 試験)において免疫原性を評価するために用いられたブリッジングイムノアッセイ法の感 度は、約 5.4ng/mL である(2.7.2.1.3 参照)。抗薬物抗体(anti-drug antibody:ADA)陽性反 応を示した数検体の抗体価はいずれも低かった。レーザー治療群を含む全治療群において、投与 前の VTE への免疫反応率は約 1~2%であり、試験治療下での ADA 陽性反応の発現率は約 1%であ った(2.7.2.4.1 参照)。ADA 陽性反応が認められた被験者と認められなかった被験者の間に、 安全性の差は認められなかった(2.7.4.4.3.4 参照)。試験治療下での ADA 陽性反応が認められ た 2 例の被験者(2Q4 群 1 例、2Q8 群 1 例)にのみ中和抗体活性が認められた。
これらの結果は、滲出型 AMD 患者集団や CRVO 患者集団で観察された投与前の VTE への免疫反 応率及び 52 週の試験治療下での ADA 陽性反応の発現率(いずれも 1~3%)と同様であった (AMD CTD 2.7.2.3.4 及び CRVO CTD 2.7.2.4.1 参照)。