九州大学学術情報リポジトリ
Kyushu University Institutional Repository
口腔扁平上皮癌細胞由来エクソソームによる癌微小
環境制御機構の解析
森岡, 政彦
http://hdl.handle.net/2324/1931839
出版情報:Kyushu University, 2017, 博士(歯学), 課程博士 バージョン: 権利関係:口腔扁平上皮癌細胞由来エクソソームによる
癌微小環境制御機構の解析
2018 年 3 月九州大学大学院歯学府 歯学専攻
口腔顎顔面病態学講座
顎顔面腫瘍制御学分野
森岡 政彦
福岡大学 薬学部 統合臨床医学講座 免疫・分子治療学分野 研究指導者 中島 学 教授 九州大学大学院 歯学研究院 口腔顎顔面病態学講座 顎顔面腫瘍制御学分野 指導教員 中村 誠司 教授対 象 論 文
本論文の一部は下記の原著論文として発表した。
1) Tomoyo Kawakubo-Yasukochi, Masahiko Morioka, Mai Hazekawa, Atsushi Yasukochi, Takuya Nishinakagawa, Kazuhiko Ono, Shintaro Kawano, Seiji Nakamura, and Manabu Nakashima
miR-200c-3p spreads invasive capacity in human oral squamous cell carcinoma microenvironment
Molecular Carcinogenesis (2018) 57: 295-302.
2) Tomoyo Kawakubo-Yasukochi, Masahiko Morioka, Yoshikazu Hayashi, Takuya Nishinakagawa, Mai Hazekawa, Shintaro Kawano, Seiji Nakamura, and Manabu Nakashima
The SQUU-B cell line spreads its metastatic properties to nonmetastatic clone SQUU-A from the same patient through exosomes
Journal of Oral Biosciences 58 (2016) 33–38
3) Masahiko Morioka, Tomoyo Kawakubo-Yasukochi, Yoshikazu Hayashi, Mai Hazekawa, Takuya Nishinakagawa, Kazuhiko Ono, Shintaro Kawano, Seiji Nakamura, and Manabu Nakashima
Exosomes from oral squamous carcinoma cell lines, SQUU-A and SQUU-B, define the tropism of lymphatic dissemination
目 次
要 旨 1 緒 言 2 第一章 4 材料と方法 5 結 果 13 考 察 32 第二章 35 材料と方法 36 結 果 39 考 察 44 総 括 45 謝 辞 47 参考文献 481
要 旨
口腔扁平上皮癌の浸潤・転移に対する評価は、腫瘍の進展を的確に把握するた めに必須であり、より精度の高い浸潤・転移評価法の開発が望まれている。 また、最近の研究では、癌細胞が分泌するエクソソーム(細胞外小胞の一種)が、 癌における微小環境の構築に重要な役割を果たしていることが明らかとなった。 そこで、本研究では、それぞれ単一クローンからなる同一患者由来の口腔扁平上 皮癌細胞株 SQUU-A(非転移株)と SQUU-B(高転移株)を用いて、これらの細胞が 分泌するエクソソームの浸潤・転移における役割と、その内包物であるマイクロ RNA (micro RNA; miRNA)に着目した解析を行った。第一章では、SQUU-B 由来エクソソームが SQUU-A の浸潤能を誘導することを示 した。さらに、SQUU-A および SQUU-B 由来エクソソームが内包する miRNA と、それ らを添加した SQUU-A における細胞内メッセンジャーRNA(messenger RNA; mRNA)を 網羅的に比較統合解析することで、浸潤規定因子として miR-200c-3p、およびその標 的遺伝子 CHD9 (chromodomain helicase DNA binding protein 9)と WRN(Werner syndrome RecQ like helicase)を同定した。
第二章では、ヒト臍帯静脈内皮細胞 (HUVECs; human umbilical vein endothelial cells)とヒトリンパ管内皮細胞 (HDLECs; human dermal lymphatic endothelial cells) を用いた管腔形成実験を行った結果、SQUU-A および SQUU-B 由来エクソソームが 脈管形成、特にリンパ管新生を促進させた。また、そのメカニズムとして、血管内皮細 胞 増 殖 因 子 VEGFs (vascular endothelial growth factors) と そ の 受 容 体 で あ る
VEGFRs(VEGF receptors)の発現量制御が関わっていることが示唆された。
これらの研究結果により、がん細胞由来エクソソームや miR-200c-3p を用いた口 腔扁平上皮癌の浸潤・転移マーカーの開発、あるいは転移先予測因子探索の可能 性が提示された。
2
緒 言
がんの浸潤・転移は、患者の生命予後を損なう要因であり、その制御機構を明らか にすることは急務である。 近年、がんの浸潤・転移には、がん細胞の特性のみならず、宿主由来の線維芽細 胞、血管・リンパ管内皮細胞、免疫細胞などが構築する多様な微小環境が関与して いることが明らかになった。すなわち、がん進展機構を理解する上では、微小環境を 構成する個々の因子を同定し、それらの分子基盤を解明することが必須となる。 最近の研究では、がん細胞と微小環境を構築する細胞との間に、エクソソームなど の細胞外小胞を介した相互の情報伝達が行われていることが明らかにされた(1,2)。 エクソソームは、直径 30〜100 nm 程度の脂質二重膜構造をもつ細胞外小胞であり、 がん細胞のみならず、すべての細胞から産生・分泌される。エンドソーム由来の小胞 が多数集まり、細胞膜と融合することで細胞外へ放出されることから、発見当初は細 胞の老廃物処理小胞という認識がなされていた(3)。しかし、近年、エクソソーム内部 にタンパク質や脂質、DNA、mRNA、miRNA など多彩な機能性分子が内包されている ことや、放出されたエクソソームが他の細胞に取り込まれることが報告された(4)。こ のことから、エクソソームは機能性分子を脂質二重膜で内包することによって、安定 的に分泌細胞由来の機能性分子を受容細胞に伝達する、細胞間コミュニケーション ツールとして重要視されている。特に、がん細胞由来エクソソームは、周囲のがん細 胞や、微小環境に存在する正常細胞にパラクライン的に働きかけ、エクソソームを取 り込んだ細胞を“教育”することで、がんの進展を促進していることが明らかとなってい る(5-8)。また、細胞外に放出されたエクソソームは血液、尿、唾液などの体液中にも 存在することが明らかとなっていることから(9,10)、エクソソームあるいはエクソソーム 内包分子に着目したがん診断マーカーの探索が多くの研究グループによって行われ ている。 しかしながら、体液中に存在するエクソソーム、あるいはヘテロながん細胞集団か ら回収したエクソソームは、それらが由来する細胞を特定できず、個々の細胞から放 出された質的量的多様性をもつエクソソームの総和を見ているに過ぎない。このこと から、がん進展に関与するエクソソームあるいはエクソソーム内包分子の特定には、 大きな課題が残されている。 本研究では、浸潤・転移性の異なる同一患者の口腔扁平上皮癌由来細胞クローン である SQUU-A と SQUU-B(11)を用いて、これらが分泌するエクソソームの浸潤・転 移における役割について解析を行った。3
まず、第一章では、SQUU-A および SQUU-B の細胞培養上清からエクソソームを 精製し、それぞれの細胞由来のエクソソームが癌細胞の浸潤能に与える影響を解析 した。さらに、SQUU-A と SQUU-B が分泌するエクソソーム内の miRNA に着目した解 析を行った。miRNA は、18 から 25 塩基程度の短鎖一本鎖非コード RNA であり、RNA 誘導サイレンシング複合体(RISC : RNA induced silencing complex)に取り込まれるこ とで、標的 mRNA の 3‘末端非翻訳領域に結合し、標的 mRNA の翻訳抑制を行う (12,13)。ヒトでは、約 60%以上の遺伝子が、このプロセスによって制御を受けているこ とが推測されていることから、miRNA は、がんの病態のみならず、様々な生命現象に おいて重要な役割をはたしている可能性が高い(14)。なお、miRNA は、mRNA の転写 後発現調節を行うことで、その機能を発揮することから、本研究では miRNA と mRNA の比較統合解析を行うことで、SQUU-A と SQUU-B との浸潤能の差異を規定している miRNA とその標的遺伝子を探索した。 さらに、第二章では、SQUU-A および SQUU-B 由来のエクソソームが、転移指向性 に与える影響について、血管内皮細胞とリンパ管内皮細胞を用いた解析を行った。
4
第一章
口腔扁平上皮癌細胞由来エクソソームが
癌の浸潤に与える影響
5
材
料
と
方
法
細胞株 ヒト口腔扁平上皮癌細胞株 SQUU-A と SQUU-B は、当科(口腔顎顔面病態学講座 顎顔面腫瘍制御学分野)で樹立されたものを用いた(11)。ヒト子宮頸癌細胞株 HeLa は、DS ファーマバイオメディカル(大阪)から入手した。細胞培養は、10%ウシ胎児血 清(FCS; Fetal calf serum)(Biowest, Nuaillé, France)を添加した Dulbecco’s modifiedEagle’s medium(DMEM)(ナカライテスク、京都)を用いた。細胞はすべて 5% CO2、
37℃にて培養した。
細胞培養上清の分画
細胞培養上清は、分子量により、30 kDa 以下、30 kDa から 100 kDa、100 kDa 以 上の 3 つの画分に分けた。具体的には、150 mm ディッシュに播種した SQUU-A およ び SQUU-B 細胞が 70%から 80%コンフルエントになった時点で、培地を FCS 不含 DMEM に変更し、24 時間後に細胞培養上清を回収した。その後、遠心により不要な デブリスを除去した細胞培養上清を Amicon Ultra-15 (NMWL 100,000, Merck Millipore, Darmstadt, Germany) を用いて 17.5 倍濃縮し、さらにそのフロースルー画分を Amicon Ultra-15 (NMWL 30,000, Merck Millipore) を用いて分画した。
マトリゲル浸潤アッセイ
ポアサイズ 8 µm の 24 ウェルプレート用セルカルチャーインサート(Transwell insert, Corning, NY) に、冷 DMEM(FCS 不含)で 20 倍希釈したマトリゲル(Matrigel, growth factor reduced, Corning) を 100 µl コーティングし、室温で 2 時間静置した。その後、 余剰なマトリゲル溶液を除去し、FCS 含有 DMEM を用いてマトリゲルを再膨潤させ た。
インサート内に細胞を播種し(5×104
cells/ 500 µl FCS 含有 DMEM / insert)、イン サート下層には 750 µl FCS 含有 DMEM を加え、 21 時間または 48 時間培養した。浸 潤細胞数は、インサートのメンブレンをギムザ染色することで観察し(EVOS Cell Imaging System, Life Technologies, Carlsbad, CA)、評価を行った。
6 ギムザ染色 セルカルチャーインサートのメンブレンを 37℃ PBS で 2 回洗浄した後、メタノール 固定を行った。メンブレンを 0.1% TritonX-100 を含む PBS、続いて PBS にそれぞれ浸 漬し、5 分間静置した。その後、超純水で 20 倍希釈したギムザ染色液(Wako、大阪) を用いて、遮光下で 15 分間、室温にて染色を行った。染色後はメンブレンを水洗し、 綿棒を用いて非浸潤細胞を除去した。 エクソソームの精製
PureExo Exosome Isolation Kit (P100) (Cosmo Bio, 東京)を用いて、濃縮細胞培養 上清の分子量 100 kDa 以上の画分からエクソソームの精製を行った。なお、培養細胞 に添加するエクソソームは、0.45 µm フィルター(Millex-HV, Merck Millipore
)
でろ過したものを用いた。
ウエスタンブロッティング
プロテアーゼ阻害剤カクテル(ナカライテスク)を添加した RIPA Buffer(0.5% NP40、
0.25% sodium deoxycholate、0.5% 10%SDS、150 mM NaCl、5 mM HEPES)を用いて、 細胞抽出液、あるいはエクソソーム抽出液の回収を行った。回収した細胞抽出液は、 4ºC、9000×g にて 30 分間遠心し、その上清を解析サンプルとした。
サンプルは、BCA protein assay (Thermo Fisher Scientific, Wilmington, DE)を用い てタンパク定量後、タンパク量を揃えてアセトン沈殿を行った。濃縮されたサンプルは、 SDS-PAGEサンプルバッファー(pH 6.8, 0.125 M Tris-HCl, 2% SDS, 10% glycerol, 5% 2-mercaptoethnol, 0.02% bromophenol blue)に溶解し、95℃、5分間の熱処理を行っ た。
各 種 サ ン プ ル は 、 sodium dodecyl sulfate-polyacrylamide gel electrophoresis ( SDS-PAGE )ゲルを用い て分離し 、 ポリ フッ化ビニリ デン( PVDF; polyvinylidene difluoride)膜に転写した。ブロッキングには、ブロッキングワン(ナカライテスク)を用い た。一次抗体として、抗CD9抗体(1:1000) (System Biosciences, Mountain Veiw, CA)、 抗 CD81(1:1000) (Biolegend, San Diego, CA) 、 抗 GAPDH 抗 体 (1:40000) (Acris Antibodies, San Diego, CA)、抗CHD9抗体(1:2000) (Proteintech, Rosemont, IL)、抗 ETNK1 (ethanolamine kinase 1)抗体(1:2000) (Abgent, San Diego, CA)、抗WRN抗体 (1:2000) (Abgent) を用い、二次抗体として、HRP標識ヤギ抗マウスIgG、あるいは抗 ウサギIgG (Cell Signaling Technology, Beverly, MA) を用いた。発色試薬には、ECL Plus reagent (Thermo Fisher Scientific)を用い、FlourChemTM 8900 (Alpha Innotech,
7 San Leandro, CA, USA) を用いた。
mRNA の定量 RT-PCR
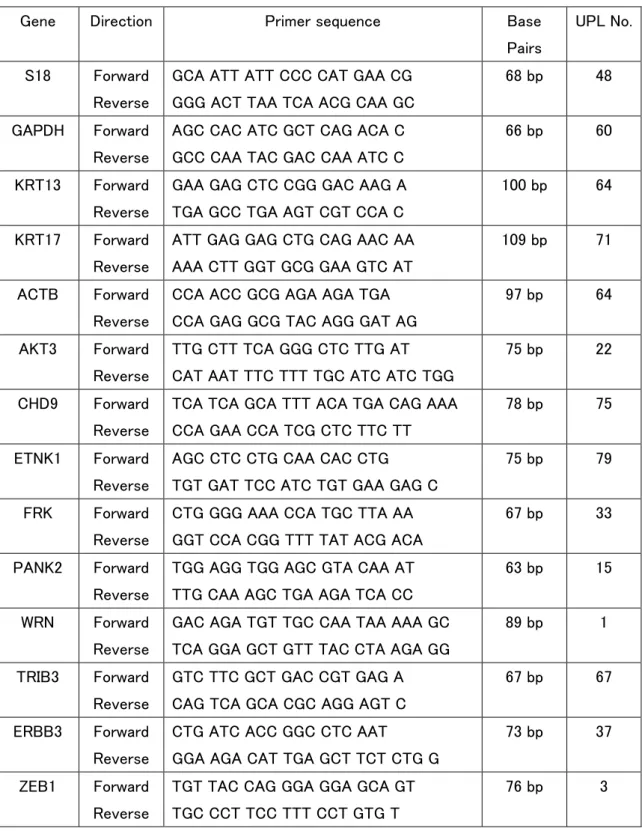
total RNA の精製は、High Pure RNA Isolation Kit (Roche Diagnostics, Mannheim, Germany)、逆転写反応は Verso cDNA Synthesis Kit (Life Technologies) を用いて行 っ た 。 逆 転 写 後 の cDNA の 増 幅 に は LightCycler 480 Probes Master (Roche Diagnostics)を用い、LightCycler 480 system (Roche Diagnostics) にて、95℃、5 分間 の酵素活性化処理後、95℃ 10 秒、60℃ 30 秒、72℃ 1 秒の増幅を 45 サイクル行っ た。TaqMan プローブは、Universal Probe Library (UPL) (Roche Diagnostics) を使用し た。表 1 にプライマーとプローブ、増幅産物の大きさを示す。
miRNA の定量 RT-PCR
miRNAの精製は、High Pure miRNA Isolation Kit (Roche Diagnostics) を用いて行っ た。miRNAのポリアデニル化反応には、E coli Poly(A) polymerase (New England
BioLabs, Ispwich, MA) を用い、オリゴ(dT)アダプターのアニーリングおよびcDNA合
成 に は 、 miRNA EasyScript cDNA synthesis kit (Applied Biological Materials, Richmond, BC, Canada) を用いた。PCR反応には、EvaGreen miRNA qPCR MasterMix (Applied Biological Materials) を用い、LightCycler 480 system (Roche Diagnostics) にて、95℃ 10分間の酵素活性化処理後、95℃ 10秒、63℃ 15秒、72℃ 5秒の増幅 を45サイクル行った。また、PCR増幅産物の反応特異性は、融解曲線で確認した。内
部標準にはSNORD44を用いた。各miRNAに特異的なプライマーは、すべて Applied
Biological Materialsから入手した。
miRNA 発現アレイ
Sepasol-RNA I Super G (ナカライテスク)を用いて、エクソソームから total RNA を精 製し、ND-1000 spectrophotometer (NanoDrop; Thermo Fisher Scientific)、Experion System (Bio Rad, Hercules, CA)で RNA 濃度および純度の確認を行った。total RNA は FlashTagTM Biotin HSR RNA Labeling Kit (Thermo Fisher Scientific)を用いて標識を
行い、Affymetrix GeneChip miRNA 4.0 Array(Affymetrix, Santa Clara, CA)を用いて、 発現アレイ解析を行った。データの解析はセルイノベーター(福岡)に委託した。得ら れた解析結果をもとに、miRNA 発現が 2.0 倍以上増加した遺伝子と 0.5 倍以下に減少 した遺伝子をピックアップした。
8 mRNA 発現アレイ
Sepasol-RNA I Super G (ナカライテスク)、および RNeasy Mini Kit (Qiagen, Hilden, Germany) を用いて、エクソソーム添加 24 時間後の SQUU-A 細胞から total RNA を 精製し、ND-1000 spectrophotometer (NanoDrop; Thermo Fisher Scientific)、Experion
System (Bio Rad) で RNA 濃度および純度の確認を行った。mRNA 発現解析は
Affymetrix Human Transcriptome Array 2.0(Affymetrix)を用いて行い、データの解 析はセルイノベーターに委託した。得られた解析結果をもとに、miRNA 発現が 1.5 倍 以上増加した遺伝子と 0.66 倍以下に減少した遺伝子をピックアップした。
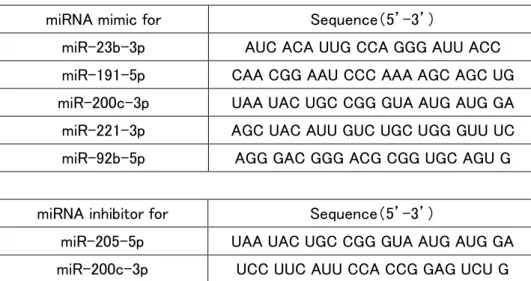
miRNA mimic および miRNA inhibitor の遺伝子導入
12 ウェルプレートに 8×104 cells/ well の細胞を播種し、24 時間後、GeneSilencer
siRNA transfection Reagent (Genlantis, San Diego, CA) を用いて、miR-23b-3p、 miR-191-5p、miR-200c-3p、miR-221-3p、miR-92b-5p の miRNA mimic (Bioneer, Alameda, CA) 、あるいは miR-205-5p、miR-200c-3p に対する miRNA inhibitor を遺 伝子導入した。miRNA mimic と miRNA inhibitor の配列は表 2 に示す。陰性コントロー ルには、miRNA mimic negative control (Bioneer)、あるいは miRNA inhibitor negative control (Bioneer) を用いた。miRNA mimic 遺伝子導入の確認には、導入された細胞 内 miRNA を 24 時間後に定量 RT-PCR で測定することでバリデーションを行った。ま た、miRNA inhibitor 遺伝子導入の確認には、それぞれの標的 miRNA の既知の下流 mRNA 発現レベルを調べることでバリデーションを行った。
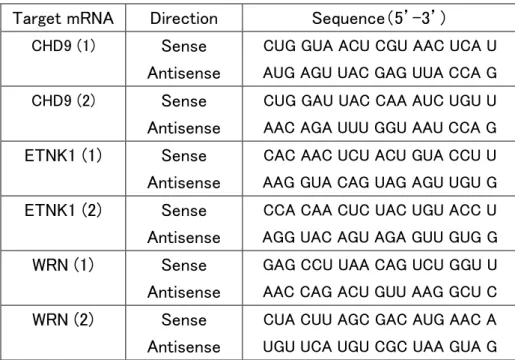
siRNA の遺伝子導入
12 ウェルプレートに 8×104 cells/ well の細胞を播種し、24 時間後、GeneSilencer
siRNA transfection Reagent (Genlantis) を用いて各種 siRNA の遺伝子導入を行った。 各 siRNA の遺伝子配列は表 3 に示す。
cDNA 発現クローンの遺伝子導入
ヒト CHD9、ETNK1、WRN の cDNA を pcDNA3.1-C-(k)DYK に挿入することで各種発
現ベクターを作成した。12 ウェルプレートに 8×104
cells/ well の細胞を播種し、一晩 培養した後に、各プラスミド DNA 0.5 µg を FuGENE HD Transfection Reagent (Promega, Madison, WI)を用いて遺伝子導入した。
9 統計解析
すべてのデータは平均±標準誤差で表した。データの解析には Mann-Whitney U 検
10
表 1 定量 RT-PCR に用いたプライマーとプローブ、および増幅産物の大きさ
Gene Direction Primer sequence Base Pairs
UPL No.
S18 Forward Reverse
GCA ATT ATT CCC CAT GAA CG GGG ACT TAA TCA ACG CAA GC
68 bp 48
GAPDH Forward Reverse
AGC CAC ATC GCT CAG ACA C GCC CAA TAC GAC CAA ATC C
66 bp 60
KRT13 Forward Reverse
GAA GAG CTC CGG GAC AAG A TGA GCC TGA AGT CGT CCA C
100 bp 64
KRT17 Forward Reverse
ATT GAG GAG CTG CAG AAC AA AAA CTT GGT GCG GAA GTC AT
109 bp 71
ACTB Forward Reverse
CCA ACC GCG AGA AGA TGA CCA GAG GCG TAC AGG GAT AG
97 bp 64
AKT3 Forward Reverse
TTG CTT TCA GGG CTC TTG AT CAT AAT TTC TTT TGC ATC ATC TGG
75 bp 22
CHD9 Forward Reverse
TCA TCA GCA TTT ACA TGA CAG AAA CCA GAA CCA TCG CTC TTC TT
78 bp 75
ETNK1 Forward Reverse
AGC CTC CTG CAA CAC CTG TGT GAT TCC ATC TGT GAA GAG C
75 bp 79
FRK Forward Reverse
CTG GGG AAA CCA TGC TTA AA GGT CCA CGG TTT TAT ACG ACA
67 bp 33
PANK2 Forward Reverse
TGG AGG TGG AGC GTA CAA AT TTG CAA AGC TGA AGA TCA CC
63 bp 15
WRN Forward Reverse
GAC AGA TGT TGC CAA TAA AAA GC TCA GGA GCT GTT TAC CTA AGA GG
89 bp 1
TRIB3 Forward Reverse
GTC TTC GCT GAC CGT GAG A CAG TCA GCA CGC AGG AGT C
67 bp 67
ERBB3 Forward Reverse
CTG ATC ACC GGC CTC AAT
GGA AGA CAT TGA GCT TCT CTG G
73 bp 37
ZEB1 Forward Reverse
TGT TAC CAG GGA GGA GCA GT TGC CCT TCC TTT CCT GTG T
11
表 2 miRNA mimic および miRNA inhibitor の配列
miRNA mimic for Sequence(5’-3’)
miR-23b-3p AUC ACA UUG CCA GGG AUU ACC miR-191-5p CAA CGG AAU CCC AAA AGC AGC UG miR-200c-3p UAA UAC UGC CGG GUA AUG AUG GA miR-221-3p AGC UAC AUU GUC UGC UGG GUU UC miR-92b-5p AGG GAC GGG ACG CGG UGC AGU G
miRNA inhibitor for Sequence(5’-3’)
miR-205-5p UAA UAC UGC CGG GUA AUG AUG GA miR-200c-3p UCC UUC AUU CCA CCG GAG UCU G
12
表 3 siRNA の配列
Target mRNA Direction Sequence(5’-3’) CHD9 (1) Sense
Antisense
CUG GUA ACU CGU AAC UCA U AUG AGU UAC GAG UUA CCA G CHD9 (2) Sense
Antisense
CUG GAU UAC CAA AUC UGU U AAC AGA UUU GGU AAU CCA G ETNK1 (1) Sense
Antisense
CAC AAC UCU ACU GUA CCU U AAG GUA CAG UAG AGU UGU G ETNK1 (2) Sense
Antisense
CCA CAA CUC UAC UGU ACC U AGG UAC AGU AGA GUU GUG G
WRN (1) Sense
Antisense
GAG CCU UAA CAG UCU GGU U AAC CAG ACU GUU AAG GCU C
WRN (2) Sense
Antisense
CUA CUU AGC GAC AUG AAC A UGU UCA UGU CGC UAA GUA G
13
結 果
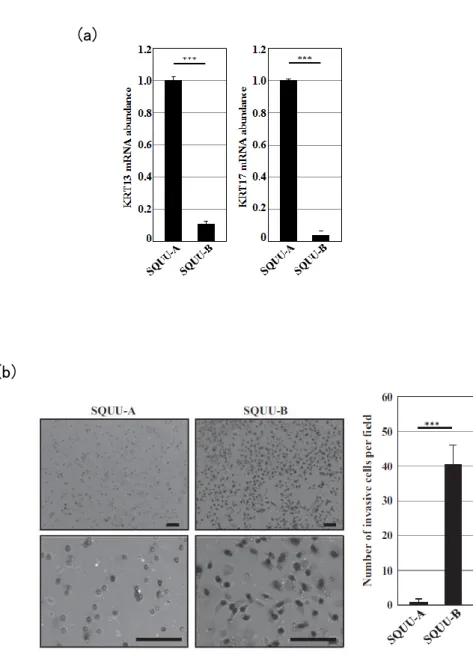
(1) In vitro における SQUU-A および SQUU-B の浸潤能の解析
同一患者由来口腔扁平上皮癌細胞株である SQUU-A(低転移株)と SQUU-B(高 転移株)は、ヌードマウスにおける所属リンパ節への転移性が異なる細胞株として報 告されている (11)。また、これらの細胞間では、サイトケラチンの発現パターンが異な り、このことが転移能を規定している可能性が報告されていたため(11)、まず両細胞 におけるサイトケラチン 13(KRT13)とサイトケラチン 17(KRT17)の mRNA 発現量を定 量 RT-PCR で解析した。 その結果、SQUU-A におけるKRT13 発現量は SQUU-B の約 10 倍、KRT17 発現 量は約 20 倍であり(図 1a)、過去の報告における傾向と一致した。 次に、マトリゲル浸潤アッセイを行い、細胞播種から 21 時間後における SQUU-A と SQUU-B の浸潤能を解析した。その結果、SQUU-A はほとんど浸潤しなかったのに 対して、SQUU-B では多数の浸潤細胞を認めた(図 1b)。 そこで、これらの浸潤能の相違を規定している因子が SQUU-A あるいは SQUU-B の細胞培養上清中に存在する可能性を検討するため、両細胞から細胞培養上清を 回収して濃縮を行い、最終濃縮倍率が 17.5 倍となるようにそれぞれの細胞に添加し、 マトリゲル浸潤アッセイを行った。 その結果、SQUU-A 由来細胞培養上清(supA)は、いずれの細胞の浸潤能にもほ とんど影響を及ぼさなかった。一方、SQUU-B 由来細胞培養上清(supB)添加によっ て、SQUU-B の浸潤細胞数には変化はなかったが、単独では浸潤能を示さなかった SQUU-A が浸潤能を獲得した(図 2)。 上記の結果から、SQUU-B が分泌する可溶性成分の中に、浸潤誘導因子が含ま れていると考えられた。そこで、細胞培養上清を分子量 30 kDa 以下、30 kDa から 100 kDa、100 kDa 以上の 3 つの画分に分け、どの画分に浸潤誘導因子が含まれてい るのかをマトリゲル浸潤アッセイを用いて検討を行った。
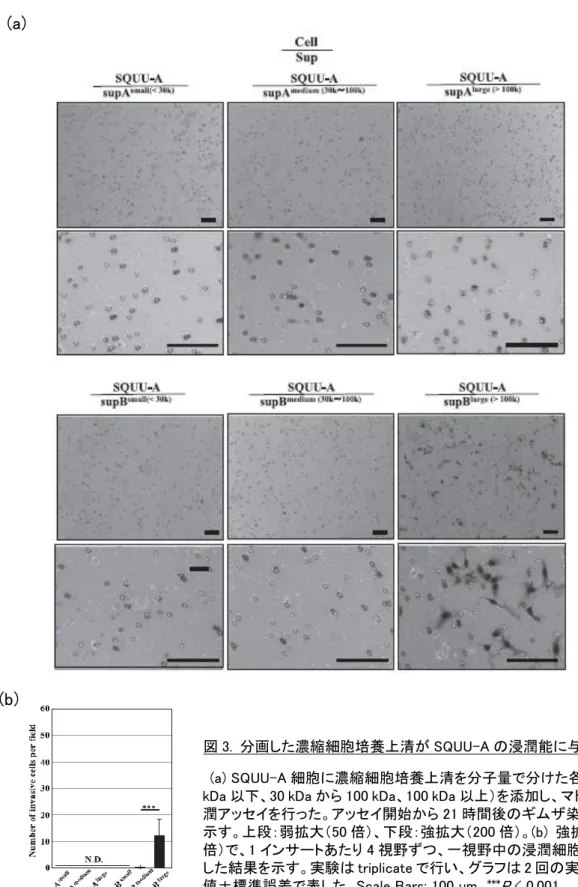
その結果、SQUU-A は、supB の分子量 100 kDa 以上の画分によって、浸潤が誘導 された。なお、supA はいずれの画分も SQUU-A の浸潤能に影響を及ぼさなかった (図 3)。
14
図 1. SQUU-A, SQUU-B の細胞の特徴
(a) SQUU-A と SQUU-B におけるKRT13、KRT17の定量 RT-PCR 発現解析。 内部標準にはGAPDHを用いた。(b) マトリゲル浸潤アッセイ 21 時間後のギム ザ染色。上段:弱拡大(50 倍)、下段:強拡大(200 倍)。強拡大(200 倍)で、1 イ ンサートあたり 4 視野ずつ、一視野中の浸潤細胞数を計測した結果を右に示す。 実験は triplicate で行い、グラフは 3 回の実験の平均値±標準誤差で表した。 Scale Bars: 100 µm。***P < 0.001。 (b) (a)
15 図 2. 濃縮細胞培養上清添加時のマトリゲル浸潤アッセイ それぞれの細胞に 17.5 倍濃縮した SQUU-A 細胞培養上清(supA)、あるい は SQUU-B 細胞培養上清(supB)を添加し、マトリゲル浸潤アッセイを行っ た。アッセイ開始から 21 時間後のギムザ染色結果を示す。上段:弱拡大(50 倍)、下段:強拡大(200 倍)。強拡大(200 倍)で、1 インサートあたり 4 視野ず つ、一視野中の浸潤細胞数を計測した結果を右下に示す。実験は triplicate で行い、グラフは 2 回の実験の平均値±標準誤差で表した。Scale Bars: 100 µm。***P < 0.001。
16
図 3. 分画した濃縮細胞培養上清が SQUU-A の浸潤能に与える影響 (a) SQUU-A 細胞に濃縮細胞培養上清を分子量で分けた各画分(30 kDa 以下、30 kDa から 100 kDa、100 kDa 以上)を添加し、マトリゲル浸 潤アッセイを行った。アッセイ開始から 21 時間後のギムザ染色結果を 示す。上段:弱拡大(50 倍)、下段:強拡大(200 倍)。(b) 強拡大(200 倍)で、1 インサートあたり 4 視野ずつ、一視野中の浸潤細胞数を計測 した結果を示す。実験は triplicate で行い、グラフは 2 回の実験の平均 値±標準誤差で表した。Scale Bars: 100 µm。***P < 0.001。 (a) (b)
17 (2) SQUU-B 由来エクソソームが浸潤能に及ぼす影響 前述の結果から、SQUU-B 細胞培養上清中に含まれている分子量 100 kDa 以上の 分子、あるいは分子量 100 kDa 以上に相当する粒径の大きさを持つ何らかの細胞外 分泌小胞によって、SQUU-A が浸潤能を獲得したと考察された。 そこで、まず、細胞外小胞のひとつであるエクソソームに着目した。 SQUU-A と SQUU-B の濃縮細胞培養上清からエクソソームを精製し(以後、それぞ れ exoA、exoB と記す)、エクソソームの特異的マーカーである CD9 と CD81 の発現を 確認した(図 4)。
続いて、exoA および exoB が SQUU-A の浸潤能に与える影響について、マトリゲル 浸潤アッセイを用いて検討した。 その結果、SQUU-A に exoB を添加することで、浸潤細胞数が有意に増加した。ま た、exoA は SQUU-A の浸潤能に変化を及ぼさなかった(図 4b)。 また、エクソソーム添加後の SQUU-A におけるKRT13 および KRT17 の mRNA 発 現量を定量 RT-PCR で評価したところ、exoB 添加時には対照群に比べて約 20%の KRT13 発現低下が認められた(図 4c)。また、KRT17 の発現量は、exoA や exoB 添加 による影響は認められなかった(図 4c)。 以上のことから、SQUU-B 由来の細胞培養上清中に存在している浸潤誘導因子は エクソソームであることが示された。
18 図 4. エクソソームによる浸潤能の変化 (a)精製したエクソソーム(exoA、exoB)における CD9 と CD81 の発現確認(ウエスタンブ ロッティング)。(b) SQUU-A に exoA、exoB を添加してマトリゲル浸潤アッセイ 21 時間後 のギムザ染色結果。上段:弱拡大(50 倍)、下段:強拡大(200 倍)。強拡大(200 倍)で、1 インサートあたり 4 視野ずつ、一視野中の浸潤細胞数を計測した結果を右に示す。実験 は triplicate で行い、グラフは 2 回の実験の平均値±標準誤差で表した。Scale Bars: 100 µm。***P < 0.001。(c) エクソソーム添加 21 時間後の SQUU-A におけるKRT13、KRT17
mRNA の発現解析。内部標準にはGAPDHを用いた。**P < 0.01。
(b)
(c) (a)
19
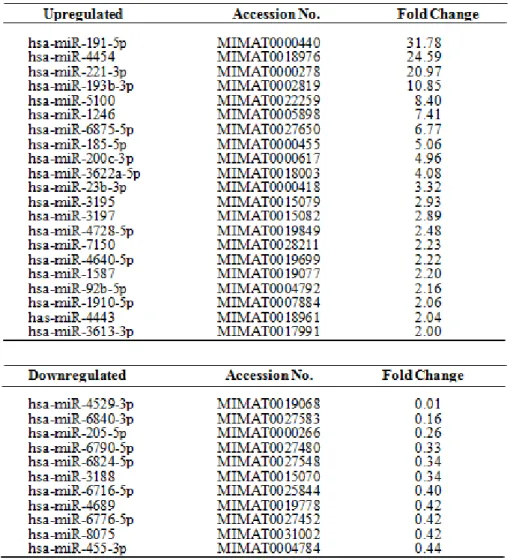
(3) SQUU-A および SQUU-B 由来エクソソームに内在する miRNA の発現比較解析 前述の結果から、何らかの浸潤誘導因子が exoB に存在することが示唆された。 そこで、当該浸潤規定因子を同定するために、まず miRNA に着目し、exoA と exoB に内包されている miRNA について、miRNA array による網羅的発現解析を行った。
exoA に比べて、exoB で発現量が 2 倍以上増加していた miRNA(21 個)、0.5 倍以 下に減少していた miRNA(11 個)を表 4 に示す。
20
表 4. miRNA array 解析(Affymetrix GeneChip miRNA 4.0 Array)
exoA に対して exoB で発現が 2 倍以上増加(上段)あるいは 0.5 倍以上減少(下段)していた miRNA を示す。
21
(4) エクソソーム添加後の SQUU-A における mRNA の発現比較解析
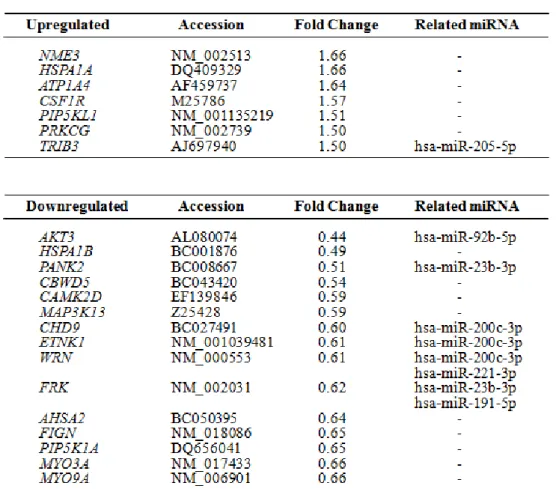
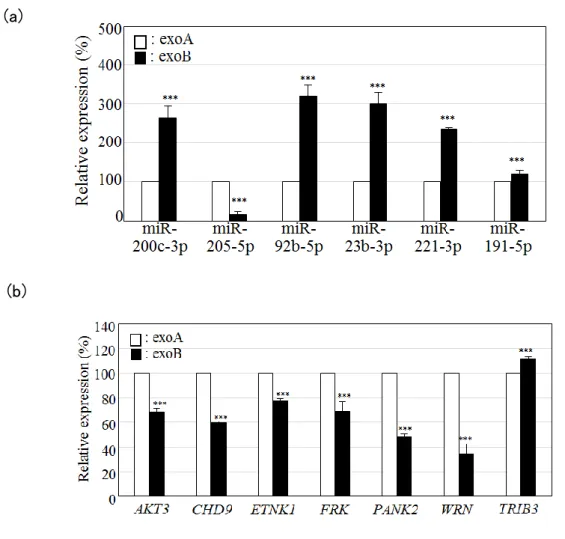
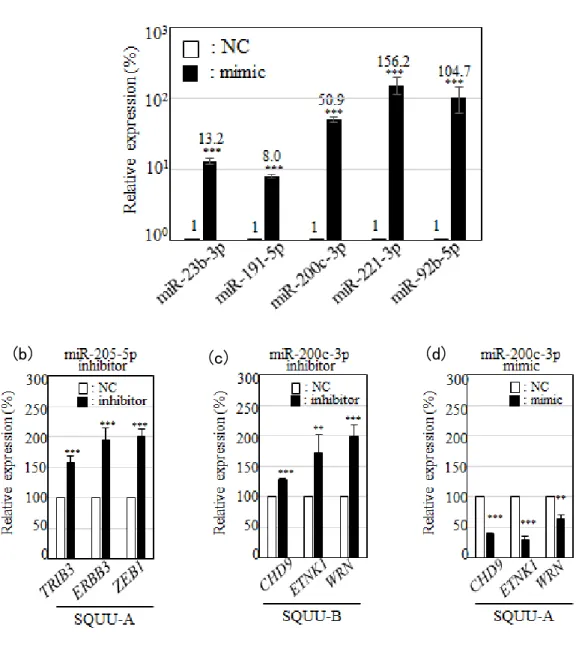
miRNA は、mRNA の 3’末端非翻訳領域に配列相補的に結合することによりその遺 伝子の発現を調節し、機能発現することから、続いて、SQUU-A に exoA あるいは exoB を添加し、24 時間後の SQUU-A における mRNA 発現比較解析を行った。 exoA 添加後の SQUU-A に比べ、exoB 添加後の SQUU-A で発現量が 1.5 倍以上 増加していた mRNA(7 個)、0.66 倍以下に減少していた mRNA(15 個)を(表 5)に示す。 さらに、これらの mRNA に対して配列相補的に結合することが予測される miRNA のう ち、(表 4)に含まれる miRNA をデータベースより抽出し、統合解析を行った(表 5)。 続いて、上記の統合解析結果を確認するため、まず、抽出した 6 個の miRNA (miR-200c-3p、miR-205-5p、miR-92b-5p、miR-23b-3p、miR-221-3p、miR-191-5p) について、定量 RT-PCR にて、exoA と exoB における発現量を確認した。その結果、 すべての miRNA について、倍率はそれぞれ異なるものの、miRNA array の結果と同じ 相関関係が認められ、有意な量的差異が得られた(図 5a)。
さ ら に 、 そ れ ら 6 個 の miRNA の 標 的 遺 伝 子 と 推 定 さ れ る AKT3 (AKT serine/threonine kinase 3 )、CHD9、ETNK1、FRK (fyn related Src family tyrosine kinase)、PANK2 (pantothenate kinase 2)、WRN、TRIB3 (tribbles pseudokinase 3) につ いて、exoA 添加後と exoB 添加後の SQUU-A における発現量の比較を行った。その 結果、すべての遺伝子について、DNA microarray での結果と同じ相関が認められ、 有意な量的差異が得られた(図 5b)。
22
表 5. DNA microarray 解析(Affymetrix Human Transciptome Array 2.0)
exoA 添加 24 時間後の SQUU-A に対して、exoB 添加 24 時間後の SQUU-A で発現が 1.5 倍以上 増加(上段)あるいは 0.66 倍以上減少(下段)していた mRNA、および、それぞれと配列相補的に結合 することが予測される miRNA のうち(表 4)に含まれる miRNA を抽出した結果を示す。miRNA と対応す る mRNA との結合予測検索には miRTarBase (15), microcosm (16), TargetScan (17, 18)を使用した。
23
図 5. miRNA-mRNA 統合比較解析のバリデーション
(a) 細胞培養上清から精製した エクソソームに含 まれる 各 miRNA の発現量を 定量 RT-PCR で解析した。内部標準には SNORD44 を用いた。***P < 0.001。(b) exoA または
exoB を添加して 24 時間後の SQUU-A における各 mRNA の発現量を定量 RT-PCR で解 析した。内部標準にはS18 を用いた。実験は duplicate で行い、グラフは 3 回の実験の平 均値±標準誤差で表した。***P < 0.001。
(a)
24
(5) miRNA mimic あるいは miRNA inhibitor が浸潤能に及ぼす影響
次に、前述の miRNA-mRNA 統合解析の結果から絞られた 6 個の miRNA に着目し、 各 miRNA の mimic(合成 2 本鎖オリゴ)あるいは inhibitor を SQUU-A または SQUU-B に導入し、それらのターゲット遺伝子の制御が細胞浸潤能に及ぼす影響を検討した。 はじめに、miRNA mimic あるいは miRNA inhibitor の 24 時間後の遺伝子導入効率 を(図 6)に示す。いずれの miRNA mimic も導入されていることが確認できた(図 6a)。
さらに、miR-205-5p inhibitor の遺伝子導入により、既知の標的遺伝子であるTRIB3、
ERBB3、ZEB1 (zinc finger E-box binding homeobox 1)(19)の mRNA 発現量が増加す ることが確認された(図 6b)。
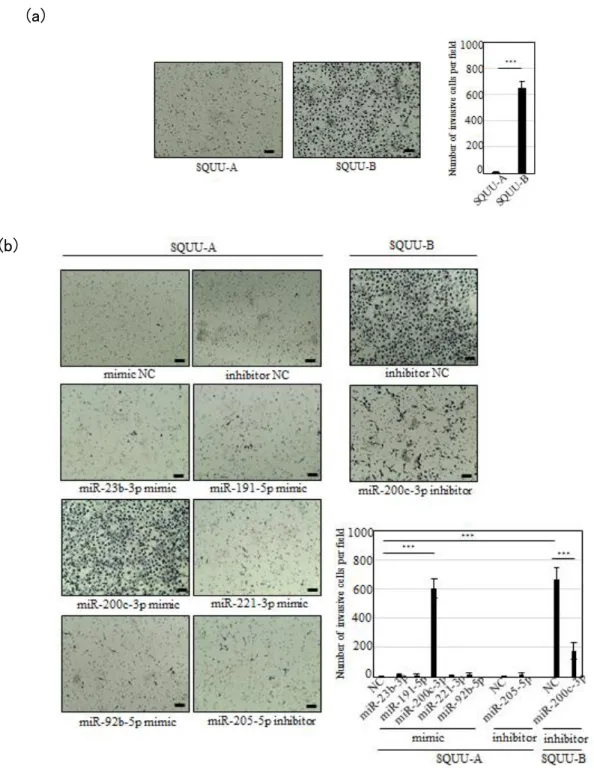
マトリゲル浸潤アッセイは、miRNA mimic あるいは miRNA inhibitor の標的 mRNA への作用、および翻訳過程の時間を考慮し、48 時間後の評価を行った。なお、48 時 間経過後のマトリゲル浸潤アッセイにおいても、SQUU-A はほとんど浸潤しなかった が、SQUU-B では非常に多くの浸潤細胞が認められた(図 7a)。
SQUU-A に、miR-23b-3p、miR-191-5p、miR-200c-3p、miR-221-3p、miR-92b-5p の各 miRNA mimic、あるいは miR-205-5p に対する miRNA inhibitor を遺伝子導入し、 48 時間後のマトリゲル浸潤アッセイの結果を観察した。その結果、miR-200c-3p mimic を遺伝子導入した SQUU-A においてのみ、顕著な浸潤能の亢進が観察された (図 7b)。
そこで、SQUU-B に対し、miR-200c-3p inhibitor を遺伝子導入し、同様に浸潤能を 観 察 し た 。 な お 、 miR-200c-3p inhibitor の 遺 伝 子 導 入 の バ リ デ ー シ ョ ン に は 、
miR-200c-3p mimic により mRNA 発現が抑制された標的遺伝子であるCHD9、ETNK1、
WRN (図 6d)の mRNA 発現が亢進することを確認した(図 6c)。マトリゲル浸潤アッセ イの結果、miR-200c-3p の機能を抑えることで、SQUU-B の浸潤能が顕著に抑制さ れた(図 7b)。
以上の結果から、SQUU-A と SQUU-B との浸潤能の相違には、miR-200c-3p の発 現量の違いが関与している可能性が示唆された。
25
図 6. miRNA mimic および miRNA inhibitor 遺伝子導入の確認 (a) SQUU-A に miRNA mimic を遺伝子導入した 24 時間後の miRNA 発現量を定 量 RT-PCR で解析した。内部標準には SNORD44 を用いた。(b)(c)SQUU-A ある いは SQUU-B に対して、miR-205-5p inhibitor あるいは miR-200c-3p inhibitor を それぞれ遺伝子導入した 24 時間後、それぞれ miRNA の標的遺伝子の発現量を 定量 RT—PCR で解析した。miR-205-5p の標的遺伝子として、TRIB3、ERB3、ZEB1、 また、miR-200c-3p の標的遺伝子として、CHD9、ETNK1、WRNの発現量を解析し た。(d)SQUU-A に miR-200c-3p mimic を遺伝子導入した 24 時間後の CHD9、
ETNK1、WRNの発現量を定量 RT—PCR で解析した。(b)(c)(d)の解析では、内部標
準に S18 を用いた。実験は triplicate で行い、グラフは 3 回の実験の平均値±標 準誤差で表した。 **P < 0.05, ***P < 0.001。
(a)
26
図 7. miRNA 発現量の変化による浸潤能への影響
(a)マトリゲル浸潤アッセイ 48 時間後のギムザ染色。1 インサートあたり 4 視野 ずつ、一視野中の浸潤細胞数を計測した結果を右に示す。(b)miRNA mimic あ るいは miRNA inhibitor を遺伝子導入した SQUU-A または SQUU-B について、 マトリゲル浸潤アッセイを行い、48 時間後のギムザ染色結果を示す。1 インサ ートあたり 4 視野ずつ、一視野中の浸潤細胞数を計測した結果を右下に示す。 実験は triplicate で行い、グラフは 3 回の実験の平均値±標準誤差で表した。 Scale bars: 100 µm。***P < 0.001。 (a) ) (b)
27
(6) miR-200c-3p 標的遺伝子の発現レベルが SQUU-A の浸潤能に及ぼす影響 続いて、miR-200c-3p による SQUU-A と SQUU-B との浸潤能の相違に、当該 miRNA の標的 mRNA、特に、miRNA-mRNA 統合解析結果で抽出された遺伝子である CHD9、ETNK1、WRN の発現量制御が関与しているか否か、検討を行った。 まず、SQUU-A において、CHD9、ETNK1、WRN の発現量が浸潤能に与える影響を 検討した。各遺伝子に対する siRNA を SQUU-A に遺伝子導入して 24 時間後の mRNA レベル(図 8a)および 48 時間後の蛋白レベル(図 8b)での発現量を定量 RT-PCR およびウエスタンブロッティングを用いて確認した。 マトリゲル浸潤アッセイの結果、CHD9、WRN の発現量を抑制することにより、 SQUU-A の浸潤細胞数が、コントロールに比べて有意に増加した。また、ETNK1 の発 現量抑制は、SQUU-A の浸潤能に影響を及ぼさなかった(図9)。
28
図 8. siRNA 導入後の各標的分子の mRNA および蛋白質の発現量(SQUU-A) (a)CHD9、ETNK1、WRNに対する siRNA をそれぞれ 2 種類ずつ遺伝子導入し て、24 時間後の標的分子の mRNA 発現量を定量 RT-PCR で確認した。内部標 準にはGAPDHを用いた。(b) siRNA 導入後 48 時間後の標的分子の蛋白発現 量をウエスタンブロッティングで確認した。内部標準には GAPDH を用いた。実 験は duplicate で行い、グラフは 3 回の実験の平均値±標準誤差で表した。*P < 0.05、***P < 0.001。 (a) (b)
29
図 9. siRNA 導入後のマトリゲル浸潤アッセイ(SQUU-A)
CHD9、ETNK1、WRNに対する各 siRNA を導入した SQUU-A のマトリゲル浸潤アッセ
イの結果(48 時間後)。1 インサートあたり 4 視野ずつ、一視野中の浸潤細胞数を計測 した結果を下に示す。実験は triplicate で行い、グラフは 3 回の実験の平均値±標準 誤差で表した。Scale bars: 100 µm。***P < 0.001。
30 (7) miR-200c-3p 標的遺伝子の発現レベルが SQUU-B の浸潤能に及ぼす影響 次に、SQUU-B に、CHD9、ETNK1、WRN を過剰発現させ、浸潤能の観察を行った。 遺伝子導入の効率はウエスタンブロッティングで確認した(図 10a)。 マトリゲル浸潤アッセイの結果、CHD9、WRN の過剰発現により、SQUU-B の浸潤 細胞数は、コントロールに比べて有意に減少した。また、ETNK1 の過剰発現は、 SQUU-B の浸潤細胞数に変化を及ぼさなかった(図 10b)。 以上の結果から、SQUU-A と SQUU-B の浸潤能の違いには、両細胞における miR-200c-3p の発現量が関わっている可能性が考えられた。また、miR-200c-3p に よる浸潤能制御機構には、当該 miRNA の標的遺伝子であるCHD9 と WRN が関与し ていることが示唆された。
31
図 10. CHD9、ETNK1、WRNを過剰発現させた SQUU-B におけるマトリゲル浸潤アッセイ (a) CHD9、ETNK1、WRN の各 cDNA 発現クローンの遺伝子導入後、各蛋白 質の発現をウエスタンブロッティングで解析した。内部標準は GAPDH を用いた。 (b)マトリゲル浸潤アッセイ 48 時間後のギムザ染色。1 インサートあたり 4 視野 ずつ、一視野中の浸潤細胞数を計測した結果を下に示す。実験は triplicate で 行い、グラフは 3 回の実験の平均値±標準誤差で表した。Scale bars: 100 µm。 *P < 0.05、***P < 0.001。 (a) (b)
32
考 察
本章では、同一患者由来のヒト口腔扁平上皮癌細胞株 SQUU-A と SQUU-B には、 in vitro において浸潤能の相違があり、浸潤規定因子は SQUU-B が分泌するエクソソ ームに含まれていることを示した。すなわち、単一癌巣内のそれぞれの癌細胞が 各々の個性をもつエクソソームを分泌しており、それらを介した複雑な細胞間クロスト ークによって浸潤性が規定されている可能性を提示した。 以前の報告では、SQUU-A と SQUU-B との浸潤・転移性の違いには、サイトケラチ ンの発現パターンの違いが関与している可能性が示されていた(11)。本研究では、 SQUU-A は exoB 添加によって浸潤能が亢進したが、その際、SQUU-A における KRT13 の発現量が対照群に比べて減少する傾向が観察された。また、DNA micro array の結果においても、KRT13 の発現は 0.66 倍未満ではあるもののわずかに減少 傾向を示していた。これらの結果から、in vitro で行った今回の実験では、exoB 添加 による SQUU-A の浸潤能亢進にサイトケラチンの発現パターンの変動が直接関与し ていたかどうかは不明であるが、実際の微小環境(in vivo)下では、一部のサイトケラ チンの発現量制御が、エクソソームを介して二次的に引き起こされている可能性が考 えられた。 さらに、本章では、エクソソームに内包されている miRNA と、エクソソームを添加した 細胞の mRNA を網羅的かつ統合的に解析することで、口腔扁平上皮癌の浸潤能を 規定する miRNA とその標的 mRNA を探索した。その結果、SQUU-A の浸潤能亢進に関与する miRNA として miR-200c-3p、さらに、その標的 mRNA としてCHD9 と WRN を
同定した。
なお、今回の網羅的解析のバリデーションには、miRNA mimic、miRNA inhibitor を 用いたが、これは標的 miRNA を過剰発現、あるいは強制的に抑制した場合にみられ る現象を捉えている。しかしながら、実際のエクソソーム添加実験によって生じた変化 はエクソソームに内包される複数の miRNA がそれぞれの標的 mRNA を各々の変動 幅で変化させる現象である。
このことを考慮すると、miR-200c-3p が必ずしも exoB が内包する SQUU-A 浸潤誘 導因子であったとは限らないが、今回エクソソーム内包 miRNA の解析をキッカケとし て、miR-200c-3p を口腔扁平上皮癌の浸潤能制御を担う候補分子として同定した。
がんの進展における miR-200c の存在意義については、現在までに数多くの報告 がなされているが、miR-200c の善玉としての役割を報告するものも多い。例えば、口
33
腔癌のみならず、肝癌、大腸癌、胃癌などでは、miR-200c が ZEB1 や ZEB2 (zinc
finger E-box binding homeobox 2) などの上皮間葉転換(EMT; Epithelial Mesenchymal Transition)の制御因子の発現抑制を行うことで、浸潤・転移を制御し、がんの進展を 抑制することが報告されている(20-24)。
一方、健常血清と比較して、がん患者血清中に含まれる miR-200c の発現が増加
していることや(25,26)、miR-200c がその標的遺伝子である TKS5 (SH3 and PX
domains 2A ) と MYLK (myosin light chain kinase) の発現制御を介して、転移能を 亢進させていることも報告されている(27)。 なお、今回の miRNA-mRNA 統合解析の結果では、過去に miR-200c 下流のがん 進展制御因子として報告があった上述の遺伝子(ZEB1、ZEB2、TKS5、MYLK)の発現 に変動はなかった。 が ん の 病 態 解 析 に お い て 、 こ の よ う な 特 定 の miRNA の 相 反 す る 作 用 は 、 miR-200c-3p についてのみならず、他の miRNA についてもしばしば報告されている が、これは、多くの解析対象となる検体が、がん組織などのヘテロな細胞集団である ことに起因していると考えられる。 前述のように、本研究では口腔扁平上皮癌細胞の 2 つの異なるクローンを用いた 解析により、癌の微小環境下において、各々の癌細胞クローンがそれぞれの個性を もったエクソソームを分泌しており、それに内包される miRNA 量もクローンごとに異な ることを証明した。すなわち、ヘテロな細胞集団における miRNA の量的変動は、生存 するすべての細胞が産生する miRNA の足し算の結果であることを意味することから、 がんの病態や予後予測因子検索には適切なツールといえるものの、特定の miRNA の機能解析としては、本質的な作用がマスクされてしまう可能性が高い。
さらに、miR-200c-3p の標的遺伝子のうち、SQUU-A と SQUU-B の浸潤能制御に 関わる遺伝子として、CHD9 と WRN を同定した。
CHD9 は、RUNX2 (runt related transcription factor 2 )、BGN (biglycan)、BGLAP (bone gamma-carboxyglutamate protein )、MYH6 (myosin heavy chain 6 )などの遺伝 子における骨格組織特異的プロモーターと結合する ATP 依存性クロマチンリモデリン グ酵素である(28)。がんの病態における CHD9 の関わりはほとんど報告されていな いが、神経芽細胞腫において、CHD9 の不活化が骨転移を促進することが報告され ている(29)。 また、WRN は、RecQ4 ヘリカーゼの一つであり、ゲノム安定性の維持に寄与し(30)、 その発現減少は発がんの直接的な原因となることが報告されている(31)。さらに、
34
WRN の機能欠失は、早期老化、ゲノム不安定、若年性癌の発症を特徴とするウェル ナー症候群発症の原因となることが知られている(32)。
これらの miR-200c-3p 標的遺伝子が直接的に SQUU-A や SQUU-B の浸潤能制 御に寄与している可能性については今後の詳細な解析が必要であるが、本研究結 果から、miR-200c-3p が口腔扁平上皮癌細胞の浸潤促進因子であること、また、 CHD9 と WRN は、浸潤抑制因子であることが示唆された。
35
第二章
口腔扁平上皮癌細胞由来エクソソームが
転移指向性に及ぼす影響
36
材
料
と
方
法
細胞培養
ヒト臍帯静脈内皮細胞(HUVECs)とヒトリンパ管内皮細胞(HDLECs)はPromo Cell (Heidelberg, Germany) から入手した。HDLECsとHUVECsの培養は、Endothelial cell growth medium MV2 kits (Promo Cell) を用いた。細胞はすべて5% CO2、37℃にて培
養した。
管腔形成実験
96 ウェルプレート底面に 50 µl マトリゲル (Matrigel, Growth factor reduced, BD Biosciences, San Jose, CA) をコーティングし、37℃で 30 分間静置して硬化させた。そ の後、1.5×104 cells/ well の HUVECs または HDLECs を播種し、培養を行った。18
時間後に管腔形成の状態を観察し(EVOS Cell Imaging System, Life Technologies)、 一視野中の管腔分岐点の数を計測した。
ウエスタンブロッティング
プロテアーゼ阻害剤カクテル(ナカライテスク)を添加した RIPA Buffer を用いて、細 胞抽出液の回収を行った。4ºC、9000×g にて 30 分間遠心し、その上清を解析サンプ ルとした。
サンプルは、BCA protein assay (Thermo Fisher Scientific) を用いてタンパク定量 後、タンパク量を揃えてアセトン沈殿を行った。濃縮されたサンプルは、SDS-PAGEサ ンプルバッファーに溶解し、95℃、5分間の熱処理を行った。
各種サンプルは、SDS-PAGEゲルを用いて分離し、PVDF膜に転写した。ブロッキン グには、ブロッキングワン(ナカライテスク)を用いた。一次抗体として、抗VEGFR1抗 体 (1:3000) (Cell Signaling Technology)、抗VEGFR2抗体 (1:3000) (Cell Signaling Technology)、抗VEGFR3抗体(1:1000)(Abcam)、抗VEGF-A抗体 (1:3000)(Abcam)、 抗VEGF-C抗体 (1:1000)(Cell Signaling Technology)、抗VE-cadherin抗体(1:3000) (Cell Signaling Technology)、抗podoplanin抗体 (1:1000) (Biolegend)、抗GAPDH抗体 (1:40000)(Acris Antibodies) を用い、二次抗体として、HRP標識ヤギ抗マウスIgG、あ るいは抗ウサギIgG(Cell Signaling Technology)を用いた。発色試薬には、ECL Plus reagent (Thermo Fisher Scientific) を用い、FlourChemTM 8900 (Alpha Innotech)にて 検出を行った。
37
total RNA の精製は High Pure RNA Isolation Kit (Roche Diagnostics)、逆転写反応 は Verso cDNA Synthesis Kit (Life Technologies)を用いて行った。逆転写後の cDNA の増幅には LightCycler 480 Probes Master (Roche Diagnostics)を用い、LightCycler 480 system (Roche Diagnostics) にて、95℃ 5 分間の酵素活性化処理後、95℃ 10 秒、60℃ 30 秒、72℃ 1 秒の増幅を 45 サイクル行った。TaqMan プローブは、 Universal Probe Library (UPL) (Roche Diagnostics) を使用した。表 6 にプライマーと プローブ、増幅産物の大きさを示す。
細胞増殖試験
細胞増殖能の評価は、WST-8 Cell Count Reagent SF (ナカライテスク)を用いて行 った。96 ウェルプレート上に 1.5×104 cells/ 100 µl MV2 medium/ well の HUVECs ま
たは HDLECs を播種し、エクソソーム存在下で 18 時間培養した後、WST-8 Cell Count
Reagent SF を 10 µl/ well 添加した。1 時間の呈色反応後、マイクロプレートリーダー
(Bio Rad)にて 450 nm(参照波長 630 nm)の吸光度を測定した。 統計解析
すべてのデータは平均±標準誤差で表した。データの解析には Mann-Whitney U 検
38
表6 定量RT-PCRに用いたプライマーとプローブ、および増幅産物の大きさ
Gene Direction Primer sequence Base Pairs
UPL No.
VEGFR1 Forward Reverse
CAG CAT ACC TCA CTG TTC AAG G CCA CAC AGG TGC ATG TTA GAG
75 bp 50
VEGFR2 Forward Reverse
GAA CAT TTG GGA AAT CTC TTG C CGG AAG AAC AAT GTA GTC TTT GC
66 bp 18
VEGFR3 Forward Reverse
CAG GCT GAC GCT GAG GAC
AAA GGA CAC CCA GTT GTA ATA CCT
78 bp 64
VEGF-A Forward Reverse
CTA CCT CCA CCA TGC CAA GT CCA TGA ACT TCA CCA CTT CGT
86 bp 29
VEGF-C Forward Reverse
AAG TCC ACA GAA ATG CTT GTT AAA TCG TAC ATG GCC GTC TGT AA
77 bp 31
VEGF-D Forward Reverse
AAA GTT TTA CCA GTA TGG ACT CTC G GAG TTC TTT GCC ATT CTT CAT CTA T
39
結 果
(1) 口腔扁平上皮癌細胞由来エクソソームが血管新生に及ぼす影響 がん細胞における脈管形成は、がん細胞が増殖するための酸素や栄養の供給源 としての役割を持つとともに、転移経路の確保という重要な要素を持つ。一般に、血 管新生やリンパ管新生の亢進は、血行性転移やリンパ行性転移をそれぞれ高めると 考えられている(33,34)。そこで、第二章では、口腔扁平上皮癌細胞由来のエクソソー ムが、血行性転移とリンパ行性転移に及ぼす影響について、血管新生とリンパ管新 生に着目した解析を行った。 まず、HUVECs を用いた管腔形成実験を行い、第一章で精製したヒト口腔扁平上皮 癌細胞由来エクソソーム(exoA, exoB)が、血管新生に及ぼす影響について解析した。 なお、管腔形成能は、実験開始から 18 時間後の管腔構造の分岐部数を指標として 評価した(35,36)。 解析の結果、対照群と exoA あるいは exoB 添加群との間には、分岐部数に有意な 変化は認められなかった(図 11a,b)。なお、管腔形成実験において、exoB 添加時に 不規則な細胞凝集像が認められた(図 11a)。エクソソーム添加時の HUVECs の細胞 増殖能について、対照群との間に変化はなかった(図 11c)。 一般に、がん細胞は血管内皮細胞増殖因子(VEGFs)などの血管新生因子を産生し、 血管内皮細胞に発現している VEGF 受容体(VEGFRs)に作用することで、がん間質に おける血管内皮細胞の増殖と運動を亢進させることが知られている(37,38)。また、血 管新生において中心的な役割を果たすのは、VEGF-A とその受容体である VEGFR1 および VEGFR2 であることが知られている(39,40)(図 12)。 そこで、定量 RT-PCR とウエスタンブロッティングによって、exoA および exoB 添加時 の HUVECs における VEGFs と VEGFRs の発現量を解析した。その結果、exoA およ び exoB 添加によって、VEGFR2 の発現量が有意に増加した(図 11d,e)。これらの結果から、exoA や exoB の添加は、管腔形成開始から 18 時間後の HUVECs 管腔構造分岐部数には顕著な変化を与えなかったものの(図 11a,b)、 HUVECs における VEGFR2 の発現を増加させることで、血管新生を亢進させる可能性 が示唆された。
40
図 11. exoA および exoB が血管新生に及ぼす影響(HUVECs)
(a)管腔形成の様子(エクソソーム添加 18 時間後) ▲は細胞凝集を示す。Scale bars: 500 µm (b)一視野中の管腔構造の分岐部数。 (c)細胞増殖能(エクソソーム添 加 18 時間後)(d)VEGFs と VEGFRs の定量 RT-PCR 発現解析(エクソソーム添加 18 時間後)。内部標準には GAPDH を用いた。*P < 0.05。(e)VEGFs と VEGFRs のウエス
タンブロッティング(エクソソーム添加 36 時間後)。VE-cadherin は血管内皮細胞のポ ジティブコントロールとして用いた。内部標準には GAPDH を用いた。実験は triplicate で行い、3 回の実験の平均値±標準誤差で表した。 (a) (b) (c) (d) (e)
41
図 12 VEGF-VEGFR 関連分子と脈管新生との関連
VEGF-A は VEGFR1 もしくは VEGFR2 に結合することで主に血管新生を誘導し、 VEGF-C と VEGF-D は主に VEGFR3 に結合することで主にリンパ管新生を誘導する。
42 (2) ヒト口腔扁平上皮癌細胞由来エクソソームがリンパ管新生に及ぼす影響 次に、HDLECs を用いた管腔形成実験を行い、ヒト口腔扁平上皮癌細胞由来エクソ ソーム(exoA, exoB)が、リンパ管新生に及ぼす影響について解析した。なお、管腔形 成能は、実験開始から 18 時間後の管腔構造の分岐部数を指標として評価を行った (35, 36)。 解析の結果、対照群と exoA 添加群との間には、分岐部数に変化はなかった(図 13a,b)。一方、exoB 添加群は、対照群や exoA 添加群に比べ、有意に管腔構造の分 岐部数が増加した(図 13a,b)。なお、エクソソーム添加時の HDLECs の細胞増殖能に は変化がなかった(図 13c)。 血管新生と同様、がん細胞はリンパ管新生因子を産生し、リンパ管内皮細胞に発 現している VEGFRs に作用することで、がん間質におけるリンパ管内皮細胞の増殖と 運動を亢進させることが知られている(37,38)。また、リンパ管新生において中心的な 役割を果たすのは、VEGF-C および VEGF-D とそれらの受容体である VEGFR3 であ る(41)(図 12)。
そこで、定量 RT-PCR とウエスタンブロッティングによって、エクソソーム添加時の HDLECs における VEGFs と VEGFRs の発現量を解析したところ、VEGFR1、VEGFR2、 VEGFR3 の発現量が、exoA および exoB 添加によって、有意に増加した(図 13d,e)。 また、それらのリガンドである VEGF-A、VEGF-C、VEGF-D については、対照群に比 べて exoB 添加群で、有意に増加した(図 13d,e)。 これらの結果から、HDLECs における exoB の添加は、管腔形成開始から 18 時間後 の管腔構造分岐部数を有意に増加させ(図 13a,b)、そのメカニズムは exoB による VEGFR3 の発現量増加が寄与していたと示唆された。また、exoA の添加では、管腔 形成開始から 18 時間後の有意な管腔形成の亢進は認められなかったが、exoB 同様、 VEGFRs の発現亢進を認めた(図 13a,b)。
43
図 13.exoA および exoB がリンパ管新生に及ぼす影響(HDLECs)
(a)管腔形成の様子(エクソソーム添加 18 時間後)。Scale bars: 500 µm (b)一視野中の 管腔構造の分岐部数。***P<0.001。(c)細胞増殖能(エクソソーム添加 18 時間後)(d)
VEGFs と VEGFRs の定量 RT-PCR 発現解析(エクソソーム添加 18 時間後)。内部標準 には GAPDH を用いた。*P < 0.05、**P < 0.01(vs Vehicle)。‡P < 0.05、‡‡P < 0.01 (vs exoA)。
(e)VEGFs と VEGFRs のウエスタンブロッティング(エクソソーム添加 36 時間後)。 podoplanin はリンパ管内皮細胞のポジティブコントロールとして用いた。内部標準には GAPDH を用いた。実験は triplicate で行い、3 回の実験の平均値±標準誤差で表した。 (a) (b) (c) (d) (e)
44
考 察
本章では、口腔扁平上皮癌細胞由来エクソソームが血行性転移とリンパ行性転移 に及ぼす影響について検討を行った。
血管新生の検討では、HUVECs を解析に用いた。exoA と exoB の添加により、 HUVECs における VEGFR2 の発現が増強したが、管腔形成実験開始 18 時間後では、 エクソソーム添加による有意な管腔形成能の亢進は認められなかった。 しかし、exoB 添加時には、管腔形成の起点となることが報告されている不規則な 細胞凝集像(42)が多数認められた。この細胞凝集が形成される機序については不 明であるが、これらの結果をふまえ、実験開始から 18 時間以降も継続して管腔形成 を観察した場合、exoB が血管新生能を亢進すると推察された。 一方、リンパ管新生の検討では、HDLECs を解析に用いた。exoB 添加により、 HDLECs の管腔形成能亢進が認められた。VEGF-VEGFR 関連分子の発現解析では、 exoA および exoB 添加によって、VEGFR2、VEGFR3 の発現量が増加したことから、 exoA および exoB は、血管新生に比べて、リンパ管新生を亢進させる作用が大きいこ とが示唆された。
また、exoB 添加によって、HDLECs における VEGF-A、VEGF-C、VEGF-D の発現 亢進が認められた。通常、がんにおける脈管新生について VEGFs-VEGFRs 関連分 子を考慮する場合、VEGFs はがん細胞が産生・分泌するものとして重要視されるが、 今回の解析では、リンパ管上皮細胞からもこれらのリガンドが産生されていることが 確認された。これらのリガンドが細胞外に分泌されているかどうかについては、今後 の検討が必要となるが、exoB による VEGF-A、VEGF-C、VEGF-D の発現亢進が確認 されたことは、in vivo において、exoB がリンパ管新生のみならず、リンパ管上皮細胞 を介した間接的な血管新生をも促進させる可能性を意味しており、興味深い。 以上のことから、口腔扁平上皮癌細胞は、エクソソームを介して血管内皮細胞やリ ンパ管内皮細胞の VEGF-VEGFR 関連分子の発現量を制御していることが示唆され た。また、exoA および exoB は、血管新生に比較して、高いリンパ管新生亢進作用を もつことが確認され、このことは、口腔扁平上皮癌の多くが、リンパ行性転移指向性 をもつことと関連する可能性が高いと考えられた。
45
総 括
本研究では、第一章、第二章を通して、口腔扁平上皮癌の進展における癌細胞由 来エクソソームの役割について、同一患者由来で浸潤・転移能が異なるヒト口腔扁平 上皮癌細胞株 SQUU-A、SQUU-B を使用した解析を行った。 すべての実験を通して、2 つの異なる単一クローンから分泌されるエクソソームは、 癌の浸潤・転移に対して、それぞれ異なる個性をもつことが明らかとなった。このこと は、がん細胞由来エクソソームの解析において、病態進行に関わる具体的なターゲッ ト分子の検索を目的とする場合には、ヘテロな細胞集団を対象とする実験は不適当 である可能性があり、目的に応じた検体を選択する重要性が提示された。第一章では、exoA および exoB を用いた miRNA-mRNA 統合解析を行うことで、浸
潤促進因子としての miR-200c-3p、およびその標的遺伝子としてのCHD9 と WRN を 同定した。 がんの浸潤に関与する miRNA として miR-200c-3p を同定したことは、当該ターゲッ トを口腔扁平上皮癌の診断ツールや治療効果マーカーの標的としてのみならず、が ん治療のターゲットとして医薬応用できる可能性を提示することとなり、その臨床的意 義は高い。 miRNA に対する阻害方法については、現在、インヒビター(43)、スポンジ(44)、デ コイ(45)を用いた方法など、次々と開発されているが、今後これらの知見をもとに、in vivo 実験にて、miR-200c-3p のがん進展阻害効果や副作用、ドラッグデリバリーの検 討等を行う必要がある。 第二章では、exoA および exoB が転移指向性に及ぼす影響について、血管新生と リンパ管新生に着目した実験を行った。現在までに、前立腺癌(46)、乳癌(47)、メラノ ーマ(48)など多くのがん種において、腫瘍細胞が分泌するエクソソームやその内包 物である miRNA が転移先ニッチの形成に必須の役割を果たしていることが明らかに されている。 今回の実験で、口腔扁平上皮癌細胞由来エクソソームが、VEGFs-VEGFRs 分子 群の発現制御を介して、脈管新生を亢進させ、特にリンパ行性転移を促進する可能 性が示された。 がん微小環境におけるリンパ管の生物学的特性については、未解明の部分が多 いが、現在、腫瘍リンパ管新生制御の中心的な役割は VEGF-C-VEGFR3 シグナル にあるとされており、VEGFR3、あるいは VEGF-C に対する中和抗体を用いた臨床試 験が開始されている。
46 今回の実験により、これらのターゲット分子を制御するエクソソームの機能を見出 したことは、がん細胞由来エクソソームを標的とした新しいリンパ管新生抑制療法の 可能性を提示するものであった。 なお、口腔扁平上皮癌細胞由来エクソソームに内包されていたリンパ管新生誘導 因子が VEGFs-VEGFRs 分子群以外にも作用した可能性も残されており、今後は、今 回得られた結果をもとに、エクソソームに内包されているリンパ管新生誘導因子の同 定を行い、具体的な転移指向性決定機構の解析を行う必要がある。
47
謝 辞
稿を終えるにあたり、懇篤なる御指導、御高閲を頂きました、福岡大学 薬学部 統合臨床医学講座 免疫・分子治療学分野 中島 学 教授に深甚なる感謝の意を 表します。また、今回このような機会を与えて下さった九州大学大学院歯学研究院 口腔顎顔面病態学講座 顎顔面腫瘍制御学分野 中村 誠司 教授に深甚なる感謝 の意を表します。直接御指導いただき、すべての研究遂行、および本稿と投稿論文 の作成に際し懇切丁寧な御指導、御助言を頂きました福岡大学 薬学部 統合臨床 医学講座 免疫・分子治療学分野 安河内(川久保) 友世 講師に深甚なる感謝の意 を表します。その他の各種実験に際し様々な御指導、御助言を頂きました福岡大学 薬学部 統合臨床医学講座 免疫・分子治療学分野の皆様に深謝いたします。大学 院入学時より様々な御助言を頂きました九州大学大学院歯学研究院 口腔顎顔面 病態学講座 顎顔面腫瘍制御学分野の皆様に深謝いたします。48
参
考
文
献
1. Kucharzewska P, Christianson HC, Welch JE, Svensson KJ, Fredlund E, Ringnér M, Mörgelin M, Bourseau-Guilmain E, Bengzon J, Belting M. Exosomes reflect the hypoxic status of glioma cells and mediate hypoxia-dependent activation of vascular cells during tumor development. Proc Natl Acad Sci USA 2013;110: 7312–7317.
2. Kosaka N, Iguchi H, Hagiwara K, Yoshioka Y, Takeshita F, Ochiya T. Neutral sphingomyelinase2 (nSMase2)-dependent exosomal transfer of angiogenic
microRNAs regulate cancer cell metastasis. J Biol Chem 2013;288(15):10849– 10859.
3. Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem 1987;262(19):9412–9420.
4. Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007;9:654–659.
5. Huang Q, Gumireddy K, Schrier M, Ie Sage C, Nagel R, Nair S, Egan DA, Li A, Huang G, Klein-Szanto AJ, Gimotty PA, Katsaros D, Coukos G, Zhang L, Puré E, Agami R. The microRNAs miR-373 and miR-520c promote tumour invasion and metastasis. Nat Cell Biol 2008;10:202–210.
6. Peinado H, Aleckovic M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, Garcia-Santos G, Ghajar C, Nitadori- Hoshino A, Hoffman C, Badal K, Garcia BA, Callahan MK, Yuan J, Martins VR, Skog J, Kaplan RN, Brady MS, Wolchok JD, Chapman PB, Kang Y, Bromberg J, Lyden D. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat Med 2012;18:883–891.
7. Harris DA, Patel SH, Gucek M, Hendrix A, Westbroek W, Taraska JW. Exosomes released from breast cancer carcinomas stimulate cell movement. PLoS One 2015;10:e0117495.
8. Atay S, Banskota S, Crow J, Sethi G, Rink L, Godwin AK. Oncogenic KIT- containing exosomes increase gastrointestinal stromal tumor cell invasion. Proc Natl Acad Sci USA 2014;111:711–716.
9. Kapsogeorgou EK, Abu-Helu RF, Moutsopoulos HM. Salivary gland epithelial cell exosomes: A source of autoantigenic ribonucleoproteins. Arthritis & Rheumatism 2005;52(5):1517–1521.
49
10. Valadi H, Ekstrom K, Bossios A, Lötvall JO. Exosome- mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007;9(6):654–659.
11. Morifuji M, Taniguchi S, Sakai H, Nakabeppu Y, Ohishi M. Differential expression of cytokeratin after orthotopic implantation of newly established human tongue cancer cell lines of defined metastatic ability. Am J Pathol 2000;156(4):1317–1326.
12. Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell 2009;136:215–223.
13. Chekulaeva M, Filipowicz W. Mechanisms of miRNA-mediated post-transcriptional regulation in animal cells. Curr Opin Cell Biol Biol 2009;21:452–460.
14. Jansson MD, Lund AH. MicroRNA and cancer. Mol Oncol 2012;6:590-610. 15. Calin GA, Croce CM. MicroRNA signatures in human cancers. Nat Rev
Cancer 2006;6:857–866.
16. Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thausands of human genes are microRNA targets. Cell 2005;120:1-20.
17. Grimson A, Farh KK, Johnston WK, Garrett-Engele P, Lim LP, Bartel DP. MicroRNA targeting specificity in mammals: determinants beyond seed pairing. Mol Cell 2007;27:91–105.
18. Chou CH, Chang NW, Shrestha S, Hsu SD, Lin YL, Lee WH, Yang CD, Hong HC, Wei TY, Tu SJ, Tsai TR, Ho SY, Jian TY, Wu HY, Chen PR, Lin NC, Huang HT, Yang TL, Pai CY, Tai CS, Chen WL, Huang CY, Liu CC, Weng SL, Liao KW, Hsu WL, Huang HD. miRTarBase 2016: updates to the experimentally validated miRNA-target interactions database. Nucleic Acids Res 2016;44:D239– D247.
19. Berezikov E, Guryev V, van de Belt J, Wienholds E, Plasterk RH, Cuppen E. Phylogenetic shadowing and computational identification of human microRNA genes. Cell 2005;120:21–24.
20. De Cola A, Volpe S, Budani MC, Ferracin M, Lattanzio R, Turdo A, D'Agostino D, Capone E, Stassi G, Todaro M, Di Ilio C, Sala G, Piantelli M, Negrini M, Veronese A, De Laurenzi V. miR-205-5p-mediated downregulation of ErbB/HER receptors in breast cancer stem cells results in targeted therapy resistance. Cell Death Dis 2015;6:e1823.