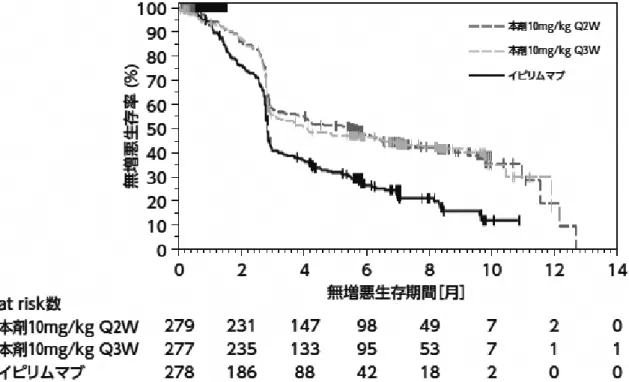
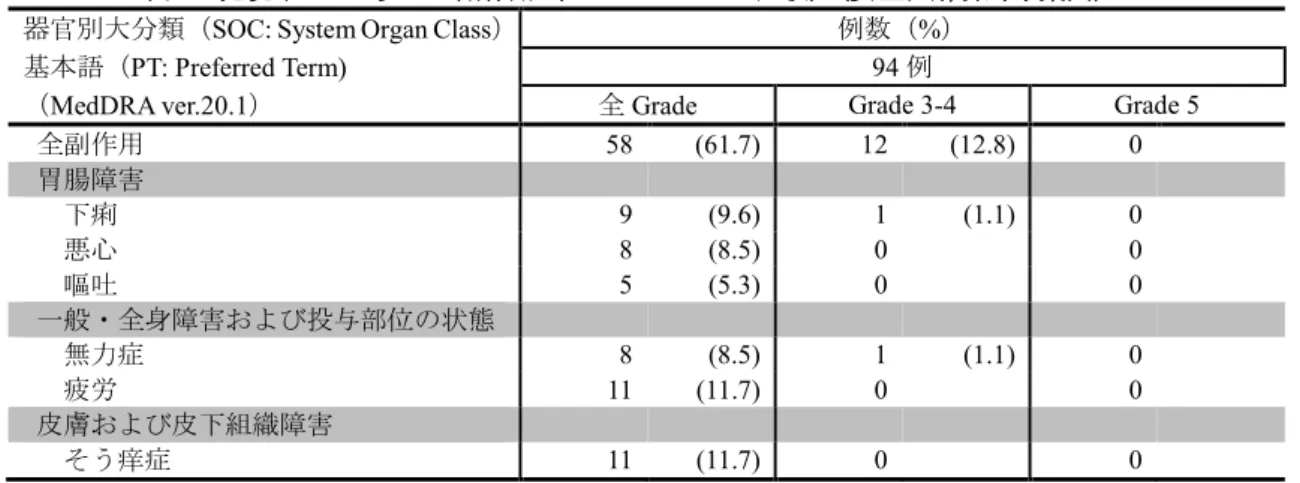
(PDF:7.82MB)
164
0
0
全文
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)
(12)
(13)
(14)
(15)
(16)
(17)
(18)
(19)
(20)
(21)
(22)
(23)
(24)
(25)
(26)
(27)
(28)
(29)
(30)
図
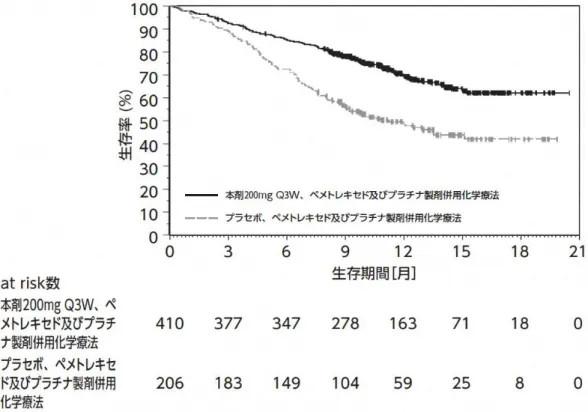
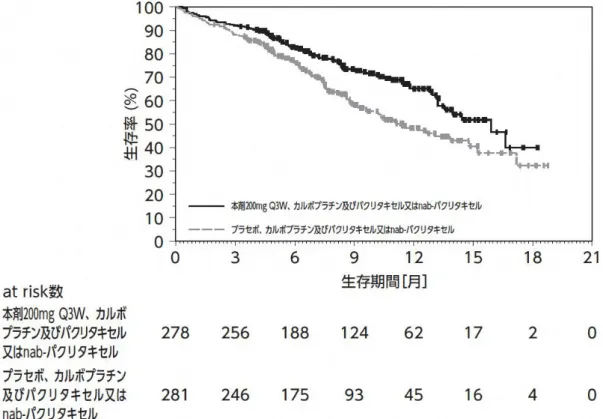
+3
関連したドキュメント
全国の緩和ケア病棟は200施設4000床に届こうとしており, がん診療連携拠点病院をはじめ多くの病院での
大曲 貴夫 国立国際医療研究センター病院 早川 佳代子 国立国際医療研究センター病院 松永 展明 国立国際医療研究センター病院 伊藤 雄介
[r]
在宅の病児や 自宅など病院・療育施設以 通年 病児や障 在宅の病児や 障害児に遊び 外で療養している病児や障 (月2回程度) 害児の自
妊娠中、プレパパママ教室やピアサ ポート訪問、病院サポート利用者もお
病院と紛らわしい名称 <例> ○○病院分院 ○○中央外科 ○○総合内科 優位性、優秀性を示す名称 <例>
在宅医療の充実②(24年診療報酬改定)
の 立病院との連携が必要で、 立病院のケース ー ーに訪問看護の を らせ、利用者の をしてもらえるよう 報活動をする。 の ・看護 ・ケア