1
マキュエイド硝子体内注用
40mg
医薬品製造販売承認事項一部変更承認申請書
添付資料
CTD 第 2 部(資料概要)
2.5 臨床に関する概括評価
わかもと製薬株式会社
2
目次
略語一覧 ... 3 臨床に関する概括評価... 5 2.5 2.5.1 製品開発の根拠 ... 5 製品及び予想される追加適応 ... 5 2.5.1.1 製品開発の科学的背景 ... 7 2.5.1.2 適応疾患の臨床的/病態生理学的側面 ... 9 2.5.1.3 アンメットメディカルニーズ ... 25 2.5.1.4 WP-0508ST 全体の臨床開発計画 ... 27 2.5.1.5 試験の概略 ... 28 2.5.1.6 本剤の臨床的な位置付け... 36 2.5.1.7 公表文献の検索及び抽出... 39 2.5.1.8 2.5.2 生物薬剤学に関する概括評価 ... 41 2.5.3 臨床薬理に関する概括評価 ... 41 薬物動態評価 ... 41 2.5.3.1 薬物動態のまとめ ... 49 2.5.3.2 2.5.4 有効性の概括評価 ... 50 糖尿病黄斑浮腫に対する試験 ... 50 2.5.4.1 網膜静脈閉塞症に対する試験 ... 79 2.5.4.2 非感染性ぶどう膜炎に対する試験 ... 96 2.5.4.3 有効性評価のまとめ ... 115 2.5.4.4 2.5.5 安全性の概括評価 ... 119 本治験に特徴的な有害事象の評価方法 ... 119 2.5.5.1 臨床安全性評価成績 ... 122 2.5.5.2 有害事象 ... 130 2.5.5.3 市販後情報 ... 146 2.5.5.4 文献による安全性情報 ... 150 2.5.5.5 推奨する用法・用量 ... 151 2.5.5.6 有害事象の予防,軽減,管理方法 ... 153 2.5.5.7 2.5.6 ベネフィットとリスクに関する結論 ... 161 推奨する使用方法 ... 161 2.5.6.1 本剤のベネフィット ... 162 2.5.6.2 本剤のリスク ... 164 2.5.6.3 推奨する使用法とベネフィットとリスクの総括 ... 165 2.5.6.4 2.5.7 参考文献 ... 1663
略語一覧
用語及び略号 正式名称(英語) 正式名称(日本語)
AAO American Academy of Ophthalmology アメリカアカデミー眼科学会 AGEs Advanced Glycation End products 糖化後期反応生成物
AUC0-t Area Under Concentration time curve from
zero to time t
投与後 t 日までの血漿中濃度―時 間曲線下面積
AUC0-∞
Area Under Concentration time curve from zero to time ∞
投与後∞日までの血漿中濃度―時 間曲線下面積
BRVO Branch Retinal Vein Occlusion 網膜静脈分枝閉塞症 CCL CC Chemokine Ligand CC ケモカインリガンド CDER Center for Drug Evaluation and Research 医薬品評価研究センター Cmax maximum Concentration 最高血漿中濃度
CRVO Central Retinal Vein Occlusion 網膜中心静脈閉塞症 CSME Clinically Significant Macular Edema 臨床的に明らかな黄斑浮腫 CTD Common Technical Document コモンテクニカルドキュメント EMA European Medicines Agency 欧州医薬品庁
ETDRS Early Treatment Diabetic Retinopathy Study 糖尿病網膜症の早期治療研究 FAG Fluorescein Angiography 蛍光眼底造影検査
FAS注1) Full Analysis Set 最大の解析対象集団
FDA U.S. Food and Drug Administration アメリカ合衆国食品医薬品局 GCP Good Clinical Practice 医薬品の臨床試験の実施の基準 HbA1C Hemoglobin A1c グリコヘモグロビン
Hemi-RVO Hemi Retinal Vein Occlusion 半側中心網膜静脈閉塞症 HPLC High Performance Liquid Chromatography 高速液体クロマトグラフ ICAM Intercellular Adhesion Molecule 細胞接着因子
IL Interleukin インターロイキン
IRMA Intraretinal Microvascular Abnormality 網膜内細小血管異常 LC Liquid Chromatography 液体クロマトグラフ logMAR log Minimum Angle of Resolution 対数視力
MedDRA/J Medical Dictionary for Regulatory
Activities Terminology ICH 国際医薬用語集 日本語版 MCP Monocyte Chemotactic Protein 単球走化性タンパク質
MS Mass Spectrometry 質量分析計
N Number 被験者数
4
用語及び略号 正式名称(英語) 正式名称(日本語)
PGE2 Prostaglandin E2 プロスタグランジンE2
PMDA Pharmaceuticals and Medical Devices Agency
独立行政法人医薬品医療機器総合 機構
PPS注2) Per Protocol Set 治験実施計画に適合した対象集団
PRP Panretinal Laser Photocoagulation 汎網膜光凝固
PT Preferred Term MedDRA における基本語 RIA Radioimmunoassay 放射免疫測定
RVO Retinal Vein Occlusion 網膜静脈閉塞症 SAS Statistical Analysis System 統計分析システム SD Standard Deviation 標準偏差
SOC System Organ Class MedDRA における器官別大分類
T1/2 Half Life 半減期
TA Triamcinolone Acetonide トリアムシノロンアセトニド Th T-helper cell ヘルパーT 細胞
Tmax Time to reach maximum concentration 最高血漿中濃度到達時間
TNF-α Tumor Necrosis Factor-α 腫瘍壊死因子-α
UPLC Ultra-Performance Liquid Chromatography 超高速液体クロマトグラフ VEGF Vascular Endothelial Growth Factor 血管内皮細胞増殖因子 WHO World Health Organization 世界保健機関
WP-0508 MaQaid® Intravitreal injection 40mg
トリアムシノロンアセトニド 硝 子体内注用(マキュエイド®硝子体 内注用40mg)の開発コード番号, 本剤 WP-0508ST注3) ― トリアムシノロンアセトニド テ ノン嚢下注用の開発コード番号, 本剤 注 1)選択基準を満たし,除外基準に該当しない症例で,治験薬の投与,又は注射筒の先を当て る処置がなされ,解析対象とするデータが存在するもの。 注2)FAS のうち,中止基準違反,併用薬・併用療法違反,用法用量・投与方法違反のないもの。 注3)WP-0508(マキュエイド®硝子体内注用40mg)と同じ製剤
5
臨床に関する概括評価
2.5
2.5.1 製品開発の根拠
製品及び予想される追加適応
2.5.1.1
マキュエイド®硝子体内注用40mg1)(開発コード番号:WP-0508)は,トリアムシノロンアセト ニド(TA)を有効成分とし,わかもと製薬株式会社が市販している添加剤を含有しない眼科手術 補助剤,硝子体内注用副腎皮質ホルモン剤である。2010 年 10 月に「硝子体手術時の硝子体可視 化」,2012 年 11 月に「糖尿病黄斑浮腫」の効能・効果が承認されている。 TA はプレドニゾロンの誘導体の 1 つで,9α 位にフッ素,16α 位に水酸基が置換された合成副 腎皮質ホルモンであり,筋肉内注射用,関節腔内注射用等の製剤として1961 年頃から抗炎症薬と して用いられている 2)。薬理作用として黄斑浮腫や血管新生の原因となる血管内皮増殖因子 (VEGF)の作用を抑制すること3),4),さらに,VEGF 産生を促進するプロスタグランジン E(2 PGE2) 5),6)や腫瘍壊死因子-α(TNF-α)7)の産生を抑制することが知られており,眼科用剤として,糖尿病 黄斑浮腫,網膜静脈閉塞症(RVO),ぶどう膜炎等の治療に使用されている8)。本剤の投与経路と して硝子体内投与が糖尿病黄斑浮腫に対して承認されているが,臨床現場では,安全性の観点等 からTA 含有製剤のテノン嚢下投与が広く選択され,適応外使用されている。 硝子体内投与,テノン嚢下投与及び他の眼科投与経路を図2.5.1-1に示した。 図2.5.1-1 硝子体内投与,テノン嚢下投与及び他の眼科投与経路 今回,WP-0508ST[マキュエイド®硝子体内注用40mg(WP-0508)と同じ製剤]のテノン嚢下 投与による糖尿病黄斑浮腫,RVO 及び非感染性ぶどう膜炎患者を対象とした国内臨床試験より, 本剤の有効性が確認され,忍容性が確認されたことから,テノン嚢下投与で副腎皮質ホルモン剤 としての効能・効果を有する「新投与経路医薬品」として製造販売承認事項一部変更承認申請を 行うこととした。6 本剤の予想される薬効分類,販売名,追加効能・効果及び追加用法・用量は以下のとおりとし た。 予想される薬効分類 眼科手術補助剤、眼科用副腎皮質ホルモン剤 予想される販売名 マキュエイド®硝子体内注用40mg 追加が予想される 効能・効果 [テノン嚢下投与] 下記の疾患に伴う黄斑浮腫の軽減 ・糖尿病黄斑浮腫 ・網膜静脈閉塞症 ・非感染性ぶどう膜炎 追加が予想される 用法・用量 [テノン嚢下投与] 通常、本剤1 バイアルに 1 mL の生理食塩液又は眼灌流液を注入してト リアムシノロンアセトニド濃度が40 mg/mL になるように用時懸濁し、 トリアムシノロンアセトニドとして20 mg(懸濁液として 0.5 mL)をテ ノン嚢下に投与する。 <用法・用量に関連する使用上の注意> [硝子体内投与]【糖尿病黄斑浮腫】、[テノン嚢下投与] 1. 長期投与時の有効性及び安全性は確立していない。長期投与により、 白内障のリスクが高くなるおそれがあることから、継続的な長期投 与は避けること。再投与は、患者の状態をみながら治療上の有益性 が危険性を上回ると判断される場合にのみ、3 ヶ月以上の間隔をあ けて行うこと。糖尿病黄斑浮腫に対する硝子体内投与の場合は、ト リアムシノロンアセトニド粒子の消失を細隙灯顕微鏡等で確認した 後に再投与すること。 2. 臨床試験においては、両眼治療は行われていない。両眼に治療対象 となる病変がある場合は、両眼同時治療の有益性と危険性を慎重に 評価した上で本剤を投与すること。 なお、初回治療における両眼同日投与は避け、片眼での安全性を十 分に評価した上で対側眼の治療を行うこと。
7
製品開発の科学的背景
2.5.1.2
開発の背景
2.5.1.2.1
黄斑浮腫は,糖尿病網膜症,網膜静脈閉塞症,ぶどう膜炎等に合併する視力低下の主要な原因 であり,血液網膜関門が破綻し,網膜血管の透過性が亢進するなどにより引き起こされる病態で ある。 黄斑浮腫の病態は,疾患や患者ごとに多様性があり,一度発症すると根治は難しいと考えられ るため,治療の使い分け,組合せを患者ごとに検討し,適切な時期に治療する必要がある。本邦 での標準的な治療方法としては,糖尿病網膜症や網膜静脈閉塞症に伴う黄斑浮腫には,薬物治療 [ステロイドの局所投与(硝子体内投与,テノン嚢下投与,点眼等),VEGF 阻害剤硝子体内投与], 網膜光凝固,硝子体手術等 9)-12)が選択されている。しかし,効能・効果が承認された硝子体内注 射用剤があるにもかかわらず,承認されていない投与経路(テノン嚢下投与,点眼等)の薬剤が 適応外使用されている実態がある。ぶどう膜炎には,薬物治療[ステロイドの局所投与(点眼, 結膜下注射,テノン嚢下投与等),ステロイドの内服,コルヒチン,シクロスポリン,抗腫瘍壊死 因子(TNF)-α 抗体製剤等13)-18)]が選択されており,原疾患コントロールの観点から,眼科以外 の薬物治療も承認されている。眼科治療においては,ステロイド治療(適応外使用含む)が主体 となっている。 TA 含有製剤の眼科使用については,2001 年に Jonas ら19)が初めて糖尿病黄斑浮腫患者の硝子 体内にTA を投与し,浮腫が軽減することを報告しており,2004 年には Ohguro ら20)が硝子体切 除に無効であった糖尿病黄斑浮腫患者にTA をテノン嚢下投与し,中心窩網膜厚及び視力改善を 確認したと報告している。以来,眼科領域では,骨粗鬆症,糖尿病,肥満,高血圧等の全身副作 用を避ける目的も含め,硝子体内投与やテノン嚢下投与が多く選択され,他の疾患も含め適応外 使用されてきた8)。 TA のテノン嚢下投与は,硝子体内投与に比して効果がやや減弱することが示唆されている21) が,20 mg 及び 40 mg 投与後の有効性や持続性が報告されており22),23),他の治療(光凝固,硝子 体手術,VEGF 阻害剤等)との併用や組合せ治療に適していると考えられる。有害事象について も多くの臨床報告があり,眼圧上昇,白内障,眼瞼下垂等,有害事象の種類,発生頻度,コント ロール方法等,実態が把握されてきている8),24),25)。TA テノン嚢下投与は,硝子体内投与に比して, 眼圧上昇,白内障進展,眼内炎等のリスクが少ないことから,適応外であるがより広く臨床使用 されている8)。 以上,適応外使用是正の観点からテノン嚢下投与での開発に意義があると考えられた。また, 本剤のテノン嚢下投与は網膜疾患治療剤として汎用性が高いと考えられ,糖尿病黄斑浮腫,網膜 静脈閉塞症及び非感染性ぶどう膜炎の治療においても重要な選択肢の1 つになると考えられた。9
適応疾患の臨床的/病態生理学的側面
2.5.1.3
黄斑浮腫の臨床的/病態生理学的側面
27),28)2.5.1.3.1
網膜浮腫は網膜血管の循環障害,網膜血管炎などの炎症性疾患で網膜血管の透過性が亢進し, 網膜内の細胞外組織液が貯留した状態をいう。特に,黄斑部では,Henle 線維が長く,大きな空 間が得られるので,浮腫が起こりやすい。Müller 細胞の突起が他の網膜部分より少ないこと,網 膜血管が少なく液体の吸収が悪いことも関与している。黄斑部に浮腫を伴う場合は視力低下を合 併することが多いため,臨床的に重要であるとされている。病態としては,網膜血管の内皮細胞 及び網膜色素上皮ではtight junction による細胞間結合によりバリアを形成している(図2.5.1-2) が,循環障害,糖尿病に伴う代謝異常,高血圧,炎症性疾患など種々の原因によりバリアが傷害 されることによって,網膜内に浮腫を生じ,血漿蛋白や脂質の沈着を起こすと考えられている。 a)網膜の縦横基本構造 b)網膜の血管構造と黄斑部の特殊構造 図2.5.1-2 網膜の構造28) 蛍光眼底造影検査(FAG)が血管透過性,毛細血管瘤の検出には有用である。また,近年,光 干渉断層計(OCT)の進歩により,黄斑部浮腫の病態を鮮明に描出することができるようになっ てきており,嚢胞様,漿液性網膜剥離を伴うものなど浮腫の形態や,プログラム解析によって網 膜浮腫の程度を非侵襲的かつ定量的に評価することが可能になった。 血液網膜関門の破綻によって黄斑浮腫を起こす代表的な疾患は,糖尿病網膜症,網膜静脈閉塞 症(RVO)[網膜中心静脈閉塞症(CRVO),網膜静脈分枝閉塞症(BRVO)],加齢黄斑変性,傍中 心窩毛細血管拡張症などの網脈絡膜疾患やぶどう膜炎がある。 硝子体の関与,主に硝子体の牽引による黄斑浮腫を起こす疾患は,黄斑前膜,黄斑硝子体牽引 症候群,網膜剥離術後などがある。 その他,外因性要因より黄斑浮腫をきたすものとして,エピネフリンやラタノプロスト点眼, 白内障術後の黄斑浮腫(Irvine-Gass 症候群),外傷性低眼圧黄斑症,放射線網膜症などがある。10
糖尿病黄斑浮腫
2.5.1.3.2
糖尿病黄斑浮腫に関連する疾患の臨床的/病態生理学的側面を以下に要約した。糖尿病黄斑浮腫 とは,糖尿病網膜症に伴う黄斑浮腫である。 1. 糖尿病網膜症の臨床的/病態生理学的側面30) 糖尿病網膜症とは,糖尿病により血管壁障害や循環障害が引き起こされ,重症化すると網膜や 硝子体において3 次元的に多彩な病変を呈し,高度の視覚障害を惹起する疾患である。ただし, 重症化する前に適切な治療を施すことで進行を食い止め,視機能障害を予防することが可能な疾 患でもある。 厚生労働省の平成24年国民健康栄養調査報告31)によると,本邦には推定950万人(成人男性の 15.2%,女性の8.7%)の糖尿病患者がおり,糖尿病患者のうち15~38%32),33)に網膜症が認められる ため,糖尿病網膜症患者数は約150~330万人と推計される。年間約3,000人が失明しており,網膜 症は中途失明原因の上位を占めている34)。 高血糖による代表的な糖代謝異常には,ポリオール代謝経路の活性亢進,蛋白質への非酵素的 糖化反応に基づく糖化後期反応生成物(AGEs)の蓄積,プロテインキナーゼ C 活性化,活性酸 素や過酸化脂質の産生増加が挙げられる。これらの糖代謝異常は相互にネットワークを形成し, 網膜の血管壁細胞に直接的に,又はサイトカインの発現亢進や,ネットワーク形成を介して間接 的に作用して糖尿病網膜症の発症・伸展に関与している35)。 眼底所見における基本病態は,網膜血管の透過性亢進,網膜血管の内腔閉塞,血管新生の3 つ に要約され,これら3 つの基本病態には VEGF を中心とした様々なサイトカインの関与が報告さ れている35)。 糖尿病網膜症のリスク背景因子としては,高血糖,高血圧,脂質異常症,肥満,糖尿病罹患期 間,妊娠が挙げられる 36)。日本で行われた久山町研究においては,糖尿病罹患期間,HbA1cの関 連が大きかったと報告されている32)。 糖尿病網膜症の重症度分類として米国眼科学会(AAO)分類37)を表2.5.1-1に示した。11 表2.5.1-1 AAO糖尿病網膜症重症度新分類37) 重症度 散瞳下眼底検査所見 軽症非増殖糖尿病網膜症 毛細血管瘤のみ認める 中等症非増殖糖尿病網膜症 毛細血管瘤以外の所見も認めるが,重症非増殖糖尿 病網膜症より軽い 重症非増殖糖尿病網膜症 以下の所見のいずれかを認め,かつ増殖性網膜症の 所見を認めないもの ・4 象限すべてで 20 個以上の網膜出血 ・2 象限以上で明らかな静脈の数珠状拡張 ・1 象限以上で顕著な網膜内細小血管異常(IRMA) 増殖糖尿病網膜症 以下の所見のいずれかを認めるもの ・新生血管 ・硝子体出血 ・網膜前出血 糖尿病黄斑浮腫の病態と治療 2. 病態27),29),38) 1) 糖尿病黄斑浮腫とは,糖尿病網膜症を基礎疾患として黄斑部に生じる組織浮腫のことである。 黄斑部は網膜の中でも神経が密集し,視力に直接影響する部位であるため,黄斑部での浮腫は直 接視力低下に結びつく。 糖尿病網膜症の約20~30%に糖尿病黄斑症を合併していると報告されており,現在の日本での 糖尿病黄斑症患者数は約30~70 万人と推測される。糖尿病網膜症重症度との関連では,軽度の非 増殖糖尿病網膜症の3%,中等度から重度の非増殖糖尿病網膜症の 38%,増殖糖尿病網膜症の 71% に合併しているといわれる39)。糖尿病黄斑症の中で90%以上を占めるのが糖尿病黄斑浮腫である。 糖尿病黄斑浮腫は糖尿病網膜症の進行に並行して重症化することが多いが,軽症~中等症非増殖 性網膜症でも発症することがあり注意が必要である。 糖尿病では網膜血管透過性の亢進により後部硝子体に構造的な変化が生じ,後部硝子体膜の肥 厚と収縮を起こすと考えられている。肥厚・収縮した後部硝子体膜は,網膜の前後・接線方向の 牽引を生じ,黄斑浮腫を助長させる。さらに,網膜の前に硝子体ゲルが存在することで,網膜内 の液性成分の拡散が妨げられることや,肥厚した後部硝子体膜や硝子体のゲル内にサイトカイン などの透過性因子が貯留すること,硝子体内にある細胞が透過性因子を産生することなどが黄斑 浮腫の悪化因子として考えられている。糖尿病黄斑浮腫患者では,非糖尿病患者及び網膜症を伴 わない糖尿病患者よりも,硝子体液中のVEGF,細胞接着分子(ICAM)-1,インターロイキン(IL) -6, 単球走化性タンパク質(MCP)-1 濃度が有意に高く,重度の糖尿病黄斑浮腫患者では,重篤でな い糖尿病黄斑浮腫患者に比べて有意に高値を示すことが確認されている40)。 糖尿病黄斑浮腫のリスク背景因子としては,糖尿病網膜症と同様に高血糖,高血圧,脂質異常 症,肥満,糖尿病罹患期間,妊娠が挙げられる36)。 臨床的には,黄斑の一部に限局した浮腫が生じる局所性黄斑浮腫(図 2.5.1-3a)と,黄斑部の 増殖膜や硝子体の収縮,血管透過性の亢進などによりびまん性の浮腫が生じるびまん性黄斑浮腫
12 (図2.5.1-3b)とに分けられる。診断には糖尿病の罹患を確認し,加えて眼底検査を行う。 図2.5.1-3 a)局所性黄斑浮腫の眼底写真27) b)びまん性黄斑浮腫の眼底写真27) 糖尿病黄斑浮腫のFAG の特徴は蛍光漏出が黄斑部に認められることであり,大きく分けて以下 の3 パターンになる(表2.5.1-2)。FAG は循環状態を把握するのに重要である。 表2.5.1-2 FAGによる糖尿病黄斑浮腫の特徴29),41) 分類 特徴 FAG 画像 局所漏出 網膜血管の局所から血漿成分が漏出した状態 であり,網膜毛細管瘤の存在を示唆するもの と考えられる。 び ま ん 性 漏 出 網膜血管内皮のバリア破綻による網膜血管の 透過性亢進,あるいは炎症に伴う網膜組織へ の水分貯留を示唆するものと考えられてい る。 花弁状漏出 (中心窩) 蜂巣状漏出 (傍中心窩) 花弁状漏出は黄斑部中心窩における外網状層 での水分貯留でありMüller 細胞をはじめとす る網膜細胞の浮腫を,蜂巣状漏出は傍中心窩 の内網状層,いわゆるHenle 線維層での水分 貯留を反映しているとされる。ともに境界明 瞭な貯留パターンを示すことから,細胞ある いは組織間隙での水分停滞と考えられてい る。血管透過性の亢進というよりは組織での 水分貯留を主体とする病態と考えられる。 花弁状漏出 蜂巣状漏出
13 糖尿病黄斑浮腫のOCT 所見については Otani ら42),43)が以下の3 つのパターンに分類することを 提唱している(表2.5.1-3)。OCT は形態異常を把握するのに重要である44)。 表2.5.1-3 OCTによる糖尿病黄斑浮腫の特徴29),42),43) 分類 特徴 OCT 画像 スポンジ状浮腫 (網膜膨化) 黄斑浮腫の中でも最も頻繁に認められる形態であり,糖尿 病黄斑浮腫では60~90%の症例に認められる。傍中心窩か ら周中心窩にかけ,内網状層には小さな,外網状層には比 較的大きな嚢胞様間隙が認められるため,網膜血管のバリ ア破綻から組織間隙への水分貯留の移行段階と考えられ る。 嚢胞様浮腫 Müller 細胞に代表される網膜内の細胞が極度に腫脹,ある いは網膜全層に著しく水分貯留が起きている病態と考え られる。網膜血管の透過性の亢進が病変の主体とは考えに くく,スポンジ状浮腫を伴えば遷延化した病態が伴わなけ れば急激に水分貯留が引き起こされる病態が考えられる。 漿液性網膜剥離 網膜色素上皮細胞のバリア機能の破綻による脈絡膜側か らの水分漏出も考えられるが,糖尿病黄斑浮腫では,細胞 間隙の水分が網膜色素上皮細胞のポンプ機能によって吸 収される過程で機能不全を起こしたものと考えられる。多 くはスポンジ状浮腫,嚢胞様浮腫を伴っている。糖尿病黄 斑浮腫の15%に合併している。 治療方法29),38),45) 2) 糖尿病黄斑浮腫は,直接視力低下に結びつくためその治療は非常に重要であるが,現時点でも 決定的な治療方法はない。糖尿病黄斑浮腫は様々な病態が複雑に絡んでいる可能性があるため, 個々の病態についてFAG や OCT 所見を組み合わせて適切に把握することが重要である。 糖尿病網膜症発症以前や初期糖尿病網膜症では内科的な血糖,血圧コントロールが重要である が,糖尿病黄斑浮腫発症後の治療としては,薬物療法,網膜光凝固,硝子体手術が主に選択され, 組合せ治療が実施されている。 (1)薬物治療 現在,糖尿病黄斑浮腫治療に臨床使用されている眼科用製剤を表2.5.1-4に示した。硝子体内投 与においては,糖尿病黄斑浮腫の効能が承認されているマキュエイド®硝子体内注用40mg 1),ル センティス®硝子体内注射液46),アイリーア®硝子体内注射液47)の他に,眼科適応が承認されてい ないケナコルト-A®筋注用関節腔内用2),アバスチン®点滴静注用48)が使用されている。テノン嚢 下投与においては,副腎皮質ホルモン剤(TA)が,点眼においては,副腎皮質ホルモン,非ステ ロイド点眼液等が適応外使用されている。TA,VEGF 阻害剤については,投与後早期(1 週間以 内)に効果を発揮し,1~数ヶ月間隔での継続投与が必要とされる。持続性は薬剤によって異なり, 維持期においては再発が認められた場合に再投与する。
14 表2.5.1-4 糖尿病黄斑浮腫治療に臨床使用されている眼科用製剤 治療薬の種類 販売名 承認状況 投与 経路 効能 効果 用法・用量 注2) 硝子体内投与 副腎皮質ホルモン剤 (TA) マキュエイド®硝子体内注用40mg 1) ケナコルト-A®筋注用関節腔内用2) ○ × ○ × 3 ヶ月以降再投与 - VEGF 阻害剤 ルセンティス®硝子体内注射液46) アイリーア®硝子体内注射液47) アバスチン®点滴静注用48) ○ ○ × ○ ○ × 1 ヶ月毎注3) 1~2 ヶ月毎注4) - テノン嚢下投与 副腎皮質ホルモン剤 (TA) マキュエイド®硝子体内注用40mg 1) ケナコルト-A®筋注用関節腔内用2) ×注1) × ×注1) × - - 点眼 副腎皮質ホルモン剤,非ステロイド剤 ○ × - 注1)本申請における適応。 注2)効能・効果が承認されているもののみ記載 注3)1 ヶ月に 1 回視力等を測定し,その結果及び患者の状態を考慮し,本剤投与の要否を判断するこ と。投与開始後,視力が安定するまでは1 ヶ月毎に投与することが望ましい。 注4)1 ヶ月毎に 1 回,連続 5 回硝子体内投与する。その後は,通常,2 ヶ月毎に 1 回,硝子体内投与 する。なお,症状により投与間隔を適宜調節するが,1 ヶ月以上あけること。 (2)網膜光凝固49),50) 汎網膜光凝固(PRP)及び局所光凝固の治療適応,治療効果及び合併症について表2.5.1-5に示 した。治療効果,発現時期及び合併症を考慮して,TA テノン嚢下投与等との組合せ治療が選択さ れている51),52)。 表2.5.1-5 汎網膜光凝固と局所光凝固の治療適応,治療効果及び合併症 光凝固種類 (推奨併用処置) 主な適応疾患 治療効果,合併症 汎網膜光凝固 増殖糖尿病 網膜症 黄斑浮腫を認める症例に対して視力悪化を有意に抑制した が,軽症,中等度の非増殖網膜症では PRP による視野狭窄 等の合併症の頻度が視力悪化抑制より上回っており推奨さ れないとの報告がある53)。処置合併症として中心窩誤照射, 炎症,黄斑浮腫,硝子体出血,視野欠損が挙げられる。 局所光凝固(TA テ ノン嚢下投与) 汎網膜光凝固 糖尿病黄斑浮腫 局所光凝固 (TA,VEGF 阻害 剤) CSME注) 黄斑浮腫に対して,局所光凝固を行わない場合,約 30%に 中等度の視力低下が起こるが,局所光凝固によりこのリスク を15%まで低下させると報告されている54)。 a)直接凝固 局所性浮腫 毛細血管瘤や透過性が亢進した異常血管を直接光凝固する。 中心窩誤照射に注意する。 b)格子状凝固 びまん性浮腫 毛細血管瘤が原因ではないびまん性浮腫がよい適応であり, 浮腫のある部位を凝固する。中心窩誤照射に注意するととも に,不要な凝固は視野欠損や視力低下の原因となるので行っ てはならない。
注)CSME(clinically significant macular edema):I 黄斑中央 500 μm 以内に黄斑浮腫が存在,II 黄斑中央 500 μm 以
15 (3)硝子体手術55)-58) 硝子体手術適応となる疾患,所見,治療効果及び合併症について表2.5.1-6に示した。侵襲的治療 法であり,近年は侵襲が小さい治療法(薬物療法,光凝固)が優先される結果,施行機会が減少 しているが,本邦においては欧米と比較して選択されることが多い。また,効果発現までに半年 から1 年を要することが多いことから,薬物治療の併用が推奨されている。硝子体手術施行後は, 眼内における薬剤のクリアランスが亢進し 56),59),治療効果の持続期間が短くなることから,TA テノン嚢下投与による治療が推奨されている。 表2.5.1-6 硝子体手術の治療適応疾患,所見,治療効果及び合併症 適応疾患 (推奨併用処置) 所見 治療効果,合併症 増殖糖尿病網膜症 (汎網膜光凝固, TA,VEGF 阻害剤) 硝子体出血,網膜剥 離,線維血管増殖, 血管新生緑内障 主に増殖性変化の除去と進行抑制を目的として施 行される。後部硝子体剥離が起こっておらず,血管 新生が多発している場合は,難易度が非常に高くな る。術中合併症として新生血管からの出血,医原性 網膜裂孔形成,術後合併症として硝子体出血,再増 殖,眼圧上昇等が挙げられる。 びまん性黄斑浮腫 (光凝固,TA テノ ン嚢下投与) 牽引性黄斑浮腫, 後部硝子体膜肥厚 (光凝固や薬物療法 の無効・再発例) 硝子体手術により浮腫は改善するが,視力改善効果 は乏しい60)。浮腫改善までに半年~1 年を要するこ とから,その間に視細胞の不可逆的な障害が進行し てしまうことが理由の一つと考えられる。術後糖尿 病黄斑浮腫残存例は0~30%である。術中合併症と して医原性網膜裂孔形成,術後合併症として浮腫の 再発,眼圧上昇等が挙げられる。
16
網膜静脈閉塞症
10),61)2.5.1.3.3
網膜静脈閉塞症の臨床的/病態生理学的側面 1. 網膜静脈閉塞症は,種々の原因によって網膜静脈内に血栓が形成され,網膜静脈の閉塞により, 血流のうっ滞を生じ,それに伴って網膜浮腫,網膜出血,網膜虚血を引き起こし,これらが黄斑 に及ぶと急性に視力低下を引き起こす疾患である。網膜静脈閉塞症は糖尿病網膜症に次いで多い 網膜血管疾患であり,片眼失明原因の5 番目に挙げられている62)。本邦における網膜静脈閉塞症 の有病率は久山町研究により2.1%と報告されており,欧米諸国や他のアジアの国よりも高いこと が知られている63)。病期は大きく,「切迫期」,「急性期」,「慢性期」に分けられる。3 ヶ月以上経 過して「慢性期」に入り,黄斑にかかる嚢胞用浮腫,硬性白斑,黄斑変性が長期化すると回復は 困難になることから,「慢性期」に至る前の治療が肝要と考えられる。 網膜静脈閉塞症は,視神経内の篩状板付近の動静脈の静脈閉塞によるCRVO と,網膜動静脈交 叉部で網膜静脈の分枝部に閉塞が起こるBRVO に大別される。BRVO 及び CRVO 別の有病率は, 久山町研究ではそれぞれ2.0%及び 0.2%と報告されている63)。網膜静脈閉塞症に占めるBRVO と CRVO の比率は,BRVO の割合で 34%~86%と報告により差がみられる。網膜中心静脈は櫛状版 部で先天的に二本に分かれている場合があり,そのうちの1 本が閉塞した場合には半側網膜静脈 閉塞症(Hemi-RVO)となる。BRVO,Hemi-RVO 及び CRVO の分類は,眼底検査及び蛍光眼底造 影検査による眼底出血又は静脈閉塞を認める象限数で判別される。SCORE study による分類を表 2.5.1-7に示した64)。SCORE study では Hemi-RVO は BRVO の subtype としている。一方,Hemi-RVO は半側中心網膜静脈閉塞症(Hemi-CRVO)にも分類されている。出血の範囲が少しでも 2 象限に かかればHemi-CRVO とするか,完全に 2 象限に及んでいる場合とするかで頻度が変わるといわ れており,有病率はRVO 全体の 5%前後であるが,13~14%とする報告もある62),65)。BRVO との 相違点として,CRVO では血管新生緑内障を生じることに伴う完全失明の危険性があるため注意 が必要である。 表2.5.1-7 網膜静脈閉塞症の分類64) BRVO 網膜出血又は顕微鏡下で観察される網膜静脈閉塞を 1 象限以下に認める Hemi-RVO (BRVO subtype) 網膜出血又は顕微鏡下で観察される網膜静脈閉塞を 1 象限を超え,4 象限未満に認める。 CRVO 網膜出血又は顕微鏡下で観察される網膜静脈閉塞を 4 象限すべてに認める 網膜静脈閉塞症は静脈閉塞により網膜虚血の状態となる。CRVO では虚血の程度によって虚血 型と非虚血型に分類されている。蛍光眼底造影検査で10 乳頭面積以上の無灌流領域を認める場合 は虚血型,10 乳頭面積未満の場合は非虚血型と分類される 66)。発症初期の 2/3 が非虚血型,1/3 が虚血型であり,虚血型は非虚血型に比して予後不良である。非虚血型では最終視力が 0.7 以上 の症例が全体の57%であったが,虚血型では全体の 87%の症例が 0.05 以下であったと報告されて いる。また,全CRVO の中で,虹彩ルベオーシスの頻度は 20%であるが,虚血型では 45~80%に17 起こり,未治療ではその3 分の 2 に新生血管緑内障が発症すると報告されている。そのため,米 国のガイドラインでは新生血管を認めた後に光凝固が勧められるのに対し,本邦では新生血管の 予防を念頭に虚血の程度が強ければその時点で汎網膜光凝固が施行される。 網膜静脈閉塞症のリスク背景因子としては,高血圧,糖尿病,高脂血症,心血管病変,脳卒中, 睡眠時無呼吸症候群,腎疾患が挙げられ,本邦における久山町研究では高血圧が最も重要な危険 因子と報告されている63)。 網膜静脈閉塞症に伴う黄斑浮腫の病態と治療11),12),67) 2. 静脈内の血栓により血流障害が起き,血管内液から網膜内に血液成分の滲出をきたすことによ って,浮腫,蛋白漏出や虚血が引き起こされる。これらの変化によってVEGF などの炎症性サイ トカインの産生が亢進され,黄斑浮腫を促進させると考えられている。VEGF の過剰な発現は血 管拡張や網膜血管柵の破綻をきたす。RVO に伴う黄斑浮腫患者において,硝子体内の VEGF,IL-6 濃度が上昇し,その濃度は黄斑浮腫の重篤度と有意な相関を示すことが報告されている68),69)。そ の他の病態に関与する炎症性サイトカインとして,IL-8,MCP-1 の増加が報告されている。CRVO では著明な黄斑浮腫を伴うことが多く,BRVO においても急性期では 96%に嚢胞様黄斑浮腫が認 められたとの報告がある 70)。遷延する黄斑浮腫が視力予後の最も重要な因子と考えられており, 急性期には黄斑浮腫による視力低下の回復が治療の対象とされる。加えて,慢性期や虚血状態に よって新生血管に対する治療が行われる。
RVO の診断,治療方針,治療効果の判定のため,眼底検査,FAG,OCT 検査が行われる。FAG 検査は網膜の虚血状態を評価することが重要である。BRVO の典型的な所見は,静脈閉塞部位よ り神経線維層に沿って扇状に広がる火焔状の出血を呈し,出血部位に一致して網膜静脈からの血 管透過性の亢進や無潅流領域が認められることである(図 2.5.1-4)。CRVO と同様に嚢胞様黄斑 浮腫や漿液性網膜剥離を認めることが多い(図2.5.1-5)。 図2.5.1-4 BRVOの眼底画像(左)及びFAG画像(右)67) ↓:網膜静脈閉塞部
18 図2.5.1-5 BRVOのOCT画像72) CRVO の典型的な所見は,視神経乳頭から放射状に広がる火焔状出血を呈し,FAG 検査による 網膜内循環時間に遷延が認められることである(図2.5.1-6)。嚢胞様黄斑浮腫を伴うことが多く, 漿液性網膜剥離,網膜外層の膨化を伴うこともある(図2.5.1-7)。 図2.5.1-6 CRVOの眼底画像(左)及びFAG画像(右)67) 図2.5.1-7 CRVOのOCT画像72) 網膜静脈閉塞症に伴う黄斑浮腫に対する治療としては,眼局所に対する薬物治療,網膜光凝固, 硝子体手術が主に選択される。その他,有効性は証明されていないまま RVO に対して抗血小板 薬・抗凝固薬治療が行われていたが,近年,これらの治療は視力予後を悪化させると報告されて いる。虚血型のCRVO に対しては,ルベオーシス発生後の緑内障進展を汎網膜光凝固が有意に抑 えると大規模臨床試験により報告されており,本邦では予防的な光凝固の施行が行われている。
19 治療方法 1) (1)薬物治療 現在,網膜静脈閉塞症に伴う黄斑浮腫治療に臨床使用されている眼科用製剤を表2.5.1-8に示し た。硝子体内投与において,ルセンティス®硝子体内注射液46)及びアイリーア®硝子体内注射液47) は網膜静脈閉塞症に伴う黄斑浮腫の効能が承認されている。他に,網膜静脈閉塞症では適応が承 認されていないマキュエイド®硝子体内注用40mg 1),眼科適応が承認されていないケナコルト-A® 筋注用関節腔内用2),アバスチン®点滴静注用48)が使用されている。他の投与経路において,承認 されている薬剤はないが,副腎皮質ホルモン剤(TA)のテノン嚢下注射用剤,副腎皮質ホルモン 点眼剤,非ステロイド点眼剤等が使用されている。抗VEGF 療法は頻回の投与による患者,医療 者側への負担軽減のため,副腎皮質ホルモン剤などの併用療法の有効性検討の必要性が言及され ている。 表2.5.1-8 網膜静脈閉塞症に伴う黄斑浮腫治療に臨床使用されている眼科用製剤 治療薬の種類 販売名 承認状況 投与 経路 効能 効果 用法・用量 注2) 硝子体内投与 VEGF 阻害剤 ルセンティス®硝子体内注射液46) アイリーア®硝子体内注射液47) アバスチン®点滴静注用48) ○ ○ × ○ ○ × 1 ヶ月毎注3) 1~2 ヶ月毎注4) - 副腎皮質ホルモン剤 (TA) マキュエイド®硝子体内注用40mg 1) ケナコルト-A®筋注用関節腔内用2) ○ × × × - - テノン嚢下投与 副腎皮質ホルモン剤 (TA) マキュエイド®硝子体内注用40mg 1) ケナコルト-A®筋注用関節腔内用2) ×注1) × ×注1) × - - 点眼 副腎皮質ホルモン剤,非ステロイド剤 ○ × - 注1)本申請における適応 注2)効能・効果が承認されているもののみ記載 注3)1 ヶ月に 1 回視力等を測定し,その結果及び患者の状態を考慮し,本剤投与の要否を判断するこ と。投与開始後,視力が安定するまでは1 ヶ月毎に投与することが望ましい。 注 4)視力等の測定は 1 ヶ月に 1 回を目安に行い,その結果及び患者の状態を考慮し,本剤の要否に ついて慎重に判断すること。投与開始後,視力が安定するまでは,1 ヶ月に 1 回投与することが 望ましい。 (2)網膜光凝固 BRVO では,FAG による無灌流領域が 5 乳頭径を超える場合に無灌流領域に対する格子状光凝 固が網膜新生血管及び硝子体出血の発生を有意に抑えることが示され73),発症6 ヶ月以降が推奨 されている。しかし,視野を傷害し暗点を生じることが問題点として挙げられている。
20 CRVO では,虚血型において,新生血管に対する汎網膜光凝固が薦められている74)。黄斑浮腫 に対する汎網膜光凝固は,浮腫軽減の効果はあるが視力改善は得られないことが無作為前向き試 験で示されている75)。一方で,浮腫遷延例に対しては毛細血管瘤など漏出点が明らかなものに対 しては局所光凝固が行われることもある。 (3)硝子体手術 エビデンスのレベルは低いが,BRVO に対して交叉部血管外膜切開術76),CRVO に対して放射 状視神経乳頭切開術が行われている77)。
ぶどう膜炎
2.5.1.3.4
1. ぶどう膜炎の臨床的/病態生理学的側面 ぶどう膜炎は眼球の前部,中間部,後部において血管‐眼関門が破綻することで起こる炎症性 疾患である。ぶどう膜は眼球内の虹彩や毛様体,脈絡膜の総称であり,占有体積はわずかである が豊富な量の血液が流れている。このコンパクトかつ血管密度の高い構造から,膠原病や自己免 疫疾患,感染症等様々な要因でぶどう膜を介して眼内炎症が惹起される。 世界各国の統計をまとめた報告によると,ぶどう膜炎の年間新規発症患者数は 10 万人当たり 17~52 人,有病率は 10 万人当たり 38~714 人である。おおむね男女差はないが,年齢層別では 20 歳~59 歳に多いことが報告されている。また,ぶどう膜炎患者の約 35%が重度の視覚障害あ るいは社会的失明となっている78)。 ぶどう膜炎は細菌や真菌,ウイルスが原因である感染性ぶどう膜炎と,感染以外が原因である 非感染性ぶどう膜炎に分類される。非感染性ぶどう膜炎は,色素細胞に反応して炎症を起こす自 己免疫反応や,全身性の疾患の影響により合併症として誘発されるなど,根本的原因の解明は困 難とされている。 非感染性ぶどう膜炎は,肉芽腫性(図2.5.1-8a)と非肉芽腫性(図2.5.1-8b)に分類される79),80)。 肉芽腫性ぶどう膜炎は,マクロファージやリンパ球が血管に浸潤することで炎症を呈し,雪玉状 硝子体混濁や結節性血管炎を引き起こす。一方,非肉芽腫性ぶどう膜炎は,好中球が貪食を行い 浸潤することで炎症を呈し,びまん性の硝子体混濁や血管炎を引き起こすことが報告されている 81),82)。ぶどう膜炎の眼底所見は①脈絡膜炎,②網脈絡膜炎,③血管壁や血管周囲に炎症細胞が浸 潤する網膜血管炎81),83),④網膜視神経炎84),85)に要約され,どの疾患においても自己免疫や炎症性 物質の産生が関与することが報告されている(図2.5.1-9)。21 図2.5.1-8 a)肉芽腫性ぶどう膜炎眼底所見80) b)非肉芽腫性ぶどう膜炎眼底所見80) 図2.5.1-9 それぞれの眼底所見の写真86)-89) ぶどう膜炎に伴う黄斑浮腫の病態と治療 2. 病態 1) ぶどう膜炎に伴う黄斑浮腫は,ぶどう膜炎を基礎疾患として黄斑部に生じる組織浮腫のことで ある。黄斑部は網膜の中でも神経が密集し,視力に直接影響する部位であるため,黄斑部での浮 腫は直接視力低下につながる。 本邦では,非感染性ぶどう膜炎に起因する疾患としてサルコイドーシスや Vogt-小柳-原田病, ベーチェット病が代表的であり,非感染性ぶどう膜炎での三大ぶどう膜炎90)といわれている。ぶ どう膜炎を診察している主な大学病院36 施設の 2009 年度の臨床統計をまとめた報告91)によると, 非感染性ぶどう膜炎が75%,感染性ぶどう膜炎が 25%であった。また,非感染性ぶどう膜炎の原
22 因疾患として,サルコイドーシスが10.6%,Vogt-小柳-原田病が 7.0%,ベーチェット病が 3.9%を 占めている(表 2.5.1-9)。ベーチェット病においては,発症した患者のうち約 34%がびまん性黄 斑浮腫,約45%が嚢胞様黄斑浮腫を合併することが報告されている。 表2.5.1-9 日本でのぶどう膜炎の診察例数上位 7 位91) 症例 症例数(%) サルコイドーシス 407(10.6) Vogt-小柳-原田病 267(7.0) 急性前部ぶどう膜炎 250(6.5) 強膜炎 235(6.1) ヘルペス性虹彩炎 159(4.2) ベーチェット病 149(3.9) 細菌性眼内炎 95(2.5) ぶどう膜炎が遷延すると黄斑部に浮腫を生じる。炎症病巣におけるサイトカイン等の炎症性物 質産生細胞の浸潤及び壊死に陥った組織,浸出液等が眼底において貯留し滲出斑となる。特に黄 斑部は滲出斑が生じやすく,大部分は中心窩周囲の内顆粒層と外網状層に滲出液が溜まり神経線 維層にまで突出した嚢胞様黄斑浮腫となることが多い。また,中間部ぶどう膜炎患者から採取し たサイトカインから,血清中ではTNF-α が,房水中においては IL-1β,IL-6,IL-8,IL-10,IL-12, 及びCCL/MCP-1 の濃度が有意に上昇する結果が報告されている92)。日本人に代表的なぶどう膜 炎であるサルコイドーシス,Vogt-小柳-原田病,ベーチェット病の病態形成には Th1 サイトカイ ンとTh17 サイトカインが重要な役割を果たすことが数多く報告されることから 93),人種による 大きな違いはないと考えられる。 治療方法 2) ぶどう膜炎は種類や重症度によって治療法や治療の期間が異なる。局所療法として,炎症によ り虹彩が水晶体に癒着することで瞳が不整円となる虹彩後癒着を予防する散瞳薬点眼が処方され る。眼球の炎症が強い場合は,眼周囲の組織に注射する場合もある。眼の局所治療だけでは改善 がみられない場合や,眼の奥に強い炎症がみられる場合は,副腎皮質ステロイド薬や免疫抑制薬 の全身投与が行われる。副腎皮質ステロイド療法は症状の改善に伴い徐々に量を減らす一方,自 覚症状に改善がみられた場合に自己判断による薬剤の急激な減量や中止は炎症を再燃させるばか りではなく,死に至るショック症状を引き起こす危険性があり,注意が必要である。 ぶどう膜炎の原因が細菌等の病原微生物の場合,その病原微生物に有効な薬が使用される。し かし,ぶどう膜炎の多くは,原因疾患が判明しても根治が困難である。そのため,治療の目的は 炎症の抑制及び視力障害につながる合併症の予防である。
23 (1)薬物治療 1)ぶどう膜炎 現在,ぶどう膜炎の薬物治療としてステロイドの局所投与及び内服,コルヒチン,シクロスポ リン,抗TNF-α 抗体製剤等が広く使用されている(表2.5.1-10)14)-18)。多くのぶどう膜炎におい ては,当初からステロイドの全身治療を行うのではなく,できる限りテノン嚢下投与をはじめと する,ステロイドの局所治療が望ましいとされている。 ぶどう膜炎の中でも,非感染性ぶどう膜炎と感染性ぶどう膜炎で治療方針が異なる。非感染性ぶ どう膜炎は多くの場合,ステロイド投与が一般的に使用されているのに対し,感染性ぶどう膜炎 においてはステロイド投与も用いられるが,ステロイドの単独療法における感染症の悪化による 重篤な副作用が懸念される。そのため,確定診断前のステロイド投与は慎重に行うべきとの報告 がされている152)。 副腎皮質ステロイドは,眼内において血液網膜関門の破綻を改善し血液外滲出物の再吸収に貢 献する94)。また眼局所投与は副腎皮質ステロイド全身投与に伴う副作用の発現を回避できること や高濃度の副腎皮質ステロイドを直接眼局所に伝達できるといった長所を持つ。このことから, 多くのぶどう膜炎では当初からステロイドの全身治療に頼るのではなく,できる限りテノン嚢下 投与をはじめ,副腎皮質ステロイドの眼局所治療のみが望まれる。しかし,慢性疾患に対するス テロイドの長期投与は様々な副作用を引き起こすことが報告されている95)。 免疫抑制剤は炎症性疾患の活動性の抑制,寛解導入を目的としてステロイドと併用,あるいは ステロイドを減量するために用いられる。近年では抗TNF-α抗体であるインフリキシマブが単独, 又はステロイドとの併用療法で使用されている。抗TNF-α 抗体は,腫瘍壊死因子(Tumor Necrosis Factor)を標的にした生物学的製剤の一つで,炎症性サイトカインを治療標的分子として反応す る抗体である。作用としては①血中の可溶型TNF-α の中和,②受容体に結合した TNF-α の解離作 用,TNF-α 産生細胞に対する細胞障害作用が報告されている。一方,TNF-α は身体の感染防御に 対して重要な働きをしているため,感染症といった重篤な副作用が懸念される。 2)ぶどう膜炎に伴う黄斑浮腫 ぶどう膜炎に伴う黄斑浮腫に対する治療は,ぶどう膜炎の治療と同様に副腎皮質ステロイドの 局所治療が基本であり,点眼薬,眼軟膏,眼周囲注射などの投与方法がある。その中でトリアム シノロンアセトニドのテノン嚢下投与は中間部ぶどう膜炎,後部ぶどう膜炎に広く使用されてお り104),ぶどう膜炎に伴う黄斑浮腫の改善に有効である報告がされている105)-107)。
24 表2.5.1-10 ぶどう膜炎に臨床使用されている製剤 治療薬の種類 販売名 承認状況 投与 経路 効能 効果 用法・用量 注1) テノン嚢下投与 副腎皮質ホルモン剤 (TA) マキュエイド®硝子体内注用40mg 1) ケナコルト-A®筋注用関節腔内用2) ×注2) × ×注2) × - - 結膜下注射,球後注射 副腎皮質ホルモン剤 マキュエイド®硝子体内注用40mg 1) ケナコルト-A®筋注用関節腔内用2) リンデロン®注96) × × ○注3) × × ○注3) - - 下記参照注6) 点眼 副腎皮質ホルモン剤 非ステロイド剤 サンテゾーン®点眼液0.1%97) フルメトロン®点眼液0.1%98) ニフラン®点眼液0.1%99) ○注3) ○注3) ○注3) ○注3) ○注3) ○注3) 3~4 回/日,1~2 滴 2~4 回/日,1~2 滴 4 回/日,1~2 滴 内服 副腎皮質ホルモン剤 ○注3) ○注3) - 免疫抑制剤(シクロスポリン剤) ○注4) ○注4) - 静注 抗TNF-α 抗体剤 (インフリキシマブ) レミケード ®点滴静注用100) ○注5) ○注5) 下記参照注7) 注1) 効能・効果が承認されているもののみ記載 注2) 本申請における適応 注3) 前眼部ぶどう膜炎若しくはぶどう膜炎を含む炎症性疾患の対症療法として 注4)非感染性ぶどう膜炎(既存治療で効果不十分であり,視力低下のおそれのある活動性の中間部 又は後部の非感染性ぶどう膜炎に限る) 注5) ベーチェット病による難治性網膜ぶどう膜炎 注6) 結膜下注射:1 回 0.4~2 mg/0.2~0.5 mL,球後注射:1 回 0.8~4 mg/0.5~1.0 mL 注7) 体重 1 kg あたり 1 回 5 mg 投与。初回投与から 2 週,6 週に投与以後,8 週間隔で投与 (2)外科的手術 ぶどう膜炎に伴う硝子体混濁や黄斑浮腫に対して,治療の第一選択はステロイド局所治療が基 本である。一方,近年の眼科手術の手技向上により,以前は難しいとされたぶどう膜炎に伴う黄 斑浮腫に対し,硝子体手術等の外科的治療も積極的に選択されている。
25
アンメットメディカルニーズ
2.5.1.4
糖尿病黄斑浮腫
2.5.1.4.1
糖尿病黄斑浮腫に伴う黄斑浮腫の治療におけるアンメットメディカルニーズを以下に示した。 1. VEGF 阻害剤(ルセンティス®硝子体内注射液,アイリーア®硝子体内注射液,等) ・非常に高価であり,効果の持続が1~2 ヶ月と短く,投与回数が多くなることから,医師及 び患者の精神的・肉体的負担,保険及び患者の経済的負担が大きくなっている。 ・VEGF 阻害剤無効例が存在する。嚢胞様黄斑浮腫,漿液性網膜剥離を伴う浮腫に対する効 果に限定される。 ・脳梗塞,心疾患等の患者には重篤副作用発現のおそれがある。 ・硝子体手術後の無硝子体眼における効果持続期間が短くなる(硝子体手術の効果発現が約 半年以降であり,術中投与した場合,再発予防のための追加投与が必要になる)。 ・投与手技による眼内炎のリスクがあり,手術室を持たないクリニック等での投与が制限さ れる。 2. マキュエイド®硝子体内注用40mg ・効果持続期間が約3 ヶ月であり,繰り返し投与が必要となる。 ・眼圧上昇のリスクがあり,長期間の投薬や手術を必要とする場合がある。 ・白内障進展に伴う白内障手術が必要となる場合がある。 ・硝子体手術後の無硝子体眼における効果持続期間が短くなる。(硝子体手術の効果発現が約 半年以降であり,術中投与した場合,再発予防のための追加投与が必要になる) ・眼内に粒子が残存するため,投与後一過性の視力低下等,視力への影響がある場合がある。 また,光凝固前の投与には向かない。 ・投与手技による眼内炎のリスクがあり,手術室を持たないクリニック等での投与が制限さ れる。 3. 光凝固 ・局所性黄斑浮腫に対する網膜光凝固の有用性は証明されているが,主として視力悪化抑制 の目的で使用される。 ・中心窩誤照射,炎症,黄斑浮腫,硝子体出血,視野欠損等の処置後合併症のリスクがある。 ・効果発現までに数週間から数ヶ月の期間を要する。 4. 硝子体手術 ・びまん性黄斑浮腫の選択肢と考えられているが無効例もある。 ・浮腫改善効果発現までに半年から1 年の期間を要し,視力改善効果に乏しい。 ・硝子体手術後の無硝子体眼において,眼内における薬剤のクリアランスが亢進し,治療効 果の持続期間が短くなることから,術後の治療選択肢が狭まる。 ・難易度が高く,術後合併症(眼内炎,硝子体出血,再増殖,眼圧上昇等)のリスクがある。 ・侵襲性が大きく,手術室及び入院設備を持つ病院のみで施行可能となる。26
網膜静脈閉塞症
2.5.1.4.2
網膜静脈閉塞症に伴う黄斑浮腫の治療におけるアンメットメディカルニーズを以下に示した。 1. VEGF 阻害剤(ルセンティス®硝子体内注射液,アイリーア®硝子体内注射液,等) ・非常に高価であり,効果の持続が1~2 ヶ月と短く,投与回数が多くなることから,医師及 び患者の精神的・肉体的負担,保険及び患者の経済的負担が大きくなっている。 ・脳梗塞,心疾患等の患者には重篤副作用発現のおそれがある。 ・硝子体手術後の無硝子体眼における効果持続期間が短くなる。 ・投与手技による眼内炎のリスクがあり,手術室を持たないクリニック等での投与が制限さ れる。 2. 光凝固 ・網膜静脈分枝閉塞症に対する格子状光凝固の有用性は報告されているが,レーザー光凝固 単独での黄斑浮腫のコントロールは困難である。 ・急性期の出血の多い症例など実施困難な例がある。 ・中心窩誤照射,炎症,黄斑浮腫,硝子体出血,視野欠損等の処置後合併症のリスクがある。 3. 硝子体手術 ・網膜静脈分枝閉塞症から生じる硝子体出血や牽引性又は裂孔原性網膜剥離には有効である が黄斑浮腫に対する効果は限定的である。 ・種々の術式があり,手術成績についても一定していない。 ・硝子体手術後の無硝子体眼において,眼内における薬剤のクリアランスが亢進し,治療効 果の持続期間が短くなることから,術後の治療選択肢が狭まる。 ・難易度が高く,術後合併症(眼内炎,硝子体出血,再増殖,眼圧上昇等)のリスクがある。 ・侵襲性が大きく,手術室及び入院設備を持つ病院のみで施行可能となる。非感染性ぶどう膜炎
2.5.1.4.3
非感染性ぶどう膜炎に伴う黄斑浮腫の治療におけるアンメットメディカルニーズを以下に示し た。 1. 副腎皮質ホルモン剤(注射剤)(マキュエイド®硝子体内注用40mg,ケナコルト-A®筋注用関 節腔内用,リンデロン®注,等) ・効果持続期間が限定的なため,繰り返し投与が必要となる。 ・注射用液剤による後眼部への投与は持続性(滞留性)が期待できない。 ・硝子体注投与では眼内炎リスクがあり,添加剤を含む製剤の場合除去が必要になる。 ・眼圧上昇のリスクがあり,長期間の投薬や手術を必要とする場合がある。 ・白内障進展に伴う白内障手術が必要となる場合がある。 2. 副腎皮質ホルモン剤(内服剤) ・糖尿病,骨粗しょう症,易感染性,高血圧,脂質代謝異常,消化性潰瘍など重度の副作用28
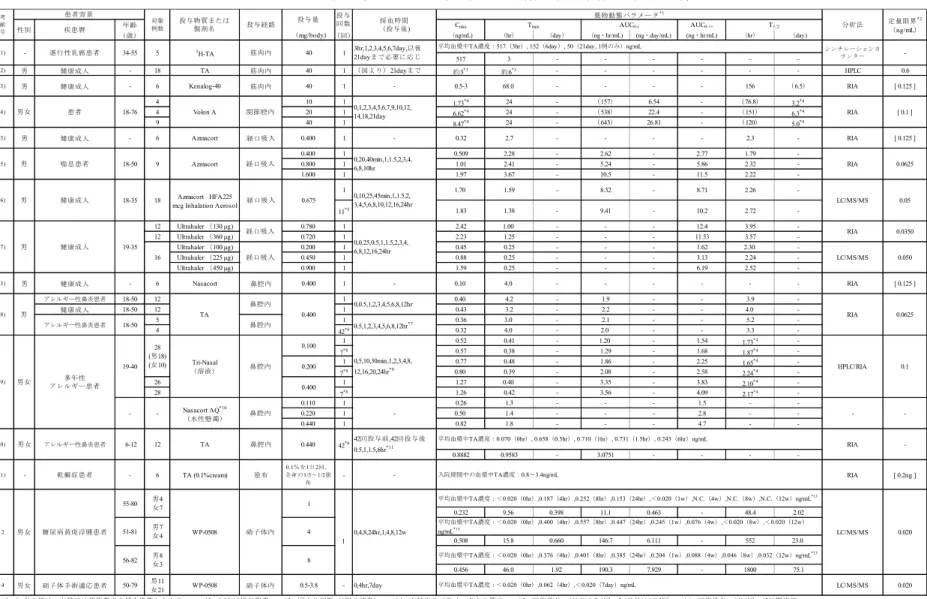
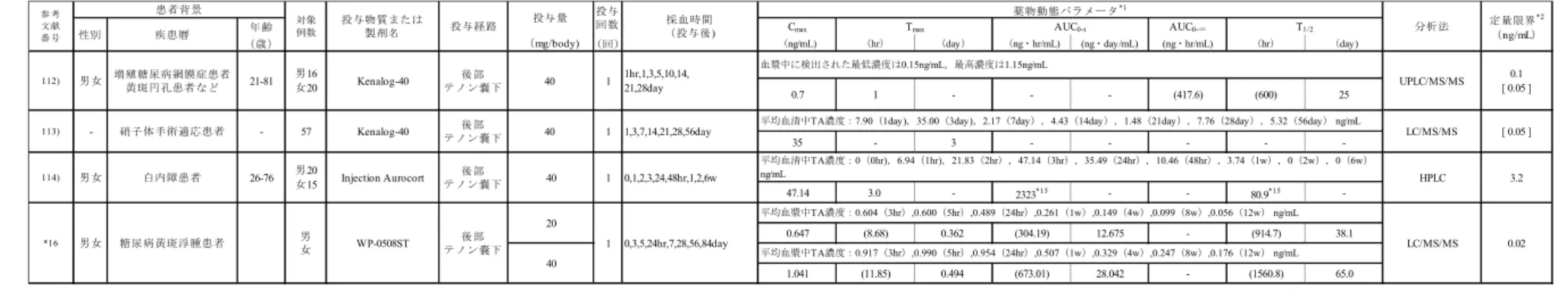
試験の概略
2.5.1.6
臨床試験一覧表を表2.5.1-12に示した。WP-0508ST(糖尿病黄斑浮腫)第 II/III 相試験
2.5.1.6.1
(資料番号:5.3.5.1-1,治験番号:WP0508-4003ST) WP0508-4003ST 試験は,糖尿病黄斑浮腫を有する患者を対象とした第 II/III 相,多施設共同無 作為化二重遮蔽(評価者遮蔽)並行群間比較試験である。本剤を94 例[40 mg 群(30 例),20 mg 群(32 例)又は非投与群(32 例)]の被験者の片眼に単回テノン嚢下投与し,有効性,安全性及 び血漿中薬物濃度を検討した。また,初回投与後12 週以降 1 年以内に基準を満たした 37 例[40 mg 群(8 例),20 mg 群(14 例)又は非投与群(15 例)]の被験者に対し 1~3 回の再投与(延べ 60 回)を行い,有効性,安全性及び血漿中薬物濃度を検討した。 初回投与後 12 週の経過観察の結果,主要評価項目(FAS)において,20 mg 群の投与後 12 週 最終評価時(エンドポイント)の時点で非投与群と比べ統計学的に有意な中心窩平均網膜厚改善 が認められた[p<0.025(Bonferroni);スクリーニング値を共変量とした共分散分析(以下同様)]。 一方で40 mg 群では統計学的に有意な改善は認められなかった(p=0.029)。PPS においては,両 群にて有意差が認められた(p<0.025)。 副次的評価項目である中心窩平均網膜厚及び最高矯正視力の推移(FAS)においては,40 mg 群,20 mg 群とも投与後観察期間のいずれの時点(初回投与後 1~12 週)においてもスクリーニ ング時と比べ有意な改善が認められ,エンドポイントにおける変化量平均は,中心窩平均網膜厚 では 40 mg 群で-97.8±153.20 μm,20 mg 群で-124.1±103.65 μm,最高矯正視力では 40 mg 群で 7.6±6.70 文字改善,20 mg 群で 6.1±8.52 文字改善した。投与後 12 週以降の追跡調査期間において も,中心窩平均網膜厚では40 mg 群で初回投与後 9 ヶ月,20 mg 群で初回投与後 12 ヶ月,最高矯 正視力では40 mg 群,20 mg 群で初回投与後 9 ヶ月時点まで有意な改善が維持された(p<0.05; 対応のあるt 検定)。 再投与における中心窩平均網膜厚(FAS)において,投与後 12 週の変化量は,40 mg 群で再投 与1 回目-55.1±154.41 μm(p=0.381,7 例),再投与 2 回目-50.5±64.88 μm(p=0.114,6 例),再投与 3 回目-2.0±53.74 μm(p=0.966,2 例)であった。20 mg では,再投与 1 回目-41.7±125.64 μm(p=0.236, 14 例),再投与 2 回目-17.0±28.00 μm(p=0.197,6 例),再投与 3 回目で 8.3±52.37 μm(p=0.808,3 例)であった。非投与群(40 mg)では,再投与 1 回目-108.1±61.88 μm(p<0.001,14 例),再投 与2 回目-81.0±73.63 μm(p=0.196,3 例),再投与 3 回目 30.0 μm(1 例)であった。 本剤40 mg が投与された非投与群を含めて,40 mg 群及び 20 mg のいずれの群においても再投 与 2 回目まで投与後 12 週における中心窩平均網膜厚の減少がみられ,少数例となった再投与 3 回目においても各症例の中心窩平均網膜厚の推移は初回から再投与2 回までと同様の推移であっ たことから,再投与においても本剤による中心窩平均網膜厚の改善効果が維持されていると考え られた。 再投与における最高矯正視力(FAS)において,投与後 12 週の変化量は,再投与 1 回目の 20 mg29 群及び非投与群(40 mg)は,再投与前検査時から再投与後 12 週に 5 文字以上の改善がみられ, 40 mg 群は明らかな改善がみられなかった。再投与 2 回以降はいずれの群においても明らかな最 高矯正視力の改善がみられなかった。 本試験の再投与を含む全試験期間において,重篤な有害事象が 40 mg 群 3 例(10.0%),20 mg 群 2 例(6.3%),非投与群 1 例(3.1%),非投与群(40 mg)1 例(6.7%)にみられた。因果関係 が否定されず副作用と判定されたのは40 mg 群 3 例(10.0%),20 mg 群 1 例(3.1%)であり,い ずれも水晶体混濁であった。中止に至った有害事象は糖尿病性網膜浮腫であり,非投与群で1 例 (3.1%),再投与 3 回目に 40 mg 群で 1 例(3.3%)であった。当該事象はいずれも追跡調査期間 中に軽快が確認され,治験薬との因果関係は否定された。 全試験期間における副作用発現は40 mg 群 15 例(50.0%),20 mg 群 9 例(28.1%),非投与群 2 例(6.3%),非投与群(40 mg)2 例(13.3%)であった。いずれかの群において発現率 5.0%以上 となった副作用は,眼圧上昇[40 mg 群 7 例(23.5%),20 mg 群 5 例(15.6%)] ,水晶体混濁[40 mg 群8 例(26.7%),20 mg 群 3 例(9.4%)],後嚢部混濁[20 mg 群 2 例(6.3%)]及び好中球百分率 増加[20 mg 群 2 例(6.3%)],角膜炎[非投与群(40 mg)1 例(6.7%)]であった。 本剤20 mg 及び 40 mg をテノン嚢下投与した場合の血漿中薬物濃度は,用量に依存して Tmaxは 長くなる傾向を,AUC0-tは増加する傾向を示し,また,Cmaxにおいても用量に依存した増加がみ られた。また,全身からの消失(T1/2)も硝子体内投与の場合と類似し比較的遅い傾向にあり,全 身への吸収量(投与量あたりのAUC0-t)は他の投与経路(硝子体内投与[5.3.5.4-1],筋肉内注射 101)-103)等)と同程度であると考えられた。眼以外の副作用発現率についても,マキュエイド®硝子 体内注用40mg(WP-0508)と同様であった。 以上より,20 mg 群にて副作用発現率,血漿中薬物濃度(Cmax)が低かったこと,主要評価項 目である初回投与後12 週最終評価時(エンドポイント)の中心窩平均網膜厚が非投与群と比較し て有意に改善(p<0.025)していたことから,本剤の臨床用量として 20 mg が妥当と考えられた。
WP-0508ST(網膜静脈閉塞症)第 III 相試験
2.5.1.6.2
(資料番号:5.3.5.2-1,治験番号:WP0508-4004ST) WP0508-4004ST 試験は,網膜静脈閉塞症に伴う黄斑浮腫を有する患者を対象とした第 III 相, 多施設共同非遮蔽非対照試験である。WP0508-4003ST 試験で至適用量とされた本剤 20 mg を用い て50 例の被験者の片眼に単回テノン嚢下投与し,投与後 12 ヶ月までの有効性及び安全性を検討 した。 主要評価項目である投与後12 週最終評価時(エンドポイント)における中心窩平均網膜厚のス クリーニング値からの変化量-150.0±179.12 μm であり,その 95%信頼区間は-200.9~-99.1 μm であ った。95%信頼区間の上限値は本剤の有効性の判断として臨床的に意味のある閾値として設定し た-100 μm を下回らなかったものの,その上限は設定した閾値と同程度の結果であることから, 本剤は有効と判断できるものと考えた。 副次的評価項目である中心窩平均網膜厚の推移において,各評価時点のスクリーニング時から30 の変化量は,投与後 1 週-84.0±114.07 μm,4 週-124.3±116.40 μm,8 週-167.9±154.95 μm,12 週 -192.1±155.50 μm,エンドポイント-150.0±179.12 μm であり,いずれの時点でも有意な浮腫改善を 示した[p<0.001;対応のある t 検定(以下同様)]。 投与後12 週検査終了後に併用禁止が解除された追跡調査期間の投与後 6 ヶ月,9 ヶ月,12 ヶ月 ( い ず れ も 39 例 ) のス ク リ ーニ ン グ時 か らの 中 心 窩平 均 網膜 厚 の変 化 量 はそ れ ぞれ -217.7±195.81 μm,-235.6±175.79 μm,-244.2±171.99 μm と有意な浮腫改善を示した(p<0.001)。 副次的評価項目であるスクリーニング時からの ETDRS による最高矯正視力の変化量は,投与 後1 週 1.7±8.11 文字,4 週 2.3±6.78 文字,8 週 3.9±7.07 文字,12 週 4.6±8.08 文字,エンドポイン ト2.6±9.77 文字であり,投与後 4 週,8 週及び 12 週で有意な文字数の改善がみられた(4 週で p =0.023,8 週及び 12 週で p=0.001)。 また,投与後6 ヶ月,9 ヶ月,12 ヶ月(いずれも 39 例)のスクリーニング時からの最高矯正視 力の変化量はそれぞれ5.4±8.27 文字,6.1±8.35 文字,6.2±8.96 文字であった(いずれも p<0.001)。 投与後12 ヶ月において重篤な有害事象及び重度の有害事象はみられなかった。投与後 12 ヶ月 における副作用発現は21 例(42.0%)であった。そのうち発現率 5.0%以上の副作用は,眼圧上昇 が7 例(14.0%),結膜充血が 6 例(12.0%),結膜浮腫及び血中コルチゾール減少が各 5 例(10.0%), 血中トリグリセリド増加が4 例(8.0%)であった。 中止に至った有害事象は,投与後12 週以内に 7 例(網膜静脈閉塞 4 例,一過性視力低下 2 例, 一過性視力低下及び黄斑浮腫1 例)の発現がみられた。これらの事象はいずれも現病の悪化とさ れた。一過性視力低下の2 例については,それぞれ発現から 21 日後,28 日後に消失が確認され た。網膜静脈閉塞の4 例については,発現から 286~331 日後に消失(2 例)又は軽快(2 例)が 確認された。一過性視力低下及び黄斑浮腫の1 例については発現から 331 日後に消失が確認され た。 以上より,本剤20 mg は,有効性においてエンドポイントである中心窩平均網膜厚の変化量の 95%信頼区間の上限値が有効性の判断として臨床的に意味のある閾値として設定した-100 μm と 同程度であること,安全性において臨床的に問題となる有害事象はみられなかったことから,臨 床用量として妥当と考えられた。