版番号:
2.5 臨床に関する概括評価
ネキシウム
®カプセル
ネキシウム
®懸濁用顆粒分包
本資料に記載された情報に係る権利はアストラゼネカ株式会社に帰属します。弊社の事前の承 諾なく本資料の内容を他に開示することは禁じられています。目次
頁
目次... 2 略語及び専門用語一覧表... 5 2.5.1 製品開発の根拠... 7 2.5.1.1 はじめに... 7 2.5.1.1.1 予定する効能・効果及び用法・用量... 7 2.5.1.1.2 薬剤の概要... 12 2.5.1.2 薬剤開発に至った科学的背景... 12 2.5.1.2.1 小児における海外の承認状況... 12 2.5.1.2.2 海外における懸濁用顆粒剤の承認状況... 13 2.5.1.3 本邦における疾患及び医学的ニーズ... 14 2.5.1.3.1 消化管酸関連疾患について... 14 2.5.1.3.1.1 胃食道逆流症... 14 2.5.1.3.1.2 消化性潰瘍... 15 2.5.1.3.1.3 Zollinger-Ellison 症候群... 16 2.5.1.3.2 懸濁用顆粒剤の開発について... 16 2.5.1.4 臨床試験計画の概要... 17 2.5.1.4.1 開発戦略... 17 2.5.1.4.2 臨床データパッケージ... 17 2.5.1.4.2.1 評価資料... 17 2.5.1.4.2.2 参考資料... 18 2.5.1.5 治験相談... 20 2.5.1.5.1 相談(オーファン以外)(受付番号: P2340) ... 21 2.5.1.5.2 相談(オーファン以外)(受付番号:P4100)... 22 2.5.1.5.3 相談(受付番号:P3091)... 22 2.5.1.6 医薬品の臨床試験の実施の基準(GCP)の遵守 ... 22 2.5.2 生物薬剤学に関する概括評価... 22 2.5.2.1 カプセル製剤と懸濁用顆粒剤との生物学的同等性... 22 2.5.2.2 含量違いの生物学的同等性... 23 2.5.3 臨床薬理に関する概括評価... 24 2.5.3.1 国内第I/III 相試験(D961TC00002 試験)(評価資料)... 24 2.5.3.1.1 国内第I/III 相試験(D961TC00002 試験)のデザイン ... 24 2.5.3.1.2 国内第I/III 相試験(D961TC00002 試験)の人口統計学的及び他の基 準値の特性... 26 2.5.3.2 薬物動態試験成績... 262.5.3.3 薬力学試験成績... 29 2.5.4 有効性の概括評価... 30 2.5.4.1 有効性の評価に用いた臨床試験... 30 2.5.4.2 国内第I/III 相試験(D961TC00002 試験)(評価資料)の有効性の結 果... 31 2.5.4.3 海外探索的治療試験(SH-NEC-0001 試験及び SH-NEC-0002 試験) 及び海外第III 相試験(D9614C00097 試験、D9614C00098 試験及び D9614C00096 試験)(参考資料) ... 32 2.5.4.4 有効性に関する全般的結論... 33 2.5.5 安全性の概括評価... 33 2.5.5.1 安全性評価に関する概要... 33 2.5.5.2 データの出典及び曝露... 33 2.5.5.3 国内第I/III 相試験(D961TC00002 試験)及び国内第Ⅰ相臨床薬理試 験(D961TC00004 試験)(評価資料)の安全性の結果 ... 35 2.5.5.3.1 国内第I/III 相試験(D961TC00002 試験)... 35 2.5.5.3.2 国内成人第Ⅰ相臨床薬理試験(D961TC00004 試験) ... 36 2.5.5.4 成人及び参考資料として提出した海外小児試験との安全性の比較... 36 2.5.5.4.1 日本人成人患者との比較... 36 2.5.5.4.2 海外小児患者との比較... 37 2.5.5.4.3 CYP2C19 遺伝子型による比較... 37 2.5.5.4.4 小児を対象とする薬剤疫学試験... 37 2.5.5.4.5 市販後成績データとの比較... 38 2.5.5.5 国内成人第Ⅰ相臨床薬理試験(D961TC00001 試験)(参考資料)の 安全性の結果... 39 2.5.5.6 安全性に関する全般的結論... 39 2.5.6 ベネフィットとリスクに関する結論... 40 2.5.6.1 ベネフィット... 40 2.5.6.2 リスク... 41 2.5.6.3 ベネフィットとリスクに関する全般的結論... 41 2.5.7 参考文献... 41
表目次
表 1 米国におけるD961H の小児に対する GERD 適応症及び用法・用量 ... 13 表 2 EU における D961H の小児に対する GERD 適応症及び用法・用量... 13表 4 臨床データパッケージ:参考資料... 18 表 5 懸濁用顆粒剤及びカプセル製剤を20 mg の用量で 1 日 1 回 5 日間反 復経口投与したときの薬力学的パラメータと製剤間の比較 (D961TC00004)... 23 表 6 目的及び評価項目(D961TC00002 試験) ... 24 表 7 治療群(D961TC00002 試験) ... 25 表 8 小児患者にD961H を 1 日 1 回 5 日間以上反復経口投与したときの投 与後12 時間における胃内 pH>4 の時間率、胃内 pH>3 の時間率及び 胃内pH の中央値 ... 29 表 9 有効性の評価資料とした試験... 30 表 10 有効性の参考資料とした試験... 30 表 11 安全性の評価資料とした試験... 33 表 12 安全性の参考資料とした試験... 34 表 13 累積曝露(20 年 月 日現在)、及び市販後使用経験における 有害事象報告件数(2016 年 3 月 10 日現在) ... 39
図目次
図 1 小児及び成人にD961H を 10 mg、20 mg あるいは 40 mg の用量で 1 日1 回反復経口投与したときの定常状態におけるエソメプラゾールの AUCτ の個体値に基づく変動幅の比較 ... 27 図 2 小児及び成人にD961H を 10 mg、20 mg あるいは 40 mg の用量で 1 日1 回反復経口投与したときの定常状態におけるエソメプラゾールの Cmaxの個体値に基づく変動幅の比較... 28 図 3 小児及び成人におけるD961H(10 mg、20 mg 及び 40 mg)を 1 日 1 回反復経口投与したときの AUCτと胃内pH>4 の時間率との関係... 30略語及び専門用語一覧表
本概要で使用する略語及び専門用語を以下に示す。 略語及び専門用語 用語の説明
AU Anastomotic ulcer:吻合部潰瘍
AUC Area under the plasma concentration-time curve from time zero to infinity: 投与後無限大時間までの血漿中濃度-時間曲線下面積
AUCt Area under the plasma concentration-time curve from time zero to time of last quantifiable concentration:投与後最終測定可能時点 t までの血漿中濃度-時間 曲線下面積
AUCτ Area under the plasma concentration-time curve during a dosing interval: 投与間隔(τ)における血漿中濃度-時間曲線下面積
BE Bioequivalence:生物学的同等性
CL/F Apparent oral clearance:経口クリアランス Cmax Maximum plasma concentration:最高血漿中濃度 CYP Cytochrome P450:チトクロム P450
D961H Esomeprazole magnesium hydrate:エソメプラゾールマグネシウム水和物 DU Duodenal ulcer:十二指腸潰瘍
EE Erosive esophagitis:びらん性食道炎
EGD Esophagogastroduodenoscopy:上部消化管内視鏡検査 EU European Union:欧州連合
FAS Full analysis set:最大の解析対象集団
FDA The US Food and Drug Administration:米国食品医薬品局 GCP Good Clinical Practice:医薬品の臨床試験の実施に関する基準 GERD Gastroesophageal reflux disease:胃食道逆流症
GU Gastric ulcer:胃潰瘍
H2RA H2 receptor antagonist:H2 受容体拮抗薬 hetero EM Heterozygote extensive metaboliser homo EM Homozygote extensive metaboliser
HPMC Hydroxypropyl methylcellulose:ヒプロメロース H. pylori Helicobacter pylori:ヘリコバクター・ピロリ
ICH International Conference on Harmonisation:日米欧医薬品規制調和国際会議 MALT Mucosa-associated lymphoid tissue
NERD Non-erosive reflux disease:非びらん性胃食道逆流症
NSAID Non-steroidal anti-inflammatory drug:非ステロイド性消炎鎮痛剤 OPZ Omeprazole:オメプラゾール
PD Pharmacodynamics:薬力学
PK Pharmacokinetic (s):薬物動態学/薬物動態/体内動態 PM Poor metaboliser
略語及び専門用語 用語の説明
RE Reflux esophagitis:逆流性食道炎 t½ Elimination half-life:消失半減期
Vz/F Apparent volume of distribution during terminal phase:経口投与後の終末相に基づ く分布容積
ZES Zollinger-Ellison syndrome:Zollinger-Ellison 症候群 CYP2C19 遺伝子型:
homo EM hetero EM PM
CYP2C19*2 及び CYP2C19*3 の有無に基づく CYP2C19 遺伝子型の分類 homo EM (homo Extensive Metaboliser): *1/*1
hetero EM (hetero Extensive Metaboliser): *1/*2、*1/*3 PM (Poor Metaboliser): *2/*2、*3/*3、*2/*3
胃内pH>4 の時間率 Percentage of time with intragastric pH>4 during 12 or 24 hours:12 時間又は 24 時 間のうち胃内pH が 4 を上回っていた時間の割合
2.5.1
製品開発の根拠
2.5.1.1
はじめに
2.5.1.1.1
予定する効能・効果及び用法・用量
今回、エソメプラゾールマグネシウム水和物(D961H)に関し、以下の 2 つの承認申請を行う に至った。 (a) 申請区分(8)剤形追加に係る医薬品(再審査期間中のもの)としての承認申請 懸濁用顆粒剤の剤形を追加する。 (b) 小児に対する以下の効能・効果、用法・用量の追加を目的とした承認事項一部変更 承認申請(申請区分(6)新用量医薬品) 効能・効果(案) 臨床試験データに基づき、以下の下線部を追加した効能・効果を予定している。 <ネキシウムカプセル10 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、非びらん性胃食道逆流症、Zollinger-Ellison 症候群、非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低 用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 ○下記におけるヘリコバクター・ピロリの除菌の補助 胃潰瘍、十二指腸潰瘍、胃MALT リンパ腫、特発性血小板減少性紫斑病、早期胃癌に対する内 視鏡的治療後胃、ヘリコバクター・ピロリ感染胃炎 <ネキシウムカプセル20 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、Zollinger-Ellison 症候群、非ステロイド 性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低用量アスピリン投与時におけ る胃潰瘍又は十二指腸潰瘍の再発抑制 ○下記におけるヘリコバクター・ピロリの除菌の補助 胃潰瘍、十二指腸潰瘍、胃MALT リンパ腫、特発性血小板減少性紫斑病、早期胃癌に対する内 視鏡的治療後胃、ヘリコバクター・ピロリ感染胃炎 <ネキシウム懸濁用顆粒分包10 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、非びらん性胃食道逆流症、 Zollinger-Ellison 症候群、非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低 用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制○下記におけるヘリコバクター・ピロリの除菌の補助 胃潰瘍、十二指腸潰瘍、胃MALT リンパ腫、特発性血小板減少性紫斑病、早期胃癌に対する内 視鏡的治療後胃、ヘリコバクター・ピロリ感染胃炎 <ネキシウム懸濁用顆粒分包20 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、Zollinger-Ellison 症候群、非ステロイド 性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、低用量アスピリン投与時におけ る胃潰瘍又は十二指腸潰瘍の再発抑制 ○下記におけるヘリコバクター・ピロリの除菌の補助 胃潰瘍、十二指腸潰瘍、胃MALT リンパ腫、特発性血小板減少性紫斑病、早期胃癌に対する内 視鏡的治療後胃、ヘリコバクター・ピロリ感染胃炎 用法・用量(案) 臨床試験データに基づき、以下の下線部を追加した用法・用量を予定している。 <ネキシウムカプセル10 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison 症候群 成人 通常、成人にはエソメプラゾールとして1 回 20 mg を 1 日 1 回経口投与する。なお、通常、胃 潰瘍、吻合部潰瘍では8 週間まで、十二指腸潰瘍では 6 週間までの投与とする。 小児 通常、1 歳以上の幼児及び小児にはエソメプラゾールとして、体重 20 kg 未満では 1 回 10 mg を、体重20 kg 以上では症状に応じて 1 回 10~20 mg を 1 日 1 回経口投与する。なお、通常、胃 潰瘍、吻合部潰瘍では8 週間まで、十二指腸潰瘍では 6 週間までの投与とする。 ○逆流性食道炎 成人 通常、成人にはエソメプラゾールとして 1 回 20 mg を 1 日 1 回経口投与する。なお、通常、8 週間までの投与とする。 さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1 回 10~20 mg を 1 日 1 回 経口投与する。 小児 通常、1 歳以上の幼児及び小児にはエソメプラゾールとして、体重 20 kg 未満では 1 回 10 mg を、体重 20 kg 以上では症状に応じて 1 回 10~20 mg を 1 日 1 回経口投与する。なお、通常、8 週間までの投与とする。 ○非びらん性胃食道逆流症 成人 通常、成人にはエソメプラゾールとして 1 回 10 mg を 1 日 1 回経口投与する。なお、通常、4 週間までの投与とする。
小児 通常、1 歳以上の幼児及び小児にはエソメプラゾールとして、1 回 10 mg を 1 日 1 回経口投与 する。なお、通常、4 週間までの投与とする。 ○非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を 1 日 1 回経口投与する。 ○低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を 1 日 1 回経口投与する。 ○ヘリコバクター・ピロリの除菌の補助 通常、成人にはエソメプラゾールとして1 回 20 mg、アモキシシリン水和物として 1 回 750 mg (力価)及びクラリスロマイシンとして1 回 200 mg(力価)の 3 剤を同時に 1 日 2 回、7 日間経 口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、 1 回 400 mg(力価)1 日 2 回を上限とする。 プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によ るヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人 にはエソメプラゾールとして1 回 20 mg、アモキシシリン水和物として 1 回 750 mg(力価)及び メトロニダゾールとして1 回 250 mg の 3 剤を同時に 1 日 2 回、7 日間経口投与する。 <ネキシウムカプセル20 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison 症候群 成人 通常、成人にはエソメプラゾールとして1 回 20 mg を 1 日 1 回経口投与する。なお、通常、胃 潰瘍、吻合部潰瘍では8 週間まで、十二指腸潰瘍では 6 週間までの投与とする。 小児 通常、体重 20 kg 以上の幼児及び小児にはエソメプラゾールとして、症状に応じて 1 回 10~ 20 mg を 1 日 1 回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では 8 週間まで、十二指腸潰 瘍では6 週間までの投与とする。 ○逆流性食道炎 成人 通常、成人にはエソメプラゾールとして 1 回 20 mg を 1 日 1 回経口投与する。なお、通常、8 週間までの投与とする。 さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1 回 10~20 mg を 1 日 1 回 経口投与する。 小児 通常、体重 20 kg 以上の幼児及び小児にはエソメプラゾールとして、症状に応じて 1 回 10~ 20 mg を 1 日 1 回経口投与する。なお、通常、8 週間までの投与とする。 ○非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を 1 日 1 回経口投与する。
○低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を 1 日 1 回経口投与する。 ○ヘリコバクター・ピロリの除菌の補助 通常、成人にはエソメプラゾールとして1 回 20 mg、アモキシシリン水和物として 1 回 750 mg (力価)及びクラリスロマイシンとして1 回 200 mg(力価)の 3 剤を同時に 1 日 2 回、7 日間経 口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、 1 回 400 mg(力価)1 日 2 回を上限とする。 プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によ るヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人 にはエソメプラゾールとして1 回 20 mg、アモキシシリン水和物として 1 回 750 mg(力価)及び メトロニダゾールとして1 回 250 mg の 3 剤を同時に 1 日 2 回、7 日間経口投与する。 <ネキシウム懸濁用顆粒分包10 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison 症候群 成人 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、胃潰瘍、吻合部潰瘍では8 週間まで、十二指腸潰瘍では 6 週間までの投与とする。 小児 通常、1 歳以上の幼児及び小児にはエソメプラゾールとして、体重 20 kg 未満では 1 回 10 mg を、体重20 kg 以上では症状に応じて 1 回 10~20 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、胃潰瘍、吻合部潰瘍では8 週間まで、十二指腸潰瘍では 6 週間までの投与とする。 ○逆流性食道炎 成人 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、8 週間までの投与とする。 さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1 回 10~20 mg を用時水で 懸濁して1 日 1 回経口投与する。 小児 通常、1 歳以上の幼児及び小児にはエソメプラゾールとして、体重 20 kg 未満では 1 回 10 mg を、体重20 kg 以上では症状に応じて 1 回 10~20 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、8 週間までの投与とする。 ○非びらん性胃食道逆流症 成人 通常、成人にはエソメプラゾールとして1 回 10 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、4 週間までの投与とする。 小児 通常、1 歳以上の幼児及び小児にはエソメプラゾールとして、1 回 10 mg を用時水で懸濁して 1 日1 回経口投与する。なお、通常、4 週間までの投与とする。
○非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 ○低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 ○ヘリコバクター・ピロリの除菌の補助 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して、アモキシシリン水和 物として 1 回 750 mg(力価)及びクラリスロマイシンとして 1 回 200 mg(力価)の 3 剤を同時 に 1 日 2 回、7 日間経口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量するこ とができる。ただし、1 回 400 mg(力価)1 日 2 回を上限とする。 プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によ るヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人 にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して、アモキシシリン水和物として 1 回 750 mg(力価)及びメトロニダゾールとして 1 回 250 mg の 3 剤を同時に 1 日 2 回、7 日間経口投 与する。 <ネキシウム懸濁用顆粒分包20 mg> ○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison 症候群 成人 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、胃潰瘍、吻合部潰瘍では8 週間まで、十二指腸潰瘍では 6 週間までの投与とする。 小児 通常、体重 20 kg 以上の幼児及び小児にはエソメプラゾールとして、症状に応じて 1 回 10~ 20 mg を用時水で懸濁して 1 日 1 回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では 8 週間 まで、十二指腸潰瘍では6 週間までの投与とする。 ○逆流性食道炎 成人 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 なお、通常、8 週間までの投与とする。 さらに再発・再燃を繰り返す逆流性食道炎の維持療法においては、1 回 10~20 mg を用時水で 懸濁して1 日 1 回経口投与する。 小児 通常、体重 20 kg 以上の幼児及び小児にはエソメプラゾールとして、症状に応じて 1 回 10~ 20 mg を用時水で懸濁して 1 日 1 回経口投与する。なお、通常、8 週間までの投与とする。 ○非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。 ○低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して 1 日 1 回経口投与する。
○ヘリコバクター・ピロリの除菌の補助 通常、成人にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して、アモキシシリン水和 物として 1 回 750 mg(力価)及びクラリスロマイシンとして 1 回 200 mg(力価)の 3 剤を同時 に 1 日 2 回、7 日間経口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量するこ とができる。ただし、1 回 400 mg(力価)1 日 2 回を上限とする。 プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの 3 剤投与によ るヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人 にはエソメプラゾールとして1 回 20 mg を用時水で懸濁して、アモキシシリン水和物として 1 回 750 mg(力価)及びメトロニダゾールとして 1 回 250 mg の 3 剤を同時に 1 日 2 回、7 日間経口投 与する。
2.5.1.1.2
薬剤の概要
D961H は、AstraZeneca R&D Mӧlndal(スウェーデン)において開発された、オメプラゾール (OPZ)の一方の光学異性体(S-体)のみを含有するプロトンポンプ阻害剤(PPI)である。ネキ シウム(D961H の日本における販売名)錠 20 mg 及び 40 mg は、成人を対象として 2000 年 3 月 10 日にスウェーデンで初めて承認され、その後、欧州連合(EU)、米国、カナダ、オーストラ リア、南アメリカ及びアフリカの大半の国々、並びに中国を含むアジア諸国など世界 125 カ国以 上で承認されている。20 年 月 日までに処方されたD961H 経口製剤の累積曝露は、全世界 で合計約1 億 2000 万患者・年であると推定される。 本邦では国内臨床開発プログラムに基づいて、ネキシウムカプセル10 mg 及び 20 mg は胃潰瘍 (GU)、十二指腸潰瘍(DU)、吻合部潰瘍(AU)、逆流性食道炎(RE)、非びらん性胃食道 逆流症(NERD、ネキシウムカプセル 10 mg のみ)、Zollinger-Ellison 症候群(ZES)、非ステロ イド性抗炎症薬(NSAID)投与時における GU 又は DU の再発抑制等を適応症として 2011 年 7 月1 日に承認された。その後、ネキシウムカプセル 10 mg 及び 20 mg は、2012 年 6 月に「低用量 アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制」、2013 年 2 月に「ヘリコバクタ ー・ピロリ感染胃炎におけるヘリコバクター・ピロリの除菌の補助」の適応症が追加承認された。 本邦においては合計約 530 万患者・年の患者に D961H が投与されている(2016 年 2 月 29 日時 点)。
2.5.1.2
薬剤開発に至った科学的背景
2.5.1.2.1
小児における海外の承認状況
D961H の国際小児臨床プログラムのデータを基に、小児の胃食道逆流症(GERD)の適応症が 世界75 カ国以上において承認されている。 D961H の国際小児臨床プログラムにおいて最初に検討した年齢群は、成人と類似していると考 えられる12 歳以上 17 歳以下であった。本プログラムに基づき、12 歳以上の患者に対する用法・ 用量が2006 年に EU、米国、カナダで、その後、オーストラリア、韓国、台湾、ベトナム、タイ、 フィリピン、カンボジア、マレーシア、シンガポール、インドネシア等のアジア諸国を含む世界 各国において承認された。 D961H の国際小児臨床プログラムで次に検討した年齢群は、1 歳以上 11 歳以下であった。本 プログラムに基づき、1 歳以上 11 歳以下の患者に対する用法・用量及び 1 歳以上 11 歳以下を対象とする懸濁用顆粒剤が、EU、米国、カナダ、及び、オーストラリア、韓国、台湾、ベトナム、 フィリピン、タイ、インドネシア等のアジア諸国を含む世界各国において承認された。 3 番目に検討した年齢群は、1 歳未満であった。本プログラムの有効性の評価において PK/PD データを基に成人及び小児の静注データをブリッジングすることにより、米国、メキシコ及びフ ィリピンで承認された。 米国及び EU における D961H の小児に対する GERD 適応症及び用法・用量を表 1、表 2に示 す。 表 1 米国におけるD961H の小児に対する GERD 適応症及び用法・用量 適応症 用量 投与期間 12~17 歳 EE の治癒 20 mg 又は 40 mg 1 日 1 回 4~8 週間まで 症候性GERD の短期投与 20 mg 1 日 1 回 4 週間まで 1~11 歳* 症候性GERD の短期投与 10 mg 1 日 1 回 8 週間まで EE の治癒、体重 20 kg 未満 10 mg 1 日 1 回 8 週間まで EE の治癒、体重 20 kg 以上 10 mg 又は 20 mg 1 日 1 回 8 週間まで 1 カ月~ 1 歳未満** EE、体重 3 kg 以上 5 kg 以下 2.5 mg 1 日 1 回 6 週間まで EE、体重 5 kg 超 7.5 kg 以下 5 mg 1 日 1 回 6 週間まで EE、体重 7.5 kg 超 12 kg 以下 10 mg 1 日 1 回 6 週間まで GERD:胃食道逆流症、EE:びらん性食道炎 * 1 mg/kg/日を超える用量は検討していない。 ** 1.33 mg/kg/日を超える用量は検討していない。 表 2 EU における D961H の小児に対する GERD 適応症及び用法・用量 適応症 用量 投与期間 12~17 歳 RE 40 mg 1 日 1 回 4 週間まで(治癒しない/ 症状が残る場合は更に4 週間) 食道炎治癒後の再発防止のため の長期維持療法 20 mg 1 日 1 回 症候性GERD 20 mg 1 日 1 回 4 週間まで 1~11 歳* RE、体重 10 kg 以上 20 kg 未満 10 mg 1 日 1 回 8 週間まで RE、体重 20 kg 以上 10 mg 又は 20 mg 1 日 1 回 8 週間まで 症候性GERD 10 mg 1 日 1 回 8 週間まで GERD:胃食道逆流症、RE:逆流性食道炎 * 1 mg/kg/日を超える用量は検討していない。
2.5.1.2.2
海外における懸濁用顆粒剤の承認状況
海外では既にD961H の懸濁用顆粒剤が、EU、US を含む世界 75 カ国以上で承認されている。2.5.1.3
本邦における疾患及び医学的ニーズ
本邦においても、消化管酸関連疾患を有する小児患者に対して PPI を使用することの医学的ニ ーズがあり、第1回小児薬物療法検討会議(平成18 年 3 月 30 日)の開催にあたってとりまとめ られた要望においても PPI に対してヘリコバクター・ピロリの除菌の補助及び胃食道逆流に対し て日本小児栄養消化器肝臓学会から要望が出されている。しかし、本邦では小児の消化管酸関連 疾患を適応症として承認されている医薬品は H2RA のロキサチジン酢酸エステル塩酸塩(2011 年 1 月小児適応追加承認)のみであり、成人で第一選択薬である PPI については、現時点で既承 認の製品はない。また、ロキサチジン酢酸エステル塩酸塩の適応症は小児(7 歳以上 15 歳未満) に対してのみであり、幼児(1 歳以上 7 歳未満)に対する適応症は有していない。D961H は、同じ PPI である OPZ と比較してチトクロム P450(CYP)2C19 遺伝子多型による影 響を受けにくい。また、D961H には今回あわせて剤形追加の申請をする懸濁用顆粒剤があり、カ プセル剤又は錠剤のみの他の PPI よりも低年齢児等のカプセル剤や錠剤の服用が困難な患者に対 しても大きな利点を有している。 本項では、GERD、消化性潰瘍、ZES など今回申請する適応症に関連した消化管酸関連疾患に ついての背景、治療、及び医学的ニーズについて、並びに懸濁用顆粒剤の開発について述べる。
2.5.1.3.1
消化管酸関連疾患について
2.5.1.3.1.1
胃食道逆流症
胃食道逆流は、胃内容物の食道又は食道外の部位への逆流と定義されている。下部食道括約筋 の一過性の弛緩が原因と考えられ、健康な新生児や乳児における生理学的な事象として一般的に 報告されている(Vandenplas and Sacré-Smits 1987、Gustafsson and Tibbling 1988、Vandenplas et al 1991、Vandenplas et al 2009)。単純な生理的逆流が、胃内容物の逆流により不快な症状や合併症 が引き起こされた場合、疾患(GERD)に発展する(Vakil et al 2006、Sherman et al 2009)。逆流 物の酸性度や酸活性化されたペプシンの存在が主な刺激要因となって粘膜の炎症や症状を引き起 こし、また GERD による長期の影響をもたらす可能性がある(Orenstein 1991、Kawahara et al 1997、Gunasekaran et al 2002、Kawahara et al 2002、Gold 2004a、Gold 2004b、Vandenplas et al 2009)。生理的な逆流から病的なGERD への移行には複数の事象が関連しているが、食道の蠕動運動の 異常、下部食道括約筋の高頻度の緊張低下や解剖学的欠陥など、いずれも刺激性の胃内容物の食 道への接触を増加させるものである。GERD はまた、胃内容物排出の遅延及び胃の膨満感により 更に複雑になる場合もある(Werlin et al 1980、Orenstein 1991、Vandenplas et al 2009)。びらん性 食道炎等の合併症を含む GERD の病態生理、臨床経過及び兆候は、成人と小児(1 歳以上)で類 似しているとのコンセンサスが得られており(Youssef and Orenstein 2001、Gilger et al 2008、Gold et al 2007)、成人の有効性データを小児集団に外挿する根拠となっている。
小児のGERD で一般的な臨床兆候は、嘔吐、体重増加不良、嚥下障害、腹痛又は胸骨下痛、及 び呼吸障害である。また、これらの他に年長の小児及び思春期の患者においては、胸やけや酸逆 流など成人にみられる症状・兆候が報告されている。最も高頻度にみられる合併症は RE である (Euler and Ament 1977、Orenstein 1991、Hassall 1997、Richter 1997、DeMeester et al 1999、 Rudolph et al 2001、Youssef and Orenstein 2001、Gupta et al 2006、Vakil et al 2006、Sherman et al 2009、Vandenplas et al 2009)。
GERD は小児集団においても一般的に認められる。米国の 3~17 歳の小児における GERD 症状 の発現率は1.4~8.2%であるが(Nelson et al 2000、Gold 2004a、Gold 2004b)、14~18 歳の高校生 を対象とした最近の調査では 9%以上に“顕著な”GERD 症状(週 1 回以上)がみられるという結 果であった(Gunasekaran et al 2008)。日本では成人の 10%程度がびらん性 GERD を有しており、 症状から診断される症例を加味するとGERD 患者はさらに多いと推定されている(胃食道逆流症 (GERD)診療ガイドライン 2015 改訂第 2 版)。日本の小児においても米国と同様に有病率は低 くないと考えられる。更に、小児及び思春期のGERD は、消化器症状、耳鼻咽喉症状、呼吸器症 状、神経学的症状、アレルギー症状それぞれにおいて患児及びその両親の生活の質に負の影響を もたらしていると考えられるとの報告がある(Tolia et al 2004)。脳性麻痺やダウン症候群などの 神経学的障害を有する小児あるいは胃食道括約筋の機能障害を有する小児は、再発を繰り返す GERD を合併するリスクが高い(Vandenplas et al 2009)。 本邦において小児に対する効能・効果を有するPPI はなく、小児の GERD に対しては適応外使 用されているのが現状である。小児に対する上部消化管内視鏡検査(EGD)の普及とともに、主 に慢性消化器症状や吐下血を有する症例を対象としてGERD をはじめとする消化管酸関連疾患が 診断されるようになった。このような現状を鑑みると、薬剤の適正使用の観点からも、成人と同 様に小児に対するこれらの疾患の適応がPPI には必要と考える。 成人及び小児におけるGERD 関連の症状を治療するため、食事療法、就寝中の体位、減量、制 酸剤など、様々な治療法が行われている。その他にも、H2 受容体拮抗薬(H2RA)や消化管運動 促進剤の投与等がある。PPI は、成人及び小児のいずれにおいても、長期間投与における有効性 及び安全性が示されている(Hassall et al 2007、Tolia and Boyer 2008、Vandenplas et al 2009)。PPI である OPZ は、H2RA 等の他剤に対し難治性を示した乳児及び小児の GERD 関連の食道炎を効 果的に治療した。思春期の患者を対象とした欧州の調査では、最初にH2RA を投与された患者の 26%がその後 PPI に変更したが、PPI から H2RA に変更した患者はわずか 9%であった。なお、通 常、手術は重症例のみを対象としている(Gunasekaran and Hassall 1993、Hassall et al 2000、 Ruigómez et al 2011、Vandenplas et al 2009)。 GERD は酸性の胃内容物が食道に頻回に接触することが原因であることから、PPI による治療 は、成人及び小児における GERD の症状及び合併症の軽減に効果的な方法である(Mössner et al 1995、Chiba et al 1997)。胃食道逆流の診断・治療の標準化を目的とした小児胃食道逆流症診断 治療指針作成ワーキンググループによる「小児胃食道逆流症診断治療指針の報告」の中で「酸分 泌抑制剤として H2 受容体拮抗剤やプロトンポンプ阻害剤があり、食道炎の治療として有効性が 高い。プロトンポンプ阻害剤は H2 受容体拮抗剤よりも酸分泌抑制効果が強く逆流性食道炎に対 する治療効果も高い。」と記載されている(小児胃食道逆流症診断治療指針作成ワーキンググル ープ 2006)。
2.5.1.3.1.2
消化性潰瘍
成人と同様に、小児における消化性潰瘍の病態生理は、胃酸、ヘリコバクター・ピロリ(H. pylori)菌感染に関連している。日本では、小児の DU 患児の約 80%、GU 患児の約 40%が H. pylori 陽性である(Kato et al 2004)。厚生労働省の患者調査によると、2014 年の GU 及び DU の 総患者数はそれぞれ 272,000 人及び 39,000 人であった。年齢別で見た場合、1~4 歳、5~9 歳、 及び10~14 歳の小児ではいずれの年齢層においても総患者数は 1,000 人未満であった。 AU は、胃の部分切除あるいは胃空腸吻合術後、吻合部に発生する潰瘍であり、術後 3 カ月か ら2 年以内に起こることが多い。胃切除後の AU 発生率は 0~1.4%との報告(京 1980)があり、小児での有病率について正確な数字は不明であるが、胃の手術そのものが少なく、稀な疾患であ る。 成人及び小児のいずれの場合も DU、GU、AU などの消化性潰瘍は、胃の酸性度を低下させる あるいは胃酸から保護する薬剤により治療することが通常であり、H. pylori 菌に感染している場 合は、除菌療法を実施する場合もある。一般に、小児で認められる消化性潰瘍は主に DU である (Oderda et al 2009、Tam et al 2009)。
2.5.1.3.1.3
Zollinger-Ellison 症候群
ZES は、ときに小児でも認められる稀な疾患である。日本では 1961 年以降 1983 年までの集計 で111 例が集計される程度の有病数で、未成年はそのうちの 7 例、初発年齢は 7 歳であった(岸 本 1984)。本疾患は、腫瘍に伴うガストリンの産生によって引き起こされる消化性潰瘍である。 成人と小児の間で病態生理には大きな違いはないと考えられる。血漿中ガストリン値が非常に高 値となることで、胃酸の産生及び酸性度に関連した症状が病的に増加する。PPI 投与などによる 胃酸分泌のコントロールが治療の基本であり(鈴木ら 2000)、最終的に胃の外科手術となるか、 又はガストリン産生腫瘍の治療となる。2.5.1.3.2
懸濁用顆粒剤の開発について
本邦において既承認のネキシウムカプセル20 mg 及び 10 mg は、大きさ 5 号のカプセル製剤を 経口投与するものである。一方、種々の年齢の小児患者に対しては、正確な投与を可能にし、服 薬率を高めるために適切な小児用製剤が必要な場合がある。すなわち、5 号カプセルは、長さ約 11 mm、幅約 5 mm で既存のカプセル剤で最も小さいサイズであり、小児も服用可能と考えられ るが、患者の年齢、発育、習慣等によって、カプセル剤を服用できなかったり、あるいはカプセ ル剤の服用に抵抗を感じる小児患者が存在し、カプセル剤のみでは薬剤の服用そのものに悪影響 を及ぼしたり、服薬率を低下させたりすることが考えられる。また、実際の医療現場では肢体不 自由児に対する投薬も考えられる。これらの患者では嚥下が困難な場合が多く、カプセル剤の投 与が難しい。海外では既に D961H の懸濁用顆粒剤が世界 75 カ国以上で承認されており、本邦に おいても懸濁用顆粒剤はこれらの状況を改善すると期待される。 医薬品・医療機器等レギュラトリーサイエンス総合研究事業 小児薬物療法におけるデータネ ットワークの実用性と応用可能性に関する研究において、石川らは、小児薬物療法において使用 する投与剤形が成人に比べて十分に供給されていないとの問題点を取り上げ、医療現場で剤形を 変更して使用している状況を明らかにし、製薬企業等への剤形の追加あるいは新規剤形の製造に 関する要望の基礎データを収集するため処方実態調査を実施している。平成 16 年~18 年度総合 研究報告書では、少数ではあるがOPZ 及び他の PPI 錠・カプセルを粉砕した実績が報告されてい る。 なお、PPI は消化性潰瘍や RE をはじめとする胃酸関連疾患の治療に対して高い効果を示し汎 用されているが、カプセル剤や錠剤の内服が難しい嚥下困難な患者や胃瘻の患者等に対して、懸 濁用顆粒剤が成人に対しても必要であると考えられる。そこで、懸濁用顆粒剤(20 mg、10 mg) については、国内で既承認のネキシウムカプセル(20 mg、10 mg)との製剤間の生物学的同等性 を証明することで、申請区分(8)剤形追加に係る医薬品(再審査期間中のもの)としての承認 申請を行う。2.5.1.4
臨床試験計画の概要
2.5.1.4.1
開発戦略
小児に対する医薬品の承認を得るには、臨床経過及び治療の転帰が成人と小児で類似している 場合、成人における有効性データを小児に外挿することが可能である(小児集団における医薬品 の臨床試験に関するガイダンスについて[平成12 年 12 月 15 日医薬審第 1334 号]日米欧医薬品 規制調和国際会議[ICH]ガイドライン E11、2000)。加えて、小児における安全性についても 確認する必要がある。 本邦におけるD961H の小児プログラムを開始するため、20 年 月に 相談を実施した。本相談及びその後の協議において、独立行政法人医薬品医療機器総合機構 (以下、「機構」)より、 について助言を得た。その助言に基づき、 を明示した。 第 I/III 相試験の終盤にあたり、PM 例及び pH モニタリング実施例が必要数に達する前に最大 症例数(50 例)に達することが判明したため、予定症例数に達した段階で第 I/III 相試験を一時 中断し、 ため、20 年 月 日に 相談を実施した。本相談において、 ことについて合意された。今回のGU、DU、AU、NERD、RE 又は ZES の小児患者を対象とした第 I/III 相試験の結果によ り、成人で承認を得ている適応症のうち「胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、 非びらん性胃食道逆流症、Zollinger-Ellison 症候群」を D961H の小児の適応症として承認申請す ることとした。なお、 ことから、今回の承認 申請には含まれない。 本開発戦略に関する機構からの助言は、2.5.1.5項を参照のこと。 また、2.5.1.3.2項で述べた成人患者を含めた懸濁用顆粒剤開発の必要性を踏まえ、懸濁用顆粒 剤の剤形の追加を検討した。上述の第Ⅰ/Ⅲ相試験においては本邦にて承認されていない D961H 懸濁用顆粒剤20 mg を体重が 20 kg 未満の被験者に使用したが、当該第Ⅰ/Ⅲ相試験に先立って実 施 し た 日 本 人 健 康 被 験 者 を 対 象 と し た 国 内 第 Ⅰ 相 臨 床 薬 理 試 験 (D961TC00001 試験及び D961TC00004 試験)により、D961H 懸濁用顆粒剤 20 mg と D961H カプセル 20 mg との生物学的 同等性を確認した。
2.5.1.4.2
臨床データパッケージ
2.5.1.4.2.1
評価資料
今回の申請では、小児適応については、GU、DU、AU、NERD、RE 又は ZES を有する又は有 する疑いのある 1~14 歳の小児患者を対象に、安全性、薬物動態(PK)、薬力学(PD)及び上 部消化器症状の評価による有効性を評価した国内第 I/III 相試験(D961TC00002 試験)を、また、づいてD961H カプセル 20 mg に対する D961H 懸濁用顆粒剤 20 mg の生物学的同等性を検討した 国内第Ⅰ相臨床薬理試験(D961TC00004 試験)を評価資料として提出する(表 3)。 表 3 臨床データパッケージ:評価資料 試験の相 実施地域 提出 目的 試験番号 CTD 番号 試験デザイ ン 用量/投与期間 対象患者/無作為割付 例数 第I/III 相 日本 有効性 安全性 PK PD D961TC00002 5.3.5.2.1 非盲検、 並行群間、 多施設共同 被験薬:D961H 懸濁用顆 粒剤 10 mg、D961H カプ セル10 mg 又は 20 mg qd 投与期間:8 週間 GU、DU、AU、 NERD、RE 又は ZES を有する又は有する 疑いのある1~14 歳 の小児患者:50 例 第I 相 日本 安全性 PD PK D961TC00004 5.3.1.2.2 単一施設、 非盲検、 無作為化、 2 期クロス オーバー 被験薬:D961H 懸濁用顆 粒剤20 mg 又は D961H カ プセル20 mg qd 投与期間:5 日間×2 期 (少なくとも 14 日間の休 薬期間をはさむ) CYP2C19 の遺伝子型 がhomo EM である日 本人健康成人男性: 34 例
AU:吻合部潰瘍、CYP:チトクロム P450、DU:十二指腸潰瘍、GU:胃潰瘍、homo EM:homozygote extensive metaboliser、NERD:非びらん性胃食道逆流症、PD:薬力学、PK:薬物動態、qd:1 日 1 回投与、RE:逆流性食 道炎、ZES:Zollinger-Ellison 症候群
2.5.1.4.2.2
参考資料
小児適応については、GERD 小児患者を対象とした海外第Ⅰ相臨床薬理試験(D9614C00094 試 験、D9614C00099 試験)、海外探索的治療試験(SH-NEC-0001 試験、SH-NEC-0002 試験)、海 外第III 相試験(D9614C00097 試験、D9614C00098 試験、D9614C00096 試験)、及び 2 件の海外 疫学試験(D9612N00014 試験及び D9612N00016 試験)の結果を、また、懸濁用顆粒剤について は、健康成人男性を対象に PK の評価に基づいて D961H カプセル 20 mg に対する D961H 懸濁用 顆粒剤20 mg の生物学的同等性を検討した国内第Ⅰ相臨床薬理試験(D961TC00001 試験)を参考 資料として提出する(表 4)。 表 4 臨床データパッケージ:参考資料 試験の相 実施地域 提出 目的 試験番号 CTD 番号 試験デザイン 用量/投与期間 対象患者/無作為 割付例数 第I 相 海外 安全性 PK D9614C00094 5.3.3.2.1 単一施設、 非盲検、 無作為化 被験薬:D961H カプセル 20 mg 又は 40 mg qd 投与期間:8 日間 GERD 又は症候性 GERD を有する 12~17 歳の小児 患者:28 例表 4 臨床データパッケージ:参考資料 試験の相 実施地域 提出 目的 試験番号 CTD 番号 試験デザイン 用量/投与期間 対象患者/無作為 割付例数 第I 相 海外 安全性 PK D9614C00099 5.3.3.2.2 単一施設、 非盲検、 無作為化 被験薬:1~5 歳児は D961H カプセル 5 mg 又は 10 mg、6~11 歳児は D961H カプセル 10 mg 又 は20 mg qd 投与期間:5 日間 GERD 又は症候性 GERD を有する 1 ~11 歳の小児患 者:31 例 探 索 的 治 療 海外 有効性 安全性 PK PD SH-NEC-0001 5.3.4.2.1 単一施設、 単盲検、 無作為化、 並行群間 被験薬:D961H 0.25 mg/kg 及び 1.0 mg/kg カプセル qd 投与期間:7/8 日間 24 時間 pH モニタ リングにより症候 性GERD の確定 診断を受けた1~ 24 カ月齢の外来 患者である乳児: 50 例 探 索 的 治 療 海外 有効性 安全性 PK PD SH-NEC-0002 5.3.4.2.2 単一施設、 非盲検 被験薬:D961H 0.5 mg/kg カプセルqd 投与期間:7 日間 24 時間 pH モニタ リングにより症候 性GERD の確定 診断を受けた早産 児及び新生児(在 胎齢32 週以上か ら在胎38 週間後 1 カ月未満の過期 産まで):26 例 第III 相 海外 有効性 安全性 D9614C00097 5.3.5.1.1 多施設共同、 二重盲検、 無作為化、 並行群間 被験薬:D961H カプセル 5 mg、10 mg 又は 20 mg (8 kg 以上 20 kg 未満児は D961H 5 mg 又は 10 mg、 20 kg 以上児は D961H 10 mg 又は 20 mg)qd 投与期間:8 週間 内視鏡検査により GERD が認められ た1~11 歳の小児 患者:109 例 第III 相 海外 有効性 安全性 D9614C00098 5.3.5.1.2 多施設共同、 二重盲検、 無作為化、 並行群間 被験薬:D961H カプセル 20 mg 又は 40 mg qd 投与期間:8 週間 GERD と診断され た12~17 歳の小 児患者:149 例
表 4 臨床データパッケージ:参考資料 試験の相 実施地域 提出 目的 試験番号 CTD 番号 試験デザイン 用量/投与期間 対象患者/無作為 割付例数 第III 相 海外 有効性 安全性 D9614C00096 5.3.5.1.3 多施設共同、 無作為化、 二重盲検、 プ ラ セ ボ 対 照、 並行群間 被験薬:D961H 2.5 mg(3 ~5 kg 児)、5 mg(>5~ 7.5 kg 児)又は 10 mg (>7.5~12 kg 児)qd 対照薬:プラセボ 投与期間:6 週間 GERD と疑われる 又は症候性GERD と臨床的に診断さ れた、又は内視鏡 によりGERD が 確認された月齢1 ~11 カ月の乳児 :80 例 薬 剤 疫 学 試験 海外 実 医 療 で の 長 期 安 全 性 D9612N00014 5.3.5.4.1 英国Health Improvement Network database を用 いた前向き薬 剤疫学試験 D961H、その他の PPI 及 びH2RA 追跡期間:最長18 カ月 20 年 月~ 20 年 月の期 間中にD961H、 他のPPI 又は H2RA を処方され た0~18 歳の患者 :16,077 例 薬 剤 疫 学 試験 海外 実 医 療 で の 長 期 安 全 性 D9612N00016 5.3.5.4.2 オランダ PHARMO Database Network を用 いた前向き薬 剤疫学試験 D961H、その他の PPI 及 びH2RA 追跡期間:最長18 カ月 2008 年 9 月~ 2011 年 8 月の期 間中にD961H、 他のPPI 又は H2RA を処方され た0~18 歳の患者 :23,470 例 第I 相 日本 安全性 PK D961TC00001 5.3.1.2.1 単一施設、 非盲検、 無作為化、 2 期クロスオ ーバー 被験薬:D961H 懸濁用顆 粒剤20 mg 又は D961H カ プセル20 mg qd 投与期間:5 日間×2 期 (少なくとも 14 日間の休 薬期間をはさむ) CYP2C19 の 遺 伝 子型が homo EM である日本人健康 成人男性:48 例
CYP:チトクロム P450、homo EM:homozygote extensive metaboliser、GERD:胃食道逆流症、H2RA:H2 受容体 拮抗薬、PD:薬力学、PK:薬物動態、PPI:プロトンポンプ阻害薬、qd:1 日 1 回投与
2.5.1.5
治験相談
相談(オーファン以外)(20 年)及び 相談(オーファ
ン以外)(20 年)及び 相談(20 年)における機構との主な相
2.5.1.5.1
相談(オーファン以外)(受付番号:
P2340)
申請者は、 について、機構と相談し、以下の見解を得た。 ことについて 可能である。 について 可能である。 すること。 について 必要があり、また、 ではない。 について することでよい。 すること。 について することでよい。 すること。 すること。 について と考えられる。 なお、 重要である。したがって、 すべきである。2.5.1.5.2
相談(オーファン以外)(受付番号:P4100)
申請者は、 ことについて、機構から了解を得た。また、 ことについて、機構から了解を得た。2.5.1.5.3
相談(受付番号:P3091)
溶出試験結果から、「含量が異なる経口固形製剤の生物学的同等性試験ガイドラインについ て」(平成12 年 2 月 14 日医薬審第 64 号、平成 24 年 2 月 29 日付薬食審査発 0229 第 10 号によ り一部改正)に基づき、 ことについて、機構から了 解を得た。2.5.1.6
医薬品の臨床試験の実施の基準(GCP)の遵守
今回の承認申請で評価資料及び参考資料として提出する臨床試験は、ヘルシンキ宣言に基づい た倫理原則、ICH の「医薬品の臨床試験の実施に関する基準(GCP)のガイドライン」及び各地 域で適応される規制要件、並びに治験依頼者の生命倫理に関する方針に準拠した倫理原則に従っ て実施された。 また、「小児集団における医薬品の臨床試験に関するガイダンス」(平成 12 年 12 月 15 日医 薬審第1334 号)に則り、小児臨床試験の実施に当たって以下のような対応を行った。 治験に関わる手順・検査を開始する前に、代諾者により文書による同意を得るとともに、 可能であれば被験者本人からアセントフォーム文書によりアセントを得ることとした。 治験期間中の来院時の診察及び週 1 回の電話連絡等により、全被験者をモニターし、安全 性にかかわる徴候及び症状を収集することとした。2.5.2
生物薬剤学に関する概括評価
年齢、発育、習慣等によりカプセル剤の服用が困難な小児患者や、カプセル剤や錠剤の服用が 難しい嚥下困難な成人患者等に対して懸濁用顆粒剤の有用性が期待されことから、D961H 懸濁用 顆粒剤を開発し、カプセル製剤との生物学的同等性を臨床試験にて、懸濁用顆粒剤の含量違い製 剤(10 mg 及び 20 mg)間の生物学的同等性を溶出試験にて、それぞれ検討した。2.5.2.1
カプセル製剤と懸濁用顆粒剤との生物学的同等性
既承認のネキシウムカプセル(D961H カプセル)と D961H 懸濁用顆粒剤の生物学的同等性を 検討するために、「後発医薬品の生物学的同等性試験ガイドライン等の一部改正について(平成 24 年 2 月 29 日付薬食審査発 0229 号第 10 号)(以下、「BE ガイドライン」)に準じて、エソメ プラゾールの定常状態における最高血漿中濃度(Cmax)及び投与間隔(τ)における血漿中濃度- 時間曲線下面積(AUCτ)を同等性評価パラメータとする生物学的同等性試験(D961TC00001) を実施した。しかしながら、本試験では AUCτ は生物学的同等性の判定基準を満たしたが、Cmax は同等性の基準を満たすことができなかった。そこで、BE ガイドラインを参考にして D961H の効力を裏付ける薬理作用を比較し、D961H カプセルと D961H 懸濁用顆粒剤の生物学的同等性を 検討する薬力学的試験(D961TC00004)を実施した。なお、同等性評価パラメータには、投与後 24 時間において胃内 pH が 4 を上回る時間の割合(胃内 pH>4 の時間率)を用い、90%信頼区間 法により生物学的同等性を判定した。
試験 D961TC00004 では、日本人健康成人男性被験者 34 例(CYP2C19 遺伝子型:homozygote extensive metaboliser[homo EM])を対象として、懸濁用顆粒剤(20 mg)と既承認のカプセル製 剤(20 mg)の生物学的同等性を検討した。両製剤を 1 日 1 回 5 日間反復経口投与し、最終投与 後 24 時間における胃内 pH>4 の時間率を比較したところ、胃内 pH>4 の時間率の幾何平均の比 (懸濁用顆粒剤/カプセル製剤)は0.96(90%信頼区間:0.85~1.07)となり、事前に設定してい た生物学的同等性の許容域である 90%信頼区間(0.8~1.25)の範囲内に含まれていた。この結果 に基づいて、懸濁用顆粒剤とカプセル製剤は、胃内 pH に対する効果において生物学的に同等で あると考えられた。また、胃内 pH>3 の時間率及び胃内 pH の中央値の比較においても、両製剤 の同等性が示された。 表 5 懸濁用顆粒剤及びカプセル製剤を20 mg の用量で 1 日 1 回 5 日間反復経口投与した ときの薬力学的パラメータと製剤間の比較(D961TC00004) 変数 懸濁用顆粒剤 20 mg (試験製剤) カプセル製剤 20 mg (標準製剤) 製剤間の比 (試験製剤/標準製剤) n 推定値 95%信頼区間 n 推定値 95%信頼区間 推定値 90%信頼区間 胃内pH>4 の時間率 (%) 34 55.37 48.53~63.18 34 57.96 50.79~66.13 0.96 0.85~1.07 胃内pH>3 の時間率 (%) 34 70.36 64.71~76.51 34 71.60 65.85~77.85 0.98 0.92~1.05 胃内pH の中央値 34 4.57 4.22~4.95 34 4.72 4.36~5.11 0.97 0.90~1.04
2.5.2.2
含量違いの生物学的同等性
懸濁用顆粒剤の含量違い(10 mg 及び 20 mg)について、BE ガイドラインの別紙 2「含量が異 なる経口固形製剤の生物学的同等性試験ガイドライン」(以下、「含量違い BE ガイドライ ン」)に従い処方変更水準を評価したところ、 水準に該当し、溶出挙動の比較により同等性を 判定することとした(品質に関する概括資料 -製剤- 2.3.P.2.2.1 項参照)。 含量違いBE ガイドラインに従い、懸濁用顆粒剤 10 mg 包及び 20 mg 包を用いて溶出試験を 実施したところ、全ての溶出試験条件における平均溶出率及び個々の溶出率は判定基準を満たし、 本剤10 mg と 20 mg の溶出挙動の類似性が認められた。この結果に基づき、懸濁用顆粒の含量違 い製剤(10 mg 及び 20 mg)は生物学的に同等とみなすことができると考えられた。2.5.3
臨床薬理に関する概括評価
2.5.3.1
国内第
I/III 相試験(D961TC00002 試験)(評価資料)
2.5.3.1.1
国内第
I/III 相試験(D961TC00002 試験)のデザイン
本治験は、GU、DU、AU、NERD、RE 又は ZES を有する又は有する疑いのある 1~14 歳の小 児患者を対象とした非盲検、並行群間、多施設共同無作為試験であった。 本治験のデザインは機構との治験相談に基づき設定した(2.5.1.5項)。 本治験の目的及び評価項目を表 6に示す。 表 6 目的及び評価項目(D961TC00002 試験) 目的 評価項目 優先順位 種類 内容 内容 副次的 有効性 D961H 10 mg 及び D961H 20 mg 経口投与 1、4 及び 8 週後のベースラインとの比較 に お け る 上 部 消 化 器 症 状 ( 胸 や け 、 呑 酸、心窩部痛及び上腹部不快感)の有無 及び重症度の評価により有効性を評価す ること 治験責任医師等及び患者日誌 による評価による上部消化器 症状(胸やけ、呑酸、心窩部 痛及び上腹部不快感)の有無 及び重症度 探索的 有効性 患者の一部を対象として D961H 10 mg 及 びD961H 20 mg 経口投与の有効性を EGD 所見により評価すること GU、DU、AU 又は RE の有無 の内視鏡的評価 副次的 PK D961H 10 mg 及び D961H 20 mg の 5 日間 以上経口投与後のエソメプラゾールの PK パラメータによりPK を評価することAUC、AUCt、Cmax、tmax、
t1/2、CL/F 及び Vz/F
副次的 PK D961H 10 mg 及び D961H 20 mg の 5 日間 以上経口投与後のエソメプラゾールの代 謝物である 5-水酸化体及びスルホン体の PK パラメータにより PK を評価すること
AUC、AUCt、Cmax、tmax、 及
びt1/2
副次的 PK CYP2C19 遺伝子多型が PK に及ぼす影響 を評価すること
AUC、AUCt、Cmax、tmax、
t1/2、CL/F 及び Vz/F 副次的 PD 患者の一部を対象として D961H 10 mg 及 びD961H 20 mg の 5 日間以上経口投与後 の観察期間12 時間での胃内 pH が 4 を超 える及び 3 を超える割合(時間率)並び に中央値を評価すること D961H 10 mg 及 び D961H 20 mg の 5 日間以上経口投与後 の観察期間 12 時間での胃内 pH が 4 を超える及び 3 を超え る割合(時間率)並びに中央 値
表 6 目的及び評価項目(D961TC00002 試験) 目的 評価項目 優先順位 種類 内容 内容 副次的 PD CYP2C19 遺伝子多型が PD に及ぼす影響 を評価すること 患 者 の 一 部 を 対 象 と し た D961H 10 mg 及 び D961H 20 mg の 5 日間以上経口投与後 の観察期間 12 時間での胃内 pH が 4 を超える及び 3 を超え る割合(時間率)並びに中央 値 主要 安全性、 忍容性 GU、DU、AU、NERD、RE 又は ZES を 有する又は有する疑いのある 1~14 歳の 日本人小児患者における D961H 10 mg 及 び20 mg 1 日 1 回反復経口投与の安全性及 び忍容性を検討すること 有害事象、臨床検査、バイタ ルサイン AU:吻合部潰瘍、AUCt:投与後最終測定可能時点t までの血漿中濃度-時間曲線下面積、AUCτ:投与間隔(τ) における血漿中濃度-時間曲線下面積、CL/F:経口クリアランス、Cmax:最高血漿中濃度、CYP:チトクロ ムP450、DU:十二指腸潰瘍、EGD:上部消化管内視鏡検査、GU:胃潰瘍、NERD:非びらん性胃食道逆流 症、t½:消失半減期、tmax:最高血漿中濃度到達時間、PD:薬力学、PK:薬物動態、RE:逆流性食道炎、 Vz/F:経口投与後の終末相に基づく分布容積、ZES:Zollinger-Ellison 症候群 同意が得られた被験者のうち、1 歳以上で体重が 10 kg 以上 20 kg 未満の被験者は自動的に第 1 群に割り付けた(体重10 kg 未満の被験者は除外した)。また、20 kg 以上の被験者は、年齢に基 づき、第 2~5 群に無作為に割り付けた(表 7)。なお、体重が 20 kg 以上の各群(第 2~5 群) では、CYP2C19 の遺伝子型が PM の被験者、及び胃内 pH モニタリングに同意した被験者を各群 2 例以上組み入れることを目標とした。投与期間は 8 週間とした。 表 7 治療群(D961TC00002 試験) 群 対象 必要例数 投与 年齢 体重 1 1 歳以上 20 kg 未満 5~10 D961H 懸濁用顆粒 10 mg 2 1~11 歳 20 kg 以上 10 D961H カプセル 10 mg 3 1~11 歳 20 kg 以上 10 D961H カプセル 20 mg 4 12~14 歳 20 kg 以上 10 D961H カプセル 10 mg 5 12~14 歳 20 kg 以上 10 D961H カプセル 20 mg 用量の設定根拠は、次の通りであった。海外では RE 小児患者に対して、D961H の PK 及び安 全性が確認され、米国では1~11 歳の小児での症候性 GERD 及び RE に対する用法・用量(「症 候性胃食道逆流症」:1 日 1 回 8 週間まで、「逆流性食道炎」:体重 20 kg 未満では 10 mg を 1 日1 回 8 週間まで、体重 20 kg 以上では 10 mg 又は 20 mg を 1 日 1 回 8 週間まで)が承認されて いる。これら海外での小児患者での承認状況及び日本人と西洋人の小児での標準成長曲線に大き な違いがみられていないことから、本治験の用量は10 mg 又は 20 mg を 1 日 1 回とした。
投与期間の設定根拠は次の通りであった。本邦の成人患者で承認されている D961H 及び他の PPI の消化器系胃酸関連疾患に対する投与期間(4~8 週間)及び海外で承認されている D961H の小児での消化器系胃酸関連疾患に対する投与期間(8 週間)に基づき、本治験の投与期間を 8 週間と設定した。
2.5.3.1.2
国内第
I/III 相試験(D961TC00002 試験)の人口統計学的及び他の
基準値の特性
患者は日本の20 の医療機関から登録された。スクリーニングを受けた 55 例のうち、50 例が適 格とされ、第 1~5 群のいずれかに割り付けられた。割付例全 50 例が治験薬の投与を受けた。こ のうち、47 例(94.0%)が試験を完了し、3 例(6.0%)(有害事象 1 例、患者の希望 2 例)が試 験を中止した。 登録例全 50 例が安全性解析対象集団及び最大の解析対象集団(FAS)に含まれた。PK 解析対 象集団はPK データの得られなかった 2 例(第 1 群 1 例、第 4 群 1 例)を除く計 48 例であった。 PD 解析には、胃内 pH モニタリングに同意し、解析可能なデータが得られた 5 例を含めた。 性別は男児 48.0%、女児 52.0%で男女比は同様であった。全例(100%)が日本人であった。 CYP2C19 遺伝子型は、全体で、heterozygote extensive metaboliser(hetero EM):29 例(58.0%)、 homo EM:14 例(28.0%)、PM:7 例(14.0%)であった。 主な組入れ基準に該当する疾患は、第 1 群、第 3 群及び第 4 群では NERD(各 6 例[60.0% ])、第2 群では RE(5 例[50.0%])、並びに第 5 群では GU(5 例[50.0%])であった。全 体で 5 例(10.0%)がヘリコバクター・ピロリ(H. pylori)検査陽性であった(第 1 群 2 例 [20.0%]、第 2 群、第 3 群及び第 5 群各 1 例[10.0%])。2.5.3.2
薬物動態試験成績
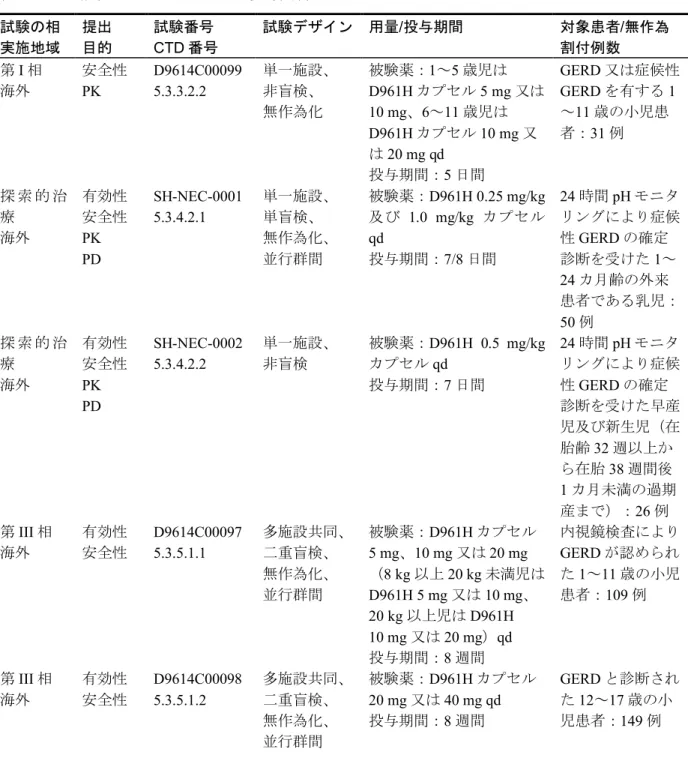
小児患者におけるエソメプラゾールの吸収は速やかであり、tmaxは 1.47~1.75 時間(中央値)であ った。また、エソメプラゾールの消失も速やかであり、t1/2は 0.80~1.37 時間(平均値)であった。 D961H を 10 mg の用量で投与したときの血漿中濃度を群間で比較したところ、第 1 群(年齢 1 歳以 上、体重20 kg 未満)の血漿中濃度が最も高く推移し、第 4 群(年齢 12~14 歳、体重 20 kg 以上)の 血漿中濃度が最も低かった。D961H の用量を 20 mg とした第 3 群(年齢 1~11 歳、体重 20 kg 以上) と第5 群(年齢 12~14 歳、体重 20 kg 以上)の比較では、第 3 群の方が高い血漿中濃度推移を示し た。この血漿中濃度の群間差に対応して、エソメプラゾールの経口クリアランス(CL/F)にも年齢 区分による群間差がみられたが、体重補正したCL/F は D961H 10 mg を投与した第 1 群、第 2 群及 び第4 群では 0.315~0.343 L/h/kg(幾何平均値)、D961H 20 mg を投与した第 3 群及び第 5 群では 0.216~0.227 L/h/kg(幾何平均値)となり、年齢に依存した群間差は認められなかった。 小児におけるエソメプラゾールの曝露量には CYP2C19 遺伝子型による影響がみられ、成人と 同様に、CYP2C19 活性に応じてエソメプラゾールの曝露量は変化すると考えられた。しかしなが ら、エソメプラゾールの曝露量には大きな個体差がみられ、多くの場合、同じ群では PM 被験者 が最も高い曝露量を示したが、EM 被験者よりも低い曝露量を示す PM 被験者も認められた。 図 1及び図 2に示すとおり、小児で検討した D961H の用量(10 mg 及び 20 mg)におけるエ ソメプラゾールの曝露量は、成人に 10 mg、20 mg あるいは 40 mg の用量で D961H を投与した ときに類似するものであり、成人に 40 mg の用量で投与したときの曝露量を超えるものではな いと考えられた。図 1 小児及び成人にD961H を 10 mg、20 mg あるいは 40 mg の用量で 1 日 1 回反復経口投与したときの定常状態におけるエソ メプラゾールのAUCτ の個体値に基づく変動幅の比較 0 5 10 15 20 25 30 35 0 10 20 30 40 50 A U C τ (µ m o l. h /L ) 投与量(mg)
(1) 成人におけるAUC
τ Homo-EM Hetero-EM PM 0 5 10 15 20 25 0 10 20 30 40 50 60 A U C τ (µ m o l. h /L )(2) 小児におけるAUC
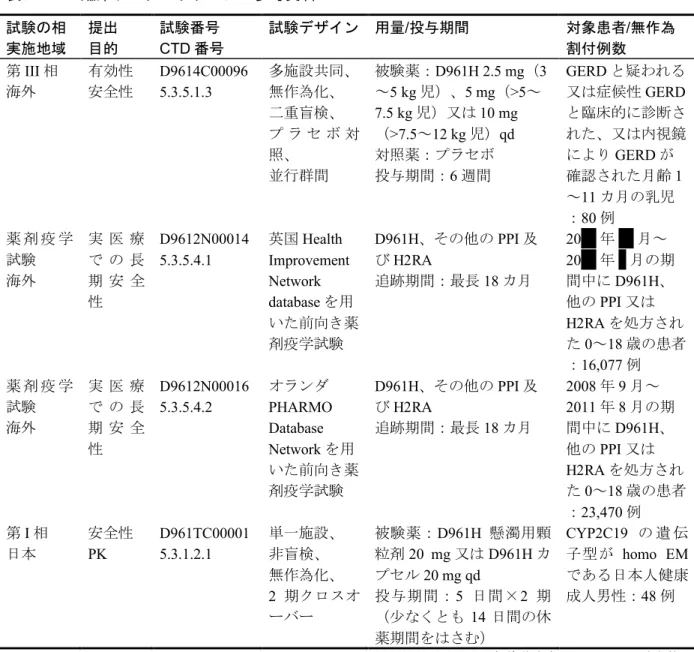
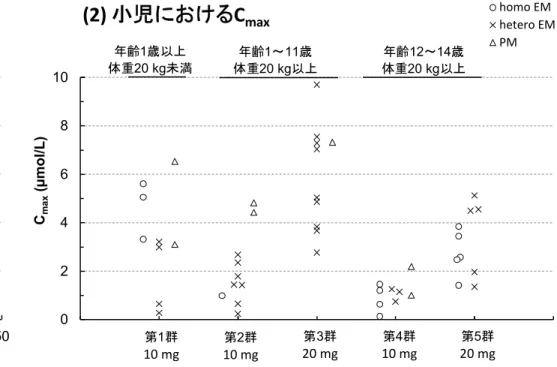
τ homo EM hetero EM PM 第1群 10 mg 第2群 10 mg 第3群 20 mg 第4群 10 mg 第5群 20 mg 年齢1歳以上 体重20 kg未満 年齢1~11歳 体重20 kg以上 年齢12~14歳 体重20 kg以上 比較に用いた成人の試験: SH-QBE-0098(赤シンボル、AUC を代用) D961HC00004(20 mg 及び 40 mg の黒シンボル) D961HC00009(10 mg の黒シンボル)図 2 小児及び成人にD961H を 10 mg、20 mg あるいは 40 mg の用量で 1 日 1 回反復経口投与したときの定常状態におけるエソ メプラゾールのCmaxの個体値に基づく変動幅の比較 0 2 4 6 8 10 0 10 20 30 40 50 Cm a x (µ m o l/L ) 投与量(mg)
(1) 成人におけるC
max Homo-EM Hetero-EM PM 0 2 4 6 8 10 0 10 20 30 40 50 60 Cm a x (µ m o l/L )(2) 小児におけるC
max homo EMhetero EMPM 第1群 10 mg 第2群 10 mg 第3群 20 mg 第4群 10 mg 第5群 20 mg 年齢1歳以上 体重20 kg未満 年齢1~11歳 体重20 kg以上 年齢12~14歳 体重20 kg以上 比較に用いた成人の試験: SH-QBE-0098(赤シンボル) D961HC00004(20 mg 及び 40 mg の黒シンボル) D961HC00009(10 mg の黒シンボル)
2.5.3.3
薬力学試験成績
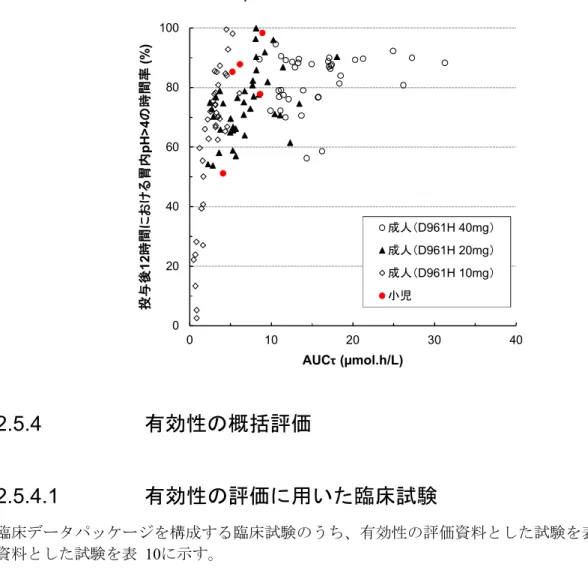
小児患者5 例において胃内 pH を測定したところ、投与後 12 時間における胃内 pH>4 の時間 率は 51.2%~98.3%であり、胃内 pH>3 の時間率は 65.4%~99.0%であった(表 8)。また、投 与後 12 時間における胃内 pH の中央値は、4.10~7.10 であった。この結果に基づいて、10 mg 及び20 mg の D961H は、小児患者における胃酸分泌を効果的に抑制すると考えられた。 エソメプラゾールの曝露量(AUCτ)と投与後 12 時間における胃内 pH>4 の時間率との関係に ついて検討したところ、小児の結果は成人とよく一致し、小児における曝露量と反応性の関係は 成人と同様であると推察された。(図 3)。 表 8 小児患者にD961H を 1 日 1 回 5 日間以上反復経口投与したときの投与後 12 時間にお ける胃内pH>4 の時間率、胃内 pH>3 の時間率及び胃内 pH の中央値 被験者 年齢/性別 体重 (kg) 用量 (mg) CYP2C19 遺伝子型 薬力学的パラメータ 薬物動態パラメータ pH>4 時間率 (%) pH>3 時間率 (%) 胃内 pH の 中央値 Cmax (mol/L) AUCτ (mol.h/L) 歳/女 23.2 10 PM 85.3 93.4 6.60 4.43 5.22 1 歳/女 48.9 20 hetero EM 98.3 99.0 6.20 5.13 8.90 1 歳/男 42.3 20 hetero EM 51.2 65.4 4.10 2.77 4.08 歳/女 23.4 10 PM 77.9 84.3 6.20 4.82 8.63 1 歳/男 27.1 20 hetero EM 87.8 89.5 7.10 3.68 6.15 CYP:チトクロム P450、hetero EM:heterozygote extensive metaboliser、PM:poor metaboliser図 3 小児及び成人におけるD961H(10 mg、20 mg 及び 40 mg)を 1 日 1 回反復経口投与 したときのAUCτと胃内pH>4 の時間率との関係 0 20 40 60 80 100 0 10 20 30 40 投 与 後 1 2 時 間 に お け る 胃 内 p H > 4 の 時 間 率 (% ) AUCτ (µmol.h/L) 成人(D961H 40mg) 成人(D961H 20mg) 成人(D961H 10mg) 小児