The authors declare no con‰ict of interest. 北海道大学大学院薬学研究院分子生物学(〒0600812 札幌市北区北 12 条西 6 丁目) e-mail: nkazu@pharm.hokudai.ac.jp 本総説は,日本薬学会第 132 年会シンポジウム S06 で 発表したものを中心に記述したものである. ―Review―
DJ-1 のミトコンドリアにおける機能
仁木(高橋)加寿子,仁木剛史,有賀(井口)早苗,有賀寛芳Function of DJ-1 in Mitochondria
Kazuko Takahashi-Niki,Takeshi Niki, Sanae Iguchi-Ariga, and Hiroyoshi Ariga
Hokkaido University Graduate School of Pharmaceutical Science; Kita-12 jo, Nishi-6-chome, Kita-ku, Sapporo 0600812, Japan.
(Received July 4, 2012)
Parkinson's disease is a degenerative disorder of the central nervous system caused by selective dopamine-generat-ing cell death, and oxidative stress and mitochondrial dysfunction are thought to be responsible for the onset of Parkin-son's disease. While most cases of ParkinParkin-son's disease are idiopathic, 510% of cases are attributed to genetic factors. DJ-1 was ˆrst identiˆed as an activatedras-dependent oncogene and later found to be a causative gene for a familial form of Parkinson's disease, PARK7. We and others found that DJ-1 plays roles in transcriptional regulation and anti-oxidative stress function, and loss of its function is thought to aŠect the onset of Parkinson's disease. DJ-1 is mainly lo-cated in the cytoplasma and nucleus and partially in mitochondria. When mice or mouse cells were treated with bisphenol A, an endocrine disruptor and inducer of reactive oxygen species, DJ-1 was translocated into mitochondria to maintain mitochondrial complex I activity. We also found that DJ-1 directly bound to and was co-localized with NDU-FA4 and ND1, nuclear and mitochondrial DNA-encoding subunits of mitochondrial complex I, respectively, and that these associations were enhanced by oxidative stress. Furthermore, complex I activity was reduced in two types of DJ-1-knockdown NIH3T3 and HEK293 cells. These ˆndings suggest that DJ-1 is an integral mitochondrial protein and main-tains mitochondrial complex I activity to regulate mitochondrial homeostasis.
Key words―DJ-1; Parkinson's disease; mitochondria; oxidative stress
はじめに パーキンソン病はアルツハイマー病についで多い 神経変性疾患である.中脳黒室ドーパミン神経が変 性・脱落すなわち細胞死を引き起こし,線条体にお ける神経伝達物質のバランスが崩壊することにより 振戦,固縮,無動などの運動機能障害を主症状とし て生じる.運動機能障害以外に,認知症,睡眠障 害,嗅覚障害等の症状を伴うことも多い.パーキン ソン病の日本での有病率は,50 歳で人口 4000 人当 たりに約 1 人と言われており,患者数は国内に 12 15万人,世界中では 500 万人の患者がいると推定 されている.高齢になるほど発症率が高く,65 歳 以上では 100 人に 1 人が罹患すると言われており, 今後さらに増加すると予想されている.そのほとん どが孤発性であるが,510%ほどが家族性で発症 し,現在までに 13 ヵ所(PARK113)の変異・欠 損が報告されている.神経が冒される原因について は諸説あり,単一の要因ではなく酸化ストレス,ミ トコンドリア機能障害,異常タンパク質の蓄積など 複数の要因の関与が示唆されているが,詳細はいま だ不明である.また,パーキンソン病の治療は,l-dopaによるドーパミンの補充による対症療法が確 立されているが,いまだ発症を抑えることができな い.したがって,根本的治療法/予防法の開発のた めの発症機構の解明は今後深刻になる高齢化社会に おいて急務である. 本稿では,われわれの同定した多機能タンパク質 DJ-1 の機能を記述するとともに,パーキンソン病 とその原因の 1 つであるミトコンドリアの機能障害 の関連を中心に,DJ-1 の関与を紹介する. 1. パーキンソン病とミトコンドリア 脳には大量のエネルギーが必要であり,身体の他 の部位に比較しても,エネルギー産生源のミトコン
仁木(高橋)加寿子 2000 年 に 北 海 道 大 学 薬 学 部 卒 業 . CREST技術員,理研テクニカルスタ ッフを経て,2006 年北大より薬学博士 を授与(論文博士).日本学術振興会特 別研究員を経て,2009 年より北海道大 学大学院薬学研究院助教.DJ-1 が関与 する多くの疾患の病因・治療法の発見 を目指している.
Fig. 1. Function of DJ-1 and Its Related Diseases
DJ-1 is a multi-functional protein that plays roles in anti-oxidative stress, transcriptional regulation, protease and mitochondria complex I regu-lation, and loss of its functions is thought to be responsible for the onset of Parkinson's disease and various oxidative stress-inducing diseases. ドリアが重要な役割を果たしている.パーキンソン 病発症とミトコンドリアの関連については,古くか ら多数の関与が示唆されている.まず,パーキンソ ン病患者の脳細胞ではミトコンドリアが機能してい ないことが知られている.とくに中脳黒質と大脳皮 質においてミトコンドリアの電子伝達系のミトコン ドリア Complex I の減少,活性能低下がみられる ことが知られている.1,2) また,1980 年代に 1-methyl-4-phenyl-1,2,3,6-tet-rahydropyridine(MPTP)が黒質変性を伴うパーキ ン ソ ニ ズ ム を 発 症 さ せ る こ と が 報 告 さ れ た .3) MPTPはモノアミン酸化酵素(MAO-B)による代 謝 物 MPP+ が , ド ー パ ミ ン ト ラ ン ス ポ ー タ ー (DAT)を介して中脳黒質のドーパミン神経に選択 的に取り込まれ,ミトコンドリアに蓄積し,ミトコ ンドリア Complex I を阻害することで,活性酸素 を細胞内に発生させ,毒性を発揮する.また,除草 剤であるパラコートは MPTP と類似構造を有し, MPTPと同様にミトコンドリア Complex I を障害 し,パラコートを投与された動物では黒質ドーパミ ン神経の変性が観察されている.殺虫剤であるロテ ノンもミトコンドリア Complex I を障害すること がわかっており,ロテノンを投与された動物では パーキンソン病様症状がみられる.また,内分泌か く乱物質の 1 つとして知られるビスフェノール A は活性酸素を発生させ,幼弱げっ歯類に暴露する と,成獣後,ドーパミン神経の脱落が観察され, パーキンソン病様の神経変性を起こすことが知られ ている.47)これらに加えて,ミトコンドリアはエ ネルギーを産生する際に活性酸素種(reactive oxy-gen species; ROS)を副産物として産生しており, 常に酸化ストレスにさらされていることも原因とな ると考えられている.
また,前述の家族性パーキンソン病原因遺伝子産 物 13 個のうち 3 個がミトコンドリアの機能に関与 していることが報告されている遺伝子産物である. そのうち,Parkin (PARK2), PINK1 (PARK6)の 変異による患者の病態がよく似ていることが知られ ていた.810)Parkin はユビキチンを別の標的タンパ ク質に付加する酵素ユビキチンリガーゼ(E3)で あることも知られており,11,12)一方 PINK1 は N 末 端にミトコンドリア移行シグナルを有するセリン/ スレオニンキナーゼとして働く.13)近年,Parkin と PINK1が協調して,膜電位を失ったミトコンドリ アを,オートファジーを介した分解,及びアグリ ソーム様構造へ隔離することが明らかとなり,機能 損失に陥ったミトコンドリアを除去する品質管理に 関与することが報告されている.14,15) 2. DJ-1の単離とこれまで明らかになってきた こと DJ-1 は ras と協調的に細胞をがん化させる新規 がん遺伝子として本研究室において同定した.16)そ の後,DJ-1 が様々な疾患に関係していることが次 々と明らかとなり(Fig. 1),2003 年には家族性パー キンソン病原因遺伝子(PARK7)であることが報 告された.17) 遺伝子産物 DJ-1 は 189 アミノ酸からなる小さな タンパク質で,主に細胞質に局在するが,一部は核 やゴルジ体,ミトコンドリアに局在することが知ら れている.特徴的なドメインは有していないが,古 細菌の細胞内プロテアーゼ PFPI に類似した構造を とり,18,19)ホモダイマーを形成して,様々なタンパ ク質と相互作用して多彩な機能を有することが明ら かとなっている. 特に DJ-1 の抗酸化ストレス機能はパーキンソン 病発症メカニズムを理解する上で重要であると考え
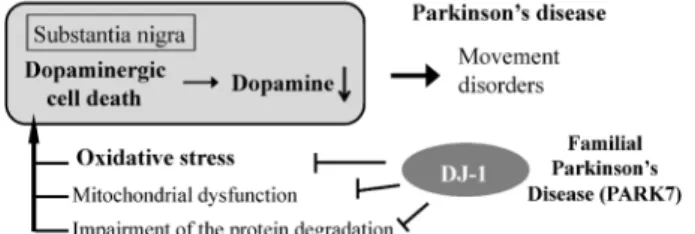
Fig. 2. DJ-1 Has Various Functions to Prevent Cell Death
Parkinson's disease is caused by dopaminergic cell death and oxidative stress, mitochondrial dysfunction and impairment of the protein degrada-tion. られている.DJ-1 には 3 つの Cys 残基があり,こ の Cys 残基が酸化されて活性酸素種を吸収・除去 することで抗酸化ストレス能を発揮する.20,21)3 つ の Cys 残基のうち,106 位の Cys 残基(C106)が 最も酸化ストレスに対して感受性が高く,C106 を セリンに変異した C106S 変異体では,C106 だけで なく,他の Cys 残基も酸化されなくなることを明 らかとしている.20,21)さらに,弧発性パーキンソン 病患者においては,活性酸素を吸収できる還元型で はなく,酸化型 DJ-1 が異常蓄積していることも報 告されている.ドーパミンは自動酸化されることで スーパーオキシドを産生することが知られており, ドーパミン神経は脳の中で最も高レベルの酸化スト レスに常に暴露されており,パーキンソン病発症原 因となる.このことから,DJ-1 の機能不全は家族 性パーキンソン病のみならず,孤発性パーキンソン 病発症にも深く関与していると考えられる(Fig. 2).22,23) さらに DJ-1 は前述の抗酸化機能のほかに,転写 調節,プロテアーゼ,ミトコンドリア機能調節等の 機能を有する(Fig. 1). われわれは DJ-1 が転写調節因子として,PIASxa24) や DJBP25)と結合してアンドロゲンレセプターの 転写活性化能を調節することを報告している.また, p5326,27)やグルタチオン合成酵素,SOD などレド ックス系遺伝子の転写を調節していることも知られ ており,2830)DJ-1による抗酸化ストレス能には, 自身が酸化されることだけでなく,これら遺伝子の 発現調節によっても行われていると考えられる. そのほかにも,DJ-1 がパーキンソン病に特徴的 なレビー小体の主要成分である a-synuclein の凝集 を阻害することからシャペロン活性を有すると考え られている.さらに,このシャペロン活性において, DJ-1は C106-SO2H型が活性型であり,SO3H型に まで酸化してしまったものは阻害活性がないことが 報告されている.31)したがって,DJ-1 の機能のほ ぼすべてにおいて C106 が重要であり,この酸化修 飾により活性酸素種の吸収・除去機能も,その他の 機能も調節されると考えられる. これらのことから DJ-1 はパーキンソン病のみな らず,これまで全く別のものだと考えられていた疾 患に対して,DJ-1 が欠損若しくは様々な要因によ る機能不全に陥ったときに生じる共通のシグナル伝 達の異常が様々な疾患の発症原因につながるもので あることが明らかにされつつあり,注目されている. 3. ビスフェノール A による DJ-1 のミトコンド リアへの移行32) DJ-1 は酸化ストレスに応答して様々な細胞内の タンパク質と相互作用して機能すること,その機能 は DJ-1 の Cys 残基の酸化修飾によって調節されて いることは先述した通りである.そこで,前述の内 分泌かく乱物質で,パーキンソン病様症状を引き起 こすことが知られているビスフェノール A をマウ ス神経芽腫 Neuro2A 細胞に添加し,DJ-1 の局在を 検討した. まず,ビスフェノール A を投与した細胞内に ROS
probe である Hydroxyphenyl Fluorescein 試薬を添
加し ‰ow cytometry で細胞内の ROS 量を測定した ところ,ROS 量の顕著な増加がみられた.同時に, MitoSOXを用いてミトコンドリア内のスーパーオ キシド(O- 2 )量を測定したところ,増加が観察さ れた.そのときの DJ-1 の酸化レベルを等電点電気 泳動で検討したところ,酸化型 DJ-1 が増加してい ることも確認された.さらに,DJ-1 の局在を観察 したところ,コントロールの溶媒のみの処理では, DJ-1 は核,細胞質両方に局在し,ミトコンドリア への局在はごくわずかであったが,ビスフェノール A処理により,DJ-1 の発現量が増加し,ミトコン ドリアでの DJ-1 局在が増加することが示された. このことから,細胞がビスフェノール A 処理によ って酸化ストレスを受け,ミトコンドリアが障害を 受けた際に,DJ-1 の一部は障害を受けたミトコン ドリアに移行することが示された. 次に,ビスフェノール A 処理によるミトコンド リア Complex I 活性を検討したところ,ビスフェ ノール A が低濃度ではわずかに増加するものの,
高濃 度 では 顕著 な 低下 がみ ら れた .こ の とき の DJ-1の発現量は,活性と並行するように,低濃度 で増加した後に高濃度で顕著に減少する.一方,ミ トコンドリア Complex I 構成タンパク質の発現量 をウエスタンブロッティングにより検討したとこ ろ,ビスフェノール A
添加量の増加に伴い,Com-plex I構成タンパク質の 20 kDa, 30 kDa, 39 kDa の
サブユニットの減少が確認された.ビスフェノール A処理による Complex I 活性と,Complex I 構成 タンパク質量の変化における DJ-1 の関与をみるた め に , siRNA を 用 い て DJ-1 を 減 少 さ せ た 際 の Complex I活性及び Complex I 構成タンパク質量を 検討した.その結果,DJ-1 減少に伴い Complex I 活性の顕著な低下がみられ,そのとき Complex I 構成タンパク質量に変化はなかった.これらのこと から,低濃度のビスフェノール A 処理時の DJ-1 量 増加は,Complex I 活性調節において重要な役割を 果たしていると考えられる. 次に,ビスフェノール A 処理による細胞死を MTT assay により検討したところ,DJ-1 はビスフ ェノール A による細胞死を抑制することも示され た. これらの結果に加えて,DJ-1 がビスフェノール A以外にも様々な酸化ストレスを受けてミトコン ドリアに移行するという論文もいくつか報告されて いることから,DJ-1 は自身が酸化されることのみ で酸化ストレスに抵抗するだけでなく,酸化ストレ スを受けた後にミトコンドリアへ移行し,他のタン パク質と相互作用することで Complex I の機能調 節に係わるなど,酸化ストレスセンサーとしての働 きも有しているのではないかと考えている. 次に DJ-1 が Complex I 活性を調節していること が示されたことから,CCCP という脱共役剤を用 いて膜電位を消失させた際の DJ-1 の局在を検討し た.その結果,DJ-1 の局在に顕著な変化がみられ, DJ-1 が通常時より多くミトコンドリアと共局在し ていることが明らかとなった(論文未発表).これ らの結果は,DJ-1 が酸化ストレスによる障害時だ けでなく,他の原因によるミトコンドリア障害時に もミトコンドリアに動員され,障害に対する防御機 構に機能していることを示唆していると考えている. 4. DJ-1によるミトコンドリア Complex I の制 御メカニズム33) DJ-1 が酸化ストレスを受けてミトコンドリアへ 移行し,細胞死抑制と Complex I 活性調節に関与 していることが明らかとなったが,その詳細なメカ ニズムは不明である.そこで,DJ-1 がミトコンド リアで機能する際にパートナーとなるタンパク質を Yeast two-hybrid 法で探索したところ,ミトコンド リア Complex I のサブユニットである NADH de-hydrogenase (ubiquinone) 1 alpha subcomplex 4 ( NDUFA4 ) 及 び ND1 が 得 ら れ た . NDUFA4, ND1はともにミトコンドリアの内膜に存在するタ ンパク質で,ND1 はミトコンドリア DNA にコー ドされている.複数の細胞を用いた in vivo 結合実 験により NDUFA4, ND1 は,還元型 DJ-1 及び酸 化型 DJ-1 両方に結合し,この結合は酸化ストレス 時に増加することが明らかとなった.また,精製し た DJ-1 を用いた in vitro 結合実験により,両者の 結合が確認できたことから,DJ-1 がミトコンドリ ア Complex I 構成タンパク質に直接作用している こ と が 明 ら か と な り , DJ-1 が ミ ト コ ン ド リ ア Complex I活性に直接影響していることが考えられ た.また,DJ-1 ノックダウン細胞において Com-plex1活性の顕著な低下がみられ,野生型 DJ-1 を 導入すると回復がみられたのに対し,家族性パーキ ンソン病 PARK7 でみられる変異型 DJ-1(L166P) 変異体では,回復がみられなかった. これらのことから,DJ-1 がミトコンドリアの Complex活性において正の調節をしていること, 家族性パーキンソン病患者から見つかった DJ-1 変 異体ではその活性増強能を失っていることが示され た.このことは DJ-1 がミトコンドリア Complex 活性維持に必須であり,その機能の低下・欠損が パーキンソン病発症へとダイレクトにつながってい ることを示唆している. 5. まとめと今後の展望 本研究により,DJ-1 が酸化ストレスを受けてミ トコンドリアに移行し,ミトコンドリア Complex I 構成因子に直接結合し,Complex I 活性を正に調節 していることが示された.また,DJ-1 のミトコン ドリアへの移行は酸化ストレスに限らず,ミトコン ドリアが損傷を受ける場合にも確認された(Fig. 3).しかしながら,DJ-1 には典型的なミトコンド
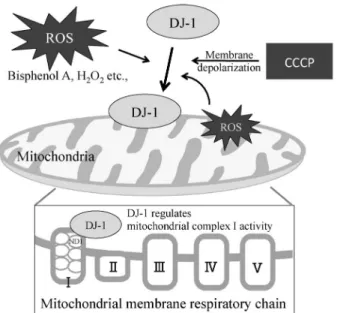
Fig. 3. Proposed Model of Mitochondrial Translocation of DJ-1
DJ-1 is localized in the cytoplasm, nucleus and mitochondria, and mitochondrial localization of DJ-1 is enhanced by oxidative stress such as treatment of cells with Bisphenol A and H2O2and by mitochondrial
mem-brane depolarization, all of which compromise mitochondria. Since DJ-1 does not contain the mitochondrial localization signal, the molecular mechanism how DJ-1 is translocated into mitochondria has not been fully dissolved. It is thought that DJ-1 is translocated into mitochondria in associ-ation with other protein(s) containing the mitochondrial localizassoci-ation signal, leading to maintaining mitochondrial complex I activity.
リア移行シグナルがないことから,DJ1 のミトコ ンドリア移行メカニズムは全く不明である.これま でに構造に関係するアミノ酸一個の変異により,通 常状態でもミトコンドリアに移行することが報告さ れ,当研究室においても解析を行い,興味深い結果 が得られている(論文投稿準備中).また,DJ-1 減 少時にミトコンドリア量及び形態が変化することも 十分考えられることから,現在検討中であり,パー キンソン病の新たな発症メカニズムが解明されると 期待される. 謝辞 本研究の一部は日本学術振興会 特別研 究員奨励費 No. 09J40124 及び日本学術振興会科学 研究 若手研究(B)No. 23790970 によった.本研 究の遂行に当たり,北海道大学大学院薬学研究院分 子生物学教室の大学院生及び学生の方々,北海道大 学大学院農学研究院環境分子生物科学教室の大学院 生及び学生の方々に深く感謝いたします.また,執 筆する機会を与えてくださったオーガナイザーの徳 島大学ゲノムセンター 篠原康雄教授に深く感謝致 します. REFERENCES
1) Schapira A. H., Cooper J. M., Dexter D.,
Clark J. B., Jenner P., Marsden C. D., J. Neurochem., 54, 823827 (1990).
2) Parker W. D., Parks J. K., Swerdlow R. H., Brain Res., 1189, 215218 (2008).
3) Langston J. W., Ballard P., Tetrud J. W., Ir-win I., Science, 219, 979980 (1983).
4) Kabuto H., Hasuike S., Minagawa N., Shishi-bori T., Environ. Res., 93, 3135 (2003).
5) Mizuo K., Narita M., Miyagawa K., Narita
M., Okuno E., Suzuki T., Neurosci. Lett., 356, 9598(2004).
6) Suzuki T., Mizuo K., Nakazawa H., Funae
Y., Fushiki S., Fukushima S., Shirai T., Nari-ta M., Neuroscience, 117, 639644(2003). 7) Kabuto H., Hasuike S., Minagawa N.,
Shishi-bori T., Environ. Res., 93, 3135(2003). 8) Clark I. E., Dodson M. W., Jiang C., Cao J.
H., Huh J. R., Seol J. H., Yoo S. J., Hay B. A., Guo M., Nature, 441, 11621166(2006). 9) Park J., Lee S. B., Lee S., Kim Y., Song S., Kim S., Bae E., Kim J., Shong M., Kim J. M., Nature, 441, 11571161 (2006).
10) Yang Y., Gehrke S., Imai Y., Huang Z.,
Ouyang Y., Wang J. W., Yang L., Beal M. F., Vogel H., Lu B., Proc. Natl. Acad. Sci. USA, 103, 1079310798(2006).
11) Shimura H., Hattori N., Kubo S., Mizuno Y., Asakawa S., Minoshima S., Shimizu N., Iwai K., Chiba T., Tanaka K., Suzuki T., Nat. Ge-net., 25, 302305 (2000).
12) Imai Y., Soda M., Takahashi R., J. Biol.
Chem., 275, 3566135664 (2000).
13) Valente E. M., Abou-Sleiman P. M., Caputo
V., Muqit M. M., Harvey K., Gispert S., Ali Z., Del Turco D., Bentivoglio A. R., Healy D. G., Albanese A., Nussbaum R., Gonz áalez-Maldonado R., Deller T., Salvi S., Cortelli P., Gilks W. P., Latchman D. S., Harvey R. J., Dallapiccola B., Auburger G., Wood N. W., Science, 21, 11581160 (2004).
14) Vives-Bauza C., Zhou C., Huang Y., Cui M.,
de Vries R. L., Kim J., May J., Tocilescu M. A., Liu W., Ko H. S., Magran áe J., Moore D. J., Dawson V. L., Grailhe R., Dawson T. M., Li C., Tieu K., Przedborski S., Proc. Natl.
Acad. Sci. USA, 107, 378383(2010).
15) Matsuda N., Sato S., Shiba K., Okatsu K.,
Saisho K., Gautier C. A., Sou Y. S., Saiki S., Kawajiri S., Sato F., Kimura M., Komatsu M., Hattori N., Tanaka K., J. Cell Biol., 189, 211221(2010).
16) Nagakubo D., Taira T., Kitaura H., Ikeda M., Tamai K., Iguchi-Ariga S. M., Ariga H., Bio-chem. Biophys. Res. Commun., 231, 509513 (1997).
17) Bonifati V., Rizzu P., van Baren M. J.,
Schaap O., Breedveld G. J., Krieger E., Dek-ker M. C., Squitieri F., Ibanez P., Joosse M., van Dongen J. W., Vanacore N., van Swieten J. C., Brice A., Meco G., van Duijn C. M., Oostra B. A., Heutink P., Science, 299, 256 259 (2003).
18) Honbou K., Suzuki N. N., Horiuchi M., Taira T., Niki T., Ariga H., Inagaki F., Acta Crys-tallogr. D Biol. CrysCrys-tallogr., 59, 15021503 (2003).
19) Honbou K., Suzuki N. N., Horiuchi M., Niki
T., Taira T., Ariga H., Inagaki F., J. Biol. Chem., 278, 3138031384 (2003).
20) Takahashi-Niki K., Niki T., Taira T., Iguchi-Ariga S. M., Iguchi-Ariga H., Biochem. Biophys. Res. Commun., 320, 389397 (2004).
21) Taira T., Saito Y., Niki T., Iguchi-Ariga S. M., Takahashi K., Ariga H., EMBO Rep., 5, 213218(2004).
22) Choi J., Sullards M. C., Olzmann J. A., Rees H. D., Weintraub S. T., Bostwick D. E., Gearing M., Levey A. I., Chin L. S., Li L., J. Biol. Chem., 281, 1081610824 (2006).
23) Bandopadhyay R., Kingsbury A. E., Cookson
M. R., Reid A. R., Evans I. M., Hope A. D.,
Pittman A. M., Lashley T., Canet-Aviles R., Miller D. W., McLendon C., Strand C., Leonard A. J., Abou-Sleiman P. M., Healy D. G., Ariga H., Wood N. W., de Silva R., Revesz T., Hardy J. A., Lees A. J., Brain, 127, 420430(2004).
24) Takahashi K., Taira T., Niki T., Seino C.,
Iguchi-Ariga S. M., Ariga H., J. Biol. Chem., 276, 3755637563 (2001).
25) Niki T., Takahashi-Niki K., Taira T., Iguchi-Ariga S. M., Iguchi-Ariga H., Mol. Cancer Res., 1, 247261 (2003).
26) Shinbo Y., Taira T., Niki T., Iguchi-Ariga S. M., Ariga H., Int. J. Oncol., 26, 641648 (2005).
27) Fan J., Ren H., Jia N., Fei E., Zhou T., Jiang P., Wu M., Wang G., J. Biol. Chem., 283, 40224030(2008).
28) Gan L., Johnson D. A., Johnson J. A.,Eur.
J. Neurosci., 31, 967977 (2010).
29) Clements C. M., McNally R. S., Conti B. J., Mak T. W., Ting J. P., Proc. Natl. Acad. Sci. USA, 103, 1509115096 (2006).
30) Im J. Y., Lee K. W., Woo J. M., Junn E.,
Mouradian M. M., Hum. Mol. Genet., 21, 30133024 (2012).
31) Shendelman S., Jonason A., Martinat C.,
Leete T., Abeliovich A., PLoS Biol., 2, e362 (2004).
32) Ooe H., Taira T., Iguchi-Ariga S. M., Ariga H., Toxicol. Sci., 88, 114126 (2005). 33) Hayashi T., Ishimori C., Takahashi-Niki K.,
Taira T., Kim Y. C., Maita H., Maita C., Ari-ga H., Iguchi-AriAri-ga S. M., Biochem. Biophys. Res. Commun., 390, 667672 (2009).