2.7.4.5 特別な患者集団及び状況下における安全性に関する観察項目
2.7.4.5.1 内因性要因
2.7.4.5.1.1 CYP2D6遺伝子型別安全性
アトモキセチンの代謝に関係しているチトクローム P450 2D6(以下、CYP2D6)は遺 伝子多型を有しており、遺伝子型により大きく Extensive Metabolizer(以下、EM)と Poor Metaborizer(以下、PM)に分けられる。白人における PM の比率は約 7%(Broly 1991)と報告されている。一方、日本人では PM の比率が 1%未満(Nakamura 1985、 Horai 1990)と低く、野生型遺伝子より代謝活性の低い CYP2D6*10 などのアレルが関連 す る Intermediate Metabolizer ( 以 下 、 IM ) が 着 目 さ れ る こ と が 多 い [ 日 本 人 の CYP2D6*10 アレル頻度は約 38%と報告されている(Nishida 2000)]。 CYP2D6 遺伝子多型がアトモキセチンの安全性に及ぼす影響を検討するために、海外 長期併合データベースを用いて、EM 及び PM 間における安全性を比較した。日本、台 湾、中国及び韓国で実施した臨床試験(LYBD 試験、LYBC 試験、LYDA 試験、LYBR 試験、S010 試験)では、EM を更に細かく分類し、CYP2D6*10 などの代謝活性低下型ア レルが関連する IM に着目した分類方法 1(表 2.7.4-368)による解析及び不活性型アレ ル数に着目した分類方法 2(表 2.7.4-369)による解析を行った。 本項では、分類方法 1 による結果を主に示し、分類方法 2 による結果は第 2.7.4.7.4.1 項に示した。 表 2.7.4-368. 活性低下型アレルに着目した CYP2D6 分類(分類方法 1) PM IM EM (その他の EM:ヘテロ接合型 EM、ホモ接合型 EM、UM) 1 対の不活性型を有する群 (不活性型/不活性型) 1 対の活性低下型を有する、又は活 性低下型と不活性型を対で有する 群 (活性低下型/活性低下型、活性低 下型/不活性型子) PM 又は IM 以外 (通常活性型/不活性型、 通常活性型/活性低下型、通常 活性型/通常活性型) 表 2.7.4-369. 不活性型アレル数に着目した CYP2D6 分類(分類方法 2)
PM (IM 及びヘテロ接合型 EM) IM’ (ホモ接合型 EM 及び UM) EM’
1 対の不活性型を有する群 (不活性型/不活性型) 1 対の活性低下型を有する、又は 1 つの不活性型を有する群 (活性低下型/活性低下型、 活性低下型/不活性型、 通常活性型/不活性型) 2 つ 以 上 の 通 常 活 性 型 を 有 す る、又は通常活性型と活性低下 型を 1 つずつ有する群 (通常活性型/活性低下型、通 常活性型/通常活性型) 日本人で実施した臨床試験(LYBC 試験)で認められた PM 患者及びアジアで実施し
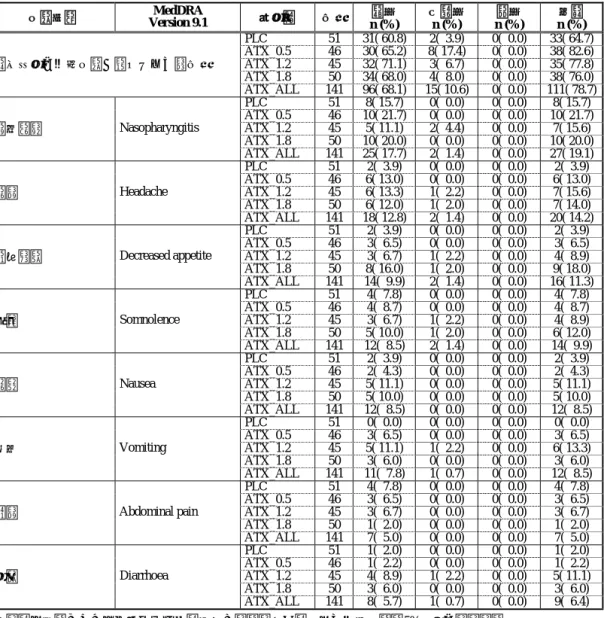
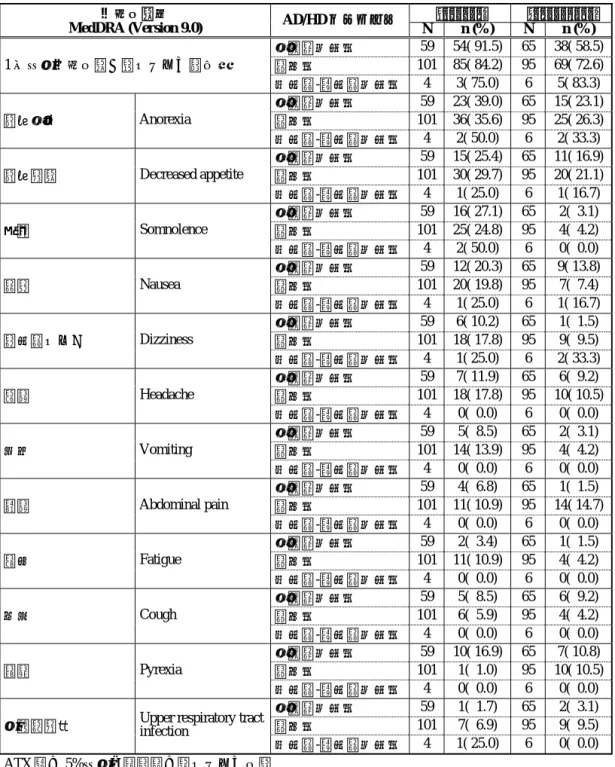
592 2.7.4.5.1.1.1 日本で実施した試験における CYP2D6 遺伝子型 EM/IM 別安全性 2.7.4.5.1.1.1.1 有害事象 2.7.4.5.1.1.1.1.1 プラセボ対照二重盲験比較試験:LYBC 試験 LYBC 試験より、アトモキセチンが投与された全患者を対象とし、アトモキセチン群 全体(以下、ATX_ALL 群)で 5%以上の発現率を示した 8 事象について CYP2D6 遺伝子 型別に評価した。分類方法 1 による EM/IM 別の有害事象を表 2.7.4-370 に示した。分類 方法 2 の結果を、第 2.7.4.7.4.1.1.1.1 項に示した。 分類方法 1 により EM/IM を分類したとき、1 件以上の有害事象が認められた患者の割 合 は 、 EM 患 者 に つ い て ATX_ALL 群 で 78.7% ( 111/141) 、 プ ラ セ ボ 群 で 64.7% (33/51)と、アトモキセチン群で大きかった。一方、IM 患者について ATX_ALL 群で 80.0%(32/40)、プラセボ群で 90.9%(10/11)と、プラセボ群で大きかった。 各用量群における有害事象の発現率を EM 患者と IM 患者で比較したとき、プラセボ 群、アトモキセチン 1.2 mg/kg/日群(以下、ATX_1.2 群)及びアトモキセチン 1.8 mg/kg/ 日群(以下、ATX_1.8 群)では、IM 患者の方が高かった。一方、アトモキセチン 0.5 mg/kg/日群(以下、ATX_0.5 群)では、EM 患者の方が高かったことから、一定の傾 向は認められなかった。 ATX_ALL 群で認められた有害事象の発現率について、EM 患者に比べ IM 患者で高か ったのは、頭痛、食欲減退、傾眠、悪心及び腹痛であった。これらの事象のうち、IM 患者及び EM 患者の間で ATX_ALL 群とプラセボ群との発現率の差が 5%以上認められ たのは、頭痛、食欲減退及び傾眠であった。頭痛については、IM 患者に比べ EM 患者 の方が ATX_ALL 群とプラセボ群との発現率の差は大きかった。 食欲減退及び傾眠について、各用量群における発現率を EM 患者と IM 患者で比較し た。食欲減退及び傾眠は、EM 患者及び IM 患者のいずれにおいても、用量依存的な発 現率の増加が認められた。また、ATX_1.2 群及び ATX_1.8 群における発現率は、IM 患 者の方が EM 患者より高かった。しかし、食欲減退及び傾眠に起因する試験の中止及び 重篤な有害事象は認められなかった。 アトモキセチンが投与された全患者を対象とし、ATX_ALL 群で 5%以上の発現率を示 した 8 事象の最大重症度について、CYP2D6 遺伝子型別に評価した。分類方法 1 により 分類された EM 患者及び IM 患者において報告された有害事象の最大重症度をそれぞれ 表 2.7.4-371 及び表 2.7.4-372 に示した。 EM 患者において、ATX_ALL 群で有害事象を報告した 111 例中、その有害事象の最大 重症度が軽度であった患者は 96 例であり、報告された有害事象の多くは軽度であった。 プラセボ群及びアトモキセチン群のいずれにおいても高度の有害事象は認められなかっ た。IM 患者において、ATX_ALL 群で有害事象を報告した 31 例中、その有害事象の最 大重症度が軽度であった患者は 24 例であり、報告された有害事象の多くは軽度であっ た。プラセボ群及びアトモキセチン群のいずれにおいても高度の有害事象は認められな かった EM 患者及び IM 患者のいずれにおいても用量依存な発現率の増加が認められた食欲 減退及び傾眠について、ATX_ALL 群で報告された最大重症度を比べた。食欲減退につ
いて、EM 患者では軽度が 87.5%(14/16)、中等度が 12.5%(2/16)であり、IM 患者で は、軽度が 83.3%(5/6)、中等度が 16.7%(1/6)であった。EM 患者及び IM 患者のい ずれにおいても、多くは軽度であり、アトモキセチン高用量群で中等度が増加する傾向 は見られなかった。傾眠について、EM 患者では軽度が 85.7%(12/14)、中等度が 14.3%(2/14)であり、IM 患者では、軽度が 100%(4/4)であった。IM 患者において中 等度の傾眠は報告されておらず、EM 患者においてもアトモキセチン高用量群で中等度 が増加する傾向は見られなかった。 これらは分類方法 2 においても同様の結果であった(表 2.7.4.7-97~99)。 以上、食欲減退及び傾眠に関しては、IM 患者で EM 患者より発現率が高く、いずれ においても用量依存的に発現率も増加していた。しかし、これらの有害事象の重症度は、 EM 患者及び IM 患者のいずれにおいても多くは軽度であり、用量依存的に重症度が高 くなる傾向も見られなかった。IM 患者の例数が EM 患者に比べ少ないため例数のばら つきが発現率に影響した可能性も考えられた。1 件以上の有害事象発現率では、EM 患 者でプラセボ群に比べ ATX_ALL 群で発現率が高かった。一方、IM 患者では ATX_ALL 群に比べプラセボ群で発現率が高かったことから、CYP2D6 遺伝子型の違いにより一方 の有害事象が高く発現するような傾向は認められなかった。
ストラテラカプセル 594 表 2.7 .4-370. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別の有害事象( LYBC 試験) PLC ATX _ 0. 5 ATX _ 1. 2 ATX _ 1. 8 ATX _ ALL 事象分 類 Med DRA Version 9.1 CYP2D6 遺伝子 型 * N n (% ) N n (% ) N n (% ) N n (% ) N n (% ) EM 51 33( 64.7) 46 38( 82.6) 45 35( 77.8) 50 38( 76.0) 141 111( 78.7) 1 件以上の有害事象が認められた症例数 IM 11 10( 90.9) 15 11( 73.3) 14 11( 78.6) 11 10( 90.9) 40 32( 80.0) EM 51 8( 15.7) 46 10( 21.7) 45 7( 15.6) 50 10( 20.0) 141 27( 19.1) 鼻咽頭炎 Nasophar y ng itis IM 11 2( 18.2) 15 1( 6 .7) 14 0( 0 .0) 11 1( 9 .1) 40 2( 5 .0) EM 51 2( 3 .9) 46 6( 13.0) 45 7( 15.6) 50 7( 14.0) 141 20( 14.2) 頭痛 Headach e IM 11 2( 18.2) 15 1( 6 .7) 14 3( 21.4) 11 2( 18.2) 40 6( 15.0) EM 51 2( 3 .9) 46 3( 6 .5) 45 4( 8 .9) 50 9( 18.0) 141 16( 11.3) 食欲減退 Decreas ed app et ite IM 11 0( 0 .0) 15 0( 0 .0) 14 2( 14.3) 11 4( 36.4) 40 6( 15.0) EM 51 4( 7 .8) 46 4( 8 .7) 45 4( 8 .9) 50 6( 12.0) 141 14( 9 .9) 傾眠 S o m nolence IM 11 0( 0 .0) 15 0( 0 .0) 14 2( 14.3) 11 2( 18.2) 40 4( 10.0) EM 51 2( 3 .9) 46 2( 4 .3) 45 5( 11.1) 50 5( 10.0) 141 12( 8 .5) 悪心 Naus ea IM 11 1( 9 .1) 15 2( 13.3) 14 1( 7 .1) 11 1( 9 .1) 40 4( 10.0) EM 51 0( 0 .0) 46 3( 6 .5) 45 6( 13.3) 50 3( 6 .0) 141 12( 8 .5) 嘔吐 Vom iting IM 11 0( 0 .0) 15 0( 0 .0) 14 1( 7 .1) 11 2( 18.2) 40 3( 7 .5) EM 51 4( 7 .8) 46 3( 6 .5) 45 3( 6 .7) 50 1( 2 .0) 141 7( 5 .0) 腹痛 Abdominal pain IM 11 1( 9 .1) 15 2( 13.3) 14 1( 7 .1) 11 1( 9 .1) 40 4( 10.0) EM 51 1( 2 .0) 46 1( 2 .2) 45 5( 11.1) 50 3( 6 .0) 141 9( 6 .4) 下痢 Diarrhoea IM 11 1( 9 .1) 15 0( 0 .0) 14 0( 0 .0) 11 1( 9 .1) 40 1( 2 .5) 全患者を対象としてアトモキセチン群全体で比較的よく見られた有害事象( 5% 以上の発現率) 分類方法 1 : PM 、 IM 、 EM ( ヘテロ接合型 EM 、ホモ接合型 EM 及び UM ) *PM は解析か ら除外した。 t14_23f_ .lst
表 2.7.4-371. CYP2D6 EM 患者(分類方法 1)における有害事象の重症度別表示 (LYBC 試験) 事象分類 Version 9.1 MedDRA 投与群 例数 軽度 n (%) 中等度 n (%) 高度 n (%) 合計 n (%) PLC 51 31( 60.8) 2( 3.9) 0( 0.0) 33( 64.7) ATX_0.5 46 30( 65.2) 8( 17.4) 0( 0.0) 38( 82.6) ATX_1.2 45 32( 71.1) 3( 6.7) 0( 0.0) 35( 77.8) ATX_1.8 50 34( 68.0) 4( 8.0) 0( 0.0) 38( 76.0) 1件以上の有害事象が認められた症例数 ATX_ALL 141 96( 68.1) 15( 10.6) 0( 0.0) 111( 78.7) PLC 51 8( 15.7) 0( 0.0) 0( 0.0) 8( 15.7) ATX_0.5 46 10( 21.7) 0( 0.0) 0( 0.0) 10( 21.7) ATX_1.2 45 5( 11.1) 2( 4.4) 0( 0.0) 7( 15.6) ATX_1.8 50 10( 20.0) 0( 0.0) 0( 0.0) 10( 20.0) 鼻咽頭炎 Nasopharyngitis ATX_ALL 141 25( 17.7) 2( 1.4) 0( 0.0) 27( 19.1) PLC 51 2( 3.9) 0( 0.0) 0( 0.0) 2( 3.9) ATX_0.5 46 6( 13.0) 0( 0.0) 0( 0.0) 6( 13.0) ATX_1.2 45 6( 13.3) 1( 2.2) 0( 0.0) 7( 15.6) ATX_1.8 50 6( 12.0) 1( 2.0) 0( 0.0) 7( 14.0) 頭痛 Headache ATX_ALL 141 18( 12.8) 2( 1.4) 0( 0.0) 20( 14.2) PLC 51 2( 3.9) 0( 0.0) 0( 0.0) 2( 3.9) ATX_0.5 46 3( 6.5) 0( 0.0) 0( 0.0) 3( 6.5) ATX_1.2 45 3( 6.7) 1( 2.2) 0( 0.0) 4( 8.9) ATX_1.8 50 8( 16.0) 1( 2.0) 0( 0.0) 9( 18.0) 食欲減退 Decreased appetite ATX_ALL 141 14( 9.9) 2( 1.4) 0( 0.0) 16( 11.3) PLC 51 4( 7.8) 0( 0.0) 0( 0.0) 4( 7.8) ATX_0.5 46 4( 8.7) 0( 0.0) 0( 0.0) 4( 8.7) ATX_1.2 45 3( 6.7) 1( 2.2) 0( 0.0) 4( 8.9) ATX_1.8 50 5( 10.0) 1( 2.0) 0( 0.0) 6( 12.0) 傾眠 Somnolence ATX_ALL 141 12( 8.5) 2( 1.4) 0( 0.0) 14( 9.9) PLC 51 2( 3.9) 0( 0.0) 0( 0.0) 2( 3.9) ATX_0.5 46 2( 4.3) 0( 0.0) 0( 0.0) 2( 4.3) ATX_1.2 45 5( 11.1) 0( 0.0) 0( 0.0) 5( 11.1) ATX_1.8 50 5( 10.0) 0( 0.0) 0( 0.0) 5( 10.0) 悪心 Nausea ATX_ALL 141 12( 8.5) 0( 0.0) 0( 0.0) 12( 8.5) PLC 51 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_0.5 46 3( 6.5) 0( 0.0) 0( 0.0) 3( 6.5) ATX_1.2 45 5( 11.1) 1( 2.2) 0( 0.0) 6( 13.3) ATX_1.8 50 3( 6.0) 0( 0.0) 0( 0.0) 3( 6.0) 嘔吐 Vomiting ATX_ALL 141 11( 7.8) 1( 0.7) 0( 0.0) 12( 8.5) PLC 51 4( 7.8) 0( 0.0) 0( 0.0) 4( 7.8) ATX_0.5 46 3( 6.5) 0( 0.0) 0( 0.0) 3( 6.5) ATX_1.2 45 3( 6.7) 0( 0.0) 0( 0.0) 3( 6.7) ATX_1.8 50 1( 2.0) 0( 0.0) 0( 0.0) 1( 2.0) 腹痛 Abdominal pain ATX_ALL 141 7( 5.0) 0( 0.0) 0( 0.0) 7( 5.0) PLC 51 1( 2.0) 0( 0.0) 0( 0.0) 1( 2.0) ATX_0.5 46 1( 2.2) 0( 0.0) 0( 0.0) 1( 2.2) ATX_1.2 45 4( 8.9) 1( 2.2) 0( 0.0) 5( 11.1) ATX_1.8 50 3( 6.0) 0( 0.0) 0( 0.0) 3( 6.0) 下痢 Diarrhoea ATX_ALL 141 8( 5.7) 1( 0.7) 0( 0.0) 9( 6.4) 全患者を対象としてアトモキセチン群全体で比較的よく見られた有害事象(5%以上の発現率) 同一患者で同一の事象が 2 回以上報告された場合、そのうちの最大重症度を示した。
分類方法 1:EM(ヘテロ接合型 EM、ホモ接合型 EM 及び UM) A_T14_19_IMEM_EM_CYP1.tsv
596 表 2.7.4-372. CYP2D6 IM 患者(分類方法 1)における有害事象の重症度別表示 (LYBC 試験) 事象分類 Version 9.1 MedDRA 投与群 例数 軽度 n (%) 中等度 n (%) 高度 n (%) 合計 n (%) PLC 11 10( 90.9) 0( 0.0) 0( 0.0) 10( 90.9) ATX_0.5 14 8( 57.1) 2( 14.3) 0( 0.0) 10( 71.4) ATX_1.2 14 7( 50.0) 4( 28.6) 0( 0.0) 11( 78.6) ATX_1.8 11 9( 81.8) 1( 9.1) 0( 0.0) 10( 90.9) 1件以上の有害事象が認められた症例数 ATX_ALL 39 24( 61.5) 7( 17.9) 0( 0.0) 31( 79.5) PLC 11 2( 18.2) 0( 0.0) 0( 0.0) 2( 18.2) ATX_0.5 14 1( 7.1) 0( 0.0) 0( 0.0) 1( 7.1) ATX_1.2 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.8 11 1( 9.1) 0( 0.0) 0( 0.0) 1( 9.1) 鼻咽頭炎 Nasopharyngitis ATX_ALL 39 2( 5.1) 0( 0.0) 0( 0.0) 2( 5.1) PLC 11 2( 18.2) 0( 0.0) 0( 0.0) 2( 18.2) ATX_0.5 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.2 14 2( 14.3) 1( 7.1) 0( 0.0) 3( 21.4) ATX_1.8 11 1( 9.1) 1( 9.1) 0( 0.0) 2( 18.2) 頭痛 Headache ATX_ALL 39 3( 7.7) 2( 5.1) 0( 0.0) 5( 12.8) PLC 11 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_0.5 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.2 14 1( 7.1) 1( 7.1) 0( 0.0) 2( 14.3) ATX_1.8 11 4( 36.4) 0( 0.0) 0( 0.0) 4( 36.4) 食欲減退 Decreased appetite ATX_ALL 39 5( 12.8) 1( 2.6) 0( 0.0) 6( 15.4) PLC 11 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_0.5 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.2 14 2( 14.3) 0( 0.0) 0( 0.0) 2( 14.3) ATX_1.8 11 2( 18.2) 0( 0.0) 0( 0.0) 2( 18.2) 傾眠 Somnolence ATX_ALL 39 4( 10.3) 0( 0.0) 0( 0.0) 4( 10.3) PLC 11 1( 9.1) 0( 0.0) 0( 0.0) 1( 9.1) ATX_0.5 14 1( 7.1) 0( 0.0) 0( 0.0) 1( 7.1) ATX_1.2 14 1( 7.1) 0( 0.0) 0( 0.0) 1( 7.1) ATX_1.8 11 1( 9.1) 0( 0.0) 0( 0.0) 1( 9.1) 悪心 Nausea ATX_ALL 39 3( 7.7) 0( 0.0) 0( 0.0) 3( 7.7) PLC 11 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_0.5 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.2 14 1( 7.1) 0( 0.0) 0( 0.0) 1( 7.1) ATX_1.8 11 0( 0.0) 2( 18.2) 0( 0.0) 2( 18.2) 嘔吐 Vomiting ATX_ALL 39 1( 2.6) 2( 5.1) 0( 0.0) 3( 7.7) PLC 11 1( 9.1) 0( 0.0) 0( 0.0) 1( 9.1) ATX_0.5 14 2( 14.3) 0( 0.0) 0( 0.0) 2( 14.3) ATX_1.2 14 1( 7.1) 0( 0.0) 0( 0.0) 1( 7.1) ATX_1.8 11 1( 9.1) 0( 0.0) 0( 0.0) 1( 9.1) 腹痛 Abdominal pain ATX_ALL 39 4( 10.3) 0( 0.0) 0( 0.0) 4( 10.3) PLC 11 1( 9.1) 0( 0.0) 0( 0.0) 1( 9.1) ATX_0.5 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.2 14 0( 0.0) 0( 0.0) 0( 0.0) 0( 0.0) ATX_1.8 11 0( 0.0) 1( 9.1) 0( 0.0) 1( 9.1) 下痢 Diarrhoea ATX_ALL 39 0( 0.0) 1( 2.6) 0( 0.0) 1( 2.6) 全患者を対象としてアトモキセチン群全体で比較的よく見られた有害事象(5%以上の発現率) 同一患者で同一の事象が 2 回以上報告された場合、そのうちの最大重症度を示した。
分類方法 1:EM(ヘテロ接合型 EM、ホモ接合型 EM 及び UM) A_T14_19_IMEM_IM_CYP1.tsv 2.7.4.5.1.1.1.1.2 長期継続投与試験:LYBC 試験・LYDA 試験併合解析 LYBC 試験及び長期継続投与試験である LYDA 試験の結果を併合し、アトモキセチン が 1 回以上投与された患者を対象とし、EM 患者又は IM 患者のいずれかにおいて、5% 以上の発現率を示した有害事象を評価した。分類方法 1 による EM/IM 別の有害事象を 表 2.7.4-373 に示した。分類方法 2 の結果を、第 2.7.4.7.4.1.1.2.1 項に示した。 分類方法 1 により EM/IM を分類したとき、評価期間(0~3 年)を通じて 1 件以上の 有害事象が認められた患者の割合は、EM 患者で 85.8%(139/162)、IM 患者で 93.6% (44/47)であった。 全評価期間(0~3 年)における各有害事象の発現率について、IM 患者及び EM 患者 の差が 10%以上認められたのは、鼻咽頭炎、頭痛及び腹痛であった。このうち、EM 患 者に比べ IM 患者で発現率が高かったのは、頭痛及び腹痛であった。
0~6 ヵ月以内と 6~12 ヵ月までの評価期間における有害事象の発現頻度を比べると、 6~12 ヵ月で EM 患者及び IM 患者ともに発現頻度が低い傾向を示した。 分類方法 2 において、全評価期間(0~3 年)において、1 件以上有害事象が認められ た患者の割合は、分類方法 1 と同様であった(EM’群 85.9%、IM’群 91.7%)。全評価期 間(0~3 年)における各有害事象の発現率について、IM 患者及び EM 患者の差が 10% 以上認められたのは、鼻咽頭炎及び頭痛であった。このうち、EM 患者に比べ IM 患者 で発現率が高かったのは、頭痛であった(表 2.7.4.7-104)。 以上、12~24 ヵ月の評価期間における患者が少ないため、期間別の評価は難しいが、 全評価期間における有害事象の発現頻度に、EM 患者及び IM 患者の間に大きな差は見 られなかった。
ストラテラカプセル 598 表 2.7 .4-373. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別の有害事象( LYBC 試験・ LYDA 試験併合解析 (注 1) ) 有害事象名 MedDRA PT(V er 9.1) CYP 2D6 遺伝子型 * 0 ~ 3 年 N n( %) 0 ~ 6 ヵ月以内 N n( %) 6 ~ 12 ヵ月 N n( %) 12 ~ 24 ヵ月 N n( %) 24 ~ 36 ヵ月 N n( %) E M 162 139( 85. 8) 162 138( 85. 2) 62 49( 79. 0) 16 9( 56. 3) 0 0( 0. 0) 1 件以上 の有害事 象が認 められた 症例数 IM 47 44( 93. 6) 47 44( 93. 6) 23 14( 60. 9) 5 5( 100. 0) 0 0( 0. 0) E M 162 23( 14. 2) 162 24( 14. 8) 62 13( 21. 0) 16 7( 43. 8) 0 0( 0. 0) 有 害事象 が認めら れなか った症例 数 IM 47 3( 6. 4) 47 3( 6. 4) 23 9( 39. 1) 5 0( 0. 0) 0 0( 0. 0) E M 162 54( 33. 3) 162 51( 31. 5) 62 8( 12. 9) 16 2( 12. 5) 0 0( 0. 0) 鼻 咽頭炎 Nasophary ngitis IM 47 6( 12. 8) 47 6( 12. 8) 23 2( 8. 7) 5 0( 0. 0) 0 0( 0. 0) E M 162 29( 17. 9) 162 27( 16. 7) 62 8( 12. 9) 16 0( 0. 0) 0 0( 0. 0) 頭痛 Headache IM 47 16( 34. 0) 47 15( 31. 9) 23 3( 13. 0) 5 0( 0. 0) 0 0( 0. 0) E M 162 23( 14. 2) 162 22( 13. 6) 62 5( 8. 1) 16 0( 0. 0) 0 0( 0. 0) 食 欲減退 Decreased appetite IM 47 8( 17. 0) 47 8( 17. 0) 23 1( 4. 3) 5 1( 20. 0) 0 0( 0. 0) E M 162 23( 14. 2) 162 23( 14. 2) 62 4( 6. 5) 16 0( 0. 0) 0 0( 0. 0) 傾眠 So m nolence IM 47 6( 12. 8) 47 4( 8. 5) 23 1( 4. 3) 5 1( 20. 0) 0 0( 0. 0) E M 162 16( 9. 9) 162 14( 8. 6) 62 3( 4. 8) 16 0( 0. 0) 0 0( 0. 0) 腹痛 Abdo m inal pain IM 47 10( 21. 3) 47 8( 17. 0) 23 3( 13. 0) 5 2( 40. 0) 0 0( 0. 0) E M 162 20( 12. 3) 162 16( 9. 9) 62 6( 9. 7) 16 0( 0. 0) 0 0( 0. 0) 下痢 Diarrhoea IM 47 3( 6. 4) 47 2( 4. 3) 23 1( 4. 3) 5 0( 0. 0) 0 0( 0. 0) E M 162 18( 11. 1) 162 17( 10. 5) 62 2( 3. 2) 16 0( 0. 0) 0 0( 0. 0) 悪心 Nausea IM 47 6( 12. 8) 47 5( 10. 6) 23 1( 4. 3) 5 0( 0. 0) 0 0( 0. 0) E M 162 14( 8. 6) 162 11( 6. 8) 62 3( 4. 8) 16 0( 0. 0) 0 0( 0. 0) イ ンフル エンザ In fluenza IM 47 6( 12. 8) 47 5( 10. 6) 23 1( 4. 3) 5 0( 0. 0) 0 0( 0. 0) E M 162 16( 9. 9) 162 15( 9. 3) 62 4( 6. 5) 16 0( 0. 0) 0 0( 0. 0) 嘔吐 Vo m iting IM 47 4( 8. 5) 47 4( 8. 5) 23 0( 0. 0) 5 0( 0. 0) 0 0( 0. 0) E M 162 15( 9. 3) 162 12( 7. 4) 62 3( 4. 8) 16 1( 6. 3) 0 0( 0. 0) 発熱 Pyrexia IM 47 4( 8. 5) 47 3( 6. 4) 23 0( 0. 0) 5 1( 20. 0) 0 0( 0. 0) E M 162 12( 7. 4) 162 10( 6. 2) 62 5( 8. 1) 16 0( 0. 0) 0 0( 0. 0) 上 気道の 炎症 Upper r espir atory tr act infla m m ation IM 47 3( 6. 4) 47 2( 4. 3) 23 1( 4. 3) 5 0( 0. 0) 0 0( 0. 0) E M 162 7( 4. 3) 162 7( 4. 3) 62 2( 3. 2) 16 0( 0. 0) 0 0( 0. 0) 便秘 Constipation IM 47 5( 10. 6) 47 3( 6. 4) 23 2( 8. 7) 5 2( 40. 0) 0 0( 0. 0) E M 162 8( 4. 9) 162 7( 4. 3) 62 1( 1. 6) 16 0( 0. 0) 0 0( 0. 0) 齲歯 Dental car ies IM 47 4( 8. 5) 47 3( 6. 4) 23 1( 4. 3) 5 1( 20. 0) 0 0( 0. 0) E M 162 7( 4. 3) 162 6( 3. 7) 62 2( 3. 2) 16 0( 0. 0) 0 0( 0. 0) 挫傷 Contusio n IM 47 2( 4. 3) 47 2( 4. 3) 23 0( 0. 0) 5 0( 0. 0) 0 0( 0. 0) 全 試験期 間( 0 ~ 3 年)を 通して、 CYP2D6 EM 患者又 は IM 患者 で 5% 以上の 発現率 が見ら れた事象 対象 0~ 6 ヵ月: アトモ キセチ ン投与例 かつベ ースライ ンと投 与後観察 値を有 する症例 6 ヵ月~ 1 年: アト モキセ チン 6 ヵ 月投与 例かつベ ースラ インと投 与後観 察値を有 する症 例 1 年~ 2 年:ア トモ キセチ ン 1 年投 与例か つベース ライン と投与後 観察値 を有する 症例 2 年~ 3 年:ア トモ キセチ ン 2 年投 与例か つベース ライン と投与後 観察値 を有する 症例 分類 方法 1 : PM 、 IM 、 EM ( ヘ テ ロ接合 型 EM 、 ホモ接 合型 EM 及び UM ) *PM は 解析か ら除 外した 。 A_T 1 2_03 _T E A E _ (C YP2D6_1 E M _I M ). tsv ( 注 1 ):表 2. 7. 4-3 参照
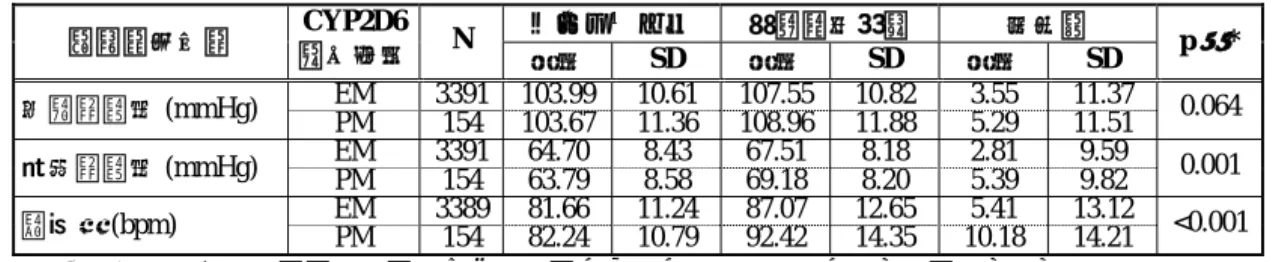
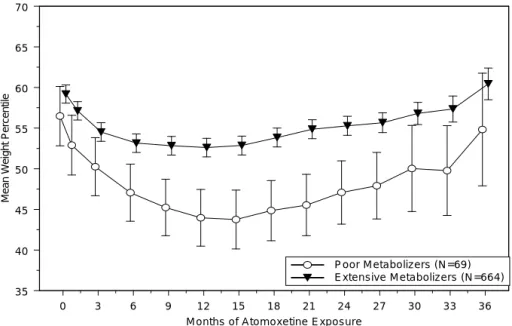
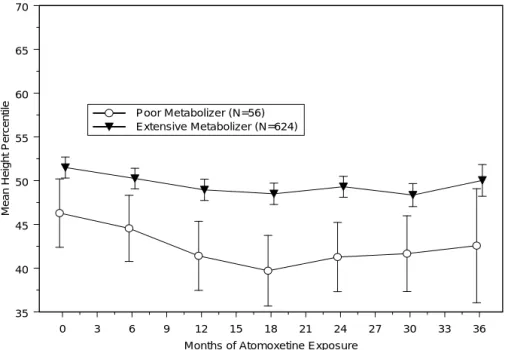
2.7.4.5.1.1.1.2 バイタルサイン、身長及び体重 2.7.4.5.1.1.1.2.1 プラセボ対照二重盲験比較試験:LYBC 試験 LYBC 試験より、分類方法 1 で EM/IM を分類したとき、バイタルサイン、身長及び体 重におけるベースラインから最終観察時点までの平均変化量を表 2.7.4-374 に示した。分 類方法 2 の結果を、第 2.7.4.7.4.1.1.1.2 項に示した。 収縮期血圧について、EM 患者及び IM 患者のいずれも、プラセボ群に比べいずれの 投与群においてもベースラインからの平均変化量に統計学的に有意な差はなく、部分集 団(EM 患者及び IM 患者)と投与群に有意な交互作用は認められなかった(p=0.712)。 拡張期血圧については、EM 患者において、プラセボ群に比べ ATX_1.2 群及び ATX_1.8 群でベースラインからの平均変化量が統計学的に有意に増加した。プラセボ群 との差は、いずれの投与群においても IM 患者と EM 患者の間で大きな違いはなく、部 分 集 団 ( EM 患者及び IM 患者)と投与群に有意な交互作用は認められなかった (p=0.834)。 脈拍数について、EM 患者及び IM 患者のいずれも、プラセボに比べ ATX_1.2 群及び ATX_1.8 群でベースラインからの平均変化量が統計学的に有意に増加した。プラセボ群 との差は、EM 患者に比べ IM 患者でいずれの投与群でも 2 倍程度大きかった。しかし、 最終観察時点で最も高値を示した IM 患者の ATX_1.8 群において、平均値が 99.45 bpm であったことより、これらの変動は臨床的に重大な問題とは考えられなかった。 身長について、EM 患者の ATX_1.2 群におけるベースラインからの平均変化量が、統 計学的に有意に減少した。プラセボ群との差は、いずれの投与群においても IM 患者と EM 患者の間で大きな違いはなく、部分集団(EM 患者及び IM 患者)と投与群に有意な 交互作用は認められなかった(p=0.906) 体重について、EM 患者及び IM 患者のいずれも、プラセボ群に比べ、すべての投与 群でベースラインからの平均変化量が統計学的に有意に減少した。プラセボ群との差は、 いずれの投与群においても EM 患者と IM 患者の間で大きな違いはなく、最も低値を示 したのは、EM 患者及び IM 患者とも ATX_1.8 群でそれぞれ-1.67 kg 及び-1.74 kg であっ た。また、部分集団(EM 患者及び IM 患者)と投与群の間に有意な交互作用は認めら れなかった(p=0.909)。 分類方法 2 により分類された EM’患者及び IM’患者において、脈拍数、拡張期血圧、 身長及び体重について、プラセボ群との差は分類方法 1 と同様の結果であった(表 2.7.4.7-100)。収縮期血圧について、プラセボとの差が IM’患者に比べ EM’患者で大き か っ た が 、 EM’患 者 及び IM’患者の いず れにお いて も最終 観察 時点の 平均 値が約 106 mmHg で、平均変化量が最大でも 5.50 mmHg(IM 患者のプラセボ群)であることよ り臨床的に問題とは考えられなかった。
ストラテラカプセル 600 表 2.7 .4-374. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別バイタルサインのベースラインから最終観察時点までの変化量( LYBC 試験) ベース ライ ン 最終観 察時 点 変化量 95% CI 項目 (単位 ) CYP2D6 遺伝子 型 *** 投与群 N 平均 SD 平均 SD 平均 SD 差 信頼 下限 信頼 上限 p 値 * PLC 51 103.27 11.84 102.96 10.65 -0.31 12.90 ATX_0.5 46 104.85 10.25 104.78 10.77 -0 .07 12.55 1.32 -2.55 5.20 0.500 ATX_1.2 45 103.00 10.18 106.69 10.06 3.69 10.45 3.81 -0.07 7.70 0.054 EM ATX_1.8 50 102.08 10.74 105.34 9.27 3.26 12.32 2.76 -1.03 6.54 0.153 PLC 11 94.00 12.84 99.45 12.32 5.45 13.16 ATX_0.5 15 98.07 9.01 100.60 12.93 2. 53 10.65 -1.32 -9.92 7.27 0.758 ATX_1.2 14 97.86 7.79 102.50 9.44 4.64 8.07 0.70 -8.01 9.41 0.872 IM ATX_1.8 11 102.73 8.22 108.09 13.21 5.36 12.98 3.34 -6.22 12.90 0.486 部分集団の効果 ** 0 .7 9 6 収縮期血圧 (mm Hg ) 部分集団と投与群の交互作用 ** 0 .7 1 2 PLC 51 57.88 10.54 58.43 8.92 0.55 10.35 ATX_0.5 46 59.02 10.30 61.00 9.01 1.98 9.85 2.13 -1.02 5.28 0.183 ATX_1.2 45 58.82 8.86 62.11 7.56 3.29 8.87 3.32 0.15 6.49 0.040 EM ATX_1.8 50 57.84 9.68 63.28 9.08 5.44 10.46 4.86 1.78 7.94 0.002 PLC 11 54.18 8.30 55.55 8.24 1.36 7.13 ATX_0.5 15 56.80 8.65 61.60 8.87 4.80 9.81 5.41 -1.03 11.86 0.098 ATX_1.2 14 54.00 7.73 61.14 7.72 7.14 10.11 5.64 -0.86 12.14 0.087 IM ATX_1.8 11 58.36 8.04 62.82 7.67 4.45 12.55 6.25 -0.73 13.23 0.078 部分集団の効果 ** 0 .9 9 6 拡張期血圧 (mm Hg ) 部分集団と投与群の交互作用 ** 0 .8 3 4 PLC 51 81.37 12.56 81.96 10.47 0.59 12.79 ATX_0.5 46 80.54 12.88 85.63 10.03 5.09 11.28 3.97 -0.57 8.50 0.086 ATX_1.2 45 79.64 12.36 88.13 14.41 8.49 18.33 6.79 2.22 11.36 0.004 EM ATX_1.8 50 84.24 12.94 90.44 13.27 6.20 12.57 7.46 3.00 11.91 0.001 PLC 11 77.00 7.69 76.36 8.24 -0.64 8.59 ATX_0.5 15 82.40 11.20 86.73 12.99 4.33 12.97 6.70 -2.12 15.52 0.133 ATX_1.2 14 85.86 10.76 95.07 11.62 9.21 10.36 12.70 3.53 21.86 0.008 IM ATX_1.8 11 82.91 14.86 99.45 18.53 16.55 12.55 19.08 9.60 28.56 <0.001 部分集団の効果 ** 0 .1 4 5 脈拍数 (bpm ) 部分集団と投与群の交互作用 ** 0 .0 7 4 (続く)
ストラテラカプセル 遺伝子型(分類方法 1 : EM/I M )別バイタルサインのベースラインから最終観察時点までの変化量( LYBC 試験)(続き) ベース ライ ン 最終観 察時 点 変化量 95% CI CYP2D6 遺伝子 型 *** 投与群 N 平均 SD 平均 SD 平均 SD 差 信頼 下限 信頼 上限 p 値 * PLC 50 138.62 12.12 139.82 12.20 1.21 0.73 ATX_0.5 46 138.97 14.35 139.80 14.17 0. 83 0.75 -0.37 -0.79 0.04 0.075 ATX_1.2 45 139.76 13.86 140.49 14.09 0. 72 1.46 -0.49 -0.90 -0.07 0.022 EM ATX_1.8 50 140.37 14.93 141.28 15.19 0. 92 1.02 -0.30 -0.70 0.11 0.148 PLC 11 144.36 9.77 145.48 9.73 1.12 0.45 ATX_0.5 15 133.01 13.31 134.06 13.27 1. 05 0.65 -0.22 -0.79 0.35 0.438 ATX_1.2 14 138.38 18.61 139.10 18.35 0. 72 0.84 -0.48 -1.04 0.09 0.095 IM ATX_1.8 11 139.06 18.77 140.08 18.42 1. 02 0.80 -0.17 -0.76 0.42 0.567 部分集団の効果 ** 0 .7 1 5 部分集団と投与群の交互作用 ** 0 .9 0 6 PLC 51 35.29 9.87 36.26 10.00 0.97 0.98 ATX_0.5 46 35.45 11.03 35.56 11.21 0.11 0.95 -0.85 -1.30 -0.40 <0.001 ATX_1.2 45 36.90 11.75 36.55 11.62 -0. 35 1.20 -1.30 -1.75 -0.84 <0.001 EM ATX_1.8 50 36.89 11.55 36.16 10.98 -0. 72 1.36 -1.67 -2.11 -1.23 <0.001 PLC 11 37.45 8.99 38.10 9.29 0.65 0.95 ATX_0.5 15 30.94 12.37 30.71 12.07 -0. 23 0.86 -1.05 -1.87 -0.22 0.014 ATX_1.2 14 33.57 13.28 32.66 12.95 -0. 91 1.23 -1.66 -2.49 -0.84 <0.001 IM ATX_1.8 11 36.25 16.13 35.20 15.59 -1. 05 1.14 -1.74 -2.61 -0.87 <0.001 部分集団の効果 ** 0 .0 1 9 部分集団と投与群の交互作用 ** 0 .9 0 9 p 値は共 分散分析に基づき算出された。 = ベースライン + 投与群 p 値は共分散分析に基づき算出された。 = ベースライン + 投与群 + 部 分集団 + 部分 集団と投与群の交互作用 PM 、 IM 、 EM ( ヘテロ接合型 EM 、ホモ接合型 EM 及び UM ) から除外した。 b_VITAL_cy pb .tsv
602
分類方法 1 によるカテゴリー解析の結果、EM 患者及び IM 患者においてバイタルサイ ン及び体重に異常を示した患者の割合を表 2.7.4-375 に示した。
脈拍数については、脈拍数の基準 A(110 bpm 以上)、基準 B(変化量が 25 bpm 以 上)及び基準 C(A かつ B)に該当する患者の割合は、ATX_ALL 群において、EM 患者 (基準 A:11.6%、B:22.7%、C:5.1%)に比べて IM 患者(基準 A:28.2%、B:30.0%、 C:17.9%)で大きかった。これは、アトモキセチンの薬理作用によるものと考えられた。 体重については、基準 D(3.5%以上減少)に該当した患者の割合は、アトモキセチン のいずれの群においても EM 患者に比べ IM 患者で大きかった。基準 D に該当する患者 のうち有害事象として体重減少が報告された患者は、EM 患者においてプラセボ、 ATX_0.5、ATX_1.2、ATX_1.8 群でそれぞれ 0 例、1 例(中等度)、1 例(中等度)、2 例(軽度 1 例、中等度 1 例)であった。一方、IM 患者では、ATX_1.8 群の 1 例(軽度) のみであった。また、体重減少の有害事象による中止はなかった。これより、IM 患者 で EM 患者に比べ基準 D に該当した患者の割合が大きかったことが、臨床的に問題のあ るものではないと考えられた。 分類方法 2 においても同様の結果であった(表 2.7.4.7-101)。 以上、バイタルサイン、身長及び体重について、分類方法 1 及び 2 による CYP2D6 遺 伝子型の分類により臨床的に問題となるような差は認められなかった。
ストラテラカプセル 2.7 .4-375. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別バイタルサイン異常を示した患者の割合( LYBC 試験) PLC ATX _ 0. 5 ATX _ 1. 2 ATX _ 1. 8 ATX _ ALL CYP2D6 遺伝子 型 *** N n % N n % N n % N n % N n % EM 50 3 6.0 44 3 6.8 45 5 11.1 49 8 16.3 138 16 11.6 IM 11 0 0.0 15 3 20.0 14 5 35.7 10 3 30.0 39 11 28.2 EM 51 4 7.8 46 7 15.2 45 17 37.8 50 8 16.0 141 32 22.7 IM 11 2 18.2 15 3 20.0 14 4 28.6 11 5 45.5 40 12 30.0 EM 50 2 4.0 44 0 0.0 45 2 4.4 49 5 10.2 138 7 5.1 IM 11 0 0.0 15 2 13.3 14 3 21.4 10 2 20.0 39 7 17.9 EM 51 0 0.0 46 3 6.5 45 8 17.8 50 15 30.0 141 26 18.4 IM 11 0 0.0 15 1 6.7 14 7 50.0 11 5 45.5 40 13 32.5 EM 51 0 0.0 46 0 0.0 45 0 0.0 50 0 0.0 141 0 0.0 IM 11 0 0.0 15 1 6.7 14 0 0.0 11 0 0.0 40 1 2.5 EM 51 4 7.8 46 3 6.5 45 2 4.4 48 4 8.3 139 9 6.5 IM 11 0 0.0 15 2 13.3 14 3 21.4 11 2 18.2 40 7 17.5 以上 25 bpm 以上 3.5% 以上減少 、 IM 、 EM ( ヘテロ接合型 EM 、ホモ接合型 EM 及び UM ) _WGTb_VITAL_CATE_ CYPB_ _EGT.tsv
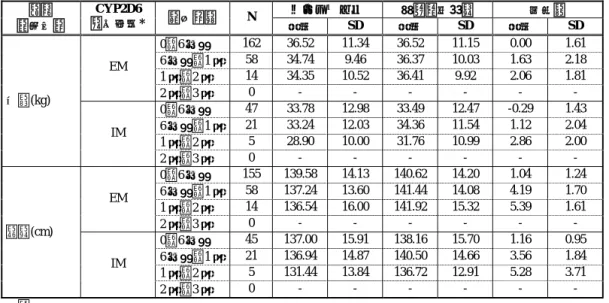
604 2.7.4.5.1.1.1.2.2 長期継続投与試験:LYBC 試験・LYDA 試験併合解析 LYBC 試験及び長期継続投与試験である LYDA 試験の結果を併合し、アトモキセチン が 1 回以上投与された患者を対象とし、CYP2D6 遺伝子型の分類方法 1 及び 2 における バイタルサインを評価した。 分類方法 1 により EM/IM を分類したときのバイタルサイン、身長及び体重における ベースラインから最終観察時点までの平均変化量を投与期間別に表 2.7.4-376 に示した。 分類方法 2 の結果を、第 2.7.4.7.4.1.1.2.2 項に示した。 脈拍数及び収縮期血圧について、IM 患者と EM 患者の間で最も大きな違いがあった のは評価期間 1~2 年で、その変化量は、EM 患者に比べ IM 患者で大きかった(脈拍 数:EM 患者 0.71 bpm、IM 患者 17.00 bpm、収縮期血圧:EM 患者 4.00 mmHg、IM 患者 11.40 mmHg)。脈拍数及び血圧の増加はアトモキセチンの薬理的作用によるものであり、 最終観察時点における IM 患者の脈拍数が 97.20 bpm、収縮期血圧が 110.20 mmHg であ ることより、臨床的に問題とは考えられなかった。 拡張期血圧、体重及び身長について、EM 患者及び IM 患者における平均変化量は、 どの評価期間においても同程度であった。 分類方法 2 においても同様であった(表 2.7.4.7-105)。 表 2.7.4-376. CYP2D6 遺伝子型(分類方法 1:EM/IM)別バイタルサインの ベースラインから最終観察時点までの変化量(LYBC 試験・LYDA 試験併合解析(注1)) ベースライン 最終観察時点 変化量 項目 (単位) CYP2D6 遺伝子型* 評価期間 N 平均 SD 平均 SD 平均 SD 0~6 ヵ月 162 81.33 12.29 89.22 14.51 7.88 16.03 6 ヵ月~1 年 58 84.00 13.84 91.57 15.27 7.57 14.98 1 年~2 年 14 84.57 12.89 85.29 14.76 0.71 20.57 EM 2 年~3 年 0 - - - 0~6 ヵ月 47 82.68 11.58 90.13 12.90 7.45 12.16 6 ヵ月~1 年 21 79.86 10.00 89.81 12.87 9.95 17.12 1 年~2 年 5 80.20 9.91 97.20 21.11 17.00 20.22 脈拍数(bpm) IM 2 年~3 年 0 - - - 0~6 ヵ月 162 103.29 10.50 105.27 10.21 1.98 11.30 6 ヵ月~1 年 58 102.79 8.80 105.47 10.14 2.67 12.43 1 年~2 年 14 103.21 10.53 107.21 7.77 4.00 10.08 EM 2 年~3 年 0 - - - 0~6 ヵ月 47 99.79 8.72 104.43 12.29 4.64 11.69 6 ヵ月~1 年 21 98.67 7.72 105.38 8.61 6.71 10.49 1 年~2 年 5 98.80 9.86 110.20 9.91 11.40 9.79 収縮期血圧 (mm Hg) IM 2 年~3 年 0 - - - 0~6 ヵ月 162 58.44 9.42 62.06 9.07 3.62 10.23 6 ヵ月~1 年 58 57.47 9.39 61.59 9.22 4.12 11.09 1 年~2 年 14 57.79 10.44 63.07 8.86 5.29 9.09 EM 2 年~3 年 0 - - - 0~6 ヵ月 47 55.70 8.05 60.72 9.20 5.02 11.00 6 ヵ月~1 年 21 55.67 9.15 60.33 8.59 4.67 9.84 1 年~2 年 5 53.40 13.92 59.00 12.77 5.60 7.96 拡張期血圧 (mm Hg) IM 2 年~3 年 0 - - - (続く)
表 2.7.4-376. CYP2D6 遺伝子型(分類方法 1:EM/IM)別バイタルサインの ベースラインから最終観察時点までの変化量(LYBC 試験・LYDA 試験併合解析(注 1)) (続き) ベースライン 最終観察時点 変化量 項目 (単位) CYP2D6 遺伝子型* 評価期間 N 平均 SD 平均 SD 平均 SD 0~6 ヵ月 162 36.52 11.34 36.52 11.15 0.00 1.61 6 ヵ月~1 年 58 34.74 9.46 36.37 10.03 1.63 2.18 1 年~2 年 14 34.35 10.52 36.41 9.92 2.06 1.81 EM 2 年~3 年 0 - - - 0~6 ヵ月 47 33.78 12.98 33.49 12.47 -0.29 1.43 6 ヵ月~1 年 21 33.24 12.03 34.36 11.54 1.12 2.04 1 年~2 年 5 28.90 10.00 31.76 10.99 2.86 2.00 体重(kg) IM 2 年~3 年 0 - - - 0~6 ヵ月 155 139.58 14.13 140.62 14.20 1.04 1.24 6 ヵ月~1 年 58 137.24 13.60 141.44 14.08 4.19 1.70 1 年~2 年 14 136.54 16.00 141.92 15.32 5.39 1.61 EM 2 年~3 年 0 - - - 0~6 ヵ月 45 137.00 15.91 138.16 15.70 1.16 0.95 6 ヵ月~1 年 21 136.94 14.87 140.50 14.66 3.56 1.84 1 年~2 年 5 131.44 13.84 136.72 12.91 5.28 3.71 身長(cm) IM 2 年~3 年 0 - - - 対象 0~6 ヵ月:アトモキセチン投与例かつベースラインと投与後観察値を有する症例 6 ヵ月~1 年:アトモキセチン 6 ヵ月投与例かつベースラインと投与後観察値を有する症例 1 年~2 年:アトモキセチン 1 年投与例かつベースラインと投与後観察値を有する症例 2 年~3 年:アトモキセチン 2 年投与例かつベースラインと投与後観察値を有する症例 分類方法 1:PM、IM、EM(ヘテロ接合型 EM、ホモ接合型 EM 及び UM)
*PM は解析から除外した A_T12_10_Vital__(CYP2D6_1 EM_IM).tsv (注 1):表 2.7.4-3 参照 カテゴリー解析の結果、分類方法 1 により定義された EM 患者及び IM 患者において バイタルサイン、身長及び体重に異常を示した患者の割合を表 2.7.4-377 に示した。 全評価期間(0~3 年)において、基準に該当する患者の割合が、すべての基準で EM 患者に比べ IM 患者で高く、2 倍以上の差が見られたのは、脈拍数の基準 C(110 bpm 以 上及び変化量が 25 bpm 以上)及び収縮期血圧の基準 E(小児・青少年期の高血圧判断基 準以上)であった。これはアトモキセチンの薬理作用によるものと考えられた。 分類方法 2 において、試験期間を通して(0~3 年)、EM’患者に比べ IM’患者で該当 する割合が高く、2 倍以上の差が見られたのは、脈拍数の基準 C のみであった(表 2.7.4.7-106)。
ストラテラカプセル 606 表 2.7 .4-377. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別バイタルサイン異常を示した患者の割合( LYBC 試験・ LYDA 試験併合解析 (注 1) ) 0 ~ 3 年 0 ~ 6 ヵ月 以内 6 ~ 12 ヵ月 12 ~ 24 ヵ月 24 ~ 36 ヵ月 項目 基準 CYP2D6 遺伝子 型 * N n (% ) N n (% ) N n (% ) N n (% ) N n (% ) EM 159 37 ( 23.3) 159 34 ( 21.4) 55 14 ( 25.5) 13 0 ( 0 .0) 0 0 ( 0 .0) A IM 46 18 ( 39.1) 46 16 ( 34.8) 21 2 ( 9 .5) 5 2 ( 40.0) 0 0 ( 0 .0) EM 162 54 ( 33.3) 162 51 ( 31.5) 58 13 ( 22.4) 14 4 ( 28.6) 0 0 ( 0 .0) B IM 47 22 ( 46.8) 47 19 ( 40.4) 21 7 ( 33.3) 5 2 ( 40.0) 0 0 ( 0 .0) EM 159 22 ( 13.8) 159 20 ( 12.6) 55 9 ( 16.4) 13 0 ( 0 .0) 0 0 ( 0 .0) 脈拍数 C IM 46 15 ( 32.6) 46 13 ( 28.3) 21 2 ( 9 .5) 5 2 ( 40.0) 0 0 ( 0 .0) EM 162 60 ( 37.0) 162 58 ( 35.8) 58 7 ( 12.1) 14 0 ( 0 .0) 0 0 ( 0 .0) 体重 D IM 47 22 ( 46.8) 47 21 ( 44.7) 21 2 ( 9 .5) 5 0 ( 0 .0) 0 0 ( 0 .0) EM 162 3 ( 1 .9) 162 2 ( 1 .2) 58 1 ( 1 .7) 14 0 ( 0 .0) 0 0 ( 0 .0) 収縮期血圧 E IM 47 2 ( 4 .3) 47 2 ( 4 .3) 21 0 ( 0 .0) 5 0 ( 0 .0) 0 0 ( 0 .0) EM 160 24 ( 15.0) 160 20 ( 12.5) 58 6 ( 10.3) 14 1 ( 7 .1) 0 0 ( 0 .0) 拡張期血圧 F IM 47 11 ( 23.4) 47 10 ( 21.3) 21 2 ( 9 .5) 5 0 ( 0 .0) 0 0 ( 0 .0) N : ベ ー スライン 値が基 準を満た してい ない症例 数 n :投 与後、 少なく とも 1 度基 準を 満たし た症例数 基準 A:脈 拍数 が 1 10 b p m 以上 B : ベース ラインか らの脈 拍数変化 量が 25 b p m 以上 C : A かつ B D : ベ ー スライン から体 重が 3. 5 % 以 上減少 E : 収 縮 期血圧 が小 児・青 少年期の 高血圧 判断基準 以上 F : 拡張期 血圧が小 児・青 少年期の 高血圧 判断基準 以上 対象 0~ 6 ヵ月: アトモ キセチ ン投与例 かつベ ースライ ンと投 与後観察 値を有 する症例 6 ヵ月~ 1 年: アト モキセ チン 6 ヵ 月投与 例かつベ ースラ インと投 与後観 察値を有 する症 例 1 年~ 2 年:ア トモ キセチ ン 1 年投 与例か つベース ライン と投与後 観察値 を有する 症例 2 年~ 3 年:ア トモ キセチ ン 2 年投 与例か つベース ライン と投与後 観察値 を有する 症例 分類 方法 1 : PM 、 IM 、 EM ( ヘ テ ロ接合 型 EM 、 ホモ接 合型 EM 及び UM ) *PM は 解析か ら除 外した A_T 12_12 _Vital__( CYP2D6_1 E M _I M ). tsv (注 1 ): 表 2. 7. 4-3 参照
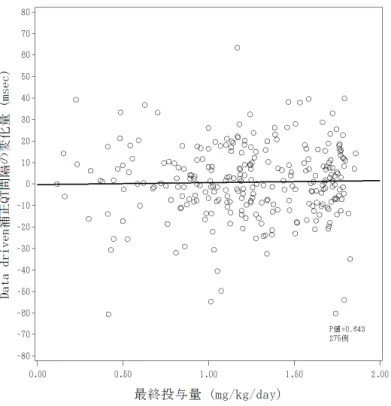
2.7.4.5.1.1.1.3 心電図 2.7.4.5.1.1.1.3.1 プラセボ対照二重盲験比較試験:LYBC 試験 LYBC 試験より、ベースラインから最終観察時点までの Fridericia 補正 QT 間隔(以下 QTcF)及び Data driven 補正 QT 間隔(以下 QTcD)の変化量を分類方法 1 及び 2 におい て評価した。また、補正 QT 間隔を 5 つのカテゴリーに分け、2 つの分類方法にて解析 を行った。分類方法 2 の結果を、第 2.7.4.7.4.1.1.1.3 項に示した。 分類方法 1 により EM/IM を分類したとき、QT 間隔におけるベースラインから最終観 察時点までの平均変化量を表 2.7.4-378 に示した。 分類方法 1 の結果より、EM 患者及び IM 患者いずれにおいても、投与量の増加による QTcF の平均変化量の増加は認められなかった。また、プラセボ群とアトモキセチン群 の差についても同様に、EM 患者及び IM 患者のいずれにおいても、QTc 間隔の延長を示 すような増加の傾向は認められなかった。 QTcD においても、QTc 間隔の延長を示すような投与量の増加に伴う平均変化量の増 加及び CYP 遺伝子型による平均変化量の増加は認められなかった。 この結果は、分類方法 2 においても同様であった(表 2.7.4.7-102)。 以上、QT 間隔の変化量の解析では、用量依存的又は分類方法 1 及び 2 の CYP2D6 遺 伝子型の影響は認められなかった。
ストラテラカプセル 608 表 2.7 .4-378. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別心電図のベースラインから最終観察時点までの変化量( L YBC 試験) ベース ライ ン 最終観 察時 点 変化量 95% CI 項目( 単位 ) CYP2D6 遺伝子 型 *** 投与群 N 平均 SD 平均 SD 平均 SD 差 信頼 下限 信頼 上限 p 値 * PLC 51 393.57 16.46 392.84 16.13 -0.73 15.08 ATX_0.5 46 389.81 17.57 392.20 16.87 2.39 14.56 1.41 -4.10 6.92 0.614 ATX_1.2 45 393.22 19.48 390.01 17.85 -3 .21 17.56 -2.64 -8.16 2.88 0.347 EM ATX_1.8 50 390.58 16.80 392.08 15.94 1.51 16.01 0.88 -4.51 6.26 0.748 PLC 11 398.56 16.09 399.82 13.87 1.26 14.20 ATX_0.5 15 388.01 19.83 388.41 19.50 0. 40 16.12 -6.43 -17.46 4.59 0.246 ATX_1.2 14 388.31 14.00 393.06 13.58 4. 75 15.16 -1.93 -13.10 9.24 0.730 IM ATX_1.8 11 393.64 16.60 384.95 12.88 -8. 69 18.48 -12.55 -24.15 -0.94 0.035 部分集団の効果 ** 0.853 QTcF ( mse c ) 部分集団と投与群の交互作用 ** 0.076 PLC 51 397.92 16.55 397.08 16.13 -0.84 16.24 ATX_0.5 46 395.06 18.45 399.01 17.83 3.95 15.57 3.43 -2.36 9.23 0.244 ATX_1.2 45 397.62 19.43 397.63 18.82 0.02 18.48 0.71 -5.11 6.53 0.810 EM ATX_1.8 50 395.36 17.52 399.51 16.16 4.15 16.60 3.77 -1.90 9.45 0.191 PLC 11 402.87 16.59 402.96 13.16 0.09 13.93 ATX_0.5 15 394.46 19.03 394.29 20.25 -0 .16 17.45 -5.12 -16.67 6.44 0.377 ATX_1.2 14 394.37 15.17 402.64 13.64 8.27 17.25 3.26 -8.46 14.99 0.578 IM ATX_1.8 11 398.11 18.34 394.47 14.02 -3 .64 19.97 -6.48 -18.76 5.79 0.293 部分集団の効果 ** 0.929 QTcD ( me se c ) 部分集団と投与群の交互作用 ** 0.134 アトモキセチン投与例 *部分集団内比較の p 値は共 分散分析に基づき算出された。 モデル:変化量 = ベースライン + 投与群 ** 部分集団の効果及び部分集団と投与群の交互作用の p 値は共分散分析に基づき算出された。 モデル:変化量 = ベースライン + 投与群 + 部分集団 + 部 分集団と投与群の交互作用 分類方法 1 : PM 、 IM 、 EM ( ヘテロ接合型 EM 、ホモ接合型 EM 及び UM ) ***PM は解析 から除外した。 A_T14_39_ b_QT_cy p b.tsv
カテゴリー解析の結果、分類方法 1 による EM 患者及び IM 患者において QT 延長を示 した患者の割合を表 2.7.4-379 に示した。 QTcF について、EM 患者及び IM 患者いずれにおいても補正 QT 間隔が 450 msec を超 える患者は見られなかった。補正 QT 間隔の変化量の基準 D(補正 QT 間隔がベースラ インから 30 msec 以上増加)に該当する患者の割合は、EM 患者において投与量の増加 に伴い増加した。一方、IM 患者では基準 D に該当する患者の割合に用量の増加との関 係は認められなかった。また、ATX_ALL 群で EM 患者と IM 患者の基準 D に該当する 患者の割合を比較すると、EM 患者で 9.9%(14 例/141 例)、IM 患者で 2.5%(1 例/40 例)であり、EM 患者のほうが高かった。QTcD についても同様の結果であった。 分類方法 2 におけるカテゴリー解析の結果も同様に、補正 QT 間隔の変化量の基準 D 以外の基準に該当する患者は見られなかった。基準 D に該当する患者の割合は、EM’患 者及び IM’患者ともに、用量の増加に伴い増加した。ATX_ALL 群で EM’患者及び IM’ 患者の基準 D に該当する患者の割合を比較すると、同程度であった(表 2.7.4.7-103)。 以上、IM 患者において EM 患者と比べて基準 D に該当する患者の割合が大きくなる 所見は認められず、また、いずれにおいても補正 QT 間隔が 450 msec を超える患者及び ベースラインから 60 msec 以上増加する患者が認められなかったことより、QTc 間隔に 対して CYP2D6 遺伝子型の分類による影響はないと考えられた。
ストラテラカプセル 610 表 2.7 .4-379. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別 QT 延長を示した患者の割合( LYBC 試験) PLC ATX _ 0. 5 ATX _ 1. 2 ATX _ 1. 8 ATX _ ALL 項目 基準 CYP2D6 遺伝子 型 *** N n % N n % N n % N n % N n % EM 51 0 0.0 46 0 0.0 44 0 0.0 50 0 0.0 140 0 0.0 A IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 0 0.0 46 0 0.0 45 0 0.0 50 0 0.0 141 0 0.0 B IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 0 0.0 46 0 0.0 45 0 0.0 50 0 0.0 141 0 0.0 C IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 1 2.0 46 2 4.3 45 4 8.9 50 8 16.0 141 14 9.9 D IM 11 1 9.1 15 0 0.0 14 1 7.1 11 0 0.0 40 1 2.5 EM 51 0 0.0 46 0 0.0 45 0 0.0 50 0 0.0 141 0 0.0 QTcF E IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 0 0.0 46 0 0.0 44 0 0.0 50 0 0.0 140 0 0.0 A IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 0 0.0 46 0 0.0 44 0 0.0 50 0 0.0 140 0 0.0 B IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 0 0.0 46 0 0.0 45 0 0.0 50 0 0.0 141 0 0.0 C IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 EM 51 2 3.9 46 2 4.3 45 4 8.9 50 8 16.0 141 14 9.9 D IM 11 1 9.1 15 0 0.0 14 2 14.3 11 0 0.0 40 2 5.0 EM 51 0 0.0 46 0 0.0 45 0 0.0 50 0 0.0 141 0 0.0 QTcD E IM 11 0 0.0 15 0 0.0 14 0 0.0 11 0 0.0 40 0 0.0 N :ベースラインで基準を満たさなかった症例数 n :投与後基準を満たした症例数 基準 A :補正 QT 間隔 が 450 msec より大きい B :補正 QT 間隔 が 480 msec より大きい C :補正 QT 間隔 が 500 msec より大きい D :補正 QT 間 隔がベースラインから 30 msec 以上増加 E :補正 QT 間隔がベースラインから 60 msec 以上増加 分類方法 1 : PM 、 IM 、 EM ( ヘテロ接合型 EM 、ホモ接合型 EM 及び UM ) ***PM は解析 から除外した。 略語 PL C= プラセボ、 ATX= アトモキセチン A_T14_41_ b_QT_CATE_cy pb .tsv
2.7.4.5.1.1.1.3.2 長期継続投与試験:LYBC 試験・LYDA 試験併合解析 LYBC 試験及び長期継続投与試験である LYDA 試験の結果を併合し、ベースラインか ら最終観察時点までの心電図の平均変化量を CYP2D6 遺伝子型別(分類方法 1 及び 2) に評価した。また、QTcF 及び QTcD について、CYP2D6 遺伝子型別(分類方法 1 及び 2)のカテゴリー解析を行った。分類方法 2 の結果を、第 2.7.4.7.4.1.1.2.3 項に示した。 分類方法 1 による EM/IM 別の、QT 間隔におけるベースラインから最終観察時点まで の平均変化量を表 2.7.4-380 に示した。 分類方法 1 において、評価期間 6 ヵ月~1 年の QTcF の変化量は EM 患者で 1.56 msec、 IM 患者で-1.03 msec と、EM 患者で平均変化量が増加し、IM 患者で減少したが、評価期 間 1~2 年の QTcF の平均変化量は、EM 患者及び IM 患者のいずれも 4.53 msec と同じで あった。いずれの評価期間においても、EM 患者に比べ IM 患者で臨床的に問題となる ような QTcF の平均変化量の増加は見られなかった。 QTcD でも同様に、評価期間 6 ヵ月~1 年の平均変化量は IM 患者の方が小さく、評価 期間 1~2 年の QTcD の平均変化量は EM 患者で 7.58 msec、IM 患者で 8.38 msec と同程 度であった。いずれの評価期間においても、EM 患者に比べ IM 患者で臨床的に問題と なるような QTcD の変化量の増加は見られなかった。 分類方法 2 においても同様に、EM’患者に比べ IM’患者で臨床的に問題となるような 変化量の増加は見られなかった。(表 2.7.4.7-107)。 以上、評価期間別の QT 間隔の変化量について、分類方法 1 及び 2 による CYP2D6 遺 伝子型の影響は認められなかった。 表 2.7.4-380. CYP2D6 遺伝子型(分類方法 1:EM/IM)別心電図のベースラインから 最終観察時点までの変化量(LYBC 試験・LYDA 試験併合解析(注1)) ベースライン 最終観察時点 変化量 CYP2D6 遺伝子型 評価期間 N 平均 SD 平均 SD 平均 SD 0~6 ヵ月 160 75.23 11.81 83.97 14.18 8.74 14.05 6 ヵ月~1 年 58 76.55 11.65 84.41 13.36 7.86 13.81 1 年~2 年 14 77.50 13.49 87.93 10.19 10.43 13.67 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 78.00 11.77 87.43 12.08 9.43 13.68 6 ヵ月~1 年 21 78.67 11.90 82.48 11.94 3.81 14.39 1 年~2 年 5 72.80 6.76 86.00 9.54 13.20 13.18 心拍数 (bpm) IM 2 年~3 年 0 - - - 0~6 ヵ月 160 816.80 126.18 735.08 125.34 -81.72 131.21 6 ヵ月~1 年 58 800.19 112.43 729.15 120.10 -71.04 120.85 1 年~2 年 14 792.40 116.16 691.39 84.04 -101.01 100.52 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 787.59 127.51 698.53 92.79 -89.06 130.29 6 ヵ月~1 年 21 779.45 117.78 741.37 103.71 -38.08 131.14 1 年~2 年 5 830.11 80.14 704.33 75.10 -125.78 126.33 RR 間隔 (msec) IM 2 年~3 年 0 - - -
612 表 2.7.4-380. CYP2D6 遺伝子型(分類方法 1:EM/IM)別心電図のベースラインから 最終観察時点までの変化量(LYBC 試験・LYDA 試験併合解析(注 1))(続き) ベースライン 最終観察時点 変化量 CYP2D6 遺伝子型* 評価期間 N 平均 SD 平均 SD 平均 SD 0~6 ヵ月 160 86.37 7.27 87.38 7.71 1.01 5.19 6 ヵ月~1 年 58 85.41 7.08 88.86 8.60 3.45 5.91 1 年~2 年 14 86.43 9.68 91.50 8.24 5.07 6.16 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 86.52 9.80 87.35 8.42 0.83 5.26 6 ヵ月~1 年 21 85.90 10.03 86.10 9.92 0.19 7.03 1 年~2 年 5 81.80 8.17 81.40 10.85 -0.40 3.97 QRS 間隔 (msec) IM 2 年~3 年 0 - - - 0~6 ヵ月 160 365.11 25.98 350.84 26.46 -14.27 25.52 6 ヵ月~1 年 58 359.93 23.28 350.31 27.73 -9.62 23.66 1 年~2 年 14 356.50 24.10 344.86 21.27 -11.64 30.00 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 359.43 24.78 342.96 21.26 -16.48 23.55 6 ヵ月~1 年 21 354.10 26.37 347.19 20.07 -6.90 17.60 1 年~2 年 5 368.40 4.98 352.60 12.80 -15.80 15.69 QT 間隔 (msec) IM 2 年~3 年 0 - - - 0~6 ヵ月 160 405.88 20.73 411.58 21.98 5.70 22.00 6 ヵ月~1 年 58 403.98 18.74 412.05 18.89 8.07 19.81 1 年~2 年 14 402.07 16.30 415.93 21.77 13.86 23.74 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 407.11 19.15 411.98 17.81 4.87 22.24 6 ヵ月~1 年 21 402.71 21.52 404.81 21.56 2.10 24.58 1 年~2 年 5 405.60 17.52 421.20 25.41 15.60 28.07 QTcB (mesc) IM 2 年~3 年 0 - - - 0~6 ヵ月 160 391.56 17.84 389.91 18.32 -1.65 17.52 6 ヵ月~1 年 58 388.52 15.92 390.08 17.53 1.56 15.57 1 年~2 年 14 386.06 14.30 390.58 18.78 4.53 23.10 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 390.21 16.28 387.22 15.01 -2.99 17.00 6 ヵ月~1 年 21 385.60 19.22 384.57 17.10 -1.03 15.85 1 年~2 年 5 392.55 10.84 397.08 19.02 4.53 18.22 QTcF (msec) IM 2 年~3 年 0 - - - 0~6 ヵ月 160 396.35 18.19 397.10 18.82 0.75 18.31 6 ヵ月~1 年 58 393.69 16.30 397.39 17.26 3.70 16.28 1 年~2 年 14 391.42 14.26 399.00 19.40 7.58 22.73 EM 2 年~3 年 0 - - - 0~6 ヵ月 46 395.79 16.56 395.37 15.39 -0.42 18.10 6 ヵ月~1 年 21 391.32 19.43 391.40 18.30 0.08 18.37 1 年~2 年 5 396.85 12.92 405.23 21.12 8.38 21.09 QTcD (msec) IM 2 年~3 年 0 - - - 略語
QTcB:Bazett 法による補正 QT 間隔、QTcD:Data driven 法による補正 QT 間隔、QTcF:Fridericia 法による補 正 QT 間隔。 対象 0~6 ヵ月:アトモキセチン投与例かつベースラインと投与後観察値を有する症例 6 ヵ月~1 年:アトモキセチン 6 ヵ月投与例かつベースラインと投与後観察値を有する症例 1 年~2 年:アトモキセチン 1 年投与例かつベースラインと投与後観察値を有する症例 2 年~3 年:アトモキセチン 2 年投与例かつベースラインと投与後観察値を有する症例 分類方法 1:PM、IM、EM(ヘテロ接合型 EM、ホモ接合型 EM 及び UM)
PM は解析から除外した。
A_T12_13_ECG__(CYP2D6_1 EM_IM).tsv (注 1):表 2.7.4-3 参照
分類方法 1 によるカテゴリー解析の結果、EM 患者及び IM 患者において QT 延長を示 した患者の割合を表 2.7.4-381 に示した。
QTcD 及び QTcF において、EM 患者及び IM 患者のいずれも全評価期間(0~3 年)に おいて、補正 QT 間隔が 450 msec を超える患者は見られなかった。QTc 間隔の変化量の 基準 D(補正 QT 間隔がベースラインから 30 msec 以上増加)に該当する患者の割合に ついては、全評価期間(0~3 年)において、EM 患者で IM 患者に比べ高かった。
ストラテラカプセル 614 表 2.7 .4-381. CYP2D6 遺伝子型(分類方法 1 : EM/I M )別 QT 延長を示した患者の割合( LYBC 試験・ LYDA 試験併合解析 (注 1) ) 0 ~ 3 年 0 ~ 6 ヵ月以内 6 ~ 12 ヵ月 12 ~ 24 ヵ月 24 ~ 36 ヵ月 項目 基準 CYP 2D6 遺伝子型 N n (% ) N n (% ) N n (% ) N n (% ) N n (% ) E M 159 0 ( 0. 0) 159 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) A IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 160 0 ( 0. 0) 160 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) B IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 160 0 ( 0. 0) 160 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) C IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 160 18 ( 11. 3) 160 15 ( 9. 4) 58 3 ( 5. 2) 14 2 ( 14. 3) 0 0 ( 0. 0) D IM 46 1 ( 2. 2) 46 1 ( 2. 2) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 160 0 ( 0. 0) 160 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) QTcD E IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 159 0 ( 0. 0) 159 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) A IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 159 0 ( 0. 0) 159 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) B IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 160 0 ( 0. 0) 160 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) C IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) E M 160 21 ( 13. 1) 160 17 ( 10. 6) 58 6 ( 10. 3) 14 1 ( 7. 1) 0 0 ( 0. 0) D IM 46 4 ( 8. 7) 46 3 ( 6. 5) 21 1 ( 4. 8) 5 1 ( 20. 0) 0 0 ( 0. 0) E M 160 0 ( 0. 0) 160 0 ( 0. 0) 58 0 ( 0. 0) 14 0 ( 0. 0) 0 0 ( 0. 0) QTcF E IM 46 0 ( 0. 0) 46 0 ( 0. 0) 21 0 ( 0. 0) 5 0 ( 0. 0) 0 0 ( 0. 0) N : ベ ー スライン 値が基 準を満た してい ない症例 数 n :投 与後、 少なく とも 1 度基 準を 満たし た症例数 基準 A :補正 QT 間隔 が 450 m sec より 大き い B :補 正 QT 間隔が 480 m sec より 大き い C :補 正 QT 間隔が 500 m sec より 大き い D :補正 QT 間 隔 が ベース ラインか ら 30 m sec 以上 増 加 E :補正 QT 間隔が ベース ラインか ら 60 m sec 以上 増 加 対象 0 ~ 6 ヵ月: アトモ キセチ ン投与例 かつベ ースライ ンと投 与後観察 値を有 する症例 6 ヵ月~ 1 年: アト モキセ チン 6 ヵ 月投与 例かつベ ースラ インと投 与後観 察値を有 する症 例 1 年~ 2 年:ア トモ キセチ ン 1 年投 与例か つベース ライン と投与後 観察値 を有する 症例 2 年~ 3 年:ア トモ キセチ ン 2 年投 与例か つベース ライン と投与後 観察値 を有する 症例 略語 QTcD : Data driven 法に よる補 正 QT 間隔 、 QTcF : Fridericia 法に よる 補正 QT 間隔 分類 方法 1 : PM 、 IM 、 EM ( ヘ テ ロ接合 型 EM 、 ホモ接 合型 EM 及び UM ) PM は 解 析 から除外 した。 A_T 12_15 _E CG__( CYP2D6_1 E M _I M ). tsv (注 1 ): 表 2. 7. 4-3 参照
2.7.4.5.1.1.2 日本で実施した試験における CYP2D6 遺伝子型 PM の安全性 LYBD 試験において、治験実施計画書で定義した CYP2D6 遺伝子型分類が PM に該当 する症例はいなかった。 LYBC 試験において、治験実施計画書で定義した CYP2D6 遺伝子型分類が PM に該当 する症例が、ATX_0.5 群に 1 例(患者番号 1001)、ATX_1.2 群に 1 例(患者番号 10-1003)で認められた。これらの患者の安全性の詳細を第 2.7.4.7.4.1.2.1 項に示す。 患者番号 10-1001(ATX_0.5 群、男性、14 歳)では有害事象は認められなかった。脈 拍数については、Visit 1 で 92 bpm、Visit 2 で 86 bpm、Visit 3 で 101 bpm、Visit 4 で 100 bpm、Visit 5 で 109 bpm 及び Visit 6 で 98 bpm であった。収縮期血圧及び拡張期血圧、 体重及び心電図(QTcF)については、特に大きな変化は見られず、LYBC 試験を完了し た。
患者番号 10-1003(ATX_1.2 群、女性、9 歳)では、下痢、体重減少が認められた。し かし、いずれも重症度は軽度であった。脈拍数については、Visit 1 で 96 bpm、Visit 2 で 100 bpm、Visit 3 で 88 bpm、Visit 4 で 105 bpm、Visit 5 で 107 bpm 及び Visit 6 で 101 bpm であった。体重については、Visit 1 で 39.2 kg、Visit 2 で 38.9 kg、Visit 3 で 36.5 kg、 Visit 4 で 36.7 kg、Visit 5 で 35.7 kg 及び Visit 6 で 35.6 kg であった。収縮期血圧及び拡張 期血圧及び心電図(QTcF)については、特に大きな変化は見られず、LYBC 試験を完了 した。 2.7.4.5.1.1.3 日本で実施した試験において CYP2D6 遺伝子型と表現型に不一致が認め られた患者 2.7.4.5.1.1.3.1 LYBD試験に参加した患者に対する追跡試験:LYDH 試験 LYBD 試験において、患者番号 015-1501 は治験実施計画書で定義した CYP2D6 遺伝子 型より EM に分類されたが、通常 EM 患者に予測される血漿中濃度よりも高い血漿中濃 度が認められた(第 2.7.2.3.1.1.2.1.1 項)。 LYBD 試験において当該患者に認められた有害事象は、気分変動、頻脈、体重減少、 食欲減退、口内炎、上気道の炎症及び息詰まり感であったが、それぞれ軽度又は中等度 であり、高度の有害事象は認められなかった。バイタルサインについて、脈拍数の増加 が見られ、有害事象の頻脈として報告された。その他のバイタルサイン及び心電図につ いては大きな変化は認められなかった。当該患者は LYBD 試験を完了した。当該患者の LYBD 試験における安全性の詳細を第 2.7.4.7.4.1.2.2 項に示す。 CYP2D6 遺伝子型と表現型の不一致に関して、他の併用薬やコンプライアンス不良等 の原因を特定することができなかったため、当該患者を対象に CYP2D6 遺伝子型を更に 検討するため LYDH 試験を実施した。
616
2.7.4.5.1.1.3.1.1 LYBD試験で CYP2D6 遺伝子型と表現型に不一致が認められた患
者(患者番号 015-1501)の成績
LYBD 試験は強制漸増試験であり、Visit 2 で 0.5 mg/kg/日から投与を開始し、Visit 3 で 0.8 mg/kg/日、Visit 4 で 1.2 mg/kg/日、Visit 5 で 1.8 mg/kg/日と段階的に投与量を増量した。 LYBD 試験において CYP2D6 遺伝子型と表現型に不一致が認められた患者(患者番号 015-1501)は、追跡試験(LYDH 試験)の結果、CYP2D6 遺伝子型 PM に分類されるこ とが判明した。当該患者の LYBD 試験における薬物動態、有効性及び安全性の成績を以 下に示した。 (1) 薬物動態 LYBD 試験及び海外試験(母集団薬物動態解析に用いた 5 試験)で得られた定常状態 における血漿中アトモキセチン濃度を図 2.7.4-191 に示した。LYBD 試験における当該 PM 患 者 の 血 漿 中 ア ト モ キ セ チ ン 濃 度 は 、 最 終 投 与 後 約 2 時 間 の 時 点 で 6360 (ng/mL)/(mg/kg)であり、海外試験の PM 患児の値と大きな違いは認められなかった。
Time From Dose (h)
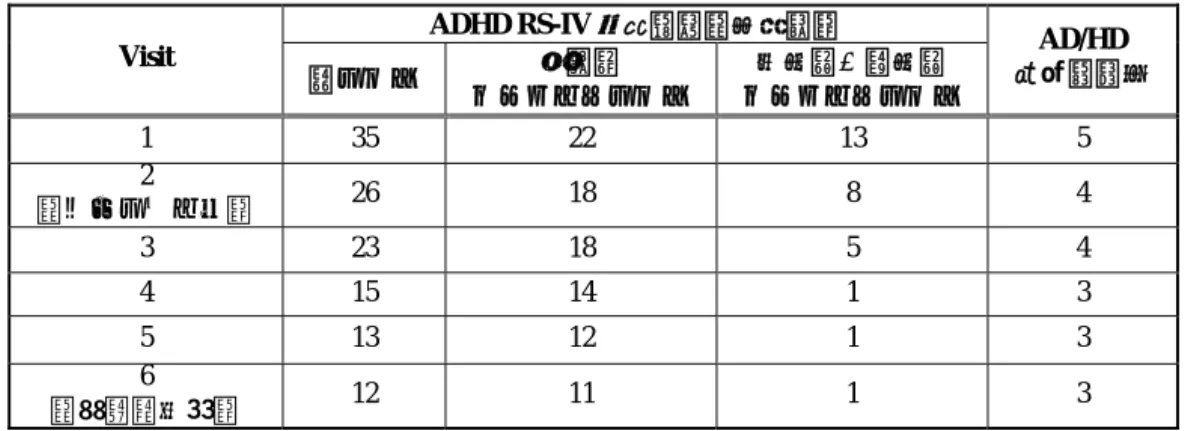
0 3 6 9 12 15 18 21 24 27 N o rmali zed A tomoxeti n e P lasma C o nc (ng/ mL)/ (mg/ kg) 1 10 100 1000 10000 LYBD EM Patients LYBD UM Patient LYBD PM Patient Pop PK EM Patients Pop PK UM Patients Pop PK PM Patients 図 2.7.4-191. CYP2D6 UM、EM 及び PM 患者における 体重あたりの投与量で規準化した血漿中アトモキセチン濃度推移 [日本人 (LYBD 試験)、外国人 (HFBC, HFBD, HFBE, HFBF 及び HFBK 試験)] (2) 有効性 有効性の成績として、ADHD RS-IV 日本語版(医師用)の総スコア、不注意サブタイ プスコア及び多動性‐衝動性サブタイプスコア並びに AD/HD 概括重症度を Visit ごとに 表 2.7.4-382 に示した。 ADHD RS-IV 日本語版(医師用)の総スコアはベースラインの 26 から最終観察時の 12 に減少し、AD/HD 症状の改善が認められた。同様に、不注意サブタイプスコア(18 →11)及び多動性‐衝動性サブタイプスコア(8→1)においても、スコアは減少し、サ ブタイプスコアの改善も認められた。更に、AD/HD 概括重症度(CGI-AD/HD-S)にお いても、4(中等度の疾患)から 3(軽度の疾患)への改善が認められた。
表 2.7.4-382. 患者番号 015-1501 の有効性に関する成績(LYBD 試験) ADHD RS-IV 日本語版(医師用) Visit 総スコア サブタイプスコア不注意 サブタイプスコア多動性‐衝動性 AD/HD 概括重症度 1 35 22 13 5 2 (ベースライン) 26 18 8 4 3 23 18 5 4 4 15 14 1 3 5 13 12 1 3 6 (最終観察時) 12 11 1 3 (3) 安全性 安全性の成績として、バイタルサイン、体重、身長及び心電図(QTcF)を Visit ごと に、また、試験期間中に認められた有害事象について表 2.7.4-383 に示した。 LYBD 試験において当該患児に認められた有害事象は、気分変動、頻脈、体重減少、 食欲減退、口内炎、上気道の炎症及び息詰まり感であり、上気道の炎症以外は因果関係 が認められたが、それぞれ軽度又は中等度で、高度の有害事象は認められなかった。バ イタルサインの変化については、脈拍数の増加と体重の減少が見られ、前述のとおり有 害事象として頻脈及び体重減少が報告された。その他のバイタルサイン及び心電図につ いては大きな変化は認められなかった。当該患児は治験医師が各 Visit で規定の安全性 評価を行った結果、途中で中止することもなく最大用量 1.8 mg/kg/日までの投与を受け 試験を完了した。 表 2.7.4-383. 患者番号 015-1501 の安全性に関する成績(LYBD 試験) 患者番号 015-1501 年齢・性別・病型 10 歳・男性・不注意優勢型 中枢刺激薬使用経験 無し 投与群 アトモキセチン群 Visit V1 (BL)V2 V3 V4 V5 V6 追跡 収縮期血圧 120 122 130 124 118 102 - 拡張期血圧 64 70 66 72 70 51 - 脈拍数 92 70 87 91 101 110 - 体重 38.20 38.20 36.80 36.20 35.30 36.00 - 身長 143.30 - - - - 145.30 - QTcF 415.93 - 412.11 406.83 397.78 424.88 410.42 気分変動(軽度)V3~最終投与時未回復(不変)/因果関係あり 頻脈(中等度)V3~最終投与時未回復(不変)/因果関係あり 体重減少(中等度)V3~最終投与時未回復/因果関係あり
618
2.7.4.5.1.1.3.2 LYBC試験/LYDA 試験
LYBC 試験において、治験実施計画書に定義した CYP2D6 遺伝子型(EM)から予測 される血漿中濃度よりも高い血漿中濃度を示し、CYP2D6 遺伝子型と表現型に不一致が 認められた患者が 2 例(患者番号 4-401、患者番号 29-2903)認められた。以下に、これ ら 2 例について更に CYP2D6 遺伝子型を調べた結果及び安全性の結果について示す。患 者番号 4-401 及び患者番号 29-2903 の安全性結果の詳細については第 2.7.4.7.4.1.2.3 項に 示す。 患者番号 4-401(ATX_1.8 群、男性、10 歳)について、更に CYP2D6 の検討を行った 結果、CYP2D6 遺伝子型が CYP2D6 *5/*21 で、PM に分類されることが判明した。当該 症例の試験期間中に認められた有害事象は、不快気分、食欲減退、早朝覚醒及び体重減 少であり、重症度は軽度もしくは中等度であった。脈拍数について、Visit 1 で 84 bpm、 Visit 2 で 82 bpm、Visit 3 で 112 bpm、Visit4 で 108 bpm、Visit5 で 92 bpm 及び Visit 6 で 88 bpm であった。心電図(QTcF 間隔)について、Visit 1 で 389.72 msec、Visit 4 で 427.72 msec、Visit 5 で 418.30 msec 及び Visit 6 で 423.31 msec であった。当該患者は LYBC 試験を完了した。 患者番号 4-401 は LYBC 試験の完了後継続して、LYDA 試験に参加した。新たに因果 関係のある有害事象は認められておらず、バイタルサイン及び心電図(QTcF)について も、LYBC 試験で認められた変化と同程度であった(表 2.7.4.7-111)。 患者番号 29-2903(ATX_1.8 群、男性、10 歳)について、更に CYP2D6 の検討を行っ た結果、CYP2D6 遺伝子型が CYP2D6 *5/*21 で、PM に分類されることが判明した。当 該症例の試験期間中に認められた有害事象は、上気道の炎症、食欲減退及び感情不安定 であり、重症度は軽度又は中等度であった。当該症例は、Visit 2 の投薬開始後(アトモ キセチン 0.5 mg/kg/日)5 日目に発現した感情不安定(中等度)により Visit 4 にて服薬 を中止した。感情不安定は試験中止後 4 日後に消失した。
脈拍数については、Visit 1 及び Visit 2 で 66 bpm 及び 60 bpm であり、Visit 3 及び Visit 4 で 64 bpm 及 び 87 bpm で あ っ た 。 心 電 図 ( QTcF ) に つ い て は 、 Visit 1 で 407.78 msec 及び Visit 4 で 413.13 msec であった。
2.7.4.5.1.1.4 日本で実施した試験における CYP2D6 遺伝子型別による安全性の要約 日本で実施した試験の CYP2D6 遺伝子型による安全性を、二つの分類方法に基づき CYP2D6 遺伝子型 EM/IM 別に評価した。PM 患者については患者数が少ないため個々に 評価した。 有害事象について、短期投与及び長期投与のいずれにおいても、EM 患者及び IM 患 者の間で、有害事象が認められた症例数の割合に一定の傾向は認められなかった。重症 度についても、IM 患者で重症度が高くなる傾向は見られなかった。 バイタルサイン、身長及び体重については、EM 患者に比べ IM 患者で大きな変化が 見られたものもあったが、変化の程度及び測定値は臨床的に問題となるものではないと 考えられた。心電図については、QTcD 及び QTcF のいずれにおいても、EM 患者及び IM 患者の間で、臨床的に問題となるような補正 QT 間隔の延長は認められなかった。ま