高圧処理/酵素処理併用による鶏卵白オボムコイドの抗原性とアレルゲン性の低減化
9
0
0
全文
(2) 172. 近年、高圧処理の食品加工への利用が高まっている[4]。高圧を利用した食品のアレルゲン 性の低減化は、リンゴ[5]や牛肉[6]、ウシ血清アルブミン[7, 8]、鶏卵白オボムコイド[9]で報告 されている。一方Okamoto等[10]は牛乳β-ラクトグロブリンを高圧下でサーモライシン処理 することで、Peñas等[11]は乳清タンパク質を高圧処理/酵素処理併用で低アレルゲン化したこ とを報告した。 本研究では、OVMを高圧処理後および高圧下でペプシンまたはα-キモトリプシン処理す ることでアレルゲン性を低下させることを試みた。上記方法で処理したOVMの加水分解度は tricine-SDS-PAGEにより、抗原性の変化は抗OVMウサギ血清IgGおよび卵アレルギー患者血清 IgEとの抗体結合能をELISA法により、アレルゲン性の変化はヒト好塩基球様KU812F細胞と 鶏卵白アレルギー患者血清を用いたヒスタミン遊離試験により検討した。. 2. 2.1.. Domain Ⅲ 131L-186F. Domain Ⅰ 1A-64E. Domain Ⅱ 65T-130E. Fig. 1. Amino acid sequence of chicken preovomucoid [1]. Signal peptide sequence residues were shown in diamonds. The mature protein sequence is given in circles. The blue bars indicate the chymotrypsin reactive sites. The saw-toothed lines indicate glycosyl chains. The red circles indicate the epitopes to human serum IgE antibody as determined by Mine and Zang [12].. 材料と方法 材料. オボムコイドはTakahashiとAsao[13]の方法を一部改変し、産卵後1日以内の鶏卵白をエタノ ール分画後ゲルろ過することにより精製した。抗OVMウサギ血清は、OVMをフロイントアジ ュバントと共にウサギ(New Zealand White)の皮下に免疫して得た。卵アレルギー患者血清 は新潟県立吉田病院小児科の松野博士より提供を受け、OVMに対するRAST値4~6を示す4検 体を使用した。 2.2. 高圧処理/酵素処理. 精製OVMを1.4 mg/mlになるようにペプシン消化の場合は0.01N 塩酸緩衝液, pH2.0でα-キ モトリプシンの場合は0.1 M 蟻酸/ 0.1 M アンモニウム緩衝液, pH 8.0で溶解した。ポリエチレ ン袋に移し、空気が入らないようにシーラーで密封し、高圧処理装置NBIP45-120-70(日機装.
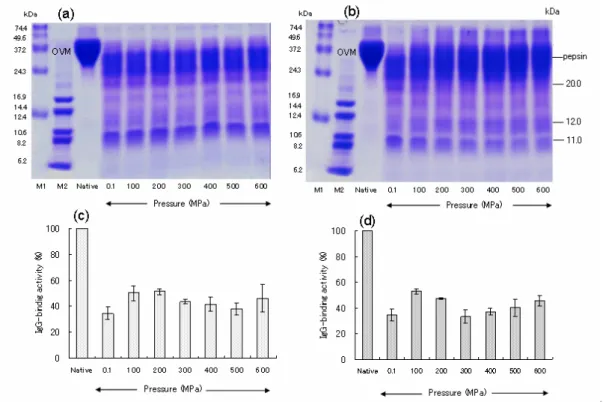
(3) 173. ㈱, 東京, 日本)の圧力容器に入れ、100~600MPaで37℃、30分間高圧処理をした。その後、 ペプシン(Pepsin A [E.C.3.4.23.1]、ブタ胃;Sigma-Aldrich)を25 U/mlになるように、または キモトリプシン(α-Chymotrypsin [E.C.3.4.21.1]、ウシ膵臓;TLCK-treated type;Sigma-Aldrich) を2.5 U/mlになるように加え、37℃、30分間保温しOVMの消化を行った。また高圧処理後と 同様の酵素処理を高圧下で行った。氷冷により酵素反応を停止し、凍結乾燥したのち-20℃で 保存した。対照は常圧で酵素処理したものとした。 2.3. Tricine-SDS PAGE. OVMの加水分解による変化は、SchäggerとJagow [14]の方法によるトリシン-ドデシル硫酸 ナトリウム-ポリアクリルアミド電気泳動(Tricine SDS-PAGE)で分析した。 2.4. ELISA. 残存抗原活性は加水分解物の抗OVMウサギ血清IgGまたは卵アレルギー患者血清IgEとの 抗体結合能をEngvallとPerlman [15]による酵素免疫法(Enzyme-linked immunosorbent assay, ELISA)を一部改変した方法で測定した。 2.5. ヒスタミン遊離試験. ヒト好塩基球様KU812F細胞の表面上にある高親和性IgEレセプターFcεRIにIgEを結合さ せるため、KU812F細胞(1.0×106 cells/ml)を卵アレルギー患者血清(100倍希釈)と共に培 地RPMI*1040中で37℃、60分間インキュベートした。その後細胞を2回洗浄し、タイロード緩 衝液, pH9.2に再懸濁した。次に未処理OVM 1μg/mlおよび高圧処理/酵素処理したOVM加水分 解物を添加し、37℃、60分間インキュベートしヒスタミン遊離を誘導した。遠心分離後、上 清中のヒスタミン含有量をHåkanson等の方法[16]に若干の変更を加えて蛍光法により測定し た。ヒスタミン遊離は、細胞内総ヒスタミン量に対する各サンプル刺激により遊離したヒス タミン量の割合で示した(但し、すべての遊離量から自然遊離の量を減じた値とした)。 2.6. 統計処理. 平均値の差の検定はt検定によった。 3.結果 3.1. 高圧処理/ペプシン処理したオボムコイドの加水分解性と抗原性. OVMを常圧(0.1 MPa)でペプシン処理すると、34.0 kDaのOVMバンドは完全に消失し、 8.0~30 kDaの消化ペプチドに分解された(Fig. 2-a,b)。高圧処理後にペプシン処理しても消 化ペプチドプロフィールの変化はほとんど認められなかった(Fig. 2-a)。しかし高圧下にお いてペプシン処理した場合、未消化OVMに相当するバンドと12 kDa付近のバンドが圧力の上 昇に依存して増加し、20 kDaおよび11 kDa付近のバンドが減少することが認められた(Fig. 2-b)。 常圧でペプシン処理したOVMの抗原性は、Native OVMの34.7±4.8%に低下した。高圧処理 後あるいは高圧下でペプシン処理した場合、100~200 MPaでは抗体結合能が47.4~52.9%に、 300~500 MPaでは33.3~43.6%に、600 MPaでは45.6~46.2%に変動した(Fig. 2-c, d)。.
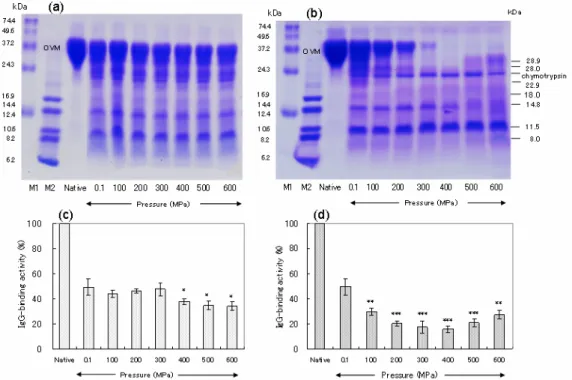
(4) 174. Fig. 2. Effect of combined high-pressure /peptic treatment on OVM with respect to hydrolysis and binding activity to rabbit anti-sera against OVM. OVM solutions were hydrolyzed using 25 U/ml pepsin after (Fig. 2-a and 2-c) and during (Fig. 2-b and 2-d) exposure to pressures of 100-600 MPa for 30 min at 37°C. The samples were subjected to tricine SDS-PAGE on 16.5% polyacrylamide gels [19] for hydrolysis tests (Fig. 2-a and 2-b) and ELISA for binding activity assays using rabbit anti-sera against OVM (Fig. 2c and 2d). M1, M2: MW markers. Native: native OVM. 3.2. 高圧処理/α-キモトリプシン処理したオボムコイドの加水分解性と抗原性. OVMを常圧でα-キモトリプシン処理すると、native OVMの他に28.9、28.0、14.8、11.5 kDa のペプチドバンドが生成した(Fig. 3-a,b)。高圧処理後にα-キモトリプシン処理した場合、 圧力の上昇につれnative OVMが若干減少したが、消化ペプチドプロフィールに大きな変化は 認められなかった(Fig. 3-a)。しかし高圧下でα-キモトリプシン処理した場合、圧力の上昇 にともないOVMの消化が促進し、400~600 MPaでは完全に消失した。また圧力の上昇ととも に28.0、22.9、18.0、14.8 kDaのバンドは減少し、11.5 kDaのバンドは増加傾向を示した。また 500、600 MPaの圧力下では、100~400 MPaの圧力下で見られなかった28.9 kDaのバンドが確 認された(Fig. 3-b)。 常圧でα-キモトリプシン処理した場合の抗原性は、native OVMの49.4±6.7%となった。高 圧処理後にα-キモトリプシン処理した場合(Fig. 3-c)、400~600 MPaで34.2~37.5%に低下し た(p<0.05)。一方高圧下でキモトリプシン処理した場合(Fig. 3-d)、圧力の上昇に伴い抗体 結合能が有意に低下した(p<0.01, 0.001)。最も低下した圧力は400 MPaで抗体結合能は15.6 ±0.8%であった。.
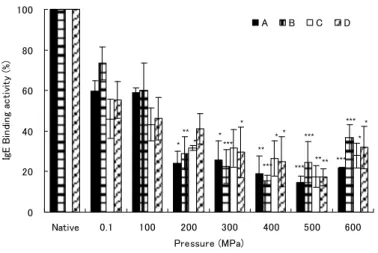
(5) 175. Fig. 3. Effect of combined high-pressure /α-chymotryptic treatment on OVM with respect to hydrolysis and binding activity to rabbit anti-sera against OVM. OVM solutions were hydrolyzed using 2.5 U/mlα-chymotrypsin after (Fig. 3-a and 3-c) and during (Fig. 3-b and 3-d) exposure to the pressures of 100-600 MPa for 30 min at 37°C. The samples were subjected to tricine SDS-PAGE on 16.5% polyacrylamide gels [19] for hydrolysis tests (Fig. 3-a and 3-b) and ELISA for binding activity assays using rabbit anti-sera against OVM (Fig. 3-c and 3-d). M1, M2: MW markers. Native: native OVM . * p<0.05, ** p<0.01, *** p<0.001.. 3.3. 高圧下でα-キモトリプシン処理したオボムコイドの患者血清IgE抗体との結合能. 高圧下でα-キモトリプシン処理したOVM加水分解物に抗OVMウサギ血清IgG抗体との結 合能に顕著な低下が認められたことから、鶏卵アレルギー患者血清IgE抗体との結合能を ELISA法により検討した(Fig. 4)。患者血清は鶏卵白とOVMに対してRAST値4~6を示す4 検体を使用した。 常圧でα-キモトリプシン処理したOVM加水分解物のIgE抗体結合能は、native OVMの50~ 70%となった。100~600MPaの高圧下でα-キモトリプシン処理した場合、いずれの患者血清 においても500 MPaまでは処理圧力の上昇とともに抗体結合能が低下する傾向が認められた。 最も低下した圧力は400~500 MPaで抗体結合能は15~27%であった(p<0.05, 0.01, 0.001)。 しかし600 MPaではいずれの血清も抗体結合能が高まった。.
(6) 176. 100 A. B. C. D. IgE Binding activity (%). 80. 60 ***. *. 40. ** *. * *. *. *. ***. ***. * *. ** ***. 20. ***. **** ***. 0 Native. 0.1. 100. 200. 300. 400. 500. 600. Pressure (MPa). Fig. 4. Effect of chymotryptic digestion under high pressures on the binding activity of OVM to sera from egg-allergic patients. OVM solutions were hydrolyzed usingα-chymotrypsin under pressures of 100-600 MPa for 30 min at 37°C. The samples were subjected to ELISA using sera from egg allergic patients with high RAST values to OVM. Native: native OVM. A, B, C, D: sera from egg allergic patients. The data represent the means of triplicate samples. * p<0.05, ** p<0.01, *** p<0.001.. 3.3. 高圧下でα-キモトリプシン処理したオボムコイドのヒスタミン遊離. 抗OVMウサギ血清IgG抗体との結合能と卵アレルギー患者血清IgE抗体との結合能が最も 低下した400 MPaでα-キモトリプシン処理したOVMについてアレルゲン性を検討した。卵ア レルギー患者血清を感作したヒト好塩基球様KU812F細胞からOVM処理によるヒスタミンの 遊離が認められた。0.1 MPaでキモトリプシン処理したOVM加水分解物のヒスタミン遊離率は 約80%に低下した。400 MPa処理で得られたOVM加水分解物のヒスタミン遊離率は、患者血 清Aで27.2±5.4%、Bで51.5±7.2%、Dで30.8±4.8%に低下することが認められた。. Histamine releaseactivity (%). 120. A. B. D. 100 80 60 40. **. *. 20 0 Native. 0.1MPa. 400MPa. Fig. 5. Effect of α-chymotryptic digestion under 400MPa on OVM with respect to histamine released from KU812F cells sensitized with sera from three allergic patients. KU812F human pre-basophilic cells (3.0×105/tube) were sensitized with serum IgE from egg allergic patients (1/100). Histamie release from the cells after stimulation with high-pressure/α-chymotrypsin-treated ovomucoid (1 μM) was measured by fluorophotometric assay. Native: native OVM, 0.1 MPa: α-chymotrypsin digestion under 0.1 MPa, 400MPa: α-chymotrypsin digestion under 400 MPa. A, B, D: sera from egg allergic patients. The data represent the means of triplicate samples. * p<0.05, ** p<0.01..
(7) 177. 4.考察 鶏卵白OVMのアレルゲン性低減化を目指し、高圧処理と酵素処理を併用して検討した。高 圧処理後にペプシンあるいはα-キモトリプシン処理しても常圧処理で得られた消化ペプチ ドプロフィールとの違いは認められなかった。高圧下でペプシン処理すると、圧力に依存し てnative OVMの増加と低分子ペプチドの減少が観察された。この結果は高圧下でペプシン活 性が抑制されたことを示す。しかし600 MPaまで圧力を上げても常圧処理で得られたペプチド バンドは無くならないことから、本圧力でもペプシン活性は残存することが分かる。一方、 高圧下でα-キモトリプシン処理すると、native OVMは圧力に依存して急速に減少し400 MPa で完全に消失した。本結果は高圧下でOVMの加水分解が進むような高次構造変化がOVMおよ びキモトリプシンに生じたことを意味する。 高圧下でのタンパク質の挙動を理解するためには、タンパク質の部分体積や部分圧縮率を 考慮する必要がある。観測される断熱圧縮率は、タンパク質内部の空洞cavityと分子表面の水 和への圧力効果によって決定され、断熱圧縮率が小さいほど固く、大きいほど柔らかいタン パク質である [17]。ペプシンの断熱圧縮率は8.60(×1012 cm2/dyn)であることから高圧力の影 響を過度に受け酵素活性が低下したと推察される。このことは高圧下におけるペプシン処理 でnative OVMに相当するバンドが圧力の上昇に従い増加傾向を示したことからも言える。一 方α-キモトリプシンの断熱圧縮率は4.15 (×1012 cm2/dyn)でありOVMの3.38 (×1012 cm2/dyn)よ り若干高い [17]。著者らはOVM水溶液を100~400 MPaで処理すると不可逆な高次構造変化を 起こすことを見出している[9]。これらのことから高圧下でOVMおよびα-キモトリプシン双 方の高次構造変化が相乗的に働き、α-キモトリプシによるOVMの消化が促進されたと推察さ れる。 高圧下でα-キモトリプシン処理したOVMは圧力に依存して抗OVMウサギ血清IgGや卵ア レルギー患者血清IgEとの抗体結合能が急速に低下した。また400 MPaでα-キモトリプシン処 理したOVMの卵アレルギー患者血清IgE抗体との結合能は約20%に、ヒト好塩基球様KU812F 細胞と卵アレルギー患者血清を用いたヒスタミン遊離は約30%に低下した。これは高圧下で OVMのB細胞エピトープ [13] 近傍の高次構造が変化すると共にα-キモトリプシンの活性部 位がゆらぎ、抗原性やアレルゲン性を示すB細胞エピトープの断片化が進んだためと考えられ る 以上の結果は、高圧処理/酵素処理併用によるOVM加水分解物のアレルゲン性低減化は抗 原エピトープ除去に用いる酵素の特異性と高圧処理によりプロテアーゼ活性部位と結合する OVMのエピトープ部位近傍の高次構造変化の兼ね合いに依存することを意味する。超高圧処 理/酵素処理の併用は食品タンパク質のアレルゲン性低減化に有効であり、アレルギー発症の 危険性を低減化した食品の製造を可能にする有用な技術として期待が寄せられる。 謝辞 本研究の一部は日本学術振興会科学研究費の補助を受け行った。 参考文献 [1] Kato, I., Schrode, W., Kohr, J. and Laskowski, M. Jr. (1987) Chicken ovomucoid: Determination of its amino acid sequence, determination of the trypsin reactive site, and preparation of all three of its domains. Biochemistry. 26: 193-201. [2] Matsuda, T., Watanabe, K. and Nakamura, R. (1983) mmunochemical and physical properties of peptic-digested ovomucoid. J. Agric. Food Chem. 31: 942-946. [3] Osuga, D. T., Bigler, J. C., Ruth L. UY, Sjöberg, L.B. and Feeney, R. E. (1974) Comparative biochemistry of penguin egg white proteins-Ⅰ. Ovomucoids: composition.
(8) 178. and inhibitory activities for trypsin, α-chymotrypsin and subtilisin. Comp. Biochem. Physiol. 48B: 519-533 [4] Hayashi, R. (1996) An overview of the use of high pressure in bioscience and biotechnology. In: High Pressure Bioscience and Biotechnology, Hayashi, R. and Balny, C. (eds.), Elsevier, Netherlands, pp 1-7. [5] Schibenzuber, M., Grimm, Y., Bluemelhuber, G., Beherendt, H., Ring, J. and Meyer-Pittroff, J. G. (2003) Influence of high pressure treatment on the allergenicity of foods: in Adv. High Pressure Bioscience and Biotechnolo.Ⅱ, ed. R. Winter (Springer, Berlin, 2003), p.363 [6] Han, G.D., Matsuno, M., Ikeuchi, Y. and Suzuki, A. (2002) Effects of heat and highpressure treatments on antigenicity of beef extract. Biosci. Biotechnol. Biochem. 66, 202-205 [7] Suzuki, A., Hara, T., Koyama, H., Nogami, N., Han, G.D., Odani, S., Matsuno, M., Joh, T. and Nishiumi, T. (2004) Effect of high pressure treatment on the allergenicity of bovine serum albumin evaluated by histamine release assay using sera from allergic patients and human basophilic KU812F cells. Proceedings of the 50th International Congress of Meat Science & Technology. 1163-1166, Helsinki [8] Nogami, N., Matsuno, Takashi Hara, T., Joh, T., Nishiumi, T. and Suzuki, A. (2006) Elimination of the allergenicity of food protein by high pressure, The review of high pressure science and technology, 16: 11-16 [9] Odani, S., Kanda, Y., Hara, T., Matsuno, M. and Suzuki, S. (2007) Effects of High Hydrostatic Pressure Treatment on the Allergenicity and Structure of Chicken Egg White Ovomucoid. High Pressure Bioscience and Biotechnology. Proceedings of the 4th International Conference on High Pressure Bioscience and Biotechnology. 1: 252-258 [10] Okamoto, M., Hayashi, A., Enomoto, A., Kaminogawa, S. and Yamauchi, K. (1991) High-pressure proteolytic digestion of food protein: Selective elimination of β-lactoglobulin in bovine milk whey concentrate. Agric. Biol. Chem. 55: 1253-1257. [11] Peñas, E., Snel, H., Floris, R., Préstamo, G. and Gomez, R. (2006) High pressure can reduce the antigenicity of bovine whey protein hydrolysates. Int. Dairy J. 16: 969-975. [12] Mine, Y. and Zhang, J.W. (2002) Identification and fine mapping of IgG and IgE epitopes in ovomucoid. Biochem. Biophys. Res. Commun. 292: 1070-1074 [13] Takahashi, K. and Aso, T. (1992) An improved method for purification of ovomucoid from Japanese quail egg white. Bull. Mukogawa Women's Univ. Nat. Sci. 40: 21-25. [14] Schägger, H. and von Jagow, G. (1987) Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal. Biochem. 166: 368-379. [15] Engvall, E. and Perlman, P. (1971) Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G. Immunochemistry. 8: 871-874 [16] Håkanson, R., Rönnberg, A. -L. and Sjölund K. (1972) Fluorometric determination of histamine with OPT: Optimum reaction conditions and tests of identity, Analytical Biochemistry: 47: 356-370 [17] Gekko. K.(1993) Compressibility-structure-function relationships of proteins. In High Pressure Bioscience and Food Science. Hayashi, R. (ed.) Sanei Publisher, Kyoto, Japan. pp 63-73.
(9) 179. Effects of Combined High-Pressure/Enzymatic Treatment on the Antigenicity and Allergenicity of Chicken Egg White Ovomucoid Yasuko Kanda¹, Takashi Hara², Toshio Jou², Masatomo Matuno³, Atsushi Suzuki4, and Sumiko Odani5 ¹ Graduate School of Science and Technology, Niigata University, 8050 Nino-cho, Igarashi, Nishi-ku, Niigata 950-2181, Japan ²Department of Applied Biological Chemistry, Faculty of Agriculture, Niigata University, 8050 Nino-cho, Nishi-ku, Igarashi, Niigata 950-2181, Japan 3 Department of Pediatrics, Yoshida Hospital, 32-14 Yoshidadaibo-cho, Tsubame -Yoshida, Niigata 959-0242, Japan 4 Faculty of Health and Medical, Teikyou Heisei University, 2289 Uruido, Ichihara, Chiba 290-0171, Japan 5 Department of Living Sciences and Technology, Faculty of Education and Human Sciences, Niigata University, 8050 Nino-cho, Igarashi, Nishi-ku, Niigata 950-2181, Japan *e-mail:odani@ed.niigata-u.ac.jp Proceedings of the 15th Symposium for Japanese Research Group of High Pressure Bioscience and Biotechnology Received 12 March 2008/Accepted 19 March 2008. Abstract Ovomucoid (OVM) is a dominant allergen in chicken egg white. It is difficult to lower the antigenicity and allergenicity of OVM because of its stability to heat and chemical treatments. The effects of combined high-pressure/enzymatic treatment on the proteolysis, antigenicity and allergenicity of OVM were investigated. OVM (1.4 mg/ml) was pressurized to 100-600 MPa at 37°C for 30 min prior to pepsin or chymotrypsin hydrolysis, which was also conducted under high pressures (100-600 MPa). The peptide profile was analyzed by tricine sodium dodecyl sulfate polyacrylamide gel electrophoresis. The residual antigenicity was assayed by enzyme-linked immunosorbent assay, using rabbit antisera against OVM and sera from egg-allergic patients. The residual allergenicity was measured on the basis of the histamine released from KU812F human pre-basophilic cells sensitized with sera from egg-allergic patients. Chymotryptic digestion carried out under high pressures enhanced the hydrolysis of OVM and reduced its antigenicity and allergenicity. The greatest reduction of antigenicity and allergenicity was obtained at a pressure of 400 MPa. Combined high-pressure/enzymatic treatment could be useful for reducing the antigenicity of food proteins Keywords:ovomucoid, allergen, high-pressure, pepsin, chymotrypsin.
(10)
図
![Fig. 1. Amino acid sequence of chicken preovomucoid [1]. Signal peptide sequence residues were shown in diamonds](https://thumb-ap.123doks.com/thumbv2/123deta/6847191.1170469/2.892.107.463.383.799/sequence-chicken-preovomucoid-signal-peptide-sequence-residues-diamonds.webp)
関連したドキュメント
(1)高圧ケーブル及び公称断面積 60mm 2 以上の低圧ケーブルの端末処理は、JCAA 規格の材料を用いること。. ただし、 60mm 2
Amount of Remuneration, etc. The Company does not pay to Directors who concurrently serve as Executive Officer the remuneration paid to Directors. Therefore, “Number of Persons”
あれば、その逸脱に対しては N400 が惹起され、 ELAN や P600 は惹起しないと 考えられる。もし、シカの認可処理に統語的処理と意味的処理の両方が関わっ
[No.20 優良処理業者が市場で正当 に評価され、優位に立つことができる環 境の醸成].
固体廃棄物の処理・処分方策とその安全性に関する技術的な見通し.. ©Nuclear Damage Compensation and Decommissioning Facilitation
「JSME S NC-1 発電用原子力設備規格 設計・建設規格」 (以下, 「設計・建設規格」とい う。
廃棄物の再生利用の促進︑処理施設の整備等の総合的施策を推進することにより︑廃棄物としての要最終処分械の減少等を図るととも
上水道施設 水道事業の用に供する施設 下水道施設 公共下水道の用に供する施設 廃棄物処理施設 ごみ焼却場と他の処理施設. 【区分Ⅱ】