東 京 農 業 大 学
学 位 論 文
卵胞発育と低酸素環境が顆粒層細胞の
代謝と増殖に及ぼす影響
Effects of follicular growth and low oxygen environment
on metabolism and proliferation in granulosa cells
2017 年
農学研究科 畜産学専攻
白 築 章 吾
論文題目 卵胞発育と低酸素環境が顆粒層細胞の代謝と増殖に及ぼす影響 博士学位論文 目次 第一章 緒論 1 第二章 卵胞ステージがブタ顆粒層細胞の遺伝子発現に与える影響 第一節 緒言 5 第二節 材料および方法 7 第三節 結果 11 第四節 考察 13 付表および付図 16 第三章 低酸素環境がウシ顆粒層細胞の代謝と増殖に及ぼす影響 第一節 緒言 19 第二節 材料および方法 21 第三節 結果 29 第四節 考察 31 付表および付図 34 第四章 SIRT1 が低酸素環境におけるウシ顆粒層細胞の代謝と増殖に与える影響 第一節 緒言 46 第二節 材料および方法 48 第三節 結果 51 第四節 考察 52 付表および付図 54 第五章 総括 58 Summary 63 謝辞 66 引用文献 67
1 第一章 緒論 哺乳動物の卵胞は外側から莢膜細胞、基底膜そして顆粒層細胞の三層構造か ら成り、顆粒層細胞に囲まれるように卵子が卵胞の中心部に存在している。卵 胞は卵巣の皮質部に存在しており、ホルモンや局所成長因子の働きを受けてそ の体積を増大させ、最終的に成熟卵を排卵する。排卵後、卵胞の細胞は黄体へ と分化し、妊娠維持に必須な組織へと再編成される。これらの一連の事象にお いて、中心的な役割を担っているのは顆粒層細胞である。顆粒層細胞は卵胞の 発育に伴い、ギャップ結合を介して、ATP を含む栄養物質や cGMP を流入させ ることで間接的に卵子の減数分裂再開能力や細胞質成熟に関与する。また卵子 と顆粒層細胞間の相互作用も重要である。例えば卵子から分泌される bone morphogenetic protein-15 や growth differentiation factor-9 は、顆粒層細胞の 増殖や分化、顆粒層細胞の卵丘膨化を促進する (Paulini and Melo, 2011)。一方 で顆粒層細胞から分泌される kit ligand は卵子細胞膜上にあるレセプターであ る c-kit を 介 し て phosphatidylinositol 3-kinases (PI3K)- protein kinase B/AKT (AKT) 経 路 を 活 性 化 し 、 卵 子 の 成 長 を 促 進 す る (Thomas and Vanderhyden, 2006)。顆粒層細胞はエストラジオールやインヒビン、アクチビ ンといったホルモン分泌により、下垂体からのゴナドトロピン分泌を制御し、 視床下部-下垂体-性腺軸が円滑に機能するように支配している。そのため卵子と の相互作用やホルモン分泌に焦点を当てた研究がこれまで数多く行われてきた。 卵胞の発育には顆粒層細胞の爆発的な増殖を伴う。ウシの原始卵胞の直径は 0.035mm であるが、約 80 日かけて直径約 20mm まで成長する(Fair, 2003)。ま た原始卵胞内の顆粒層細胞数は約20 個程度であるが、排卵前のグラーフ卵胞は 40×106個まで増加することが推量されている(van Wezel and Rodgers, 1996)。
2 一方で卵胞は成長に伴い血管新生が活発に行われる。しかしながら卵胞内部へ の血管網の侵入は卵胞基底膜により遮断されており、莢膜細胞までしか到達す る事が出来ない。そのため血管網を介した酸素供給は他の組織と比較して低下 していると考えられる。技術的に卵胞内の酸素濃度を直接的に計測することは 困難であるが、ドップラー超音波診断によると1.5 から 5.5%である事がヒトに おいて報告されている(van Blerkom et al., 1997)。また数理的モデルを用いた 解析においても卵胞内部の酸素濃度は低酸素状態である事が予測されている (Redding et al., 2007,2008)。これらのことから顆粒層細胞の爆発的な増殖は低 酸素環境下で行われていると考えられる。 低 酸 素 環 境 下 で 爆 発 的 な 細 胞 増 殖 を 示 す 組 織 と し て 腫 瘍 が あ げ ら れ る (Vaupel et al., 1989)。腫瘍細胞は低酸素刺激により血管新生を伴いながら増殖 するが、成体の細胞において新規の血管新生を行うのは腫瘍と卵胞由来組織だ けであり、この点において卵胞と腫瘍は非常に類似していることが報告されて いる(Neeman et al., 1997)。また腫瘍細胞は低酸素環境に適応するために代謝を 変化させることが知られている。すなわち酸化的リン酸化(OXPHOS)から解糖 への変化である(Kroemer and Pouyssegur, 2008)。腫瘍細胞において、OXPHOS はpyruvate dehydrogenase kinase 1(PDK1)の活性化によって抑制的に調節さ れていることが報告されている(Kim et al., 2006)。PDK1 は TCA 回路において ピルビン酸からアセチル Co-A への変換を担うピルビン酸脱水素酵素を抑制的 にリン酸化させる事でOXPHOS を低下させる。この PDK1 や解糖系酵素の発 現は転写因子複合体であるhypoxia inducible factor 1(HIF1) complex により調 節される(Yeung et al., 2008)。HIF1 complex は調節因子である HIF-1ɑ と HIF-1β のへテロダイマーから構成されている。通常酸素分圧下では、調節因子 である HIF-1ɑ のプロリンとアスパラギン残基がそれぞれ prolyl hydroxylase
3
(PHD)と factor inhibiting HIF-1(FIH-1)により水酸化され、ユビキチンリガー ゼである von-Hippel-Lindau タンパクにより水酸化プロリン残基がユビキチン 化され、ユビキチン-プロテアソーム系の働きによって分解される。またアスパ ラギン残基の水酸化はヒストンアセチル基転移酵素である CREB-binding protein /p300 の結合阻害を介して、転写活性を抑制する(Lee et al., 2004)。し かしながら低酸素環境下では酸素を必要とする PHD と FIH-1 の活性が阻害さ れ、結果として分解を逃れたHIF-1ɑ が蓄積し、パートナーである HIF-1β とヘ テロダイマーを形成し、プロモーター領域にhypoxia response elements (HRE) を持つ解糖や血管新生に関与する遺伝子発現を活性化させる。HRE 領域を持つ 遺伝子の中には卵胞の血管新生に重要な vascular endothelial growth factor (VEGF)が含まれる(Koh et al., 2008)。
また腫瘍形成において、AKT と mammalian target or rapamycin (mTOR) のシグナルカスケードの活性化は細胞増殖の強力な調節因子である事が知られ ている。AKT は tuberous sclerosis complex 2 (TSC2)を抑制的にリン酸化し、 mTOR complex 1(mTORC1) 活 性 を 上 昇 さ せ る 。 mTORC1 は p70S6 kinase(p70S6K)をリン酸化し、p70S6K はタンパク合成や細胞増殖に関与する S6 ribosormal protein (S6RP)をリン酸化する(Browne and Proud, 2004)。腫瘍 におけるこれらの知見から、低酸素環境下における顆粒層細胞の HIF1 や AKT-mTORC1 の活性化が解糖や細胞増殖に影響を及ぼすものと考えられる。 しかしながら HIF1 を起点としたシグナルカスケードが卵胞発育や酸素環境下 における顆粒層細胞の増殖にどのような影響を及ぼすかは不明である。 OXPHOS から解糖への代謝変化はミトコンドリアの量的、質的な低下を伴う 事が幹細胞において報告されている(Chen et al., 2012)。また低酸素刺激により 誘導されるHIF-1 complex の働きがミトコンドリアでのエネルギー代謝を変化
4
させ、細胞の代謝変化を引き起こす(Semenza, 2010)。一方でミトコンドリアの 代謝を正に制御する因子として、NAD+依存型の Class Ⅲ脱アセチル化酵素で あるsirtuin 1 (SIRT1)が挙げられる。SIRT1 は転写コアクチベーターである peroxisome proliferator activated receptor gamma coactivator 1ɑ (PGC1ɑ)を 脱アセチル化し、活性化させる。PGC1ɑ は転写因子である nuclear respiratory factors (NRFs)や peroxisome proliferator activated receptor gamma と共に核 内に移行し、ミトコンドリアDNA の合成やミトコンドリアの構成タンパク、脂 肪酸代謝などに関与する遺伝子発現を増加させる。またSIRT1 は TSC2 を脱ア セチル化することにより mTORC1 の活性を抑制することが報告されている (Ghosh et al., 2010)。しかし低酸素環境下における顆粒層細胞の代謝能や増殖 能の変化にSIRT1 の働きがどのような影響を及ぼすかは不明である。 本研究では、1)異なる卵胞ステージにおける網羅的遺伝子発現解析 2)低酸素 環境が顆粒層細胞の解糖やミトコンドリア代謝および細胞増殖シグナリングに 与える影響について解析することによって、低酸素環境が顆粒層細胞の代謝能 や増殖能に与える影響について明らかにし、3)SIRT1 の活性化が低酸素環境下 の顆粒層細胞の代謝能および増殖能に与える影響について検討を行った。
5 第二章 卵胞ステージがブタ顆粒層細胞の遺伝子発現に与える影響 第一節 緒言 哺乳類において卵胞形成は一層の扁平な顆粒層細胞と卵子とから成る原始卵 胞の出現から始まる。性成熟を向かえると原始卵胞が活性化し、立方状の顆粒 層細胞と卵子とから成る一次卵胞へと成長し、続いて重層した顆粒層細胞と卵 子から成る二次卵胞へと成長する。二次卵胞になると莢膜細胞が顆粒層細胞を 取り囲み、莢膜細胞、顆粒層細胞、卵子から成る卵胞構造が完成する。その後、 卵子を取り囲むように卵胞内部に腔が形成され、初期胞状卵胞(EAF)へと成長す る。EAF から胞状卵胞(AF)への成長は約 2 週間を必要とし、顆粒層細胞数は数 千から数百万へと著しく増殖する(Oi et al., 2015)。また腔形成後の卵胞発育は 卵子の減数分裂再開能力やその後の受精、初期発生能力に影響を与える事から 卵胞ステージの進展に伴う顆粒層細胞の変化について明らかにする事は重要で ある。 一般的に細胞の増殖にはエネルギー即ちATP が必要となる。細胞は解糖また はミトコンドリアでの酸化的リン酸化(OXPHOS)を介して ATP を産生するが、 卵胞発育においてはその成長に伴い、代謝変化が生じることが知られている。 前胞状卵胞では、解糖活性の指標であるグルコース消費量とラクトース産生量 の比率が低調であり、解糖がエネルギー産生の主要因ではないことが示唆され ているが、腔形成を境に解糖が優勢となることが報告されている(Boland et al., 1993 and 1994, Harris et al., 2007)。しかしながら家畜において卵胞の成長に 伴い、代謝関連遺伝子の発現がどのように変化するのか報告された例は少ない。
6 解析することが容易となった。さらに解析ソフトの充実により、得られた遺伝 子発現情報から分子間の相互作用や遺伝子発現を支配している上流因子の予測 が可能となり、生命現象を解明するための有効なツールとなった。第二章では 卵胞の発育に伴い、顆粒層細胞のどのような因子が卵胞の発育に伴い変化する のか、または代謝関連遺伝子の発現がどのように変化するのかをNGS を用いて 網羅的に解析した。
7 第二節 材料および方法 1) 試薬 以下、特に記述のない試薬および培地はナカライテスク (Kyoto, Japan)の製 品を用いた。 2) 供試卵巣 神奈川県食肉センターにて入手した未経産ブタ卵巣は,抗生物質を添加した 37ºCのPBS(+)中に保存し,一時間以内に実験室に持ち帰った。 持ち帰った卵巣は,37°C に温めた PBS(-)にて数回洗浄後,滅菌ペーパータオ ルに乗せ,血液およびPBS を除去した。 3) 顆粒層細胞の回収 卵巣表面を薄切し実体顕微鏡下で200 個の EAF (0.5-0.7mm)を採取し、細く 引いたパスツールピペットを用いて卵子を除去し、顆粒層細胞を回収した。ま たEAF を採取した同一卵巣より、200 個の 1-3mm の小卵胞(SAF)および 3-5mm の大卵胞(LAF)を無作為に選出し、卵胞内内容物を 21 ゲージ針を装着した注射 筒を用いて吸引採取した。吸引採取後、卵胞内内容物より卵子卵丘細胞複合体 を回収し、0.1%ヒアルロニダーゼを含む PBS に移し、5 分間振盪し、顆粒層細 胞と卵子を分離した。EAF、SAF および LAF の 3 つの成長ステージの卵胞よ り得られた顆粒層細胞は後述の網羅的遺伝子発現解析に供した。 4) 網羅的遺伝子解析
8
(Thermo Fisher Scientific, Waltham, MA, USA)同梱の RNA 抽出液を用いて抽 出した。得られたRNA の正常性は KAPA Library Quantification Kit (KAPA Biosystems, Wilmington, MA, USA) を 用 い 、 Agilent 2100 Bioanalyzer (Aglient Technologies, Palo Alto, CA, USA)にて解析した。cDNA ライブラリー はTruSeq RNA Sample Preparation Kit (Illumina, San Diego, CA, USA)を用 いて調整した。また得られたcDNA ライブラリーは cBot (Illumina)を用いてク ラスタリングし、HiSeq2500 (Illumina)を用いて 2 レーン、50-bp (single end) で配列決定を行った。また画像解析、base-calling および quality-filtering を CASAVA software ver 1.8.3(Illumina)を用いて行った。得られた結果からアダ プター配列、参照配列に一致しない配列ならびに精度の低い配列をフィルタリ ングし、ブタゲノム配列(susScr3)にマッピングを行い、リード数を測定した。 マッピングされた配列よりそれぞれの遺伝子のReads per kilobase of exon per million mapped sequence reads (RPKM)を算出し、解析を行った。フィルタリ ング、マッピングならびにそれに続く解析はCLC genomics workbench (Qiagen, Redwood City, CA, USA)を用いて行った。また遺伝子発現量の有意性は Ingenuity Pathway Analysis (IPA, Qiagen)を用いて解析した。上流転写調節因 子の解析は IPA の Upstream Regulator 機能を用いて行い、Overlapping p-value ならびに Activation Z-score を算出した。Overlapping p-value は上述 の遺伝子発現解析により得られた遺伝子とその遺伝子の既知の転写調節因子の 間に有意な重なりがあるかを意味し、重なりの有意性はFisher’s exact test を用 いて解析し、P 値が 0.01 未満を有意差ありとした。Activation Z-score は得ら れた遺伝子発現量の有意性を基に、転写調節因子が正負のどちらの方向に動い ているかを示し、Z-score が 0 より大きいものを Activated、その逆に 0 より小 さいものInhibited とした。特に Z-score が絶対値で 2 以上の値を示したものに
9
関しては発現の方向性(Predicted activation state)を各図表に示した。また NGS により得られた遺伝子発現量を基にHIF1、解糖および OXPHOS に関与する遺 伝子群の中で有意に発現量が変化したものの割合をそれぞれの卵胞ステージ間 で比較した。 5) 逆転写リアルタイム PCR NGS により得られた結果の正常性を確認するためにFLT1、SPP1、HIF1、V EGF ならびに ACTN4 の遺伝子発現量を定量し、卵胞ステージ間で相対遺伝子 発現量を比較した。NGS の結果からほとんどのハウスキーピング遺伝子(β-ACT IN、H2A、HPRT1、PGK1、GAPDH ならびに ATP5F1)が卵胞ステージの進 展に伴い、有意に変化していたため卵胞ステージ毎で発現量が変化せず、恒常 的に高い発現量を示す GPX7 を内部標準遺伝子とした。GPX7 の卵胞ステージ 間の Fold change は EAF/SAF=1.001 (P=0.88)、SAF/LAF=0.845 (P=0.35) であった。顆粒層細胞は異なるグループのブタ卵巣を無作為に選抜し、20 個の EAF、SAF ならびに LAF よりそれぞれ、上述のように採取した。得られた顆 粒層細胞からRNA queous Micro (Thermo Fisher Scientific)を用いて、RNA を単離し、Thermo script RT-PCR system (Thermo Fisher Scientific)を用い て逆転写を行い、cDNA を合成した。また逆転写反応時のプライマーはキット 同梱のOligo(dT)20を用いた。得られたcDNA はリアルタイム PCR の鋳型とし て用い、SSoFastTM EvaGreen Supermix (BioRad、Hercules、CA、USA)を プレミックスとして用いた。それぞれのプライマーセットはPrimer3 を用いて 作成し(FLT1; Forward:CGTGGCTTCCAACAAAGTGG、Reverse:GACAGCT TCAGGTCTTCCCC、SPP1;Forward:AGTCCAACGAAAGCCCTGAG、Rev erse:CGGAGTGATGAGACTCGTCG、HIF1; Forward:AGCCAGATGATCGT
10
GCAACT、Reverse:CCATTGATTGCCCCAGGAGT、VEGFA; Forward:TCG GAGCGGAGAAAGCATTT、Reverse:CGGCTTGTCACATCTGCAAG、ACTN 4; Forward:CGACCACTTGGCAGAGAAGT、Reverse:TTGCGGATGAGGGC TTTGAT、GPX7; Forward:GGGCGGAAAAGTCTAGCAGT、Reverse:GGCT GGTGAATGACTGGTCA)、PCR 反応は First denaturation を 95℃で 1 分間 行った後、それに続くDenaturation ステップ(98℃、5 秒)、Annealing および Extension ステップ(59℃、11 秒)の 40 サイクルで行った。また SYBR Green の蛍光はAnnealing および Extension ステップの終わりに計測した。また PCR 反応の終了後、融解曲線解析および電気泳動を行い、標的産物の特異性を確認 した。サーマルサイクラーはRotor-Gene 6500 system (Qiagen)を用いた。そ れぞれの遺伝子発現量は標的増幅配列を含むプラスミドDNA を段階的に 10 倍 希釈し、スタンダードとして用いることで定量した。またそれぞれのプラスミ ドDNA に標的配列が組み込まれていることを DNA シーケンスにより確認した。 また逆転写リアルタイムPCR は異なる卵巣由来の顆粒層細胞を用いて、3 回反 復した。標的遺伝子の相対発現量はそれぞれの発現量を GPX7 の発現量により 除することにより標準化し、得られた値を統計解析に用いた。 6) 統計解析 NGS により得られた遺伝子発現量については上述のように統計解析を行い、 HIF1、解糖または OXPHOS に関与する遺伝子発現量の割合は Chi-Squared test を用いて比較し、P 値が 0.05 未満を有意差ありとした。また逆転写 PCR より得られた相対発現量は、EAF-SAF および SAF-LAF 間でそれぞれ Student’s t-test により比較し、P 値が 0.05 未満を有意差ありとした。
11
第三節 結果
逆転写リアルタイムPCR により得られたGPX7 に対する FLT1、SPP1、HIF1、 VEGF ならびに ACTN4 の相対発現量と NGS により得られた発現量のパターン を比較したところ、発現パターンはおおよそ同様の傾向を示した(Table 1)。ま たIPA に実装された Upstream Regulator 機能により卵胞ステージの進展 (EAF-SAF、SAF-LAF)に伴い、どのような因子が上流因子として働くかを予測 した。EAF-SAF では 5 種類の因子が上流因子として予測され、SP1、TP53、 NR3C1 がそれぞれ抑制され、HIF1A および STAT3 は活性化した。SAF-LAF においては6 種類の因子が予測され、すべての因子 1(SP1、CTNNB1、TP53、 SP3、JUN および HIF1A)が抑制された(Table 2)。
続いて代謝に関与する解糖およびOXPHOS の関連遺伝子の発現比が卵胞の ステージの進展に伴い変化するかどうかをNGS により得られた遺伝子発現量 を基に探索した。またUpstream Regulator 機能により HIF1A が卵胞ステージ の進展に伴い変化する共通の上流因子として予測されたため、HIFA に関連する 因子の発現比を求めた(Table 3)。解糖関連遺伝子、OXPHOS 関連遺伝子ならび にHIF1A 関連因子は Kyoto Encyclopedia of Genes and Genomes (KEGG) パ スウェイデータベースのMap No.00010、00190 ならびに 04066 をそれぞれ 参照した。また遺伝子発現量の正確性を担保するためにRPKM が1より大きい ものを抽出し、卵胞ステージの進展(EAF-SAF、SAF-LAF)に伴い、遺伝子発現 量が有意に上昇しているものまたは減少しているものをそれぞれ抽出し、解析 に用いた。EAF-SAF 間では、解糖に関わる遺伝子群が有意に増加した(低下: 1/18、増加:15/18、P < 0.05)。またこの傾向は SAF-LAF 間でも同様に観察さ れた(低下:3/18、増加:15/18、P < 0.05)。一方、OXPHOS 関連遺伝子群の発
12 現はEAF-SAF 間で卵胞ステージの進展に伴い、有意に増加した(低下:8/70、 増加:50/70、P < 0.05)。しかしながら SAF-LAF 間ではその差は消失した(低下: 22/70、増加:26/70、P > 0.05)。また HIF1 関連遺伝子群の発現量は EAF-SAF 間ならびにSAF-LAF 間で有意な差は見られなかった(EAF-SAF;低下:14/41、 増加:22/41、P > 0.05、SAF-LAF;低下:17/41、増加:21/41、P > 0.05)。
13 第四節 考察 本章では卵胞ステージ進展に伴い顆粒層細胞にどのような転写調節因子が関 与し、代謝関連遺伝子がどのように変化するのかを網羅的遺伝子解析により明 らかにした。 EAF から LAF へと成長する過程で共通して上流因子として予測されたのは TP53、SP1 および HIF1A であった (Table 2)。これら 3 つの因子は異なる発達 段階のウシ卵胞より得られた顆粒層細胞のマイクロアレイ解析結果と同様の上 流因子であった(Douville and Sirard, 2014)。TP53 遺伝子は p53 タンパクをコ ードする転写活性因子であり、TP53 遺伝子の変異はがんの引き金となる事から がん遺伝子とも呼ばれる。p53 は下流因子の発現調節を介して、細胞周期の進 展の抑制、DNA 修復、オートファジーの抑制やアポトーシスなど多様な細胞調 節機構に関与する(Zilfou and Lowe, 2009)。また p53 は卵胞閉鎖を起こした顆 粒層細胞に高発現し、細胞周期の停止およびアポトーシスが増加することが知 られている(Kim et al., 1999)。SP1 は GC-rich な領域に結合するジンクフィン ガー転写因子であり、リン酸化、グリコシル化などの転写後修飾を受け、細胞 の分化、成長、アポトーシス、免疫応答やクロマチンリモデリングなどに関与 する。興味深いことにSP1 は p53 と協調して細胞周期の抑制に関与する遺伝子 群を制御していることが報告されている(Beishline and Clifford, 2015)。本研究 においてTP53 および SP1 は EAF-SAF および SAF-LAF 間で有意に抑制され ていた(Table 2)。Oi ら(2015)は EAF から AF に至る過程で顆粒層細胞が劇的 に増加することを報告している事から、TP53 や SP1 の抑制が卵胞の成長過程 における細胞周期の進展に影響を与えている可能性が示唆された。
14
昇することが示された(Table 2)。HIF1 は低酸素環境下で発現が安定する basic helix-loop-helix を持つ転写因子であり、HIF1α と HIF1β とヘテロダイマーを 形成し、OXPHOS の抑制、解糖や血管新生に関与する遺伝子群を制御している (Koh et al., 2008)。HIF1 の関連遺伝子の発現が EAF-SAF 間において変化する かを検討したところ、増加する傾向が見られた (P=0.075)。また EAF-SAF およ びSAF-LAF 間で解糖関連遺伝子の発現は有意に増加しており、この解糖関連遺 伝子はHIF1 により制御を受けるものであった(Table 3)。Makanji ら(2014)は 初期段階の卵胞の発育はHIF1 誘導性の解糖系遺伝子(Pgk1、Hmox1、Hk2、 Gpi、Pfk1、Pfkp、Aldoa、Gapdh、Pgam1、Eno1、Pkm および Ldha)の発現 により支持される事を報告している。今回の検討においてはAldoa を除く全て の因子の発現が有意に上昇していた(P < 0.05)。また HIF1 はグルコース供与体 であるGLUT1(SLC2A1)および GLUT3(SLC2A3)のプロモーター領域に結合し、 遺伝子発現を亢進することが報告されている(Kroemer and Pouyssegur, 2008)。 本検討においてはGLUT1の発現は見られなかったものの GLUT3 の発現は EAF-SAF 間で有意に高い値を示した(RPKM; EAF vs SAF = 180.25 vs 671.93、 P < 0.05)。同じく HIF1 により転写制御を受け、ミトコンドリアでのピルビン 酸代謝を負に制御するPDK1 の発現は EAF-SAF および SAF-LAF 間で有意に 発現が上昇した(PRKM; EAF vs SAF = 6.60 vs 17.17、P < 0.05、SAF vs LAF = 17.17 vs 35.89、P < 0.05)。また卵胞発育に伴い発現が増加するVEGFA の発現 も卵胞ステージの進展に伴い増加した(RPKM; EAF vs SAF = 61.53 vs 432.78、 P < 0.05、SAF vs LAF = 432.78 vs 749.67、P < 0.05)。卵胞ステージの進展に 伴いHIF1 の下流因子がどのようなメカニズムを介して活性化したのかは不明 であるが、顆粒層細胞の密度が細胞周囲の酸素環境や、HIF1 の活性ならびに下 流因子の発現量に影響を与えることが報告されている(Marsters et al., 2014)。
15
これらの事からEAF から SAF に至る過程で増殖した顆粒層細胞により卵胞内 部が低酸素環境に陥り、HIF1 関連遺伝子の発現が亢進された可能性が考えられ た。しかしながらOXPHOS 関連遺伝子は予想を裏切り、EAF から SAF に至る 過程で増加しており、SAF-LAF 間ではこの差が消失した(Table 3)。なぜこのよ うな現象が起こったのかは不明であるが、顆粒層細胞が卵胞内のどの部位にい るかで細胞の状態が変化することが報告されており(Russo et al., 2006)、他のが んと異なり血流量が豊富な肝臓がん由来細胞であるHepG2 細胞においては、 OXPHOS が活性化している事が報告されている(Rodríguez-Enríquez et al., 2015)。本実験においては顆粒層細胞卵子複合体の位置を選別してはいないため、 異なるバックグラウンドを持つ顆粒層細胞が混在していた可能性が考えられる。 もしくは顆粒層細胞の代謝には一部のがん細胞と同様に解糖とOXPHOS の両 方がATP 産生に重要なのかもしれない。しかしながらこれらの代謝変化が顆粒 層細胞の増殖にどのような影響を与えるかは本実験からは明らかとならなかっ た。そこで第三章ではHIF1 の安定化に必要十分な酸素条件下において顆粒層 細胞の代謝ならびに増殖能がどのように変化するかを検討した。
16
GPX7
1.00
-1.11
-
-FLT1
6.45 *
-2.30 *
6.27 *
-2.67 *
SPP1
7.66 *
-17.63 *
21.85 *
-1.69 *
HIF1A
1.54 *
1.66 *
1.68 *
1.21 *
VEGFA
7.03 *
1.73 *
3.38 *
1.48 *
ACTN4
-2.19 *
-1.15 *
-1.93 *
-1.42 *
Table 1. Comparison between NGS and RT-PCR.
*; Significant difference (P < 0.01). NGS; fold difference of RPKM value
between SAFs and EAFs, and between LAFs and SAFs. RT-PCR; relative
expression level to GPX7 was compared between SAFs and EAFs, and
between LAFs and SAFs.
SAFs/EAFs
LAFs/SAFs
SAFs/EAFs
Feature ID
NGS
RT-PCR
LAFs/SAFs
Fold difference
Fold difference
17
P
-v
a
lu
e
P
re
d
ic
te
d
P
-v
a
lu
e
P
re
d
ic
te
d
of
a
c
ti
v
a
ti
o
n
of
a
c
ti
v
a
ti
o
n
o
v
e
rl
a
p
st
a
te
o
v
e
rl
a
p
st
a
te
1
S
P
1
-0
.7
6
4
.9
0
E
-2
2
S
P
1
-2
.4
1
8
.7
2
E
-2
2
In
h
ib
it
e
d
2
T
P
5
3
-2
.9
4
2
.4
9
E
-1
7
In
h
ib
it
e
d
C
T
N
N
B
1
-0
.4
4
1
.1
5
E
-1
9
3
H
IF
1
A
0
.4
5
1
.1
7
E
-1
4
T
P
5
3
-4
.0
5
3
.0
5
E
-1
9
In
h
ib
it
e
d
4
N
R
3
C
1
-1
.4
8
2
.8
3
E
-1
4
S
P
3
-0
.2
7
2
.5
4
E
-1
8
5
S
T
A
T
3
0
.3
0
5
.9
3
E
-1
4
JU
N
-1
.6
4
4
.0
3
E
-1
7
o
th
e
rs
H
IF
1
A
-2
.5
9
1
.9
9
E
-0
9
In
h
ib
it
e
d
N
o
.
o
f
b
e
st
T
a
b
le
2
.T
o
p
fi
v
e
u
p
st
re
a
m
re
g
u
la
to
rs
i
n
g
ra
n
u
lo
sa
c
e
lls
d
u
ri
n
g
i
n
v
iv
o
fo
lli
c
u
la
r
d
e
v
e
lo
p
m
e
n
t.
E
A
F
s
-
S
A
F
s
S
A
F
s
-
L
A
F
s
U
p
st
re
a
m
re
g
u
la
to
r
U
p
st
re
a
m
re
g
u
la
to
r
A
c
ti
v
a
ti
o
n
z-s
c
o
re
A
c
ti
v
a
ti
o
n
z-s
c
o
re
18
EAFs - SAFs SAFs - LAFs
Down 5.6 (1/18) 16.7 (3/18) Up 83.3 (15/18)* 72.2 (13/18)* Down 11.4 (8/70) 31.4 (22/70) Up 71.4 (50/70)* 37.1 (26/70) Down 34.1 (14/41) 41.5 (17/41) Up 53.7 (22/41) 51.2 (21/41) Follicle stages
Table 3. Rate of up- or down-regulated genes associated with glycolysis, OXPHOS, and HIF1 in granulosa cells of EAFs, SAFs, LAFs.
*; Significant difference between number of up- and down-regulated genes. P < 0.05; (Chi-squared test). Expression pattern Glycolysis OXPHOS HIF1
19
第三章 低酸素環境がウシ顆粒層細胞の代謝と増殖に及ぼす影響
第一節 緒言
前章より、ブタ卵胞の発育過程においてHIF1 が上流因子として予測され、 HIF1 の下流因子である解糖系遺伝子の発現亢進、ならびに OXPHOS を抑制す るPDK1 の発現の亢進が認められた。HIF1 は HIF1α と HIF1β がヘテロダイ マーを形成することで機能する転写因子である。通常酸素環境下ではHIF1 の 調節因子であるHIF1α がユビキチンプロテアソーム系による分解もしくは転写 活性の抑制を受け機能しない。そのため卵胞ステージの進展に伴うHIF1 下流 因子の発現上昇は卵胞内が低酸素環境である事を間接的に示しているものと考 えられる。しかしながら一般的に低酸素環境下ではATP 合成に酸素を用いる好 気呼吸が抑制され、得られるエネルギー量は低下する。もし卵胞内部が低酸素 環境であるならば細胞内のエネルギーバランスに不均衡が生じ、細胞増殖は抑 制方向に傾くと考えられるが、実際の顆粒層細胞数は卵胞の発育に伴い増加す る。その事から低酸素環境で顆粒層細胞の増殖を担保する機構が存在している ものと考えられるが、前章では遺伝子発現のみに着目していたため、実際に低 酸素環境がどのようなメカニズムを介して、顆粒層細胞の解糖能やOXPHOS、 細胞増殖に影響を及ぼしているのかは検討していない。 一般に細胞の分裂や成長においてAKT-mTORC1 パスウェイが重要な役割を 担っている。AKT は上流の PI3K が成長因子やホルモンの働きにより活性化す ることでリン酸化を受け、TSC2 の抑制的リン酸化を解して、mTORC1 の働き を制御している。またmTORC1 は GβL、Raptor、Deptor およびコアタンパク であるmTOR から成る複合体である。mTORC1 は細胞の増殖、成長、生存に
20 関与する一方でオートファジーによる分解過程を制御する分水嶺として働く。 mTORC1 はリン酸化を受けるとタンパクへの翻訳を制御する p70S6K や 4E-BP1 をリン酸化し、タンパクの翻訳を活性化させ、オートファジーに必須の セリンスレオニンキナーゼであるULK1 や ATG13 などの働きを抑制的リン酸 化により阻害し、オートファジーの進行を負に制御している。 一方でVEGF は PI3K-AKT シグナリングを活性化させる事が報告されている (Riesterer et al., 2004)。VEGF の発現は卵胞の成長に伴い増加することが報告 されており(Barboni et al., 2000)、前章においても、EAF-SAF および SAF-LAF 間で有意に増加していた。またVEGF はプロモーター領域に HRE を持つ HIF1 の活性化を介して発現が増加する因子である事から、VEGF が上述のパスウェ イを介して、低酸素環境下で顆粒層細胞の増殖に何らかの影響を及ぼしている 可能性が考えられる。
そこで本章では、低酸素環境においてどのような因子がウシ顆粒層細胞の代 謝、増殖を制御しているのかについて分子生物学的手法を用いて検討した。
21 第二節 材料および方法 1) 試薬 以下、特に記述のない試薬および培地はナカライテスク (Kyoto, Japan)の製 品を用いた。 2) 顆粒層細胞の回収および培養 神奈川食肉センターより入手したウシ卵巣より小卵胞を選抜し、21 ゲージの 針を装着した注射筒を用いて卵胞内容物を吸引採取した。この時、由来の異な る少なくとも 3 頭由来の卵巣対を用いた。実体顕微鏡下でパスツールピペット を用いて卵胞内容物より卵丘卵子複合体を除去し、細胞懸濁液を得た。得られ た細胞懸濁液を40μm のナイロンンメッシュ(BD Falcon, Bedford, MA, USA) に通し、挟雑物を除去した後、1 分間遠心分離(200 × G)を行い、細胞を洗浄し た。洗浄後、Accumax (Innovative Cell Technologies、San Diego、CA、USA) を用いて単一細胞化し、再度、上述のように 3 回洗浄した。洗浄後、培養液 (TCM-199、1mM タウリン、100IU/ml ペニシリン、0.1μg/ml ストレプトマ イシン、50μg/ml ゲンタマイシン、5%ウシ胎児血清)で再懸濁し、細胞濃度を 5.0 × 105cell/ml に調整し、低酸素培養区(38.5℃、5%O2、5%CO2、90%N2)と高 酸素培養区(38.5℃、5%CO2、95%Air)の 2 区に分け 24 時間培養を行った。ま た VEGF に対する中和抗体試験では rabbit anti-VEGF antibody (2μg/ml、 Santa Cruz Biotechnologies、Heidelberg、Germany)を培養液中に添加し、低 酸素環境下で培養を行った。またその際、IgG コントロールとして rabbit anti-p38 antibody(2μg/ml、Santa Cruz)を用いた。
22
3) 網羅的遺伝子解析
異なる由来の12 対の卵巣より得た顆粒層細胞を低酸素および高酸素区に分け それぞれ4-well dish(Thermo Fisher Scientific)にて 2.5× 105cell /well で 24 時 間培養した後、PBS で 3 回洗浄し、前章と同様に RNA を回収した。回収した RNA は前章と同様に cDNA ライブラリーを構築し、配列決定を行った。マッピ ングはウシゲノム配列(UMD3)に対して行い、各遺伝子のリード数を測定した。 得られた解析結果を基に、IPA に実装された Upstream Regulator 機能を用い て低酸素環境下でどのような因子が上流因子として働くのかを検討し、
Activation Z-score ならびに Overlapping P-value を算出した 。また低酸素区 ならびに高酸素区におけるそれぞれの遺伝子発現量はKal’s Z-test を用いて有 意差検定を行った。またHIF-1、解糖、TCA 回路ならびに OXPHOS に関与す る遺伝子群の中で有意に発現量の異なる遺伝子の割合をChi-Squared test を用 いて2試験区間で比較した。比較に用いたHIF1 依存性の遺伝子群は既報より 収集した(Gerber et al., 1997、Wang et al., 2005、Liu et al., 2008、Benita et al., 2009、Chen et al., 2009、Mole et al., 2009、Semenza, 2009、Formenti et al., 2010、 Pescador et al., 2010、Wyatt et al., 2010、Tello et al., 2011、Liu et al., 2012、Mylonis et al., 2012、Takubo et al., 2013、Kimura et al., 2015)。また 解糖、ETC(電子伝達系)および TCA 回路に関与する遺伝子群はウシのゲノムデ ータベースより収集した(KEGG Map No. 00010、00190、00020)。
4) Pimonidazole 染色
酸素濃度が1.4%(10mmHg pO2)未満の時、タンパクに共有結合する
Pimonidazole (Hypoxyprobe; HPI、Burlington、MA、USA) を用いて、培養 環境の違いが顆粒層細胞に低酸素誘導を惹起するかどうかを検討した。顆粒層
23
細胞を4-well dish (Thermo Fisher Scientific)に 2.5× 105cell/well になるように 播種し、24 時間培養した。Pimonidazole の検出は同梱の取扱説明書に従い行い、 免疫染色を行い、蛍光顕微鏡下で観察した。
5) Mitochondrial mass
8-well chamber スライド(Thermo Fisher Scientific)上で 24 時間培養後、 PBS で 3 回洗浄を行い、4%パラフォルムアルデヒドを含む PBS で 15 分間固定 処理を行い、再度PBS で 3 回洗浄した。洗浄後、0.25%Triton X-100 を含む PBS を用いて30 分間透過処理を行った。PBS で 3 回洗浄した後、5%BSA を含む PBS 中にて 1 時間ブロッキング処理を行った。ブロッキング後、rabbit anti-mitochondrial import receptor subunit TOM20 homolog (TOM20)
(Santa Cruz)を含む 5%BSA-PBS を用いて 200 倍に希釈し、1 次抗体処理を 4℃、 overnight で行った。1 次抗体処理後、goat anti-rabbit IgG fluorescein
conjugate(Merck Millipore、Billerica、MA、USA)を用いて 2 次抗体処理を行 い、Hoechst33342 (1.0μg/ml; Sigma-Aldrich、St Louis、MO、USA)を用い、 核に対して対比染色を行った。画像はLAS AF を取り付けた Leica DMI 6000B (Leica、Wetzlar、Germany)を用いて撮影し、1 つの細胞に占める TOM20 の蛍 光を測定し、Mitochondrial mass を求めた。またこの実験は異なる由来の顆粒 層細胞を用いて3 回繰り返した。
6) 細胞増殖活性
顆粒層細胞を96-well プレート(BD Falcon)に 1.0 × 104cell /well で播種し、 低酸素区ならびに高酸素区でそれぞれ24 時間培養した。増殖活性は Cell Proliferation ELISA, BrdU kit (Roche、Basel、Switzerland)を用いて同梱の取
24
り扱い説明書に従って、解析した。またこの実験は7 回繰り返した。
7) ATP 量
顆粒層細胞を低酸素および高酸素区に分け、それぞれ4-well dish(2.5× 105cell /well)中で 24 時間培養した後、PBS で 3 回洗浄した。洗浄後、Accumax を用い て細胞を剥離し、細胞濃度および生存細胞数をトリパンブルー染色にて測定し た。ATP 量は細胞の ATP 測定試薬(TOYO B-Net、Tokyo、Japan)を用いて、 同梱の取扱説明書に従い、測定した。またATP 依存性ルシフェリン-ルシフェラ ーゼ反応による発光はルミノメーターを用いて検出した。また得られたATP 量 は生存している1.0 × 104cell あたりの値に変換した。またこの実験は異なる由 来の顆粒層細胞を用いて3 回繰り返した。 8) ミトコンドリア膜電位活性 ミトコンドリアの膜電位活性(MMP)の測定には MMP 依存的および MMP 非 依存的にミトコンドリアを染色するMitoTracker Orange および MitoTracker Green FM (Thermo Fisher Scientific)を用いた。顆粒層細胞を低酸素および高 酸素区に分け、それぞれ4-well dish(Thermo Fisher Scientific; 2.5× 105cell /well)中で 24 時間培養した後、培養液で 3 回洗浄した。洗浄後 Hoechst 33342(0.5μg/ml)および 0.5μM の MitoTracker Green FM (膜電位非依存性 Thermo Fisher Scientific) および MitoTracker Orange(膜電位依存性
Thermo Fisher Scientific)を含む培養液中にて 30 分間インキュベートし、3 回 培養液で洗浄した後、蛍光顕微鏡下でそれぞれの蛍光を200 倍で撮影した。60 個の細胞を無作為に選抜し、Image J software (NIH、Bethesda、MD、USA) を用いてMitoTracker Orange および MitoTracker Green FM の蛍光輝度をそ
25
れぞれ測定した。MitoTracker Orange の蛍光輝度を MitoTracker Green FM の 蛍光輝度で除することで細胞あたりのMMP を計算した。またこの実験は 3 回 繰り返した。 9)ミトコンドリア DNA コピー数の測定 採取直後ならびに低酸素区および高酸素区で24 時間培養した顆粒層細胞を P BS で 3 回洗浄した。洗浄後 DNA 抽出液(20mM Tris-aminomethane、0.4 mg /ml protenase K、0.9% Nonidet-P40、0.9%Tween 20)を 50μl 加え 55℃で 3 0 分間、98℃で 10 分間加温し DNA を抽出した。抽出した DNA をテンプレー トにNADH: ubiquinone oxidoreductase core subunit 5 (ND5)および Interl eukin-13 (IL-13)のコピー数をリアルタイム PCR にてそれぞれ定量した(ND5; Forward: ATTTACAGCAATATGCGCCC、Reverse: AAAAGGCGTGGGTAC AGATG、IL-13; Forward: CCCTTACTGGTTGTGGCACT、Reverse: CTTC AGTGTTCCCGAGCTTC)。PCR 反応は First denaturation を 95℃で 3 分間 行った後、それに続くDenaturation ステップ(95℃、2 秒間)と Annealing およ びExtension ステップ(55℃、11 秒間)の 35 サイクルで行った。サーマルサイ クラーはCFX Connect Real-Time PCR Detection System(Bio-Rad)を用い て行った。ミトコンドリア特異的な配列であるND5 のコピー数を 1 コピー遺伝 子であるIL-13 のコピー数の 2 倍で除することにより細胞あたりのミトコンド リアDNA コピー数を求めた。またこの実験は 3 回繰り返した。
10) グルコース消費量
顆粒層細胞を低酸素および高酸素区に分け、それぞれ4-well dish(2.5× 105cell /well)中で 24 時間培養した。培養後の培養液 500µl を採取し、遠心分離(15000 ×
26
G)を行い、挟雑物を除去し、上清を回収し測定まで-20℃で保存した。また残っ た顆粒層細胞は後述のウェスタンブロッティングに供した。培養液中のグルコ ース消費量はGlucose assay kit (Biovision、Mountain View、CA、USA)を用 い、取扱説明書に従い測定した。測定されたグルコース消費量は細胞のタンパ ク濃度で除す事で標準化した。またこの実験は5 回繰り返した。
11) フォスフォフルクトキナーゼ活性
顆粒層細胞を低酸素および高酸素区に分け、それぞれ4-well dish(2.5× 105cell /well)中で 24 時間培養した後、PBS で 3 回洗浄した。洗浄後、PFK activity colorimetric assay kit (Biovision)を用いて、取扱説明書に従い測定した。また この実験は5 回繰り返した。
12) ウェスタンブロッティング
培養後の顆粒層細胞は氷上にて、冷PBS(-)にて 3 回洗浄した。洗浄後、プ ロテアーゼインヒビター(Complete protease inhibitor cocktail; 1 錠/10ml, Roche)およびホスファターゼインヒビター(PhosSTOP; 1 錠/10ml、Roche)を含 む50µl のタンパク抽出液(Complete Lysis-M; Roche)を加え、氷上にて 10 分間 静置し、タンパクを抽出した。タンパク抽出液は超音波発生装置(TOMY sonicator UD-100; TOMY、Tokyo、Japan)を用いて音波破砕し、20 分間遠心 分離(15000 × G)を行い、上清を回収した。タンパク濃度は BCA protein assay kit (Thermo Fishers Scientific)を用いて測定した。回収したタンパクは-80℃で 測定まで保存した。得られたタンパクはβ-メルカプトエタノールを含む
Laemmli Buffer(Bio-Rad)を用いて1レーンあたり 10µg に調整し、95℃で 5 分 間処理した。タンパクはSDS-PAGE にて分画し、Trans-Blot Turbo Transfer System(Bio-Rad)を用いて PVDF 膜(Transfer-Blot Turbo Mini Transfer Packs;
27 Bio-Rad)に転写した。転写後、PVDF 膜を TBS-T(pH7.2)中にて、振盪させなが ら5 分間洗浄した。また洗浄は3回行った。洗浄後、イムノブロック(DS Pharma Bio Medical、Osaka、Japan)を用いて1時間ブロッキング処理を行った。TBS-T (pH7.2)を用いて 3 回洗浄を行った後、PVDF 膜を抗体溶液とともにハイブリパ ック内に封入し、1 次抗体処理を overnight (4℃)で行った。標的タンパクおよ び希釈溶液、希釈倍率はTable 4 に示した。1 次抗体処理終了後、TBS-T にて 3 回洗浄を行い、PVDF 膜を再度ハイブリパックに封入した後、1 次抗体の宿主に 対する2 次抗体処理を 1 時間室温にて行った。2 次抗体は 1 次抗体の宿主に応 じて(Table 4)、Horseradish peroxidase conjugated anti-mouse もしくは anti-rabbit 抗体を用いた。また 1 次抗体処理に Signal Booster A を用いた標的 タンパクの2 次抗体の希釈液は Signal Booster B を用い、TBS-T を用いたもの にはTBS-T(pH7.2)を引き続き希釈液として用いた。2 次抗体処理後、TBS-T (pH7.2)にて 3 回洗浄を行い、Western Blot Quant HRP substrate (GE Healthcare, Little Chalfont, UK)を用いて 5 分間発色反応を行い、ImageQuant LAS 4000 Biomolecular Imager (GE Healthcare)を用いて特異的バンドを 検出した。検出した特異的バンドの輝度はImageQuant software (GE
Healthcare)を用いて定量した。標的タンパク量の輝度はそれぞれのサンプルの β-ACTIN の輝度を用いて補正した。またリン酸化タンパク量は非リン酸化タン パク量の輝度を用いて標準化した。またウェスタンブロットは3 回繰り返した。
13) 統計解析
網羅的遺伝子解析における遺伝子発現量はFalse Discovery Rate test および Kal’s Z-test を用いて、有意差検定を行った。また解糖、ETC、TCA 回路およ びHIF1 に関与する遺伝子群における低酸素区および高酸素区の比較には
28 Chi-squared test を行い検討した。上述の遺伝子解析を除き、各実験で得られ た値は高酸素区を1とした時の相対値に変換し、統計処理を行った。ミトコン ドリアDNA コピー数においては、1 元配置分散分析に続く Fisher’s LSD を用 いて有意差検定を行った。またその他の実験においては低酸素区および高酸素 区間の有意差をStudent’s t-test を用いて検討した。
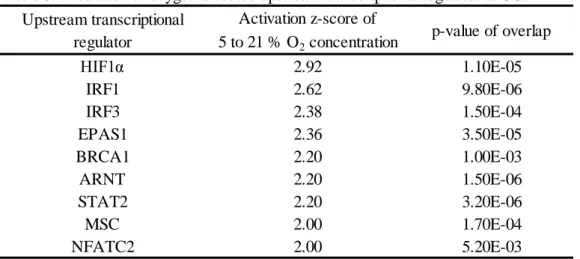
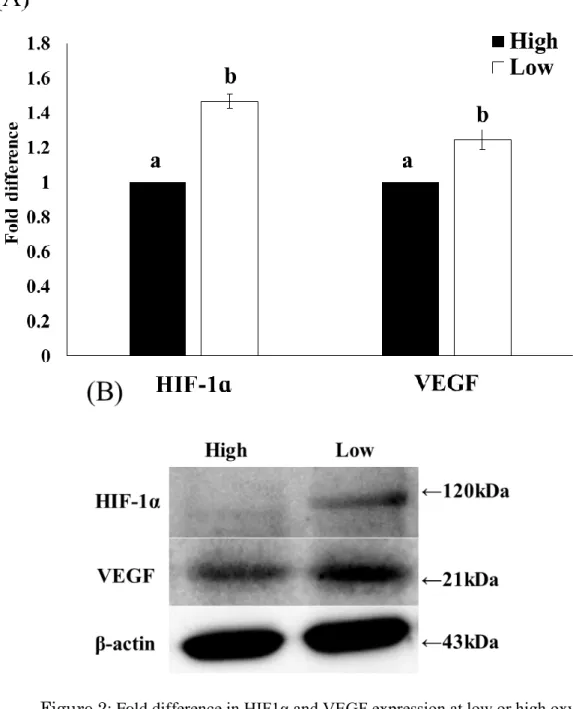
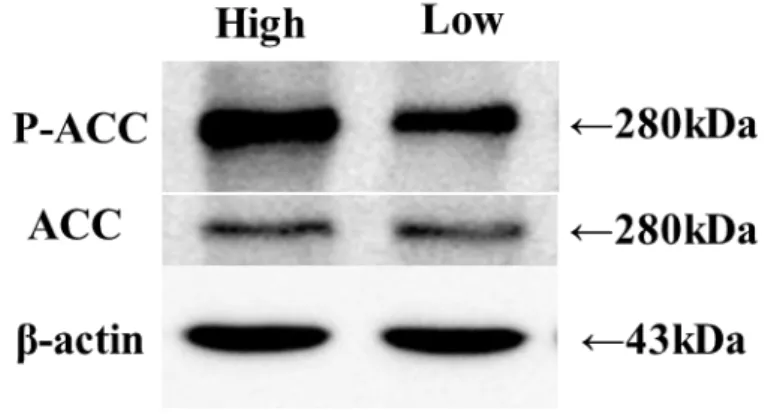
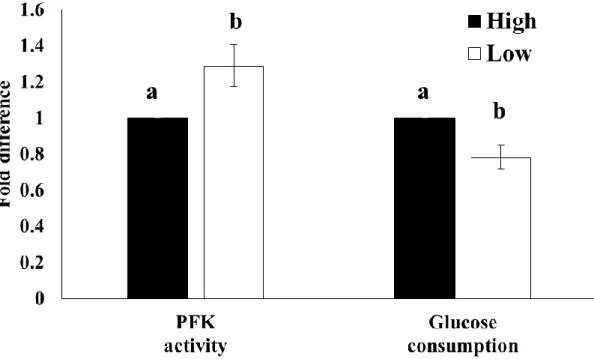
29 第三節 結果 低酸素区ならびに高酸素区におけるPimonidazole に対する免疫染色の結果 をFigure 1 に示した。低酸素区では高酸素区と比較して、強い蛍光が観察され た。また網羅的遺伝子発現解析の結果から、低酸素区で機能する上流転写調節 因子を予測したところ、低酸素応答に関与する因子(HIF1α、EPAS および ARNT)、免疫応答(IRF1、IRF3、STAT2、NFATC2 ならびに MSC)および DNA 正常性の維持に重要なBRCA1 が見出された(Table 5)。この結果を受け、既報 を元にHIF1 により発現が誘導される 140 の遺伝子を選抜し、有意に発現が上 昇していたものの割合を比較したところ、低酸素区において有意に高い値とな った(低酸素区 vs 高酸素区 = 36.4% vs 7.1%、P < 0.05、Table 6)。また HIF1 により発現調節を受ける遺伝子の中からFold change が 1.5 より大きいものを Table 7 に示した。その中には OXPHOS の抑制 (NDUFA4L2、PDK1)、解糖 (LDHA、ALDOC、PFKL)、血管新生(ANGPTL4、VEGFA)が含まれていた。 続いてHIF1 の調節因子である HIF1α および HIF1 の下流因子である VEGF の 発現をウェスタンブロットにて解析した所、低酸素区で有意に高い値を示した (P < 0.05、Figure 2A、B)。 続いて低酸素環境が代謝にどのような影響を与えるかを検討した。網羅的遺 伝子発現解析の結果より解糖、ETC および TCA 回路に関与する因子を選抜し、 それら割合を比較した。TCA 回路に関与する遺伝子群の割合に有意な差は見ら れなかったものの(P > 0.05、Table 6)、解糖関連遺伝子群の割合は有意に上昇し ており(低酸素区 vs 高酸素区 = 65.2% vs 4.4%、P < 0.05、Table 6)、逆に ETC 関連遺伝子群の割合は有意に低下していた(低酸素区 vs 高酸素区 = 4.6% vs 33.3%、P < 0.05、Table 6)。続いてミトコンドリア量の指標としてミトコンド
30
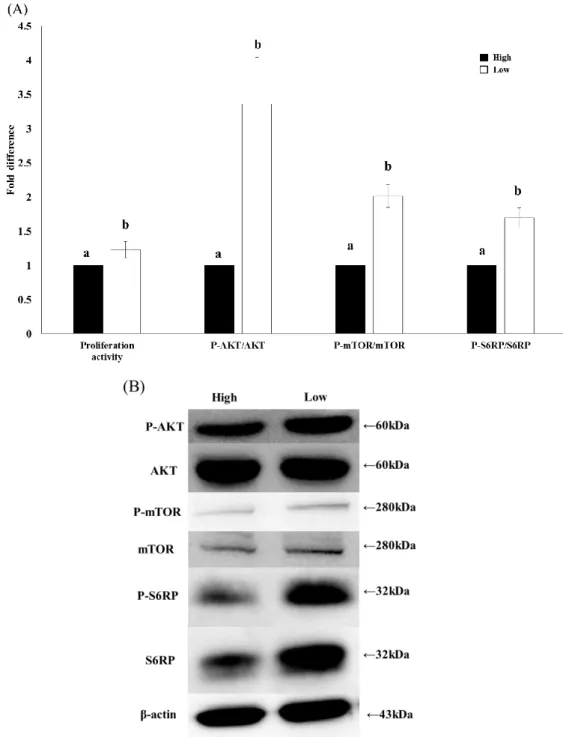
リアDNA コピー数および Mitochondrial mass を計測し、ミトコンドリアの質 の指標として、MMP、ATP 量およびリン酸化 ACC の相対値を計測した。 Mitochondrial mass、MMP および ATP 量は低酸素区で有意に低い値となった (P < 0.05、Figure 3A、C、D)。β 酸化の指標であるリン酸化 ACC 量はウェス タンブロットにより計測し、非リン酸化ACC 量で補正したところ、低酸素区で 有意に低い値を示した(P < 0.05、Figure 3A、E)。また採取直後、および培養後 に計測したミトコンドリアDNA コピー数の平均値は 246.5±12.1 であり、コピ ー数の幅は180.4 から 310.9 であった。ミトコンドリア DNA のコピー数は高酸 素区で有意に高い値を示したが(P < 0.05、Figure 3B)、低酸素区と採取直後の 間には有意な差は見られなかった(P > 0.05、Figure 3B)。また糖代謝の指標と して解糖の律速酵素であるPFK 活性およびグルコース消費量を測定した。PFK 活性ならびにグルコース消費量は低酸素環境下で有意に増加し(P < 0.05、 Figure 4)。 低酸素環境下で顆粒層細胞の増殖がどのように変化するのかを、増殖活性な らびにAKT、mTOR および S6RP に対するリン酸化レベルを解析することで評 価した。結果としてBrdU の取り込みは低酸素区で有意に高く(P < 0.05、Figure 5A)、また AKT、mTOR ならびに S6RP も有意に高い値となった(P < 0.05、 Figure 5A、B)。 また中和抗体を用い、低酸素環境下における顆粒層細胞の増殖にVEGF がど のように関与するかを、増殖活性ならびにAKT ならびに mTOR のリン酸化レ ベルを解析することで検討した。BrdU の取り込みは anti-VEGF 抗体添加区で 有意に低くなり(Figure 6A)、またリン酸化 AKT ならびに mTOR の相対値も有 意に低くなった(P < 0.05、Figure 6A、B)
31 第四節 考察 本章では低酸素環境が顆粒層細胞の代謝と増殖能に与える影響について、分 子生物学的な手法を用いて検討した。その結果、低酸素環境は顆粒層細胞に低 酸素誘導を引き起こし、HIF1 の安定性を増加させ、HIF1 の制御を受ける下流 の遺伝子発現を増加させる事が示された。また低酸素環境は解糖能を亢進させ、 逆にミトコンドリアでの代謝を低下させることが示された。一方、低酸素環境 下ではHIF1 により発現制御を受ける VEGF が mRNA およびタンパクレベル で増加し、顆粒層細胞の増殖を促す事がわかった。
顆粒層細胞の増殖が行われる卵胞内の酸素濃度は低酸素環境である事が報告 されている(van Blerkom et al., 1997)。本研究において、5%の酸素濃度は顆粒 層細胞自体に低酸素誘導を引き起こすのに十分である事が示された(Figure 1)。 網羅的遺伝子発現解析の結果を基に、低酸素環境がOXPHOS や解糖関連の遺伝 子群にどのような変化を与えるかを解析した所、ETC 関連遺伝子群の発現を低 下させ、逆に解糖に関与する遺伝子群の発現を増加させることがわかった(Table 6)。また低酸素誘導は顆粒層細胞のミトコンドリア量や機能を低下させる一方で、 解糖能を増加させた(Figure 3、4)。一方、低酸素誘導は HIF1 関連遺伝子群の 発現を上昇させ(Table 6)、その中にはミトコンドリアの代謝能の抑制に関わる PDK1 や NDUF4L2 が含まれていた(Table 7)。PDK1 は PDH をリン酸化する 事により、ピルビン酸からアセチルCoA への変換を阻害し、TCA 回路へのエネ ルギー基質の動員を抑制する(Kim et al.,2006)。また NDUF4L2 は ETC におけ るComplex1 の機能を阻害することが知られている(Tello et al.,2011)。低酸素 環境における、これらのミトコンドリアの機能を抑制する遺伝子発現の上昇に は、HIF1α の発現量が増加したことが原因として考えられる(Figure 2A、B)。
32 HIF1 の転写活性は、制御因子である HIF1α の安定性に依存しており、これは 活性化に酸素を必要とする水酸化酵素の働きにより支配されている。そのため 低酸素環境下ではHIF1 の安定化とそれに伴うミトコンドリアの代謝抑制に関 与するPDK1 や NDUF4L2 などの発現上昇を介して、ミトコンドリアの機能を 抑制したものと考えられる。 また低酸素誘導は解糖関連遺伝子の発現上昇を伴いながら(Table 6、7)、PFK の活性やグルコース消費量を増加させた (Figure 4)。低酸素区でのPFKL の発 現量は高酸素区と比較して1.70 倍であり、グルコースの供与体であるSLC2A3 の発現量は2.59 倍であった(Table 7)。グルコース供与体は細胞膜表面に局在し ており、細胞内へのグルコースの取り込みに重要な役割を担う。ウシの顆粒層 細胞ではHIF1 により発現制御を受けるSLC2A1 (GLUT1)および
SLC2A3(GLUT3)の発現は小卵胞から大卵胞までの顆粒層細胞において主要に 発現しているグルコース供与体である事が報告されている(Nishimoto et al., 2006)。また Frucutose-6-phosphate から Fructose-1,6-bisphosphate への変換 を触媒するPFK は解糖の律速酵素であり、3 つのアイソフォームを持つが、い ずれのアイソフォーム(PFKL、PFKM、PFKP)も低酸素区で有意に発現が上昇 していた。これらのことより低酸素刺激はHIF1 の安定化を誘導し、HIF1 依存 性の解糖系構成遺伝子の発現およびグルコース供与体の発現を上昇させ、結果 として解糖能を亢進させる可能性が示された。 また本章では低酸素環境において、顆粒層細胞の増殖能がどのように変化す るのかを検討した。低酸素誘導は顆粒層細胞のAKT、mTOR および S6RP を活 性化させ、増殖活性を増加させた(Figure 5)。胚性幹細胞、胎盤や血管細胞など において5%の酸素濃度は増殖活性を増加させることが報告されており(Humar et al., 2002、Forristal et al., 2010、Shirasuna et al.,2015)、Gook ら(2014)は
33
5%の低酸素環境はマウスの体外発育卵胞の成長を促進させる事を報告している。 またウシおいてゴナドトロピンやインスリン様成長因子はPI3K-AKT 経路を活 性化させ、顆粒層細胞を増殖させることが報告されている(Mani et al.,2010)。 またマウスにおいて、mTOR の活性化が卵胞発育および顆粒層細胞の増殖を亢 進する事が報告されている(Yu et al., 2011)。一方で、VEGF はウシやブタ顆粒 層細胞の増殖活性を増加させることが報告されている(Doyle et al., 2010、 Grasselli et al.,2002)。またラット顆粒層細胞において VEGF は AKT を活性化 させ、増殖活性を亢進させることが報告されている(Irusta et al., 2010)。VEGF 欠損マウスでは卵胞の腔形成ならびに黄体形成が起こらないことが報告されて いる(Rico et al., 2014)。本検討において、低酸素誘導は VEGF の発現を上昇さ せ(Table 7、Figure 1)、AKT-mTOR-S6RP の活性化を伴って増殖活性を亢進さ せた(Figure 5)。また低酸素環境下で中和抗体を用いて VEGF の働きを阻害す ると、増殖活性およびAKT-mTOR の活性が低下した(Figure 6)。その事から低 酸素環境により引き起こされたHIF1 依存的な VEGF 発現の亢進が AKT-mTOR-S6RP を活性化させ、結果として顆粒層細胞の増殖を促す可能性が 示された。 次章では、代謝と増殖を共通して制御する因子が低酸素環境下においてどの ような役割を持つかについて検討する。
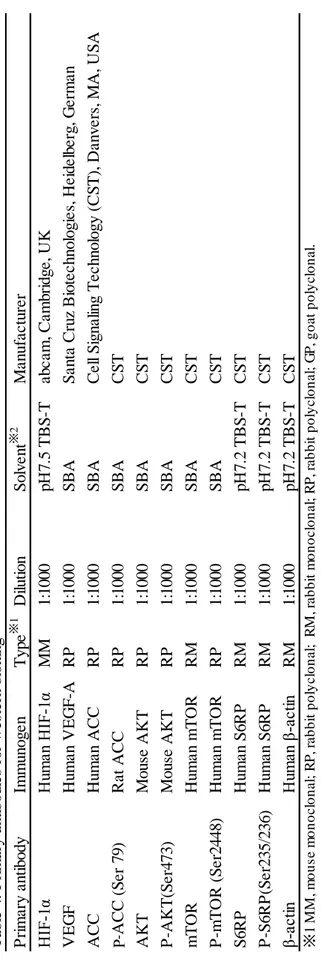
34 P ri m a ry a n ti b o d y Im m u n o g e n T y p e ※ 1 D ilu ti o n S o lv e n t ※ 2 M a n u fa c tu re r H IF -1 α H um an H IF -1 α MM 1 :1 0 0 0 p H 7 .5 T BS -T a b c a m , Ca m b ri d g e , U K V E G F H u m a n V E G F -A RP 1 :1 0 0 0 S BA S a n ta Cru z Bi o te c h n o lo g ie s, H e id e lb e rg , G e rm a n A CC H u m a n A CC RP 1 :1 0 0 0 S BA Ce ll S ig n a lin g T e c h n o lo g y (CS T ), D a n v e rs , M A , U S A p -A CC (S e r 7 9 ) Ra t A CC RP 1 :1 0 0 0 S BA CS T AKT M o u se A K T RP 1 :1 0 0 0 S BA CS T P -A K T (S e r4 7 3 ) M o u se A K T RP 1 :1 0 0 0 S BA CS T m T O R H u m a n m T O R RM 1 :1 0 0 0 S BA CS T P -m T O R (S e r2 4 4 8 ) H u m a n m T O R RP 1 :1 0 0 0 S BA CS T S 6 RP H u m a n S 6 RP RM 1 :1 0 0 0 p H 7 .2 T BS -T CS T P -S 6 RP (S e r2 3 5 /2 3 6 ) H u m a n S 6 RP RM 1 :1 0 0 0 p H 7 .2 T BS -T CS T β-a ct in H um an β -a ct in RM 1 :1 0 0 0 p H 7 .2 T BS -T CS T ※ 1 M M , m o u s e m o n o c lo n a l; R P , ra b b it p o ly c lo n a l; R M , ra b b it m o n o c lo n a l; R P , ra b b it p o ly c lo n a l; G P , g o a t p o ly c lo n a l. ※ 2 S B A , s ig n a l b o o s te r A ; S B B , s ig n a l b o o s te r B ( B e a c le I n c , K y o to , Ja p a n ). T a b le 4 . P ri m a ry a n ti b o d ie s fo r w e st e rn b lo tt in g P
35 Activation z-score of 5 to 21 % O2 concentration HIF1α 2.92 1.10E-05 IRF1 2.62 9.80E-06 IRF3 2.38 1.50E-04 EPAS1 2.36 3.50E-05 BRCA1 2.20 1.00E-03 ARNT 2.20 1.50E-06 STAT2 2.20 3.20E-06 MSC 2.00 1.70E-04 NFATC2 2.00 5.20E-03
Table 5. Prediction of oxygen affected upstream transcriptional regulator in GCs Upstream transcriptional
36
T
a
b
le
6
.
T
h
e
e
ffe
c
t
o
f
o
x
y
g
e
n
t
e
n
si
o
n
o
n
m
e
ta
b
o
lis
m
a
n
d
H
IF
1
re
la
te
d
g
e
n
e
e
x
p
re
ss
io
n
T
o
ta
l
N
o
.
o
f
re
la
te
d
g
e
n
e
P
e
rc
e
n
ta
g
e
o
f
u
p
-re
g
u
la
te
d
g
e
n
e
s
u
n
d
e
r
5
%
O
2t
e
n
si
o
n
(N
o
.
o
f
g
e
n
e
s)
P
e
rc
e
n
ta
g
e
.
o
f
u
p
-re
g
u
la
te
d
g
e
n
e
s
u
n
d
e
r
2
1
%
O
2t
e
n
si
o
n
(N
o
.
o
f
g
e
n
e
s)
χ
2-
te
st
P
-v
a
lu
e
H
IF
1
140
3
6
.4
(5
1
)
7
.1
(10
)
3
.E
-0
9
G
ly
c
o
ly
si
s
23
6
5
.2
(1
5
)
4
.4
(1
)
1
.E
-0
5
ETC
132
4
.6
(6
)
3
3
.3
(4
4
)
2
.E
-0
9
T
C
A
c
y
c
le
24
1
2
.5
(3
)
2
5
(6
)
3
.E
-0
1
37 RPKM L/H NDUFA4L2 85.98 10.50 / 0.12 0.00E+00 ANKRD37 14.8 1.09 / 0.07 1.87E-05 SLC16A3 8.55 9.91 / 1.16 0.00E+00 SLC2A3 2.59 23.09 / 8.93 0.00E+00 ANGPTL4 2.1 1.20 / 0.57 1.65E-04 PDK1 2.22 5.61 / 2.53 1.97E-14 LDHA 2.09 185.86 / 89.14 0.00E+00 BNIP3 2.02 44.01 / 21.81 0.00E+00 VEGFA 1.92 7.83 / 4.07 0.00E+00 FAM115C 1.86 0.77 / 0.41 2.72E-03 KRT19 1.84 2.40 / 1.31 1.22E-03 PFKL 1.7 55.95 / 32.99 0.00E+00 NARF 1.63 24.47 / 15.02 0.00E+00 ALDOC 1.6 18.97 / 11.86 0.00E+00 DDIT4 1.53 27.03 / 17.70 0.00E+00
Table 7. HIF-1 regulated gene expression affected by different oxygen levels
Genes Fold change FDR corrected p-value
38
Figure 1: Effect of oxygen levels on cellular hypoxia in GCs
酸素環境の違いが顆粒層細胞に低酸素誘導を引き起こすかどうかについて、低 酸素マーカーである Pimonidazole (Hypoxyprobe)を用いて検討した。低酸素ならび に高酸素区における共有結合した Pimonidazole を免疫染色により検出した。A お よび B はそれぞれ高酸素区および低酸素区における Pimonidazole 陽性の顆粒層細 胞を示しており、C および D は Hoechst33342 染色した核を示す。E および F は上 述の画像を合わせたものである。
39
Figure 2: Fold difference in HIF1α and VEGF expression at low or high oxygen level 酸素環境の違いが顆粒層細胞の HIF1α および VEGF の発現量に及ぼす影響につ いてウェスタンブロッティングを用いて検討した(n=3)。それぞれの発現量は β-actin の発現量を用いて標準化し、高酸素区に対する相対値を算出した。HIF1α および VEGF の相対発現量を A に示し、B にそれぞれの特異的ブロットを示した。有意差 検定はStudent’s t-test を用いて行い、P < 0.05 を有意差ありとした。異符号間に有意 差あり(a、b)。
42
Figure 3: Effects of oxygen level on mitochondrial quantity and activity
酸素環境の違いが顆粒層細胞の Mitochondrial mass、ATP 量、MMP、リン酸化 ACC レベルならびにミトコンドリア DNA コピー数に与える影響について検討した。 Mitochondrial mass は細胞に占める TOM20 の蛍光輝度を求める事で測定し (A、C) 、ATP 量は ATP 依存的なルシフェリン-ルシフェラーゼ反応による発光をルミノメ ーターにより検出することで求めた(n=3、A)。また MMP は MitoTracker Green に対 する MitoTracker Orange の蛍光輝度を測定する事で求めた(A、D)。またリン酸化 ACC および非リン酸化 ACC はウェスタンブロッティングにより検出し、 β-actin を用いて標準化した。非リン酸化 ACC 量をリン酸化 ACC 量で除することにより、 ACC のリン酸化レベルを算出した(n=3、A、E)。また培養前、低酸素区ならびに高 酸素区で培養した顆粒層細胞から DNA を抽出し、ミトコンドリア DNA コピー数 をリアルタイム PCR を用いて計測した。得られた値は1コピー遺伝子の発現量を 用いて標準化した(n=4、A)。有意差検定は Student’s t-test もしくは 1 元配置分散分 析を用いて行い、P < 0.05 を有意差ありとした。異符号間に有意差あり(a、b、c)。
43
Figure 4: Effect of oxygen levels on PFK activity and glucose consumption of GCs
酸素環境の違いが顆粒層細胞の PFK 活性およびグルコース消費量に及ぼす影 響について検討した(n=5)。PFK 活性は PFK activity colorimetric kit (Biovision)を用 いて測定し、グルコース消費量は glucose assay kit (Biovision)を用いて測定した。
統計解析はStudetnt’s t-test を用い、P < 0.05 を有意差ありとした。異符号間に有
44
Figure 5: Effect of oxygen levels on GC proliferation
酸素環境の違いが顆粒層細胞の増殖能に及ぼす影響について、増殖活性およびウ ェスタンブロッティングにより解析した。増殖活性は Cell proliferation ELISA, BrdU kit (Roche)を用いて測定し(n=7)、AKT、mTOR ならびに S6RP のリン酸化レベルは β-actin 量で補正した後、リン酸化タンパクを非リン酸化タンパク量で除することに より求めた(n=3)。また統計解析は Studetnt’s t-test を用い、P < 0.05 を有意差ありと した。異符号間に有意差あり(a、b)。
45
Figure 6: Effect of VEGF neutralization under low oxygen level
低酸素環境下における VEGF の細胞増殖に与える役割について、VEGF に対す
る中和抗体を用いて検討した。BrdU 取り込み量はCell proliferation ELISA, BrdU
kit (Roche)を用いて測定し(n=7)、AKT、mTOR ならびに S6RP のリン酸化レベル
はβ-actin 量で補正した後、リン酸化タンパクを非リン酸化タンパク量で除するこ
とにより求めた(n=3)。また統計解析は Studetnt’s t-test を用い、P < 0.05 を有意差 ありとした。異符号間に有意差あり(a、b)。
46
第四章 SIRT1 が低酸素環境におけるウシ顆粒層細胞の 代謝と増殖に与える影響
第一節
前章において低酸素環境は顆粒層細胞の好気代謝を抑制し、解糖能を亢進す ることが示された。ミトコンドリアではTCA 回路で発生した NADH を ETC で 酸化することによりMMP 形成に必要なプロトンを生成する。ミトコンドリア は膜管腔に生じたプロトン勾配を利用してATP 合成酵素を働かせ、ATP を合成 する。この時生じるNAD や NADH は様々な酸化還元反応を触媒する補酵素と して働く。またNADH は解糖の報酬期に産生され、TCA 回路に入る事でミト コンドリアにおけるATP 産生に寄与する。しかしながら低酸素環境下では解糖 が亢進し、TCA 回路を抑制するPDK1 や Complex1 の働きを阻害する NDUFA4L2 の発現が亢進しており、実際に MMP や ATP 量は低下していた。 この事から低酸素環境下では顆粒層細胞のミトコンドリアにおけるNADH 消費 が抑制される一方で、NADH の供給源である解糖活性が増加しているため NADH 供給過多の状態に陥り、その結果として顆粒層細胞の NAD+/NADH 比 に不均衡が生じているものと考えられる。この結果を裏付ける報告として Santidrian ら(2013)はがん細胞において Complex1 の働きを亢進させると、 NAD+/NADH 比が向上し、さらに低酸素環境下では NAD+/NADH 比が低下す る事を示している。 一方、このNAD+/NADH のバランスに応じて機能する分子として SIRT1 が 挙げられる。SIRT1 は NAD+依存的に働くクラスⅢ脱アセチル化酵素であり、 ミトコンドリアの生合成やOXPHOS の強力な調節因子として働く(Price et al.,