熊本大学学位論文
α 1 -酸性糖蛋白質の生理作用と動態特性に関する研究
2003 松元 一明
Study of the biological activities and pharmacokinetic properties of α 1 - acid glycoprotein
Kazuaki Matsumoto
Study of the biological activities and pharmacokinetic properties of
1
-acid glycoprotein
Kazuaki Matsumoto α
1-Acid glycoprotein (AGP) is an acute phase protein that is synthesized largely by the liver. AGP serum concentrations that remain stable under physiological conditions (about 0.5-1.0 g/L) increase several-fold during inflammation, burn or infection. The expression of AGP is controlled by a combination of major regulatory mediators, i.e. glucocorticoids and a cytokine network involving mainly interleukin-1, tumour necrosis factor-α and interleukin-6. AGP is synthesized not only by the liver but also by monocytes, lymphocytes and endothlial cells related to infammatory reaction.
Fluorescence microscopy studies indicate that AGP is present at an inflammatory site. Therefore, AGP may, to some extent, be involved in the inflammatory process. However, its exact biological function and mechanism of action remain obscure. Detailed information on its anti-inflammatory effect and the effect of AGP on blood rheology would be useful in elucidating the role of acute phase proteins that are produced of an accelerated rate in body during acute phase response. In addition, a study of the process at the active region is important in understanding of the above-mentioned role. An analysis of the pharmacokinetics of AGP would be desirable in elucidating the mechanism of action of AGP including its anti-inflammatory activity and ligand transport.
We report here a pharmacokinetics including the drug binding characteristics, an anti-inflammatory effect and an effect of AGP on blood rheology.
The results of this work can be summarized as follows.
1) AGP, asialo-AGP and agalacto-AGP disappeared through receptors in liver parenchymal cells.
Carbohydrate modified AGP (asialo-AGP and agalacto-AGP) was eliminated more rapidly than AGP. The liver clearance of modified AGP was large compared with AGP itself. The issue of whether the three types of AGP were mutually competitive or not was investigated through coadministration experiments. AGP did not compete with asialo-AGP, but, interestingly agalacto-AGP competed with both AGP and asialo-AGP, respectively. These results suggest that AGP shares the low affinity receptor for agalacto-AGP, and the asialoglycoprotein receptor which recognizes asialo-AGP, acts as a high affinity receptor for agalacto-AGP. Therefore, we propose two elimination routes for AGP. a) AGP is converted to asialo-AGP by sialidase, and is then taken up by the asialoglycoprotein receptor. b) AGP is directly taken up the liver through the receptor.
2) AGP and asialo-AGP suppressed carrageenan, dextran or kaolin induced paw oedema and
vascular permeability. AGP inhibited the chemotatic response of neutrophils to
N-formyl-methionyl-leucyl-phenylalanine (fMLP) and superoxide anion generation in response to
fMLP and phorbol 12-myristate 13-acetate. AGP also suppressed cyclooxygenase activity.
Moreover, sialic acid, a component of AGP, suppressed carrageenan (after 3 hours), or kaolin induced paw oedema and vascular permeability. Sialic acid also inhibited the chemotactic response of neutrophils to fMLP and cyclooxygenase activity. We conclude that AGP might exert its own activity in the form of intact AGP in the body in view of the fact that asialo-AGP and sialic acid rapidly disappeared from blood.
3) AGP facilitated the passage time of human erythrocytes through a 5 µm wide microchannel;
hemolysis was suppressed after the passage. AGP prevented hemolysis induced by a hypotonic phosphate buffer solution. AGP protected erythrocytes from H
2O
2and prevented the oxidation of dihydrorhodamine 123 to rhodamine 123 from H
2O
2. These results suggest that AGP facilitates the passage of erythrocytes through capillaries, stabilizes erythrocyte membranes and protects against oxidative stress. Meanwhile, the effects of AGP on erythrocytes might not be a function of the negative charge associated with sialyl residues.
AGP showed a vasodilative action by means of interaction with the lectin-like domain expressed at the surface of vascular smooth muscle cells in a Ca
2+-dependent manner. It is more likely that the AGP-induced vasodilation was due to the blocking of Ca
2+entry through inositol triphosphate-dependent Ca
2+release, nonselective cation channels or voltage-dependent Ca
2+channels.
4) Using a model analysis of the interaction, the ligand binding site on human AGP consists of at least 3 partially overlapping subsites: a basic ligand binding site, an acidic ligand binding site and a steroid hormone binding site. Moreover,dog and bovine AGPs each have a basic ligand binding site and a steroid hormone binding site, which significantly overlap and affect one another. However, dog and bovine AGPs do not contain an acidic ligand binding region. The results obtained herein clearly indicate the existence of species differences in terms of drug binding properties.
In conclusion, an increase in the AGP content of serum found under pathological conditions may suppress inflammation induced by autacoids and neutrophil activities and improve blood rheology, based upon its own activity.
The data presented here will be useful in terms of understanding the role of acute phase proteins that
are produced of an accelerated rate during acute phase response.
本論文で使用した略語一覧表
AC
アセノクマリンAcenocoumarin ACh
アセチルコリンAcetylcholine
AGP
α1-酸性糖蛋白質Alpha 1-acid glycoprotein AO
オーラミン OAuramin O
Asn
アスパラギンAsparagine
cAMP
サイクリックアデノシンCyclic adenosine 3', 5'-monophosphate
3 ,5 - 1 リン酸cGMP
サイクリックグアノシンCyclic guanosine 3', 5'-monophosphate
3 ,5 - 1 リン酸CL
liver 肝クリアランスHepatic clearance
CPZ
クロルプロマジンChlorpromazine
DRD
ジヒドロローダミン 123Dihydrorhodamine 123
fMLP
N-ホルミルメチオニルロN-Formyl-methionyl-leucyl-phenylalanine
イシルフェニルアラニンFuc
フコースFucose
Gal
ガラクトースGalactose
GlcNAc
N-アセチルグルコサミンN-Acetylglucosamine
H
2O
2 過酸化水素hydrogen peroxide HSA
ヒト血清アルブミンHuman serum albumin IL
インターロイキンInterleukin
L-NAME N
G-Nitro-L-arginine methyl ester
Man
マンノースMannose
NO
一酸化窒素Nitric oxide
PBS
等張リン酸緩衝液Phosphate buffered saline PG
プロゲステロンProgesterone
PGE
2 プロスタグランジン E2Prostaglandin E
2Phe
フェニレフリンPhenylephrine
PMA
ホルボールミリステートPhorbol 12-myristate 13-acetate
アセテートRD
ローダミン 123Rhodamine 123
Sia
シアル酸Sialic acid
TNF-α
腫瘍壊死因子αTumor necrosis factor α
本論文は,学術雑誌に記載された次の論文を基礎とするものである.
1) Characterization of ligand binding sites on the alpha 1-acid glycoprotein in humans, bovines and dogs
Drug Metabolism and Pharmacokinetics, 17, 300-306 (2002).
Matsumoto K., Sukimoto K., Nishi K., Maruyama T., Suenaga A. and Otagiri M.
2) Effects of alpha 1-acid glycoprotein on erythrocyte deformability and membrane stabilization Biological & Pharmaceutical Bulletin, 26, 123-126 (2003).
Matsumoto K., Nishi K., Tokutomi Y., Irie T., Suenaga A. and Otagiri M.
3) Effects of alpha 1-acid glycoprotein on isometric tension of mouse aorta Journal of Cardiovascular Pharmacology, submitted for publication.
Tokutomi Y., Tokutomi N., Okamoto K., Matsumoto K., Otagiri M. and Nishi K.
目次
第1章 緒論... 1
第2章 α1-酸性糖蛋白質(AGP)の体内動態特性... 6
第1節 序... 6
第2節 AGP 及び脱糖化 AGP の体内動態... 7
2-1 AGP の体内動態... 7
2-2 アシアロ AGP の体内動態... 8
2-3 アガラクト AGP の体内動態... 8
第 3 節 AGP,アシアロ AGP 及びアガラクト AGP の肝取り込み機構... 10
3-1 AGP,アシアロ AGP 及びアガラクト AGP の取り込み阻害実験... 10
3-2 AGP, アシアロ AGP 及びアガラクト AGP の細胞認識特性... 12
第4節 小括... 14
第3章 AGP の抗炎症効果... 15
第1節 序... 15
第2節 In vivoにおける抗炎症効果... 15
2-1 カラゲニン誘導足蹠浮腫及び血管透過性に対する AGP の影響... 15
2-2 デキストラン誘導足蹠浮腫及び血管透過性に対する AGP の影響... 17
2-3 カオリン誘導足蹠浮腫及び血管透過性に対する AGP の影響... 17
第3節 好中球活性に対する AGP の影響... 19
3-1 N-ホルミルメチオニルロイシルフェニルアラニン(fMLP)刺激による好 中球遊走に対する AGP の影響... 19
3-2 fMLP 及びホルボールミリステートアセテート(PMA)刺激による好中球 スーパーオキシドアニオン産生に対する AGP の影響... 19
第4節 ラット血中におけるプロスタグランジン E2(PGE2)生成に対する AGP の 影響... 21
第5節 小括... 22
第 4 章 AGP の循環系に及ぼす生理作用... 23
第1節 序... 23
第2節 赤血球変形能及び膜安定性に対する影響... 23
2-1 赤血球のマイクロチャンネル通過に対する AGP の影響... 23
2-2 赤血球浸透圧脆弱性試験に対する AGP の影響... 25
2-3 H2O2による赤血球酸化に対する AGP の影響... 25
第3節 マウス血管に対する AGP の弛緩応答... 27
3-1 フェニレフリン誘導収縮に対する AGP の弛緩応答... 27
3-2 AGP による弛緩反応の NO 依存性... 27
3-3 AGP による弛緩反応に及ぼす細胞外カルシウムの影響... 30
3-4 AGP による弛緩反応に及ぼすヘパリンの影響... 31
3-5 高カリウム溶液誘導収縮に対する AGP の弛緩応答... 31
第4節 小括... 33
第5章 AGP の輸送蛋白としての機能評価... 35
第1節 序... 35
第2節 ヒト AGP variant に対する薬物の結合特性... 35
2-1 ヒト AGP variant に対する各種薬物の結合パラメータ... 35
2-2 ヒト AGP variant に結合した蛍光プローブ・オーラミン O に対する各種薬 物の影響... 37
2-3 ヒト AGP に対する薬物の結合様式... 38
第3節 ヒト,イヌ及びウシ AGP 分子上の薬物結合サイトの識別... 40
3-1 各種 AGP に対する薬物の結合パラメータ... 40
3-2 各種 AGP に対する薬物の結合様式... 41
第4節 小括... 43
第6章 総括... 44
実験の部... 47
謝辞... 58
参考文献... 59
第1章 緒論
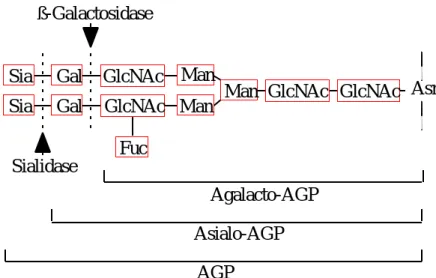
ヒトα1- 酸性糖蛋白質(AGP)は,分子量約 44100 で,183 個のアミノ酸と 5 本の N-結合型糖鎖からなり(Fig. 1),その糖鎖末端にはシアル酸が結合している1-4).し たがって,約 40%の高い糖含量と低い pI 値 2.7 を特徴とする血漿蛋白質である.その アミノ酸配列は,免疫グロブリン,上皮成長因子受容体の細胞外ドメイン及びレチノー ル結合蛋白質と高い相同性が認められている1,5-7).またその糖鎖構造はアスパラギン に N-アセチルグルコサミン,マンノース,N-アセチルグルコサミン,ガラクトース,
シアル酸の順に結合しており,さらに N-アセチルグルコサミンにフコースが結合した シアリルルイス X 型を形成する場合もある(Fig. 2).通常,健常人の AGP1 分子当た り約 60%がフコシル化されている8).
: glycan chain : - S - S - bond Fig. 1 Structure model of human AGP
N 5
147
15
54 164
72 75 85
1
183 C
38
Fig. 2 Oligosaccharide structure of human AGP
Sia : sialic acid Gal : galactose GlcNAc : N-acetylglucosamine Man : mannose Fuc : fucose Asn : asparagine
Asn GlcNAc
GlcNAc Man
Man Man GlcNAc
GlcNAc Gal
Gal Sia
Sia
Fuc
AGP はイヌの摘出肝実験9)やラット肝臓の灌流実験 10)により,肝臓での生合成が明 らかにされ,血中の AGP の大部分は肝臓で作られると考えられている.Weisman11)ら は131I-AGP の turn over から,その半減期を 5 日と報告している.また,その血漿中 濃度は,健常時に 0.5〜1.0 g/L であるが12),炎症,火傷,感染症,腫瘍(癌),心筋 梗塞,妊娠時などに血液及び組織中で 2〜4 倍増加し13,14),フェノバルビタールやリ ファンピシンなどの薬物の反復投与時にも増加する15-18).また,肝硬変や尿毒症では,
合成不全や尿への漏出によって減少する19,20)(Table 1).この AGP の誘導・発現は,
免疫,炎症反応に重要なインターロイキン-1(IL-1),インターロイキン 6(IL-6),
腫瘍壊死因子α(TNF-α)といった炎症性サイトカイン及び糖質コルチコイドにより 制御されていることが報告されている21,22).一方,AGP の消失には糖鎖部分が深く関 与しており,最近まで,AGP は血中でシアリダーゼにより糖鎖末端のシアル酸が除去 され,露出したガラクトースが肝実質細胞に存在するアシアログリコプロテインレセプ ターに取り込まれ,消失すると信じられてきた23).この仮説を実証すべく,石橋らは アシアログリコプロテインレセプターノックアウトマウスを作成し,AGP の血中濃度 推移をノーマルマウスと比較検討したところ,予想に反し両者共にまったく同様な血中 濃度推移を示したことから,著者らは AGP の血中からの消失にはアシアログリコプロ テインレセプター以外の経路が関与している可能性を報告している 24).このように,
AGP の消失経路及び消失部位については未だ明らかにされていない部分も数多く残さ れている.
Table 1 Variation of AGP levels in human serum
0.5-1.0 g/L (Healthy subjects plasma levels) Inflammation
Burn Infection
Cardiac infarction Malignant tumor
Disease AGP levels
Liver cirrhosis Nephrosis
Drug Phenytoin Phenobarbital
Rifampicin Dexamethasone Ethinyl estradiol
Clarithromycin FK506
興味深いことに,AGP は肝臓だけでなく炎症反応に深く関わりのある単球,リンパ 球,血管内皮細胞などでも合成され25)(Table 2),さらに,炎症部位に局在することが 蛍光電顕などで明らかにされている26,27).そのため従来より,AGP は急性炎症中,炎 症性サイトカインにより誘導され,その病巣部位で何らかの働きをしているものと推察
されてきた.現在までに報告されている AGP の生理作用としては,例えば,血小板凝
集抑制28,29),IL-1 レセプターアンタゴニスト誘導30,31),リンパ球増殖抑制32,33),
抗好中球活性,抗補体活性34)などがある.また,最近では白血球と血管内皮細胞の接
Table 2 Extra-hepatic expression of AGP
Organs or cell types
Brain Breast
Breast epithelial cell Uterus
Decidua Lung
Pulmonary fibroblast Pneumocyte Ⅱ Alveolar macropharge Peritoneal macropharge Monocyte
Lymphocyte Granulocyte Endothelial cell
Protein
+
+
+
+
+
+
+
+
+
+
Inducible
Stomach + +
Ileum + +
Prostatic epithelial cell + +
+
+
+
+
+
+
+
+
+ Constitutive
Colon + + +
+
+
−
−
+
+
+
+
−
−+
mRNA
Kidney + − +
Adipose −
Spleen −
Thymus −
Heart + − +
Testis −
Intestinal epithelial cell + +
−
+
+
+
−
+
−+
The expression (+) or the absence of expression (-) of AGP protein and mRNA are described for the extra-hepatic tissues and cell types studied. When the AGP gene expressed, constitutive (basal) or inducible (inflammation, cancer) expression in the corresponding tissue or cell type is indicated.
Fournier et al., Biochim. Biophys. Acta, 1482: 157-171 (2000)
着因子であるセレクチンと高親和性のシアリルルイス X 残基の発現増大が炎症時 AGP で観察されており 35),セレクチンとシアリルルイス X 残基の結合を AGP が阻害する 可能性も見出されている 36).さらに,AGP は微小血管の内皮細胞に結合し,自身の負 電荷を供与することにより 37,38)ポリアニオン高分子量蛋白質の血管透過抑制に関与し ていると考えられている37,39).したがって,急性炎症時に増加した AGP は炎症部位 に局在し,抗炎症及び免疫抑制物質として機能しているかもしれない.
また,急性炎症時には,腫瘍壊死因子などのサイトカインによりもたらされる活性酸 素などによって赤血球膜障害が起こり,異型化した赤血球がマクロファージによる貪食 反応を受けるようになる.なかでも脾臓は特有のフィルター構造が発達しており,停滞 した赤血球に対し代謝的ストレスを与えることと相まって,変形能の低下した赤血球を 高感度に検出して除去し,貧血や組織の低酸素血症を引き起こすことが知られている40,
41).また火傷時では,大量の体液が失われ、浸透圧低下や末梢循環血流量が減少する結 果,末梢組織への酸素供給が不足し,ショック症状を引き起こす。興味深いことに AGP をマウス火傷モデルに投与すると,メカニズムは不明ながら炎症の緩解がみられ ることが報告されている42).また,in vitro実験ながら,AGP が赤血球の毛細血管擬 似モデルである膜フィルター通過を促進させるという報告も認められている43,44).し たがって,AGP が急性炎症時に末梢組織への赤血球の移行を促進することで,微小循 環改善物質として働いている可能性も推察される.
ところで,AGP のもう一つの重要な機能としてリガンド結合能が良く知られている.
AGP は非常に多くのリガンドと結合するものの,特に,塩基性薬物45)やステロイドホ ルモン46)に対する親和性が高いことから,これらリガンドの血中主要キャリア蛋白質 として位置づけられている.多くの場合,生体膜を通過し,組織に移行して薬理作用を 発現したり,代謝や排泄を受けるのは,蛋白質と結合していない非結合型薬物分子であ ることから,AGP に対する結合はこれら薬剤の体内動態や薬理作用にまで影響を及ぼ すことが予想される.ここで,AGP に対する結合能を評価することや,AGP 分子上の 結合サイトを同定することは,薬効の指標となる非結合型濃度推移や,蛋白結合におけ る薬物間相互作用を予測する上で重要である.
近年,医薬品開発では,各種細胞系を用いた実験が主流であるが,体内動態の検討に おいては,依然実験動物を用い,得られた結果をヒトに外挿するいわゆるアニマルスケー ルアップを行うケースが多い.その際,体内動態における種差が十分理解されていない と,ヒトにおける臨床試験をスムーズに実施することができないことがある.この代表 例として,新規抗癌剤 UCN-01(7-hydroxy-staurosporine)の AGP 結合における 種差が挙げられる.これは,UCN-01 のヒト AGP に対する結合性がラットを始めとす る実験動物の場合に比べ 100 倍以上強いために,ラットの実験系より外挿したヒトにお ける投与量では予想した体内動態を示さないばかりでなく,期待した治療効果が得られ ないため,新たなモデルの構築を必要とした47).したがって,薬物と AGP の相互作用 における種差を明らかにすることは,医薬品開発過程でのアニマルスケールアップや薬 物間相互作用の予測において重要である.ヒト AGP に関するデータは整いつつあるも のの,動物種 AGP に関する情報が乏しいために,AGP と薬物の結合における種差に関
する情報はほとんど構築されていない.なかでも結合サイトの場合,ヒト AGP 分子上 には塩基性薬物結合サイト,酸性薬物結合サイト,ステロイドホルモン結合サイトが互 いに重なり合った一つの幅広く柔軟な薬物結合領域の存在が示唆されている48).一方,
他種 AGP では結合サイトの存在は見出されているものの,その特性についてはほとん ど検討されていない.
以上示したように,in vitro実験結果から,AGP が抗炎症効果を有する可能性は示さ れているものの,
in vivo
における抗炎症作用やその詳細な作用機序については未だ十 分に明らかにされていない.また,組織の修復過程における細胞の増殖と分化,さらに 損傷部位の再形成にとって損傷組織への血液供給は極めて重要であるにもかかわらず,血液循環動態に対する AGP の作用についてもほとんど検討されていない.さらに,火 傷や外傷といった急性炎症疾患は緊急災害時や,平時でも若年者における疾病の中心で あり,急性炎症反応の機構の解明とその制御は依然として重要な研究課題であると考え られる.したがって,AGP の抗炎症効果の実体を把握し,血液循環動態に対する作用 を明らかにすることは,急性炎症時,生合成が亢進する急性期蛋白質が生体内でどのよ うな役割を担っているのか理解する上で重要な基礎資料になると考えられる.加えて,
AGP が上述した役割を果たすためには,作用部位に至る過程,すなわち,生体内動態 を明らかにし,それを関連づけることも大切である.
このような背景の下,本研究ではAGP の生理作用と動態特性について検討を行った.
まず,第 2 章で,111In 標識した AGP,アシアロ AGP,アガラクト AGP をそれぞれマ ウスに尾静脈内投与し,これら糖修飾 AGP の体内動態特性について native AGP と比 較検討した.さらにこれら AGP のマウス肝臓の実質細胞,内皮細胞,クッパー細胞へ の取り込みについても検討を加えた.第 3 章では,急性滲出性炎症モデルであるラット 足蹠浮腫に,起炎剤として作用機序の異なるカラゲニン,デキストラン,カオリンを用 いて,in vivoにおける AGP の抗炎症効果やその作用機序について検討した.さらに,
好中球の遊走及びスーパーオキシドアニオン生成に対する AGP の影響を検討し,アラ キドン酸からプロスタグランジン E2(PGE2)生成に対する AGP の影響についても明 らかにした.第 4 章では,血液循環動態への影響を検討するために,AGP の赤血球変 形能に対する影響を調べ,赤血球浸透圧脆弱性試験により AGP の赤血球膜安定化効果 を検討した.さらに,AGP が活性酸素種による赤血球破壊を保護するかどうか検討し た.また,マウスから摘出した胸部大動脈の張力応答に対し,AGP がどのように影響 するか検討した.第 5 章では,ヒト AGP variant に対するサイトマ−カーの結合デー タに基づき,ヒト,イヌ,ウシ AGP 分子上における薬物結合サイトの同定を行った.
第 6 章は,以上の知見を総括したものである.
以下,各章において得られた知見を詳述する.
第2章 α 1-酸性糖蛋白質(AGP)の体内動態特性
第1節 序
AGP には抗炎症作用や免疫抑制作用などがあるが,これらの作用は糖鎖構造の違い により異なることが知られている30,32,49,50).したがって,作用部位などを考える場合,
AGP やその糖修飾体の生体内における動態を明らかにすることは,AGP の構造・機能 発現という観点から大変興味深い.一般に AGP,セルロプラスミン,フェツインなど 糖蛋白質の半減期は数時間であるのに対し,糖鎖末端のシアル酸をシアリダーゼにより 除去し,アシアロ体にすると半減期は数分になる.これはシアル酸を除去することによ り,露出したガラクトースが肝臓のアシアログリコプロテインレセプターに認識され,
取り込まれることによって生じることが明らかにされている23,51).しかしながら,生 体内で糖蛋白質がシアリダーゼによりアシアロ体になるメカニズムは分かっていない
(Fig. 3).一方,石橋らはアシアログリコプロテインレセプターノックアウトマウス を作成し,AGP の消失にアシアログリコプロテインレセプターが関与していないこと を示唆している24).このように,AGP の消失経路や消失部位については,様々な説が あり,未だ不明瞭な点が多く残されている.
Fig. 3 A model for elimination route of AGP
Terminal sialic acid residues were removed by sialidase, then desialylated (terminal galactose residues) AGP was uptaked in asialoglycoprotein receptor on parenchymal cells of the liver.
: N-acetylglucosamine, : mannose, : galactose, : sialic acid, : fucose.
Asialoglycoprotein receptor No report
Sialidase
Oligosaccharide of AGP
Liver
a); Morell A. G., et al., J. Biol. Chem., 246: 1461-7 (1971) Previous report
a)そこで本章では,AGP 及び 2 種類の糖修飾体,すなわち,シアリダーゼによりシア ル酸を除去した糖鎖末端がガラクトースのアシアロ AGP とβ-ガラクトシダーゼにより ガラクトースを除去したアガラクト AGP(Fig. 4)をそれぞれマウスに尾静脈内投与し,
体内動態特性を比較検討した.さらに,マウス肝臓の実質細胞,内皮細胞,クッパー細
胞への取り込みについても検討した.
Asialo-AGP Agalacto-AGP
GlcNAc GlcNAc
Man Man Man GlcNAc
GlcNAc Gal
Gal Sia
Sia
Fuc
Asn ß-Galactosidase
Sialidase
AGP
Fig. 4 Oligosaccharide structure of asialo- and agalacto-AGP Sia : sialic acid Gal : galactose GlcNAc : N-acetylglucosamine Man : mannose Fuc : fucose Asn : asparagine
第2節 AGP 及び脱糖化 AGP の体内動態
2-1 AGP の体内動態
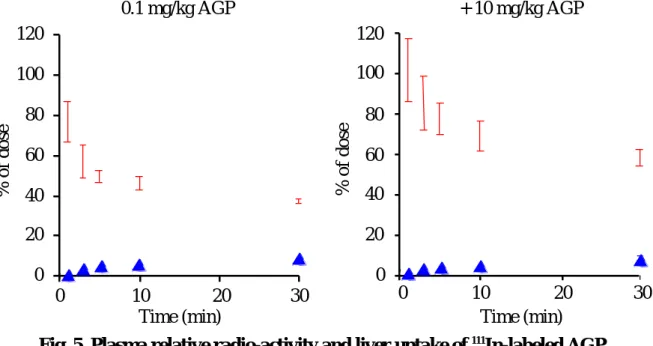
Fig. 5 に,111In 標識した AGP をマウスに 0.1mg/kg で尾静脈から投与した場合と,
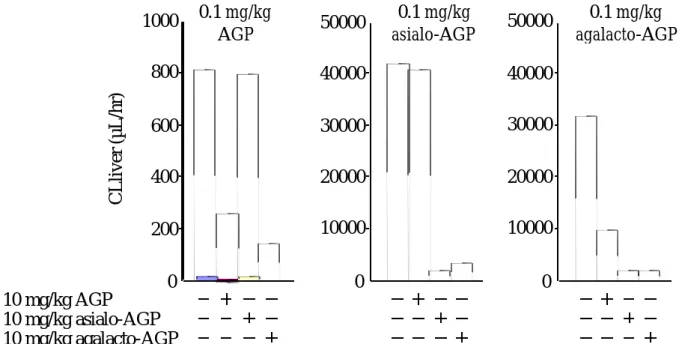
111In 標識した AGP,0.1mg/kg にコールドの AGP,10mg/kg を併用投与した場合を 示す.経時的に血中濃度及び各組織への蓄積を評価したところ,30 分では,AGP は血 中からほとんど消失せず,肝臓への取り込みは投与量の 10%以下だった.次に AGP の 消失,肝臓への取り込みが能動的か受動的かを検討するために,100 倍量のコールド AGP を併用投与した.図から明らかなように,AGP の血中からの消失は阻害され,肝 クリアランスは約 1/3 に減少した(Table 3).また,データには示していないが,皮 膚,筋肉,肺,心臓,胃,腸,膵臓,脾臓,腎臓への取り込みは小さく,臓器クリアラ ンスにおいても有意な阻害は認められなかった.これらのことから,AGP は肝臓に存 在するレセプターを介して消失する可能性が示唆された.
CL
liver (µL/min) 8160.1 mg/kg
264
+10 mg/kg
Table 3 Liver clearance of
111In-labeled AGP after intravenous administration
: liver : plasma,
Fig. 5 Plasma relative radio-activity and liver uptake of
111In-labeled AGP after intravenous administration
The data are average values of three experiments (± S. D.).
120 100 80 60 40 20 0
0 10 20 30
Time (min)
% of dose
+ 10 mg/kg AGP
% of dose
Time (min) 120
100 80 60 40 20 0
0 10 20 30
0.1 mg/kg AGP
2-2 アシアロ AGP の体内動態
Fig. 6 に示すように,アシアロ AGP は AGP とは異なり,素早い血中からの消失と肝 臓への取り込みが顕著に認められた.また,コールドのアシアロ AGP を併用投与する と血中からの消失及び肝臓への取り込みが阻害され,肝クリアランスは約 1/20 に減少 した(Table 4).これは,従来より報告23)されている通り,アシアロ AGP が肝臓に 存在するアシアログリコプロテインレセプターによって認識され,血中から消失したた めと考えられる.
2-3 アガラクト AGP の体内動態
Fig. 7 に示すように,アガラクト AGP はアシアロ AGP と同様,速い血中からの消失 と肝臓への顕著な取り込みが認められた.また,コールドのアガラクト AGP を併用投 与すると,血中からの消失が緩やかになり,肝クリアランスは約 1/17 に減少した
(Table 5).このことから,アガラクト AGP の場合もアシアロ AGP と同様,肝臓に 存在するレセプターを介して消失する可能性が示唆された.
CL
liver (µL/min)+10 mg/kg
20520.1 mg/kg
43404
Table 4 Liver clearance of
111In-labeled asialo-AGP after intravenous administration
% of dose 120 100 80 60 40 20 0
Time (min)
0 10 20 30
+ 10 mg/kg asialo-AGP
% of dose
120 100 80 60 40 20 0
Time (min)
0 10 20 30
0.1 mg/kg asialo-AGP
: liver : plasma,
Fig. 6 Plasma relative radio-activity and liver uptake of
111In-labeled asialo-AGP after intravenous administration
The data are average values of three experiments (± S. D.).
CL
liver (µL/min)0.1 mg/kg
31908+10 mg/kg
1860Table 5 Liver clearance of
111In-labeled agalacto-AGP after intravenous administration
: liver : plasma,
Fig. 7 Plasma relative radio-activity and liver uptake of
111In-labeled agalacto-AGP after intravenous administration
The data are average values of three experiments (± S. D.).
+ 10 mg/kg agalacto-AGP
% of dose
120 100 80 60 40 20 0
Time (min)
0 10 20 30
% of dose
120 100 80 60 40 20 0
Time (min)
0 10 20 30
0.1 mg/kg agalacto-AGP
第 3 節 AGP,アシアロ AGP 及びアガラクト AGP の肝取り込み機構
3-1 AGP,アシアロ AGP 及びアガラクト AGP の取り込み阻害実験
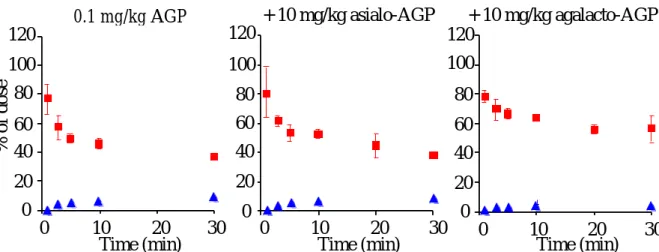
AGP,アシアロ AGP,アガラクト AGP は肝臓に存在するレセプターを介して消失す ることが示唆されたので,次にその 3 者が同じレセプターを介して取り込まれるかどう かを明らかにするために,競合阻害実験を行った.111In 標識した AGP 0.1mg/kg に対 してコールドのアシアロ AGP 10mg/kg またはアガラクト AGP10mg/kg を併用投与 した.同様にアシアロ AGP,アガラクト AGP に対しても競合阻害実験を行い,そのと きの肝クリアランスをそれぞれ算出した.興味深いことにアシアロ AGP を併用投与し ても,AGP の血中濃度推移及び肝クリアランスは影響を受けなかったが,アガラクト AGP の場合は,AGP の血中からの消失が阻害され,肝クリアランスは著しく減少した
(Fig. 8,11).また,アシアロ AGP に AGP を併用投与しても,アシアロ AGP の血 中濃度推移及び肝クリアランスは変化しなかったが,アガラクト AGP を併用投与する と,血中からの消失は阻害され,肝クリアランスは減少した(Fig. 9,11).したがっ て,AGP とアシアロAGP を併用投与しても互いの血中濃度推移に全く影響を与えなかっ たことから,従来より提唱されている23)AGP が血中でシアリダーゼによりアシアロ AGP になり,アシアログリコプロテインレセプターに取り込まれ,消失するという可 能性は極めて低いことが示唆された.また,この結果は石橋らのノックアウトマウスを 用いた実験結果と良く対応していた24).しかしながら,本研究も石橋らの実験もとも に 30 分までの結果であり,さらに長い時間の検討が必要と思われる.なぜなら,AGP からアシアロ AGP になる過程が非常に緩やかであるならば,数時間後には互いに競合 阻害が起こる可能性が考えられる.したがって,血中のシアリダーゼ活性については今 後検討する必要がある.Fig. 10 及び 11 に示すように,アガラクト AGP に AGP また はアシアロ AGP を併用投与すると,アガラクト AGP の血中からの消失は阻害さ
Fig. 8 Competition of disappearance of
111In-labeled AGP by coadministration of asialo-AGP or agalacto-AGP
The data are average values of three experiments (± S. D.).
: liver : plasma,
% of dose
Time (min) 120
100 80 60 40 20 0
0 10 20 30
120 100 80 60 40 20 0
Time (min)
0 10 20 30
120 100 80 60 40 20 0
Time (min)
0 10 20 30
+ 10 mg/kg asialo-AGP + 10 mg/kg agalacto-AGP
0.1 mg/kg AGP
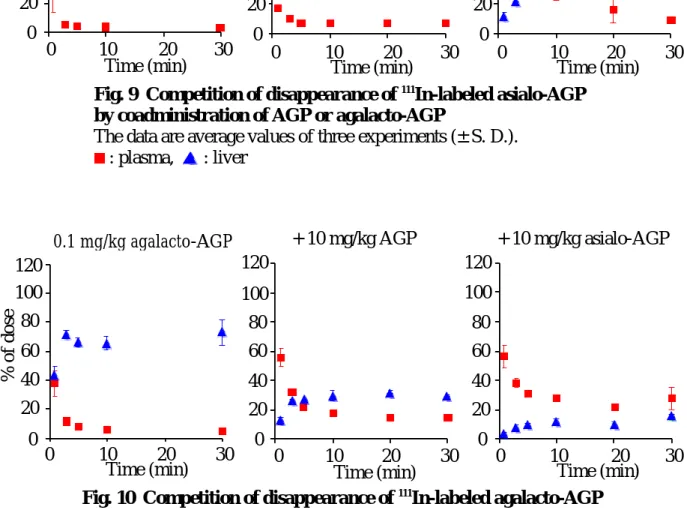
れ,肝クリアランスは減少し,AGP よりアシアロ AGP の方に強い阻害効果が認められ た.投与後 30 分までの検討ではあるが,AGP とアシアロ AGP は異なるレセプターを 介して取り込まれ,また,アガラクト AGP は AGP 及びアシアロ AGP とそれぞれ競合 し,特にアシアロ AGP と競合するレセプターに優先して取り込まれる可能性が示唆さ れた.
% of dose
120 100 80 60 40 20 0
Time (min)
0 10 20 30
120 100 80 60 40 20 0
Time (min)
0 10 20 30
+ 10 mg/kg AGP
120 100 80 60 40 20 0
Time (min)
0 10 20 30
+ 10 mg/kg agalacto-AGP 0.1 mg/kg asialo-AGP
Fig. 9 Competition of disappearance of
111In-labeled asialo-AGP by coadministration of AGP or agalacto-AGP
The data are average values of three experiments (± S. D.).
: liver : plasma,
Fig. 10 Competition of disappearance of
111In-labeled agalacto-AGP by coadministration of AGP or asialo-AGP
The data are average values of three experiments (± S. D.).
: liver : plasma,
% of dose
120 100 80 60 40 20 0
Time (min)
0 10 20 30
120 100 80 60 40 20 0
Time (min)
0 10 20 30
120 100 80 60 40 20 0
Time (min)
0 10 20 30
+ 10 mg/kg AGP + 10 mg/kg asialo-AGP
0.1 mg/kg agalacto-AGP
Fig. 11 Competition of liver uptake clearance of
111In-labeled AGP, asialo-AGP and agalacto-AGP by coadministration of the other glycoproteins
10 mg/kg AGP 10 mg/kg asialo-AGP 10 mg/kg agalacto-AGP
800 600 400 200 0
1000 50000
20000 30000 40000
10000 0 50000
20000 30000 40000
10000 0 0.1 mg/kg
AGP
0.1 mg/kg asialo-AGP
0.1 mg/kg agalacto-AGP
CLliver (µL/hr)
3-2 AGP, アシアロ AGP 及びアガラクト AGP の細胞認識特性
肝臓には糖鎖認識能が異なる実質細胞,内皮細胞,クッパー細胞が存在するので52), この 3 種の AGP がどの細胞に取り込まれるか検討した.すなわち,マウス尾静脈内に 3 種の111In 標識体をそれぞれ 0.1mg/kg で投与し,30 分後に門脈から肝灌流を行い,
各細胞を分離し,取り込み量を調べた.以前からの報告23)で,アシアロ AGP は実質細 胞のアシアログリコプロテインレセプターによって取り込まれることは明らかである.
また,アガラクト AGP もレセプターは分からないけれども,非実質細胞より実質細胞 に有意に取り込まれることが報告されている 53).事実,アシアロ AGP もアガラクト AGP も実質細胞に投与量の約 80%が取り込まれた.また,これら糖修飾体に比べ,取 り込み量は少ないけれども,AGP もほとんど実質細胞に取り込まれた(Table 6).こ れらのことから,アガラクト AGP にとってはおそらく低親和性と考えられる肝実質細 胞に存在する何らかのレセプターにより AGP は取り込まれ,また,アガラクト AGP とアシアロ AGP は肝実質細胞に存在するアシアログリコプロテインレセプターを介し て取り込まれる可能性が示唆された(Fig. 12B).
以上の結果より,AGP の血中からの消失が従来から言われていたアシアロ AGP に変 換後,アシアログリコプロテインレセプターを介する経路だけではなく(Fig. 12A),
例えば AGP から直接レセプターを介して肝臓へ取り込まれるような他の経路の寄与を 考慮する必要性が強く示唆された(Fig. 12B).しかしながら,AGP は消失半減期が 5 日と比較的ゆっくりと消失していく11).これは従来 AGP がシアリダーゼによりアシア ロ AGP に変換後,消失していくと考えられてきた23).すなわち,シアリダーゼによる アシアロ化が消失の律速と考えられてきた.ところが,本研究結果からは,AGP が肝 臓に存在するレセプターを介して変換なしに直接消失している可能性が示された.この
Table 6 Liver cells uptake (%) of
111In-labeled AGP, asialo-AGP and agalacto-AGP (0.1 mg/kg) at 30 min after intravenous administration
a) ; not determined.
AGP Asialo-AGP
80.53 1.44 0.65
Agalacto-AGP 76.18
1.03 1.03 6.41
0.04 a) Kupffer cell
Endothelial cell Parenchymal cell
Fig. 12 A model showing the presumed liver uptake of AGP, asialo-AGP and agalacto-AGP in mouse
AGP Agalacto-AGP Asialo-AGP
Asialoglycoprotein receptor
? receptor
Parenchymal cell Liver
Asialo-AGP AGP
Asialoglycoprotein receptor Sialidase
(A) Previous hypothesis
(B) Our hypothesis
結果は,石橋らによるアシアログリコプロテインレセプターノックアウトマウスにおい て,AGP の消失がノーマルマウスと類似していたという報告24)とよく対応している.
したがって,AGP はアシアロ AGP に変換する前に肝臓に取り込まれている可能性が強 く示唆される.このことを明らかにするためには,今後,血中シアリダーゼを阻害した 条件下で取り込み実験を行う必要があると思われる.特に病態時においてはシアリダー ゼ活性やアシアログリコプロテインレセプター活性が変化する可能性も考えられること から,AGP の消失過程の全貌を明らかにするためには,炎症を始めとする各種病態マ ウスを用いた検討が必要である.また,AGP の肝取り込みは他の修飾 AGP に比べ小さ いことから,AGP を認識するレセプターは取り込み能力が小さいか,あるいは元来
AGP を認識しているレセプターではないのかもしれない.現段階の限られたデータで は,この AGP を認識する受容体の特性を明らかにすることはできないが,AGP の消失 が自身からの直接経路であるとすると,他の蛋白質と同様,酸化などの翻訳後修飾によ りスカベンジャーレセプターに認識されているのかもしれない.今後この点については,
スカベンジャーレセプターの基質として考えられるアセチル化体を用いて取り込み阻害 実験から明らかにしていく必要がある54).
第 4 節 小括
本章では,AGP 及びその糖修飾体であるアシアロ AGP,アガラクト AGP をそれぞ れマウス尾静脈より投与し,それらの体内動態特性を明らかにした.さらに,マウス肝 臓の実質細胞,内皮細胞,クッパー細胞への取り込みについて検討した.その結果,以 下の知見が得られた.
1)AGP 及び 2 種類の糖修飾体,アシアロ AGP,アガラクト AGP は肝臓に存在するレ セプターを介して消失する可能性が示唆された.なお,AGP≪アガラクト AGP≦アシ アロ AGP の順に血中からの消失は速くなり,肝クリアランスは大きくなった.
2)AGP とアシアロ AGP の肝取り込みは競合しなかったが,AGP とアガラクト AGP,
アシアロ AGP とアガラクト AGP のそれは競合した.さらに,AGP,アシアロ AGP,
アガラクト AGP は主に肝実質細胞に取り込まれることが明らかになった.その際,
AGP はアガラクト AGP の低親和性受容体に認識され,一方アシアロ体を認識する受容 体いわゆるアシアログリコプロテインレセプターはアガラクト AGP の高親和性受容体 に相当する可能性が示唆された.
第3章 AGP の抗炎症効果
第1節 序
急性期蛋白質である AGP は,抗炎症作用を有することが知られている.しかしなが ら,それを裏付けているのはほとんど
in vitro
実験であり,実際in vivo
における抗炎 症効果についてはほとんど検討されておらず,また,その作用機序についても不明瞭な 点が多く残されている.さらに,AGP には 5 本の糖鎖が結合しており,抗炎症効果に ペプチド部分が関与しているのか,それとも糖鎖部分(特にシアル酸)が関与している のかほとんど分かっていない.ところで,急性の滲出性炎症においては,肥満細胞やマクロファージなどから産生・
遊離したメディエーターが細静脈の血管透過性を引き起こし,その結果,血漿成分や様々 な白血球が血管内から炎症部位へ大量動員されて活性化が起こり,さらに様々なメディ エーターが産生してくる.それらのメディエーターが相互に作用しあって炎症反応が進 行する.足蹠浮腫モデルは,ラットの足蹠に炎症を引き起こす物質(起炎剤)を皮下注 射して足蹠浮腫を誘発する急性滲出性炎症モデルであり,炎症反応過程でみると,起炎 剤刺激に続く微小血管の拡張,白血球の遊走,血漿・血液成分の血管外滲出までの急性 相が対象となる.そのため,様々な抗炎症薬の急性炎症
in vivo
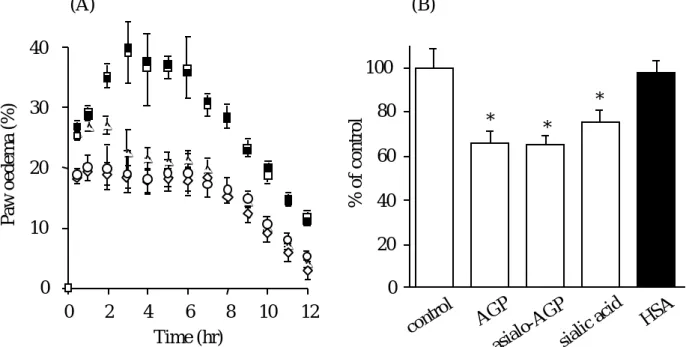
モデルとしてスクリー ニングに用いられてきた55).そこで本章では,AGP の抗炎症効果を明らかにするために,in vivoモデルとしてラッ ト足蹠浮腫を用い,その作用機序解明のために,3 種の起炎剤,カラゲニン,デキスト ラン及びカオリンを用いて実験を行った.すなわち,好中球の遊走が顕著で,その初期 にはヒスタミンとセロトニンが,次いでプロスタグランジンとブラジキニンが関与する カラゲニン56,57),好中球の遊走はなく,ヒスタミンとセロトニンの関与が主体となる デキストラン 58),及びプロスタグランジンとブラジキニンの関与が主体となるカオリ ン59)を起炎剤として検討を行った.Fig.13A,14A,15A に示すように,それぞれ,
投与後 3 時間,1 時間,8 時間で浮腫が最大になり,作用機序の異なる起炎剤の特性を よく反映した結果が得られた.さらに,急性炎症は障害を受けた場所への血管からの血 漿成分の滲出と好中球を主とした白血球の浸潤が顕著に表れることから,好中球活性に 対する影響も検討した.また,シクロオキシゲナーゼ活性に対する検討も加えた.
第2節
In vivo
における抗炎症効果2-1 カラゲニン誘導足蹠浮腫及び血管透過性に対する AGP の影響
Fig. 13A に示すように,10mg AGP,アシアロ AGP はカラゲニン誘導浮腫を有意に 抑制したが,15 mg ヒト血清アルブミン(HSA)は全く抑制しなかった.図には示し ていないが,濃度依存的に AGP は浮腫を抑制し,効果がプラトーになった 10mg の結
果をここには示した.AGP,アシアロAGP はカラゲニンが誘導するケミカルメディエー ター及び好中球遊走能を抑制する可能性が示唆された.一方,シアル酸は 3 時間以降で 浮腫を有意に抑制したことから,炎症初期のヒスタミン,セロトニンには影響を及ぼさ ず,好中球遊走,プロスタグランジン,ブラジキニンを抑制する可能性が考えられた.
ここで用いたシアル酸は AGP1 分子当たり約 12%がシアル酸であることから 60), AGP の 12%の量を用いて検討した.つまり,10mg AGP に対して 1.2 mg シアル酸を 用いた.また,AGP,アシアロ AGP は血管透過性を有意に抑制し(Fig. 13B),シア ル酸も AGP,アシアロ AGP に比べ弱いけれども有意に抑制した.
Fig. 13 Effects of AGP on carrageenan induced paw oedema (A) and vascular permeability (B)
G, control (saline); E, 10mg AGP; A, 10mg asialo-AGP;
C, 1.2mg sialic acid; B, 15mg HSA.
The data are average values of three experiments (± S. D.).
* P < 0.01 as compared with control.
(B) 100
80 60 40 20 0
% of control
(A)
Time (hr)
0 2 4 6 8 10 12
30 40
10 20
0
control AGP
asialo-AGPsialic acid
HSA
* *
*
Paw oedema (%)
カラゲニンによる浮腫は好中球の遊走が顕著であるが,好中球が血管内皮細胞に付着 して血管外に漏出する現象には,好中球表面上と内皮細胞表面上のいくつかの接着分子 の相互作用と,走化性因子による遊走が関与する.接着分子の一つであるセレクチンは,
C 型レクチン様ドメインを有しており,さらにシアリルルイス X 残基と高親和性である ことが報告されている61).AGP は C 型レクチン様ドメインに結合し,シアリルルイス X 残基を有している62).炎症時に,AGP のシアリルルイス X 残基の発現増大が認めら れており 35),セレクチンとシアリルルイス X 残基の結合を AGP が阻害するという報 告もある36).接着分子であるインテグリンの活性化をサイクリックアデノシン3 ,5 - 1 リン酸(cAMP)がプロテインキナーゼ A,RhoA を介して抑制することが示され
ているが 63,64),AGP は cAMP 濃度を増大させるという報告があり 65),AGP がイン
テグリンの活性化に何らかの影響を及ぼしている可能性がある.さらにインテグリンを 活性化し,好中球を遊走させるケモカインの発現調節に IL-1 が関与しているが66,67), AGP には IL-1 レセプターアンタゴニストを誘導させるという報告がある 30,31).した がって,AGP はセレクチンに結合し,インテグリンの活性化を抑制し,ケモカインの 発現量を抑制することで,好中球と内皮細胞が接着できず,好中球の炎症組織への漏出 を抑制しているものと推測される.
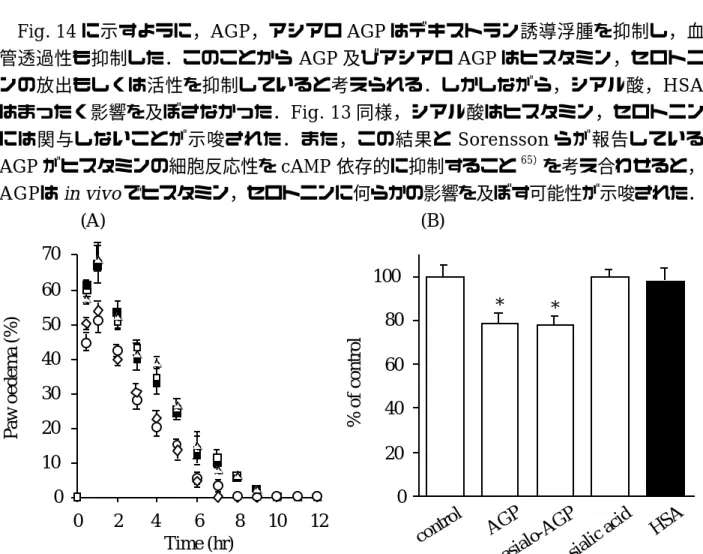
2-2 デキストラン誘導足蹠浮腫及び血管透過性に対する AGP の影響
Fig. 14 に示すように,AGP,アシアロ AGP はデキストラン誘導浮腫を抑制し,血 管透過性も抑制した.このことから AGP 及びアシアロ AGP はヒスタミン,セロトニ ンの放出もしくは活性を抑制していると考えられる.しかしながら,シアル酸,HSA はまったく影響を及ぼさなかった.Fig. 13 同様,シアル酸はヒスタミン,セロトニン には関与しないことが示唆された.また,この結果と Sorensson らが報告している AGP がヒスタミンの細胞反応性を cAMP 依存的に抑制すること65)を考え合わせると,
AGPは
in vivo
でヒスタミン,セロトニンに何らかの影響を及ぼす可能性が示唆された.Fig. 14 Effects of AGP on dextran induced paw oedema (A) and vascular permeability (B) G, control (saline); E, 10mg AGP; A, 10mg asialo-AGP; C, 1.2mg sialic acid; B, 15mg HSA.
The data are average values of three experiments (± S. D.). * P < 0.01 as compared with control.
Paw oedema (%)
70 60 50 40 30 20 10 0
0 2 4 6 8 10 12
% of control
Time (hr)
(A) (B)
* *
100 80 60 40 20 0
control AGP
asialo-AGPsialic acid
HSA
2-3 カオリン誘導足蹠浮腫及び血管透過性に対する AGP の影響
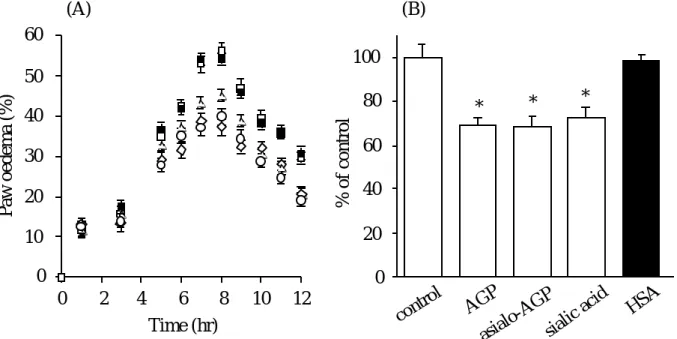
Fig. 15 に示すように,AGP,アシアロ AGP,シアル酸はカオリン誘導浮腫を抑制し,
血管透過性も抑制した.しかしながら,HSA は全く影響を及ぼさなかった.AGP,ア シアロ AGP,シアル酸はプロスタグランジン,ブラジキニンの放出,または活性を抑 制していることが示唆された.
以前,AGP は血管内皮細胞に結合し,糖鎖末端のシアル酸により,血管内皮細胞上 に負電荷を増加させることによって37,38),ポリアニオン分子の血管透過性を減少させ るという報告がなされている37,39).しかしながら,アシアロ AGP がカラゲニン,デ キストラン,カオリン誘導血管透過性を抑制したので,上述以外にも血管透過性を調節 する機能があると考えられる.一般的に,血管透過性亢進は細胞内カルシウム濃度の上 昇とプロテインキナーゼ C(PKC)の活性化を介して,ミオシン軽鎖キナーゼを活性化 し,アクチン,ミオシンの相互作用を引き起こし,血管内皮細胞が収縮し,細胞間隙が 開口して起こる68).Timoshenko らは AGP が PKC 活性を阻害するという報告をして おり69),また,cAMP はミオシン軽鎖キナーゼをリン酸化し,細胞を弛緩させること から68),AGP は PKC や cAMP のシグナル伝達に影響を与え,血管透過性を抑制して いる可能性が考えられる.
ところで,AGP は急性期蛋白質である.そこで,今回用いた 3 種の起炎剤によって ラット AGP 濃度が変動するかどうか検討を行った.図には示していないが,投与後 12 時間まで血清中ラット AGP 濃度は変化しなかった.これまでの報告で,急性炎症時に AGP 濃度が増加し始めるのは 24 時間以降であるため,この結果は妥当であると考えら れる25).このことから,本章で認められた AGP の効果は内因性の AGP によるもので はなく,投与された AGP による効果と考えられる.
Fig. 15 Effects of AGP on kaolin induced paw oedema (A) and vascular permeability (B) G, control (saline); E, 10mg AGP; A, 10mg asialo-AGP; C, 1.2mg sialic acid; B, 15mg HSA.
The data are average values of three experiments (± S. D.). * P < 0.01 as compared with control.
50
20 10 0
0 2 4 6 8 10 12
100 80 60 40 20 0
% of control
30 40 60
Paw oedema (%)
Time (hr)
(B) (A)
* * *
control AGP
asialo-AGPsialic acid
HSA
第3節 好中球活性に対する AGP の影響
3-1 N-ホルミルメチオニルロイシルフェニルアラニン(fMLP)刺激による好中球 遊走に対する AGP の影響
好中球の機能の特性は,旺盛な偽足活動に基づく遊走能と異物貪食能70),及び活性 酸素の生成と放出による食腔胞内での殺菌や,細胞外組織を傷害し自己防衛反応の第一 線を預かる点にある.すなわち,好中球は炎症巣から生ずる免疫関連物質,サイトカイ ン,走化因子に反応して活性化され,細胞内カルシウム濃度が増大し,ミオシンのリン 酸化やアクチンの重合化など,細胞内収縮蛋白や細胞骨格蛋白の活性化と再編を生じ71,
72),細胞膜に各種接着因子を発現,これに,G 蛋白 Rho などの作用による細胞膜裏打 ち蛋白を介して,アクチン繊維が結合する73,74).そして,接着因子のリガンド分子を 発現した血管内皮細胞や,細胞外基質との接着を介し,活性化収縮蛋白の作動による原 形質流動を生じて偽足の形成を引き起こす73,74).これにより病巣へ匍匐遊走し,偽足 活動による異物の補足貪食とともに70),NADPH 依存性五炭糖- 1 リン酸回路の代謝が 亢進して,活性酸素の細胞膜からの放出による食腔胞内での殺菌や,好中球の細胞膜外 側での組織障害をきたす.すなわち,好中球の遊走ならびに活性酸素種生成を抑制する ことは抗炎症作用において重要なことであり,Fig. 13 において,好中球遊走が顕著な カラゲニン誘導浮腫を抑制したことから,実際に,好中球遊走を AGP が抑制するかど うか,Boyden-chamber 法75)を用いて検討した.ケモタキシチャンバーの上室に好中 球(107cell/mL),下室に白血球遊走因子である fMLP を添加すると,好中球が遊走 し始め,フィルター小孔を通過し,下室に移動する.その下室に移動した好中球を数え 評価した.急性炎症時の濃度である 45µM の AGP,アシアロ AGP,及び 900µM のシ アル酸はフィルターを通過する好中球数を有意に減少させた.しかしながら,45
µM の
HSA は全く影響を及ぼさなかった(Fig. 16).ここで用いたシアル酸は AGP1 分子当 たり約 12%がシアル酸であることから60),AGP の 12%の量を用いて検討した.つま り,2g/L AGP(45µM)に対して 0.24g/L シアル酸(900µM)を用いた.fMLP は
G 蛋白質受容体を介した様々なシグナル伝達によりアクチン繊維の再構築により好中球 を遊走させるが76),AGP がどの部位に作用するかは今後の検討課題である.3-2 fMLP 及びホルボールミリステートアセテート(PMA)刺激による好中球スー パーオキシドアニオン産生に対する AGP の影響
好中球に fMLP または PMA を添加するとスーパーオキシドアニオンを放出し,ルミ ノールが酸化され,化学発光する 77-79).この方法を用いて,AGP の好中球スーパーオ キシドアニオン産生に対する影響を検討した.Fig. 17 に示すように,AGP,アシアロ AGP,HSA はルミノールの酸化を抑制したが,シアル酸はコントロールとして用いた 等張リン酸緩衝液(PBS)と同様の挙動を示し,ルミノールの酸化をまったく抑制しな かった.すなわち,AGP,アシアロ AGP,HSA は好中球の活性酸素放出を抑制したが,
シアル酸はまったく抑制しなかった.