蛍光酵素免疫測定法による新しい HIV 抗原抗体同時検出試薬
(第 4 世代)の検討
1) 神奈川県衛生研究所,2) 東京医科歯科大学大学院医歯学総合研究科政策科学分野, 3)横浜市立市民病院感染症部嶋
貴子
1)2)須藤 弘二
1)近藤真規子
1)倉井 華子
3)相楽 裕子
3)今井 光信
1) (平成 19 年 4 月 26 日受付) (平成 19 年 6 月 1 日受理)Key words : human immunodeficiency virus (HIV), antigen-antibody detection assay,
enzyme-linked fluorescent immunoassay, fourth-generation assay, window period
要 旨
ELFA 法を原理とした抗 HIV-1 抗体,抗 HIV-2 抗体と HIV-1 p24 抗原を同時検出可能な HIV スクリーニ ング検査試薬(バイダスアッセイキット HIV デュオ II:以下,バイダスデュオ II と略)について,他の HIV 抗原抗体同時検出試薬との比較検討を行った.HIV 抗体陽性血漿 95 検体および HIV 陰性血漿 1,228 検体を 用いて検討した結果,感度は 100%,特異性は 99.8% であった.各ジェノタイプとの反応性は HIV-1 グルー プ M のサブタイプ A,B,B’,C,D,A!E,F,G,B!D,グループ O,HIV-2 のすべてを検出可能であっ た.HIV-1 p24 抗原の検出感度は,バイダスデュオ II では約 5pg!mL から検出が可能であり,他の抗原抗 体同時検出試薬と比べて抗原検出感度が高いことが分かった.また,感染初期セロコンバージョンパネルを 用いた感染初期検出感度の比較では,バイダスデュオ II は他の抗原抗体同時検出試薬と同等あるいはより 早い時期からの検出が可能であり,またバイダスの従来品では検出できなかった抗 IgM 抗体の検出も可能 となり,セカンドウインドウ期が解消されていることが確認できた.以上の結果から,バイダスデュオ II は HIV スクリーニング検査法として十分な感度,特異性を有するとともに,他の抗原抗体同時検出試薬と 比較して感染初期検出にも優れており,スクリーニング検査法として有用であることが分かった. 〔感染症誌 81:562∼572,2007〕 序 文 1986 年に HIV 抗体スクリーニング検査試薬が発売 されて以来,スクリーニング検査試薬は HIV 感染を より高感度に検出できるよう改良され続けている.最 初に開発された第 1 世代試薬はウイルス粒子由来の抗 原を使用した抗 IgG 抗体検出用試薬であったが,第 2 世代では組換え抗原および合成ペプチドを用いた抗 IgG 抗体検出用試薬となり,また,HIV-2 についても 検出が可能となった.第 3 世代では,検出系に抗原― 抗体―抗原サンドイッチ法を用いることで,抗 IgG 抗体に加え抗 IgM 抗体も検出できるようになり,ま た,HIV-1 グループ O についても検出が可能となっ た.さらに,第 4 世代として,抗 HIV 抗体と HIV-1 p24 抗原が同時に検出できる HIV 抗原抗体同時検出 試薬が開発されたことから,第 3 世代試薬では HIV 抗体が検出できなかった時期(ウインドウ期)が 3∼ 4 週間存在したのが,第 4 世代ではさらに 4 日程度の 短縮が可能となり,HIV 抗原のみ陽性の感染初期か ら抗体陽性期まで幅広い時期の検出ができるように なった1)∼4) .現在,EIA 法を原理とする HIV スクリー ニング検査試薬は,第 3 世代試薬から第 4 世代試薬に 切り替わりつつあり,すでに日本においても第 4 世代 試薬は広く使用されている. 今回我々は,蛍光 基 質 を 用 い た 酵 素 免 疫 測 定 法 (Enzyme-linked Fluorescent Assay:以下 ELFA 法 と略)を原理とする抗原抗体同時検出試薬を検討する 機会を得た.ELFA 法の従来試薬も含めた他の抗原 原 著 別刷請求先:(〒253―0087)神奈川県茅ヶ崎市下町屋 1―3― 1 神奈川県衛生研究所微生物部 嶋 貴子
Fig. 1 Testprinciple ofVIDAS HIV DUOII 抗体同時検出用試薬との比較検討を行い,それぞれの 試薬の性能についても検討したので報告する. 材料と方法 1.検討試薬および対照試薬 (1)検討試薬の原理および測定方法 今回,ELFA 法を原理とし,全自動測定が可能な 抗原抗体同時検出試薬であるバイダスアッセイキット HIV デュオ II(日本ビオメリュー社:以下バイダス デュオ II と略)について検討を行った.この試薬は 従来使用していたバイダスアッセイキット HIV デュ オ(日本ビオメリュー社:以下バイダスデュオと略) に比べ,①抗原―抗体―抗原サンドイッチ法を検出系 に用いることで HIV-1,HIV-2 の抗 IgM 抗体の検出 が可能,②抗 HIV-1 抗体検出系に gp160 蛋白抗原を 使用することで抗体検出感度が上昇,③ HIV-1 p24 抗原の検出感度が 4 倍に上昇,④測定時間が 100 分か ら 80 分に短縮,⑤結果判定においてグレーゾーン表 示を廃止,等の特徴が挙げられる.原理および測定方 法を Fig. 1に示す. 試薬はピペットチップ様のスパー(SPR : solid phase receptacles)および検体ウェルとコンジュゲート等 の試薬が 1 つにパッケージされた試薬ストリップの セットで 1 検体測定の仕様となっている.スパー上部 には,抗原検出用の抗 p24 マウスモノクローナル抗 体,下部には抗体検出用の HIV-1 gp160 蛋白,HIV-1 グループ O gp41 合成ペプチド,HIV-2 gp36 合成ペ プチドが固相化されている.試薬ストリップには,検 体ウェルおよび抗原検出用コンジュゲートとしてビオ チン標識された抗 p24 ウサギポリクローナル抗体,抗 体検出用コンジュゲートとして,ビオチン標識された HIV-1 gp160 蛋白,HIV-1 グループ O gp41 合成ペプ チド,HIV-2 gp36 合成ペプチド,検出用トレーサー としてアルカリフォスファターゼ標識ストレプトアビ ジン,酵素基質である 4-メチルウンベリフェリルリン 酸(以下 4-MUP と略)および洗浄用バッファーがセッ トされている. 測定の第 1 ステップでは,検体が試薬中の HIV-1 p 24 抗原検出用のビオチン標識抗 p24 ウサギポリ ク ローナル抗体および抗 HIV 抗体検出用のビオチン標 識 HIV-1 gp160 蛋 白,HIV-1 グ ル ー プ O gp41 合 成 ペプチド,HIV-2 gp36 合成ペプチド複合物とともに, スパー内に吸引・排出され,スパー上部で抗原検出系, スパー下部で抗体検出系の測定が同時に行われる.反 応およびインキュベーション終了後,洗浄され第 2 ス テップに移行する.第 2 ステップでは再度,検体とビ オチン標識 HIV-1 gp160 蛋白,HIV-1 グループ O gp 41 合成ペプチド,HIV-2 gp36 合成ペプチド複合物が スパー下部に吸引・排出され,抗体検出系の反応が行 われる.反応終了後,洗浄され第 3 ステップに移行す る.第 3 ステップでは,アルカリフォスファターゼ標 識ストレプトアビジンがビオチンと結合し,第 4 ス テップとして,検出用ウェル内で 4-MUP がアルカリ フォスファターゼにより蛍光物質である 4-メチルウン ベリフェロン(4-MU)に加水分解され,370nm の励 起光を照射して得られる 450nm の蛍光強度を測定す る.蛍光強度は検体中の抗 HIV 抗体量,HIV-1 p24 抗原量に比例する. 必要検体量は 200µL であり,検体は血清または血
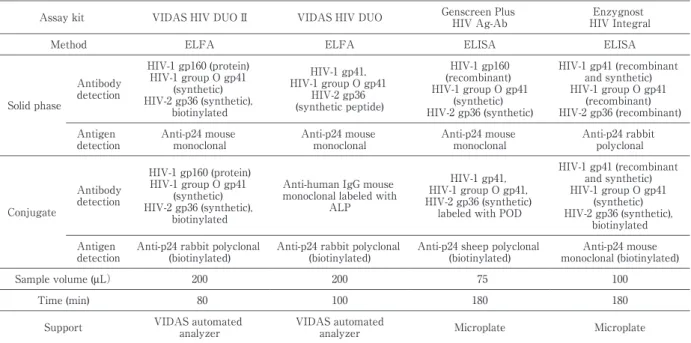
Table 1 HIV antigen-antibody detection assay Enzygnost HIV Integral Genscreen Plus HIV Ag-Ab VIDAS HIV DUO VIDAS HIV DUO II Assay kit ELISA ELISA ELFA ELFA Method HIV-1 gp41 (recombinant and synthetic) HIV-1 group O gp41 (recombinant) HIV-2 gp36 (recombinant) HIV-1 gp160 (recombinant) HIV-1 group O gp41 (synthetic) HIV-2 gp36 (synthetic) HIV-1 gp41, HIV-1 group O gp41 HIV-2 gp36 (syntheticpeptide) HIV-1 gp160 (protein) HIV-1 group O gp41 (synthetic) HIV-2 gp36 (synthetic), biotinylated Antibody detection Solid phase Anti-p24 rabbit polyclonal Anti-p24 mouse monoclonal Anti-p24 mouse monoclonal Anti-p24 mouse monoclonal Antigen detection HIV-1 gp41 (recombinant and synthetic) HIV-1 group O gp41 (synthetic) HIV-2 gp36 (synthetic), biotinylated HIV-1 gp41, HIV-1 group O gp41, HIV-2 gp36 (synthetic) labeled with POD Anti-human IgG mouse
monoclonallabeled with ALP HIV-1 gp160 (protein) HIV-1 group O gp41 (synthetic) HIV-2 gp36 (synthetic), biotinylated Antibody detection Conjugate Anti-p24 mouse monoclonal(biotinylated) Anti-p24 sheep polyclonal
(biotinylated) Anti-p24 rabbitpolyclonal
(biotinylated) Anti-p24 rabbitpolyclonal
(biotinylated) Antigen detection 100 75 200 200
Sample volume (μL)
180 180 100 80 Time (min) Microplate Microplate
VIDAS automated analyzer VIDAS automated
analyzer Support 漿を使用する.今回の測定にはバイダス専用装置であ るミニバイダスを用いた.この装置では最大 12 検体 の同時測定が可能である.測定時間は 80 分であり,測 定終了後,測定値および判定結果は自動的に印字され る.2 週間に一度,添付のスタンダード試薬(S1)の 二重測定によるキャリブレーションおよび HIV 抗体 陽性コントロール(C1),HIV 陰性コントロール(C2) HIV 抗原陽性コントロール(C3)を用いての精度管 理を実施する.測定値はスタンダードの相対蛍光強度 (以下 RFV と略)に対する検体の RFV の比である TV (Test Value)値として表され,TV 値が 0.25 以上で あれば陽性,0.25 未満であれば陰性と判定する. (2)対照検査法 バイダスデュオ II の性能評価の検討を行うにあた り,対照試薬として以下の検査試薬を用いた. ①抗原抗体同時検出法 ELFA 法であるバイダスデュオ5) ,ELISA 法である ジェンスクリーン HIV Ag-Ab(富士レビオ社:以下 ジェンスクリーンと略)6) およびエンザイグノスト HIV インテグラル(デイドベーリング社:以下エン ザイグノストと略)7) を使用した(Table 1).検体必 要量はバイダスデュオは 200µL,ジェンスクリーンは 75µL,エンザイグノストは 100µL であった.測定方 法は各試薬添付説明書に従った. ②抗体検査法 スクリーニング検査試薬として PA 法のジェネディ ア HIV1!2 ミックス PA(富士レビオ社:以下 PA 法 と略),確認検査試薬としてウエスタンブロット法の ラブブロット 1,2(富士レビオ社:以下 WB 法と略) を使用した.測定方法は各試薬添付説明書に従った. ③抗原検査法 ELFA 法で抗原の定量が可能であるバイダスアッ セイキット HIV P24II(日本ビオメリュー社:以下バ イダス P24II と略)8) を使用した.測定方法は試薬添 付説明書に従った. ④核酸増幅検査法 PCR 法であるアンプリコア HIV-1 モニター Ver.1.5 (ロシュ・ダイアグノスティックス社:以下 NAT 法 と略)9) を使用した.測定方法は試薬添付説明書に従っ た. 保健所 HIV 抗体・核酸増幅検査希望者検体につい ては,抗体スクリーニング検査で陰性と判定された検 体をプールし,それを遠心濃縮して 32 検体までを 1 検体として PCR を行う「プール・遠心濃縮法」10) を 用いて核酸増幅検査を行った. 2.被検検体 (1)HIV 陽性検体 医療機関や保健所等から当所に HIV 検査を依頼さ れ,WB 法により HIV 抗体陽性と判定された HIV 陽 性者血漿 131 例を使用した. (2)HIV 陰性検体 保健所等において HIV 抗 体 検 査,核 酸 増 幅 検 査 (NAT 法)を希望し,PA 法および NAT 法により HIV 陰性と判定された HIV 検査希望者血漿 1228 例を使用 した. (3)バイダスデュオ偽陽性検体 従来品であるバイダスデュオにより陽性反応を示 し,医療機関から当所に確認検査依頼があり,確認検 査によって陰性と確認された血漿 13 例を使用した. 上記の医療機関,保健所等からの検体は,当所へ
Table 2 Results of HIV-positive and negative specimensby VIDAS HIV DUO II
Resultsof VIDAS HIV DUO II Negative Positive 0 131 131 HIV-positive plasma specimens 1,225 3 1,228 HIV-negative plasma specimens Sensitivity 100% (131/131) Specificity 99.8% (1,225/1,228)
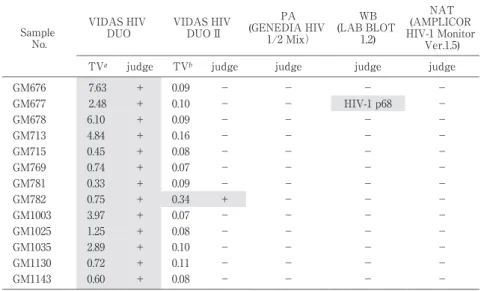
Table 3 ResultsofVIDAS HIV DUO IIfalse positive specimensby otherassays
NAT Antibody assay
Antigen-antibody detection assay sample No. AMPLICOR HIV-1 Monitor Ver.1.5 WB (LAB BLOT 1,2) PA (GENEDIA HIV 1/2Mix) EnzygnostHIV Integral Genscreen PlusHIV Ag-Ab VIDAS HIV DUO VIDAS HIV DUO II copies/mL judge judge judge C.O.I judge C.O.Ic judge TVb judge TVa < 400 - - - 0.056 - 0.103 - 0.05 + 0.41 X1426 < 400 - - - 0.110 - 0.103 - 0.05 + 0.36 X1516 < 400 - - - 0.062 - 0.323 - 0.03 + 0.40 B36
aTV:testvalue < 0.25:Negative,≧ 0.25:Positive
bTV:testvalue < 0.25:Negative,0.25≦ TV< 0.35:Borderline,≧ 0.35:Positive cC.O.I.:cutoffindex HIV 検査を依頼された検体であり,医療機関からの 依頼は検査受け入れの段階ですべて記号化,保健所検 査は保健所での検査受け入れの段階からすべて匿名, 記号化されている.今回の検討にあたり,検体番号は 新たに記号化し,検討を行った. (4)HIV-1 IIIB株培養上清 HIV-1 IIIB実験室株を正常ヒト末梢血単核球を用い て 7 日間培養した上清を使用した. (5)市販パネル検体 市販の HIV 感染者パネル検体として,BBI 社製の Worldwide HIV Performance Panel(WWRB 302), HIV p24 Antigen Mixed Titer Performance Panel (PRA201),HIV-1 Seroconversion Panel AK(PRB 936),AL(PRB937),AM(PRB938),AN(PRB939 (E)),AU(PRB945),BA(PRB951),BB(PRB952), BC(PRB953),BD(PRB954),BE(PRB955)を 使 用した. 3.方法 (1)感度,特異性の検討 HIV 陽 性 者 血 漿 131 例 お よ び HIV 陰 性 検 体 血 漿 1228 例を用いて,バイダスデュオ II の感度,特異性 の検討を行った. (2)従来品偽陽性検体を用いた検討 バイダスデュオの偽陽性検体 13 例について,バイ ダスデュオ II で測定を行い,交差反応の有無を検討 した. (3)HIV ジェノタイプ別の反応性の検討 HIV-1 グ ル ー プ M の サ ブ タ イ プ A,B,B’,C, D,A!E,F,G,B!D,グループ O,HIV-2 を含んだ パネルである Worldwide HIV Performance Panel (WWRB 302)を用いて,ジェノタイプ別の反応性の 検討を行った. (4)HIV ジェノタイプ別の抗体検出感度の比較 WWRB 302 パネルから各ジェノタイプを 1 検体ず つ選択し,HIV 陰性プール血漿を用いて 106 倍までの 10 倍階段希釈系列を作成し,検討試薬および対照抗 原抗体同時検出試薬とのジェノタイプ別の抗体検出感 度の比較を行った.HIV-1 については,p24 抗原の存 在による測定値への影響がないことを調べるために, あらかじめ 10 倍希釈した検体をバイダス P24II を用 いて測定を行い,陰性を確認した. (5)HIV-1 p24 抗原の反応性の検討 様々な抗原・抗体力価の検体を含んだパネルである HIV p24 Antigen Mixed Titer Performance Panel (PRA201)を用いて,反応性の検討を行った.
(6)HIV-1 p24 抗原の検出感度の比較
HIV-1 IIIB培養上清をバイダス P24II で測定し,p24
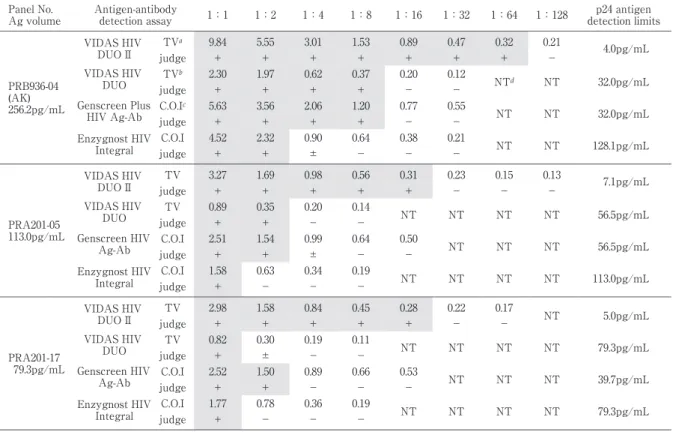
濃度が約 150pg!mL および約 100pg!mL になるよう に調製した試料を母液とした 2 倍階段希釈系列を作成 し,検討試薬および対照抗原抗体同時検出試薬の抗原 検出感度の比較を行った.また,血漿検体として,HIV-1 Seroconversion Panel AK(PRB936)および HIV p 24 Antigen Mixed Titer Performance Panel(PRA 201)の中から,抗体出現前で抗原のみ陽性である PRB 936-04,PRA201-05,PRA201-17 の 3 検 体 を 用 い て, HIV 陰性プール血漿で 2 倍階段希釈系列を作成し,検 討試薬および対照抗原抗体同時検出試薬の p24 抗原 の検出感度を比較した. (7)HIV 感染初期検出感度の比較 HIV 感染初期に経時的に採血されたパネルである HIV-1 Seroconversion Panel AK(PRB936),AL(PRB 937),AM(PRB938),AN(PRB939(E)),AU(PRB
Table 4 ResultsofVIDAS HIV DUO false positive specimensby VIDAS HIV DUO II NAT (AMPLICOR HIV-1 Monitor Ver.1.5) WB (LAB BLOT 1,2) PA (GENEDIA HIV 1/2 Mix) VIDAS HIV DUO II VIDAS HIV DUO Sample No. judge judge judge judge TVb judge TVa - - - - 0.09 + 7.63 GM676 - HIV-1 p68 - - 0.10 + 2.48 GM677 - - - - 0.09 + 6.10 GM678 - - - - 0.16 + 4.84 GM713 - - - - 0.08 + 0.45 GM715 - - - - 0.07 + 0.74 GM769 - - - - 0.09 + 0.33 GM781 - - - + 0.34 + 0.75 GM782 - - - - 0.07 + 3.97 GM1003 - - - - 0.08 + 1.25 GM1025 - - - - 0.10 + 2.89 GM1035 - - - - 0.11 + 0.72 GM1130 - - - - 0.08 + 0.60 GM1143
aTV:testvalue < 0.25:Negative,0.25≦ TV< 0.35:Borderline,≧ 0.35:Positive bTV:testvalue < 0.25:Negative,≧ 0.25:Positive
Table 5 ResultsofHIV antigen-antibody detection assay,antibody assay,antigen assay,and nucleic acid test(NAT)on Worldwide HIV Performance Panel(WWRB302)
NAT Antibody assay
Antigen-antibody detection assay
WWRB302 Roche RNA RT-PCRa EIA (AbbottHIV 1/2)a Enzygnost HIV Integral Genscreen Plus HIV Ag-Ab VIDAS HIV DUO II judge judge judge C.O.I judge C.O.Ic judge TVb Genotype No. - + + > 6.1 + > 15.4 + 1.32 O 1 + + + > 6.1 + > 15.4 + 18.01 A 2 + + + > 6.1 + > 15.4 + 21.01 G 3 + + + > 6.1 + > 15.4 + 19.51 G 4 + + + > 6.1 + > 15.4 + 21.09 A 5 + + + > 6.1 + > 15.4 + 15.32 G 6 - + + > 6.1 + > 15.4 + 22.91 HIV-2 7 + + + > 6.1 + > 15.4 + 22.65 G 8 + + + > 6.1 + > 15.4 + 21.11 A 9 - - - 0.09 - 0.14 - 0.12 negative 10 - + + > 6.1 + > 15.4 + 23.27 HIV-2 11 + + + > 6.1 + > 15.4 + 21.55 C 12 + + + > 6.1 + > 15.4 + 14.3 A 13 + + + > 6.1 + > 15.4 + 11.39 D 14 + + + > 6.1 + > 15.4 + 17.39 D 15 + + + > 6.1 + > 15.4 + 19.51 D 16 + + + > 6.1 + > 15.4 + 18.82 D 17 + + + > 6.1 + > 15.4 + 20.1 C 18 + + + > 6.1 + > 15.4 + 12.83 C 19 + + + > 6.1 + > 15.4 + 18.83 C 20 + + + > 6.1 + > 15.4 + 17.88 B’ 21 - + + > 6.1 + > 15.4 + 20.75 E 22 + + + > 6.1 + > 15.4 + 16.04 E 23 + + + > 6.1 + > 15.4 + 15.07 E 24 - + + > 6.1 + > 15.4 + 22.03 HIV-2 25 + + + > 6.1 + > 15.4 + 21.21 B 26 + + + > 6.1 + > 15.4 + 18.06 B/D 27 + + + > 6.1 + > 15.4 + 21.22 F 28 + + + > 6.1 + > 15.4 + 20.83 B 29 - - - 0.08 - 0.17 - 0.10 negative 30
aData from paneldata sheet
bTV:testvalue < 0.25:Negative,≧ 0.25:Positive cC.O.I.:cutoffindex
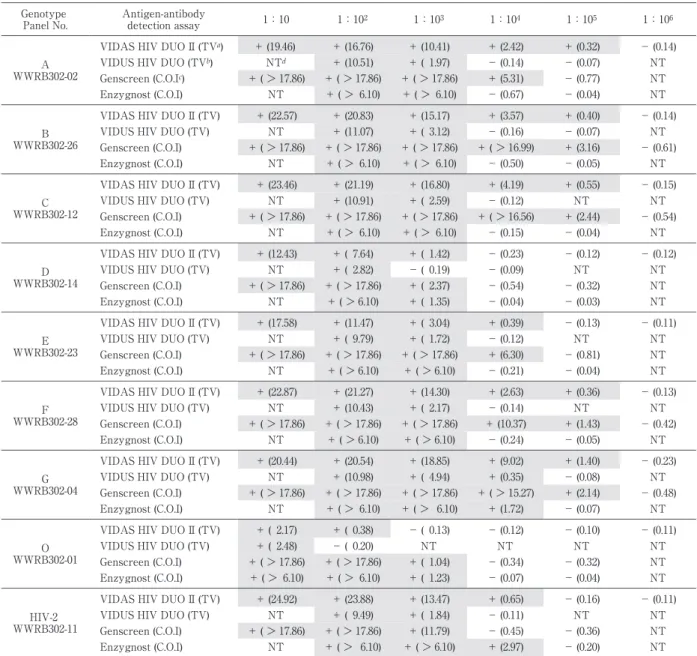
Table 6 Comparison of detection limits by antigen-antibody detection assays using Worldwide HIV Performance Panel (WWRB302) 1:106 1:105 1:104 1:103 1:102 1:10 Antigen-antibody
detection assay Genotype PanelNo. - (0.14) + (0.32) + (2.42) + (10.41) + (16.76) + (19.46) VIDAS HIV DUO II(TVa) A WWRB302-02 NT - (0.07) - (0.14) + ( 1.97) + (10.51) NTd VIDUS HIV DUO (TVb) NT - (0.77) + (5.31) + (> 17.86) + (> 17.86) + (> 17.86) Genscreen (C.O.Ic) NT - (0.04) - (0.67) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I) - (0.14) + (0.40) + (3.57) + (15.17) + (20.83) + (22.57) VIDAS HIV DUO II(TV) B WWRB302-26 NT - (0.07) - (0.16) + ( 3.12) + (11.07) NT VIDUS HIV DUO (TV) - (0.61) + (3.16) + (> 16.99) + (> 17.86) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.05) - (0.50) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I) - (0.15) + (0.55) + (4.19) + (16.80) + (21.19) + (23.46) VIDAS HIV DUO II(TV) C WWRB302-12 NT NT - (0.12) + ( 2.59) + (10.91) NT VIDUS HIV DUO (TV) - (0.54) + (2.44) + (> 16.56) + (> 17.86) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.04) - (0.15) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I) - (0.12) - (0.12) - (0.23) + ( 1.42) + ( 7.64) + (12.43) VIDAS HIV DUO II(TV) D WWRB302-14 NT NT - (0.09) - ( 0.19) + ( 2.82) NT VIDUS HIV DUO (TV) NT - (0.32) - (0.54) + ( 2.37) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.03) - (0.04) + ( 1.35) + (> 6.10) NT Enzygnost(C.O.I) - (0.11) - (0.13) + (0.39) + ( 3.04) + (11.47) + (17.58) VIDAS HIV DUO II(TV) E WWRB302-23 NT NT - (0.12) + ( 1.72) + ( 9.79) NT VIDUS HIV DUO (TV) NT - (0.81) + (6.30) + (> 17.86) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.04) - (0.21) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I) - (0.13) + (0.36) + (2.63) + (14.30) + (21.27) + (22.87) VIDAS HIV DUO II(TV) F WWRB302-28 NT NT - (0.14) + ( 2.17) + (10.43) NT VIDUS HIV DUO (TV) - (0.42) + (1.43) + (10.37) + (> 17.86) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.05) - (0.24) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I) - (0.23) + (1.40) + (9.02) + (18.85) + (20.54) + (20.44) VIDAS HIV DUO II(TV) G WWRB302-04 NT - (0.08) + (0.35) + ( 4.94) + (10.98) NT VIDUS HIV DUO (TV) - (0.48) + (2.14) + (> 15.27) + (> 17.86) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.07) + (1.72) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I) - (0.11) - (0.10) - (0.12) - ( 0.13) + ( 0.38) + ( 2.17) VIDAS HIV DUO II(TV) O WWRB302-01 NT NT NT NT - ( 0.20) + ( 2.48) VIDUS HIV DUO (TV) NT - (0.32) - (0.34) + ( 1.04) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.04) - (0.07) + ( 1.23) + (> 6.10) + (> 6.10) Enzygnost(C.O.I) - (0.11) - (0.16) + (0.65) + (13.47) + (23.88) + (24.92) VIDAS HIV DUO II(TV) HIV-2 WWRB302-11 NT NT - (0.11) + ( 1.84) + ( 9.49) NT VIDUS HIV DUO (TV) NT - (0.36) - (0.45) + (11.79) + (> 17.86) + (> 17.86) Genscreen (C.O.I) NT - (0.20) + (2.97) + (> 6.10) + (> 6.10) NT Enzygnost(C.O.I)
aTV:testvalue < 0.25:Negative,≧ 0.25:Positive
bTV:testvalue < 0.25:Negative,0.25≦ TV< 0.35:Borderline,≧ 0.35:Positive cC.O.I.:cutoffindex dNT:nottested 945),BA(PRB951),BB(PRB952),BC(PRB953), BD(PRB954),BE(PRB955)の計 10 パネルを使用 し,検討試薬および対照試薬の感染初期検出感度の比 較を行った. 成 績 1.感度,特異性の検討 HIV 陽性者血漿 131 例をバイダスデュオ II で測定 した結果,131 例すべてが陽性となり,感度は 100% であった.HIV 陰性検体血漿 1228 例をバイダスデュ オ II で測定した結果,1,225 例が陰性,3 例が陽性と 判定された(Table 2).3 例はバイダスデュオ II によ る再検査においても陽性であったが,他の抗原抗体同 時検査試薬,抗体検査法(PA 法,WB 法)および NAT 法による再検査ではすべて陰性であった(Table 3). 従って,この 3 例はバイダスデュオ II による偽陽性 によるものであることが分かった.特異性は 99.8%(偽 陽性率 0.2%)であった. 2.従来品偽陽性検体を用いた検討 バイダスデュオにより陽性反応を示したが,PA 法, NAT 法により HIV 陰性が確認された検体 13 例につ いてバイダスデュオ II で測定を行ったところ,12 例 が陰性,1 例が陽性となった.バイダスデュオの偽陽 性検体はバイダスデュオ II では大部分が陰性となる ことが分かった(Table 4).
Table 7 Resultsofantigen-antibody detection assaysand antibody assay on HIV p24 Antigen Mixed TiterPer -formance Panel(PRA201)
Antibody assay Antigen assay
Antigen-antibody detection assay PRA201 PA (GENEDIA HIV 1/2 Mix) EIA (AbbottHIV p24 Antigen)d Enzygnost HIV Integral Genscreen PlusHIV Ag-Ab VIDAS HIV DUO VIDAS HIV DUO II group No. + + + + + + earlya 1 + + + + + + highb 2 + + + + + + early 3 + + + + + + high 4 - + + + + + early 5 + + + + + + high 6 - - - - - - negativec 7 + + + + + + early 8 + + + + + + high 9 + + + + + + early 10 + + + + + + high 11 + + + + + + early 12 + + + + + + high 13 + + + + + + high 14 + + + + + + high 15 - - - - - - negative 16 - + + + + + early 17 + + + + + + early 18 + + + + + + early 19 + + + + + + high 20
aEarly seroconversion sample bHigh titerantibody sample cNegative controlsample dData from paneldata sheet
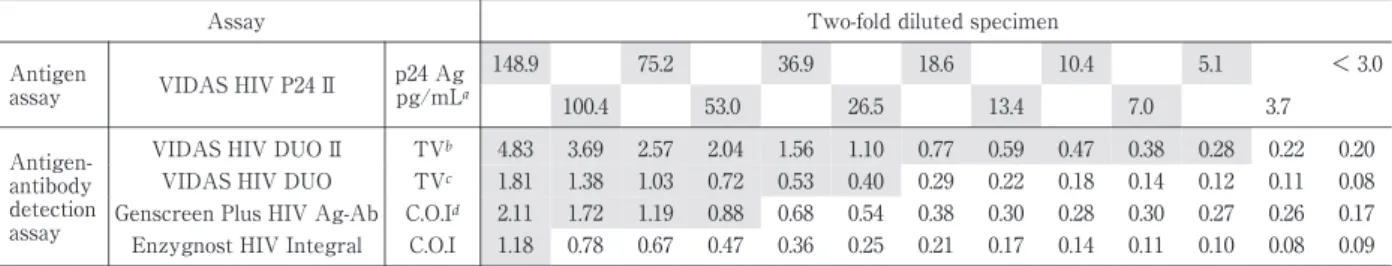
Table 8 Comparison ofHIV p24 antigen detection limitusing two-fold diluted specimensofcultured isolate HIV-1IIIB
Two-fold diluted specimen Assay < 3.0 5.1 10.4 18.6 36.9 75.2 148.9 p24 Ag pg/mLa VIDAS HIV P24 II Antigen assay 100.4 53.0 26.5 13.4 7.0 3.7 0.20 0.22 0.28 0.38 0.47 0.59 0.77 1.10 1.56 2.04 2.57 3.69 4.83 TVb VIDAS HIV DUO II Anti gen-antibody detection assay 0.08 0.11 0.12 0.14 0.18 0.22 0.29 0.40 0.53 0.72 1.03 1.38 1.81 TVc VIDAS HIV DUO 0.17 0.26 0.27 0.30 0.28 0.30 0.38 0.54 0.68 0.88 1.19 1.72 2.11 C.O.Id
Genscreen PlusHIV Ag-Ab
0.09 0.08 0.10 0.11 0.14 0.17 0.21 0.25 0.36 0.47 0.67 0.78 1.18 C.O.I EnzygnostHIV Integral
ap24 Ag pg/mL:< 3.0:Negative,≧ 3.0 and < 5.0:Equivocal,≧ 5.0:Positive bTV:testvalue < 0.25:Negative,≧ 0.25:Positive
cTV:testvalue < 0.25:Negative,0.25≦ TV< 0.35:Borderline,≧ 0.35:Positive dC.O.I.:cutoffindex 3.HIV ジェノタイプ別の反応性の検討 WWRB 302 を用いて,HIV-1 グループ M のサブタ イプ A,B,B’,C,D,A!E,F,G,B!D,グルー プ O,HIV-2 の反応性を見たところ,すべてのジェノ タイプで陽性となった.パネル中の 2 例の陰性検体は 陰性となった(Table 5).ジェンスクリーンに関して は,既報 6)において,陰性検体の WWRB302-10 が 陽性反応を示したと報告したが,今回の検査において は陰性が確認された. 4.HIV ジェノタイプ別の抗体検出感度の比較 WWRB 302 パネルの各ジェノタイプを 106 倍まで 10 倍階段希釈し,検討試薬および対照抗原抗体同時 検出試薬で測定を行ったところ,HIV-1 サブタイプ A,B,C,E,F,G に関してはバイダスデュオ II と ジェンスクリーンがバイダスデュオとエンザイグノス トより 10∼100 倍抗体検出感度が高く,サブタイプ D については同程度,グループ O についてはジェンス クリーンとエンザイグノストがバイダスデュオ II よ り 10 倍感度が高かった.HIV-2 についてはバイダス デュオ II とエンザイグノストがバイダスデュオと ジェンスクリーンより 10 倍感度が高かった(Table 6). 5.HIV-1 p24 抗原の反応性の検討 様々な力価の抗原・抗体を含んだパネル検体である
Table 9 Comparison ofantigen detection limitsby antigen-antibody detection assaysusing 3 antigen-positive specimensin the panel p24 antigen detection limits 1:128 1:64 1:32 1:16 1:8 1:4 1:2 1:1 Antigen-antibody
detection assay PanelNo. Ag volume 4.0pg/mL 0.21 0.32 0.47 0.89 1.53 3.01 5.55 9.84 TVa VIDAS HIV DUO II PRB936-04 (AK) 256.2pg/mL - + + + + + + + judge 32.0pg/mL NT NTd 0.12 0.20 0.37 0.62 1.97 2.30 TVb VIDAS HIV DUO judge + + + + - - 32.0pg/mL NT NT 0.55 0.77 1.20 2.06 3.56 5.63 C.O.Ic Genscreen Plus HIV Ag-Ab judge + + + + - - 128.1pg/mL NT NT 0.21 0.38 0.64 0.90 2.32 4.52 C.O.I EnzygnostHIV Integral judge + + ± - - - 7.1pg/mL 0.13 0.15 0.23 0.31 0.56 0.98 1.69 3.27 TV VIDAS HIV DUO II PRA201-05 113.0pg/mL - - - + + + + + judge 56.5pg/mL NT NT NT NT 0.14 0.20 0.35 0.89 TV VIDAS HIV DUO judge + + - - 56.5pg/mL NT NT NT 0.50 0.64 0.99 1.54 2.51 C.O.I Genscreen HIV Ag-Ab judge + + ± - - 113.0pg/mL NT NT NT NT 0.19 0.34 0.63 1.58 C.O.I EnzygnostHIV Integral judge + - - - 5.0pg/mL NT 0.17 0.22 0.28 0.45 0.84 1.58 2.98 TV VIDAS HIV DUO II PRA201-17 79.3pg/mL - - + + + + + judge 79.3pg/mL NT NT NT NT 0.11 0.19 0.30 0.82 TV VIDAS HIV DUO judge + ± - - 39.7pg/mL NT NT NT 0.53 0.66 0.89 1.50 2.52 C.O.I Genscreen HIV Ag-Ab judge + + - - - 79.3pg/mL NT NT NT NT 0.19 0.36 0.78 1.77 C.O.I EnzygnostHIV Integral judge + - - -
aTV:testvalue < 0.25:Negative,≧ 0.25:Positive
bTV:testvalue < 0.25:Negative,0.25≦ TV< 0.35:Borderline,≧ 0.35:Positive cC.O.I.:cutoffindex
dNT:nottested
HIV p24 Antigen Mixed Titer Performance Panel (PRA201)を用いて反応性の検討を行ったところ,バ イダスデュオ II は陰性検体である PRA201-7,-16 以外 はすべて陽性となり,他の抗原抗体検出試薬とも結果 が一致した.抗体検出試薬の PA 法では PRA201-7,-16 に加え,PRA201-5,-17 も陰性となった.PA 法で検出 できなかった PRA201-5,-17 は抗体出現前の p24 抗原 陽性期の検体であった(Table 7). 6.HIV-1 p24 抗原の検出感度の比較
HIV-1 IIIB 培養上清をバイダス P24II で測定し,p24 濃度が約 150pg!mL および約 100pg!mL になるよう に調製した試料を母液として 2 倍階段希釈系列試料を 作成し,検討試薬および対照抗原抗体同時検出試薬の 抗原検出感度の比較を行った.バイダスデュオ II は p24 濃度が 5.1pg!mL まで陽性となった.他の抗原抗 体同時検出試薬では,バイダスデュオは 26.5pg!mL, ジェンスクリーンは 53.0pg!mL,エンザイグノスト は 148.9pg!mL まで陽性となった(Table 8). また,血漿検体として,HIV-1 Seroconversion Panel AK(PRB936)および HIV p24 Antigen Mixed Titer Performance Panel(PRA201)の中から,抗体出現 前で抗原 の み 陽 性 で あ る PRB936-04,PRA201-05, PRA201-17 の 3 検体を用いて,HIV 陰性プール血漿 で 2 倍階段希釈系列試料を作成し,検討試薬および対 照抗原抗体同時検出試薬の p24 抗原の検出感度を比 較したところ,バイダスデュオ II の抗原検出限界は 4.0∼7.1pg!mL(平均 5.4pg!mL),バイダスデュオは 32.0∼79.3pg!mL(平均 55.9pg!mL),ジェンスクリー ン で は 32.0∼56.5pg!mL(平 均 42.7pg!mL),エ ン ザ イグノストでは 79.3∼128.1pg!mL(平均 106.8pg!mL) であった(Table 9). 7.HIV 感染初期検出感度の比較 HIV 感染初期に経時的に採血されたパネルである HIV-1 Seroconversion Panel AK(PRB936),AL(PRB 937),AM(PRB938),AN(PRB939(E)),AU(PRB 945),BA(PRB951),BB(PRB952),BC(PRB953), BD(PRB954),BE(PRB955)の計 10 パネルを使用 し,検討試薬および対照試薬の感染初期検出感度の比 較を行ったところ,バイダスデュオ II は 9 パネルに おいて抗体検査法の陽性時期より 1∼3 採血日早く検 出が可能であった.NAT 法との比較では,2 パネル では NAT 法と同時期から陽性となり,残りの 8 パネ ルでは 1∼2 採血日(最短で 2 日,最長で 7 日)遅れ て陽性となった.抗原抗体同時検出試薬で比較すると,
Table 10 Comparison ofthe performance ofHIV antigen-antibody detection assay,antigen assay,nucleicacid test(NAT)and an-tibody assay on 10 HIV-1 Seroconversion Panels
Antibody assay NAT
Antigen assay Antigen-antibody detection assay
Days since
1st bleed
PanelNo. EIA (Abbott
HIV 1/2)a PA (GENEDIA HIV 1/2 Mix) Roche RNA RT-PCRa Abbott HIVAga VIDAS HIV P24 II Enzygnost HIV Integral Genscreen PlusHIVAg-Ab VIDAS HIV DUO VIDAS HIV DUO II judge judge judge judge pg/mLe judge C.O.I judge C.O.Id judge TVc judge TVb - - - - NT - 0.08 - 0.52 NTf NT - 0.11 0 PRB936-01 - - + - < 3.0 - 0.11 - 0.44 - 0.11 - 0.12 5 (AK)02 - - + - < 3.0 - 0.05 - 0.45 - 0.07 - 0.15 7 03 - - + + 256.2 + 4.52 + 5.63 + 2.30 + 9.84 12 04 - - + + > 400 + > 6.10 + 14.86 + 5.96 + 16.64 14 05 + + + + > 400 + > 6.10 + > 20.27 + 11.11 + 22.26 19 06 + + + + > 400 + > 6.10 + > 20.27 + 8.27 + 17.00 21 07 - - - - NT - 0.05 - 0.32 NT NT - 0.10 0 PRB937-01 - - + - < 3.0 - 0.05 - 0.34 - 0.08 - 0.11 7 (AL)02 - - + - < 3.0 - 0.05 - 0.38 - 0.10 - 0.11 9 03 - - + + 39.7 - 0.26 + 1.17 + 0.38 + 1.35 14 04 - - + + 41.7 - 0.40 + 1.59 + 0.50 + 2.12 16 05 + ± + + 150.0 + 2.51 + 9.50 + 1.82 + 8.95 21 06 - - + + 31.0 - 0.65 + 1.02 ± 0.28 + 1.08 0 PRB938-01 - - + + 171.0 + 2.49 + 3.80 + 0.85 + 5.20 3 (AM)02 + + + + > 400.0 + > 6.05 + > 20.27 + 5.91 + 19.16 9 03 - - - - < 3.0 - 0.06 - 0.36 - 0.06 - 0.11 9 PRB939 (E)-04 - - + - < 3.0 - 0.09 - 0.36 - 0.05 - 0.13 14 (AN)05 - - + - 9.3 - 0.19 - 0.55 - 0.09 + 0.45 16 06 - - + + > 400.0 + > 6.05 + 10.91 + 3.57 + 13.40 21 07 - - + + > 400.0 + > 6.05 + 18.07 + 6.15 + 18.14 23 08 + + + - < 3.0 + > 6.05 + > 20.27 + 16.28 + 15.68 103 09 - - - - < 3.0 - 0.05 - 0.35 - 0.03 - 0.18 3 PRB945-02 - - + - < 3.0 - 0.08 - 0.46 - 0.09 - 0.24 7 (AU)03 + - + + 52.5 + 1.43 + 3.66 + 0.79 + 2.35 13 04 + + + + 94.5 + > 4.0 + > 14.3 + 1.26 + 4.98 15 05 + + + + 60.9 + > 4.0 + > 14.3 + 9.16 + 7.49 20 06 - - - - < 3.0 - 0.06 - 0.35 - 0.02 - 0.10 2 PRB951-02 - - + + 17.9 - 0.19 - 0.59 ± 0.26 + 0.65 8 (BA)03 - - + + 186.3 + 1.38 + 2.91 + 2.33 + 6.34 11 04 - - + + > 400.0 + > 4.0 + > 14.3 + 8.87 + 17.98 15 05 + + + + > 400.0 + > 4.0 + > 14.3 + 6.21 + 14.41 19 06 - - - - < 3.0 - 0.06 - 0.44 - 0.04 - 0.11 0 PRB952-01 - - + - < 3.0 - 0.08 - 0.59 - 0.05 - 0.15 7 (BB)02 - - + + 39.9 - 0.49 + 1.59 + 0.58 + 1.66 10 03 + + + + 17.7 - 0.46 + 5.22 ± 0.31 + 0.69 14 04 + + + - < 3.0 + 3.53 + > 14.3 - 0.14 + 0.77 17 05 + + + - < 3.0 + > 4.0 + > 14.3 + 4.25 + 0.86 21 06 - - + - < 3.0 - 0.06 - 0.43 - 0.04 - 0.12 0 PRB953-01 - - + - 3.3 - 0.13 - 0.42 - 0.08 + 0.27 3 (BC)02 + - + + 44.8 - 0.81 + 1.77 + 0.52 + 1.75 7 03 + + + + 92.3 + > 4.0 + > 13.0 + 1.60 + 4.32 10 04 - - - - < 3.0 - 0.07 - 0.42 - 0.08 - 0.18 7 PRB954-03 - - + - < 3.0 - 0.06 - 0.26 - 0.07 - 0.11 10 (BD)04 - - + - < 3.0 - 0.06 - 0.32 - 0.12 - 0.23 14 05 - - + + 35.1 - 0.20 - 0.80 + 0.57 + 1.33 17 06 - ± + + > 400.0 + 3.45 + > 13.0 + 5.36 + 12.48 21 07 - - + - < 3.0 - 0.06 - 0.31 - 0.08 - 0.12 0 PRB955-01 - - + - 7.2 - 0.10 - 0.49 - 0.19 + 0.42 3 (BE)02 - - + + 81.7 - 0.35 + 2.11 + 1.13 + 2.76 7 03 + - + + 119.9 + 2.11 + 6.87 + 1.71 + 4.31 12 04 + + + + 119.5 + > 4.0 + > 13.0 + 4.81 + 5.49 14 05
aData from paneldata sheet
bTV:testvalue < 0.25:Negative,≧ 0.25:Positive
cTV:testvalue < 0.25:Negative,0.25≦ TV< 0.35:Borderline,≧ 0.35:Positive dC.O.I.:cutoffindex
ep24 Ag pg/mL:< 3.0:Negative,≧ 3.0 and < 5.0:Equivocal,≧ 5.0:Positive fNT:nottested
バイダスデュオ II はジェンスクリーンよりも 10 パネ ル中 5 パネルで 1 採血日早く検出が可能であり,エン ザイグノストよりも 10 パネル中 8 パネルで 1∼2 採血 日早く検出が可能であった.バイダスデュオとの比較 では,10 パネル中 5 パネルで 1 採血日早く検出が可 能であり,かつバイダスデュオで見られたパネル BB の抗 IgM 抗体陽性期のセカンドウインドウ検体(PRB 952-05)においてバイダスデュオ II では陽性となった (Table 10). 考 察 今回,ELFA 法を原理とした HIV 抗原抗体同時検 出試薬であるバイダスデュオ II について検討を行っ た.HIV 抗体陽性検体および HIV 陰性検体を用いて 検討した結果,感度は 100%,特異性は 99.8% と臨床 応用に十分な精度を有していることが分かった.従来 品であるバイダスデュオで偽陽性反応を示した検体を バイダスデュオ II で測定したところ,ほとんどの検 体で陰性となり偽陽性反応の交差出現はみられなかっ た.これは従来品では HIV-1 抗体検出系に gp41 合成 ペプチドを使用していたが,改良品では gp160 蛋白 抗原を使用したこと,また抗 HIV 抗体検出系におい て標識抗原サンドイッチ法を用いたことで特異性が向 上したと考えられる.各ジェノタイプとの反応性は HIV-1 グループ M のサブタイプ A,B,B’,C,D, A!E,F,G,B!D,グループ O,HIV-2 においてす べての検出が可能であった.ジェノタイプ別の抗体検 出感度は,他の抗原抗体同時検出試薬と比較して A, B,C,A!E,F,G,B!D,HIV-2 で は 10∼100 倍 感 度が良かった.HIV-1 p24 抗原の検出感度の比較では, バイダスデュオ II は約 5pg!mL から検出が可能であ り,他の抗原抗体同時検出試薬よりも 8∼32 倍検出感 度が高いことが分かった.また,感染初期セロコンバー ジョンパネルを用いた感染初期検出感度の比較では, バイダスデュオ II は他の抗原抗体同時検出試薬と同 等あるいはより早い時期から検出が可能であり,また 従来品では検出できなかった抗 IgM 抗体の検出も可 能となったことから,p24 抗原が検出限界以下となり, 抗 IgG 抗体が検出されるようになるまでの期間であ るセカンドウインドウ期が解消されていることが確認 できた.以上の結果から,バイダスデュオ II は抗原 検出感度,抗体検出感度ともに他の抗原抗体同時検出 試薬よりも優れており,スクリーニング検査法として 極めて有用であることが分かった. 本法は検体を検体ウェルに加えて専用自動測定装置 にセットするだけで 80 分後には結果が得られ,極め て操作が簡便であり,かつ感染初期検出感度や特異性 の結果からも非常に精度が高い検査試薬であることが 分かった.検体測定は最大 60 検体まで同時測定可能 なバイダス専用装置があり,1 検体のみの単独測定も 可能である.キャリブレーションおよびコントロール による精度管理は,2 週間に一度に行うことで検体毎 の測定は必要がなく,1 検体から必要時に随時測定が 可能である. HIV 抗原抗体同時検出試薬は,抗 HIV 抗体に加え, HIV-1 p24 抗原も検出可能なことから,従来の抗体検 査試薬のウインドウ期をさらに 4 日程度短縮が可能で あり,HIV 感染の早期診断に有効な方法となってい る.ただし,抗原抗体同時検出試薬で陽性となった場 合,確認検査の WB 法で陽性であれば HIV 陽性が確 認できるが,WB 法が陰性であった場合,抗体出現前 の HIV-1 p24 抗原を検出している可能性があるため, 確認検査としてさらに NAT 法が必要となる.日本に おける HIV 感染者の割合は,例えば妊婦集団の場合, HIV 陽性率は約 0.02% であり11) ,スクリーニング検 査試薬の偽陽性率は約 0.2% であることから,妊婦ス クリーニング検査においては,スクリーニング検査陽 性の 10 人に 9 人は偽陽性例と推測される.これらの 検体については確認のため NAT 法を実施する必要が あり,受検者には心理的負担や費用負担が課されるこ とになる.バイダスデュオ II は他のスクリーニング 検査試薬と比較して感染初期検出感度に優れているこ とから,他のスクリーニング検査法で陽性となった検 体についてバイダスデュオ II を用いて 2 次検査を実 施することで,感染初期例か偽陽性例かの判別ができ, 偽陽性例の大部分を除外できる可能性も示唆された. 今後,偽陽性例をスクリーニング検査の段階で除外す ることが可能な HIV スクリーニング検査のアルゴリ ズムについても検討していきたいと考えている. 本研究は,厚生労働科学研究費補助金エイズ対策推進事 業「HIV 検査体制の構築に関する研究」の一環として行っ たものである.本研究の実施にあたり,ご協力くださいま した厚木市立病院泌尿器科の岩室紳也先生に深謝いたしま す. 文 献
1)Saville RD, Constantine NT, Cleghorn FR, Jack N, Bartholomew C, Edwards J, et al.:Fourth-Generation Enzyme-Linked Immunosorbent As-say for the Simultaneous Detection of Human Immunodeficiency Virus Antigen and Antibody. J Clin Microbiol 2001;39:2518―24.
2)Weber B, Berger A, Rabenau H, Doerr HW: Evaluation of a New Combined Antigen and Antibody Human Immunodeficiency Virus Screening Assay, VIDAS HIV DUO Ultra. J Clin Microbiol 2002;40:1420―6.
3)Ly TD, Marin Lynn, Daghfal D, Sandridge A, West D, Bristow R, et al.:Seven Human Immu-nodeficiency Virus (HIV) Antigen-Antibody
Combination Assays : Evaluation of HIV Sero-conversion Sensitivity and Subtype Detection. J Clin Microbiol 2001;39:3122―8.
4)Weber B, G rtler L, Thorstensson R, Michl U, M hlbacher A, B rgisser P, et al.:Multicenter Evaluation of a New Automated Fourth-Generation Human Immunodeficiency Virus Screening Assay with a Sensitive Antigen De-tection Module and High Specificity. J Clin Mi-crobiol 2002;40:1938―46. 5)林 孝子,渡邉寿美,近藤真規子,斎藤隆行,今 井 光 信:HIV 抗 体・抗 原 の 同 時 測 定 試 薬 の 検 討―HIV 抗体検査キットとの比較―.感染症誌 1999;73:681―8. 6)嶋 貴子,近藤真規子,斎藤隆行,川田かおる, 伊藤 章,坂本光男,他:マイクロプレート法 に よ る HIV-1 抗 体,HIV-2 抗 体 お よ び HIVp24 抗原検出用キット(HIV 抗原抗体同時検出キッ ト)の検討.感染症誌 2001;75:1014―24. 7)嶋 貴子,林 孝子,近藤真規子,斎藤隆行,川 田かおる,伊藤 章,他:マイクロプレートを 用いた HIV 抗原抗体同時検出試薬の検討.医学 と薬学 2000;43:1131―40. 8)林 孝子,斎藤隆行,近藤真規子,渡邉寿美,今 井光信:蛍光免疫測定法による HIVp24 抗原検 出キットの評価.感染症誌 2000;74:709―15. 9)Mulder J, Mckinney N, Christopherson C,
Shin-sky J, Greenfield L, Kwok S:Rapid and simple PCR assay for quantitation of human immu-nodeficiency virus type 1 RNA in plasma : Ap-plication to acute retroviral infection. J Clin Mi-crobiol 1994;32:292―300. 10)林 孝子,近藤真規子,島崎 緑,植田昌宏,今 井光信:プール検体の遠心濃縮法による HIV ス ク リ ー ニ ン グ 遺 伝 子 検 査 の 検 討.感 染 症 誌 2000;74:82―3. 11)嶋 貴 子,今 井 光 信,谷 口 晴 記,早 川 智,外 川正生,塚原優己,他:妊婦集団における HIV スクリーニング検査の偽陽性出現率に関する調 査.第 80 回日本感染症学会総会学術 講 演 抄 録 337.2006.
Evaluation of New Fourth-Generation Human Immunodeficiency Virus Antigen and Antibody Detection Assay with Enzyme-Linked Fluorescent Immunoassay Takako SHIMA1)2)
, Koji SUDO1)
, Makiko KONDO1)
, Hanako KURAI3)
, Hiroko SAGARA3)
& Mitsunobu IMAI1) 1)Department of Biology, Kanagawa Prefectural Institute of Public Health,2)Department of Health Care Management
and Planning, Tokyo Medical and Dental University, Graduate School of Medical and Dental Science,3)Department of
Infectious Diseases, Yokohama Municipal Citizen s Hospital
We evaluated the fourth-generation HIV screening assay VIDAS HIV DUOII (DUOII) based on ELFA for simultaneous detection of anti-HIV-1 and anti-HIV-2 antibodies and HIV-1 p24 antigen through compari-son with other HIV antigen-antibody detection assays.
Materials were 1228 HIV-negative specimens, 95 HIV-antibody-positive specimens, and HIV commercial panels. The specificity of DUOII was 99.8% and sensitivity 100%, detecting all of HIV-1 group M subtype A, B, B’,C, D, A!E, F, G, B!D, HIV-1 group O, and HIV-2. The sensitivity test to HIV-1 p24 antigen was 5pg! mL, higher than other assays. DUOII was equivalent to or superior in detecting results earlier than other assays in an evaluation using 10 commercial HIV-1 seroconversion panels of primary infection. DUOII de-tects anti-HIV IgM antibody, so no negative sample was found in the second window between p24 antigen disappearance and raised anti-HIV IgG antibody.
DUOII has sufficient specificity and sensitivity for HIV screening, and detects primary infection sooner than other assays. These results indicate that DUOII is useful and reliable in HIV screening.