肺の表面に存在する界面活性タンパク質のラジカル酸化反応の研究
(京大・白眉1,京大・生存研2,JST・さきがけ3)江波進一1,2,3Interfacial radical oxidation of a human surfactant protein
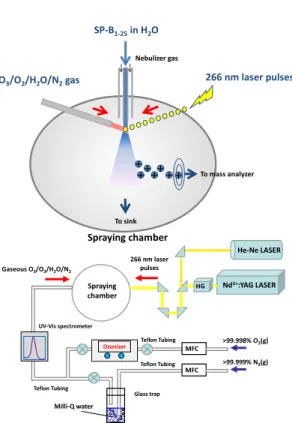
(The Hakubi Center, Kyoto Univ.1,RISH, Kyoto Univ.2,PRESTO, JST3)Shinichi Enami1,2,3 [序] 人間が PM2.5 やオゾンなどの大気汚染物質を吸い込むと肺の表面にヒドロキシルラ ジカル(OH ラジカル)が発生することが知られている。我々の肺は厚さ約 100nm の肺上皮 被覆液(ELF)で守られている。ELF にはアスコルビン酸、尿酸、グルタチオン、トコフェ ロールなどの抗酸化物質1-4のほかに、界面活性タンパク質(SP)が含まれている。SP は肺胞 の虚脱を防ぐなど、生命維持に必須のタンパク質であるが、大気汚染物質により発生する OH ラジカルとどのように反応し、その機能が失活しているかはわかっていない。本研究で はレーザーと質量分析法を組み合わせた画期的な界面ラジカル反応測定手法を用いて、SP のモデルペプチドであるSP-B1-25とOH ラジカルの気液界面反応のメカニズムの解明を行 った。 [ 実 験 ] 界 面 活 性 タ ン パ ク 質 SP-B の モ デ ル ペ プ チ ド で あ る SP-B1-25(NH2-1FPIPLPYCWLCRALIKRIQAMIPK25G-COOH, MW = 2928 Da)を含む水 のマイクロジェットを作り、そのほぼ垂直方 向からオゾンと水蒸気を含む混合ガスを放射 する(図1)。また同時にパルスレーザー光(266 nm, YAG 4 倍波)を照射することによって OH ラジカルをその場で発生させる5。 O3 (g) + 266nm → O(1D) + O2 O(1D) + H2O → 2OH(g)
OH(g) + SP-B1-25(aq) → products
空気/マイクロジェットの気液界面でラジカル 反応が起きた後、マイクロジェットはすぐに ネブライザーガスによって分解し、マイクロ メートル以下のサイズの微小液滴となり、最 終的に気相にイオンを放出する。その間約 10~50 マイクロ秒である。その過程で マイクロジェットの気液界面に存在す Gaseous O3/O2/H2O/N2 Ozonizer MFC >99.999% N2(g) Milli-Q water Teflon Tubing Teflon Tubing Glass trap MFC >99.998% O2(g) Teflon Tubing Nd3+:YAG LASER Spraying chamber 266 nm laser pulses HG He-Ne LASER UV-Vis spectrometer To sink To mass analyzer SP-B1-25in H2O
O3/O2/H2O/N2gas 266 nm laser pulses Nebulizer gas Spraying chamber ++ ++ + + +
図 1 Schematic diagram of setup used to study laser-induced radical reactions at the air-water interface.
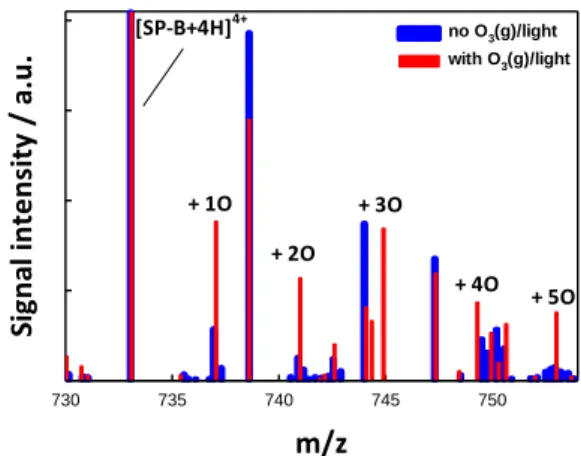
る反応物・生成物のイオンが質量分析法で検出さ れる5。 [結果と考察] SP-B1-25を含むマイクロジェット に混合ガス/266nm を放射しないとき(青)、放射 したとき(赤)の質量スペクトルを図2 に示す。 OH ラジカルとの反応で酸素原子が 1 から 5 個ま で付加した中間体・生成物が生成することがわか る。266nm のレーザー強度、オゾン濃度を変化さ せる実験結果などから、これらの中間体・生成物 はトリプトファン基とシステイン基にOH が反応 し、O 原子が付加した化合物であることがわかっ た。特に後者の中間体はシステインスルフェン酸6であることが示唆される。システインス ルフェン酸はジスルフィド結合を結ぶため、本来のSP の機能が失われている可能性が高い。 本講演では気液界面特有のラジカル酸化メカニズムについても議論する。本研究によって、 オゾンやPM2.5 などの大気汚染物質を吸引したときに肺の表面に生成する OH ラジカルに よる界面活性タンパク質の分子レベルでの変質メカニズムが一部解明された。 [参考文献]
1 Enami, S., Hoffmann, M. R. & Colussi, A. J. Acidity enhances the formation of a persistent ozonide at aqueous ascorbate/ozone gas interfaces. Proc. Natl. Acad. Sci. U. S. A. 105, 7365-7369, doi:10.1073/pnas.0710791105 (2008).
2 Enami, S., Hoffmann, A. R. & Colussi, A. J. Ozonolysis of uric acid at the air/water interface. J. Phys. Chem. B 112, 4153-4156 (2008).
3 Enami, S., Hoffmann, M. R. & Colussi, A. J. Ozone Oxidizes Glutathione to a Sulfonic Acid. Chem. Res. Toxicol. 22, 35-40, doi:10.1021/tx800298j (2009).
4 Enami, S., Hoffmann, M. R. & Colussi, A. J. How phenol and alpha-tocopherol react with ambient ozone at gas/liquid interfaces. J. Phys. Chem. A 113, 7002-7010, doi:10.1021/jp901712k (2009).
5 Enami, S., Hoffmann, M. R. & Colussi, A. J. In Situ Mass Spectrometric Detection of Interfacial Intermediates in the Oxidation of RCOOH(aq) by Gas-Phase OH-Radicals. J. Phys. Chem. A 118, 4130-4137, doi:10.1021/jp503387e (2014). 6 Enami, S., Hoffmann, M. R. & Colussi, A. J. Simultaneous detection of cysteine
sulfenate, sulfinate, and sulfonate during cysteine interfacial ozonolysis. J. Phys. Chem. B 113, 9356-9358, doi:10.1021/jp904316n (2009).
図 2 Positive ion mass spectra of 43 M SP-B1-25 aqueous microjets (blue) or exposed to 500 ppmv O3(g) in O2(g)/H2O(g)/N2(g) mixtures with 266 nm pulses (red).
m/z 730 735 740 745 750 Sig n al in te n sit y / a. u
. no Owith O3(g)/light3(g)/light
+ 1O + 2O
+ 3O
+ 4O + 5O [SP-B+4H]4+
光合成反応中心の初期電荷分離過程に伴う
立体構造変化:時間分解 EPR 法による解析
(神戸大院理
1, シカゴ大化学
2) 小堀康博
1,
Nina Ponomarenko
2James R. Norris Jr.
2Time-resolved EPR study on cofactor geometries after primary
charge-separation in the photosynthetic reaction center
(Kobe Univ.
1, Univ. of Chicago
2) Yasuhiro Kobori
1, Nina Ponomarenko
2James R. Norris Jr.
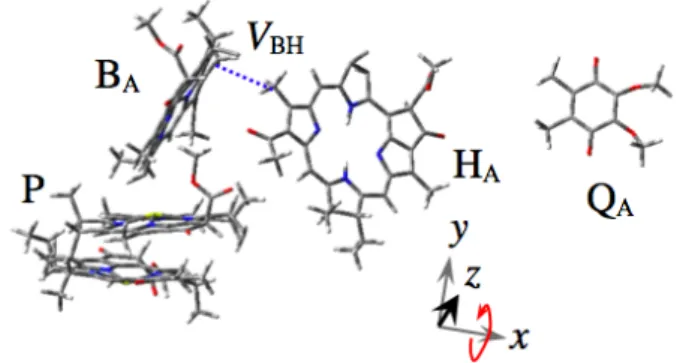
2 【序】光合成反応中心(PRC)は、クロロフ ィル二量体からなるスペシャルペア(P)の 一重項励起状態から、複数の電子受容体に 次々と電子を伝達する膜タンパク質であ る。紅色細菌 Rhodobacter sphearoides に は、色素分子であるバクテリオクロロフィ ル(B), バクテリオフェオフィチン(H), お よびキノン分子(Q)が二回軸対称性を持っ た二つのブランチとしてポリペプチド鎖 にバインドしているが、このうちの A 経路 のみが電子伝達に使われることが古くから 知られており、この原因の解明に向けて 様々な基礎研究がなされてきた。A 経路で は、初期電荷分離状態とよばれる P+· HA–· が効率よく生成する。近年では、この電荷 分離状態の生成は、1 P*BAHA → P+·BA–·HA → P+· BAHA–·による段階的電子移動機構が有力となっている。1上の各電荷分離ステップにお いて、マーカス理論に基づき電子的相互作用(それぞれ、1 VP*Bおよび VBH)2が議論されてきた (Figure 1)。例えば VBHにおいては、BAのπ*軌道と HAのメチル基によるσ*軌道との重なりが 電子によるトンネリングのルートとして重要な役割を果たすと考えられている。3このような 光合成タンパク質による高効率な光エネルギー変換機構を解明するためには、P+· HA–·による 電荷再結合過程について、立体構造と電子的相互作用(VCR)を特徴付けることが極めて重要で ある。Michel-Beyerle ら4は、P+· HA–·による三重項電荷再結合速度の解析を行い電子的相互作 用 VCR,T = 0.85 cm-1を報告した。しかしながら、初期電荷分離後にどのような立体構造変化 が起こり、それが VCRにどのような効果を与えるかについては未解明である。我々は、時間分解 EPR 法を用い、タンパク質中のキノン分子を還元処理した Rhodobacter sphearoides
R26 に生成する初期電荷分離状態と、その再結合過程で生成する励起三重項状態 3P*の時間 分解 EPR 信号を観測した。電子スピン分極の定量解析を行うことにより、P+· HA–·不対電子軌 道の立体構造とその一重項再結合 P+· BAHA–·→ 1P*BAHA(遅延蛍光)に対する電子的相互作用 VCR,Sを同時に求め、電荷分離構造が果たす電子的相互作用の役割を明らかにした。
Figure 1. Ground-state geometries of the A side cofactors in Rhodobacter sphearoides. x, y and z denote principal g-tensor axes in HA–·. The dotted line shows a
forward electron-tunneling route in the transfer integral,
VBH. Rotations of HA–· along the x-axis after the primary
CS could disrupt the route to weaken the coupling for the primary CR.
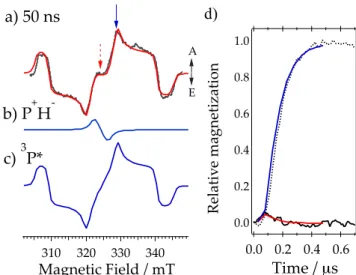
【結果と考察】Figure 2a にレーザー照 射 後 50 ns 後 に 観 測 さ れ た
Rhodobacter sphearoides R26 の時間
分解 EPR スペクトルを示す。この信号 は中心付近(Figure 2b)の A/E 型(A はマイクロ波の吸収、E は放出を表す。) 5を示す電荷分離状態 P+· HA–·と、スペク トル幅の広い A/E/E/A/A/E (Figure 2c) による励起三重項状態 3 P*の和として 説明される。P+· HA–·による電荷分離状態 の立体構造と電子的相互作用を決定す るために、電荷再結合を起こすラジカ ル対 P+· HA–·の一重項三重項スピン系 と再結合生成物である三重項スピン状 態 3 P*について量子準位分布と量子コ ヒーレンスの発展を確率リュービル方 程式で表し、P+· HA–·および3P*両者につ いて EPR 信号(横方向磁化)とその径時 変化の再現を行った。量子論に基づく 解析6,7から、次の点が明らかになった。 1) 初期電荷分離状態 P+· HA–·の一重 項三重項(S-T0)変換効率は、不対電子 によるスピン双極子間相互作用(d)の主 軸方向と、ラジカル P+·と H A–·が持つ超 微細結合テンソルの各主軸方向(Figure 1の x, y, z)に依存して大きな異方性を生じることから、T0状態を経た再結合過程で生成する 3 P*のスピン分極(Figure 2c)は P+·HA–·の立体配置に大きく依存する。 2) P+· HA–·の横方向磁化は一重項三重項間のエネルギー差を決める交換相互作用(2J)の大 きさによって強い影響を受ける。5 以上の性質から、一重項および三重項電荷再結合速度をそれぞれ考慮し、初期電荷分離状 態の立体配置と 2J をパラメータとして、P+· HA–·および 3P*両者の横方向磁化強度に対する外 部磁場(Figure 2a)と、各磁場における遅延時間依存性(Figure 2d)を再現した。この結果、P+· HA– ·の立体配置は Figure 1 に示された基底状態の立体配置と大きな変化がないことが明らかにな った。さらに電荷移動相互作用機構により、2J の値(-1.8 mT)から、P+· BAHA–·→ 1P*BAHA(遅 延蛍光)に対する電子的相互作用 VCR,S = 2.2 cm-1が決定された。この相互作用エネルギーは、 電荷分離後に軌道の重なりがわずかに増加したことを示しており、イオン対の生成でクーロ ン引力による微少な立体構造変化が起きたことが示唆される。 [文献]
(1) Huang, L. B. et al. P. Natl. Acad. Sci. USA 2012, 109, 4851-4856. (2) Tanaka, S.; Marcus, R. A. J. Phys. Chem. B 1997, 101, 5031-5045. (3) Hasegawa, J. Y.; Nakatsuji, H. Chem. Lett. 2005, 34, 1242-1243.
(4) Volk, M.; Michel-Beyerle, M. E. et al. J. Phys. Chem. B 1998, 102, 735-751. (5) Till, U.; Hore, P. J. et al. J. Phys. Chem. B 1997, 101, 10939-10948.
(6) Kobori, Y.; Noji, R.; Tsuganezawa, S. J. Phys. Chem. C 2013, 117, 1589-1599. (7) Miura, T.; Aikawa, M.; Kobori, Y. J. Phys. Chem. Lett. 2014, 5, 30-35.
d) 340 330 320 310 Magnetic.Field./.mT A E a).50.ns b).P+H> c).3P*
Figure 2. a) Time-resolved EPR spectrum at 50 ns after the laser excitation of the quinone-reduced PRC of the
Rhodobacter sphearoides R26 at 85 K. Computed spectra
are displayed at 50 ns for P+·H
A-· in b) and for 3P* in c)
with considering the quantum mechanical dynamics of the spin systems in which the hyperfine anisotropies and the spin-selective CR kinetics are considered applying geometries in Figure 1. The red line in a) is a sum of b) and c). d) Time-profiles (black solid line and dotted line) of the transient EPR signals measured at a center field position marked by a dotted arrow and at a higher field marked by a solid arrow in a), respectively. Corresponding calculated time-traces of the relative magnetizations are shown by the red and blue lines using 2J = -1.8 mT.
1.0 0.8 0.6 0.4 0.2 0.0 Relativ e/magnetization 0.6 0.4 0.2 0.0 Time///µs
バイオハイブリッド光合成アンテナ複合体
LH2-Alexa
における超高速エネルギー移動
(
1阪大基礎工・
2JST さきがけ・
3阪大ナノ・
4名工大)
○長澤 裕
1,2, 米田 勇祐
1, 片山 哲郎
2,3, 宮坂 博
1,
水谷
尚登
4, 野地 智康
4, 出羽 毅久
4Ultrafast energy transfer in
biohybrid photosynthetic antenna complex LH2-Alexa.
(
1Osaka university,
2JST PRESTO,
3Osaka Univ. Nano.,
4Nagoya Inst. Tech.)
○Nagasawa Yutaka
1,2, Yoneda Yusuke
1, Katayama, Tetsuro
2,3,
Miyasaka, Hiroshi
1, Mizutani, Naoto
4, Noji, Tomoyasu
4, Dewa, Takehisa
4【序】 紅色光合成細菌は、バクテリオクロロフィル (BChl)とカロチノイド(Car)を光捕集色素として含む2種 のアンテナ複合体light harvesting complex 1 (LH1)と 2 (LH2) を 持 ち 、 捕 集 さ れ た 光 エ ネ ル ギ ー は 反 応 中 心 reaction center (RC)に運ばれ、電子移動によって一連の光 合成反応が始まる[1]。LH1 と LH2 は、複数のサブユニッ トがリング状に会合した構造をしていて、より大きなリン グ構造の LH1 の中心に RC が取り込まれている。エネル ギー移動はLH2→LH1→RC の順に起こり、その時定数は 数~数十ピコ秒で、効率は100 %に近い[2]。Fig. 1 に示す LH2 は 2 種の BChl、B800 と B850 を含有し、B800 には 波長800 nm を中心に強い Qy吸収帯があり、より強く会 合したB850 は長波長シフトした 850 nm 中心の Qy吸収 帯を持つ。さらにCar は 400-550 nm の光を吸収するが、 BChl の QxとQy吸収帯のあいだの波長領域600-750 nm の吸光度は小さい(Fig. 2)。紅色細菌の生息環境に起因して LH2 がこのような波長特性を持つようになったと考えら れるが、600-750 nm の太陽光は光合成に効率的に利用されていない。人工光合成を実現する際には、 できる限り広い範囲の太陽光を利用することが要求されるであろう。LH2 に人工的に色素を付加した バイオハイブリッド材料を製作すれば、その吸収波長範囲を拡張することが可能だが、そのエネルギ ー移動効率を検証する必要がある。そこで我々は、650 nm 付近に強い吸収帯を持つ色素 Alexa Fluor 647 を LH2 に付加した LH2-Alexa 結合体を製作し、Alexa から LH2 内の BChl へのエネルギー移動 ダイナミクスをフェムト秒過渡吸収(TA)分光法により直接的に観測した。 Fig. 1. 光合成紅色細菌の光捕集アンテナ 複合体LH2 のリング構造。 Fig. 2. LH2-Alexa 結合体とその構成要素 のLH2 と Alexa Fluor 647 の定常吸収ス ペクトル。
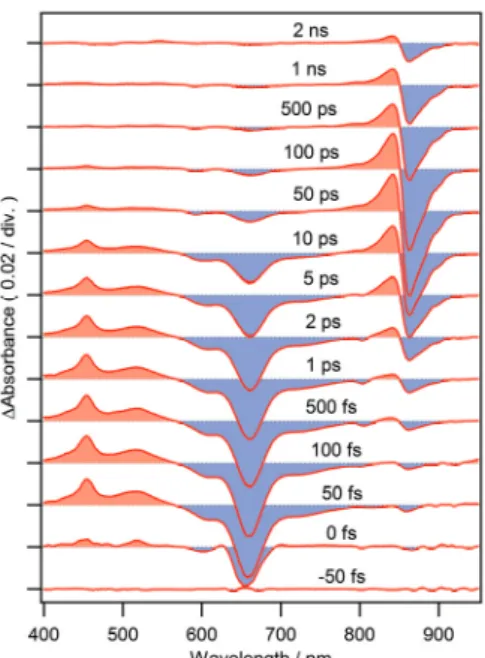
【実験】 再生増幅器付きの Ti:sapphire レーザーの出力 をビームスプリッターで分割し、2つの非同軸型光パラメ トリック増幅器(NOPA)に導入した。これをフェムト秒 TA スペクトル測定用の光源とし[3]、励起光は中心波長 650 nm、パルス幅約 17 fs であり、もう一方の NOPA から発生 させた中心波長1000 nm のパルスを CaF2板に集光して発 生させた白色光をプローブ光とした。サンプルセルの光路 長は1.0 mm であり、TA スペクトルはマルチチャンネルフ ォトダイオードアレイによって検出された。励起光とプロ ーブ光間の光Kerr 効果測定の結果に基づき、TA スペクト ルの群速度分散の補正が行われた。Rhodopseudomonas acidophila 由来の LH2 について、-ポリペプチドのリシン 残基をSH 化し、これに Alexa Fluor 647 maleimide を付 加した。Alexa と B850 の吸光度比から1つの LH2 に対し 約9個のAlexa が付加したと推定された。 【結果と考察】 LH2-Alexa 結合体は 650 nm 付近に Alexa 由来の強い吸収を有し、光捕集波長範囲が拡張している様 子がFig. 2 から確認できる。この結合体を 650 nm の光パ ルスで励起すると、Fig. 3 に示された TA スペクトルのよ うに、まず励起直後(1 ps 以内)に Alexa の基底状態ブリ ーチと誘導放出に由来する負のバンドが580-770 nm の領 域に強く表れ、Alexa が主に励起されていることがわかる。 また、450 nm と 520 nm に見られる正のバンドは、Alexa 単独の TA スペクトル測定により、Alexa の励起状態に由 来するものであることが判明している。数十ピコ秒の領域で、Alexa 由来の信号はどれも徐々に減衰 していき、代わりに800-850 nm と 850-910 nm に B850 励起子の吸収と誘導放出由来のバンドが出 現してくる。このことからAlexa から LH2 内の B850 へ高速なエネルギー移動が起こっていることが 確認できる。Fig. 4 に示すグローバル解析の結果、エネルギー移動は 2.9 ps と 17 ps のふたつの時定 数で多指数関数的に起こることが示唆された。時定数が単一でないのは、LH2 に対する Alexa の配向 に分布があるということを意味する。また、励起状態の寿命(1.2 ns)以内にエネルギー移動を起こさな い微量(約10 %)な Alexa の存在も確認された。ただし、これは LH2 から遊離したものではなく、 LH2 に付加した状態であっても、その配向によっては高効率のエネルギー移動が起こらないことを示 唆している。500 fs~1.0 ps の TA スペクトルを拡大して確認すると、800 nm 付近に弱い負のバンドが 存在することもわかった。これはB800 由来のバンドと考えられ、Alexa→B850 のエネルギー移動の 中間体としてB800 が寄与している可能性がある。そこで、B800 を排除した LH2-Alexa 結合体につ いてもTA スペクトル測定を行い、その結果も合わせて報告する予定である。
[1] S. Bahatyrova, et al., Nature 2004, 430, 1058. [2] X. Hu & K. Schulten, Physics Today 1997, 50, 28.
[3] Y. Nagasawa, et al., Phys. Chem. Chem. Phys. 2010, 12, 6067.
Fig. 3. LH2-Alexa 結合体の TA スペクト ル(励起波長:650 nm)。
Fig. 4. LH2-Alexa 結合体の過渡吸光度の 時間変化とグローバルフィッティングの 結果の一部。
バクテリオロドプシンの蛍光励起スペクトルと吸収スペクトルの比較
(東工大院・生命理工) ○生島 英嗣,大谷 弘之
Comparison of the fluorescence excitation spectrum and the
absorption spectrum of bacteriorhodopsin
(Tokyo Tech Univ)
○
Eiji Ikushima
,
Hiroyuki Ohtani
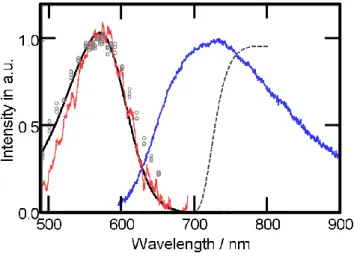
【序論】 高度好塩菌紫膜由来のバクテリオロドプシン(bR)は光駆動プロトンポンプとして知られるレチ ナールタンパク質である。bR の S1からの光反応は発色団のall-trans 型から 13-cis 型への異性化 のみがおきる。その量子収率(0.64±0.04)は励起波長に依らず [1]、あたかも S1のv=0 振動準位 から反応が進行するように見える。しかし、高い振動準位からも反応が起きるとの報告もある [2]。 v>0 振動準位からの反応の有無は蛍光励起スペクトルの測定によって判定できる。 試料濃度が低いなら、蛍光励起スペクトルの強度はモル吸光係数と蛍光量子収率Φ𝐹の積に比例 する。励起波長𝜆𝑒𝑥における蛍光量子収率Φ𝐹(𝜆𝑒𝑥)は Franck-Condon(FC)状態から S1のv=0 に振 動緩和する量子収率Φ𝑆10とS1のv=0 からの蛍光の効率𝜙𝐹の積で与えられる。𝜙𝐹は定数であるが、 Φ𝑆10は𝜆𝑒𝑥に依存する。通常の芳香族炭化水素ではΦ𝑆10が1 のため、蛍光励起スペクトルは吸収ス ペクトルに一致する。しかし、高い振動準位からの反応があるなら短波長側で励起スペクトルの 方が相対的に弱くなることが予想される。今回、我々はbR の S1←S0領域の蛍光励起スペクトル を測定し、吸収スペクトルと比較した。 【実験】 測定試料には紫膜懸濁液(pH7.9, 2.5 μM)を用いた。bR の蛍光量子収率が 10未満と非常に弱いので迷光、散乱光、 不純物発光などのバックグランド(BG) や暗電流の影響を受けやすい。蛍光検出 には光子計数法を採用し、暗電流の影響 を波高選別機能により除去した(図 1 内 a)。膜断片の散乱は強いので、その補正 には色素タンパクを脱色した白色膜(bO) を用いた。このbO は、ヒドロキシルア ミン存在下で可視光(>440 nm)を照射し、 紫膜を退色させ、さらに紫外光を照射し、 レチナールオキシムを光分解させて得た。 発色団を持たず、紫膜と同じ膜構造を持 つため散乱補正に最適である。励起側分 図1 蛍光励起スペクトル測定装置の概略図。 励起光(➡)をセル側面近傍に通し、セルの励起側表面付近の 蛍光(━)のみを検出する (a) (b)
光器はsingle monochromator では Xe ランプの近赤外光(bR の蛍光と重なる領域)が除去できず、 試料によって散乱され検出器に入る。そのため、double monochromator を備えた蛍光光度計の 出力光を使い、励起光の波長純度を上げた(図 1 内 b)。励起光側のバンド幅を 5 nm、掃引速度を 24 nm/min に設定した。励起光の散乱はカットオフフィルタで除いた。蛍光を測定したスペクト ルについて励起光強度で規格化した後、BG の補正を行い、蛍光励起スペクトルを得た。励起光 のスペクトルは感度補正済みのフォトダイオードを用いて得た。 【結果と考察】 𝜆𝐹>730 nm (IR73 カットオフフィルタを使用)の蛍光の積分強度から得た蛍光励起スペクトル (━)を吸収スペクトル(━)とともに図 1 に示す。S1←S0バンドにおいて540—650 nm 領域では吸収 スペクトルとよく一致した。この領域ではKasha-Vavilov の規則が成り立っているように見える。 一方、540 nm より短波長側では励起スペクトルは吸収スペクトルと相対的に弱めになってお り、蛍光量子収率の低下が見られる。吸収の0-0 バンド(618 nm [3])の>2300 cm上になると振 動緩和と反応の競争となる。 図2 に Schenkl et al. [4]により報告された励起スペクトルを比較のために示した。彼らのスペ クトルはピーク付近がプラトー気味であり、長波長側にすそが伸びている。バンド幅は(4000 cm FWHM)となり、吸収スペクトル(3400 cm)より広くなっている。短波長側は吸収スペクトルに 近くなっているが、この理由は膜断片による散乱の寄与であると考えている。BG 補正に bO でな く水を用いると短波長側が吸収スペクトルに合ってくるからである。 【参考文献】
1. J. Tittor and D. Oesterhelt (1990) FEBS Lett., 263, 269–273. 2. H. Kandori et al. (1992) J. Phys. Chem., 96, 6067-6071. 3. Pollard et al. (1989) J. Chem. Phys., 90, 199-200.
4. S. Schenkl et al. (2002) Phys. Chem. Chem. Phys., 4, 5020-5024.
図2 bR の蛍光励起スペクトル。
This work(━),Schenkl at el. 2002( )[4], ○
微生物型ロドプシン中に存在する水分子の近赤外分光解析
(名古屋工業大学
*)〇伊藤 奨太
*、神取 秀樹
*Near infrared spectroscopy of water molecules in microbial rhodopsins
(Nagoya Institute of Technology
*)〇Shota Ito
*、Hideki Kandori
*【序】光エネルギーを利用してイオンの輸送を行う微生物型ロドプシンとして、光駆動プロ トンポンプであるバクテリオロドプシン(BR)、クロライドポンプであるハロロドプシン(HR)、 光駆動のカチオンチャネルであるチャネルロドプシン(ChR)などがある。これら微生物型 ロドプシンのイオン輸送メカニズムの研究のため、我々は赤外分光法を用いた水素結合ネッ トワークの解析を行ってきた。その結果、BR などのプロトンポンプには必ず強い水素結合を 形成した水分子が存在していることを発見し(図1 左)、水分子の水素結合エネルギーがポン プ機能に必須であることを明らかにした[1]。またBR ではアミノ酸変異体を用いた水分子の伸 縮振動解析によって、レチナールシッフ塩基近傍に存在する水分子の水素結合強度が明らか にされている(図1 右)[2]。その一方で、ChR では水分子の水素結合が BR などと比較して弱 く、水分子の位置も異なっていることが示唆された。さらにChR ではカチオンを通すために 非常に多くの水分子が存在していることがわかった[3]。 このように、微生物型ロドプシンに結合した水分子の伸縮振動を直接、捉えることで、さ まざまなロドプシン機能における水分子の役割を調べているが、タンパク質内の水素結合ネ ットワークに含まれる複数個の水分子の解析は容易なことではない。BR の場合、1 個の水分 子に含まれる2 個の伸縮振動モードのカップリングが弱かったため(図 1 右)、変異体解析を 用いて水分子の伸縮振動を同定することができ[2]、理論計算との対応も取れているが[4]、タン パク質構造を変えてしまう変異体を用いた部位の同定には限界がある。そこで本研究におい て、我々は近赤外分光法に着目した。近赤外の領域には、水分子のO-H 伸縮振動の倍音成分 やO-H 伸縮振動と変角振動の結合音成分が現れる。近赤外分光は、水の状態をモニターする ことで食品の分析などに実用化されている手法であるが、同時に中赤外の振動情報が得られ ないために、基準振動との対応が得られず、解析は経験的なものに留まっているのが現状で 図1.(左図)ロドプシンに含まれる内部結合水で最も強い水素結合を形成した水分子のO-D 伸縮 振動[1] (右図)BR のレチナール近傍に存在する水分子を含めた水素結合ネットワーク[2]
ある。特定の水分子に対する伸縮振動(中赤外)とその倍音や結合音(近赤外)を測定する ことができれば、複雑な水素結合ネットワーク中における伸縮モードの非調和性なども将来 的には議論することが可能になると期待される。 【実験】微生物型ロドプシンの中で比較的安定かつ光反応強度の大きいBR とプロテオロド プシン(GPR)を試料として用いた。これらの精製タンパク質をフッ化バリウム製の窓板に 載せ、乾燥後、5 l の純水によって水和させ測定を行った。測定にはアジレント社製の FT- NIR 分光器(Cary 670)を用いて、7500-2800 cm-1領域の設定でX-H 伸縮振動とその倍音・結合 音の成分を検出した。 【結果と考察】近赤外分光法では禁制遷 移である X–H 伸縮振動の倍音や結合音 の振動を検出するが、その吸収は X–H 伸 縮振動の 10-100 分の 1 程度である。その ため始めに、C-H 伸縮振動(2925 cm-1) とその倍音(5785 cm-1)・結合音(4333 cm-1)の成分を用いて吸収強度の比較を 行い、近赤外分光測定に必要なタンパク 質量を見積もった(図2)。その結果、近 赤外分光には5.0 mg のサンプル量が必 要と見積もられた(中赤外分光には0.1 mg を使用)。 次に、プロトンポンプ型微生物型ロド プシンであるBR と GPR の試料(5.0 mg) を用いて、光反応の観察を 77 K で試みた。 BR や GPR のレチナール近傍に存在する水分子には、水素結合を形成していない O-H 伸縮 振動(3620 cm-1付近)をもつ水分子(dangling water)が中赤外分光で確認されている。一 方、近赤外分光での濃い試料の条件では3600-2800 cm-1の中赤外領域の吸収が大きすぎて測
定不可能であるが、dangling water の O-H 伸縮振動は同一のバンドとして観察された。そこ
で、dangling water の O-H 伸縮振動を中赤外分光法と近赤外分光法との共通の指標とした上
で、O-H 伸縮振動の倍音・結合音成分の解析を行っている。
本発表では微生物型ロドプシンに対する近赤外領域で光誘起差スペクトルを測定し、中赤
外領域に現れる水分子のO-H 伸縮振動と比較した結果をもとに議論したい。
【参考文献】
[1] Kandori, H. (2010) K.-L. Han, G.-J. Zhao, eds., pp. 377-391, John Wiley & Sons Ltd, West Sussex. [2] Shibata, M. Kandori, H. (2005) Biochemistry 44, 7406-7413
[3] Ito, S., Kato, H. E., Taniguchi, R., Iwata, T., Nureki, O., Kandori, H. (2014) J. Am. Chem. Soc. 136, 3475-3482
[4] Hayashi, S. Tajkhorshid, E. Kandori, H. Schulten, K. (2004) J. Am. Chem. Soc. 126, 10516-10517
図2.中・近赤外領域における GPR の 吸収スペクトルの軽水水和による時間変化
[NiFe]ヒドロゲナーゼの活性化サイクルにおける新規中間体の特定
(奈良先端大物質創成1
, 兵庫県大院生命理学2, CREST/JST3) ○太 虎林1,3
, 西川 幸志2, 樋口 芳樹2,3, 廣田 俊1,3
Specification of a new intermediate in the catalytic cycle of [NiFe] hydrogenase
(Nara. Inst. Sci. Tech.,1 Univ. of Hyogo,2 CREST/JST3) ○Hulin Tai,1,3
Koji Nishikawa,2 Yoshiki Higuchi,2,3 and Shun Hirota1,3
[序論] Desulfovibrio vulgaris Miyazaki F(DvMF)由来[NiFe]ヒドロゲナーゼは、水素の可逆的な合成/
分解を触媒する酵素であり、水溶液中での水素化反応や燃料電池反応への応用が期待される。Fig.1 に 示すように、本酵素は 62.5 kDa の大サブユニットと 28.8 kDa の小サブユニットからなるヘテロダイマー構 造をとっている[1]。大サブユニットの活性部位 Ni 原子には 4 つのシステイン残基の硫黄原子が配位し、そ れらのうち 2 つは Fe 原子にも配位し、架橋構造を形成している。Fe 原子には 1 個の CO と 2 個の CN-の 3 つの二原子分子も配位している。また、小サブユニットには、3 つの Fe-S クラスター(近位[Fe4S4]p2+/+, 中 位[Fe3S4]m+/0, 遠位[Fe4S4]d2+/+)が配置され、水素の分解過程で生じる電子をシトクロム c3へ伝達する。 [NiFe]ヒドロゲナーゼの活性化サイクルでは、Ni-SIa、Ni-C、及び Ni-R 型と呼ばれる構造が存在する[2]。 Ni-C 型(Ni3+)構造に光を照射すると、活性部位の Ni と Fe 間に架橋している H-が解離し、Ni-L 型構造 (Ni1+)が形成されることが報告されて いるが、触媒反応機構における Ni-L 型構造の位置づけは不明である。本 研究では、レーザー光(514.5 nm)照 射時の FT-IR スペクトルを 138~198 K で測定することにより、Ni-L 型構造 が Ni-SIa型と Ni-C 型間の構造転移 の中間体であることが示唆され、近位 [Fe4S4]p2+/+クラスターの酸化状態によ り Ni-C 型から Ni-SIa型構造への変換 が制御されることを明らかにした。 [実験] 好気的環境下で精製した酸化型ヒドロゲナーゼの水溶液を真空ラインにより脱気し、水素で満た した後、37C で 6 時間水素と反応させて、還元型サンプル(水素雰囲気下)を調整した。さらに、真空ライ ンにより水素を窒素に置換することで、窒素雰囲気下の還元型サンプルを調整した。
温度制御可能なセルホルダー(CoolSpeK IR USP-203IR-A, Unisoku)を FT-IR 装置(FT-IR 6100V, JASCO)の試料室に設置し、Ar+レーザー光をサンプルに照射しながら(サンプル点での光強度:500 mW/cm2)、FT-IR スペクトルを 138~198K で測定した。EPR スペクトルも 4~50 K で測定した。
[結果と考察] 138~198K での光照射時と光照射前の FT-IR スペクトルの差スペクトルを Fig.2 に示す。 差スペクトにおける負と正のバンドは、それぞれ光反応物と光生成物に由来する。水素雰囲気下での差
Fig. 1 Structure of [NiFe] hydrogenase from DvMF (PDB: 1WUL).
(A) Overall structure with metals (nickel, iron, and manganese) and [Fe4S4]p2+/+, [Fe3S4]d+/0, and [Fe4S4]d2+/+ clusters highlighted. (B) NiFe active site structure. Carbon, nitrogen, oxygen, sulphur, nickel, iron, and manganese atoms are shown in black, blue, red, yellow, green, pink, and cyan spheres, respectively.
CO CN -CN -Fe Ni Cys84 Cys81 Cys546 Cys549 B Mg NiFe [Fe3S4]m+/0(medial) [Fe4S4]p2+/+(proximal) [Fe4S4]d2+/+(distal) A 2e
-スペクトルで観測された 1963 cm-1の正のバンドは Ni-C 型構造の CO 伸縮振動(
CO)、1911 cm
-1の負の バンドは Ni-L 型構造のCOに帰属でき、Ni-C 型から Ni-L 型構造への光反応性が確認された(Fig.2A)
[2]。 窒素雰囲気下で同様の実験を行ったところ、Ni-L 型構造に由来する 1911 cm-1のバンド以外にも、1943 cm-1に Ni-SIa型構造に由来する正のバンドが観測され(Fig.2B)、Ni-C 型から Ni-SIa型構造への変換が 観測された。窒素雰囲気下では Ni-C 型から Ni-SIa型構造への変換が観測されたため、Ni-C 型構造の光 反応効率が水素雰囲気下に比べて増大した(Fig.2C)。さらに、138 K では約 87%の Ni-C 型構造が Ni-L 型構造に変換されたが、測定温度の上昇に伴い、Ni-C型から Ni-SIa型構造への変換が増加し、198 K で は Ni-L 型構造よりも Ni-SIa型構造への変換が多くなった(約 14%の Ni-C 型が Ni-SIa型構造に変換)。 以上より、Ni-L 型構造は Ni-C 型と Ni-SIa型間の構造転移の中間体であることが示唆された(Fig.2D)。 Ni-C 型構造における近位[Fe4S4]p 2+/+クラスターは、水素雰囲気下ではほとんど全て還元されているのに 対し、窒素雰囲気下では約 15%が酸化されていることが EPR 測定により明らかになった。Ni-C 型構造に おける酸化型[Fe4S4]p 2+クラスターの割合は、198 K における Ni-C 型から Ni-SI a型構造への変換率(約 14 %)とよく一致し(Fig.2C)、Ni-C 型から Ni-SIa型構造への変換は、近位[Fe4S4]p
2+/+クラスターが酸化型 であるときに起こることが推測された。Ni-L 型から Ni-SIa型構造への変換過程では、一個の電子が放出さ れ、近位[Fe4S4]p 2+/+クラスターへ流れると考えられる。窒素雰囲気下では、一部の[Fe 4S4]p 2+/+クラスターは 酸化型であり、電子を受取ることができるが、水素雰囲気下では、[Fe4S4]p 2+/+クラスターはほとんど全て還 元型であり、電子を受け取れず、Ni-L 型は Ni-SIa 型構造へ変換されないと推測される。以上より、 [Fe4S4]p 2+/+クラスターの酸化状態が Ni-C型から Ni-SI a型構造への変換を制御することが明らかになった。
Fig. 2 Difference FT-IR spectra of H2-activated [NiFe] hydrogenase from DvMF between the spectra with and without light irradiation under (A) H2 and (B) N2 atmosphere at 138, 158, 178, and 198 K. (C) Temperature dependence of the percentage of the Ni-C state converted to other states by light irradiation under H2 (open blue square) and N2 (closed blue circle) atmospheres and the percentages of the transition of the Ni-C state to the Ni-L state (closed red circle) and Ni-SIa state (closed green circle) under N2 atmosphere. (D) Proposed conversion mechanism between Ni-C and Ni-SIa states.
[参考文献]
[1] H. Ogata, Y. Mizoguchi, N. Mizuno, K. Miki, S. Adachi, N. Yasuoka, T. Yagi, O. Yamauchi, S. Hirota, Y. Higuchi, J. Am. Chem. Soc. 2002, 124, 11628-11635.
[2] W. Lubitz, H. Ogata, O. Rudiger, E. Reijerse, Chem. Rev. 2014, 114, 4081-4148.
Ni-C [Fe4S4]p2+ Cys Cys Fe 2+ Ni3+ S S SSCys Cys H -Ni-SIa [Fe4S4]p+ Cys Cys Fe 2+ Ni2+ S S SSCys Cys Ni-L [Fe4S4]p2+ Cys Cys Fe 2+ Ni1+ S S SSCys Cys H+ 1900 2000 2100 Ni-C 2089, 2077 Ni-L 2062, 2048 Wavenumber (cm-1) D Abs orba nce Ni-C 1963 178 K 198 K 158 K 138 K 0.005 1900 2000 2100 Ni-L 1911 A Ni-C 2089, 2077 Ni-L 2062, 2048 Ni-L 1911 D Absorba nc e Ni-C 1963 Ni-SIa 1943 178 K 198 K 158 K 138 K 0.005 1900 2000 2100 B Wavenumber (cm-1) D 14 % Temperature (K) % o f c onv ers ion 180 160 140 200 0 100 50 Ni-C Ni-L Ni-SIa C CO CN
-鉄制御蛋白質
IRP1 におけるシグナル伝達分子としてのヘムの配位環境
( 北大・院総化 1 , 京大・医 2 , 北大・院理 3 )
○ 小倉 麻梨子 1 , 武田 有紀子 2 , 内田 毅 1,3 , 岩井 一宏 2 , 石森 浩一郎 1,3
Structural characterization of heme binding as a signaling molecule for Iron Regulatory Protein 1 (Grad. Sch. of Chem. Sci. and Eng., Hokkaido Univ.1, Fac. of Med., Kyoto Univ.2, Fac. of Sci., Hokkaido Univ.3)
○ OGURA Mariko1, TAKEDA Yukiko2, UCHIDA Takeshi1 3, IWAI Kazuhiro2, ISHIMORI Koichiro1 3
【序】
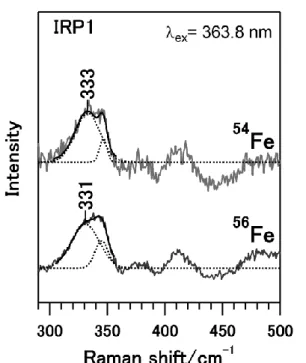
鉄は、生体内でヘモグロビンによる酸素運搬やリボヌクレオチド還元酵素による DNA 合成な ど、さまざまな反応の活性中心として機能している重要な元素である。したがって、鉄不足は鉄 欠乏性貧血など生体内の機能低下を招く恐れがある一方で、鉄は酸素と反応して活性酸素を産生 するため、過剰な鉄は活性酸素による DNA やタンパク質の損傷を引き起こす恐れがある。そこ で、哺乳類には鉄制御蛋白質Iron Regulatory Proteins (IRPs)が存在し、これらの IRPs は、鉄 不足時の鉄の取り込みや、鉄過剰時の鉄の貯蔵などに関連している鉄代謝タンパク質のmRNA と 鉄濃度に応じて結合することで、そのタンパク質の量を翻訳レベルで制御し、細胞内鉄濃度を制 御している。この鉄濃度制御機構の破綻は、肝硬変や神経変性症などの疾患との関連が示唆され ているため、より詳細な鉄濃度制御機構の解明が求められているが、その制御機構で鍵となる細 胞内での鉄濃度シグナル伝達分子については十分検討されてはいない。 これまで、そのアミノ酸配列の解析から、IRPs はシグナル伝達分子としてヘムを利用している タンパク質に共通するヘム結合領域「Heme Regulatory Motif (HRM)」を有していることが示さ れ(1)、また、これまで我々の研究結果よりIRPs の一つである IRP1 にヘムを添加すると、IRP1 とmRNA の結合が阻害されたことから、ヘムが細胞内の鉄濃度シグナル伝達分子として機能して いることが示唆されている。しかし、IRP1 におけるヘム結合部位やそのヘム配位環境については 十分な構造化学的知見が得られておらず、IRP1 におけるシグナル伝達分子としてのヘム結合の機 能的、構造的意義は不明である。そこで、本研究では IRP1 のヘム結合部位とその配位環境を明 らかにすることで、細胞内鉄濃度のシグナル伝達分子としてのヘムの IRP1 への結合の構造化学 的意義を検討した。 【結果と考察】 IRP1 におけるヘムの結合を分光学的に確認す るため、ヘム結合による紫外可視吸収スペクトル 変化を追跡したところ、ヘムを添加するに伴い 370 nm と 421 nm をピークとして吸光度が増大 した(図1)。さらに、421 nm の吸光度に対する 370 nm の吸光度の比は添加するヘムの量が増え るにしたがい増大したことから、421 nm にピー クを示すヘム結合部位の方が高い親和性を有し、 IRP1 は親和性の異なった 2 つのヘム結合部位を 図 1. IRP1 の紫外可視吸収スペクトル
もつことが明らかになった。 このようにIRP1 に結合するヘムは、その HRM 部位のCys 残基を配位子として結合することが 想定されるため、ヘム鉄とその配位子のCys の伸 縮振動を検出することができる共鳴ラマン分光 法を用いてヘム配位構造の検討を行った。その結 果、これまでのCys を配位子とするヘムタンパク 質と同様に、ヘムを添加したIRP1 では 330 cm-1 付近に幅広なラマン線が観測された(図 1 中の実 線)。このラマン線はこれまで報告されている Fe-Cys 伸縮振動のラマン線よりも低波数側であ り、さらに半値幅も大きいことから、ポルフィリ ンの振動モードと重なっている可能性が考えら れた。そこで、このラマン線を波数分解すると、 331 cm-1と345 cm-1にピークを持つバンドが検 出され(図 1 中の点線)、このうち 331 cm-1にピー クを示すラマン線は、ヘム鉄の質量数を56Fe か ら54Fe に変化させることにより、そのピークが 333 cm-1へシフトした(図 1)。この差はヘム鉄の 同位体シフトの差の計算値2 cm-1と一致することから、331 cm-1はヘムの軸配位子由来のピーク であるFe-Cys 振動モードであると帰属でき、IRP1 に結合したヘムは Cys を配位子としているこ とが分光学的にも示された。
以上の結果より、IRP1 は親和性の異なる 2 つの Cys をヘムの配位子とする HRM を有するこ とが明らかになった。IRP1 の立体構造をもとにこれらのヘム結合 HRM の構造的特徴を検討する と、IRP1 は2つの HRM 中の Cys 残基のうち118Cys は周囲に立体障害の少ないタンパク質表面 に位置するのに対し、もう一方の300Cys はタンパク質内部の mRNA 結合部位に位置しており、 ヘムのような分子が結合するためには大きな構造変化が必要と考えられる。したがって、IRP1 においては、まず親和性の高い118Cys にヘムが結合し、このヘム結合によって mRNA 結合部位 近傍にある300Cys に構造 変化が誘起され、その結 果ヘムが300Cys に結合す ることで、IRP1 は mRNA を解離するという機構が 提案できる(図 3)。 【参考文献】
1. Chen, et al., PNAS, 1991, 88, 315
図 2. IRP1 の共鳴ラマンスペクトル(低波数領域)
サブ
10
フェムト秒光パルスによる光合成アンテナにおける
エネルギー伝達機構解明
(
1大阪市大・複合先端研、
2大阪市大・理、
3グラスゴー大
)
小澄大輔
1、堀部智子
1、
杉崎満
2、
Richard J. Cogdell
3、橋本秀樹
1,2Energy transfer dynamics in photosynthetic antenna using sub-10 fs pulses
(
1OCARINA,
2Graduate School of Science, Osaka City Univ.,
3Univ. of Glasgow)
Daisuke Kosumi
1, Tomoko Horibe
1, Mitsuru, Sugisaki
2, Richard J. Cogdell
3,
and Hideki Hashimoto
1,2【序論】
植物、藻類、細菌類の光合成では、アンテナ系が光を吸収し、そのエネル
ギーを反応中心で電気化学エネルギーに変換する。反応中心における機能・構造は、
植物、藻類、細菌類等にかかわらず保存しているのに対し、アンテナ系は生息環境に
依存し多様性に富んでいる
1。例えば紅色光合成細菌の周辺アンテナ
LH2
は、光合成
色素の一種であるバクテリオクロロフィル
a (Bchl a)
分子がたんぱく質により自己会
合し、
2
つのリング会合体
(B800, B850)
を形成している
(
図
1(A))
。この
2
つのリング
会 合 体 は そ れ ぞ れ 異 な る 吸 収 帯 を 持 ち
(
図
1(B))
、 エ ネ ル ギ ー 的 に 高 い 状 態 に あ る
B800
を励起すると
B850
への励起エネルギー移動が、
1 ps
程度の時間スケールで起こ
ることが知られている
2。
この
LH2
における超高速エネルギー伝達は、
理論的にも盛
んに研究されているものの、
どのような機構で記述できるかは未解決の問題となって
いる。一方、近年光合成系エネルギー伝達において、光励起により生じる色素分子間
コヒーレンスがエネルギー伝達時間と同程度持続することが報告されているため、
そ
の役割が注目されている
3。また、
LH2
におけるエネルギー伝達は、
B800-B850
間に
働く電気双極子相互作用が
30 cm
-1程度と非常に弱いため、弱結合下でのインコヒー
レント過程であると考えられていたが
2、最近
LH2
における
2
つのリング間のコヒー
レンスが常温下で数百
fs
程度持続することが報告されている
4, 5。本研究では、
LH2
における
B800-B850
間のコヒーレンス過程を解明するため、
極超短光パルスを用いた
時間分解四光波混合分光を行った。
【実験】
LH2
は、紅色光合成細菌
Rhodobacter sphaeroides 2.4.1
から単離・精製を行
った後、界面活性剤を混入した
20mM tris HCL
バッファーに分散させた。四光波混合
分 光 で は 、 縮退 光 を用 い た ボ ッ ク ス
カ ー 配 置 に よる 過 渡回 折 測 定 を 行 っ
た 。 光 源 は 、チ タ ンサ フ ァ イ ア 再 生
増幅器
(Legend-Elite USP, 30 fs, 4.5 W,
5 kHz)
からの出力光を
Ne
ガスが充填
された光路長
1.0 m
の中空糸ファイ
バ ー 中 を 伝 搬さ せ るこ と で 、 ス ペ ク
トルの広帯域化を行った
(
図
1(B))
。
フ ァ イ バ ー から 出 力さ れ た 光 パ ル ス
は 、 負 分 散 を持 っ たブ ロ ー ド バ ン ド
チ ャ ー プ ミ ラー に より 分 散 補 償 を 行
った。図
1(C)
に、
Frequency-resolved
optical gating (FROG)
法による光パル
ス の 自 己 相 関を 示 す。 ス ペ ク ト ル 幅
図1: (A) 紅色細菌由来光合成アンテナLH2の色素配列。 (B) LH2の吸収スペクトル及びレーザーのスペクトル。 (C) FROG法によるパルス評価結果。 B850 B800 (A) (B) (C) 700 800 900 0 0.2 0.4 0.6 0.8 1 Laser Wavelength (nm) 707 cm-1 B850 B800から予測されるフーリエ変換限界パルス幅
4.8 fs
に対し、
5.1 fs
の光パルスが得られた。
試料からの過渡回折信号は、分光器を通した後、
CCD
を用いてマルチチャンネル検
出を行った。
【結果と考察】
図
2(A)
に、異なる
2
つの波長で観測した
LH2
による過渡回折信号
の遅延時間依存性を示す。過渡回折信号では、励起状態の分布生成を伴わないコヒー
レント信号が時間原点付近に現れ、
その後信号が指数関数的に減少する様子が観測さ
れた。
また、
比較的に早い遅延時間領域
(<500 fs)
では、
実時間コヒーレント振動が観
測された。このコヒーレント振動成分を明確にするため、ゆっくりと変化する成分を
差し引いた時間波形を図
2(A)
の内挿図に示す。
主として観測されたコヒーレント振動
は、
~30 fs
程度の振動周期を持ち、超高速減衰を示した。図
2(B)
に、過渡回折信号に
観測されたコヒーレント振動成分の高速フーリエ変換
(FFT)
スペクトルを示す。
2
つ
の観測波長において、
100~2500 cm
-1の領域に
3
つのブロードなモードが観測された。
これらのモードのスペクトル解析から、
3
つの振動モードの減衰時間が
100 fs
以下で
あり、異なる時定数を持つことが明らかになった。これまで報告されている
LH2
の
定常ラマンスペクトルとの比較及び、
30 fs
パルスを用いた
B800
又は
B850
帯への選
択励起による過渡回折信号測定の結果から、
図
2(B)
で観測されたブロードな振動モー
ドが、
Bchl a
分子に起因する基底状態及び励起状態の振動モードではなく、
B800-B850
間 に 作 用 す る 電 子 状 態 由 来 の 量 子
ビートであると帰属される。
また、
B850
では
Bchl a
分子間に
比 較 的 強 い 双 極 子 相 互 作 用
(~300
cm
-1)
が働くため、
その電子励起状態
は励起子的に振舞い
6、励起子サブ
バ ン ド
(k=0, ±1,…±8, 9)
を 形 成 す
ることが理論的に予測されている
7。
このサブバンドは、
2500 cm
-1程度の
帯域に及ぶことから、本研究で観測
された
3
つの量子ビートモードは、
B800
と
B850
の励起子サブバンドと
の 多 準 位 的 な コ ヒ ー レ ン ス で あ る
と考えらえる。
【まとめ】
本研究から、紅色細菌
由来光合成アンテナ
LH2
における電子状態に起因する量子ビートが観測された。そ
の結果、
B800-B850
間のコヒーレンスが多準位間で生成され、
200 fs
程度持続するこ
とが明らかになった。
1. T. Polívka and H. A. Frank, Acc. Chem. Res. 43, 1125 (2010).
2. V. Sundström, T. Pullerits and R. van Grondelle, J. Phys. Chem. B 103, 2327 (1999).
3. G. S. Engel, T. R. Calhoun, E. L. Read, T. K. Ahn, T. Mancal, Y. C. Cheng, R. E. Blankenship
and G. R. Fleming, Nature 446, 782 (2007).
4. E. Harel and G. S. Engel, Proc. Natl. Acad. Sci. USA 109, 706 (2012).
5. R. Hildner, D. Brinks, J. B. Nieder, R. J. Cogdell and N. F. van Hulst, Science 340, 1448
(2013).
6. A. M. van Oijen, M. Ketelaars, J. Kohler, T. J. Aartsma and J. Schmidt, Science 285, 400
(1999). 7. H. Sumi, J. Lumin. 87-9, 71 (2000). 図1: (A) LH2における過渡回折信号の時間依存性。(B) 過 渡回折信号に観測されたコヒーレント振動のFFTスペク トル。 0 500 1000 1500 In te n si ty Delay Time (fs) 0 100 200 300 735 nm 0 500 1000 1500 In te n si ty Delay Time (fs) 0 100 200 300 860 nm 1000 2000 3000 In te n si ty Wavenumber (cm-1) 735 nm 860 nm 1734 cm-1 878 cm-1 268 cm-1 FFT (A) (B)
図 1 PapB 野生型の TG 信号
青色光センサータンパク質 PapB のシグナル伝達反応機構
○菊川 耕太郎*、中曽根 祐介*、増田 真二**、寺嶋 正秀*(京大院理*、東工大バイオ研究基盤支援総合センター**)
Signaling mechanism of blue light sensor protein PapB
○Kikukawa Koutaro*, Nakasone Yusuke*, Masuda Shinji**, Terazima Masahide* (Dept. of Sci., Kyoto Univ.*, Center for Biological Resources and Informatics, Tokyo Institute ofTechnology**)
【序】
光センサータンパク質は光をシグナルとして様々な生理活性を制御するタンパク質であり、その反応機構が多くの興味を集めている。その一種である PapB は紅色性細菌 Rhodopseudomonas
palustris 中 に 存 在 す る 青 色 光 セ ン サ ー タ ン パ ク 質 で あ り 、 発 色 団 FAD (Flavin Adenine
Dinuculeotide)を含む BLUF (Blue Light sensing Using FAD) ドメインを N 末端に持ち、C 末端側に は 2 本のへリックス構造を持つことが知られている。PapB はホスホジエステル加水分解酵素である PapA と相互作用することが報告されており、光照射によりこの相互作用が変化することで c-di-GMP の加水分解活性が上昇すると考えられている。c-di-GMP は細菌内でセカンドメッセンジャーとして働 いており、その分解が進むことによって最終的にバイオフィルム形成が抑制される[1]。この一連のシ グナル伝達機構において、発色団 FAD が青色光を吸収した後、周囲のアミノ酸との水素結合ネット ワークがピコ秒のオーダーでシフトする反応が過渡吸収測定などにより明らかにされているが、蛋白 質全体の構造変化や PapA との相互作用変化を実時間で捉えた研究例はない。そこで我々は FAD の光励起からバイオフィルムの制御という生理機能につながる分子機構を明らかにするために、 PapB 全体の構造変化および PapA-PapB 間の相互作用変化を、過渡回折格子法を用いて時間分解 検出することを目指した。
【実験】
過渡回折格子(TG)法では励起光パルスとして波長 462nm の色素レーザーを、プローブ光 として 840 nm のダイオードレーザーを用いた。格子波数を変化させ、分子拡散信号の時間発展を解 析した。Buffer は pH8.0 の Tris バッファーを用い、二重励起を防ぐために励起光パルスの入射は 0.03Hz の間隔で行った。サンプルとして野 生型の PapB およびその C 末端へリックスを 壊した変異体を用意し、さらに PapA を加え た系での測定も行って信号伝達過程の時 間分解検出を試みた。【結果と考察】
野生型 PapB のバッファー 溶液内での反応を過渡回折格子法により測 定した結果を図 1 に示す。最初に減衰する 強い信号は熱拡散信号に同定され、そのほ かに時定数 50μs、25 ms の体積変化が観 測されたのち、分子拡散による減衰信号が図 3 PapB 単体と PapB-PapA 混合系との間の TG 信号比較 図 2 PapB 野生型と C 末端ヘリックスを壊 した変異体との間の TG 信号比較 観測された。このうち、50μs の成分は 小さい体積膨張によるものであり、他の BLUF 蛋白質でも近い時定数の反応が 観測されているため[2] 、BLUF ドメインの 構造変化を捉えたと推測される。一方、 25ms の成分は比較的大きな体積膨張 反応であり、C 末端のヘリックスを壊した 変異体での TG 測定(図 2)では観測さ れなかったことから、この成分は C 末端 にあるヘリックス構造の崩壊によるものと 推定した。この崩壊反応は CD 測定によ っても確認されている。一方、分子拡散 信号に関しては反応物の拡散係数が 8.5×10-11 m2/s から 9.8×10-11 m2/s と変化する挙動が観測された。この拡散係数変化は、先に示した C 末端のヘリックス構造の崩壊と、二量体から単量体への解離反応によるものと推測される。 次に PapB-PapA の混合系に関しても同様に過渡回折格子法による測定を行ったところ、図 3 に示 すように PapB 単体とは明確に異なる信号が観測された。PapA はこの励起波長には光吸収を持たな いため、この変化は PapA が PapB と相互作用していることを示している。PapA-PapB 混合系の信号 のうち、熱拡散信号の後に観測される立ち上がり信号は PapB 単体の信号のそれと近い時間スケー ルで起きていることから、PapB でも見られた 25 ms の体積変化由来の信号であると推測される。すな わち PapA 存在下でも、PapB の C 末端へリックスの崩壊反応は保存されていると考えられる。そのあ との分子拡散信号は混合系固有の挙 動であり、反応物の拡散係数が 5.8× 10-11 m2/s から 3.6×10-11 m2/s へと減少 する挙動が観測された。この拡散係数 変化は PapB と PapA の作る複合体が 光依存的な会合もしくは部分的な構造 の崩壊を伴う相互作用変化を起こした ものと予想される。現在これらの可能性 を検証するために、濃度を振った測定 や混合系での CD 測定を行っており、 本 討 論 会 で は こ れ ら の 結 果 も 含 め PapA-PapB の信号伝達機構を議論す る。
【参考文献】
[1]Kanazawa et al. Biochemistry. 2010 Dec 21;49(50):10647-55 [2]Tanaka et al. J Mol Biol. 2009 Mar 13;386(5):1290-300
![Fig. 2 Difference FT-IR spectra of H 2 -activated [NiFe] hydrogenase from DvMF between the spectra with and without light irradiation under (A) H 2 and (B) N 2 atmosphere at 138, 158, 178, and 198 K](https://thumb-ap.123doks.com/thumbv2/123deta/8644455.946710/12.892.111.783.601.918/difference-spectra-activated-hydrogenase-dvmf-spectra-irradiation-atmosphere.webp)