ハイゼントラ
20%皮下注 1 g/5 mL
ハイゼントラ
20%皮下注 2 g/10 mL
ハイゼントラ
20%皮下注 4 g/20 mL
2.6 非臨床試験の概要文及び概要表
2.6.1 緒言
Hizentra 2.6.1 緒言 - 2
-目次
2.6.1. 緒言 ... 5 2.6.1.1. 製品情報 ... 5 2.6.1.2. IgPro20 の非臨床試験 ... 5 2.6.1.3. L-プロリンの非臨床試験 ... 6表目次
表 2.6.1-1 IgPro20 の非臨床試験... 6 表 2.6.1-2 L-プロリンの非臨床試験 ... 7 表 2.6.1-3 Sandoglobulin Liquid の開発中に実施した L-プロリンの毒性試験 ... 8 表 2.6.1-4 非臨床試験に使用した IgPro20 と臨床試験との関連 ... 8 表 2.6.1-5 非臨床試験に使用した L-プロリンと臨床試験との関連 ... 9Hizentra 2.6.1 緒言 略号・略称の一覧表 略号・略称 内容 bw 体重 CHO チャイニーズハムスター卵巣細胞 CRO 開発業務受託機関
CSLB 2004 年夏以前は ZLB Bioplasma AG と称した 現在はCSL Behring AG, Bern であり、2007 年以前は ZLB Behring AG と称し、 Fab IgG 分子の抗原結合領域 Fc IgG 分子の一部。補体成分 C1q 及び Fc 受容体と相互作用する。 GLP 医薬品の安全性に関する非臨床試験の実施の基準 ICH 日米EU 医薬品規制調和国際会議 IgG 免疫グロブリンG L リットル mmol ミリモル SCIG 皮下投与用免疫グロブリン製剤 w/v 質量/体積 混合添加物(添加物8) ニコチンアミド mmol/L、L-イソロイシン mmol/L 及び L-プロリン 120 mmol/L を含有する pH の混合添加物
Hizentra 2.6.1 緒言 - 4 -非臨床試験で使用した製剤一覧 製剤 剤形 IgG 濃度 L-プロリン pH 臨床での 投与経路 販売状況 備考 IgPro20 液状製剤 20% + 4.8 皮下 海外で販売 (販売名:Hizentra) 治験薬 サングロポール (Sandoglobulin) 凍結乾燥 製剤 5% - 6.6 静脈内 本邦(販売名: サングロポール) 及び海外(販売名: Sandoglobulin)で販売 Beriglobin P 液状製剤 16% - 6.8 筋肉内 皮下 海外で販売 (販売名:Beriglobin) Vivaglobin 液状製剤 16% - 6.8 皮下 海外で販売 (販売名:Vivaglobin) *IgG製剤X 液状製剤 % + 4.8 静脈内 海外で販売 (販売名: ) *IgG製剤Y 液状製剤 % + 4.8 皮下 研究用製剤 *IgG製剤Z 液状製剤 % + 4.8 皮下 研究用製剤 Sandoglobulin Liquid 液状製剤 12% - 5.3 静脈内 海外で販売 (販売名: Sandoglobulin Liquid)
*新薬承認情報提供時に置き換え
Hizentra 2.6.1 緒言
2.6.1. 緒言
2.6.1.1. 製品情報
CSL Behring 社(以下、CSLB)は、「無又は低ガンマグロブリン血症」の補充療法として
皮下投与(SCIG)で使用可能な新規の液状多価人免疫グロブリン G(IgG)製剤である IgPro20
を開発した。本剤の適応症及び推奨用量に関する詳細情報は、1.8(「効能・効果」及び「用法・ 用量」の設定根拠)に記載した。また、本剤の投与量及び投与間隔は、適応疾患、患者の病 状や投与後の反応により決定される。 本剤は20% w/v IgG 水溶液であり、250 mmol/L(28.8 g/L)の L-プロリン及び 20 mg/L のポリ ソルベート80 で安定化された pH 4.8 の製剤である(3.2.P.1)。 IgG の 1 日投与量 1 g/kg には、L-プロリンが 144 mg/kg 含まれる。皮下投与される IgG は
低用量(IgPro20 の国内臨床試験では IgG の用量は 200 mg/kg を超えず、海外臨床試験では IgG
の用量は400 mg/kg を超えなかった)であるため、L-プロリンの 1 日の投与量が 58 mg/kg を 超えることはない。 2.6.1.2. IgPro20 の非臨床試験 人免疫グロブリンは、本来、生体に存在するタンパク質である。高度に精製された人免疫 グロブリン製剤はCSLB を始め多数の製薬企業より市販され、その安全性及び忍容性は長年 にわたり十分に確立されている。人免疫グロブリン製剤は動物に対して免疫学的活性を有し、 外来物反応性の抗体を含有するため、人免疫グロブリン製剤で動物を用いて試験を実施する ことには限界がある[MacMorrowら 1997; Tomlinsonら 1997; Watierら 1996; ICH S6 (R1) 「バ
イオテクノロジー応用医薬品の非臨床における安全性評価」]。このことは、ラットの28 日間 皮下投与用量設定試験及び26 週間反復皮下投与毒性試験で、IgPro20 200、800 及び 1000 mg/kg をラットに反復投与し、全動物にヒトIgG に対する抗体産生が認められたことにより確認し た。 製造工程で使用される試薬及び原料は既知のもので、市販の血漿由来製剤に広く使用され ており、IgPro 20 でも同様に管理されている。 以上のことより、IgPro20 の標準的な非臨床試験パッケージをすべて実施することは適切で ないと考えた。本剤の機能(in vitro での Fab 及び Fc 機能)について検討した(2.3.P.2.2.3)。 IgPro20 の単回及び反復皮下投与後のヒト IgG の血漿中濃度及びバイオアベイラビリティを
Hizentra 2.6.1 緒言 - 6 -さらに、ラットにおける血圧への影響を検討した(表2.6.3-2)。ラットのヒトIgG に対す る免疫原性は、IgPro20 を隔日、4 週間皮下投与したラットの用量設定試験で評価した(表 2.6.7-5)。急性毒性、蓄積毒性及び免疫原性はラットの26 週間反復皮下投与毒性試験で評価 した(表2.6.7-6)。IgPro20の局所刺激性はウサギを用いた2試験で検討し(表2.6.7-7、表2.6.7-8)、 そのうちの1 試験は臨床試験ZLB04_008CR(5.3.3.1)で使用されたIgPro20 と同一ロットで 実施された。IgPro20 の非臨床試験の概要を表 2.6.1-1に示す。 表 2.6.1-1 IgPro20 の非臨床試験 試験の種類 試験番号 動物種 投与期間 投与方法 被験物質 対照物質 投与量 GLP 安全性薬理試験 4.2.1.3 HYR 01/06 ラット 1 日 単回 ボーラス静脈内投与 IgPro20 **IgG製剤X* Sandoglobulin Liquid 生理食塩液 250 mg/kg 非適用 薬物動態試験 4.2.2.2 PSK 01/05 ウサギ 21 日 (観察期間) 単回 皮下投与 IgPro20 **IgG製剤Y* Vivaglobin 400 mg/kg (2.0 mL IgPro20/kg) 非適用 薬物動態試験 4.2.2.2 PSK 04/05 ウサギ 21 日 (観察期間) 単回 皮下投与 IgPro20 **IgG製剤Y* 400 mg/kg (1.91 mL IgPro20/kg) 非適用 薬物動態試験 4.2.2.2 PSK 02/06 ラット 5 日 皮下投与 静脈内投与 1 日 1 回 5 日間連続 IgPro20 **IgG製剤X* 100, 400 mg/kg 非適用 用量設定試験 4.2.3.2 PSR 09/08 ラット 28 日 皮下投与 隔日1 日 1 回 IgPro20 200, 800 mg/kg 非適用 反復投与毒性試験 4.2.3.2 AA79918 ラット 26 週間 皮下投与 隔日1 日 1 回 IgPro20 200, 1000 mg/kg 適用 局所刺激性試験 4.2.3.6 143.143.552 ウサギ 5 日 単回皮下投与 単回皮下持続投 与 IgPro20 **IgG製剤Z* **IgG製剤Y* **IgG製剤X* Beriglobin P 添加物溶液 (250 mmol/L L-プロリン, pH 4.8) 最大2.5 mL/kg (IgPro20 の ヒトIgG: 最大500 mg/kg, L-プロリン: 最大72 mg/kg) 適用 局所刺激性試験 4.2.3.6 143.140.883 ウサギ 8 日 初回に単回投与 静脈内、静脈周囲 及び動脈内投与 IgPro20 ヒトIgG: 100 mg L-プロリン: 14.3 mg 適用
***IgG製剤X、**IgG製剤Y、**IgG製剤Z は IgG 含有濃度がそれぞれ 、 及び %以外、IgPro20 と同一 2.6.1.3. L-プロリンの非臨床試験 L-プロリンは IgPro20 の安定剤として使用されている。L-プロリンは第十六改正日本薬局 方に収載されており、輸液成分や医薬品添加物として使用されている。L-プロリンは、静脈 内投与としては、高齢者を含むヒトで1 日当たり最大 8 g までの使用前例はあるものの(ア ミノレバン点滴静注、大塚製薬)、皮下投与では、IgPro20 の国内臨床試験で投与された 1 日
**新薬承認情報提供時に置き換え
Hizentra 2.6.1 緒言 当たり最大用量1.74 g(IgPro20 を 1 日最大用量 200 mg/kg で投与する場合)の使用前例はな いため、L-プロリンの皮下投与による少数の試験を含む毒性試験成績、並びに非臨床薬理及 び薬物動態データを示すことは有用と考えられた。高用量のL-プロリン(及びグリシン)の 影響を評価するため、単回投与薬物動態試験、皮下及び静脈内反復投与試験、胚・胎児発生 に関する静脈内投与試験、並びに幼若動物試験を実施した(表 2.6.1-2)。 表 2.6.1-2 L-プロリンの非臨床試験 試験の種類 試験番号 動物種 投与期間 投与方法 被験物質 対照物質 投与量 GLP 単回投与薬物動態 試験 4.2.3.7.7 PSR 08/06 ラット ボーラス単回 投与 皮下投与 腹腔内投与 L-プロリン 皮下投与: 2 g /kg 腹腔内投与: 最大 4 g/kg 非適用 単回薬物動態試験 4.2.3.7.7 PSR 03/07 ラット 単回 皮下投与 L-プロリン グリシン L-プロリン: 1.9 g/kg グリシン: 1.2 g/kg 非適用 反復投与毒性試験 4.2.3.7.7 AA89493 ラット 28 日 皮下投与 L-プロリン 290 mg/kg/day 適用 反復投与毒性試験 4.2.3.7.7 925/035 ラット 28 日 7 時間持続静注/日 L-プロリン グリシン L-プロリン: 最高1449 mg/kg グリシン: 最高945 mg/kg 適用 反復投与毒性試験 4.2.3.7.7 668321 イヌ 28 日 7 時間持続静注/日 L-プロリン L-プロリン: 最高4350 mg/kg 適用 反復投与毒性/ 幼若動物試験 (Irwin 試験) 4.2.3.7.7 PSR 01/07 ラット 5 日 (生後 9-13 日) 又は3 日 (生後 9, 16 及 び23 日) 皮下投与 1 日 2 回 L-プロリン グリシン L-プロリン: 最高2×2.0 g/kg グリシン: 最高 2×1.3 g/kg/day 非適用 反復投与毒性/ 幼若動物試験 (水迷路試験) 4.2.3.7.7 PSR 01/07/ZLB 06_006 ラット 5 日 (生後 9-13 日) 又は3 日 (生後 9, 16 及 び23 日) 皮下投与 1 日 2 回 L-プロリン グリシン L-プロリン: 最高2×2.0 g/kg グリシン: 最高 2×1.3 g/kg/day 非適用 生殖発生毒性/ 胚・胎児発生毒性試 験、4.2.3.7.7 AA30034 ラット 妊娠6~17 日 7 時間持続静注/日 L-プロリン グリシン L-プロリン: 1449 mg/kg グリシン: 945 mg/kg 適用 その他の静脈注射用人免疫グロブリン製剤であるSandoglobulin Liquid の開発中に、L-プロ リン、ほかのアミノ酸及びニコチンアミドを含む溶液で毒性試験を追加した。この製剤の開 発中に実施した一連の遺伝毒性試験を表 2.6.1-3に示す。
Hizentra 2.6.1 緒言 - 8 -表 2.6.1-3 Sandoglobulin Liquidの開発中に実施したL-プロリンの毒性試験 試験の種類 試験番号 動物種 /試験 投与期間 投与方法 投与量 GLP 遺伝毒性試験 4.2.3.7.7 22196 Ames 試験 -- -- L-プロリン:最高 69 μg/plate 適用 遺伝毒性試験 4.2.3.7.7 49196 Ames 試験 -- -- L-プロリン:最高 6970 μg/plate 適用 遺伝毒性試験 4.2.3.7.7 CLE 1554/3-D5140 チャイニーズ ハムスター卵 巣(CHO)を用 いる染色体異 常試験 -- -- L-プロリン:最高 15 mmol 適用 遺伝毒性試験 4.2.3.7.7 CLE 1554/4-D5140 マウス骨髄の 小核試験 5 日 単回投与 L-プロリン:最高 276 mg/kg /day 適用 L-プロリンは添加物 8(ニコチンアミド mmol/L、 L-イソロイシン mmol/L 及び L-プロリン 120 mmol/L を含有する pH の溶液)の1 成分として評価した。 L-プロリンの遺伝毒性データは、添加物溶液「添加物 8」の 1 成分として実施した試験か ら得られた。「添加物8」に含まれる 3 つの添加物については、それらの代謝経路が知られて おり、3 添加物間で相互作用が低いことが示唆されることから、これらの試験は、L-プロリ ン単独でおこなった試験と同様であると考えられた。 非臨床試験に使用したIgPro20 のロットと、それらのロットの臨床試験使用状況を表 2.6.1-4に示す。すべての非臨床試験に使用されたL-プロリンは、ヨーロッパ薬局方又はアメ リカ薬局方に準拠し、そのロットは同一製造工場からのものである。Sandoglobulin Liquid の 開発初期に実施された「添加物8」の非臨床試験に使用したロット以外は、臨床試験用 IgPro20 の製造に使用されたロットと同様、CSLB により品質が保証されていた。非臨床試験及び臨 床試験に使用されたL-プロリンのロットに関する情報を表 2.6.1-5に示す。 表 2.6.1-4 非臨床試験に使用したIgPro20 と臨床試験との関連 IgPro20 包装 Lot (充填Lot) 非臨床試験 IgPro20 の当該 Lot で 実施された臨床試験 ( ) 単回投与薬物動態試験(2.6.4.3.1、PSK 01/05) 局所刺激性試験(2.6.6.7.1、143.143.552) --- ( ) 単回投与薬物動態試験(2.6.4.3.1、PSK 04/05) --- ( ) 局所刺激性試験(2.6.6.7.2、143.140.883) 反復投与薬物動態試験(2.6.4.3.2、PSR 02/06) 用量設定試験(2.6.6.3.1.1、PSR 09/08) ZLB04_008CR ZLB06_001CR 反復投与毒性試験(2.6.6.3.2、AA79918) --- ( ) 安全性薬理試験(2.6.2.4.1、HYR 01/06) ZLB04_009CR ( ) 安全性薬理試験(2.6.2.4.1、HYR 01/06) ZLB04_009CR
Hizentra 2.6.1 緒言 表 2.6.1-5 非臨床試験に使用したL-プロリンと臨床試験との関連 L-プロリンの分 析証明書 R/試験責任者に提供された L-プロリン 非臨床試験 L-プロリンの当該 Lot を含有し、臨床 試験に使用された IgPro20 の Lot IgPro20 の当該 Lot で実施され た臨床試験 * 粉末 ラット験(2.6.6.8.3.228 日間反復皮下投与毒性試、AA89493) --- --- * 粉末 ラット28 日間反復静脈内投与毒性 試験(2.6.6.8.3.2、925/035) --- --- * 粉末 生殖発生毒性試験(2.6.6.8.3.4、 AA30034) ZLB04_008CR * 溶液 単回投与薬物動態試験(2.6.6.8.3.1、PSR 08/06) ZLB04_009CR * 粉末 単回投与薬物動態試験 (2.6.6.8.3.1、PSR 03/07) 反復投与毒性/幼若動物試験 (Irwin 試験、2.6.6.8.3.2、PSR 01/07) 反復投与毒性/幼若動物試験(水 迷路試験、2.6.6.8.3.2、ZLB 06_006) ZLB04_009CR * 粉末 イヌ(2.6.6.8.3.228 日間反復静脈内投与試験、668321) --- --- ** 添加物8 遺伝毒性/22196及びAmes 試験(49196) 2.6.6.8.3.3、 --- --- * 添加物8 遺伝毒性/ In vitro 染色体異常試験(2.6.6.8.3.3、 CLE 1554/3-D5140) マウス小核試験(2.6.6.8.3.3、CLE 1554/4-D5140) *植物由来 L-プロリンの Lot **動物由来 L-プロリンの Lot 表 2.6.1-1に示したIgPro20 の 26 週間反復皮下投与毒性試験及び局所刺激性試験は GLP 適 用下で実施し、薬物動態試験、安全性薬理試験及び用量設定試験についてはGLP 非適用試験 として実施した。 表 2.6.1-2及び表 2.6.1-3に示したL-プロリンの試験については、ラット及びイヌの 28 日 間反復投与毒性試験、遺伝毒性試験及びラットの生殖発生毒性試験はGLP 適用下で実施し、 薬物動態試験及び幼若動物試験についてはGLP 非適用試験として実施した。
ハイゼントラ
20%皮下注 1 g/5 mL
ハイゼントラ
20%皮下注 2 g/10 mL
ハイゼントラ
20%皮下注 4 g/20 mL
2.6 非臨床試験の概要文及び概要表
2.6.2 薬理試験の概要文
CSL ベーリング株式会社
Hizentra 2.6.2 薬理試験の概要文
目次
2.6.2 薬理試験概要文 ... 4 2.6.2.1 まとめ ... 4 2.6.2.2 効力を裏付ける試験 ... 5 2.6.2.2.1 文献情報 ... 5 2.6.2.2.1.1 マウス肺炎球菌菌血症モデルに対する免疫グロブリンの予防及び治療効 果... 5 2.6.2.2.1.2 ヘモフィリスインフルエンザ菌b 型の実験的感染に対する還元したヒト血 清中アルキル化免疫グロブリンの防御効果の低下 ... 6 2.6.2.2.1.3 ヒト静脈内投与用免疫グロブリンの緑膿菌に対する抗体活性 ... 6 2.6.2.3 副次的薬理試験 ... 7 2.6.2.4 安全性薬理試験 ... 72.6.2.4.1 ラット血圧に対するSandoglobulin Liquid、IgG製剤X 及びIgPro20 の影響(HYR 01/06)... 7 2.6.2.4.2 IgG の試験成績(文献情報) ... 9 2.6.2.4.2.1 免疫グロブリン製剤による血圧低下を検出する動物モデル ... 9 2.6.2.4.2.2 最新の製造工程で高度に精製された新規の液状静脈注射用免疫グロブリ ン製剤(10%静脈注射用人免疫グロブリン) ... 10 2.6.2.5 薬力学的薬物相互作用 ... 11 2.6.2.6 考察及び結論 ... 11 2.6.2.7 図表 ... 11
図目次
図 2.6.2-1 IgG 製剤静脈内投与後のラットにおける平均動脈圧の経時変化 ... 9Hizentra 2.6.2 薬理試験の概要文 - 3 -略号・略称の一覧表 略号・略称 内容 ADCC 抗体依存性細胞媒介細胞傷害 BSA ウシ血清アルブミン bw 体重 CFU コロニー形成単位 ELISA 固相酵素免疫測定法 Fab IgG 分子の抗原結合領域 Fc IgG 分子の一部。補体成分 C1q 及び Fc 受容体と相互作用する。 HBs B 型肝炎 Hib ヘモフィリスインフルエンザ菌b 型 IgG 免疫グロブリンG Ph. Eur. ヨーロッパ薬局方 PRP ヘモフィリスインフルエンザ菌b 型莢膜多糖類 SD Sprague Dawley
Hizentra 2.6.2 薬理試験の概要文 2.6.2 薬理試験概要文 2.6.2.1 まとめ IgPro20 の有効成分は健康人から採取した多価免疫グロブリン G(IgG)である。IgPro20 の製造工程を通じてIgG 分子の構造的及び機能的特性は保たれており、IgG サブクラスの血 漿中組成及び抗体スペクトルが保持されている。 効力を裏付けるin vitro 薬理試験は、5 種抗体の特異性(Fab 機能)及び 2 種の Fc 機能に関 する試験(IgG 複合体による補体活性化を測定する試験、及び IgG 複合体と Fcγ受容体との 相互作用を検討する試験)で評価し、IgPro20 の正常な Fab 機能及び Fc 機能が示された (2.3.P.2.2.3)。免疫グロブリンは、食作用、中和活性、ADCC 及び補体依存性溶菌作用のよ うな抗体のエフェクター機能を有することが知られている。また、サングロポールでは特定 のげっ歯類モデルで薬効が示されている。マウスモデルを用いた試験では、肺炎連鎖球菌3 型又は7F 型の致死量で感染誘発した動物に、サングロポールを予防目的及び治療目的で投 与し、その効果を検討した結果、生存率の上昇が認められた(Chudwin 1989)。5 日齢ラット を用いた試験では、サングロポールはヘモフィリスインフルエンザ菌b 型に防御抗体を含有 することが示された(Schreiber ら 1985)。マウス火傷モデルでは、サングロポールは火傷後 感染に対する用量依存的な防御効果を示した(Pollack 1983)。 さらに、IgPro20 をボーラス静脈内投与した後の血圧低下についてラットで検討した。その 結果、中等度の血圧低下が認められたが、静脈注射用人免疫グロブリン製剤と同程度であり、 IgPro20 に対する忍容性は良好であった(表2.6.3-2、4.2.1.3)。IgPro20 の追加薬理試験は実施 しなかった。 また、わずかであるが、動物モデルを用いたヒトIgG の安全性薬理試験が文献報告されて いる。Bleeker らは、静脈注射用人免疫グロブリン製剤の血管作動性に対して高感受性かつ再 現性のある麻酔下ラットモデルについて報告しており(Bleeker ら 1987)、血圧低下の持続時 間及びその程度はIgG の二量体及び重合体に関連があると考えられた。この動物モデルは HYR 01/06で使用された。 このラットモデルで得られた試験成績は、静脈注射用人免疫グロブリン製剤を健康人に投 与した際に一過性に観察される短期の有害事象及び被験者血清中の炎症性サイトカインの一 過性上昇と関連があることが示された(Spycher ら 1999)。したがって、IgPro20 はこの動物 モデルで静脈注射用人免疫グロブリン製剤と同様な作用を示すと考えられる。
Hizentra 2.6.2 薬理試験の概要文 - 5 -管支痙攣作用について、及び麻酔下ウサギを用いて血栓形成について検討した。また、ビー グル犬を用いて心・血管系、呼吸器系及び凝固系への影響についても検討した。その結果、 重大、かつIgG 製剤と関連したアナフィラキシー様反応の発現は認められず、比較製剤でも 呼吸器系への重大な影響や播種性血管内凝固の発現も観察されなかった。 2.6.2.2 効力を裏付ける試験 IgPro20 に含有される免疫グロブリン G は、生物学的機能を発現する Fc 及び Fab 領域を保 持している。Fab 機能は、ELISA アッセイ(抗 HBs 抗体、抗パルボウイルス B19 抗体)、免 疫比濁法(抗ストレプトリジン抗体)又は生物検定法(ジフテリア抗毒素、抗ポリオ抗体) で評価した。Fc 機能は、IgG の主要な 2 つの機能(補体活性化作用及び血球の Fcγレセプタ ーとの相互作用)を測定するin vitro アッセイで評価した。IgG 複合体で誘導される補体活性 化作用は、風疹抗原感作赤血球を用いたIgPro20 による溶血性試験で検定した。この試験は ヨーロッパ薬局方(Ph. Eur.)の Fc 機能試験に準じて実施した。IgG 複合体と Fcγレセプタ ーとの相互作用は、精製ヒト好中球を用いた化学発光アッセイにより測定した。このアッセ イでは、IgPro20 と反応させたウサギ赤血球を用いて細胞の呼吸バーストを評価した。 Fab 及び Fc 機能の検査結果は公表論文(Maeder ら 2011)で報告されており、CTD の 2.3.P.2.2.3に示す。 2.6.2.2.1 文献情報 サングロポールを非臨床で試験した場合の有効性は、3 種類のげっ歯類モデルで証明され ている。サングロポール及びほかの静脈注射用人免疫グロブリン製剤の広範囲な臨床使用経 験を考慮すると、効力を裏付ける薬理試験の追加試験データを本項で提供する必要はないと 考える。 2.6.2.2.1.1 マウス肺炎球菌菌血症モデルに対する免疫グロブリンの予防及び治療効果 公表論文:Chudwin 1989 予防効果の検討では、1 群 5~6 匹の BALB/c 雄マウスに静脈注射用人免疫グロブリン製剤 又は生理食塩液(対照群)を静脈内投与し、投与30 分後、マウスに肺炎連鎖球菌 3 型又は 7F 型生菌を致死量(LD90)で静脈内投与し感染を誘発した。その結果、day 10 で対照群のマ ウス生存率は14%であった。肺炎連鎖球菌 7F 型を接種したマウスでは、サングロポールを 動物当たり0.25 mg、1.0 mg 及び 5.9 mg を投与した場合、day 10 で生存率はそれぞれ 44%、 83%及び 100%まで上昇した。肺炎連鎖球菌 3 型を用いた試験では、サングロポール投与によ り生存率が8%から 58%に上昇した。
Hizentra 2.6.2 薬理試験の概要文 治療効果の検討では、1 群 5 又は 6 匹の BALB/c 雄マウスに肺炎連鎖球菌 3 型又は 7F 型を 最初に90%致死量(LD90)静脈内接種した。24 時間後、感染が確認されたマウスに対して、 数用量の静脈注射用人免疫グロブリン製剤及び生理食塩液(対照群)を投与し生存率を調べ た。その結果、肺炎連鎖球菌7F 型の感染動物では、サングロポールを動物当たり 0.5 mg 及 び5 mg 投与した場合、生存率はそれぞれ 60%及び 89%であり、用量依存的に上昇した(対 照群の生存率19%と比較した場合、p<0.0005)。肺炎連鎖球菌 3 型を用いた試験では、サング ロポールの5 mg 投与群で生存率が 10%から 50%に上昇した。 2.6.2.2.1.2 ヘモフィリスインフルエンザ菌b 型の実験的感染に対する還元したヒト血清 中アルキル化免疫グロブリンの防御効果の低下 公表論文: Schreiber ら 1985 還元したアルキル化静脈注射用人免疫グロブリン製剤、凍結乾燥製剤サングロポール及び 限外ろ過した静脈注射用人免疫グロブリン製剤それぞれの5%溶液を複数段階に希釈して 5 日齢のSD 系アルビノラットに腹腔内投与し、5 x 103 CFU(コロニー形成単位)のヘモフィ リスインフルエンザ菌b 型(Hib)で感染惹起した。
Hib 莢膜多糖類(PRP)に対する抗体を Farr タイプ抗原アッセイで測定し、ほかの Hib 成
分に対する抗体をELISA で測定した。血液中細菌数を接種後 1、2 及び 4 日目に、脳脊髄液 中細菌数を接種後2 日目に測定した。また、血液中抗体濃度を測定した。 その結果、サングロポール及びその他の静脈注射用人免疫グロブリン製剤は用量依存的に ラットをHib 感染から防御した。抗 PRP 抗体を in vitro で吸着除去した後でもサングロポー ルは有意な防御効果を示した。これは、おそらくその他のHib 成分に対する抗体を含んでい たと考えられる。投与1 日後に感染惹起されなかった対照群の平均血清中 PRP 濃度は各投与 群の血清中濃度と同程度であった。Hib で惹起したラットに対して、サングロポール投与群 では化学修飾した静脈注射用人免疫グロブリン製剤を投与した群と比較して、抗PRP 血清レ ベルにより多数の動物が防御された。 サングロポールはHib に対する防御抗体を含有していることが示され、化学的に修飾され た静脈注射用人免疫グロブリンよりも低用量で防御効果が得られた。サングロポールに含ま れる抗体は、IgG 分子の Fc 関連機能が変化した化学的修飾製剤の抗体と比較して効果の高い 機能を有する根拠が得られた。オプソニン活性及び補体活性(古典的経路)ともHib 感染で
Hizentra 2.6.2 薬理試験の概要文
- 7
-6 週齢の Swiss-Webster 雌マウスに静脈注射用人免疫グロブリン製剤及びウシ血清アルブミ
ン(BSA コントロール)10 mg / 0.2 mL を静脈内投与した。Stieritz 及び Holder(1975)の火
傷/感染マウスモデルに従い、マウスは火傷後18 時間目に感染させた。生理食塩液 0.5 mL に細菌を懸濁し、10 倍ごと、6 段階に希釈した液を 1 群 5 匹のマウスの火傷部位に皮下接種 し感染させた。接種後10 日間、動物の生死を観察し、50%致死量(LD50)±95%信頼区間(CI) を算出した。 静脈注射用人免疫グロブリン製剤は、用量依存的に火傷後の感染を抑制した。高力価免疫 グロブリン製剤は最高用量500 mg/kg まで数用量で最大の防御活性を示した。高力価免疫グ ロブリン製剤で防御されたマウスでは緑膿菌免疫タイプ1型に対する LD50は7.95であった。 その他の静脈注射用人免疫グロブリン製剤の中でサングロポールは最大の防御活性を示し、 毒性が強く臨床的に重要な緑膿菌免疫タイプ1 型に対する LD50(log CFU)は 7.56 であった。
これらのLD50値とBSA 対照群の緑膿菌免疫タイプ 1 型に対する LD50(log CFU)2.95 との
差は統計学的に有意であった。ペプシン処理によりFc 領域が欠損した静脈注射用人免疫グロ ブリン製剤は、サングロポールのような通常の静脈注射用人免疫グロブリン製剤と比較して、 防御能が減弱した(LD50:6.23)。 本モデルでは、サングロポールはその他の静脈注射用人免疫グロブリン製剤と比較して優 れた防御活性を示し、その予防効果は臨床的に重要な緑膿菌免疫タイプ1 型に対して最も優 れていた。 2.6.2.3 副次的薬理試験 IgPro20 の副次的薬理試験は実施していない。 2.6.2.4 安全性薬理試験
2.6.2.4.1 ラット血圧に対する Sandoglobulin Liquid、*IgG製剤X 及び IgPro20 の影響(HYR 01/06)
表2.6.3-2;試験報告書 4.2.1.3 安全性薬理(HYR 01/06;ラット血圧に対するSandoglobulin Liquid、*IgG製剤X 及びIgPro20 の影響)
Bleeker らの方法(1987)に従い、ラットを用いてIgPro20(2 ロット)の血圧低下作用を、
*IgG製剤X(1 ロット)、Sandoglobulin Liquid 及び生理食塩液と比較した。試験の第1 の目的は投
与後3 時間の観察期間で平均動脈圧の最小値を求めることであり、第2 の目的は収縮期及び
拡張期動脈圧、それらの最小値に到達するまでの時間を求めることである。体重216 g~303 g
の6~8 週齢 CD 系雌ラット24 匹を1 群5 匹、5 群に分けた。IgG 投与群には、*IgG製剤X 投与
群(投与容量2.5 mL/kg)、Sandoglobulin Liquid 投与群(投与容量2.08 mL/kg)及びIgPro20
Hizentra 2.6.2 薬理試験の概要文 投与群(2 ロット)(投与容量 1.25 mL/kg)とし、それぞれ IgG として 250 mg/kg をボーラス 静脈内投与した。対照群の4 匹には生理食塩液 2.0 mL/kg をボーラス静脈内投与した。 被験物質: *IgG製剤X、ロット番号: IgPro20、ロット番号: 及び Sandoglobulin Liquid、ロット番号: 生理食塩液 血圧は頸動脈圧を観血的方法で測定した。血圧データは各動物の投与前血圧を100%とし た場合の百分比に変換した。 結果 陽性対照群のSandoglobulin Liquid では、生理食塩液対照群の約70%平均動脈圧を示し、中 等度な血圧低下が惹起された。*IgG製剤X のロット番号 及びIgPro20 のロット番号 では同程度な血圧低下が惹起され、Sandoglobulin Liquid による変化との違いは 認められなかった。IgPro20 の2 番目のロット( )では、わずかに強い血圧低下 が惹起されたが、このモデルの個体差の範囲内であった。注目すべき変化として、生理食塩 液、10%静脈注射用人免疫グロブリン製剤及びSandoglobulin Liquid 投与群で投与直後に短期 の血圧上昇が観察された。この影響は投与容量によるものと考えられ、*IgG製剤X(投与容量2.5 mL/kg)で最大、Sandoglobulin Liquid(投与容量2.08 mL/kg)及び生理食塩液(投与容量2.0 mL/kg) で中程度、IgPro20(投与容量1.25 mL/kg)で最低であった。平均血圧の時間経過を図 2.6.2-1 に示す。
Hizentra 2.6.2 薬理試験の概要文 イで予測できなかった静脈内投与用免疫グロブリン製剤の血管に対する影響を観察する上で 感度が高く、かつ再現性のあるモデルであることが示された。 2.6.2.4.2.2 最新の製造工程で高度に精製された新規の液状静脈注射用免疫グロブリン製 剤(10%静脈注射用人免疫グロブリン) 公表論文: Teschner ら 2007 10%静脈注射用人免疫グロブリンの異なる 3 ロットについて、安全性薬理パラメーターを Gammagard S/D 及び市販の静脈注射用人免疫グロブリン製剤と比較した。 麻酔下の自然発症高血圧ラットに、10%静脈注射用人免疫グロブリン開発品 1 g/kg 及び Gammagard S/D をそれぞれボーラス動脈内投与した後、血圧への影響を検討した。血圧デー タは公表論文には載せられていないが、新規製剤で惹起された血圧低下は、市販の静脈注射 用人免疫グロブリン製剤による血圧低下と同程度であったことのみ記述されている。このラ ットモデルにみられた血圧低下はアナフィラキシー様反応の指標として使用されている。 30%以上の平均動脈圧低下が 1 分以上持続とすると定義される多くのアナフィラキシー様反 応陽性の回数を調べた。その結果、投与群間に差は認められなかった。 アナフィラキシー様反応は結果として肺膨張圧の上昇を誘発するが、そのようなアナフィ ラキシー様反応を誘発する物質に対する感受性が知られているので、モルモットを用いて気 管支攣縮の影響について検討した。30%以上の肺膨張圧上昇が 1 分以上持続すると定義され るようなアナフィラキシー様反応陽性回数を調べた。10%静脈注射用人免疫グロブリンの投 与後にそのような反応は観察されなかった。 ウサギに異なるロットの10%静脈注射用人免疫グロブリン製剤 500 mg/kg、陰性対照物質 及び陽性対照物質を投与し、血栓形成を半定量的スコア化により評価した。10%静脈注射用 人免疫グロブリン製剤を投与されたウサギでは、2 以上のスコア(数個の中型血栓又は多数 の小型血栓)を示さず、この製剤が血栓形成を誘発するリスクは低いと考えられた。 さらに、10%静脈注射用人免疫グロブリンの治験薬について、呼吸器パラメーターを含む 生命維持に必要な機能に対する影響をイヌで検討した。その結果、10%静脈注射用人免疫グ ロブリン製剤500 mg/kg を投与した麻酔下イヌの 12 例中 1 例、及び市販製剤の同用量を投与 した4 例中 1 例のイヌに呼吸器への影響が認められた。筋肉内注射用免疫グロブリン製剤は
Hizentra 2.6.2 薬理試験の概要文 - 11 -要約すると、非臨床モデルでは新規の静脈注射用人免疫グロブリン製剤は市販製剤と比較 して優れた安全性プロファイルを有すると結論づけられた。 2.6.2.5 薬力学的薬物相互作用 ヒト免疫グロブリンは、生ワクチンの効果を減弱させるおそれがあることが既に知られて おり、「相互作用(併用注意)」として、静注用人免疫グロブリン製剤の添付文書に記載され ている。添付文書の「適用上の注意」には、ヒト免疫グロブリンは、調製時に、ほかの製剤 との混注は避けることと記載されている。ほかの薬剤との重大な薬力学的相互作用は、ヒト 免疫グロブリンに関しては報告されておらず、IgPro20 でも同様に重大な薬力学的相互作用を 発現する可能性が低いことから、薬物相互作用に関する試験を検討する必要性はないと考え られた。 2.6.2.6 考察及び結論 IgPro20 は、免疫化学的及び生物学的アッセイ法で抗体定量(Fab 機能)が行われた特異抗 体を広範囲に含有する高度に精製された皮下注射用人免疫グロブリン製剤である。このFab 機能に加え、「低又は無ガンマグロブリン血症」に関連する2 つの主要な Fc 機能(補体活性 化及び食細胞のFcγ 受容体との相互作用)について in vitro 試験で評価した結果、IgPro20 の 薬理効果を示す動物試験は必要ないことが示唆された。また、サングロポールは、特定のげ っ歯類モデルで有効性が示されている。マウスモデルでは、肺炎連鎖球菌3 型又は 7F 型の 致死量で感染を誘発した動物にサングロポールを投与し、その予防効果及び治療効果を検討 する試験を行った結果、生存率上昇が認められた。5 日齢ラットで、サングロポールはヘモ フィリスインフルエンザ菌b 型に対する防御抗体を含むことが示された。火傷マウスモデル で、サングロポールは火傷後感染に対する用量依存的な防御活性を示した。さらに、免疫グ ロブリンは食作用、中和活性及びADCC のような抗体のエフェクター機能を有することが文 献的に示されている。したがって、IgPro20 に含まれるヒト免疫グロブリンの効果は十分に確 立されているものと考えられる。 ラットを用いて、IgPro20 のボーラス静脈内投与後の血圧低下作用について検討した。その 結果、IgPro20 の忍容性は良好であり、認められた血圧の変化は市販の静脈注射用人免疫グロ ブリン製剤と同程度であった。この成績は、2 つの静脈注射用人免疫グロブリン製剤の安全 性薬理試験に関する文献データと一致しており、予測できない変化はみられなかった。した がって、これらの成績はIgPro20 を誤って静脈内投与しても患者に重大なリスクを引き起こ さないことを示唆するものである。 2.6.2.7 図表 前記に示した以外に追加する図表はない。
ハイゼントラ
20%皮下注 1 g/5 mL
ハイゼントラ
20%皮下注 2 g/10 mL
ハイゼントラ
20%皮下注 4 g/20 mL
2.6 非臨床試験の概要文及び概要表
2.6.3 薬理試験概要表
Hizentra 2.6.3 薬理試験概要表 2
-目次
2.6.3 薬理試験概要表 ... 4 2.6.3.1 薬理試験:一覧表 ... 4 2.6.3.2 効力を裏付ける試験 ... 5 2.6.3.3 副次的薬理試験 ... 5 2.6.3.4 安全性薬理試験 ... 5 2.6.3.5 薬力学的薬物相互作用試験 ... 7 Hizentra 2.6.3 薬理試験概要表 2-Hizentra 2.6.3 薬理試験概要表
表目次
表 2.6.3-1 薬理試験:一覧表 ... 4 表 2.6.3-2 安全性薬理試験 (HYR 01/06) ... 6
Hizentra 2.6.3 薬理試験概要表
4 -2.6.3 薬理試験概要表
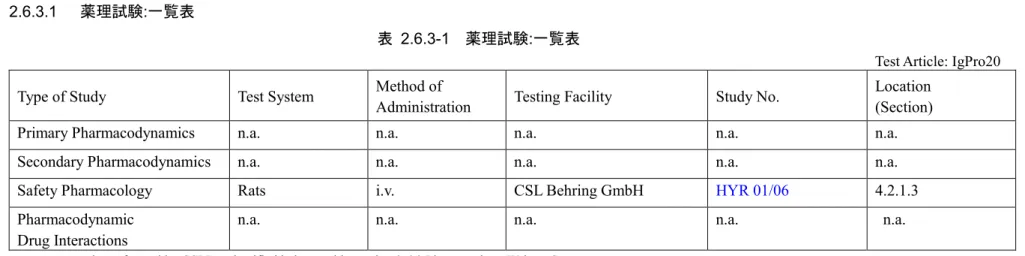
2.6.3.1 薬理試験:一覧表
表 2.6.3-1 薬理試験:一覧表
Test Article: IgPro20 Type of Study Test System Method of Administration Testing Facility Study No. Location (Section)
Primary Pharmacodynamics n.a. n.a. n.a. n.a. n.a.
Secondary Pharmacodynamics n.a. n.a. n.a. n.a. n.a.
Safety Pharmacology Rats i.v. CSL Behring GmbH HYR 01/06 4.2.1.3
Pharmacodynamic
Drug Interactions n.a. n.a. n.a. n.a. n.a.
n.a.: no study performed by CSLB as justified below and in section 2.6.2 Pharmacology Written Summary.
Hizen tra 2.6.3 薬理試 験概要 表 4
-Hizentra 2.6.3 薬理試験概要表
2.6.3.2 効力を裏付ける試験
効力を裏付ける薬理試験として、IgPro20 は in vitro で正常な Fab 及び Fc 機能を示したこと
(2.3.P.2.2,3)が確認されたため、in vivo 試験は実施しなかった。 2.6.3.3 副次的薬理試験 該当試験なし 2.6.3.4 安全性薬理試験 IgPro20 をラットにボーラス静脈内投与した場合の血圧低下作用を検討した(表 2.6.3-2)。 そのように、一部の安全性薬理試験しか実施しなかったが、公表論文から得られた情報を薬 理試験の概要文(2.6.2)に記載した。 Hizentra 2.6.3 薬理試験概要表
Hizentra 2.6.3 薬理試験概要表
6
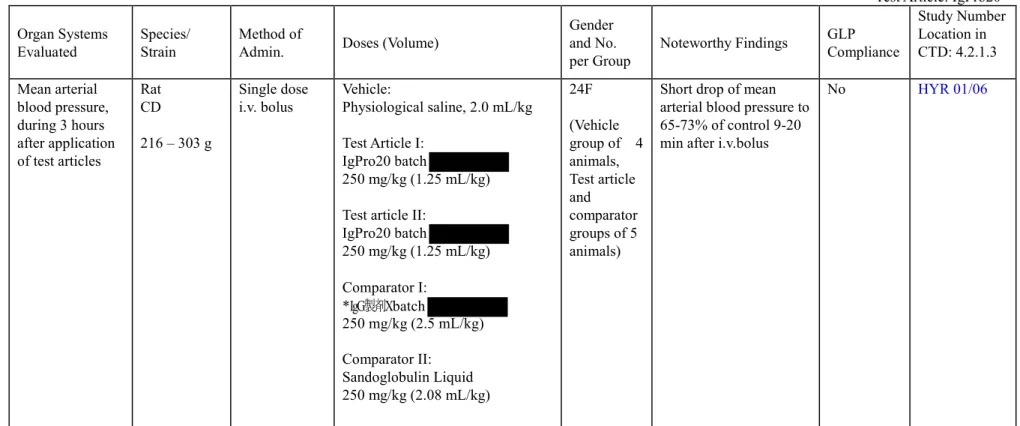
-表 2.6.3-2 安全性薬理試験 (HYR 01/06) 試験表題:
ラット血圧に対する IgPro20 の影響
Test Article: IgPro20 Organ Systems
Evaluated Species/ Strain Method of Admin. Doses (Volume)
Gender and No.
per Group Noteworthy Findings
GLP Compliance Study Number Location in CTD: 4.2.1.3 Mean arterial blood pressure, during 3 hours after application of test articles Rat CD 216 – 303 g Single dose
i.v. bolus Vehicle: Physiological saline, 2.0 mL/kg Test Article I:
IgPro20 batch
250 mg/kg (1.25 mL/kg) Test article II:
IgPro20 batch 250 mg/kg (1.25 mL/kg) Comparator I: *IgG製剤X batch 250 mg/kg (2.5 mL/kg) Comparator II: Sandoglobulin Liquid 250 mg/kg (2.08 mL/kg) 24F (Vehicle group of 4 animals, Test article and comparator groups of 5 animals)
Short drop of mean arterial blood pressure to 65-73% of control 9-20 min after i.v.bolus
No HYR 01/06
Conclusion: Two lots of IgPro20 were well tolerated with regard to the hypotension evoked. Hypotension was only moderate and in the same order of magnitude as caused by comparators *IgG製剤X and Sandoglobulin Liquid.
Hizen tra 2.6.3 薬理試 験概要 表 6
-*新薬承認情報提供時に置き換え
Hizentra 2.6.3 薬理試験概要表 2.6.3.5 薬力学的薬物相互作用試験 IgPro20 の薬力学的相互作用試験は実施していない。ヒト IgG 製剤は一般に広く用いられ ており、明らかな毒性を発現するような薬物相互作用は報告されていない。したがって、 IgPro20 で薬物相互作用が発現することを予測することは難しい。 Hizentra 2.6.3 薬理試験概要表