原 著
ブタガラス化胚のシリンジ内加温・希釈における
加温・希釈液の温度および量の検討
瀧下梨英
1*・平山祐理
1・橋谷田豊
1**
1独立行政法人家畜改良センター,福島県西白河郡西郷村,961-8511 * 現所属)独立行政法人家畜改良センター宮崎牧場,宮崎県小林市,886-0004 ** 現所属)石川県立大学,石川県野々市市,921-8836 (2020 年 2 月 20 日受付,2020 年 7 月 30 日受理) 要 約 ガラス化保存したブタ胚の移植は,特別な施設や技術を要する。このため,種豚農 場でのブタ胚移植の普及および定着に向けて,ガラス化胚の簡易で高位安定的な成績が得られ る加温・希釈方法を検討した。Micro Volume Air Cooling 法によりガラス化した胚盤胞の加 温・希釈をシリンジ内で行う簡易な方法により産子はすでに得られているが,流産および胚死 滅率は 40% と高かった。その際に用いられていた加温・希釈液の温度および量は,実験室の顕 微鏡下で加温・希釈を行う従来法の条件(45℃,3 ml)に準じたものであり,シリンジ内加温・ 希釈法での至適条件の検討が必要と考えられた。そこで,加温・希釈液に対する外気温の影響 について,15℃,27℃室温下または 38℃保温下で 1.5 ml,2 ml または 3 ml の加温・希釈液に胚 を付着させていないガラス化保存用容器を挿入し,その後 3 分間の加温・希釈液の温度変化を 調査した。その結果,15℃室温下では加温・希釈液の温度が 8∼10℃程度,27℃室温下では 4∼ 6℃程度低下した。一方,38℃保温下では一旦,1℃程度の温度低下があったが,3 分後にはガラ ス化保存用容器の挿入前に比べて 0.1℃程度の低下にとどまった。つぎに移植液量と受胎およ び分娩成績との関係を調査した。1.5 ml および 3 ml の加温・希釈液を各々 39℃に保温した状 態で加温・希釈したガラス化胚 12∼16 個を各々 5 頭に移植した。その結果,ともに 4 頭が受胎 して,各々 19 頭および 17 頭の産子を生産した。分娩率は各々 80% および 60% であった。ま た,移植胚数に対する産子率は各々 23.6% および 27.5% であり,ともに液量の間に有意差はな く,同等の成績であった。一方,加温・希釈液を 39℃に保温することで,当初 40% であった流 産および胚死滅率が 1.5 ml および 3 ml で各々 0% および 25.0% に改善された。以上のことよ り,シリンジ内加温・希釈において,加温・希釈液は 39℃に保温することが至適であり,加温・ 希釈液量は 1.5 ml および 3 ml で良好な成績が得られることが示された。 ─────────────────────────緒
言
種豚農場では,閉鎖的な繁殖による飼養豚の近交 係数を上げないために定期的に育種素材を外部から 導入する必要がある。これらの導入は一般に豚個体 で行われるが,胚移植技術を用いれば,生体からの 病原体の侵入リスクが軽減できるだけでなく,馴致 の失敗がなくなる。液体窒素は細菌に汚染されてい る可能性があるが(DANIELら,2017),ガラス化保存 用容器を液体窒素に直接触れさせずに胚を冷却する Micro Volume Air Cooling(MVAC)法(MISUMIら,2013)によるブタガラス化保存胚を用いた非外科移 植において,近年 60% の分娩率が得られている(三 角ら,2020)。また,従来から行われているブタガラ
ス化胚の加温・希釈は,実験室内での高度な胚操作 技術を要する方法(以下,従来法)であるが,ガラ ス化保存用容器を加温・希釈液が入ったシリンジに 差し込むだけでガラス化胚を加温・希釈する簡易な 方法(以下,シリンジ内加温・希釈法)が開発され, 100% の受胎率が得られている。しかし,流産およ び胚死滅率が 40% と高いといった問題が残されて いる(瀧下ら,2019)。 MVAC 法を用いた従来法では,加温・希釈液の温 度が 38℃に比べて 45℃で透明帯脱出率が有意に高 いという報告(水戸ら,2012)があるが,シリンジ内 加温・希釈法での加温・希釈液の最適温度の調査は 行われていない。一方,シリンジ内加温・希釈にお ける加温・希釈液の量は,従来法(MISUMIら,2013) に準じ,3 ml で行った場合に上記の 100% の高い受 胎率を得たが,分娩時には 60% に低下した(瀧下 ら,2019)。移植液の量が受胎性に及ぼす影響につ いては,液量の減少により受胎成績が向上したとす る報告がある(NAKAZAWAら,2008)。このため,シ リンジ内加温・希釈法において受胎性および妊孕性 を高位安定的に得るためには,胚とともに子宮内に 注入する加温・希釈液の至適量の検討が必要であ る。 本研究は,ブタガラス化胚の加温・希釈方法の簡 易的な手技を開発するなかで,加温・希釈液の至適 温度および至適量を検討することを目的とした。は じめにガラス化保存用容器の挿入によるシリンジ内 の加温・希釈液の温度変化を調べ,その後ガラス化 胚を用いた移植試験を行い,受胎性および妊孕性に 及ぼす影響を調査した。
材料および方法
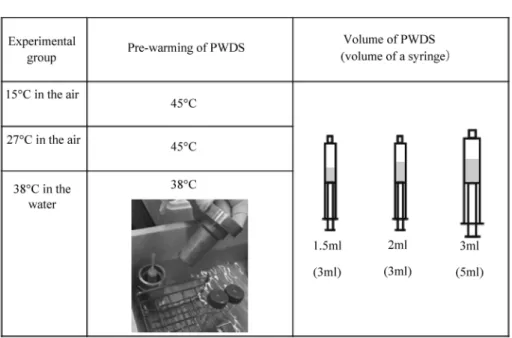
1. 動物実験 本実験は,独立行政法人家畜改良センター動物実 験実施規程に従って計画し,動物実験検証委員会の 審査,了承を得て行った(承認番号 29-08)。 2. 試験 1,シリンジ内加温・希釈法における加 温・希釈液の温度変化 加温・希釈液は,市販のブタ胚ガラス化保存液 キット(機能性ペプチド研究所,山形)のエチレン グリコールおよびトレハロースを添加した PWDS を用いた。これらは,あらかじめ 15 ml のコニカル チューブ(Corning Incorporated - Life Sciences, Reynosa,TAMP,Mexico)に入れ,ラテックスフ リーのプラスチック製シリンジ(HSW NORM-JECTPlastic Syringes,VWR International,Radnor,PA, USA)はビニール製の袋に入れて上部を縛り,45℃ の温湯中で各々温度を平衡した(水戸ら,2012)。 PWDS の容量は, 1.5 ml,2 ml または 3 ml の 3 区 を設け,これらを各々シリンジに入れた。また,加 温環境は,15℃,27℃の室温下または 38℃保温下の 3 つの区を設定して,合計 9 試験区間において液体 窒素から取り出したガラス化保存用容器(胚ス ティック,ミサワ医科工業,茨城)のシリンジへの 挿入による PWDS の温度の変化を比較した。温度 測定は,デジタル式温度記録装置(おんどとり Jr. TR-52i,T&D,長野)により行った。温度制御され ていない豚舎で移植を行うことを想定した 15℃室 温区および 27℃室温区では,ガラス化保存用容器を 差し込む直前に各量の PWDS をシリンジに入れて 試験管立に立てた。38℃保温区では,ガラス化保存 用容器を差し込む 2 分前に各量の PWDS をシリン ジに入れてアルミ製の保温器具(アルミブロック, ミサワ医科工業,茨城)に格納し,38℃の温湯中に 浸漬して保温した(図 1)。胚が付着していないガラ ス化保存用容器を液体窒素中から 1 本取り出して PWDS が入ったシリンジに差し込み,その後ガラス 化保存用容器を筒先で 10 秒間回転させた後にガラ ス化保存用容器を抜き,ガラス化保存用容器挿入直 前,1 分,2 分および 3 分後の PWDS の温度を調査 した。シリンジ内加温・希釈では,加温・希釈から 2∼3 分後に移植を完了できるため,ガラス化保存用 容器のシリンジへの挿入から 3 分間の温度変化の調 査とした。なお,実際の胚移植では,胚を付着させ たガラス化保存用容器の先端部分を液中に確実に浸 漬する必要があるため,シリンジの筒先からガス ケットの間に十分な領域を確保する目的で PWDS の容量が 1.5 ml および 2 ml では 3 ml 容量用のシリ ンジを用い,PWDS の容量が 3 ml では 5 ml 容量用 のシリンジを使用した。 3. 試験 2,加温・希釈液の保温および容量がシ リンジ内加温・希釈法よるガラス化胚の受胎 性および妊孕性に及ぼす影響 3-1.ガラス化および移植の供試胚 供試豚は,独立行政法人家畜改良センター(以下, センター)本所で飼養している 8∼46ヶ月齢の大 ヨークシャー種およびデュロック種を用いた。胚の 採取のための供胚豚の排卵誘起は,エストラジオー ルプロピオン酸エステル(オバホルモンデポー筋注 5 mg,あすか製薬,東京,以下 EDP)を使用した
HIRAYAMAら(2019)の方法,安息香酸エストラジ オール(動物用オバホルモン注,あすかアニマルヘ ルス,東京,以下 EB)を使用した平山ら(2014)に 準じた方法,またはこれら持続性エストロジェン製 剤を用いない,いずれかの方法で行った(瀧下ら, 2019)。人工授精は,精子数 35 億/70 ml に人工授精 用精液希釈液(HIRO-SWINE B 液,ヒロスワイン, 岐阜)で調整した液状精液を用い,各処理の hCG (動物用ゴナトロピン,あすかアニマルヘルス,東 京)投与後 24 時間および 41 時間の合計 2 回行っ た。供試胚は,hCG 投与翌日を 0 日として 6 日目に 供胚豚から外科的に採取した。採取胚の発育段階お よび品質は,胚移植マニュアルの指標(柏崎ら, 1996)に従って形態学的に評価した。 3-2.胚のガラス化 採胚直後の形態学的観察により胚盤胞以上の発育 が認められた胚および発育が遅い胚に対して行った 体外培養により採胚から 6 時間以内に胚盤胞以上の 発育段階に達した胚をガラス化に用いた。12∼16 個の胚を MVAC 法により,ガラス化保存用容器を 用いて 25∼28℃の室温下でガラス化した。ガラス 化には,市販のブタ胚用ガラス化液(PES-1,PES-2 および PVS,ブタ胚ガラス化保存液キット,機能性 ペプチド研究所,山形)を用いた。45℃に加温した PES-1,PES-2 および PVS の 100 μl のドロップを 38℃の加温板上のディッシュに作製し,胚を PES-1,PES-2 の順に各々 5 分間平衡した後,PVS に入 れ,直ちに極少量の PVS とともにガラス化保存用 容器に付着させ,あらかじめ冷却した 0.25 ml スト ローに差し込み,ガラス化した(水戸ら,2012)。な お,胚は,ガラス化保存用容器の先端から 1.5 cm の 位置にある胚付着位置の目印であるスリットよりも 先に付着させた。PVS に胚を入れてからガラス化 保存用容器を保管ストローに差し込むまでの時間は 1 分以内とした。そのままガラス化保存用容器はス トローを被せて液体窒素保管器内に保存した。 3-3.受胚豚への発情誘起処理 受胚豚は,センター本所で飼養している 7∼19ヶ 月齢の大ヨークシャー種およびデュロック種の未経 産豚計 10 頭を用い,PWDS の液量の違いで設定し た 1.5 ml 区および 3 ml 区に各々 5 頭を配置した。 受胚豚の発情は自然発情時に人工授精を施すことに より妊娠させた後,人工授精後 40 日までにプロス タグランジン製剤であるクロプロステノール(プラ ネート,インターベット,東京)0.2625 mg を 24 時 間間隔で 2 回投与し,2 回目の投与時に eCG(動物 用セロトロピン,あすかアニマルヘルス,東京)を 750 IU,さらに 72 時間後に hCG を 500 IU 投与して 発情を誘起した(GUTHRIEと POLGE,1978 ; LOVEと
GREY,1993)。 3-4.ガラス化胚の加温・希釈および移植 PWDS の容量として 1.5 ml および 3 ml を設定 し,これら 2 つの区を比較した。移植は,hCG 投与 翌日を 0 日目として 5 日目の受胚豚に実施した。ガ 図 1. 異なる温度環境および PWDS 量における PWDS の温度変化の実験計画 Fig. 1. The experimental design to investigate the temperature transition of PWDS.
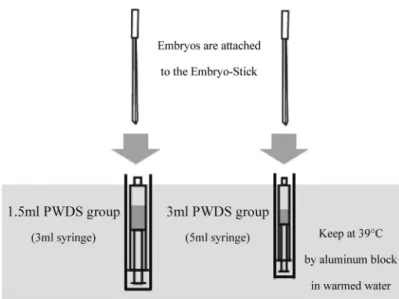
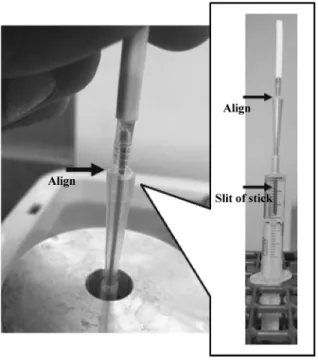
ラス化胚の加温・希釈および移植は,両試験区とも に 25∼28℃の手術室で行った。39℃に加温した PWDS を充填したシリンジをアルミ製の保温器具 に入れ,各々 39℃で保温した。試験 1 において, 38℃保温下ではすべての液量において,一旦,1℃程 度の温度低下があったため,39℃とした。試験 1 に 準じて,1.5 ml 区では 3 ml 容量用のシリンジ,3 ml 区では 5 ml 容量用のシリンジを使用した。胚が付 着したガラス化保存用容器を液体窒素に浸漬した保 管ストローから取り出し,直ちにシリンジの筒先か ら挿入して胚を PWDS 中に離脱させた(図 2)。シ リンジに入った PWDS の保温に使用したアルミ製 の保温器具は金属のため,中に入れたシリンジや挿 入したガラス化保存用容器の位置を確認することが できない。そこで,シリンジへのガラス化保存用容 器の挿入用のガイドとしているピペットチップの長 さをシリンジの容量に従って変えた。胚を付着させ ているガラス化保存用容器先端部が PWDS に浸漬 するようにピペットチップ上端とガラス化保存用容 器柄の下端の位置を合わせることにより,調節した (図 3)。その後,胚が入ったシリンジを胚注入用カ テーテル(PP カテーテル猫用先穴式,富士平工業, 東京)に接続して,黄体が確認できた受胚豚の子宮 角に,PWDS とともに熟練者が外科的に移植した。 1.5 ml 区および 3 ml 区で各 5 頭の受胚豚に各々 12∼16 胚を移植した。移植後の受胚豚は豚舎に戻 し,受胎豚は分娩時まで単飼し,不受胎豚は群に戻 した。妊娠診断は胚齢 22∼42 日に超音波画像診断 装置(HS-101V ,本多電子,愛知)を用いて行い, 胎嚢および胎子がともに確認できた受胚豚を妊娠陽 性と判定した。なお,ブタの場合,30 日齢以前は 胚,それ以降は胎子と定義される(日本家畜人工授 精師協会,2015)。死亡時期が胚であれば胚死滅,胎 子であれば流産とした。 3-5.統計処理 統計処理は,市販の統計処理ソフト(4Steps エク セル統計第 4 版,オーエムエス出版,東京)を用い て行った。受胎率,流産率,胚死滅率,分娩率およ び移植した胚数に対する産子率については,χ−2乗 検定により分析した。子数,生時体重および妊娠期 間については,一元配置分散分析を用いた。なお, 有意差の水準は,P<0.05 と設定した。
結
果
試験 1 15℃室温区では,PWDS 1.5 ml 区,2 ml 区および 3 ml 区の温度が各々 10.58±0.30℃,10.48±0.73℃お よび 7.84±0.48℃低下した。27℃室温区では,各々 の区で PWDS の温度が 5.74±0.43℃,5.68±0.74℃ および 3.92±0.21℃低下した。一方,38℃保温区で は,各々の区で PWDS の温度が 0.16±0.09℃,0.06 ±0.06℃および 0.04±0.06℃低下した(図 4)。 図 2. 39℃保温下における 1.5 ml または 3 ml の PWDS で希釈するガラス化胚のシリンジ 内加温・希釈の方法Fig. 2. The method of dilution for vitrified embryos with 1.5 or 3 ml of PWDS in a syringe
試験 2 試験 1 の室温区では PWDS の温度の著しい低下 が認められたことから,試験 2 の移植試験では ウォーターバスおよびアルミ製の保温器具を用いて シリンジおよびシリンジ内の PWDS を保温して加 温・希釈を行った。1.5 ml 区および 3 ml 区で各々移 植した 5 頭中 4 頭が受胎し,このうち 4 頭および 3 頭が分娩した(図 5)。なお,移植後(移植日を 0 日 として)16 日目に受胎を確認した 3 ml 区の受胎豚 1 頭は,その翌日の移植後 17 日に胎嚢および胎子の 消失を確認した。このことから,PWDS を保温した 今回の試験では,胚死滅率は 1.5 ml 区および 3 ml 区で各々 0%(0/4)および 25.0%(1/4)であった。 1.5 ml 区および 3 ml 区の移植胚の総数に対する産 子率は,各々 23.6%(17/72)および 27.5%(19/69) であった(表 1)。平均生時体重は各々 1.5±0.4 kg および 1.7±0.4 kg であり,妊娠期間は各々 117.5± 0.6 日および 117.7±1.2 日であった。受胚豚 1 頭あ たりの娩出された平均子豚数は,1.5 ml 区では 4.3± 0.5 頭であり,受胚豚 4 頭が分娩した計 17 頭の子豚 の内訳は雄 8 頭,雌 7 頭,死産雌 1 頭およびミイラ 1 頭であった。3 ml 区の平均子豚数は 6.3±2.1 頭で あり,受胚豚 3 頭が分娩した計 19 頭の子豚の内訳 は雄 11 頭,雌 6 頭,白子雌 1 頭およびミイラ 1 頭で あった。両区間において試験 2 のすべての結果に有 意差はなかった。なお,両区とも,娩出された子豚 の外貌および行動に異常は認められなかった。 図 3. シリンジ加温用のアルミ製の保温器具を使用 した加温・希釈時におけるガラス化保存用容 器の挿入方法。ピペットチップ上端とガラス 化保存用容器柄の下端の位置を合わせるよう に挿入することにより,ガラス化保存用容器 のスリットよりも先部に付着している胚が保 温された PWDS 中に浸漬される。
Fig. 3. Insertion method of embryo-stick into the
syringe using aluminum block. When an up-per end of a pipette tip is aligned with a lower end of a handle of the embryo-stick, embryos attached at the top from a slit of the embryo-stick is immersed into warmed PWDS.
図 4. 15℃,27℃室温区または 38℃保温区における 1.5 ml,2 ml または 3 ml の PWDS を用いたガラス
化保存用容器挿入後の液温変化
Fig. 4. Change of temperature of PWDS. An embryo-stick take out from LN2 were inserted in 1.5, 2 or
考
察
試験 1 ガラス化保存用容器のシリンジへの挿入から 3 分 後の PWDS の温度の低下は,15℃室温下において は PWDS 1.5 ml および 2 ml では 10℃程度であっ た。また,PWDS 3 ml では 8℃程度であったため, 15℃よりも環境温度が低い場合はガラス化保存用容 器のシリンジ挿入後における PWDS の温度がさら に低下することが予想される。ブタ胚は低温感受性 が非常に高いことから(POLGEら,1974),生産現場 で行うシリンジ内加温・希釈法では,ガラス化胚の 加温・希釈時の PWDS の保温により,胚の生存性や 受胎性が向上する可能性があると考えられた。シリ 図 5. 39℃で保温した 3 ml の PWDS を用いてシリンジ内加温・希釈をしたブタガラス化保存胚を外科 移植して得られた産子Fig. 5. Piglets by surgical embryo transfer. Blastocysts vitrified were warmed and diluted in 3 ml of
PWDS incubated at 39℃ in a syringe.
表 1. MVAC 法でガラス化したブタ胚のシリンジ内加温・希釈における加温・希釈液(PWDS)量の
違いによる移植成績
Table 1. Pregnancy and delivery results of transferred blastocysts vitrified by MVAC and diluted and
warmed in syringe with different volume of porcine warming and dilution solution (PWDS). Volume of
PWDS
No. of recipients No. of pregnancy
No. of
farrowing No. of piglets
Rate of piglets production1) (No. of transferred
total embryos) (%) (%) (male : female) (max-min)
1.5 ml 5 4 4 172) 23.6%
(72) (80.0) (80.0) (8 : 8) (35.7%-0%)
3 ml 5 4 3 192) 27.5%
(69) (80.0) (60.0) (11 : 7) (61.5%-0%)
1)Delivered piglets / transferred embryos
ンジを保温しないシリンジ内加温・希釈法を用いた 移植に際し,45℃のウォーターバスで温度平衡させ た PWDS を 25∼28℃の外気中に取り出し加温・希 釈を行い,60% の分娩率であった(瀧下ら,2019)。 また,MVAC 法によりガラス化保存した体外生産 胚を従来法で加温・希釈した胚盤胞の透明帯脱出率 は,PWDS の温度が 38℃に比べて 45℃で有意に高 いことが報告されている(水戸ら,2012)。従来法で はディッシュを 38℃に設定した加温板上に置くが, ディッシュ全体を保温材で覆わないため,PWDS の 温度は 38℃よりも低くなる。しかし,38℃のアルミ 製の保温器具内でシリンジに入った PWDS を保温 した場合は,ガラス化保存用容器を差し込むと 1℃ 程度の低下があるが,その後,3 分後までに温度が 38℃に回復するため,3 分時点の温度低下は 0.1℃程 度と極めて小さい。このため,本試験によるシリン ジ内加温・希釈法では,温度の低下を見込んで PWDS を 45℃といった比較的高い温度で用意して おく必要はなく,39℃を維持できる器具などを用い た保温が好適であると考える。ブタの体温は 38.9℃ であり(中村,1989),PWDS を保温した場合のガラ ス化保存用容器挿入 3 分後の温度低下は 0.1℃程度 であるため,39℃に保温することとした。 試験 2 試験 1 の結果から,PWDS が入ったシリンジの保 温により,液体窒素から取り出したガラス化保存用 容器挿入後の PWDS の温度低下を大きく抑制する ことが判明した。このため,PWDS を 39℃に保温 した状態で,液量の異なる PWDS を用いたガラス 化保存胚のシリンジ内加温・希釈による外科移植後 の受胎性を調査した。その結果,シリンジを保温し ないシリンジ内加温・希釈法を用いた移植の分娩率 60%,産子率 19.3% ならびに流産および胚死滅率 40%(瀧下ら,2019)に対し,シリンジを保温した 1.5 ml 区および 3 ml 区で各々,分娩率 80.0% および 60.0%,産子率 23.6% および 27.5% ならびに胚死滅 率 0% および 25.0% が得られた。1.5 ml 区および 3 ml 区で有意差がなかったことから,39℃に保温を 確実に行ったシリンジ内加温・希釈において,液量 が 1.5-3 ml の範囲であれば,良好な移植成績を得ら れると考えられた。また保温することにより,特に 胚 死 滅 率 は 大 幅 に 低 下 さ せ る こ と が で き た。 NAKAZAWAら(2008)による 1.6 ml および 3.2 ml の 移植液を使用した新鮮胚の非外科移植では分娩率が 各々 60.0% および 0% と,1.6 ml で有意に高い成績 であり,差がなかった本試験とは異なる結果であっ た。この原因のひとつとして,移植方法の違いが考 えられる。移植器具や移植操作によっては,生殖器 道内に損傷を与える可能性が高い非外科移植と比較 して,本試験で行った外科移植は安定的に受胎成績 を得ることができるため,分娩成績に差が生じな かったことが考えられる。また,従来法では,加 温・希釈後のガラス化胚をブタ後期胚発生培養用培 地(PBM,MITOら,2012)に 20 mM HEPES を添加 して緩衝した PBM-Hepes 液で洗浄し,同液を移植 液として共に注入する(瀧下ら,2019)。しかし,今 回用いたシリンジ内加温・希釈法では,ウシではす でに世界的に用いられているグリセロール(MASSIP と ZWALMEN,1984)やエチレングリコール(DOCHI ら,1998)といった凍害防止剤を移植液に含む凍結 胚の直接移植法と同様に,エチレングリコールを含 む PWDS とともに胚を移植した(瀧下ら,2019)。 つまり,シリンジ内加温・希釈法においては,細胞 毒性のあるエチレングリコールが子宮内に注入され る点が従来法と異なる。今回の 1.5 ml 区では胚死 滅がみられなかったが,3 ml 区では PWDS を保温 しなかった場合に胚死滅が発生した報告(瀧下ら, 2019)と同様に胚死滅がみられた。この原因とし て,単純に PWDS が減った影響であるか,または PWDS 量減少に伴うエチレングリコールの量が 減った影響であるかは,今後例数を増やして検討す る必要がある。 本試験においては,1.5 ml 区で受胎および分娩し た 4 例中 2 例において,シリンジ内に 100 μm 以下 のプラスチック様の物質が 1∼数個観察された。こ の原因としては,ガラス化保存用容器を挿入用ガイ ドとしたピペットチップよりも奥まで挿入したた め,ガラス化保存用容器の先端がプラスチック製の シリンジブランジャーの先端を削った可能性が考え られる。この操作時は保温のためにアルミ製の保温 器具がシリンジを被覆しているため,シリンジ内の ガラス化保存用容器先端の位置を目視で確認するこ とはできない。移植による子宮内への異物の持ち込 みは極力避ける必要があるため,ガラス化保存用容 器の先端からシリンジブランジャーの先端までの距 離が短い 1.5 ml 容量のシリンジでは,より慎重にガ ラス化保存用容器の挿入を行う必要がある。産子率 について,有意差は認められなかったが,1.5 ml 区 では 3 ml 区よりも若干低かった原因は,プラス チック片混入による可能性があり,今後の検討が必
要である。 今回,PWDS を 39℃に保温することで,保温しな ければ 40% であった流産および胚死滅率が 1.5 ml および 3 ml で各々 0% および 25.0% に改善された。 このことより,シリンジ内加温・希釈において, PWDS は 39℃ に 保 温 す る こ と が 至 適 で あ り, PWDS 量は 1.5 ml および 3 ml でともに良好な成績 が得られることが示された。
謝
辞
研究を遂行するにあたり助言をいただいた日本大 学生物資源科学部動物資源科学科 准教授 三角浩司 博士,供試豚の飼養管理および実験を補助して頂い た家畜改良センター企画調整部管理課の関係職員に 心より感謝申し上げる。本研究は,農研機構生研支 援センターの支援を受けた革新的技術開発・緊急展 開事業(うち地域プロジェクト)「超低温保存胚の子 宮体部非外科的移植を利用した生産農家への低リス ク低コストな高能力種豚導入実証」による助成を受 けて実施した。文
献
DANIEL, C.J., D.B. EDUARDO, G.R.V. IARA, A.N. PAULA
and A.V. ALESSANDRA: 2017, Risk of contamination
of gametes and embryos during cryopreservation and measures to prevent cross-contamination, BioMed Res., 2017, 1840417.
DOCHI, O., Y. YAMAMOTO, H. SAGA, N. YOSHIDA, N.
KANO, J. MAEDA, K. MIYATA, A. YAMAUCHI, K.
TOMINAGA, Y. ODA, T. NAKASHIMA and S. INOHAE:
1998, Direct transfer of bovine embryos frozen-thawed in the presence of propylene glycol or ethylene glycol under on-farm conditions in an integrated embryo transfer program, Therio-genology, 49, 1051-1058.
GUTHRIE, H.D. and C. POLGE: 1978, Treatment of
pregnant gilts with a prostaglandin analogue, clo-prostenol, to control oestrus and fertility, J Reprod Fertil Actions, 52, 271-273
平山祐理・吉岡耕治・三角浩司:2014,偽妊娠法によ る胚採取において偽妊娠期間及びエストロジェン 製剤の違いが採胚成績に及ぼす影響,日豚会誌,
51,225.
HIRAYAMA, Y., K. YOSHIOKA, M. NOGUCHIand K. MISUMI:
2019, Embryo collection from pigs
post-pseudo-pregnancy induced by estradiol dipropionate, Anim. Sci. J., 90, 1523-1529.
柏崎直已・亀山賢次・小島敏之・鳥生厚夫:1996, 「Ⅸ 胚の検査」,豚の胚移植マニュアル,68-73,社
団法人畜産技術協会,東京.
LOVE, R.J. and R.G. GREY: 1993,Early abortion of
gilts as a way of synchronizing oestrus and im-proving litter size, Aust Vet J Actions, 70, 452. MASSIP, A. and P.V.D. ZWALMEN: 1984, Direct
trans-fer of frozen cow embryos in glycerol - sucrose, Vet Rec, 115, 327-328.
三角浩司・江川紗智子・御澤弘靖・平山祐理:2020, ブタガラス化保存胚盤胞を用いた非外科的移植方 法の改善,日豚会誌,印刷中
MISUMI, K., Y. HIRAYAMA, S. EGAWA, S. YAMASHITA, H.
HOSHIand K. IMAI: 2013, Successful production of
piglets derived from expanded blastocysts vit-rified using a micro volume air cooling method without direct exposure to liquid nitrogen, J. Reprod. Dev., 59, 520-524. 水戸友美・吉岡耕治・三角浩司・山下祥子・星 翼・ 星 宏良:2012,MVAC 法を用いたブタ体外生産 胚のガラス化保存における平衡時間と融解温度が 胚生存性に及ぼす影響,日本繁殖生物学会講演要 旨集,58,173.
MITO, T., K. YOSHIOKA, S. YAMASHITA, C. SUZUKI, M.
NOGUCHI and H. HOSHI: 2012, Glucose and glycine
synergistically enhance the in vitro development of porcine blastocysts in a chemically defined medium, Reprod. Fertil. Dev., 24, 443-450.
中村利一:1989,「体温」,獣医学大事典,911,チク サン出版社,東京.
NAKAZAWA, Y., H. MISAWA, Y. FUJINO, S. TAJIMA, K.
MISUMI, J. UEDA, Y. NAKAMURA, T. SHIBATA, Y. H IRA-YAMA and K. KIKUCHI: 2008, Effect of volume of
non-surgical embryo transfer medium on ability of porcine embryos to survive to term, J. Reprod. Dev., 54, 30-34.
日本家畜人工授精師協会:2015,「2)胎子・胎膜の発 育と着床・胎盤」,家畜人工授精講習会テキスト, 全改訂版,268,創文印刷工業,東京.
POLGE, C., I. WILMUT and L. ROWSON: 1974, The low
temperature preservation of cow, sheep and pig embryos, Cryobiology, 11, 560.
瀧下梨英・平山祐理・橋谷田豊:2019,シリンジ内加 温・希釈したブタガラス化保存胚による産子生 産,日胚移植誌,41,25-30.
Optimum Temperature and Volume of Solution During In-Syringe
Cryoprotectant Dilution for Porcine Blastocysts Vitrified by
Method of Micro Volume Air Cooling
Rie T
AKISHITA1*, Yuri H
IRAYAMA1and Yutaka H
ASHIYADA1**
1National Livestock Breeding Center, Nishigo, Nishishirakawa, Fukushima 961-8511, Japan
* Present address : Miyazaki Branch of National Livestock Breeding Center, Kobayashi, Miyazaki 886-0004, Japan ** Present address : Ishikawa Prefectural University, Nonoichi, Ishikawa 921-8836, Japan
Transfer of vitrified porcine blastocysts requires special facilities and equipment, as well as skilled techniques. In the present study, we examined a method for warming and dilution of vitrified blastocysts that would provide simple and highly stable results for practical porcine embryo transfer in the field. Although we have already succeeded in obtaining piglets using this simple method whereby blastocysts are vitrified using micro volume air cooling (MVAC) then warmed and diluted in a syringe to remove the cryoprotectant, the rate of miscarriage was as high as 40%. Using the conventional method employing microscopy in the laboratory, the pre-warming temperature and volume of the porcine warming and dilution solution (PWDS) for vitrified embryos were 45℃ and 3 ml, respectively. In order to facilitate the transfer of porcine embryos in the field, it is necessary to develop a simplified method based on opti-mization of the dilution conditions. For this purpose, changes in the temperature of PWDS under various conditions were investigated. An individual vitrification device without embryos was taken out from LN2
followed by insertion into a syringe filled with 1.5 ml, 2 ml or 3 ml of PWDS. These syringes were held for 3 min in room air at 15℃ or 27℃, or in water at 38℃, then the PWDS temperature in each case was recorded. A significant decrease in temperature was observed for all volumes in room air temperature, being approximately 8-10℃ at 15℃ and 4-6℃ at 27℃. On the other hand, there was very little decline in the water temperature at 38℃; all volumes of PWDS showed a drop of approximately 0.1℃. Based on these results, pregnancy was examined after transfer of vitrified embryos diluted with 1.5 or 3 ml of PWDS warmed at 39℃. Between 12 and 16 blastocysts were transplanted surgically into the uterus of 5 recipients each assigned to each PWDS volume group, and 4 of the recipients each became pregnant and delivered a total of 19 and 17 piglets respectively. The farrowing rates of group of 1.5 and 3 ml were 80% and 60%, and the piglet production rates relative to the number of transplanted embryos were 23.6% and 27. 5%, respectively. Fertility and piglet production were equivalent, with no significant difference between the two volumes of PWDS. However, when the PWDS was kept warm, the ratio of pregnancy loss improved to 0% (1.5 ml) and 25.0% (3 ml), compared with 40% with no warming. These results suggest that when warming and diluting blastocysts in the syringe with an individual vitrification device inserted, optimal results are obtained by keeping the PWDS at 39℃. In addition, good results can be obtained when the volume of PWDS is 1.5 ml or 3 ml.
Jpn. J. Swine Science, 57, 4 : 138-146