1.6 外国における使用状況等に関する資料
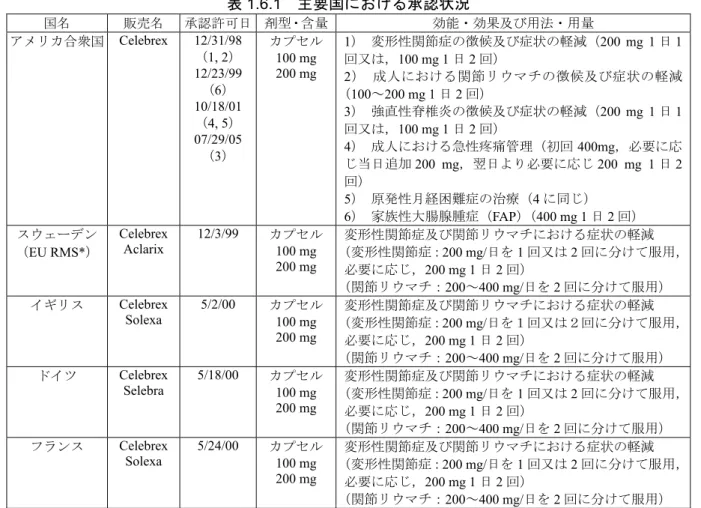
1.6.1 外国における承認状況
外国においては,米国,欧州連合諸国(イギリス,ドイツ,フランス等),アジア諸国(中国,
韓国等)を含む
106 カ国ですでに承認を受けている(平成 18 年 9 月現在).主要国における承
認状況を表
1.6.1 に示す.
1.6.1.1 米国における承認状況
米国サール社(現米国ファイザー社)は
19
年
月
日に「変形性関節症(OA)及び関節
リウマチ(RA)の徴候及び症状の軽減,急性疼痛管理」を効能・効果として FDA に NDA 申請
を行い,優先審査の指定を受け審査が開始された.審査の結果,申請効能のうち「OA 及び RA
の徴候及び症状の軽減」について
FDA より 1998 年 12 月 31 日に承認を取得し,米国において
は
1999 年 2 月より販売名 CEREBREX
®として販売を開始した.
「家族性大腸腺腫症(FAP)における腺腫性結腸直腸ポリープ数の減少」の効能については,
19
年
月
日承認申請,希少医薬品指定を受け
1999 年 12 月 23 日に FDA より承認を取得
している.
「急性疼痛管理」の効能に関しては,初回申請時の
FDA の指導により,supplemental NDA
(sNDA)として別途検討し,20
年
月
日
FDA に sNDA 申請し,
「急性疼痛管理」及び「原
発性月経困難症」について,2001 年 10 月 18 日に効能追加の承認を受けている.
また,これら承認申請と並行して,本剤の関節症患者における長期安全性臨床試験 (Celecoxib
Long-term Arthritis Safety Study-CLASS) 結果に基づく,添付文書記載事項の一部変更申請
(sNDA)を 20
年
月
日提出し,2002 年 6 月 7 日,CLASS 試験結果に基づく添付文書の
記載事項変更の承認を受けた.さらに「強直性脊椎炎の徴候及び症状の軽減」の効能について,
20
年
月
日に
sNDA 申請し,2005 年 7 月 29 日に効能追加の承認を取得した.
1.6.1.2 欧州連合(EU)における承認状況
欧州連合(EU)における最初の販売承認申請(MAA)は,19
年
月
日にスウェーデン
を審査調整国(RMS)として提出された.審査の結果,
「変形性関節症及び関節リウマチにおけ
る症状の軽減」の効能に対して,
EU での最初の承認を 1999 年 12 月 3 日に取得した.これを受
け,EU 加盟各国は,相互認証手続き(Mutual Recognition Procedure)を 19
年
月
日より
開始し,20
年
月
日にこれを完了し,引き続いてイギリス,ドイツ,フランス等を含む
表
1.6.1 主要国における承認状況
国名
販売名
承認許可日
剤型・含量
効能・効果及び用法・用量
アメリカ合衆国
Celebrex
12/31/98
(
1, 2)
12/23/99
(
6)
10/18/01
(
4, 5)
07/29/05
(
3)
カプセル
100 mg
200 mg
1) 変形性関節症の徴候及び症状の軽減(200 mg 1 日 1
回又は,
100 mg 1 日 2 回)
2) 成人における関節リウマチの徴候及び症状の軽減
(
100~200 mg 1 日 2 回)
3) 強直性脊椎炎の徴候及び症状の軽減(200 mg 1 日 1
回又は,
100 mg 1 日 2 回)
4) 成人における急性疼痛管理(初回 400mg,必要に応
じ当日追加
200 mg,翌日より必要に応じ 200 mg 1 日 2
回)
5) 原発性月経困難症の治療(4 に同じ)
6) 家族性大腸腺腫症(FAP)(400 mg 1 日 2 回)
スウェーデン
(
EU RMS*)
Celebrex
Aclarix
12/3/99
カプセル
100 mg
200 mg
変形性関節症及び関節リウマチにおける症状の軽減
(変形性関節症:
200 mg/日を 1 回又は 2 回に分けて服用,
必要に応じ,200 mg 1 日 2 回)
(関節リウマチ:
200~400 mg/日を 2 回に分けて服用)
イギリス
Celebrex
Solexa
5/2/00
カプセル
100 mg
200 mg
変形性関節症及び関節リウマチにおける症状の軽減
(変形性関節症:
200 mg/日を1回又は2回に分けて服用,
必要に応じ,200 mg 1 日 2 回)
(関節リウマチ:
200~400 mg/日を 2 回に分けて服用)
ドイツ
Celebrex
Selebra
5/18/00
カプセル
100 mg
200 mg
変形性関節症及び関節リウマチにおける症状の軽減
(変形性関節症:200 mg/日を 1 回又は 2 回に分けて服用,
必要に応じ,
200 mg 1 日 2 回)
(関節リウマチ:200~400 mg/日を 2 回に分けて服用)
フランス
Celebrex
Solexa
5/24/00
カプセル
100 mg
200 mg
変形性関節症及び関節リウマチにおける症状の軽減
(変形性関節症:200 mg/日を 1 回又は 2 回に分けて服用,
必要に応じ,
200 mg 1 日 2 回)
(関節リウマチ:200~400 mg/日を 2 回に分けて服用)
* EU Reference Member state, RMS
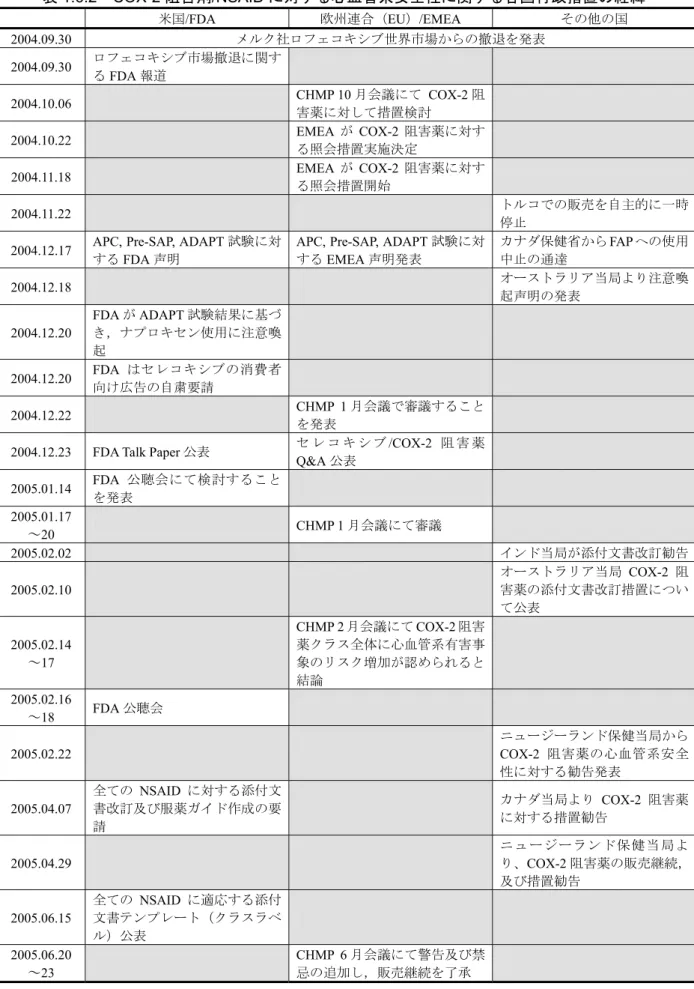
1.6.2 外国における市販後の状況
2004 年 9 月 30 日付けで米国メルク社が欧米を含む世界各国で販売していた類薬(コキシブ
系消炎鎮痛剤)であるロフェコキシブ(商品名:
®)について,同薬で進行中の長期予防
投与試験で,プラセボに比較し重篤な心血管系のリスクが増加することが示されたことから,
全世界市場から同薬を自主的に撤退することが報じられた.以下に
2004 年 9 月 30 日以降,2006
年
9 月現在までのコキシブ系消炎鎮痛剤を含む全ての非ステロイド性消炎鎮痛剤(NSAID)の
安全性に関する外国規制当局(米国食品医薬局:FDA,欧州医薬品審査庁:EMEA,及び他の
主要な海外規制当局)の検討経緯及び措置の状況について概略をまとめた.なお,表
1.6.2 に選
択的
COX-2 阻害剤/非選択的 NSAID に対する心血管系安全性に関する各国行政措置の経緯を経
時的に要約した.
表
1.6.2 COX-2 阻害剤/NSAID に対する心血管系安全性に関する各国行政措置の経緯
米国/FDA
欧州連合(EU)/EMEA
その他の国
2004.09.30
メルク社ロフェコキシブ世界市場からの撤退を発表
2004.09.30
ロフェコキシブ市場撤退に関す
る
FDA 報道
2004.10.06
CHMP 10 月会議にて COX-2 阻
害薬に対して措置検討
2004.10.22
EMEA が COX-2 阻害薬に対す
る照会措置実施決定
2004.11.18
EMEA が COX-2 阻害薬に対す
る照会措置開始
2004.11.22
トルコでの販売を自主的に一時
停止
2004.12.17
APC, Pre-SAP, ADAPT 試験に対
する
FDA 声明
APC, Pre-SAP, ADAPT 試験に対
する
EMEA 声明発表
カナダ保健省から
FAP への使用
中止の通達
2004.12.18
オーストラリア当局より注意喚
起声明の発表
2004.12.20
FDA が ADAPT 試験結果に基づ
き,ナプロキセン使用に注意喚
起
2004.12.20
FDA はセレコキシブの消費者
向け広告の自粛要請
2004.12.22
CHMP 1 月会議で審議すること
を発表
2004.12.23 FDA
Talk
Paper 公表
セ レ コ キ シ ブ
/COX-2 阻 害 薬
Q&A 公表
2005.01.14
FDA 公聴会にて検討すること
を発表
2005.01.17
~20
CHMP
1 月会議にて審議
2005.02.02
インド当局が添付文書改訂勧告
2005.02.10
オーストラリア当局
COX-2 阻
害薬の添付文書改訂措置につい
て公表
2005.02.14
~17
CHMP 2 月会議にて COX-2 阻害
薬クラス全体に心血管系有害事
象のリスク増加が認められると
結論
2005.02.16
~18
FDA 公聴会
2005.02.22
ニュージーランド保健当局から
COX-2 阻害薬の心血管系安全
性に対する勧告発表
2005.04.07
全ての
NSAID に対する添付文
書改訂及び服薬ガイド作成の要
請
カナダ当局より
COX-2 阻害薬
に対する措置勧告
2005.04.29
ニュージーランド保健当局よ
り、COX-2 阻害薬の販売継続,
及び措置勧告
2005.06.15
全ての
NSAID に適応する添付
文書テンプレート(クラスラベ
ル)公表
2005.06.20
~
23
CHMP 6 月会議にて警告及び禁
忌の追加し,販売継続を了承
米国/FDA
欧州連合(EU)/EMEA
その他の国
2005.06.
セ レ コ キ シ ブ 製 品 情 報 概 要
(SPC)改訂
2007.07.07
カナダ当局より全ての
NSAID
に対する措置勧告
2005.07.
セレブレックス米国添付文書
(
USPI)改訂
2005.08.
ニュージーランドにおけるセレ
ブレックス添付文書改訂
2005.09.
カナダにおけるセレブレックス
製品モノグラムの改訂
2005.10.17
非選択的
NSAID 製品情報概要
(SPC)に対する改訂指示
2006.02.10 FDA 公聴会において進捗確認
2006.04.
オーストラリアにおけるセレブ
レックス添付文書改訂
1.6.2.1 背景
2004 年 9 月 30 日のロフェコキシブ回収の報道時点において,セレコキシブの長期(1 年以上)
使用時における心血管系の安全性が評価可能な長期試験として,2 つの大腸ポリープの予防試
験(
APC: Adenoma Prevention with Celecoxib 及び PreSAP: Prevention of Spontaneous Adenoma
Polyps),及び 1 つのアルツハイマー病に対する予防試験(ADAPT: Alzheimer’s Disease
Anti-inflammatory Prevention Trial)が海外において進行中であった.
このうち,米国国立癌研究所(NCI)が実施した APC 試験において,プラセボと比較し,セ
レコキシブ投与群において心血管系イベントの増加が認められた.この結果を受け,NCI は本
試験の投与を一時中断した(安全性に関する追跡調査は継続).
一方,ファイザー社が実施した
PreSAP 試験においては,プラセボに対しセレコキシブ投与
群での心血管系イベントの増加は認められなかった.しかしながら,
APC 試験の投与中断を受
けて,本試験においても投与の一時中断に至った(安全性に関する追跡調査は継続).
また,米国国立衛生研究所(NIH)の依頼によって米国国立加齢研究所(NIA)で進行中であっ
たアルツハイマー病に対する予防投与試験(
ADAPT 試験)においても,プラセボに対してセレ
コキシブ投与群は心血管系イベントの増加は認められなかった.しかしながら,
NIH は APC 試
験で投与中断されたことと,対照薬群(ナプロキセン)がプラセボに比較し,心血管系イベン
トの増加を示したことから本試験についても投与を一時中断した(安全性に関する追跡調査は
継続).
APC 試験,PreSAP 試験及び ADAPT 試験の投与中断について,ファイザー社は各国規制当
局に,その時点で知り得た情報について直ちに報告を行い,これを受け
FDA,EMEA などの規
1.6.2.2 米国 FDA における経緯
米国
FDA では 2005 年 2 月 16~18 日の日程で関節炎治療に関する専門委員会(Arthritis
Advisory Committee)と医薬品安全性とリスク管理に関する専門委員会(Drug Safety and Risk
Management Advisory Committee)の合同公聴会(Advisory Comittee:AC)が開催され,選択的
COX-2 阻害剤(rofecoxib, etoricoxib, celecoxib, valdecoxib, lumiracoxib)及び非選択的 NSAID
(naproxen)の心血管系への安全性について討議された.FDA ではこの AC での議論を踏まえ,
適切に選択されて情報を提供された患者では,セレコキシブの効果がリスクの可能性を上回る
との結論に達した.FDA は,2005 年 4 月 7 日付けで,セレコキシブ(商品名:Celebrex
®)を含
む全ての市販の医療用及び一般用
NSAID の販売会社に対して,添付文書の改訂を要請し,枠囲
み警告と服薬ガイドを作成するよう求めた.さらに,2005 年 6 月 15 日付けで枠囲み警告を含
む
NSAID 添付文書テンプレート(クラスラベル)を公表した.セレコキシブの最新の米国添付
文書(USPI)は,2005 年 7 月
日付けで承認された(
1.6.3.1 参照).以下に米国 FDA におけ
る経緯の詳細を示す.
1.6.2.2.1 2004 年 9 月 30 日 FDA 報道
メルク社がロフェコキシブ(
®)の市場からの回収を公表した
2004 年 9 月 30 日に,米
国食品医薬品局(FDA)は,報道発表にてロフェコキシブの市場回収について以下のように伝
えている.
「本剤(ロフェコキシブ)の長期試験について監視していた安全性データモニタリング委員
会は,プラセボ投与を受けていた患者と比較して
を服用していた被験者において,心臓
発作及び脳卒中など重篤な心血管系事象を起こすリスクが高いことがわかったため,試験の中
止を勧告した.」
また,FDA は同日公表した
Q&A において,ロフェコキシブと同じ選択的 COX-2 阻害
薬に対するリスクに関して以下のように示している.
「1つの薬剤の臨床試験結果を同じ薬剤クラスに属する他の薬剤に適応する必要はない.全
ての
NSAID は長期使用した場合,特に消化管(胃)出血事象,肝毒性,腎毒性のリスクを有し
ている.これらの薬剤を長期(2 週間以上)にわたって使用している患者は,医師の指示に従
うことを推奨する.」
1.6.2.2.2 2004 年 12 月 17 日 FDA 声明
FDA は,進行中である癌の予防試験 2 試験のうち,米国国立癌研究所(NCI)が実施した APC
試験において,プラセボと比較し,セレコキシブ投与群の心血管系イベント増加が認められた
とする声明を発表した.声明では,心血管系事象発現のリスクがセレコキシブ
200 mg 1 日 2 回
投与群においてプラセボと比較して
2.5 倍,セレコキシブ 400 mg 1 日 2 回投与群においてはプ
ラセボと比較して
3.4 倍の増加が認められ(患者 2400 例,平均投与期間 33 ヶ月),これにより,
[1]
*[1]
*NCI がこの試験での投与を一時中断したことが報じられた.また,FDA は,ファイザー社によ
り実施されていた
PreSAP 試験で,400 mg 1 日 1 回投与でプラセポに比べ CV リスクの増加は
認められなかったが,APC 試験の中断を受け本試験も一時中断されたことについても報じた.
FDA は,これらの試験結果の検討期間中は暫定的に,「医師はセレコキシブに代わる治療を勘
案することを助言する.セレコキシブを引き続き処方することを選択した場合は,可能な限り
低い用量にすべき」と勧告した.同日,FDA Alert を発効し,医療従事者及び患者に対して注意
喚起を行った.
1.6.2.2.3 2004 年 12 月 20 日 FDA 声明
FDA は,NIH が依頼者となって実施されたアルツハイマー病に対する予防的試験(ADAPT
試験)において対照薬として使用されたナプロキセン群でプラセボに対し心血管系事象発現の
リスクが増加することが示されたことから,ナプロキセンの一般用医薬品を服薬中の患者に対
して添付文書に従った使用を喚起し,220 mg1 日 2 回の推奨用量を超えないこと,また,医師
の指示なく
10 日以上の服用を続けないよう注意喚起する声明を発表した.
1.6.2.2.4 2004 年 12 月 20 日 FDA 声明
FDA は,ファイザー社に対して,評価期間中のセレコキシブ(Celebrex
®)の消費者向け直接
広告の自粛を要請し,ファイザー社はこれを了承したとする声明を発表した.
1.6.2.2.5 2004 年 12 月 23 日 FDA Talk Paper 公表
FDA は,進行中の再評価結果がでるまで当面の間,選択的 COX-2 阻害薬の使用に関し医師
によるリスク/ベネフィットを勘案した使用を推奨した.また,選択的
COX-2 阻害薬の予防的
臨床試験に対しては見直しを求めた.さらに,NSAID を含む一般用医薬品全般の使用について
も,添付文書の指示に従うこと,10 日以上連用する場合医師の指示を受けるよう注意を公表し
た.
1.6.2.2.6 2005 年 2 月 16~18 日 FDA AC 開催
FDA は,2005 年 2 月 16~18 日の日程で合同公聴会(AC)を開催した.この公聴会では,選
択的
COX-2 阻害薬(rofecoxib, etoricoxib, celecoxib, valdecoxib, lumiracoxib)及び非選択的 NSAID
(naproxen)の心血管系への安全性について討議された.
2005 年 2 月 18 日に行われた合同公聴会最終日の 32 名の委員会メンバーによる投票の結果,
セレコキシブについては,賛成
31 に対して反対 1 で,本剤の全般的なベネフィットはリスクを
上回ると判断され,本剤が米国市場に留まることが支持された.しかしながら,全
32 名の委員
フィット,また,消化器系への安全性に対するベネフィットは認めたものの,心血管系事象発
現のリスクを増加させる可能性を示唆した.これらのリスクの程度は選択的
COX-2 阻害薬全体
の中でもばらつきがあり,薬剤毎に考慮すべきであるとされた.委員会メンバーからは,
「選択
的
COX-2 阻害薬全般に枠囲み警告を追加して注意喚起すべき」,また,
「消費者向け直接広告の
禁止の措置をすべき」などの意見も出された.
1.6.2.2.7 2005 年 4 月 7 日 FDA 声明
FDA は,COX-2 阻害薬のセレコキシブ(商品名:Celebrex
®)を含む,全ての市販の医療用
NSAID のメーカー全社に対して,医薬品表示(添付文書)の改訂を要請し,以下の枠囲み警告
と服薬ガイドを記載するよう求めた.
z これらの薬剤の使用に伴う心血管(CV)事象のリスクが増大する可能性と,報告の多い生
命を脅かすおそれのある重篤な消化管(GI)出血について,枠囲み警告で注意を喚起する
こと.
z 服薬ガイドはすべての医療用 NSAID の処方ごとに患者に提供し,心血管系および消化管の
リスクに関するより詳細な情報を提供すること.
FDA は,適切に選択されて情報を提供された患者では,セレコキシブの効果がリスクの可能
性を上回るとの結論に達し,セレコキシブ販売の継続を認めるにあたり,ファイザー社に以下
の対応を要請した.
z セレコキシブの添付文書の改訂
・ 全ての
NSAID について心血管系および消化管のリスクに関する警告および禁忌と,
セレコキシブによる心血管系の有害事象のリスクの増大を示す実薬対照試験データ
の具体的情報を付け加えて,枠囲み警告に記載する.
・ セレコキシブの使用を決定する前に,セレコキシブの潜在的なリスクとベネフィッ
ト,及び他の治療の選択肢について,患者と検討するよう処方医に奨励する.
z 個々の患者の治療目標に合わせ,最小有効量を最短期間で使用するよう,処方医に奨励す
る.
z 添付文書に服薬ガイドを含める.服薬ガイドは薬の処方時に患者に提供し,一般に NSAID,
特にセレコキシブに伴う心血管系および消化管のリスクの可能性に関する情報を提供する
必要がある.服薬ガイドにより,NSAID 使用のリスクとベネフィットや,可能な限り最小
有効量を最短期間で使用する重要性について,主治医と検討する必要性を患者に伝える.
z ナプロキセンやその他の適切な薬物と比較してセレコキシブの安全性を示すために長期臨
床試験を行なう.FDA は,この長期臨床試験の研究デザインについてファイザー社と協力
し,速やかに試験を開始し,終了させる.
z セレコキシブを服用している患者は,この新たな情報に関する質問や懸念について主治医
と協議する必要がある.
1.6.2.2.8 2005 年 6 月 15 日 FDA 声明
FDA は,NSAID の処方箋薬および OTC 薬両方の製造会社に対して,心血管系イベントのリ
スク上昇および生命を脅かす可能性のある重篤な消化管出血について,枠囲み警告の中に含め
て表示するよう改訂を要請した.禁忌と警告について心血管系に対する作用,消化管に対する
作用(潰瘍形成,出血,穿孔のリスク),アナフィラキシー反応,皮膚反応を追記した添付文書
テンプレートを公表した.FDA は,処方箋薬 NSAID および OTC 薬 NSAID の両方に対しそれ
ぞれ提案された添付文書テンプレートを使用すること,全ての種類の処方箋薬
NSAID に対して
服薬ガイドを使用することを勧告している.また,セレコキシブの添付文書には,長期投与試
験からの安全性データも含めるとしている.
『枠囲み警告』の内容は以下のとおりである.
[心血管系リスク]
・
NSAID は生命にかかわる重篤な心血管系血栓事象,心筋梗塞,脳卒中のリスクを増大さ
せる可能性がある.このリスクは使用期間とともに増大する可能性がある.心血管系疾
患またはそのリスク因子を伴う患者ではリスクがさらに高い可能性がある(「警告」およ
び「臨床試験」を参照)
.
・ 本剤は冠動脈バイパス術(CABG)の周術期疼痛治療に対して禁忌である(「警告」を参
照).
[消化管リスク]
・
NSAID は胃または腸管の出血,潰瘍形成,穿孔など生命にかかわる重篤な消化管有害事
象のリスクを増大させる.こうした事象は使用中いつでも警告徴候なしに発生するおそ
れがある.高齢者では重篤な消化管事象のリスクがさらに高い(「警告」を参照)
.
1.6.2.3 欧州 EMEA における経緯
欧州
EMEA では,セレコキシブを含めた選択的 COX-2 阻害剤全体に対して心血管系に対す
る安全性に関し再評価(照会措置)を実施することを決定し,2004 年 11 月 18 日付けで選択的
COX-2 阻害剤(celecoxib, etoricoxib, lumiracoxib, parecoxib 及び valdecoxib)の販売承認保有会社
に対し共通の照会事項を送付した.EMEA のヒト用医薬品委員会(The Committee for Medicinal
Products for Human Use :CHMP)は,2005 年 1 月 17~20 日及び 2 月 14~17 日に開催された CHMP
定例会議においてこの議題について討論した.この結果,これまでに得られたデータにより,
選択的
COX-2 阻害剤クラス全体に心血管系の有害事象のリスク増加が認められると CHMP は
結論づけた.さらにこれらのデータから,投与期間及び投与量と心血管系イベントが発現する
可能性との間に関連性があることも示唆した.さらに,EMEA は,2005 年 6 月 20~23 日開催
むその他の選択的
COX-2 阻害剤については心血管リスクについて追加的な警告および禁忌が
必要であるとしたうえで,
EU での販売の継続を認める発表をした.セレコキシブの最新の欧州
連合(EU)製品情報概要(SPC)は,2005 年 6 月
日付けで公表された(1.6.3.2 参照).
この後,
CHMP は欧州連合の要請に基づき,非選択的 NSAID についても更なる措置が必要か
について検討を行い,その結果を
2005 年 10 月 17 日付けで公表した.非選択的 NSAID につい
ては,CHMP は心血管系事象,消化管系事象,皮膚事象に関連した新たな安全性に対する懸念
は見出されなかったと結論したうえで,しかしながら,これらの安全性情報に関して欧州連合
全体で統一した注意喚起を患者及び医療従事者に対して行うべきとの結論に至った.同日付け
で全ての非選択的
NSAID に対して統一した使用上の注意(key elements)を欧州連合情報概要
(SPC)に記載することを勧告した.以下に欧州 EMEA における経緯の詳細を示す.
1.6.2.3.1 2004 年 10 月 6 日 EMEA 報道
2004 年 10 月 6 日の欧州医薬品審査庁(EMEA)からの報道発表(EMEA/97949/2004)の内容
は以下の通りであった.
「EU の行政当局は, 非公式の CHMP の会議において,2 週間以内に,全ての選択的 COX-2
阻害薬(celecoxib, etoricoxib, parecoxib, rofecoxib 及び valdecoxib) の心血管系の安全性に関し
て入手可能な長期データの再検討を行うことに合意した.この再検討の結果に基づいて,医薬
品安全性調査委員会と
CHMP は 10 月の会議において,今後の措置の必要性について検討する
予定である.
」
1.6.2.3.2 2004 年 10 月 22 日 EMEA 報道
上記を受け
2004 年 10 月 22 日に EMEA からさらに以下の報道発表(EMEA/117908/2004)が
なされた.
「全世界的な
®(ロフェコキシブ)の市場からの回収を受けて,
EMEA は欧州委員会(EC)
から選択的
COX-2 阻害薬の使用上の注意に関する評価を委託された.ヒト医薬品を扱う委員会
CHMP は,選択的 COX-2 阻害薬(celecoxib, etoricoxib, lumiracoxib, parecoxib 及び valdecoxib)
の心血管系安全性について,血栓塞栓事象(心臓発作,脳卒中など)や心腎系事象(高血圧,
浮腫,心不全など)を含めて全面的に見直すこととした.
CHMP は,以前 2003 年に選択的 COX-2
阻害薬のレビューを実施したが,今回の見直しは,新規に得られたデータについて検討するこ
ととなった.この目的は,全欧州連合において,ラベルを含む販売承認条件の変更が必要か,
また,追加の試験が必要になるかの検討である.」
1.6.2.3.3 2004 年 11 月 18 日 EMEA 照会事項
EMEA は,セレコキシブを含めた選択的 COX-2 阻害薬全体に対しての心血管系に対する安全
性に関し照会措置を実施することを決定し,2004 年 11 月 18 日付けで選択的 COX-2 阻害薬
(celecoxib,etoricoxib, lumiracoxib, parecoxib 及び valdecoxib)の販売承認保有会社に対し,共
通の照会事項を送付した.
1.6.2.3.4 2004 年 12 月 17 日 EMEA 声明
EMEA は,進行中である癌の予防試験2試験のうち,米国国立癌研究所(NCI)が実施した
APC 試験において,プラセボと比較しセレコキシブ投与群の心血管系イベント増加が認められ
たとする声明を発表した(EMEA/205831/2004).EMEA は,特に心血管系疾患の既往を有する
患者については,最新の製品情報概要(SPC)の使用上の注意に従うよう医師に勧告し,患者
は,医師に相談するよう注意喚起した.
1.6.2.3.5 2004 年 12 月 22 日 EMEA 声明
EMEA は,APC 試験及び PreSAP 試験の結果に対する予備的検討を実施し,選択的 COX-2
阻害薬に対する照会措置を可及的速やかに実施する旨発表した(EMEA/212271/2004).2005 年
1 月 17~20 日に予定されている CHMP 会議にて討議することを公表した.
1.6.2.3.6 2004 年 12 月 23 日 EMEA Q&A 公表
EMEA は,セレコキシブ/選択的 COX-2 阻害薬に対しての Q&A 集(EMEA/214027/2004)を
公表した.
1.6.2.3.7 2005 年 1 月 17~20 日 EMEA CHMP 会議
EMEA のヒト用医薬品委員会(CHMP)は 2005 年 1 月 17~20 日に開催された CHMP の定例
会議において選択的
COX-2 阻害薬全体に対しての心血管系に対する安全性に関し討議した.医
薬品販売承認取得者(MAH)へのヒアリングは 2005 年 1 月 18 日に行われた.この検討過程に
おいてファイザー社は家族性大腸腺腫症(FAP)に対して販売承認を取得した Onsenal
®(セレ
コキシブ)の販売を
EMEA による評価結果が完了するまで,一時保留することで合意した.ま
た,引き続き
2 月 14~17 日の CHMP 定例会議において討議されることが 2005 年 1 月 20 日付
けで報道された(EMEA/23547/2005).
1.6.2.3.8 2005 年 2 月 14~17 日 EMEA CHMP 会議
2005 年 2 月 14~17 日に開催された CHMP の討議内容を受けて,EMEA は,2005 年 2 月 17
日 付 け で 選 択 的
COX-2 阻 害 薬 ク ラ ス 全 体 の 薬 剤 に 対 す る 規 制 措 置 を 公 式 に 発 表 し た
(EMEA/62838/2005).なお,医薬品販売承認取得者(MAH)へのヒアリングは 2005 年 2 月 15
日に行われた.
声明においては,「これまでに得られたデータにより,選択的
COX-2 阻害薬クラス全体に心
血管系の有害事象のリスク増加がみられると
CHMP は結論づけた.さらにこれらのデータから,
投与期間及び投与量と心血管系イベントが発現する可能性との間に関連性があることも示唆さ
れた.」と発表している.併せて,EMEA は,欧州連合内で市販されている選択的 COX-2 阻害
薬に関して,下記の緊急安全性規制を行うこととした.
z 虚血性心疾患または卒中発作を有する患者に対しては,全ての選択的 COX-2 阻害薬を禁忌
とする.
z 高血圧,高脂血症(高コレステロール値),糖尿病,喫煙などの心疾患の危険因子を保有す
る患者や末梢動脈閉塞症を有する患者に対する選択的
COX-2 阻害薬の処方に際して,注意
を怠らないよう警告する.
z 選択的 COX-2 阻害薬への曝露と心血管系リスクとの間に関連性があるという前提に立ち,
医師は最小有効量を必要な最短期間だけ使用するよう勧告する.
なお,本剤とは直接関連しないが,
etoricoxib に関しては,更なる措置として血圧がコントロー
ルされていない高血圧患者に対する使用を禁忌とすることとされた.
以上は,2005 年 4 月に発表が予定されていた選択的 COX-2 阻害薬の再評価の最終結果を待
つ間の暫定的な措置とされた.また,選択的
COX-2 阻害薬の心血管系安全性を評価するために
は,さらに多くの実地の研究を行う必要があり,現在実施中の心血管系に関する治験は計画ど
おり続行するべきであると,同委員会は結論付けている.さらに,EMEA のウェブサイトで閲
覧できる選択的
COX-2 阻害薬に関する Q&A 集を同日 2005 年 2 月 17 日付けで改訂し公表した
(EMEA/62978/2005).
1.6.2.3.9 2005 年 6 月 27 日 EMEA 声明
EMEA は,2005 年 6 月 20~23 日開催の CHMP 会合で,一連の COX-2 阻害薬に対する再評価
の結果,バルデコキシブ(商品名:
®)の致死的な皮膚反応リスクがベネフィットを上回
ることを確認したとして販売の凍結,セレコキシブを含むその他の
COX‐2 阻害剤については
心血管リスクについて追加的な警告および禁忌が必要であるとしたうえで,
EU での販売の継続
を認める発表をした.以下は,CHMP の勧告事項である.
z 虚血性心疾患または脳血管疾患(脳卒中)が既に認められている患者および末梢動脈疾患
患者に対して,COX-2 阻害薬の使用を禁忌とすること.
z COX-2 阻害薬を高血圧,高脂血症(高コレステロール値),糖尿病,喫煙などの心疾患リス
ク因子のある患者に処方する際に注意を怠らないよう,医療専門家への警告を強化するこ
と.
z 心血管リスクと COX-2 阻害薬の暴露との関連性を考慮し,医師らには可能な限り投与は最
短期間とし,最小有効用量を使用するよう勧告すること.
z 過敏反応や,まれだが重篤,時として致死的な皮膚反応が全 COX-2 阻害薬によって発現す
る可能性について,医療専門家および患者への警告を追加または強化すること.多くの場
合,これらは使用1カ月以内に発現すること,また,処方医師に対し薬剤アレルギーの既
往のある患者ではリスクの増大の可能性があることを警告すること.
上記に基づいて,セレコキシブの製品情報概要(SPC)に対して,禁忌,使用上の特殊な警
告と特殊な注意,他の医薬品との相互作用及び他の相互作用の種類,有害事象などに改訂の指
示がなされた.
委員会は同会合にて,欧州共同体(European Commission)の要請を受けて安全性再評価を既
存の
NSAID(処方箋薬,一般薬)に拡大して,更なる措置が必要かどうかについての検討を開
始することを決定した.
1.6.2.3.10 2005 年 10 月 17 日 EMEA 声明
CHMP は欧州連合の要請に基づき,非選択的 NSAID についても更なる措置が必要かについて
検討を行い,
その結果を
2005 年 10 月 17 日付けで公表した.非選択的 NSAID については,CHMP
は心血管系事象,消化管系事象,皮膚事象に関連した新たな安全性に対する懸念は見出されな
かったと結論したうえで,しかしながら,これらの安全性情報に関して欧州連合全体で統一し
た注意喚起を患者及び医療従事者に対して行うべきとの結論に至った.同日付けで全ての非選
択的
NSAID に対して統一した使用上の注意(key elements)を欧州連合情報概要(SPC)に記載
することを勧告した.
1.6.2.4 他の海外規制当局における経緯
以下に具体的な措置の公表があった国のうち主要国の状況について概説する.なお,トルコ
及びベネズエラについては,自主的に販売を一時中断している.
1.6.2.4.1 カナダ
セレコキシブ
1 日 800mg 投与は,まれな遺伝子疾患であり,結腸直腸癌になる確率の高い家
族性大腸ポリープに対して条件付きで承認(2002 年 4 月)されていたが,カナダ保健省は,2004
年
12 月 17 日付けで,今回の NCI による試験結果の情報を受けて家族性大腸ポリープ予防のた
めの投与を中止するよう以下の旨を通達した.
z セレコキシブは家族性大腸ポリープ再発予防や家族性大腸ポリープに対して使用すべきで
はない.患者は医師と代替治療について検討すること.
z 長期間 1 日 400mg を使用している患者についても,医師と代替治療について検討すること
を奨める.
z 家族性大腸ポリープ再発予防に対するセレコキシブの販売承認について,本日より取り消
すことをファイザー社に通達した.
z COX-2 阻害剤の安全性に関して,さらなる勧告を公表する予定である.
その後,カナダ保健省は,
2005 年 4 月 7 日付け声明において,COX-2 阻害薬の心血管系の安
全性に関する科学的再評価に基づいて,セレコキシブに関する新たな使用制限を次のとおり勧
告した.
z 心臓発作または卒中発作,心疾患に関連した重篤な胸痛,あるいはうっ血性心不全のよう
な重篤な心疾患を経験したことのある患者には本剤を投与しないこと.
z 心臓発作,卒中発作のリスクファクターを有する患者に対しては,本剤がリスクを高める
可能性があることを知らさなければならない.
z 本剤の使用および処方は最小用量および最短期間で行うこと.
z COX-2 阻害薬は関節炎の疼痛および炎症,ある種の急性疼痛に対する治療にのみ使用する
こと.
さらに,カナダ保健省は,
2005 年 7 月 7 日付け声明において, COX-2 阻害薬に関する Expert
Advisory Panel の勧告を支持し,下記の対応を即時取る予定を公表した.
z 現在カナダで販売されている全ての NSAID の製造会社は,該当製品の最新の患者安全性情
報を提出すること.これは現在カナダで処方箋により使用可能な
Celebrex
®および
OTC で
入手可能なイブプロフェン製品が含まれる予定である.
z カナダ保健省は,NSAID の添付文書に含まれるべきリスクとベネフィット情報の基準を確
立して,製造会社に指針を発表する予定である.
カナダ保健省による選択的
COX-2 阻害薬 NSAIDs の進行中の心血管系に係わる安全性の科学
的評価に基づいて,
2005 年 9 月
日付けで医療専門家向けの文書(For Health Care Professionals)
でセレブレックスの製品モノグラフが改訂予定が公表された.製品モノグラフの主な改訂は以
下のとおりである.
z 適応および臨床使用
・ セレブレックスは最小有効用量をできるだけ短い期間に限定して使用すること等.
z 禁忌
・ 冠動脈バイパス術周術期
本剤はこの患者群において試験されていないが,他の
COX-2 阻害剤の試験において心血
管/血栓塞栓イベント,深部手術性感染症,および胸骨創傷合併症の発生の増加をもた
らした.
・ 妊婦(第
3 トリメスター),授乳婦
動脈管早期閉塞と微弱陣痛のリスクがある(出産の遅れ)
.
授乳中の乳児に重篤な副作用が起こる可能性がある.
z 警告および使用上の注意(枠囲み警告を追加)
・ すべての虚血性心疾患,脳血管疾患および/またはうっ血性心不全(NYHA II-IV)の患
者に対するセレブレックス処方において注意を払わなければならないこと.
・ 約
3 年間の無作為臨床試験 3 試験中 1 試験においてプラセボと比較し,用量に関連した
心血管イベント上昇(主に心筋梗塞)が示されたこと(1 日 2 回 200mg 以上で検知).
z 臨床試験
・ 心血管安全性と題された小項目が追加される.
1.6.2.4.2 オーストラリア
オーストラリア保健省薬品・医薬品行政局(Therapeutic Goods Administration:TGA)は,2004
年
12 月 18 日付けで,セレコキシブ長期臨床試験で高用量投与を受けていた患者において心血
管疾患のリスク上昇の可能性が示された
APC 試験の結果と関連し,セレコキシブの服用はすぐ
に止めるべきではないが,投与を継続すことや代替薬も含め,あらゆる懸念されることについ
て医師に相談すべきとする注意喚起の声明を発した.
さらに
TGA は,オーストラリア医薬品評委員会(ADEC)の勧告を受け,2005 年 2 月 10 日
付(2 月 14 日に改訂版公開)の声明文で COX-2 阻害薬の添付文書において新たな措置の導入
が必要であるとの見解を公表している.
z COX-2 阻害剤の製造者に対し,類薬の医薬品で心血管有害事象のリスクが増大したことに
ついて,直ちに添付文書に新たな警告を枠囲み警告とすることを要請.
z セレコキシブを1日 200 ㎎を超えて,またはメロキシカムを 1 日 15 ㎎を超えて服用してい
る患者に対して,医師とともに治療計画を見直すことを勧告.
z COX-2 阻害剤は,他の治療薬に忍容性に問題があるか,重篤な有害事象が懸念される時の
みに処方されるべきことを勧告.
z セレコキシブとメロキシカムは,心臓発作などの心血管有害事象のリスクが増大している
患者に処方されるべきではなく,治療は必要最短期間にとどめられることを勧告.
これに続き
TGA 及びファイザー社は,セレブレックスの改訂添付文書について協議を続け,
2006 年 4 月 日付けで合意した.
1.6.2.4.3 ニュージーランド
ニュージーランド保健当局は,選択的
COX-2 阻害薬の心血管系の安全性に対する勧告を 2005
年
2 月 22 日に公表している.
その後,ニュージーランド保健当局は
2005 年 4 月 29 日,COX-2 阻害薬を市場に残すが,心
血管系のリスク増大は全ての
COX-2 阻害薬に認められるため,このリスク増大を適切に管理す
るよう勧告した.
z COX-2 阻害薬は,以下の患者に対して禁忌とすること.
・ 心筋梗塞,卒中発作の既往歴をもつ患者
・ 心血管系の手術前後の患者
・ 大きな手術前後の心血管系疾患高リスク患者
z COX-2 阻害薬は,その代替薬が効果不十分な場合もしくはその患者固有に容認しがたい有
害な作用がある場合に使用する.
z COX-2 阻害薬は,疼痛緩和のための最小有効用量から開始したり,最小有効用量に漸減す
ること.またその治療はできる限り最短期間に抑えること.
z 患者は 2 週間後に再診を受け,治療上の有益性がなければ COX-2 阻害薬は中止すること.
長期治療が必要な患者は3ヵ月毎に治療継続の必要性と心血管系の危険因子が発現してい
ないことを確認するために受診させること.
z 処方者は,COX-2 阻害薬が,既に存在する高血圧,心不全もしくは浮腫を悪化させる可能
性について認識すること.
z 心血管系疾患予防目的のアスピリンの使用が必要な患者に対して,アスピリンを中止しな
いこと.しかしながら,COX-2 阻害薬に伴う心血管系リスク増大に対しアスピリンを使用
することにより,そのリスクを減少させるというエビデンスはないことを,処方者は認識
すること.さらにアスピリンを使用することで,胃腸に対する
COX-2 阻害薬のメリットの
大部分が無効になることも認識すること.
z 処方者は,高い心血管系疾患リスクを有する患者すべてに対し,COX-2 阻害薬の使用が心
臓発作や卒中発作のリスクを増大させる可能性について知らせること.
z COX-2 阻害薬の周術期使用に関しては,手術前に検討されることが重要である.
これに続きニュージーランド保健当局及びファイザー社は,セレブレックスの改訂添付文書
について協議を続け,2005 年 8 月
日付けで合意した.
1.6.3 外国の添付文書
以下に,米国添付文書(USPI),欧州連合製品情報概要(SPC),及び企業中核データシート
(CCDS)の原文及び対訳比較表を示す.
1.6.3.1 米国添付文書(USPI)‐原文・翻訳
CELEBREX
® (celecoxib capsules)Cardiovascular Risk
・ CELEBREX may cause an increased risk of serious cardiovascular thrombotic events, myocardial infarction, and stroke, which can be fatal. All NSAIDs may have a similar risk. This risk may increase with duration of use. Patients with cardiovascular disease or risk factors for cardiovascular disease may be at greater risk (see WARNINGS and
CLINICAL TRIALS).
・ CELEBREX is contraindicated for the treatment of peri-operative pain in the setting of coronary artery bypass graft (CABG) surgery (see WARNINGS).
Gastrointestinal Risk
・ NSAIDs, including CELEBREX, cause an increased risk of serious gastrointestinal adverse events including bleeding, ulceration, and perforation of the stomach or intestines,which can be fatal. These events can occur at any time during use and without warning symptoms. Elderly patients are at greater risk for serious gastrointestinal events (see
WARNINGS).
DESCRIPTION
CELEBREX (celecoxib) is chemically designated as 4-[5-(4-methyl- phenyl)-3-(trifluoromethyl)-1H-pyrazol-1-yl] benzenesulfonamide and is a diaryl-substituted pyrazole. It has the following chemical structure:
The empirical formula for celecoxib is C17H14F3N3O2S, and the
molecular weight is 381.38.
CELEBREX oral capsules contain either 100 mg, 200 mg or 400mg of celecoxib.
The inactive ingredients in CELEBREX capsules include: croscarmellose sodium, edible inks, gelatin, lactose monohydrate, magnesium stearate, povidone, sodium lauryl sulfate and titanium dioxide.
CELEBREX
® (celecoxib カプセル) 心血管系リスク ・ CELEBREX は生命にかかわる重篤な心血管系血栓事象, 心筋梗塞,脳卒中のリスクを増大させる可能性がある. 全てのNSAIDs に同様なリスクの可能性がある.このリ スクは使用期間とともに増大する可能性がある.心血管 系疾患またはそのリスク因子を伴う患者ではリスクがさ らに高い可能性がある(「警告」及び「臨床試験」を参照). ・ CELEBREX は冠動脈バイパス術(CABG)の周術期疼痛 治療に対して禁忌である(「警告」)を参照). 消化管リスク ・ CELEBREX を含む NSAIDs は胃または腸管の出血,潰瘍 形成,穿孔など生命にかかわる重篤な消化管有害事象の リスクを増大させる可能性がある.こうした事象は使用 中いつでも警告徴候なしに発生するおそれがある.高齢 者では重篤な消化管事象のリスクがさらに高い(「警告」 を参照). 〔添付文書〕 CELEBREX(celecoxib),4-[5-(4-methylphenyl)-3- (trifluoromethyl) -1H-pyrazol-1-yl] benzenesulfonamide は,2 つのアリール基が置換 されたピラゾールである.化学構造は以下のとおりである. Celecoxib の分子式は C17H14F3N3O2S,分子量は 381.38 である. CELEBREX 経口カプセル剤は,celecoxib を 100 mg,200 mg 及び 400 mg 含有する. CELEBREX カプセル中の添加物は,クロスカルメロースナトリ ウム,食用色素,ゼラチン,乳糖,ステアリン酸マグネシウム, ポビドン,ラウリル硫酸ナトリウム,酸化チタンである.CLINICAL PHARMACOLOGY Mechanism of Action:
CELEBREX is a nonsteroidal anti-inflammatory drug that exhibits anti-inflammatory, analgesic, and antipyretic activities in animal models. The mechanism of action of CELEBREX is believed to be due to inhibition of prostaglandin synthesis, primarily via inhibition of cyclooxygenase-2 (COX-2), and at therapeutic concentrations in humans, CELEBREX does not inhibit the cyclooxygenase-1 (COX-1) isoenzyme. In animal colon tumor models, celecoxib reduced the incidence and multiplicity of tumors.
Platelets
In clinical trials using normal volunteers, CELEBREX at single doses up to 800 mg and multiple doses of 600 mg twice daily for up to 7 days duration (higher than recommended therapeutic doses) had no effect on reduction of platelet aggregation or increase in bleeding time. Because of its lack of platelet effects, CELEBREX is not a substitute for aspirin for cardiovascular prophylaxis. It is not known if there are any effects of CELEBREX on platelets that may contribute to the increased risk of serious cardiovascular thrombotic adverse events associated with the use of CELEBREX.
Fluid Retention
Inhibition of PGE2 synthesis may lead to sodium and water retention through increased reabsorption in the renal medullary thick ascending loop of Henle and perhaps other segments of the distal nephron. In the collecting ducts, PGE2 appears to inhibit water reabsorption by counteracting the action of antidiuretic hormone.
Pharmacokinetics: Absorption
Peak plasma levels of celecoxib occur approximately 3 hrs after an oral dose. Under fasting conditions, both peak plasma levels (Cmax) and area under the curve (AUC) are roughly dose proportional up to 200 mg BID; at higher doses there are less than proportional increases in Cmax and AUC (see Food Effects). Absolute bioavailability studies have not been conducted. With multiple dosing, steady state conditions are reached on or before Day 5.
The pharmacokinetic parameters of celecoxib in a group of healthy subjects are shown in Table 1.
〔臨床薬理〕 作用機序 CELEBREX は動物モデルにおいて抗炎症,鎮痛,解熱作用を示 す非ステロイド系抗炎症薬(以下NSAIDs)である.CELEBREX の作用機序は,主としてシクロオキシゲナーゼ-2(以下 COX-2) の阻害によるプロスタグランジンの合成阻害によると考えられ ており,ヒトにおける治療濃度でCELEBREX はシクロオキシゲ ナーゼ-1(以下 COX-1)アイソザイムを阻害しない.動物の大腸 腫瘤モデルでは,celecoxib が腫瘤発現率及び腫瘤数を減少させ た. 血小板 健康志願者を対象とした臨床試験において,CELEBREX 800 mg までを単回投与及び600 mg を 1 日 2 回 7 日間反復投与したとこ ろ(推奨用量を超える用量),血小板凝集の低下及び出血時間の 延長は認められなかった.血小板に対する作用がないので, CELEBREX は血小板凝集抑制薬としてのアスピリンの代替には ならない. CELEBREX を使用することで引き起こされる重篤な 心血管系血栓事象のリスクを増大させる一因となる可能性があ る.CELEBREX の血小板に対する作用があるか否かは不明であ る. 体液貯留 PGE2 合成抑制作用に基づく腎髄質ヘンレ係蹄の太い上行脚及び おそらく他の遠位ネフロンにおける再吸収亢進のため Na・水分 貯留が起こることがある.集合管において,PGE2 は抗利尿ホル モンの作用を抑制することによって水分の再吸収を抑制すると 思われる. 薬物動態 吸収 血漿中celecoxib 濃度は,経口投与後約 3 時間で最高濃度に達する. 絶食時,最高血漿中濃度(以下 Cmax)と血漿中濃度-時間曲線 下面積(以下AUC)は,200 mg 1 日 2 回まではほぼ投与量に比 例した.より高い投与量においては,Cmax と AUC は用量比例性 からの予測値よりも低値を示した(「食事の影響」を参照).絶対 バイオアベイラビリティ試験は実施していない.反復投与では, 5 日目までに定常状態に到達した. 健康成人におけるcelecoxib の薬物動態パラメータを表 1 に示 す. 表 1 健康成人に celecoxib 単回投与(200 mg)時の 薬物動態パラメータ1 1
Food Effects
When CELEBREX capsules were taken with a high fat meal, peak plasma levels were delayed for about 1 to 2 hours with an increase in total absorption (AUC) of 10% to 20%. Under fasting conditions, at doses above 200 mg, there is less than a proportional increase in Cmax and AUC, which is thought to be due to the low solubility of the drug in aqueous media. Coadministration of CELEBREX with an aluminum- and magnesium-containing antacid resulted in a reduction in plasma celecoxib concentrations with a decrease of 37% in Cmax and 10% in AUC. CELEBREX, at doses up to 200 mg BID can be administered without regard to timing of meals. Higher doses (400 mg BID) should be administered with food to improve absorption.
Distribution
In healthy subjects, celecoxib is highly protein bound (~97%) within the clinical dose range. In vitro studies indicate that celecoxib binds primarily to albumin and, to a lesser extent, α1-acid glycoprotein. The
apparent volume of distribution at steady state (Vss/F) is approximately 400 L, suggesting extensive distribution into the tissues. Celecoxib is not preferentially bound to red blood cells.
Metabolism
Celecoxib metabolism is primarily mediated via cytochrome P450 2C9. Three metabolites, a primary alcohol, the corresponding carboxylic acid and its glucuronide conjugate, have been identified in human plasma. These metabolites are inactive as COX-1 or COX-2 inhibitors. Patients who are known or suspected to be P450 2C9 poor metabolizers based on a previous history should be administered celecoxib with caution as they may have abnormally high plasma levels due to reduced metabolic clearance.
Excretion
Celecoxib is eliminated predominantly by hepatic metabolism with little (<3%) unchanged drug recovered in the urine and feces. Following a single oral dose of radiolabeled drug, approximately 57% of the dose was excreted in the feces and 27% was excreted into the urine. The primary metabolite in both urine and feces was the carboxylic acid metabolite (73% of dose) with low amounts of the glucuronide also appearing in the urine. It appears that the low solubility of the drug prolongs the absorption process making terminal half-life (t1/2) determinations more variable. The effective half-life is
approximately 11 hours under fasted conditions. The apparent plasma clearance (CL/F) is about 500 mL/min.
Special Populations
Geriatric: At steady state, elderly subjects (over 65 years old) had a
40% higher Cmax and a 50% higher AUC compared to the young subjects. In elderly females, celecoxib Cmax and AUC are higher than those for elderly males, but these increases are predominantly due to lower body weight in elderly females. Dose adjustment in the elderly is not generally necessary. However, for patients of less than 50 kg in body weight, initiate therapy at the lowest recommended dose.
Pediatric: CELEBREX capsules have not been investigated in pediatric
食事の影響 CELEBREX カプセルを高脂肪食摂取後投与したとき,最高血漿 中濃度到達時間(Tmax)が 1~2 時間遅延し,吸収量の指標とな るAUC は 10~20%増加した.絶食時,200mg より高用量におい て,Cmax と AUC の用量比例性からの予測値よりも低値を示した のは,本剤の水性溶媒に対する溶解性が低いためと考えられる. CELEBREX をアルミニウム及びマグネシウム含有制酸剤と同時 に投与すると,celecoxib の血漿中濃度は Cmax で 37%,AUC で 10%減少した.CELEBREX は 200mg 1 日 2 回までは食事の影響を 考慮せずに投与することができる.更に高用量(400mg 1 日 2 回) では吸収改善のため食後に投与すべきである.
分布
健康成人において,臨床投与量の範囲でcelecoxib の蛋白結合率は 高い(~97%).In vitro 試験において,celecoxib は主としてアル ブミンと結合し,更にやや低い割合ではあるがα1-酸性糖蛋白質と も結合することが示された.定常状態での見かけの分布容積 (Vss/F)は約 400 L であり,組織への広範囲な分布が示唆された. Celecoxib は赤血球と特異的な結合はしない. 代謝 Celecoxib は主としてチトクロム P450 2C9 により代謝される.3 種の代謝物,すなわち一次代謝物である水酸化体,更に代謝され たカルボン酸体及びそのグルクロン酸抱合体がヒト血漿中に確 認された.これらの代謝物はCOX-1 又は COX-2 阻害剤としては 不活性である.既往歴からP450 2C9 の代謝能が低いことが分かっ ている,あるいはその疑いのある患者では,代謝クリアランスが 低下するため血漿中濃度が異常に高くなる可能性があるので注 意してcelecoxib を投与するべきである. 排泄 Celecoxib は主として肝代謝により消失し,未変化体は尿中及び糞 中からほとんど回収されない(3%未満).本剤の放射能標識体を 単回経口投与した後,投与量の約57%が糞中に,27%が尿中に排 泄された.尿糞中の主な代謝物はカルボン酸体(投与量の73%) であり,少量のグルクロン酸抱合体が尿中に認められた.本剤の 溶解性が低いことが吸収に要する時間を延長し,終末相の消失半 減期(t1/2)のバラツキを大きくしている.消失半減期は空腹時投 与で約11 時間である.見かけの血漿クリアランス(CL/F)は約 500 mL/min である. 特殊な集団 高齢者:定常状態において,高齢者(65 歳を超える)では若年者 に比較してCmax が 40%,AUC が 50%高かった.高齢の女性で はcelecoxib の Cmax と AUC は高齢の男性よりも高いが,これは 主として高齢の女性の体重が軽いためである.高齢者に対する投 与量調節は一般的には必要でない.しかし,体重が50 kg 未満の 患者には,推奨用量の最低量から治療を開始すること.
patients below 18 years of age.
Race: Meta-analysis of pharmacokinetic studies has suggested an
approximately 40% higher AUC of celecoxib in Blacks compared to Caucasians. The cause and clinical significance of this finding is unknown.
Hepatic Insufficiency: A pharmacokinetic study in subjects with mild
(Child-Pugh Class A) and moderate (Child-Pugh Class B) hepatic impairment has shown that steady-state celecoxib AUC is increased about 40% and 180%, respectively, above that seen in healthy control subjects. Therefore, the daily recommended dose of CELEBREX capsules should be reduced by approximately 50% in patients with moderate (Child-Pugh Class B) hepatic impairment. Patients with severe hepatic impairment (Child-Pugh Class C) have not been studied. The use of CELEBREX in patients with severe hepatic impairment is not recommended (see DOSAGE AND ADMINISTRATION). .
Renal Insufficiency: In a cross-study comparison, celecoxib AUC was
approximately 40% lower in patients with chronic renal insufficiency (GFR 35-60 mL/min) than that seen in subjects with normal renal function. No significant relationship was found between GFR and celecoxib clearance. Patients with severe renal insufficiency have not been studied. Similar to other NSAIDs, CELEBREX is not recommended in patients with severe renal insufficiency (see
WARNINGS - Advanced Renal Disease). Drug Interactions
Also see PRECAUTIONS – Drug Interactions.
General: Significant interactions may occur when celecoxib is
administered together with drugs that inhibit P450 2C9. In vitro studies indicate that celecoxib is not an inhibitor of cytochrome P450 2C9, 2C19 or 3A4.
Clinical studies with celecoxib have identified potentially significant interactions with fluconazole and lithium. Experience with nonsteroidal anti-inflammatory drugs (NSAIDs) suggests the potential for interactions with furosemide and ACE inhibitors. The effects of celecoxib on the pharmacokinetics and/or pharmacodynamics of glyburide, ketoconazole, methotrexate, phenytoin, and tolbutamide have been studied in vivo and clinically important interactions have not been found.
CLINICAL STUDIES
Osteoarthritis (OA): CELEBREX has demonstrated significant
reduction in joint pain compared to placebo. CELEBREX was evaluated for treatment of the signs and the symptoms of OA of the knee and hip in placebo- and active-controlled clinical trials of up to 12 weeks duration. In patients with OA, treatment with CELEBREX 100 mg BID or 200 mg QD resulted in improvement in WOMAC (Western Ontario and McMaster Universities) osteoarthritis index, a composite of pain, stiffness, and functional measures in OA. In three 12-week studies of pain accompanying OA flare, CELEBREX doses of 100 mg BID and 200 mg BID provided significant reduction of pain within 24-48 hours
検討されていない.
人種:薬物動態試験のメタアナリシスより,黒人では白人に比べ celecoxib の AUC が約 40%高いことが示唆された.この事象の原 因及び臨床的重要性は不明である.
肝機能不全:軽度(Child-Pugh Class A)及び中等度(Child-Pugh
Class B)の肝機能障害を有する被験者に対する薬物動態試験にお いて,定常状態でのcelecoxib の AUC は健康な対照被験者に比べ それぞれ約40%及び約 180%高いことが示された.したがって, 中等度(Child-Pugh Class B)の肝機能障害を持つ患者に投与する 場合は,CELEBREX カプセルの通常推奨用量の約 50%に減らす べきである.重度(Child-Pugh Class C)の肝機能障害を持つ患者 については検討されていない.重度の肝機能障害を有する患者に 対しては,CELEBREX の投与は推奨されない(「用法・用量」を 参照). 腎機能不全:交差比較試験において,慢性腎不全患者(GFR 35-60 mL/min)では腎機能が正常な被験者に比べ,celecoxib の AUC は 約40%低かった.GFR と celecoxib のクリアランスの間に有意な 相関はみられなかった.重度の腎不全患者については検討されて いない.他のNSAIDs と同様に,CELEBREX は重度の腎不全患者 には勧められない(「警告‐進行した腎臓病」を参照). 薬物相互作用 「使用上の注意-薬物相互作用」の項も参照すること. 一般的注意:P450 2C9 を阻害する薬剤と celecoxib を併用投与す ると重大な相互作用が起きる可能性がある.In vitro 試験では, celecoxib はチトクロム P450 2C9,2C19 及び 3A4 の阻害剤ではな いことが示された. Celecoxib との併用を検討した臨床試験において,フルコナゾー ル及びリチウムとの間に重大な相互作用が起きる可能性が示され た.NSAIDs の使用経験から,フロセミド及び ACE 阻害剤との相 互作用の可能性が示唆されている.グリブライド,ケトコナゾール, メトトレキサート,フェニトイン,トルブタミドの薬物動態及び薬 力学に及ぼすcelecoxib の影響が in vivo で検討されたが,臨床的に 重要な相互作用はみられていない. 〔臨床試験〕 変形性関節症(OA):CELEBREX は,プラセボに比べ関節痛を有 意に減少させることが示された.12 週間までのプラセボ及び対照 薬を用いた比較臨床試験において,CELEBREX の膝関節及び股 関節OA の徴候及び症状に対する有効性が検討された.OA 患者 にCELEBREX を 100 mg 1 日 2 回又は 200 mg 1 日 1 回投与した結 果,OA の疼痛,こわばり及び機能障害の複合的評価指標である WOMAC(Western Ontario and McMaster Universities)OA インデッ クスが改善した.OA フレアによる疼痛に対する 3 件の 12 週間試 験において,CELEBREX 100 mg 1 日 2 回又は 200 mg 1 日 2 回投 与により,投与開始から24-48 時間以内に疼痛の有意な減少がみ