<症例報告>
Glecaprevir/pibrentasvir 治療不成功であった Genotype 2 型症例に対し
glecaprevir/pibrentasvir 再治療を行った 2 症例
瀬崎ひとみ
1)*鈴木 文孝
1)藤山俊一郎
1)川村 祐介
1)保坂 哲也
1)芥田 憲夫
1)小林 正宏
1)鈴木 義之
1)斎藤
聡
1)荒瀬 康司
1)池田 健次
1)小林万利子
2)熊田 博光
1) 要旨:今回我々は,glecaprevir(GLE)/pibrentasvir(PIB)治療不成功であった genotype 2 型に対し,再度 GLE/PIB 12 週治療を行い完全著効(SVR)を得られた 2 症例を経験した.症例 1 は 65 歳の慢性肝炎男性.GLE/PIB 8 週治療終了後 HCV RNA の再燃を認め,再度 GLE/PIB 12 週治療を行った.再治療開始時 NS5A-L28F+L31M+C92S のアミノ酸変異を認めたが SVR を達成した.症例 2 は 51 歳,肝硬変女性.他院で GLE/PIB 開始後掻痒のため 3 日目に治療中 止.その後当院で再度 GLE/PIB 治療を開始した.開始時よりナルフラフィン塩酸塩を併用した ところ有害事象なく 12 週治療を完遂し SVR を達成した.同種類の薬剤を使用しても治療期間を 延長することにより治療効果が得られた症例を経験し,再治療の選択を行う上で興味深い症例と 思われたので報告した.索引用語: C型慢性肝炎 genotype 2型 glecaprevir pibrentasvir
direct acting antiviral agents はじめに パンゲノタイプ型のリバビリン-フリー治療である gle-caprevir(GLE)/pibrentasvir(PIB)併用療法は 100% に近い症例が SVR を得られるようになった1)∼3).一方 で,GLE/PIB でも治療不成功となった症例に対して有 効な治療法を明らかにすることが急務である.今回我々 は,GLE/PIB 治療で不成功であった症例に対し,再度 GLE/PIB 治療を行い完全著効(sustained virological response;SVR)を得た genotype 2 型の 2 症例を経験 したので報告する. 症例 1 症例:65 歳,男性. 合併症:高血圧,糖尿病. 飲酒歴:機会飲酒. 経過(図 1):高血圧,糖尿病で通院中の前医で C 型肝炎ウイルス(HCV)抗体陽性を指摘され,2018 年 7 月 17 日当科紹介受診した.Genotype 2b 型の初回 治療例であり,同年 9 月 19 日より GLE/PIB 8 週による 治療を開始した.治療開始後 4 週で HCV RNA は検出 感度以下となったが,8 週治療終了後 4 週目で再燃を認 めた.Direct sequence 法による HCV-NS5A アミノ酸 変異は HCV-HC-J8 を参照 sequence として,初回治療 開始時は L28F,L31M といったアミノ酸変異を有して いたが,治療不成功によりそれらに加え C92S の変異が 出現していた.早期の再治療を望まれたため,全治療 終了後 16 週経過した 2019 年 2 月 28 日より GLE/PIB 12 週による再治療を開始した.再治療開始時の臨床背 景および検査所見は表 1 に示す.再治療開始後 6 週時 点で HCV RNA が検出感度以下となったことを確認し, 特に有害事象なく 12 週治療を完遂した.再治療終了後 24 週以上経過した現在まで HCV RNA の陰性化を維持 している. 1)虎の門病院肝臓センター 2)虎の門病院肝臓研究室 *
Corresponding author: hitomis@mx1.harmonix.ne.jp <受付日2020年10月7日><採択日2020年11月12日>
図 1 Clinical course and resistance-associated substitutions in HCV-NS5A in Case 1. GT,genotype;GLE,glecaprevir;PIB,pibrentasvir
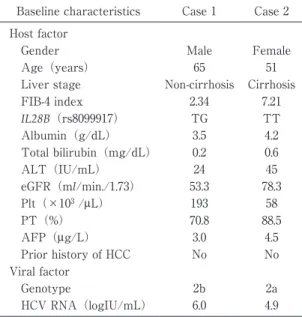
表 1 Baseline characteristics at initiation of glecap-revir/pibrentasvir re-treatment
Baseline characteristics Case 1 Case 2 Host factor
Gender Male Female
Age(years) 65 51
Liver stage Non-cirrhosis Cirrhosis FIB-4 index 2.34 7.21 IL28B(rs8099917) TG TT Albumin(g/dL) 3.5 4.2 Total bilirubin(mg/dL) 0.2 0.6 ALT(IU/mL) 24 45 eGFR(ml/min./1.73) 53.3 78.3 Plt(×103 /μL) 193 58 PT(%) 70.8 88.5 AFP(μg/L) 3.0 4.5 Prior history of HCC No No Viral factor Genotype 2b 2a HCV RNA(logIU/mL) 6.0 4.9 ALT,alanine aminotransferase;eGFR,estimated glo-merular filtration rate;PT,prothrombin time;AFP,al-pha-fetoprotein 症例 2 症例:51 歳,女性. 合併症:特記すべきものなし. 飲酒歴:なし. 経過(図 2):genotype 2a の肝硬変に対し,前医にて 2019 年 2 月 26 日に GLE/PIB 治療を開始した.2 日内 服したところで皮膚掻痒感,手掌・足底の発赤の出現 を認めたため 3 日目に内服を中止とした.C 型肝炎に対 する再治療を希望され,同年 5 月 22 日当科紹介受診と なった.同治療による早期の再治療を希望され,同年 5 月 24 日より GLE/PIB 12 週治療による再治療を開始 した.再治療開始時の臨床背景および検査所見を表 1 に示す.再治療開始時の HCV-NS5A アミノ酸変異は L 31M を認めていた.再治療開始後 2 週時点で HCV RNA は検出感度以下となり,治療開始時からのナルフラフィ ン塩酸塩併用により掻痒・皮疹の出現なく 12 週治療を 完遂した.再治療終了後 24 週以上経過した現在まで HCV RNA の陰性化を維持している. 考 察 GLE/PIB が本邦で承認されて以降,実臨床において もその高い治療効果は国内の各施設から報告されてき
図 2 Clinical course and resistance-associated substitutions in HCV-NS5A in Case 2. GT,genotype;GLE,glecaprevir;PIB,pibrentasvir た4)∼6).いずれの報告も SVR 率は約 99% と高率である が,一方で GLE/PIB 治療でも治療不成功例となる症例 が一定数存在することも確かである.今回我々は,GLE/ PIB 治療により治療不成功であった 2 例に対し,再度 DAAs 既治療例として GLE/PIB12 週治療を行った 2 例を経験した.いずれの症例も genotype 2 型であり, HCV-NS3 および NS5A 領域のアミノ酸変異の有無をダ イレクトシークエンス法により解析した. 症例 1 は,genotype 2b 型で 1 回目の GLE/PIB 治療 は慢性肝炎に対する 8 週治療を完遂したが,治療終了 後再燃した症例であった.本症例の初回治療時の NS 5Aアミノ酸配列をGenotype 2b型の参照配列であるHC-J8 と比較すると,治療前より L28F のアミノ酸変異を 有していたが,HCV 再燃時(GLE/PIB 再治療時)には C92S の変異も加わっていた(図 1).この C92S の変異 については本報告に先立ち Ohya らが genotype 2a 型の 症例で GLE/PIB 不成功例に対する GLE/PIB 再治療の 1 例を報告した際に言及しており7),初回治療時より C 92C/S の混在が確認されていたが再燃時に C92S と変異 していたことより,GLE/PIB 治療不成功に寄与する可 能性を示唆していた.Genotype 2b 型においては,HCV レプリコン細胞を用いた検討で,L28F+L31M+C92 S の変異は野生株に比し PIB に対して 1.6 倍の耐性を有 すると報告されている8).本症例では治療開始時に NS 5A-C92S は確認されていないが,再燃時に L28F+L31 M に加えて C92S が出現したことから,これらの変異の 組み合わせにより初回の GLE/PIB8 週治療では効果が 不十分となった可能性が考えられる.しかしながら, この仮説を証明するためには GLE/PIB8 週治療成功例 を含めた治療開始前の NS5A アミノ酸変異を検討する など多数例での検討が必要である.また,本症例は IL 28Bgenotype にG alleleを有する症例であった.以前我々 は,genotype 1b 型の GLE/PIB 治療の治療不成功例は 2 例とも IL28B genotype が TG の症例であったことを 報告した9).IL28Bの遺伝子多型は HCV の自発的な排除 に相関することが報告されており10),近年では IFNL3
(IL28B)の上流に位置する IFNL4 allele が sofosbuvir (SOF)+ribavirin(RBV)治療の早期ウイルス減少と
相関することも報告された11).このことから,IL28B
genotype は IFN free 治療においてもその治療効果に影 響する可能性が示唆され,本症例においても IL28B G allele がウイルス再燃に関与した可能性は否定できず, 治療を延長したことが HCV 排除に功を奏した可能性が 考えられる.しかしながら,GLE/PIB 治療効果と IL
症例 2 は,初回の GLE/PIB 治療は他院で掻痒のため 治療早期に中止となった症例であった.GLE/PIB での 再治療の希望があったため,当院では掻痒予防にナル フラフィン塩酸塩を併用して再治療を開始した.GLE/ PIB 治療による有害事象の報告の中で,掻痒感は 3-22% と報告されており1)∼6),特に本症例のような肝硬変症例 では 22% と発症率が高くなっていた.ナルフラフィン 塩酸塩は抗ヒスタミン薬や抗アレルギー薬などの既存 治療に効果不十分な慢性肝疾患症例に対して有効性が 確認され12),2015 年 3 月に適応追加承認された薬剤で あり,現在慢性肝疾患症例の掻痒に対し広く使用され ている.本症例も GLE/PIB 再治療開始と同時にナルフ ラフィン塩酸塩を併用することにより掻痒感の出現を 抑え,12 週治療を完遂しえ,SVR を達成した.GLE/ PIB 治療時の有害事象である掻痒感に対してもナルフラ フィン塩酸塩が有効である可能性が示唆された.また, 本症例の HCV アミノ酸変異については GLE/PIB 再治 療時のみの検討であるが(図 2),Genotype 2a 型の参 照配列である JFH-1 と比較すると,NS5A-L31M に変異
を認めていた.その他 genotype 2a 型の GLE および PIB
に対する耐性に関連する変異は認めず,12 週治療で SVR となりえた. 現在,日本肝臓学会が提唱する C 型肝炎治療ガイド ライン13)では,インターフェロンフリー DAAs 治療既 治療例に対して GLE/PIB 12 週治療と SOF/velpatasvir (VEL)+RBV 24 週治療が推奨されている.本症例は GLE/PIB 治療不成功であるため,本来であれば再治療 として SOF/VEL+RBV 治療を選択すべきであったか もしれない.しかしながら,再治療開始時には未だ SOF/ VEL+RBV 承認前であり,早急な再治療を希望された ために,再度 GLE/PIB 治療を選択することとなった. 同薬剤を使用することによる再治療に関しては,十分 な経験がなく薬剤に対する耐性変異の出現により治療 効果が得られない可能性があること,また公費による 医療費助成が使用できないことなどの倫理面を考慮し た上で患者に説明を行い,治療の同意を得た.Ohya らの報告した症例は7),血液透析を行っている症例であ り,SOF あるいは RBV の使用は禁忌とされているため に再治療として SOF/VEL+RBV を選択できず,GLE/ PIB 再治療を行われた.今回の報告も合わせると,GLE/ PIB 治療不成功であっても前治療が 8 週治療あるいは治 療中止例であれば GLE/PIB による再治療も有効性を保 用できない症例における再治療の選択肢となりえるこ とが示唆された. 結 語
Genotype 2 型の GLE/PIB 不成功例に対する GLE/ PIB 12 週による再治療で SVR となった症例を 2 例経験 した.同種類の薬剤を使用しても治療期間を延長する ことにより再治療時に有効性が得られるものと考える.
文 献
1)Chayama K, Suzuki F, Karino Y, et al. Efficacy and safety of glecaprevir/pibrentasvir in Japanese pa-tients with chronic genotype 1 hepatitis C virus in-fection with and without cirrhosis. J Gastroenterol 2018; 53: 557―565
2)Toyoda H, Chayama K, Suzuki F, et al. Efficacy and safety of glecaprevir/pibrentasvir in Japanese pa-tients with chronic genotype 2 hepatitis C virus in-fection. Hepatology 2017; 67: 505―513
3)Kumada H, Watanabe T, Suzuki F, et al. Correction to: Efficacy and safety of glecaprevir/pibrentasvir in HCV-infected Japanese patients with prior DAA experience, severe renal impairment, or genotype 3 infection. J Gastroenterol 2018; 53: 566―575 4)Sezaki H, Suzuki F, Hosaka T, et al. Initial- and
re-treatment effectiveness of glecaprevir and pibren-tasvir for Japanese patients with chronic hepatitis C virus-genotype 1/2/3 infections. J Gastroenterol 2019; 54: 916―927
5)Ogawa E, Furusyo N, Nakamura M, et al. Glecapre-vir and pibrentasGlecapre-vir for Japanese patients with chronic hepatitis C genotype 1 or 2 infection: Re-sults from a multicenter, real-world cohort study. Hepatol Res 2019; 49: 617―626
6)Nozaki A, Atsukawa M, Kondo C, et al. The effec-tiveness and safety of glecaprevir / pibrentasvir in chronic hepatitis C patients with refractory factors in the real world: a comprehensive analysis of a prospective multicenter study. Hepatol Int 2020; 14: 225―238
7)Ohya K, Imamura M, Osawa M, et al. Successful re-treatment with 12 weeks of glecaprevir and pi-brentasvir for a genotype 2a HCV-infected
hemo-dialysis patient who failed to respond to 8 weeks of prior glecaprevir and pibrentasvir therapy. Clin J Gastroenterol 2020; 13: 267―270
8)MAVIRETⓇ
[interview form]. Ver. 5, AbbVie, To-kyo, 2019
9)Sezaki H, Suzuki F, Hosaka T, et al. Initial- and re-treatment effectiveness of glecaprevir and pibren-tasvir for Japanese patients with chronic hepatitis C virus-genotype 1/2/3 infections. J Gastroenterol 2019; 54: 916―927
10)Thomas DL, Thio CL, Martin MP, et al. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature 2009; 461: 798―801 11)Meissner E, Bon D, Prokunina-Olsson P, et al. IFNL
4-DG genotype is associated with slower viral clearance in hepatitis C, genotype-1 patients treated with sofosbuvir and ribavirin. J Infect Dis 2014; 209: 1700―1704
12)Kumada H, Miyakawa H, Muramatsu T, et al. Effi-cacy of nalfurafine hydrochloride in patients with
chronic liver disease with refractory pruritus: A randomized, double-blind trial. Hepatol Res 2017; 47: 972―982
13)Drafting Committee for Hepatitis Management Guidelines, the Japan Society of Hepatology. Japan Society of Hepatology guidelines for the manage-ment of hepatitis C virus infection: 2019 update. He-patol Res 2020; 50: 791―816 本論文内容に関連する著者の利益相反: 熊田博光(アッヴィ合同会社,エーザイ株式会社,ギ リアド・サイエンシズ株式会社,大日本住友製薬株式 会社,MSD 株式会社,ブリストル・マイヤーズ・スク イブ株式会社),鈴木義之(アッヴィ合同会社,ブリス トル・マイヤーズ・スクイブ株式会社),小林正宏(エー ザイ株式会社),芥田憲夫(アッヴィ合同会社,ギリア ド・サイエンシズ株式会社,ブリストル・マイヤーズ・ スクイブ株式会社),川村祐介(エーザイ株式会社(講 演料))
glecaprevir and pibrentasvir therapy
Hitomi Sezaki1)*, Fumitaka Suzuki1), Shunichiro Fujiyama1), Yusuke Kawamura1), Tetsuya Hosaka1),
Norio Akuta1), Masahiro Kobayashi1), Yoshiyuki Suzuki1), Satoshi Saitoh1), Yasuji Arase1), Kenji Ikeda1),
Mariko Kobayashi2), Hiromitsu Kumada1)
We report two cases that achieved sustained virological response (SVR) upon 12 weeks of glecaprevir (GLE) and pibrentasvir (PIB) for HCV genotype 2 infection after failing prior GLE/PIB. Case 1 was a 65-year-old man without cirrhosis. His HCV RNA relapsed after the end of GLE/PIB therapy for 8 weeks; subsequently, he re-ceived retreatment with 12 weeks of GLE/PIB therapy. Although he harbored HCV NS5A-L28F+L31M+C92 S at pre-GLE/PIB retreatment, he achieved SVR. Case 2 was a 51-year-old woman with cirrhosis. She discontin-ued GLE/PIB therapy at 3 days owing to pruritus in another hospital. Subsequently, she completed 12 weeks of GLE/PIB therapy combined with nalfurafine hydrochloride without any adverse events in our hospital, and achieved SVR. These findings suggest that prolongation of the treatment period to 12 weeks might have con-tributed to SVR, even if they received retreatment with the same drugs.
Key words: Chronic hepatitis C genotype 2 glecaprevir pibrentasvir direct acting antiviral agents
Kanzo2021; 62: 357―362 1)Department of Hepatology, Toranomon Hospital, Tokyo, Japan
2)Research Institute for Hepatology, Toranomon Hospital, Tokyo, Japan
*Corresponding author:hitomis@mx1.harmonix.ne.jp