高齢在宅パーキンソン病患者の生活空間に関連する因子の検討
9
0
0
全文
(2) 352. 理学療法学 第 46 巻第 5 号. 表 1 対象者の基本属性. の関連性が高く,将来の ADL 制限に関係していること が報告されている. 14). 。生活空間に関連する因子につい. 項目. n = 45. て,国内では通所リハ利用者を対象とした研究で Timed. 年齢(歳). up & go test(以下,TUG)や握力といった身体機能に. 性別(男性 / 女性,名). 加え,趣味や友人の有無といった外出目的,交通機関の. 罹病期間(年). 有無といった現実的な外出手段が関連していたと報告さ. mH-Y stage. 19 / 26 6.0 (3.0 ‒ 8.5) 2.5 (1.7 ‒ 3.0). 15). 。また,慢性期脳卒中者で歩行速度や持久. 1. 6 (13.3%). ,末期の変形性膝関節症(以下,膝 OA)者では. 1.5. 5 (11.1%). れている 力. 74.8 ± 5.3. 16). 2. 10 (22.2%). 2.5. 12 (26.7%). 3. 11 (24.4%). 4. 1 (2.2%). TUG 所要時間や外出への自信,自宅周囲の舗装状況が 関連因子であることが報告されている. 17). 。将来的な. ADL 低下を防ぐため,活動や参加の重要性が示されて いるが. 14)15)18). ,PD 患者を対象とした生活空間の実態. 調査や関連因子の検討は十分なされていない. 19). 。. そこで本研究では,PD 患者の生活空間を調査し,そ. 平均値±標準偏差 中央値(四分位範囲),または人数(割合) mH-Y stage:modified Hoehn & Yahr staging scale. の現状を明らかにすること,また PD 患者の生活空間に 関連する因子を特定することを目的とした。 方 法. を確認した。本研究における外来患者の測定では,日常 生活で動けていると感じている状態と,測定時の状態を. 1.対象. 比較することでオン状態の確認を行った。すなわち,測. 神経内科専門医により PD の診断を受けた 65 歳以上. 定時において動きが悪い場合は 0 点,動きが良い場合は. の者で,2018 年 5 月 1 日∼ 7 月 31 日の間に札幌西円山. 10 点とする連続する数値において,本人または家族が 5. 病院で加療中(外来および入院患者)であった 88 名の. 点以上と返答した者を対象としている。. うち,選択基準に非該当であった者,除外基準該当者を 除いた 45 名(外来患者 39 名,入院患者 6 名)を対象と. 2.倫理的配慮. した。平均年齢は 74.8 ± 5.3 歳であり,modified Hoehn. 本研究は北海道医療大学倫理委員会による承認を得て. & Yahr staging scale(以下,mH-Y stage)は 2.5 であっ. 実施した(承認番号 17R064060)。対象者には研究目的. た(表 1)。服薬状況はレボドパ製剤を使用している者. と内容に加え,個人情報を厳重に管理することを初回面. は 39 名(87%),ドパミンアゴニストを使用している者. 談時に説明し,書面にて同意を得た。. は 28 名(62%),どちらも使用していない者は 3 名(7%) であった。選択基準は在宅生活を継続し明らかな認知障. 3.研究デザイン. 害を認めない者とした。除外基準は歩行不能な者,運動. 横断的研究であり,外来患者では受診日に各種測定と. 症状の変動が著明な者,活動に明らかに影響する内部障. 過去 4 週間の生活空間評価を実施した。入院患者では入. 害を有する者とした。明らかな認知障害を認めない者と. 院後 7 日の間で,かつ服薬調整等が行われる前に各種測. は Movement Disorder Society-Unified Parkinson’s. 定と入院前 4 週間の生活空間評価を実施した。. Disease Rating Scale( 以 下,MDS-UPDRS)part I-1. 認知障害にて 0 点「認知障害なし」 ,1 点「患者,ある. 4.調査項目. いは介助者が認識している認知障害で,ほとんど患者の. 1)基本情報. 日常の活動や社会とのかかわりを妨げない」に該当する. 年齢,性別,罹病期間,mH-Y stage,同居家族の有無,. 者,歩行不能な者とは MDS-UPDRS part II-12.歩行と. 自宅環境(一軒家,マンション・アパート) ,近隣道路. バランスで 4 点「私はたいてい人に助けてもらって,転. 状況(舗装,非舗装),公共交通機関の有無,過去 6 ヵ. ばず安全に歩けます」に該当する者とした。運動症状の. 月間の転倒状況について,カルテおよび本人から収集. 変動が著明な者とは MDS-UPDRS part IV-3.off 状態で. した。. 過ごす時間にて 3 点以上「目覚めている時間の 51%以. 2)生活空間. 上がオフ時間」とした。 運動症状や移動能力に関する測定は方法を統一し,個. 生活空間の評価には Life-Space Assessment 日本語版 (以下,LSA)を使用した. 18). 。LSA は身体活動を生活. 別リハ対象の患者では担当理学療法士が,非対象患者で. 空間といった概念で捉え,寝室を中心に 5 つのレベルに. は研究者が測定した。測定にあたり,対象者が抗 PD 薬. 分割された生活空間を移動した頻度や,自立度により点. を服用してから 30 分以上経過し,オン状態であること. 数化する評価方法である. 20). 。生活空間レベル 1 は自宅.
(3) 在宅パーキンソン病患者の生活空間関連因子. 表 2 測定結果. 内(寝室外)で 1 点,レベル 2 は自宅に近い屋外で 2 点, レベル 3 は自宅近隣で 3 点,レベル 4 は自宅近隣より離. 353. 評価項目. れた場所(町内)で 4 点,レベル 5 は町外で 5 点と配点. 過去 6 ヵ月の転倒経験者(名). 17 (37.8%). する。過去 4 週間のうちにどのレベルまで,どれくらい. FPSE(点). 25.2 ± 5.0. の頻度(週 1 回未満を 1 点,週 1 ∼ 3 回を 2 点,週 4 ∼. LSA-score(点). 6 回を 3 点,毎日を 4 点)で出向き,そのときの自立度. MDS-UPDRS part Ⅲ(点). 45.5 (35.0 ‒ 59.5) 30.2 ± 10.8. (人的介助で 1 点,物的介助で 1.5 点,自立で 2 点)に. 固縮 Rigidity. 7.0 (3.5 ‒ 10.0). 合わせて得点を算出し評価する。合計点数は 120 点とな. 振戦 Tremor. 2.0 (0 ‒ 6.0). り,得点が高いほど活動的な生活を営んでいることを意. 無動 Bradykinesia. 味する。. 軸症状 Axial symptoms. 3)運動症状. Timed up & go test(秒). PD の運動症状を評価するために MDS-UPDRS 日本語 版を使用した. 21). 。UPDRS は PD の多様な症状を定量的. に評価する国際基準の評価であり,信頼性が確認されて いる. 22). 。この UPDRS の改定版が MDS-UPDRS であり,. さらに判断基準を統一することで評価の一致率が高まる ことが示されている. 10 m 歩行テスト 所要時間(秒). 14.0 (9.0 ‒ 17.0) 7.0 (2.5 ‒ 9.5) 10.1 (8.4 ‒ 12.8) 7.9 (6.8 ‒ 9.7). 平均値±標準偏差 中央値(四分位範囲) FPSE:Fall Prevention Self-Efficacy LSA:Life-Space Assessment MDS-UPDRS:Movement Disorder Society-Unified Parkinson’s Disease Rating Scale. 23). 。MDS-UPDRS は part I 日常生. 活での非運動症状,part II 日常生活で経験する運動症状 の側面,part III 運動機能評価,part IV 運動合併症の 4 つの大項目から構成される. 24). 。本研究ではこの MDS-. 値を使用した。対象者が日常生活で歩行補助具を使用し ている場合は,その歩行補助具を使用し測定した。. UPDRS part III を用いて運動症状の評価を行った。 運動症状は固縮,振戦,無動,軸症状にサブスコア化. 5.統計学的解析. し, そ れ ぞ れ に 下 位 項 目 を 割 り あ て た。 固 縮 で part. 過去 6 ヵ月の転倒経験の有無,同居家族の有無,自宅. III-3 の頸部,右上肢,左上肢,右下肢,左下肢 5 ヵ所. 環境,近隣環境,公共交通機関の有無によって LSA の. の固縮状況を評価し(0 ∼ 20 点) ,振戦では part III-15. 差がないか Mann-Whitney U 検定で確認した。さらに,. ∼ 18 の手の姿勢時振戦(左右),手の運動時振戦(左右),. 転倒経験の有無による FPSE の差を対応のない t 検定に. 静止時振戦の振幅(四肢,顎・口唇),静止時振戦の持. て求めた。LSA の各行動範囲で,行動頻度別に占める. 続性を評価した(0 ∼ 40 点)。無動では part III-2 表情,. 人数と,行動自立度別に占める人数を算出した。. part III-4 指タッピング(左右) ,part III-5 手の運動(左. 各変数の関連を正規データは Pearson の相関係数を,. 右) ,part III-6 手の回内外運動(左右) ,part III-7 つま. 非正規データは Spearman の順次相関係数にて検討し. 先タッピング(左右) ,part III-8 下肢の敏捷性(左右). た。LSA を従属変数とした階層的重回帰分析では,ス. と part III-14 運動の全般的な自発性(0 ∼ 48 点)によ. テップ 1 で年齢,性別,罹病期間を交絡因子として強制. り評価した。軸症状は part III-1 会話,part III-9 椅子か. 投入し,ステップ 2 で LSA との相関係数が 0.3 以上で. らの立ち上がり,part III-10 歩行,part III-11 歩行のす. あった変数を強制投入した。運動症状を MDS-UPDRS. くみ,part III-12 姿勢の安定性,part III-13 姿勢により. part III 合計点数を使用した分析(モデル 1)と,固縮,. 4‒6). 評価した(0 ∼ 24 点). 。. 振戦,無動,軸症状のサブスコアに置き換えた分析(モ. 4)転倒予防自己効力感尺度. デル 2)の 2 つのモデルで検証した。ともに,各変数間. 日本人の生活様式に合わせて開発された Fall Preven-. で多重共線性の問題が生じていないか分散拡大要因(以. 25). 下,VIF)を算出し,回帰モデルの仮定を確認するため. FPSE は 10 項目からなり,4 段階で採点する。「まった. に回帰診断を行った。統計分析には SPSS statistics ver-. く自信がない」場合は 1 点,「大変自信がある」場合は. sion 22 を使用し,有意水準は 5%とした。. tion Self-Efficacy Scale(以下,FPSE)を使用した. 。. 4 点,最大で 40 点となり得点が高いほど自己効力感が 強いことを意味する。対象者が設問のイメージをしやす いようにイラスト版を使用した. 26). 。. 結 果 測定結果の基本統計量を表 2 に示す。過去 6 ヵ月の転 倒経験者は 17 名(37.8%) ,LSA の得点は 45.5(35.0 ‒. 5)移動能力 27). 59.5)点であった。自宅環境など背景因子による LSA. TUG は回転方向を左右 1 回ずつ実施し最速値を使用し. 得点の差はなかった(表 3) 。過去 6 ヵ月の転倒経験の. た。10 m 歩行テストでは 1 回目を練習とし,2 回目の. 有無による FPSE は,転倒あり群で 24.5 点,転倒なし. TUG と 10 m 歩行テストを最大努力で実施した. 。.
(4) 354. 理学療法学 第 46 巻第 5 号. 表 3 対象者の背景因子による LSA の比較 背景因子 過去 6 ヵ月の転倒経験. 自宅環境. 同居家族の有無. 近隣道路の舗装状況. 公共交通機関. n. LSA-score(点). 転倒あり. 17. 35.0 (34.0 ‒ 55.0). 転倒なし. 28. 50.0 (24.0 ‒ 73.5). 一軒家. 28. 45.7 (35.0 ‒ 71.0). マンション・アパート. 17. 44.0 (34.0 ‒ 55.8). あり. 39. 43.5 (34.0 ‒ 57.0). なし. 6. 54.3 (45.8 ‒ 74.0). 舗装あり. 41. 43.5 (34.5 ‒ 59.5). 舗装なし. 4. 54.3 (48.8 ‒ 67.6). あり. 44. 44.8 (35.0 ‒ 56.8). なし. 1. 62.0. p値 0.089. 0.419. 0.171. 0.299. 中央値(四分位範囲) LSA-score:Life-Space Assessment-score. 表 4 生活空間範囲ごとの行動頻度 生活空間. 毎日. 週 4-6 回. 週 1-3 回. 週 1 回未満. 自宅内. 45 (100%). 0. 0. 0. 自宅周辺. 26 (57.8%). 14 (31.1%). 5 (11.1%). 0. 自宅近隣. 14 (31.1%). 17 (37.8%). 14 (31.1%). 0. 町内. 5 (11.1%). 17 (37.8%). 20 (44.4%). 3 (6.7%). 町外. 0. 1 (2.2%). 3 (6.7%). 10 (22.2%). 値:人数(割合) 町外までの行動がなかった者は 31 名(68.9%) .. 表 5 生活空間範囲ごとの行動自立度 生活空間. 人的・物的支援なし. 物的支援あり. 人的支援あり. 自宅内. 32 (71.1%). 12 (26.7%). 1 (2.2%). 自宅周辺. 22 (48.9%). 14 (31.1%). 9 (20%). 自宅近隣. 17 (37.8%). 11 (24.4%). 17 (37.8%). 町内. 11 (24.4%). 4 (8.9%). 30 (66.7%). 町外. 4 (8.9%). 0. 10 (22.2%). 値:人数(割合) 町外までの行動がなかった者は 31 名(68.9%) .. 群で 25.5 点であり有意差は見られなかった(p = 0.47) 。. で r = ‒ 0.613(p < 0.01)と中等度の負の相関を認めた. 生活空間範囲ごとの行動頻度では,自宅内は毎日行動. (表 6)。運動症状のサブスコアでは固縮で r = ‒ 0.307(p. している者が 100% であったが範囲が拡大するにつれ減少. < 0.05)と弱い負の相関を,無動で r = ‒ 0.476(p < 0.01) ,. し,自宅近隣では毎日行動する者は 31.1% であった。町. 軸症状で r = ‒ 0.776(p < 0.01)と中等度の負の相関を. 内では週 3 回以下の者が 51.1% となり,町外への行動を. 認めた(表 7)。. していない者は 68.9% であった。行動自立度では,物的. 階層的重回帰分析のモデル 1 において,ステップ 1 で. 支援の有無を問わず単独で移動していた者は生活空間範. は年齢が有意な変数であった。ステップ 2 では年齢に加. 囲の拡大につれて減少し,自宅近隣では 37.8%,町内では. え FPSE が有意な変数であった(表 8)。モデル 2 では. 66.7% で人的支援によって行動がなされていた(表 4,5) 。. ステップ 2 において FPSE と軸症状が有意な変数となっ. 2 変 量 の 相 関 は,LSA と FPSE で は r = 0.579(p <. た(表 9)。. 0.01)と中等度の正の相関を,年齢で r = ‒ 0.477(p <. それぞれ VIF は 1.00 ∼ 6.05 であり,多重共線性が生. 0.01),MDS-UPDRS Part III の合計得点で r = ‒ 0.603(p. じていないことが確認された。Durbin-Watson 比は 1.846. < 0.01) ,TUG で r = ‒ 0.711(p < 0.01) ,10 m 歩行時間. であり,残差の独立性に問題はなかった。残差の正規性.
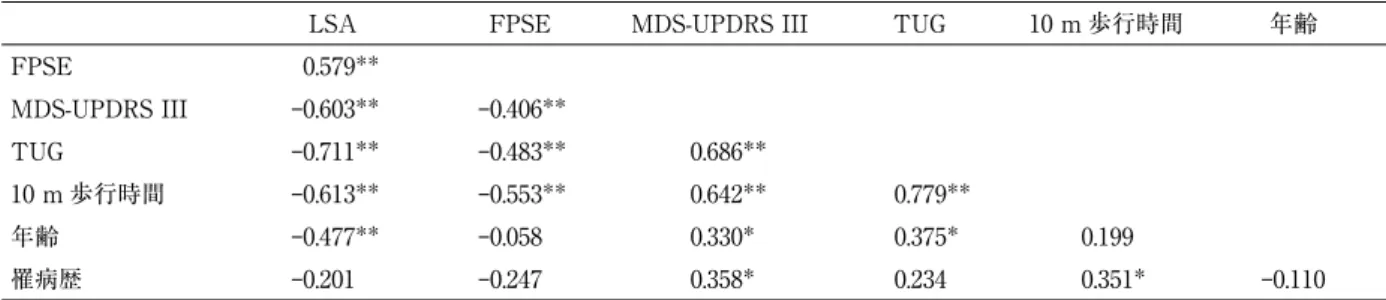
(5) 在宅パーキンソン病患者の生活空間関連因子. 355. 表 6 LSA と各評価項目との相関関係 LSA. FPSE. MDS-UPDRS III. TUG. 10 m 歩行時間. 年齢. 0.579**. FPSE MDS-UPDRS III. ‒0.603**. ‒0.406**. TUG. ‒0.711**. ‒0.483**. 0.686**. 10 m 歩行時間. ‒0.613**. ‒0.553**. 0.642**. 0.779**. 年齢. ‒0.477**. ‒0.058. 0.330*. 0.375*. 0.199. 罹病歴. ‒0.201. ‒0.247. 0.358*. 0.234. 0.351*. ‒0.110. *:p < 0.05 **:p < 0.01 年齢,FPSE,MDS-UPDRS III の相関係数は Pearson の相関係数,その他は Spearman の順位相関 係数 FPSE:Fall Prevention Self-Efficacy LSA:Life-Space Assessment MDS-UPDRS III:Movement Disorder Society-Unified Parkinson’s Disease Rating Scale part III TUG:Timed up & go test. 表 7 LSA と各運動症状との相関関係 LSA. 固縮. 振戦. 固縮. ‒0.307*. 振戦. 0.144. 0.033. 無動. ‒0.476**. 0.264. ‒0.081. 軸症状. ‒0.776**. 0.296*. ‒0.105. 無動. 0.506**. *:p < 0.05 **:p < 0.01 Spearman の順位相関係数 LSA;Life-Space Assessment. 表 8 LSA を従属変数とした階層的重回帰分析(モデル 1) ステップ 1 偏回帰係数. β. 年齢. ‒1.674. ‒0.486. 性別. ‒1.851. ‒0.051. 罹病期間. ‒1.031. ‒0.241. 独立変数. ステップ 2 VIF. 偏回帰係数. β. p<0.001. 1.004. ‒1.186. ‒0.344. 0.003. 1.269. 0.704. 1.008. ‒0.467. ‒0.13. 0.901. 1.082. 0.075. 1.007. ‒0.146. ‒0.034. 0.752. 1.220. 1.703. 0.467. p<0.001. 1.305. P. FPSE. P. VIF. MDS-UPDRS part III. ‒0.317. ‒0.187. 0.212. 2.274. TUG. ‒0.874. ‒0.187. 0.436. 5.944. 0.395. 0.064. 0.786. 5.732. 10 m 歩行時間. β :標準化偏回帰係数 VIF:Variance Inflation Factor LSA:Life-Space Assessment FPSE:Fall Prevention Self-Efficacy MDS-UPDRS part III:Movement Disorder Society-Unified Parkinson’s Disease Rating Scale part III TUG:Timed up & go test ステップ 1:自由度調整済み R2 = 0.240,ステップ 2:自由度調整済み R2 = 0.581. 表 9 LSA を従属変数とし,運動症状サブスコアを独立変数として用いた階層的重回帰分析(モデル 2) ステップ 1 独立変数 年齢. ステップ 2. 偏回帰係数. β. P. VIF. 偏回帰係数. β. P. VIF. 1.674. ‒0.486. p<0.001. 1.004. ‒0.695. ‒0.202. 0.101. 1.864. 性別. ‒1.851. ‒0.051. 0.704. 1.008. 1.745. 0.048. 0.645. 1.371. 罹病期間. ‒1.031. ‒0.241. 0.075. 1.007. 0.693. 0.162. 0.167. 1.716. 0.001. 1.383. FPSE. 1.430. 0.392. 固縮. ‒0.704. ‒0.132. 0.248. 1.649. 無動. 0.002. 0.001. 0.996. 1.711. 軸症状. ‒2.458. ‒0.540. 0.002. 3.449. TUG. ‒0.458. ‒0.098. 0.652. 6.052. 0.810. 0.131. 0.541. 5.848. 10 m 歩行時間. β :標準化偏回帰係数 VIF:Variance Inflation Factor LSA:Life-Space Assessment FPSE:Fall Prevention Self-Efficacy TUG:Timed up & go test ステップ 1:自由度調整済み R2 = 0.240 ステップ 2:自由度調整済み R2 = 0.662.
(6) 356. 理学療法学 第 46 巻第 5 号 25). と等分散性は残差プロットにより問題がないことを確認. されている. 。海外の先行研究では軽度 PD 患者にお. し,さらに Shapiro-Wilk 検定により残差の正規性が確認. いても転倒恐怖が存在し,転倒を予測する第一因子であ. された(p = 0.291) 。. ることが報告されている. 30)31). 。本研究においても過去. 6 ヵ月での転倒経験者は 37.8%であり,PD の FPSE 低. 考 察. 下には転倒経験が関与していると思われた。しかし両者. 本研究では自宅生活を継続されている 65 歳以上の. において統計学的な差は見られなかった。Bloem らは. PD 患者を対象に,日常の活動性を LSA にて評価し,. PD 患者と一般高齢者を対象とした転倒リスクの研究に. LSA の得点に関連する因子を検討した。階層的重回帰. おいて,ベースラインにおける両者の転倒回数,転倒者. 分析の結果,FPSE と軸症状が生活空間に関連している. の割合に差はなかったが,転倒恐怖を感じる者は PD 群. ことが明らかになった。. で多かったとしている. 32). 。PD 患者の転倒経験は FPSE. 低下につながる一要因と推察されるが,別の要因も関与 1.高齢在宅 PD 患者の生活空間について. していると思われる。坂本らは一般高齢者において転倒. 本研究における LSA 得点は 45.5 点であった。原田ら. 経験があっても転倒恐怖を生じていない者が一部存在. は特定高齢者と要支援者(平均年齢 79.4 歳)の LSA 得. し,身体機能認識の誤差が転倒リスクとなる可能性を指. 点を 51.4 点と報告している. 18). 。また国内において末期膝. OA 者(平均年齢 73.3 歳)の LSA 得点は 68.5 点. 17). ,慢. 性期脳卒中者(平均年齢 72.1 歳)の LSA 得点は 45.9 点 であったことが報告されている. 28). 。本研究の結果は,い. 摘している. 33). 。PD 患者では運動イメージの差が生じて. いる者もおり,歩行障害に影響していることが報告され ている. 34). 。本研究でも一部の対象者において,身体機. 能の自己認識に誤差が大きかった可能性があり,転倒経. ずれの先行研究よりも LSA 得点が低値か,ほぼ同様で. 験の有無により FPSE に差が生じなかったと考えらえる。. あった。本研究の対象者は平均年齢 74.8 歳と高齢であっ. 一般高齢者の転倒関連自己効力感が低い場合,18 ヵ月. たが,過去の報告と年齢に差はなかったと考えられる。. 後には ADL 能力が低下すること. 国内の先行研究では,生活空間に関連する予測因子と. 自己効力感が回復期リハ病棟退院後の生活空間に影響し. して歩行速度や TUG が特定され,特定高齢者と要支援. ていることが報告されている. 者の TUG は 13.1 秒であったこと. 18). ,末期膝 OA 者の 17). 35). ,ADL や外出関連. 36). 。ADL 遂行や外出への. 自信低下から活動範囲の狭小化,活動量減少を生じ,将. 。慢性. 来の ADL 能力低下につながっている。本研究において. 期脳卒中者では歩行速度の関連が指摘され 0.72 m/ 秒で. も LSA 得点が低い者では将来 ADL の低下を早める可能. TUG は 11.8 秒であったことが報告されている あったとしている. 28). 。本研究における TUG は 10.1 秒,. 性が示唆される。不活動を防ぎ生活空間を保つためにも, 17)19)35)36). 10 m 歩行時間が 7.9 秒,速度は 1.27 m/ 秒であり,先行. 自己効力感を高める必要性が指摘されている. 研究と比較しても高い値であった。van Nimwegen ら. が,PD 患者では自らの身体機能よりも過大な自信を有. は PD 患者では一般高齢者と比較し約 70%の活動量で. している者の存在が指摘されており. あったと報告している. 9). 。本研究はこれを支持するとと. 34)37). ,FPSE を高. めるだけでなく,FPSE 低下の背景や身体機能との差を. もに地域で暮らす高齢 PD 患者では,年齢や移動能力が. 考慮した対応が必要となろう。. 同等であったとしても,他の疾患を有する高齢者と比べ. 今回,生活空間の拡大に合わせて,行動頻度,自立度. て活動性が低い可能性が示唆された。. が減少していた。自宅近隣を毎日行動した者は 31.1%, 人的支援なく行動した者は 62.2%であった。LSA 得点. 2.PD 患者の生活空間と転倒予防自己効力感. が低値であったのは,自宅近隣よりも広いエリアでの行. PD 患者の生活空間へ関連する因子として,FPSE が. 動頻度,自立度の変化によるものと考える。征矢野らは. 有意な変数であった。生活空間を狭小化しないために. 一般高齢者では屋外歩行に関連する場面で FPSE が低い. は,行動への自信が必要となる. 17)29). 。FPSE が高いこ. ほど外出を自粛する者が多いことを指摘している. 25)26). 。. とは行動への自信となり,様々な機会への参加を後押し. 南條らは通所リハ利用者を 1 年間追跡し LSA 得点の低. する源となる。逆に FPSE の減少は参加への自信を低. 下には行動頻度の減少が起因していると述べている. 下させ,生活空間を狭小化すると考えられる。海外の先. 本研究においても FPSE の低下により,自宅近隣より. 行研究では,PD 患者の生活空間に歩行困難の自覚度や. も広い範囲における行動に自制が生じた可能性があり,. うつ症状といった精神心理面の影響が指摘されてお. 今回の LSA 得点に影響した一要因と考えられる。しか. り. 19). ,本研究も類似する結果となった。. 38). 。. しながら,屋外活動においては他者の支援を要すること. 国内における一般高齢者を対象とした FPSE の横断. で機会を確保できている者も多かった。PD 患者におい. 研究では,過去 1 年間の転倒経験者は 25.8%であり,転. て介護者の存在は重要であるが,行動頻度が増せば介護. 倒未経験者に対し FPSE が有意に低値であったと報告. 者の負担も増大していく可能性がある。様々なサービス.
(7) 在宅パーキンソン病患者の生活空間関連因子. の利用を含めた外出支援の提示が必要と考える。. 357. みや疲労は PD の主要な非運動症状 空間との関連も示唆されている. 3.PD 患者の生活空間と軸症状. の下位項目を含み. 1)39). であり,生活. 19). 。軸症状は姿勢異常. 4‒6). ,姿勢異常は痛み 45)や疲労 46)と. 先行研究において,PD の活動性に影響する因子とし. の関連が報告されている。本研究で軸症状が独立変数と. 9) て重症度が報告されている 。本研究では MDS-UPDRS. して選択された背景には,これら非運動症状との関連も. part III の合計点は階層的重回帰分析の結果選択されな. 考えられる。今後は PD 患者の運動症状だけでなく,非. かった。PD の運動症状は多岐にわたることが知られて. 運動症状が生活空間に影響する独立因子となるか検証. いる. 39). 。MDS-UPDRS part III の運動スコアも多彩な. し,患者ごとの個別性に対応した活動支援が求められる。. 運動症状を合わせて測定する評価指標であるが,合計点 のみでは主要な症状を判別できない。. 4.研究の意義と限界. 本研究では先行研究をもとに,MDS-UPDRS part III. 地域在住高齢 PD 患者は一般高齢者や他疾患を有した. の下位項目を固縮,振戦,無動,軸症状に分けて検討し. 高齢者よりも活動性が低い可能性が示唆され,PD 患者. た. 4‒6). 。その結果,軸症状が LSA 得点に関連する因子. の活動性には FPSE と軸症状の関連が明らかとなった。. であることが明らかになった。Levy らは PD の運動症. PD 患者に対して日々の外出状況を評価し,具体的な活. 状を軸症状とその他の運動症状に分類し,疾患と加齢の. 動や参加を促進する支援が必要と考える。そのために. 経過について検証している。その中で姿勢や歩行を含む. も,LSA による簡易な質問紙調査や FPSE の評価は重. 軸症状は,非ドパミン作動性の皮質下構造に対する疾患. 要と考える。また運動症状においても軸症状に着目し,. および加齢による影響が複合した結果であると報告して. 姿勢や歩行の自動制御機能を高めるかかわりが求められ. いる. 6). 。姿勢や歩行の自動制御は,非ドパミン作動性. ニューロンで構成される脚橋被蓋核(PPN)や中脳歩行. る。さらに活動的な生活支援には,運動能力に合った自 己効力感を保てる心理的支援が必要と思われる。. 40)41). 本研究の限界は,横断的研究であり活動に関連する要. 姿勢調整や歩行は,自動制御されることにより,その動. 因の因果関係まで検証できないことである。また対象者. 作を特に意識することなく遂行することができる。PD. が単一施設,単一地域の者であり,選択バイアスが加. 患者の軸症状増悪は非ドパミン作動性ニューロンの機能. わっている可能性に配慮しなければならない。また,今. 動作領域(MLR)の影響を受けるといわれている. 不全を反映している可能性があり. 。. 40)42‒44). ,本研究にお. 回はドパストン負荷試験によりオン状態をつくるなど,. いて軸症状が重度であった者では,姿勢調整や歩行に,. 明確な条件設定で測定が行えていないことを留意する必. より注意を要していたと思われる。. 要がある。さらに PD の非運動症状を含めた多様な要因. 4‒6). から,症状の重度化. を十分に加味できなかった。変数を増やすためにも十分. は移動能力への影響が大きいことが考えられる。本研究. なサンプルサイズが必要となる。今後は多様な地域を含. において TUG や 10 m 歩行時間で評価される移動能力. めた多施設での前向き調査を実施し,LSA による活動. は,それぞれ LSA 得点と中等度の相関が認められた。. 評価で明らかとなった生活空間の狭小化が,PD 患者の. PD 患者以外を対象とした国内の先行研究において,. 将来における運動症状や歩行障害に及ぼす影響について. 軸症状を構成する下位項目. TUG. 14)15)17)18). や歩行速度 16)28) が生活空間に関連す. る因子として報告されている。しかし,本研究では TUG や 10 m 歩行時間は生活空間に影響する独立因子ではな. 検討する必要がある。 結 論. かった。日常生活における歩行は単純な課題ではなく,. 本研究では地域で暮らす高齢 PD 患者の生活空間を評. 様々な外部刺激に対し同時に注意を払う必要がある。特. 価し関連する因子を検討した。生活空間には FPSE や. に屋外歩行においては,すれ違う人や道路状況の変化な. 運動症状の中でも軸症状が関連していることが示され. ど様々なことに注意を分配しなければならない。地域在. た。これまで PD 患者の生活空間を調査した報告はなく,. 住高齢者と比較し,PD 患者では二重課題での歩行パ. 本研究は PD 患者の生活空間の現状への理解と,生活空. フォーマンス低下が著明であったことが示されているこ. 間を維持・拡大するための一助となる。. とから. 43)44). ,本研究で実施した TUG や 10 m 歩行など. の単一課題では,PD 患者の生活空間への影響を十分に 反映できなかった可能性も考えられる。本研究では多重 課題下での移動能力を評価していないため,今後は軸症 状との関連も含め,さらなる検証が必要と思われる。 また PD 患者では多様な非運動症状が出現し,その一 部が生活空間に関連することが指摘されている. 19). 。痛. 利益相反 開示すべき利益相反はない。 文 献 1)Hatano T, Kubo SI, et al.: Unmet needs of patients with Parkinson’s disease: Interview survey of patients and.
(8) 358. 理学療法学 第 46 巻第 5 号. caregivers. J Int Med Res. 2009; 37: 717‒726. 2)Evans JR, Mason SL, et al.: The natural history of treated Parkinson’s disease in an incident, community based cohort. J Neurol Neurosurg Psychiatry. 2011; 82: 1112‒ 1118. 3)Speelman AD, van de Warrenburg BP, et al.: How might physical activity benefit patients with Parkinson disease? Nat Rev Neurol. 2011; 7: 528‒534. 4)Kotagal V, Albin RL, et al.: Modifiable cardiovascular risk factors and axial motor impairments in Parkinson disease. Neurology. 2014; 82: 1514‒1520. 5)Li X, Xing Y, et al.: Patterns of grey matter loss associated with motor subscores in early Parkinson’s disease. Neuroimage Clin. 2018; 17: 498‒504. 6)Levy G, Louis ED, et al.: Contribution of aging to the severity of different motor signs in Parkinson disease. Arch Neurol. 2005; 62: 467‒472. 7)Keus SH, Bloem BR, et al.: Evidence-based analysis of physical therapy in Parkinson’s disease with recommendations for practice and research. Mov Disord. 2007; 22: 451‒460. 8)中江秀幸,對馬 均:在宅パーキンソン病患者の介護保険 サービス利用状況と運動療法実施状況に関するアンケート 調査.ヘルスプロモーション理療研.2014; 4: 113‒119. 9)van Nimwegen M, Speelman AD, et al.: Physical inactivity in Parkinson’s disease. J Neurol. 2011; 258: 2214‒2221. 10)Benka Wallén M, Franzén E, et al.: Levels and patterns of physical activity and sedentary behavior in elderly people with mild to moderate Parkinson disease. Phys Ther. 2015; 95: 1135‒1141. 11)Cavanaugh JT, Ellis TD, et al.: Capturing ambulatory activity decline in Parkinson’s disease. J Neurol Phys Ther. 2012; 36: 51‒57. 12)Yamawaki M, Kusumi M, et al.: Changes in prevalence and incidence of Parkinson’s disease in Japan during a quarter of a century. Neuroepidemiology. 2009; 32: 263‒ 269. 13)厚生労働省ホームページ 地域包括ケアシステムの 5 つ の構成要素と「自助・互助・共助・公助」 .http://www. mhlw.go.jp/seisakunitsuite/bunya/hukushi_kaigo/kaigo_ koureisha/chiiki-houkatsu/dl/link1-3.pdf(2017 年 6 月 20 日引用) 14)Shimada H, Sawyer P, et al.: Predictive validity of the classification schema for functional mobility test in instrumental activities of daily living decline among older adults. Arch Phys Med Rehabil. 2010; 91: 241‒246. 15)川村皓生,加藤智香子,他:通所リハビリテーション利用 者の生活活動度の関連因子について.日老医誌.2018; 55: 65‒73. 16)及川真人,久保 晃:都市部在住脳卒中片麻痺者の生活空 間を判別する要因.理療科.2016; 31: 771‒774. 17)飛山義憲,川添大樹,他:末期変形性膝関節症患者におけ る生活空間に影響を及ぼす因子の検討.理学療法学.2014; 41: 138‒146. 18)原田和宏,島田裕之,他:介護予防事業に参加した地域高 齢者における生活空間(life-space)と点数化評価の妥当性 の検討.日本公衛雑誌.2010; 57: 526‒537. 19)Rantakokko M, Iwarsson S, et al.: Life-space mobility in Parkinson’s disease: associations with motor and nonmotor symptoms. J Gerontol A Biol Sci Med Sci. 2019; 74: 507‒512. 20)Baker PS, Bodner EV, et al.: Measuring life-space mobility in community-dwelling older adults. J Am Geriatr Soc. 2003; 51: 1610‒1614. 21)International Parkinson and Movement Disorder Society. [Internet]. MDS-UPDRS Translation Information; Japanese [updated 2017 July 6]. Available from: https://www. movementdisorders.org/MDS-Files1/Education/RatingScales/MDS-UPDRS_Japanese_Official_Translation_ FINAL.pdf 22)Steffen T, Seney M: Test-retest reliability and minimal detectable change on balance and ambulation tests, the 36item short-form health survey, and the unified Parkinson disease rating scale in people with parkinsonism. Phys Ther. 2008; 88: 733‒746. 23)Goetz CG, Stebbins GT, et al.: Teaching program for the Movement Disorder Society-sponsored revision of the Unified Parkinson’s Disease Rating Scale: (MDS-UPDRS). Mov Disord. 2010; 25: 1190‒1194. 24)Goetz CG, Tilley BC, et al.: Movement Disorder Societysponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Mov Disord. 2008; 23: 2129‒2170. 25)征矢野あや子,村嶋幸代,他:転倒予防自己効力感尺度の 信頼性・妥当性の検討.身教医誌.2005; 6: 21‒30. 26)征矢野あや子,岡田真平:健脚度測定に参加した地域高齢 者の転倒予防自己効力感と移動能力,転倒との関連─イラ スト版転倒予防自己効力感尺度を利用して─.身教医誌. 2009; 10: 31‒41. 27)島田裕之,古名丈人,他:高齢者を対象とした地域保健活 動における Timed Up & Go Test の有用性.理学療法学. 2006; 33: 105‒111. 28)田代英之,井所拓哉,他:慢性期脳卒中者の地域における 移動能力と歩行機能および身体活動の関係.理学療法学. 2014; 41: 131‒137. 29)森川真也,玉利光太郎,他:生活空間の短期的変化と予測 因子の抽出─通院・通所リハビリテーションを利用する低 活動高齢者を対象とした小規模多施設研究─.理学療法 学.2015; 42: 494‒502. 30)Lindholm B, Hagell P, et al.: Prediction of falls and / or near falls in people with mild Parkinson’s disease. PLoS One. 2015; 10: e0117018. 31)Almeida LR, Valenca GT, et al.: Comparsion of self-report and performance-based balance measures for predicting recurrent falls in people with Parkinson disease: cohort study. Phys Ther. 2016; 96: 1074‒1084. 32)Bloem BR, Grimbergen YA, et al.: Prospective assessment of falls in Parkinson’s disease. J Neurol. 2001; 248: 950‒958. 33)坂本由美,大橋ゆかり:地域在住高齢者の転倒に影響を及 ぼす要因の検討─転倒恐怖感,転倒歴,身体機能,身体機 能認識誤差に着目して─.理療科.2013; 28: 771‒778. 34)Cohen RG, Chao A, et al.: Freezing of gait is associated with a mismatch between motor imagery and motor execution in narrow doorways, not with failure to judge doorway passability. Neuropsychologia. 2011; 49: 3981‒3988. 35)Mendes de Leon CF, Seeman TE, et al.: Self-efficacy, physical decline, and change in functioning in communityliving elders: a prospective study. J Gerontol B Psychol Sci Soc Sci. 1996; 51: S183‒S190. 36)塩澤和人,廣瀬圭子,他:退院後生活空間の広がりに影 響を及ぼす要因─退院直前の歩行能力,ADL,環境整備, 自己効力感の観点から─.理療臨研教.2014; 21: 21‒26. 37)Kawasaki T, Mikami K, et al.: Motor planning error in Parkinson’s disease and its clinical correlates. PLoS One. 2018; 13: e0202228. 38)南條恵悟,長澤 弘,他:通所リハビリテーションにおけ る運動機能に対する介入効果に 1 年間の生活空間の変化が 及ぼす影響.理学療法学.2017; 44: 357‒363. 39) Jankovic J: Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008; 79: 368‒376..
(9) 在宅パーキンソン病患者の生活空間関連因子 40)Karachi C, Grabli D, et al.: Cholinergic mesencephalic neurons are involved in gait and postural disorders in Parkinson disease. J Clin Invest. 2010; 120: 2745‒2754. 41)Takakusaki K, Saitoh K, et al.: Role of basal gangliabrainstem pathways in the control of motor behaviors. Neurosci Res. 2004; 50: 137‒151. 42)Bejjani BP, Gervais D, et al.: Axial parkinsonian symptoms can be improved: the role of levodopa and bilateral subthalamic stimulation. J Neurol Neurosurg Psychiatry. 2000; 68: 595‒600. 43)Kelly VE, Eusterbrock AJ, et al.: A review of dual-task walking deficits in people with Parkinson’s disease: motor and cognitive contributions, mechanisms, and clinical. 359. implications. Parkinsons Dis. 2012. Epub 2011/10/27. doi: 10.1155/2012/918719. PubMed PMID: 22135764; PubMed Central PMCID: PMC3205740. 44)Wild LB, de Lima DB, et al.: Characterization of cognitive and motor performance during dual-tasking in healthy older adults and patients with Parkinson’s disease. J Neurol. 2013; 260: 580‒589. 45)Khlebtovsky A, Djaldetti R, et al.: Progression of postural changes in Parkinson’s disease: quantitative assessment. J Neurol. 2017; 264: 675‒683. 46)Solla P, Cannas A, et al.: Association between fatigue and other motor and non-motor symptoms in Parkinson’s disease patients. J Neurol. 2014; 261: 382‒391.. 〈Abstract〉. Factors Related to Life Space in Community Dwelling Elderly Patients with Parkinson’s Disease. Tomohito TADAISHI, PT, MSc Department of Rehabilitation, Sapporo Nishimaruyama Hospital Hideki SUZUKI, PT, PhD Department of Physical Therapy, School of Rehabilitation Sciences, Health Sciences University of Hokkaido. Purpose: The present study aimed to clarify the factors influencing the life space of community dwelling elderly patients with Parkinson’s disease (PD). Methods: The study included 45 community dwelling elderly patients with mild-to-moderate idiopathic PD. The following assessments were performed: life-space assessment (LSA), Movement Disorder Society-Unified Parkinson’s Disease Rating Scale (MDS-UPDRS) motor scores, fall prevention self-efficacy (FPSE) score, 10-m walking time, and Timed Up & Go test. MDS-UPDRS motor scores involve subscores for rigidity (MDS-UPDRS part III item 3), tremor (items 15 ‒ 18), bradykinesia (items 2, 4 ‒ 8, and 14), and axial symptoms (items 1 and 9 ‒ 13). Spearman rank correlations were calculated between LSA and the other variables described above. After adjusting for age, sex, and disease duration, hierarchical multiple regression analysis was performed to clarify the independent relationship of LSA with the other variables. Results: FPSE score (β = 0.39, p < 0.01) and axial symptoms (β = ‒ 0.54, p < 0.01) were significantly 2 associated with LSA (adjusted R = 0.66).. Conclusions: The results of this study suggest that FPSE and axial symptoms influence LSA in community dwelling elderly patients with mild-to-moderate idiopathic PD. Therefore, physical therapy for axial symptoms is necessary to support physical activity in patients with PD. Additionally, psychological support can maintain self-efficacy that corresponds to motor capacity. Key Words: Parkinson’s disease, Community dwelling, Life space, Motor symptoms, Self-efficacy.
(10)
図
関連したドキュメント
神経内科の臨床医として10年以上あちこちの病院を まわり,次もどこか関連病院に赴任することになるだろ
成績 在宅高齢者の生活満足度の特徴を検討した結果,身体的健康に関する満足度において顕著
医学部附属病院は1月10日,医療事故防止に 関する研修会の一環として,東京電力株式会社
*課題関連的訓練(task-related training)は,目的志向的訓練(task-oriented
藤田 烈 1) ,坂木晴世 2) ,高野八百子 3) ,渡邉都喜子 4) ,黒須一見 5) ,清水潤三 6) , 佐和章弘 7) ,中村ゆかり 8) ,窪田志穂 9) ,佐々木顕子 10)
4/1 ~ ICU 30.1 万円、 HCU 21.1 万円、 その他 5.2 万円. ※ 療養病床である休止病床は
全国の緩和ケア病棟は200施設4000床に届こうとしており, がん診療連携拠点病院をはじめ多くの病院での
在宅医療 注射 画像診断 その他の行為 検査