BET 法による表面積測定について
1.理論編 ここでは吸着等温線を利用した表面積の測定法、特にBrunauer,Emmett、Teller による BET 吸着 理論について述べる。この方法での表面積測定は「気体を物質表面に吸着させた場合、表面を 1 層覆い 尽くすのにどれほどの物質量が必要か」を調べるものである。吸着させる気体分子が 1 個あたりに占め る表面積をあらかじめ知っていれば、これによって固体の表面積を求めることができる。この吸着過程 を等温状態で行い、吸着量と平衡状態での気体の圧力の関係を示すものが吸着等温線である。 BET 吸着理論 これはLangmuir が提唱した単分子吸着理論を Brunauer,Emmett、Teller らが拡張し、多分子層吸 着理論に拡張したものである[1]。この理論は表面に分子が吸着できるサイトが存在し、それらのサイト に分子が多層に吸着するモデルを考えている。このモデルにおいて、0,1,2…i 層まで分子を吸着している サイトの数をそれぞれ S0,S1,S2…Siとする。S0=1 とは分子をまったく吸着していないサイトが1つ、 S5=3 は5層目まで吸着しているサイトが3つあることなどを示している。ここで、吸着平衡状態での (i-1)層と i 層目の間の分子の移動について考える。吸着平衡状態では(i-1)層に入ってくる分子の吸着速度 とi 層の分子の脱着速度は等しい。 まず、吸着速度について考える。吸着は分子が壁にぶつかったときに起こると考えるとその速度は単 位時間あたりにぶつかる分子数に比例する。また吸着しようとしている層のサイト数にも比例すると考 えられる。分子運動論によれば単位時間あたりに壁にぶつかる分子数nは圧力pと温度Tにより 𝑛 ∝ 𝑃 √𝑇 となるので、温度が一定のときは圧力に比例することがわかる。 一方で脱着速度についてはi 層目の吸着エネルギー𝑄𝑖により 𝑒𝑥𝑝 (−𝑅𝑇𝑄𝑖) に比例する。よって、これら二つの速度が等しくなるとき、適用な定数を用いて 𝑎𝑖𝑝𝑆𝑖−1= 𝑏𝑖𝑆𝑖𝑒𝑥𝑝 (−𝑅𝑇𝑄𝑖) が成立する。 さて、全吸着量はiS
iをすべて足し合わせたものであるので 𝑁 = ∑ 𝑖𝑆𝑖 𝑖 (1.1) (1.2) (1.3) (1.4)また単分子層吸着量は
S
iをすべて加えればよく 𝑁𝑚= ∑ 𝑆𝑖 𝑖 となる。ここで計算を簡単にするために次のような仮定をする。 2 層目以上に吸着した分子の吸着エネルギーは潜熱に等しい。したがって 𝑄𝑖 = 𝑄𝐿 (𝑖 ≥ 2) また、2 層目以上では吸着に与える表面固体の影響は小さく、主として吸着分子間の相互作用によって吸 着するとして、定数の比は変わらず 𝑎𝑖 𝑏𝑖= 𝑔 = 𝑐𝑜𝑛𝑠𝑡 (𝑖 ≥ 2) とする。さらに。計算の都合上以下のようにおく (𝑝𝑔) 𝑒𝑥𝑝 (𝑅𝑇𝑄𝐿) = 𝑥 (𝑎𝑏1𝑔 1 ) 𝑒𝑥𝑝 ( 𝑄1− 𝑄𝐿 𝑅𝑇 ) = C このようにすれば、まず(1.4)式から 𝑁 = ∑ 𝑖𝑆𝑖 𝑖 = 𝑆0∙ 𝐶𝑝 𝑔 𝑒𝑥𝑝 ( 𝑄𝐿 𝑅𝑇) ∙ (1 + 2𝑥 + 3𝑥2+ ⋯ ) = 𝑆0∙ 𝐶𝑝 𝑔 𝑒𝑥𝑝 ( 𝑄𝐿 𝑅𝑇) ∙ 1 (1 − 𝑥)2 一方、(1.5)式から 𝑁𝑚= ∑ 𝑆𝑖 𝑖 = 𝑆0+ 𝑆0∙ 𝐶𝑝 𝑔 ∙ 𝑒𝑥𝑝 ( 𝑄𝐿 𝑅𝑇) ∙ (1 + 𝑥 + 𝑥2+ ⋯ ) = 𝑆0∙ [1 +𝐶𝑝𝑔 ∙𝑒𝑥𝑝(𝑄𝐿 𝑅𝑇 ⁄ ) 1 − 𝑥 ] が得られ、これらから (1.5) (1.6) (1.7) (1.8) (1.9) (1.10)𝑁 𝑁𝑚= 𝐶𝑥 (1 − 𝑥)(1 − 𝑥 + 𝐶𝑥) となる。このモデルでは吸着層数が無限大まで可能であると仮定されている。すなわち飽和蒸気圧での 吸着層数が無限大になる。したがって飽和蒸気圧
p
0においてx
1
となる。(1.8)式を見れば 𝑥 =𝑝𝑝 0 であることがわかる。実用上は(1.11)式を 𝑃 𝑁(𝑝0− 𝑝)= 1 𝐶𝑁𝑚+ 𝐶 − 1 𝐶𝑁𝑚 ∙ 𝑝 𝑝0 として相対圧に対してグラフをつくり直線の傾きと切片から定数C,
N
mを求める。ただし、直線になる のは0
.
05
p
p
0
0
.
35
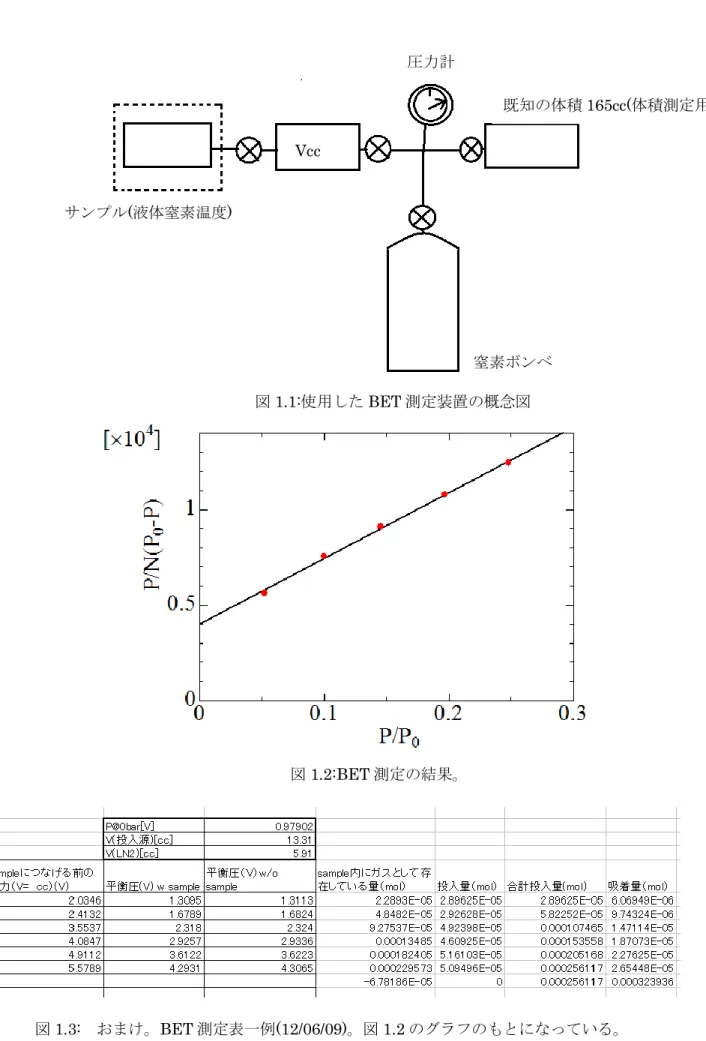
程度の範囲なので、実際はこの範囲で測定を行う。測定によって得られたグラ フから傾きと切片を求め、これにより表面を1 層覆うのに必要な物質量𝑁𝑚を求めることができる。分子 一個が占める表面積をa とすればアボガドロ数𝑁𝐴を用いて測定したい表面積は S = a × 𝑁𝑚× 𝑁𝐴 と推定される。 【参考文献】 [1]近藤精一 石川達雄 安部郁雄 「吸着の科学」 丸善出版 (1.11) (1.12) (1.13) (1.14)2.実践編 サンプルセルの表面積手順 測定は窒素ガスを用い、液体窒素温度で行うことを前提に記す。測定に用いた装置の概念図を図 1.1 に示す。実際の測定の手順は以下の通りである。 【準備】 まず、室温部分で必要と思われる領域(たとえば送り込む窒素ガスをためておく部分)の体積を測定 しておく。これはBET 系にあらかじめ取り付けた既知の体積を利用する。このとき圧力計や配管部分の 体積が無視できないこともあるので注意する。また、バルブ部分の影響も無視できない。体積を測定す るときはバルブの開閉状態も気にしたほうが無難。 室温でサンプルの体積を測っても素材が冷却されることで収縮しサンプルの体積が変化する可能性が あるため低温部分の体積は窒素温度に冷却してからヘリウムガスを用いて測るほうがいいと思われる(手 順③)。 【表面積の測定】 注意! 液体窒素温度で測定を行っているときはなるべく液面が安定するように努めること。液面が激しく変動 しているような状態では低温部分の実効的な体積が変化して正しく推定ができない。例えば、蒸発が激 しく液面がどんどん下がっていく状態は避け、途中で液体窒素をつぎ足すなどはしないほうがよい。 ① 測定するサンプルセルをポンプで十分真空に引く。 ② 液体窒素に浸し、冷却する。 注意! プラスチックと金属など熱膨張率の異なるものを接着してサンプルセルを作っているような場合に は急冷することで破損する可能性がある。したがって30 分から 1 時間程度かけてゆっくりと窒素温 度まで冷却すること。 ③ 液体窒素温度まで冷却されたところでヘリウムガスを使い液体窒素温度になっている空間の実効的 な体積(図 1.1 の点線部分)を測定する。 ④ ③で測定した実効的に液体窒素温度になっている領域の手前(図 1.1 の V ㏄と表記されている部分)に 適量の窒素ガスをためる。このときの平衡圧力と領域の体積から準備した窒素ガスの物質量を求める。 送り込む窒素ガスはあらかじめ大タンクに確保しておくと便利。測定はせいぜい0.5 気圧程度までし か行わないのでタンクにこの程度のガスを確保しておく。 注意! 1. この V ㏄には圧力計および配管の体積も含めている。 2. 適量の窒素ガス:グラフに何点ほどデータを取りたいかによる。表面積の見当がついているとき
はその表面積と取りたいデータ点の数から一回に送り込むガスの量を推定することは出来る。測 定は初めに準備するガス量を少しずつ増やし(圧力を0.5 気圧に近づけ)ながら繰り返していく ことになる。 ⑤ 窒素ガスを低温部に送り込み圧力平衡になるまで待つ。 注意! 表面が十分窒素固体で覆い尽くされるまではほとんど平衡圧力は見られない。吸着が多層になってく ると徐々に圧力が見え始めるようになるのがふつうである。 ⑥ 圧力平衡になったところで圧力pを測定する。そしてゆっくり(圧力平衡が保たれるように)バルブを 閉じて低温部分と室温部分を切り離す。そして改めて圧力を測る[1]。まず、室温部分の体積と圧力 から室温部分にガスとして残っている物質量を求める。これと④で求めているガス量の差が低温部分 に送り込んだ窒素ガスの量(A)になる。 次に、低温部分の体積と圧力から低温部分にガスとして残っている物質量(B)を求める。 (A)‐(B)が吸着された窒素ガスの物質量Nとなる。 注意! [1]わざわざこのようにするのはバルブの開閉時の体積変化を気にしたからである。室温部分の体積 を測定した時は低温部分を切り分けるバルブを閉じていたので、実際にここで室温部分に残っている ガス量の推定にはバルブを閉じたほうがいいと思った。バルブの開閉では圧力が1%くらい変わって いた。 ⑦ 以降、規定の平衡圧の領域で④から⑥を繰り返し(1.13)式 𝑃 𝑁(𝑝0− 𝑝)= 1 𝐶𝑁𝑚+ 𝐶 − 1 𝐶𝑁𝑚 ∙ 𝑝 𝑝0 に基づいたグラフを作成する(図 1.2)。今の場合は𝑝0= 1気圧(窒素温度で窒素ガスなので)。 ⑧ グラフが完成したら切片と傾きを読み取りそれらの連立方程式 { 1 𝐶𝑁𝑚= ∗∗ 𝐶 − 1 𝐶𝑁𝑚 = ∗∗ から表面一層分に吸着された窒素ガスの物質量𝑁𝑚を求める。これと窒素分子 1 個が占めるとされる 典型値a = 16.2Å2およびアボガドロ数𝑁 𝐴によりS = a × 𝑁𝑚× 𝑁𝐴としてサンプルセルの表面積を推定 する。
図1.2:BET 測定の結果。 サンプル(液体窒素温度) 窒素ボンベ 既知の体積165cc(体積測定用) 圧力計 図1.1:使用した BET 測定装置の概念図 Vcc 図1.3: おまけ。BET 測定表一例(12/06/09)。図 1.2 のグラフのもとになっている。