製造販売承認申請書添付資料
第2部(モジュール2) CTDの概要(サマリー)
2.6. 非臨床試験の概要文および概要表
2.6.4. 薬物動態試験の概要文
2.6.5. 薬物動態試験概要表
グラクソ・スミスクライン株式会社
非臨床概要 薬物動態試験の目次
項目 - 頁
2.6.4. 薬物動態試験の概要文 ... 2.6.4 - p. 1 2.6.4.1. まとめ ... 2.6.4 - p. 1 2.6.4.2. 分析方法... 2.6.4 - p. 4 2.6.4.2.1. 被験物質 ... 2.6.4 - p. 4 2.6.4.2.2. 分析法 ... 2.6.4 - p. 4 2.6.4.3. 吸収 ... 2.6.4 - p. 5 2.6.4.3.1. ラット ... 2.6.4 - p. 5 2.6.4.3.1.1. 経口投与 ... 2.6.4 - p. 5 2.6.4.3.1.1.1. 単回投与 ... 2.6.4 - p. 5 2.6.4.3.1.1.2. 反復投与 ... 2.6.4 - p. 6 2.6.4.3.1.1.2.1. 23日間投与... 2.6.4 - p. 6 2.6.4.3.1.1.2.2. 13週間投与... 2.6.4 - p. 7 2.6.4.3.1.1.2.3. 13週間投与(セチリジンとの比較)... 2.6.4 - p. 7 2.6.4.3.2. イヌ... 2.6.4 - p. 8 2.6.4.3.2.1. 経口投与 ... 2.6.4 - p. 8 2.6.4.3.2.1.1. 単回投与 ... 2.6.4 - p. 8 2.6.4.3.2.1.2. 反復投与 ... 2.6.4 - p. 9 2.6.4.3.2.1.2.1. 8日間投与... 2.6.4 - p. 9 2.6.4.3.2.1.2.2. 13週間投与... 2.6.4 - p. 10 2.6.4.3.2.2. 静脈内投与... 2.6.4 - p. 11 2.6.4.4. 分布 ... 2.6.4 - p. 12 2.6.4.4.1. 組織内分布... 2.6.4 - p. 12 2.6.4.4.1.1. 組織内放射能... 2.6.4 - p. 12 2.6.4.4.1.1.1. ラット... 2.6.4 - p. 12 2.6.4.4.1.1.2. イヌ ... 2.6.4 - p. 13 2.6.4.4.1.2. 全身オートラジオグラフィー ... 2.6.4 - p. 16 2.6.4.4.2. 蛋白結合および血球中への移行 ... 2.6.4 - p. 16 2.6.4.4.2.1. 蛋白結合 ... 2.6.4 - p. 16 2.6.4.4.2.1.1. In vitro... 2.6.4 - p. 16 2.6.4.4.2.1.2. Ex vivo... 2.6.4 - p. 17 2.6.4.4.2.2. 結合蛋白の検討 ... 2.6.4 - p. 17 2.6.4.4.2.3. 結合部位の検討 ... 2.6.4 - p. 17 2.6.4.4.2.4. 血球中への移行 ... 2.6.4 - p. 18 2.6.4.4.3. 胎盤通過および胎児への移行... 2.6.4 - p. 18 2.6.4.4.4. その他の分布試験... 2.6.4 - p. 18 2.6.4.4.4.1. 有機イオントランスポーターによる輸送 ... 2.6.4 - p. 18 2.6.4.4.4.2. 膜透過およびPgpによる輸送 ... 2.6.4 - p. 19 2.6.4.4.4.3. ヒトPgp阻害作用 ... 2.6.4 - p. 192.6.4.5. 代謝 ... 2.6.4 - p. 19 2.6.4.5.1. In vitro試験... 2.6.4 - p. 19 2.6.4.5.1.1. 肝ミクロソームによる代謝 ... 2.6.4 - p. 19 2.6.4.5.1.2. 肝細胞による代謝... 2.6.4 - p. 21 2.6.4.5.2. In vivo試験 ... 2.6.4 - p. 22 2.6.4.5.2.1. ラット... 2.6.4 - p. 22 2.6.4.5.2.1.1. 尿糞中代謝物... 2.6.4 - p. 22 2.6.4.5.2.2. イヌ ... 2.6.4 - p. 23 2.6.4.5.2.2.1. 血漿、尿糞および胆汁中代謝物 ... 2.6.4 - p. 23 2.6.4.5.3. 代謝酵素の同定 ... 2.6.4 - p. 24 2.6.4.5.4. 推定代謝経路 ... 2.6.4 - p. 26 2.6.4.5.5. 肝代謝酵素に及ぼす影響... 2.6.4 - p. 26 2.6.4.5.5.1. 酵素誘導 ... 2.6.4 - p. 26 2.6.4.5.5.1.1. In vitro... 2.6.4 - p. 26 2.6.4.5.5.1.2. In vivo ... 2.6.4 - p. 27 2.6.4.5.5.1.2.1. ラット ... 2.6.4 - p. 27 2.6.4.5.5.1.2.2. イヌ ... 2.6.4 - p. 27 2.6.4.5.5.2. 酵素阻害 ... 2.6.4 - p. 28 2.6.4.6. 排泄 ... 2.6.4 - p. 28 2.6.4.6.1. 尿糞中排泄... 2.6.4 - p. 28 2.6.4.6.1.1. ラット... 2.6.4 - p. 28 2.6.4.6.1.1.1. 単回投与 ... 2.6.4 - p. 28 2.6.4.6.1.1.2. 反復投与(セチリジンとの比較)... 2.6.4 - p. 29 2.6.4.6.1.2. イヌ ... 2.6.4 - p. 30 2.6.4.6.1.2.1. 単回投与 ... 2.6.4 - p. 30 2.6.4.6.1.2.2. 反復投与 ... 2.6.4 - p. 31 2.6.4.6.2. 胆汁中排泄... 2.6.4 - p. 33 2.6.4.6.2.1. ラット... 2.6.4 - p. 33 2.6.4.6.2.2. イヌ ... 2.6.4 - p. 33 2.6.4.6.2.2.1. 単回投与 ... 2.6.4 - p. 33 2.6.4.6.2.2.2. 反復投与 ... 2.6.4 - p. 33 2.6.4.7. 薬物動態学的薬物相互作用 ... 2.6.4 - p. 34 2.6.4.8. その他の薬物動態試験... 2.6.4 - p. 34 2.6.4.9. 考察及び結論 ... 2.6.4 - p. 34 2.6.4.10. 図表 ... 2.6.4 - p. 38 2.6.4.11. 引用文献... 2.6.4 - p. 39
2.6.5.1. 薬物動態試験:一覧表... 2.6.5 - p. 1 2.6.5.2. 分析方法及びバリデーション試験... 2.6.5 - p. 5 2.6.5.2.1. 2.6.5 - p. 5 2.6.5.2.2. 2.6.5 - p. 5 2.6.5.2.3. 血漿および尿中濃度測定法 ... 2.6.5 - p. 6 2.6.5.2.4. 血漿中濃度測定法... 2.6.5 - p. 7 2.6.5.3. 薬物動態試験:単回投与後の吸収... 2.6.5 - p. 8 2.6.5.4. 薬物動態試験:反復投与後の吸収... 2.6.5 - p. 10 2.6.5.5. 薬物動態試験:分布 ... 2.6.5 - p. 16 2.6.5.5.1. 組織内分布... 2.6.5 - p. 16 2.6.5.5.1.1. ラット... 2.6.5 - p. 16 2.6.5.5.1.2. イヌ ... 2.6.5 - p. 24 2.6.5.5.2. 全身オートラジオグラフィ ... 2.6.5 - p. 28 2.6.5.6. 薬物動態試験:蛋白結合 ... 2.6.5 - p. 29 2.6.5.6.1. 蛋白結合 ... 2.6.5 - p. 29 2.6.5.6.1.1. In vitro... 2.6.5 - p. 29 2.6.5.6.1.2. Ex vivo ... 2.6.5 - p. 31 2.6.5.6.1.3. 結合蛋白 ... 2.6.5 - p. 33 2.6.5.6.1.4. 結合部位の検討 ... 2.6.5 - p. 33 2.6.5.6.2. 血球中への移行 ... 2.6.5 - p. 34 2.6.5.7. 薬物動態試験:妊娠又は授乳動物における試験... 2.6.5 - p. 35 2.6.5.7.1. 妊娠ラットでの組織内分布 ... 2.6.5 - p. 35 2.6.5.8. 薬物動態試験:その他の分布試験... 2.6.5 - p. 36 2.6.5.8.1. 各種トランスポーターによる輸送 ... 2.6.5 - p. 36 2.6.5.8.2. 膜透過性 ... 2.6.5 - p. 37 2.6.5.8.3. P-糖蛋白質による輸送... 2.6.5 - p. 38 2.6.5.8.4. P-糖蛋白質に対する阻害作用... 2.6.5 - p. 39 2.6.5.9. 薬物動態試験:In vivoにおける代謝 ... 2.6.5 - p. 40 2.6.5.9.1. ラット尿糞中代謝物 ... 2.6.5 - p. 40 2.6.5.9.2. イヌ血漿および尿糞中代謝物... 2.6.5 - p. 41 2.6.5.9.3. イヌ胆汁中代謝物... 2.6.5 - p. 42 2.6.5.10. 薬物動態試験:In vitroにおける代謝... 2.6.5 - p. 43 2.6.5.10.1. 肝ミクロソームによる代謝 ... 2.6.5 - p. 43 2.6.5.10.2. 肝細胞による代謝... 2.6.5 - p. 46 血漿中ucb 28556およびgsk002*濃度測定法 ... 尿中ucb 28556およびgsk002*濃度測定法...
2.6.5.11. 薬物動態試験:推定代謝経路(尿糞中)... 2.6.5 - p. 47 2.6.5.12. 薬物動態試験:薬物代謝酵素の誘導/阻害 ... 2.6.5 - p. 48 2.6.5.12.1. 酵素誘導 ... 2.6.5 - p. 48 2.6.5.12.1.1. In vitro... 2.6.5 - p. 48 2.6.5.12.1.2. In vivo ... 2.6.5 - p. 49 2.6.5.12.1.2.1. ラット... 2.6.5 - p. 49 2.6.5.12.1.2.2. イヌ ... 2.6.5 - p. 52 2.6.5.12.2. 酵素阻害 ... 2.6.5 - p. 53 2.6.5.13. 薬物動態試験:累積排泄 ... 2.6.5 - p. 54 2.6.5.13.1. ラット ... 2.6.5 - p. 54 2.6.5.13.1.1. 単回投与 ... 2.6.5 - p. 54 2.6.5.13.1.2. 反復投与 ... 2.6.5 - p. 55 2.6.5.13.2. イヌ... 2.6.5 - p. 56 2.6.5.13.2.1. 単回投与 ... 2.6.5 - p. 56 2.6.5.13.2.2. 反復投与 ... 2.6.5 - p. 57 2.6.5.14. 薬物動態試験:胆汁中排泄 ... 2.6.5 - p. 60 2.6.5.14.1. 単回投与 ... 2.6.5 - p. 60 2.6.5.14.2. 反復投与 ... 2.6.5 - p. 61 2.6.5.15. 薬物動態試験:薬物相互作用... 2.6.5 - p. 61 2.6.5.16. 薬物動態試験:その他... 2.6.5 - p. 61
2.6.4 および 2.6.5 の略語等一覧 セチリジン セチリジン塩酸塩 レボセチリジン レボセチリジン塩酸塩 Ae 尿中排泄率 α1-AGP α1-酸性糖蛋白質 AUC 血漿中濃度-時間曲線下面積 BG 自然放射能 CL/F 経口クリアランス Cmax 最高血漿中濃度 CLint 肝固有クリアランス CLp 血漿クリアランス CLr 腎クリアランス CYP チトクローム P450 F 経口バイオアベイラビリティ GC ガスクロマトグラフ HDL 高密度リポ蛋白質 HPLC 高速液体クロマトグラフ HSA ヒト血清アルブミン Ka 結合定数 Km Michaelis 定数 LC/MS 液体クロマトグラフ/質量分析 LC/MS/MS 液体クロマトグラフ/タンデム質量分析 LDL 低密度リポ蛋白質 LSC 液体シンチレーション計測器 MRT 平均滞留時間 MS 質量分析 NEFA 遊離脂肪酸 NPD 窒素-リン検出器
OAT organic anion transporter
OATP organic anion transporting polypeptide OCT organic cation transporter
Papp 透過係数 Pgp P-糖蛋白質 QWBA 定量的全身オートラジオグラフ SD ラット Sprague Dawley ラット tmax 最高血漿中濃度到達時間 t1/2 消失半減期 ucb P071 セチリジン塩酸塩のフリー体 ucb 28556 レボセチリジン塩酸塩のフリー体 UDP ウリジン二リン酸 UGT UDP-グルクロン酸転移酵素 UV 紫外吸収検出器 Vdss 定常状態における分布容積 VLDL 超低密度リポ蛋白質 Vmax 最大反応速度
2.6.4. 薬物動態試験の概要文 2.6.4.1. まとめ レボセチリジンの薬物動態試験は SD および Wistar ラットならびにビーグル犬で実施した。 非臨床薬物動態試験に用いた投与経路は臨床投与経路である経口とし、一部の試験では静脈 内投与でも実施した。投与薬物はレボセチリジンの他にその14C-標識体、ラセミ体であるセ は特記しない限り二塩酸塩量で表示した。 吸 収 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与したときの血漿中放射能およ びucb 28556 の tmaxは0.5~2 時間であった。血漿中の放射能は雄で投与 4 時間後、雌で投与 8 時間後まで ucb 28556 とほぼ同様に推移したが、放射能は投与 96 時間後、ucb 28556 は投 与 24 時間後までにほぼ定量下限(放射能:25dpm、ucb 28556:0.020µg/mL)未満となった。 雌雄イヌに14C-標識体の 1mg/kg を単回経口投与したときの血漿中放射能の tmaxは雄で1.5 時間、雌で2.8 時間、Cmaxは雄で2.88µg eq./mL、雌で 2.25µg eq./mL であった。ucb 28556 の tmaxは雄で2.0 時間、雌で 2.8 時間、Cmax は雄で2.83µg/mL、雌で 2.25µg/mL、AUC0-∞は雄で 42.60µg・hr/mL、雌で 27.85µg・hr/mL、t1/2は雄で6.84 時間、雌で 8.84 時間であった。雌雄イ ヌにレボセチリジンの1mg/kg を単回静脈内投与したときの血漿中 ucb 28556 濃度は二相性を 示して体内から消失し、AUC0-∞は36.4µg・hr/mL、t1/2は約8 時間、MRT は約 11 時間であっ た。また、F は先の試験(2.6.4.3.2.1.1 参照)での経口投与後の AUC0-∞より、95%超である と考えられた。 雌雄ラットにレボセチリジンの25~225mg/kg/日を 23 日間、4~75mg/kg/日を 13 週間経口 投与したときの血漿中ucb 28556 の tmaxは1.5~3.0 時間であり、AUC0-24は投与量増加の割合 を上回って増加した。また、雌雄ラットにセチリジンの37.5 および 75mg/kg/日を 13 週間経
マー間で薬物動態が異なると考えられた。
雌雄イヌに14C-標識体の 1mg/kg を 8 日間経口投与したときの血漿中放射能の tmaxは雄で 4.0 時間、雌で 2.0 時間、Cmaxは雄で3.40µg eq./mL、雌で 2.57µg eq./mL であった。ucb28556 のtmaxは雄で4.0 時間、雌で 2.0 時間、Cmaxは雄で3.40µg/mL、雌で 2.53µg/mL、AUC0-∞は雄 で50.50µg・hr/mL、雌で 39.90µg・hr/mL であり、t1/2は雄で9.46 時間、雌で 8.29 時間であった。 雌雄イヌにレボセチリジンの8~75mg/kg/日を 13 週間経口投与したときの血漿中 ucb 28556 の曝露量は8~25mg/kg/日の範囲で投与量増加の割合を上回って増加し、25~75mg/kg/日の 範囲では投与量増加の割合を下回って増加した。 分 布 雄ラットに14C-標識体の 2mg/kg を単回経口投与したときの放射能は速やかに体内に吸収 され、大部分の組織で投与0.5 時間後に最大となった。放射能は消化管を除き、肝臓および 腎臓でもっとも高く、大脳および小脳では血漿中よりも低かった。放射能は投与168 時間後 チリジンおよびS-エナンチオマーである gsk002*(二塩酸塩)も使用した。なお、投与量 口投与したときのucb 28556 の曝露量は gsk002*よりも大きかったことから、エナンチオ ラットおよびイヌの血漿中でucb 28556 および gsk002*は相互に光学変換しなかった。 * 新薬承認情報提供時に置き換え
には大部分の組織でBG レベル(25dpm)未満となった。また、14C-標識体の 25mg/kg を単 回経口投与したときの組織内放射能は2mg/kg 群と同じ分布パターンを示した。妊娠 14 日の ラットに14C-標識体の 2mg/kg を単回経口投与したときの放射能は羊水、胎盤および胎児で も検出された。 雌雄イヌに14C-標識体の 1mg/kg を単回経口投与したときの放射能は速やかに体内に吸収 され、大部分の組織で投与2 または 6 時間後に最大となった。放射能は消化管を除き、胆汁、 肝臓、腎臓および膵臓で高かった。また、投与48 時間後でも大部分の組織で放射能が確認 された。イヌに14C-標識体の 1mg/kg を 9 日間反復投与したときの組織内放射能は単回投与 と同様の分布プロファイルを示した。 ラットおよびイヌでの放射能の in vitro 血漿蛋白結合率はそれぞれ約 85~87 および 88~ 91%であり、ex vivo の結合率と同程度であった。ヒト血漿に14C-標識体および14C-セチリジ ンを添加したときの蛋白結合率はそれぞれ約92 および 89%であった。14C-セチリジンを添 HSA のサイトⅡと結合すると考えられた。また、ヒト血球に14C-標識体を添加したときの放 射能の血球結合率は27.4%であった。 トランスポーター発現系において、ucb 28556 はヒト肝臓での胆汁排泄に関与するトラン スポーター(OATP1B1 および OATP1B3)および腎臓での排泄に関与するトランスポーター (hOAT1、hOAT3 および hOCT1)の基質ではないことが示された。また、ucb 28556 は Pgp の弱い基質であると考えられたが、Pgp を介したジゴキシン輸送を 100µM の濃度まで阻害し なかった。 代 謝 雄ラットの肝ミクロソームに14C-標識体(最終濃度 13µM)を添加し、1 時間インキュー ベートしたとき、ucb 28556 の 4%が代謝され、1 種の代謝物が検出された。デキサメタゾン 処理ラットの肝ミクロソームでは添加量の10%が代謝され、2 種の代謝物が検出された。ヒ ト肝ミクロソームでレボセチリジンを1 時間インキュベートしたときには、代謝物はほとん どみられなかったが、フェニル基の水酸化体(ucb 34695 および MU)、N-脱アルキル体 (ucb 29738)、O-脱アルキル体(ucb 1410 および P026)および N-酸化体がわずかに検出さ 標識体(最終濃度5 および 50µM)を添加したときの代謝物の生成量は 5µM 群で約 87%、 50µM 群で約 10%と ucb 28556 の代謝に飽和が確認された。また、雄ラットの肝細胞抽出液 をβ-グルクロニダーゼおよびスルファターゼで処理したときの代謝物の生成量が無処理群に 比べ変化したことから、一部の代謝物はグルクロン酸および硫酸抱合体であると考えられた。 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与したときの尿糞中には 20 種 以上の代謝物が検出され、このうちの12 種が同定された。主代謝経路はクロロベンズヒド リル基の N-脱アルキル化であった。その他には p-水酸化体および水酸化メトキシ体の生成 も確認された。イヌに14C-標識体の 1mg/kg を単回または 8 日間経口投与したときの血漿、 尿糞および胆汁中にはおもにucb 28556 が存在した。イヌでの ucb 28556 の主代謝経路はタ 加したときのucb 28556 の蛋白結合率は約 93%、gsk002*は約 86%であり、ucb 28556 は
れた。また、gsk002*の CLintはMU、ucb 29738 および ucb 1410 で ucb 28556 の約 2 倍であ ったことから、gsk002*の代謝速度は ucb 28556 よりも速かった。雄ラットの肝細胞に14C-
ウリン抱合および芳香環の酸化であり、タウリン抱合体は直接、芳香環の酸化体は抱合後に 体内から排泄された。
ヒト肝ミクロソームでの N-および O-脱アルキル体の生成には CYP3A4 が、その他の代謝 には複数のCYP 分子種(未同定)が関与した。ヒト肝細胞において、レボセチリジン(最 終濃度1、3 および 10µM)はヒトの CYP1A2、CYP2C9 および CYP3A4/5 ならびに UGT1A1 の活性をいずれも変化させなかった。また、ヒト肝ミクロソームにレボセチリジン(最終濃 度100µM)を添加したときの CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1 および CYP3A4 の活性に対する阻害作用は最大 5.9%であった。 雌雄ラットにレボセチリジンの4~75mg/kg/日を 13 週間経口投与したときの雄の 25 およ び75mg/kg/日群の CYP1A 活性は媒体群に比べ有意に増加した。ラットでレボセチリジンは 肝代謝酵素を誘導するものの、雄の誘導能は雌よりも大きかった。また、レボセチリジンの 誘導能はセチリジンよりも弱いことが示された。 排 泄 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与したときの放射能の主排泄経 路は糞であった。投与168 時間後までの放射能の尿中排泄率は 2mg/kg 群の雄で 12.5%、雌 で33.0%であり、25mg/kg 群の雄で 17.3%、雌で 64.0%であった。雌雄ラットにレボセチリ ジンの18.7~75mg/kg/日、セチリジンの 37.5 および 75mg/kg/日を 13 週間経口投与したとき 雄ラットでのucb 28556 の尿中排泄率はレボセチリジンの投与量増加および投与期間の延長 に伴い増加したが、雌では投与期間を通じてほぼ同程度であった。また、セチリジン投与群 雌雄イヌに 14C-標識体の 1mg/kg を単回経口投与したときの放射能の排泄は緩やかであり、 投与24 時間後までの糞中に雄で約 18%、雌で 27%、尿中に雄で約 20%、雌で約 21%が排泄 された。また、9 日間経口投与したときの最終投与 48 時間後までの尿糞中に放射能は約 74 ~106%が排泄された。放射能の尿中排泄率は雄で約 18~33%、雌で約 23~46%と投与期間 にかかわらずほぼ同程度であり、投与3 日以降の放射能の糞中排泄率は雄で約 46~78%、雌 で約57~96%であった。雌雄イヌにセチリジンの 135/90mg/kg を投与したときの ucb 28556 28556 は検出されなかった。雌雄イヌに14C-標識体の 1mg/kg を単回経口投与したときの放射 能は投与2 時間後で約 6%、投与 6 時間後で約 10%が胆汁中に排泄された。イヌにレボセチ リジンの33.75~135/90mg/kg/日を 4 週間経口投与したときの胆汁中濃度は 623~2226µg/mL は検出されなかった。 のucb 28556 および gsk002*の尿中排泄率は単回投与と同様に雌の方が雄よりも高かった。 のucb 28556 の尿中排泄率は gsk002*よりもわずかに高かった。 およびgsk002*の尿中排泄率は同程度であった。また、レボセチリジンを投与したときの 尿中にはgsk002*は検出されず、gsk002*(二塩酸塩)を投与したときの尿中にも ucb であり、gsk002*は検出されなかった。また、セチリジンを投与したときの胆汁中には ucb 28556 および gsk002*が検出されたが、gsk002*(二塩酸塩)を投与したときには ucb 28556 * 新薬承認情報提供時に置き換え
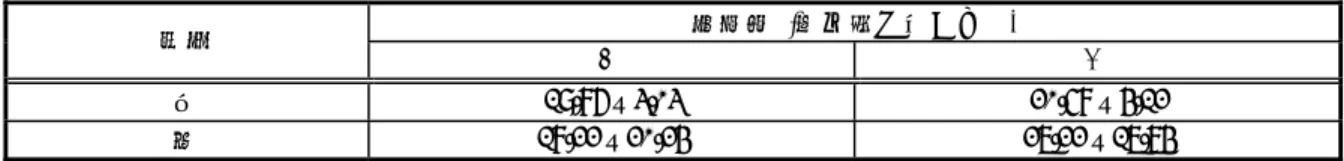
2.6.4.2. 分析方法 2.6.4.2.1. 被験物質 本試験で使用した14C-レボセチリジン(14C-標識体:図 2.6.4-1)の放射化学的純度は 97% 超、比放射能は約3.65~4.78MBq/mg であった(2.6.5.3~2.6.5.14 参照)。 N N Cl H O CO2H
*
・2HCl (*:14C 標識位置) 図 2.6.4-1 14 C-標識体の化学構造 2.6.4.2.2. 分析法 4.2.2.1.1~4.2.2.1.6, 4.2.2.2.1, 4.2.2.2.5 および 4.2.2.3.3 試料から作成した検量線を基に濃度を算出した(表 2.6.4-1)。レボセチリジンを投与したと 28556 が検出されなかったことから、アキラルな分析法も選択した。HPLC 法での日内およ び日間変動の精度(%標準偏差)は 15%以内、真度(%相対誤差)は±11%以内であった ヵ月、ucb P071 は 12 ヵ月間安定であった。 生体試料中の放射能はLSC または QWBA 法で測定した。また、代謝物は radio-HPLC、 LC/MS および LC/MS/MS 法で分離・同定した。 表 2.6.4-1 血漿および尿中濃度測定法 試料 測定薬物 抽出法 測定法 定量下限 ジクロロメタン抽出 NPD-GC 0.02µg/mL クロロホルム抽出 NPD-GC 0.02µg/mL クロロホルム抽出 NPD-GC 0.04µg/mL 酢酸エチル抽出 HPLC-achiral 0.004µg/mL 酢酸エチル抽出 HPLC-chiral 0.004µg/mL 血漿 ucb 28556および クロロホルム抽出 LC/MS/MS 0.0005µg/mL クロロホルム抽出 NPD-GC 0.1µg/mL クロロホルム抽出 HPLC-achiral 0.04µg/mL 酢酸エチル抽出 HPLC-chiral 0.015µg/mL クロロホルム抽出 HPLC-achiral 0.02µg/mL 尿 ucb 28556および 酢酸エチル抽出 HPLC-chiral 実施せず 生体試料(血漿、胆汁および尿)中のucb 28556 およびgsk002*は既知濃度を添加した きの生体試料中にgsk002*は検出されず、gsk002*を投与したときの生体試料中にもucb (2.6.5.2 参照)。ucb 28556 は-20℃で 5.5 ヵ月安定であった。gsk002*は-20℃の血漿中で 4 gsk002* gsk002* * 新薬承認情報提供時に置き換え2.6.4.3. 吸収 2.6.4.3.1. ラット 2.6.4.3.1.1. 経口投与 2.6.4.3.1.1.1. 単回投与 4.2.2.2.1 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与したときの血漿中放射能およ びucb 28556 の薬物動態について検討した(2.6.5.3 参照)。
2mg/kg 群の放射能の tmaxは雌雄でいずれも0.5 時間、Cmaxは雄で1.0µg eq./mL、雌で 0.46µg eq./mL であった。また、ucb 28556 の tmaxは雌雄でいずれも0.5 時間、Cmaxは雄で 1.14µg/mL、雌で 0.44µg/mL であった(図 2.6.4-2 および表 2.6.4-2)。25mg/kg 群の放射能の tmaxは雄で2 時間、雌で 0.5 時間、Cmaxは雄で14.60µg eq./mL、雌で 22.93µg eq./mL であり、 ucb 28556 の tmaxは雄で2 時間、雌で 0.5 時間、Cmaxは雄で13.55µg/mL、雌で 23.95µg/mL で あった。血漿中放射能は雄で投与4 時間後、雌で投与 8 時間後まで ucb 28556 とほぼ同様に 推移したが、放射能は投与96 時間後、ucb 28556 は投与 24 時間後までに定量下限(放射 能:BG レベル(25dpm)、ucb 28556:0.020µg/mL)未満となった。 以上のことから、ラットでのレボセチリジンの吸収および体内からの消失はいずれも速や かであり、投与8 時間後までの血漿中には大部分が ucb 28556 として存在したと考えられた。 また、雄ラットのCmaxは雌と異なったことから、レボセチリジンの薬物動態には性差があ ると考えられた。 0.01 0.1 1 10 100 0 8 16 24 投与後時間 (hr) 血漿中濃度( µg /m L また はµ g eq. /m L) 放射能, ♂ 放射能, ♀ ucb 28556, ♂ ucb 28556, ♀ n=1/時点 図 2.6.4-2 雌雄ラットに14 C-標識体の 25mg/kg を単回経口投与したときの 血漿中放射能および ucb 28556 濃度推移 4.2.2.2.1 の Table 1 より作成
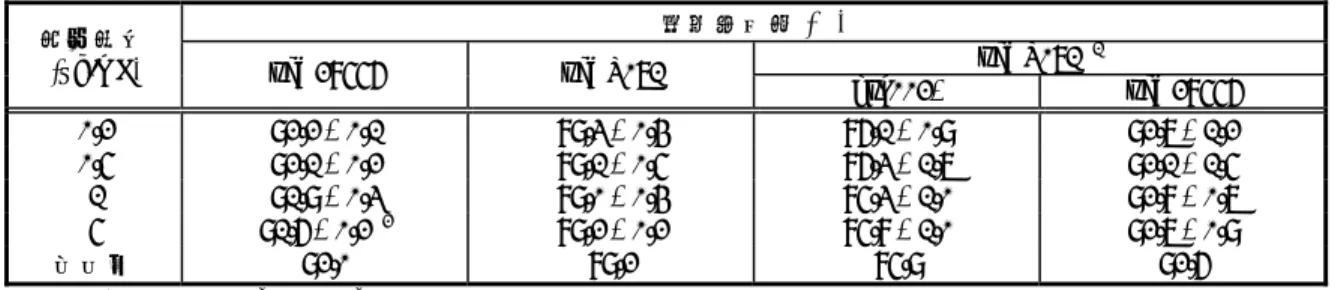
表 2.6.4-2 雌雄ラットに14 C-標識体を単回経口投与したときの 血漿中放射能および ucb 28556 の薬物動態パラメータ 4.2.2.2.1 の要約より作成 2mg/kg 25mg/kg パラメータ ♂ ♀ ♂ ♀ Cmax (µg eq./mL) 1.0 0.46 14.60 22.93 放射能 tmax (hr) 0.5 0.5 2 0.5 Cmax (µg/mL) 1.14 0.44 13.55 23.95 ucb 28556 tmax (hr) 0.5 0.5 2 0.5 n=1/時点 2.6.4.3.1.1.2. 反復投与 2.6.4.3.1.1.2.1. 23 日間投与 4.2.2.2.2 た(2.6.5.4 参照)。 AUC0-24はいずれも投与量増加の割合を上回って増加した(表 2.6.4-3)。雄にレボセチリジ ンの25 および 75mg/kg/日を反復投与したときの ucb 28556 の AUC0-24は雌よりも高かったが、 4.2.2.2.2 の Table 15、21 および 25 より作成 レボセチリジン 性 別 パラメータ 25mg/kg/日 75mg/kg/日 225mg/kg/日 25mg/kg/日 75mg/kg/日 225mg/kg/日 Cmax(µg/mL) 17.3 80.8 80.7 2.82 16.0 51.5 tmax(hr) 1.5 1.5 3.0 1.5 1.5 3.0 AUC0-24 (µg・hr/mL) 88.8 386.8 1004.6 5.0 90.6 347.5 ♂ CL/F (mL/min/kg) 4.7 3.2 3.7 83.3 13.8 10.8 Cmax(µg/mL) 12.4 44.8 127.8 5.33 16.3 29.1 tmax(hr) 1.5 1.5 3.0 1.5 1.5 1.5 AUC0-24 (µg・hr/mL) 40.7 198.9 1010.0 8.9 65.9 204.7 ♀ CL/F (mL/min/kg) 10.2 6.3 3.7 46.8 19.0 18.3 n=1/時点 雌雄ラットにレボセチリジンおよびgsk002*(二塩酸塩)の 25、75 および 225mg/kg/日 を23 日間経口投与したときの血漿中 ucb 28556 および gsk002*の薬物動態について検討し 23 日間経口投与したときのucb 28556 およびgsk002*のtmaxは1.5~3.0 時間であり、 225mg/kg/日群では雌雄で同程度であった。ucb 28556 の曝露量はgsk002*よりも大きく、 CL/Fはgsk002*よりも小さかった。また、レボセチリジン投与群の血漿中にgsk002*は 検出されず、gsk002*(二塩酸塩)投与群の血漿中にもucb 28556 は検出されなかった。 以上のことから、ラットでのucb 28556 および gsk002*の吸収はいずれも速やかである と考えられた。また、ucb 28556 の曝露量に性差が確認された。ucb 28556 の CL/F が gsk002* よりも小さいことから、エナンチオマー間で体内動態が異なると考えられた。さらに、 ラット血漿中でucb 28556 および gsk002*は相互に光学変換をしないと考えられた。 表 2.6.4-3 雌雄ラットにレボセチリジンおよび gsk002*(二塩酸塩)を 23 日間経口投与 したときの血漿中ucb 28556 および gsk002*の薬物動態パラメータ gsk002* (二塩酸塩)
2.6.4.3.1.1.2.2. 13 週間投与 4.2.2.2.3 雌雄ラットにレボセチリジンの4、8、25 および 75mg/kg/日を 13 週間経口投与したときの 血漿中ucb 28556 の薬物動態について検討した(2.6.5.4 参照)。 13 週間経口投与したときの ucb 28556 の tmaxは1.5~3.0 時間であり、曝露量は 4~ 75mg/kg/日の範囲で投与量増加の割合を上回って増加した(表 2.6.4-4)。また、4~ 25mg/kg/日群の雄の AUC0-24は雌よりも高かった。 以上のことから、ラットでのレボセチリジンの吸収は比較的速やかであると考えられた。 また、ucb 28556 の曝露量に性差があると考えられた。 表 2.6.4-4 雌雄ラットにレボセチリジンを 13 週間経口投与したときの 血漿中 ucb 28556 の薬物動態パラメータ 4.2.2.2.3 の要約より作成 性別 投与量 (mg/kg/日) Cmax (µg/mL) (hr) tmax AUC0-24 (µg・hr/mL) 4 1.71 1.5 3.08 8 5.48 3.0 32.5 25 21.2 1.5 107 ♂ 75 72.5 1.5 441 4 1.23 1.5 1.98 8 3.55 1.5 10.6 25 16.6 1.5 46.8 ♀ 75 89.0 1.5 386 各時点(n=2)の平均値より算出 2.6.4.3.1.1.2.3. 13 週間投与(セチリジンとの比較) 4.2.2.2.4 雌雄ラットにレボセチリジンの18.7、37.5 および 75mg/kg/日、セチリジンの 37.5 および いて検討した(2.6.5.4 参照)。 AUC0-12はいずれも投与量増加の割合を上回って増加した(表 2.6.4-5)。セチリジンの 37.5 きかったことから、エナンチオマー間で薬物動態が異なると考えられた。さらに、23 日間 投与試験(2.6.4.3.1.1.2.1 参照)と同様にラット血漿中で ucb 28556 は光学変換しないと考え られた。 75mg/kg/日を 13 週間経口投与したときの血漿中 ucb 28556 および gsk002*の薬物動態につ 13 週間経口投与したときのucb 28556 およびgsk002*のtmaxは1.5~3.0 時間であり、 および75mg/kg/日を投与したときの曝露量はいずれの投与量群でもucb 28556 の方がgsk002* よりも大きかった。さらに、レボセチリジンを投与したときの血漿中にgsk002*は検出され なかった。 以上のことから、ラットでのucb 28556 および gsk002*の吸収は比較的速やかであると 考えられた。また、セチリジンを投与したときのucb 28556 の曝露量が gsk002*よりも大 * 新薬承認情報提供時に置き換え
表 2.6.4-5 雌雄ラットにレボセチリジンおよびセチリジンを 13 週間経口投与 4.2.2.2.4 の要約より作成 測定薬物 ucb 28556 投与薬物 投与量 (mg/kg/日) 性 別 Cmax (µg/mL) tmax (hr) AUC0-12 (µg・hr/mL) Cmax (µg/mL) tmax (hr) AUC0-12 (µg・hr/mL) ♂ 14.1 3.0 68.4 ND - - 18.7 ♀ 17.1 1.5 41.8 ND - - ♂ 39.3 1.5 160 ND - - 37.5 ♀ 30.8 1.5 108 ND - - ♂ 63.0 1.5 405 ND - - レボセチリ ジン 75 ♀ 56.9 3.0 481 ND - - ♂ 12.1 3.0 57.5 3.19 1.5 13.1 37.5 ♀ 19.3 1.5 57.1 5.99 1.5 15.7 ♂ 30.6 1.5 200 10.5 1.5 54.5 セチリジン 75 ♀ 55.3 1.5 251 13.1 1.5 56.0 各時点(n=2)の平均値より算出、ND:定量下限 (0.02µg/mL)未満、-:算出できず 2.6.4.3.2. イヌ 2.6.4.3.2.1. 経口投与 2.6.4.3.2.1.1. 単回投与 4.2.2.2.5 雌雄イヌに14C-標識体の 1mg/kg を単回経口投与したときの血漿中放射能および ucb 28556 の薬物動態について検討した(2.6.5.4 参照)。
放射能のtmaxは雄で1.5 時間、雌で 2.8 時間、Cmaxは雄で2.88µg eq./mL、雌で 2.25µg eq./mL であった。また、ucb 28556 の tmax は雄で2.0 時間、雌で 2.8 時間、Cmax は雄で 2.83µg/mL、雌で 2.25µg/mL、AUC0-∞は雄で42.60µg・hr/mL、雌で 27.85µg・hr/mL、t1/2は雄で 6.84 時間、雌で 8.84 時間であった(図 2.6.4-3 および表 2.6.4-6)。
以上のことから、イヌに単回経口投与したときのレボセチリジンの吸収はラット
(2.6.4.3.1.1.1 参照)と同様に速やかであり、曝露量に性差はないと考えられた。血漿中の 放射能はucb 28556 とほぼ同様に推移したことから、血漿中では大部分が ucb 28556 として 存在したと考えられた。また、本試験でのucb 28556 の AUC0-∞と静脈内投与後のAUC0-∞ (2.6.4.3.2.2 参照)から、レボセチリジンの F は 95%超であると考えられた。
したときの血漿中ucb 28556 および gsk002*の薬物動態パラメータ
gsk002*
0.1 1.0 10.0 0 8 16 24 32 40 48 投与後時間 (hr) 血漿 中 濃 度 (µ g/m Lまた は µg e q./ mL) 放射能, ♂ 放射能, ♀ ucb 28556, ♂ ucb 28556, ♀ 平均値±標準偏差 (n=1~4) 図 2.6.4-3 雌雄イヌに14 C-標識体の 1mg/kg を単回経口投与したときの 血漿中放射能および ucb 28556 濃度推移 4.2.2.2.5 の Table 1 および 32 より作成 表 2.6.4-6 雌雄イヌに14C-標識体の 1mg/kg を単回および 8 日間 経口投与したときの血漿中放射能および ucb 28556 の薬物動態パラメータ 4.2.2.2.5 の Table 1, 2 および 32~34 より作成 投与 測定薬物 性別 Cmax (µg/mL) (hr) tmax AUC0-∞ (µg・hr/mL) t1/2 (hr) ♂ 2.88 ± 0.71 #1, 2 1.5 ± 0.58 #1 NC NC 放射能 ♀ 2.25 ± 0.60 #1, 2 2.8 ± 1.5 #1 NC NC ♂ 2.83 ± 0.66 #1 2.0 ± 1.4 #1 42.60 6.84 単回 ucb 28556 ♀ 2.25 ± 0.60 #1 2.8 ± 1.5 #1 27.85 8.84 ♂ 3.40 #2 4.0 NC NC 放射能 ♀ 2.57 #2 2.0 NC NC ♂ 3.40 4.0 50.50 9.46 8 日間 ucb 28556 ♀ 2.53 2.0 39.90 8.29 平均値 (n=2)、#1:平均値±標準偏差 (n=4)、#2:µg eq./mL、NC:算出せず 2.6.4.3.2.1.2. 反復投与 2.6.4.3.2.1.2.1. 8 日間投与 4.2.2.2.5 雌雄イヌに14C-標識体の 1mg/kg/日を 8 日間経口投与したときの血漿中放射能および ucb 28556 の薬物動態について検討した(2.6.5.4 参照)。
放射能のtmaxは雄で4.0 時間、雌で 2.0 時間、Cmaxは雄で3.40µg eq./mL、雌で 2.57µg eq./mL であった。また、ucb 28556 の tmaxは雄で4.0 時間、雌で 2.0 時間、Cmax は雄で
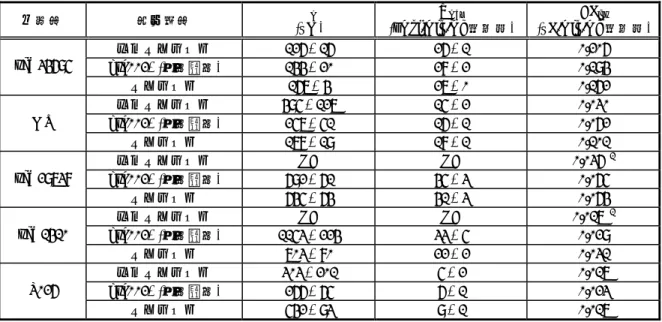
3.40µg/mL、雌で 2.53µg/mL、AUC0-∞は雄で50.50µg・hr/mL、雌で 39.90µg・hr/mL であり、t1/2 は雄で9.46 時間、雌で 8.29 時間であった(表 2.6.4-6)。 以上のことから、イヌに反復経口投与したときのレボセチリジンの吸収は速やかであると 考えられた。また、血漿中放射能のCmaxはucb 28556 と同程度であったことから、血漿中で はほとんどがucb 28556 として存在すると考えられた。さらに、反復投与したときの AUC0-∞ が単回投与(2.6.4.3.2.1.1 参照)の 2 倍未満であったことから、レボセチリジンは 1mg/kg/日 の8 日間投与で蓄積性を示さないと考えられた。 2.6.4.3.2.1.2.2. 13 週間投与 4.2.2.2.6 および 4.2.2.2.7 雌雄イヌにレボセチリジンの8、25 および 75mg/kg/日を 13 週間経口投与したときの血漿 中ucb 28556 の薬物動態について検討した(2.6.5.4 参照)。また、雌雄イヌにレボセチリジ ンの37.5 および 75mg/kg、セチリジンの 75mg/kg を 13 週間経口投与したときの血漿中の ucb レボセチリジンの8~75mg/kg/日を反復投与したときの tmaxは1.5~1.9 時間であり、ucb 28556 の曝露量は 8~25mg/kg/日の範囲では投与量増加の割合を上回って増加し、25~ 75mg/kg/日の範囲では投与量増加の割合を下回って増加した(表 2.6.4-7)。各投与量群での 投与13 週の AUC0-24は投与1 日よりも 2 倍以上高く、雄の曝露量は雌とほぼ同程度であった。 雄にレボセチリジンの37.5mg/kg/日およびセチリジンの 75mg/kg/日を 13 週間経口投与し たときの投与1 日の ucb 28556 の AUC0-24はそれぞれ352±81 および 378±173µg・hr/mL、投 与13 週では 846±236 および 937±170µg・hr/mL であった(表 2.6.4-8)。ucb 28556 および 28556 は生体内で光学変換しないと考えられた。 以上のことから、イヌでのレボセチリジンの吸収は速やかであると考えられた。また、25 および75mg/kg/日を 13 週間経口投与したときの投与 13 週の AUC0-24が投与1 日の 2 倍以上 (嘔吐がみられた動物を除く)であったことから、レボセチリジンは25mg/kg/日以上の 13 週間経口投与で蓄積性を示すと考えられた。さらに、雄イヌの曝露量が雌と同程度であった ことから、曝露量に性差はないと考えられた。 28556 および gsk002*濃度について検討した(2.6.5.4 参照)。 gsk002*の曝露量は投与期間を通じてほぼ同程度であり、性差はみられなかった。また、 レボセチリジンを投与したときの血漿中にgsk002*は検出されなかったことから、ucb * 新薬承認情報提供時に置き換え
表 2.6.4-7 雌雄イヌにレボセチリジンを 13 週間経口投与したときの 血漿中 ucb 28556 の薬物動態パラメータ 4.2.2.2.6 の Table 8 より作成 投与 期間 性別 投与量 (mg/kg/日) Cmax (µg/mL) tmax (hr) AUC0-24 (µg・hr/mL) 8 15.4 ± 1.5 1.5 ± 0.0 124 ± 18 25 37.3 ± 7.2 1.5 ± 0.0 295 ± 53 ♂ 75 85.5 ± 27.5 1.9 ± 0.8 818 ± 340 8 18.3 ± 5.9 1.5 ± 0.0 105 ± 22 25 40.4 ± 14.0 1.5 ± 0.0 320 ± 35 1 日 ♀ 75 117.1 ± 15.5 1.5 ± 0.0 1027 ± 154 8 18.8 ± 7.5 1.9 ± 0.8 194 ± 70 25 83.3 ± 33.8 1.9 ± 0.8 822 ± 241 ♂ 75 188.6 ± 19.4 1.5 ± 0.0 2379 ± 330 8 25.1 ± 6.3 1.5 ± 0.0 188 ± 46 25 74.0 ± 17.1 1.9 ± 0.8 795 ± 149 13 週 ♀ 75 145.7 ± 17.2 1.9 ± 0.8 1934 ± 333 #1 平均値±標準偏差 (n=4)、#1:投与後の試料採取前に嘔吐がみられた(1 匹) 表 2.6.4-8 雌雄イヌにレボセチリジンおよびセチリジンを 13 週間経口投与した 4.2.2.2.7 の要約より作成 測定薬物 ucb 28556 投与 期間 投与 薬物 投与量 (mg/kg/日) 性別 Cmax (µg/mL) t(hr) max AUC0-24 (µg・hr/mL) (µg/mL)Cmax (hr) tmax AUC0-24 (µg・hr/mL) ♂ 45.9 ± 18.4 1.9 ± 0.8 352 ± 81 ND - - 37.5 ♀ 47.0 ± 5.8 1.5 ± 0.0 386 ± 39 ND - - ♂ 66.5 ± 22.6 1.9 ± 0.8 643 ± 203 ND - - レボセチリ ジン 75 #1 ♀ 65.7 ± 30.4 1.5 ± 0.0 631 ± 425 ND - - ♂ 34.9 ± 11.5 1.9 ± 0.8 378 ± 173 27.9 ± 9.6 1.9 ± 0.8 385 ± 166 1 日 セチリジン 75 #1 ♀ 36.4 ± 8.9 2.3 ± 0.9 406 ± 170 30.6 ± 9.6 2.3 ± 0.9 400 ± 163 ♂ 70.6 ± 23.0 1.9 ± 0.8 846 ± 236 ND - - 37.5 ♀ 65.6 ± 18.0 1.5 ± 0.0 810 ± 133 ND - - ♂ 122 ± 14 2.6 ± 0.8 1680 ± 202 ND - - レボセチリ ジン 75 ♀ 141 ± 40 1.9 ± 0.8 1655 ± 342 ND - - ♂ 56.3 ± 11.2 4.1 ± 3.3 937 ± 170 53.6 ± 9.4 4.1 ± 3.3 887 ± 159 13 週 セチリジン 75 ♀ 54.1 ± 18.6 3.4 ± 1.9 822 ± 269 47.6 ± 16.2 3.4 ± 1.9 724 ± 242 平均値±標準偏差 (n=4)、ND:定量下限 (0.02µg/mL)未満、-:算出できず #1:投与後の試料採取前に嘔吐がみられた(雌雄各 1 匹) 2.6.4.3.2.2. 静脈内投与 4.2.2.2.8 (2.6.5.3 参照)。 ucb 28556 は血漿中から二相性を示して消失し、AUC0-∞は36.4µg・hr/mL、t1/2は約8 時間、 MRT は約 11 時間であった(表 2.6.4-9)。Vdssは0.32L/kg と体内総体液量(約 0.6L/kg) ときの血漿中ucb 28556 および gsk002*の薬物動態パラメータ gsk002* 雌雄イヌにレボセチリジンおよびgsk002*(二塩酸塩)の 1mg/kg をそれぞれ単回静脈内 投与したときのそれぞれの血漿中ucb 28556 および gsk002*の薬物動態について検討した * 新薬承認情報提供時に置き換え
[Davies, 1993]よりも小さく、CLpは0.487mL/min/kg と肝血漿流量(約 17.9mL/min/kg) [Davies, 1993]よりも低かった。ucb 28556 の尿中排泄率は投与量の約 26%、CLrは の尿中排泄率は約38%、CLrは0.243mL/min/kg であった。 以上により、イヌのVdssが体内総体液量よりも小さく、CLpが肝血漿流量よりも低かった ことから、組織内ucb 28556 濃度は血漿中よりも低く、体内からの消失は肝血漿流量に依存 が異なると考えられた。 薬物動態パラメータ 4.2.2.2.8 の要約および Table 9 より作成 投与薬物 測定薬物 AUC0-∞ (µg・hr/mL) t1/2 (hr) CLp (mL/min/kg) Vdss (L/kg) MRT (hr) Ae (%) CLr (mL/min/kg) レボセチリジン ucb 28556 ± 8.8** 36.4 ± 0.75**8.20 ± 0.134**0.487 ± 0.07**0.32 ± 1.28** 11.15 ± 2.1 25.6 ± 0.029 0.123 (二塩酸塩) 26.7 ± 4.0 9.74 ± 1.12 0.638 ± 0.103 0.51 ± 0.07 13.30 ± 1.45 38.1 ± 3.4 0.243 ± 0.044 平均値±標準偏差 (n=6)、**:p<0.01 (vs 二塩酸塩)群、ANOVA) 2.6.4.4. 分布 2.6.4.4.1. 組織内分布 2.6.4.4.1.1. 組織内放射能 2.6.4.4.1.1.1. ラット 4.2.2.3.1 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与したときの組織内放射能を LSC 法で測定し、組織内放射能分布について検討した(2.6.5.5.1.1 参照)。 雄の2mg/kg 群の放射能は大部分の組織で投与 0.5 時間後に最大となった(表 2.6.4-10)。 放射能は消化管を除き、肝臓および腎臓でもっとも高く、大脳および小脳では血漿中よりも 低かった。大部分の組織で投与24 時間後にも放射能が検出されたが、投与 168 時間後には BG レベル(25dpm)未満となった。また、25mg/kg 群の組織内放射能は 2mg/kg 群と同じ分 布パターンを示した。さらに、投与1 および 2 時間後の放射能の肝臓/血液比は雄でそれぞ れ15.1 および 15.9、雌でそれぞれ 7.4 および 9.8 であった。 以上のことから、ラットに単回経口投与後の薬物関連物質は速やかに体内に吸収されたの ち、広く組織に分布すると考えられた。また、薬物関連物質の肝臓への移行には性差がある と考えられた。 0.123mL/min/kgであった。一方、gsk002*のAUC0-∞は26.7μg・hr/mL、t1/2は約10 時間、 MRTは約 13 時間、Vdssは0.51L/kg、CLpは0.638mL/min/kg(表 2.6.4-9)であり、gsk002* しないと考えられた。さらに、ucb 28556 の AUC0-∞はgsk002*よりも有意に高く、t1/2、CLp、 VdssおよびMRT は gsk002*よりも有意に低かったことから、エナンチオマー間で体内動態 表 2.6.4-9 イヌにレボセチリジンおよび gsk002*(二塩酸塩)の 1mg/kg を単回静脈内 投与したときのそれぞれの血漿中ucb 28556 および gsk002*の gsk002* gsk002* gsk002* (
表 2.6.4-10 雄ラットに14 C-標識体の 2mg/kg を単回経口投与したときの組織内放射能 4.2.2.3.1 の Table 9 より作成 組織内放射能 (µg eq./g または mL) 組織 0.5hr 1hr 2hr 4hr 8hr 12hr 24hr 48hr 96hr 168hr 血漿 0.999 0.177 0.176 0.164 0.074 0.088 0.069 0.052 < 2BG < BG 血液 0.674 0.129 0.186 0.113 0.087 0.075 0.089 0.084 < 2BG 0.037 肝臓 14.786 6.350 3.701 1.885 0.609 0.505 0.303 0.158 0.347 0.021 腎臓 5.990 1.210 1.481 0.755 0.251 0.254 0.193 0.142 0.166 0.014 肺 1.410 0.262 0.338 0.145 0.096 0.069 0.053 0.043 0.049 < 2BG 脾臓 0.553 0.239 0.156 0.066 0.047 0.037 0.036 < 2BG 0.042 < BG 心臓 1.004 0.144 0.128 0.072 0.038 0.034 < 2BG < 2BG 0.039 < BG 胸腺 0.354 0.099 0.105 0.044 0.033 < 2BG < 2BG 0.087 < 2BG < BG 大脳 0.053 < 2BG 0.044 < 2BG < 2BG < 2BG < BG < BG 0.035 < BG 小脳 0.056 < 2BG 0.042 0.020 0.020 0.013 < 2BG < BG 0.037 < 2BG 唾液腺 0.632 0.142 0.146 0.073 0.042 0.052 0.034 < 2BG 0.020 < BG 気管 3.437 0.339 0.234 0.063 0.053 0.042 0.023 < 2BG 0.044 < BG 性腺 0.084 0.061 0.069 0.036 < 2BG < BG < 2BG < BG 0.040 < BG 副腎 1.214 0.323 0.337 0.133 0.150 0.096 < 2BG < 2BG 0.103 < 2BG 甲状腺 1.818 < 2BG < 2BG < BG < BG < BG < BG < BG < BG < BG 下垂体 1.014 < BG < BG < BG < BG < BG < BG < BG < BG < BG 眼球 0.406 0.100 < 2BG 0.093 < 2BG < 2BG < 2BG < 2BG < BG < BG 脊髄 0.227 0.032 0.053 0.026 0.030 < 2BG < 2BG < 2BG 0.059 < BG 骨髄 0.760 0.189 < 2BG < 2BG < 2BG < BG 0.674 < BG < 2BG < BG 筋肉 0.344 0.077 0.077 0.032 < 2BG 0.030 < 2BG < BG 0.015 < BG 脂肪細胞 0.145 0.126 0.098 < 2BG 0.067 0.131 < 2BG < 2BG 0.061 < BG 皮膚 0.220 0.086 0.094 0.060 0.053 < 2BG < 2BG < 2BG 0.024 < BG 被毛 0.206 0.038 0.032 0.043 < 2BG < 2BG 0.047 0.030 0.049 < 2BG 個別値/時点、BG レベル:25dpm 2.6.4.4.1.1.2. イヌ 4.2.2.3.2 雌雄イヌに14C-標識体の 1mg/kg を単回および 9 日間反復経口投与したときの組織内放射 能をLSC 法で測定し、組織内放射能分布について検討した(2.6.5.5.1.2 参照)。 単回投与後の放射能は大部分の組織で投与2 または 6 時間後に最大となった(表 2.6.4-11)。放射能は消化管を除き、胆汁、肝臓、腎臓および膵臓で高かった。投与 48 時間 後の胆汁中放射能は約10µg eq./g、肝臓中放射能は約 0.3µg eq./g であった。大脳、小脳、脳 幹、脊髄、水晶体、被毛、皮膚および骨髄での放射能は血液中よりも低かったが、心臓、腎 臓、肺、膵臓および下垂体での放射能は血液中と同程度またはわずかに高かった。また、大 部分の組織で投与48 時間後にも放射能が検出された。反復投与後の放射能は単回投与と同 様に大部分の組織で投与2 または 6 時間後に最大となった(表 2.6.4-12)。放射能は消化管 を除き、胆汁、肝臓、腎臓および膵臓で高かった。投与48 時間後の放射能は胆汁で約 17µg eq./g、肝臓中で約 1µg eq./g となったが、大部分の組織で放射能が検出された。 以上のことから、イヌに単回経口投与後の薬物関連物質は速やかに体内に吸収され、胆汁 中へ移行すると考えられた。また、反復投与後の各時点の組織内放射能は単回投与よりも高 かったが、単回投与と同様の分布プロファイルを示した。
表 2.6.4-11 雌雄イヌに14 C-標識体の 1mg/kg を単回経口投与したときの組織内放射能 4.2.2.3.2 の Table 13 および 14 より作成 組織内放射能 (µg eq./g または mL) ♂ ♀ ♂ ♀ 組織 2hr 6hr 24hr 48hr 血漿 1.778 2.595 0.598 0.100 血液 1.452 1.687 0.388 0.059 副腎 0.985 0.901 0.423 0.083 房水/硝子体 0.139 0.080 0.042 < 2BG 胆汁 97.546 146.337 31.397 9.847 膀胱 1.235 1.255 0.302 0.057 骨髄 0.418 0.538 0.120 < 2BG 脳幹 0.222 0.266 0.193 0.047 小脳 0.203 0.229 0.129 0.030 大脳 0.177 0.243 0.126 0.039 眼球 0.860 1.057 0.405 0.136 脂肪 0.290 0.134 0.071 < 2BG 被毛 0.037 0.023 < 2BG < 2BG 心臓 1.453 1.219 0.379 0.053 腎臓 1.994 1.707 0.574 0.127 水晶体 0.027 0.058 0.051 0.017 肝臓 3.641 3.185 1.130 0.276 肺 1.733 1.304 0.490 0.108 腸間膜リンパ節 0.678 0.876 0.187 0.051 膝窩リンパ節 0.912 0.784 0.304 0.051 筋肉 1.109 0.836 0.233 0.034 食道 1.013 0.775 0.219 0.042 卵巣 - 0.613 - 0.055 膵臓 1.960 1.433 0.648 0.132 耳下腺 1.154 1.168 0.314 0.058 副甲状腺 1.084 1.540 0.274 < 2BG 下垂体 1.451 1.581 0.422 0.086 前立腺 1.324 - 0.359 - 下顎/舌下唾液腺 1.378 1.066 0.339 0.076 皮膚 0.466 0.441 0.094 0.023 脊髄 0.164 0.162 0.184 0.067 脾臓 1.152 0.841 0.302 0.056 精巣 0.797 - 0.302 - 胸腺 0.656 0.561 0.193 < 2BG 甲状腺 1.232 0.809 0.288 0.046 気管 0.609 0.547 0.162 0.033 子宮 - 0.814 - 0.056 胃 1.31 0.87 0.61 0.07 胃内容物 NS 0.67 1.49 NS 十二指腸 1.53 1.04 0.47 0.10 十二指腸内容物 4.86 1.82 2.82 1.17 空腸 2.19 1.16 0.49 0.09 空腸内容物 25.08 13.05 3.18 0.69 回腸 1.31 0.99 0.50 0.05 回腸内容物 NS NS 4.69 NS 大腸 2.74 1.31 1.53 0.32 大腸内容物 17.8 8.73 21.58 4.49 n=1/時点、-:該当せず、NS:サンプルなし、BG レベル:25dpm
表 2.6.4-12 雌雄イヌに14 C-標識体の 1mg/kg/日を 9 日間経口投与したときの 組織内放射能 4.2.2.3.2 の Table 19 および 20 より作成 組織内放射能 (µg eq./g または mL) ♂ ♀ ♂ ♀ 組織 2hr 6hr 24hr 48hr 血漿 3.650 1.811 0.525 0.290 血液 2.870 1.311 0.446 0.233 副腎 1.518 1.110 0.397 0.277 房水/硝子体 0.110 0.133 0.033 < 2BG 胆汁 124.101 230.023 38.043 17.138 膀胱 1.417 1.193 0.461 0.182 骨髄 0.716 0.814 0.152 0.161 脳幹 0.384 0.450 0.190 0.110 小脳 0.363 0.997 0.156 0.096 大脳 0.372 0.464 0.172 0.107 眼球 1.934 1.730 0.945 0.523 脂肪 0.403 0.189 < 2BG < 2BG 被毛 0.102 0.062 < 2BG 0.429 心臓 2.276 1.146 0.296 0.153 腎臓 3.526 2.323 0.614 0.294 水晶体 0.107 0.280 0.100 0.116 肝臓 6.685 4.828 1.433 0.963 肺 1.932 1.449 0.526 0.306 腸間膜リンパ節 1.857 1.074 0.358 0.240 膝窩リンパ節 1.603 0.877 0.285 0.194 筋肉 1.277 0.970 0.141 0.082 食道 1.207 0.805 0.155 0.106 卵巣 - 0.944 - 0.170 膵臓 3.180 1.993 0.555 0.511 耳下腺 1.644 1.126 0.286 0.150 副甲状腺 2.251 1.320 < 2BG < BG 下垂体 2.810 1.505 0.442 < 2BG 前立腺 1.526 - 0.288 - 下顎/舌下唾液腺 2.023 1.108 0.269 0.178 皮膚 0.846 0.412 0.118 0.148 脊髄 0.439 0.492 0.229 0.128 脾臓 1.704 0.964 0.327 0.187 精巣 1.205 - 0.360 - 胸腺 0.871 0.355 0.164 0.120 甲状腺 1.342 1.223 0.278 0.163 気管 0.902 0.491 0.150 0.099 子宮 - 0.996 - 0.175 胃 1.90 1.03 0.39 0.52 胃内容物 NS NS 1.14 3.78 十二指腸 1.90 1.28 0.40 0.16 十二指腸内容物 3.40 7.00 2.31 0.63 空腸 2.77 1.31 0.39 0.22 空腸内容物 22.00 15.60 2.37 1.73 回腸 1.92 9.38 0.45 0.32 回腸内容物 5.84 NS 7.03 2.38 大腸 3.12 3.92 2.18 0.39 大腸内容物 21.95 37.57 14.86 2.29 n=1/時点、-:該当せず、NS:サンプルなし、BG レベル:25dpm
2.6.4.4.1.2. 全身オートラジオグラフィー 4.2.2.3.3 雌雄ラットに14C-標識体の 2mg/kg を単回経口投与したときの組織内放射能を QWBA 法で 測定し、放射能分布について検討した(2.6.5.5.2 参照)。 放射能は大部分の組織で投与2 または 6 時間後に最大となった。放射能は消化管を除き、 肝臓、腎臓および膵臓で高かった。そののち、放射能は体内から速やかに消失し、投与12 時間後には大部分の組織で定量下限(1.6µg eq./g)未満となった。 以上のことから、ラットに単回経口投与後の薬物関連物質は広く組織に分布し、体内から 速やかに消失すると考えられた。 2.6.4.4.2. 蛋白結合および血球中への移行 2.6.4.4.2.1. 蛋白結合 2.6.4.4.2.1.1. In vitro 4.2.2.3.1, 4.2.2.3.2 および 4.2.2.3.4 ラットおよびイヌ血漿に14C-標識体の 0.5~250µg/mL、ヒト血漿に14C-標識体および14 C-セチリジンの0.2~5µg/mL を添加したときの血漿蛋白結合率を平衡透析法で測定し、放射能 の蛋白結合について検討した(2.6.5.6.1.1 参照)。 ラット血漿蛋白結合率は0.5~100µg/mL の範囲では約 85~87%であったが、150µg/mL 以 上ではわずかに低下した。イヌ血漿蛋白結合率は0.5~2.0µg/mL の範囲では約 88~91%であ ったが、5µg/mL 以上では濃度依存的に低下した(表 2.6.4-13)。ヒト血漿蛋白結合率は約 92%であった。また、14C-セチリジンを添加したときの ucb P071 の蛋白結合率は約 89%であ 以上により、ラット、イヌおよびヒトでのucb 28556 の血漿蛋白結合率は約 85~92%と中 表 2.6.4-13 ラットおよびイヌにおける14C-標識体の in vitro 血漿蛋白結合率 4.2.2.3.1 の Table 29 および 4.2.2.3.2 の Table 26 より作成 蛋白結合率 (%) 添加濃度 (µg/mL) ラット イヌ (♂) イヌ (♀) 0.5 86.6 #1 90.78 ± 0.57 87.61 ± 0.71 1 86.6 ± 0.7 90.34 ± 1.29 88.43 ± 0.93 2 85.4 ± 1.6 90.79 ± 0.41 88.20 ± 0.31 5 86.6 ± 0.5 89.35 ± 0.19 86.79 ± 0.34 10 86.7 ± 0.7 89.54 ± 0.96 85.63 ± 2.99 20 86.5 ± 0.4 87.97 ± 0.39 84.41 ± 2.40 50 86.5 ± 0.9 85.74 ± 0.45 83.93 ± 2.20 100 85.4 ± 1.0 84.88 ± 0.22 83.13 ± 2.28 150 83.5 ± 0.3 83.45 ± 0.58 83.86 ± 3.76 200 82.4 ± 0.1 82.76 ± 0.59 84.63 ± 2.84 250 81.0 ± 0.5 81.98 ± 0.44 83.03 ± 1.72 平均値±標準偏差 (n=3、#1:n=2) り、ucb 28556 の蛋白結合率は約 93%とgsk002*(約 86%)よりも高かった(表 2.6.4-14)。 等度であった。また、gsk002*の血漿蛋白非結合率は約 14%と ucb 28556(約 7%)の 2 倍 であり、ヒトでのucb 28556 の VdssおよびCLpがgsk002*と異なると考えられた。
表 2.6.4-14 ヒトにおける14C-標識体および14C-セチリジンの in vitro 血漿蛋白結合率 4.2.2.3.4 の Table 12.3 より作成 蛋白結合率 (%) ucb P071 #1 添加濃度 (µg/mL) ucb 28556 ucb P071 ucb 28556 0.2 92.2 ± 0.1 89.3 ± 0.4 86.1 ± 0.9 92.7 ± 1.2 0.5 92.1 ± 0.2 89.1 ± 0.5 86.3 ± 1.7 92.1 ± 1.5 1 91.9 ± 0.3 89.0 ± 0.4 85.3 ± 1.0 92.8 ± 0.7 5 91.6 ± 0.2 #2 89.2 ± 0.2 85.8 ± 1.0 92.7 ± 0.9 平均値 92.0 89.2 85.9 92.6 平均値±標準偏差 (n=6, #2: n=5) #1: セチリジンを添加 2.6.4.4.2.1.2. Ex vivo 4.2.2.3.1 および 4.2.2.3.2 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与、雌雄イヌに14C-標識体の 1mg/kg を単回および 9 日間経口投与したときの血漿蛋白結合率を平衡透析法で測定し、放 射能の血漿蛋白結合について検討した(2.6.5.6.1.2 参照)。 血漿蛋白結合率はラットで82.8~87.3%であり、イヌでは単回投与の雄で 90.0%、雌で 92.2%、反復投与の雄で 93.8%、雌で 89.5%であった。 以上のことから、ラットに14C-標識体を経口投与したときのレボセチリジンの ex vivo 血漿 蛋白結合率は in vitro の結果(2.6.4.4.2.1.1 参照)と同程度であると考えられた。また、イヌ の血漿蛋白結合に性差および投与期間による影響はないと考えられた。 2.6.4.4.2.2. 結合蛋白の検討 4.2.2.3.5 ヒト血漿、HSA、HSA-NEFA、α1-AGP、γ-グロブリン、VLDL、LDL および HDL に14 C-標識体(最終濃度122~5272nM)を添加したときの蛋白結合率を平衡透析法で測定し、放射 能の結合蛋白について検討した(2.6.5.6.1.3 参照)。 血漿蛋白結合率は約91%であった。また、HSA、HSA-NEFA、α1-AGP、γ-グロブリン、 VLDL、LDL および HDL に対する蛋白結合率はそれぞれ約 98、89、45、13、9、23 および 52%であった。
以上のことから、ucb 28556 はおもに HSA に結合し、一部は HDL およびα1-AGP にも結合 すると考えられた。 2.6.4.4.2.3. 結合部位の検討 4.2.2.3.5 HSA(40µM)に14C-標識体(最終濃度 0.558~153µM)およびワルファリンまたはジアゼ パム(300µM)を添加したときの放射能の HSA に対する結合率を平衡透析法で測定し、結 合部位について検討した(2.6.5.6.1.4 参照)。 gsk002* * 新薬承認情報提供時に置き換え
放射能のHSA に対する Kaは約11mM-1であった。KaはHSA のサイトⅠに結合するワルフ ァリンの存在下では約15mM-1であったが、サイトⅡに結合するジアゼパムの存在下では約 1.8mM-1に低下した。 以上のことから、ucb 28556 は HSA のサイトⅡに結合すると考えられた。 2.6.4.4.2.4. 血球中への移行 4.2.2.3.5 ヒト血球に14C-標識体(最終濃度 216~5391nM)を添加したときの放射能の血球中への移 行について検討した(2.6.5.6.2 参照)。 放射能のヒト血球結合率は27.4%であった。 以上のことから、ucb 28556 はヒト血球中には移行しないと考えられた。なお、ヒトに 14C-標識体を投与したときの放射能は血球とほとんど結合しないことが確認されている (5.3.3.1.3/ref)。 2.6.4.4.3. 胎盤通過および胎児への移行 4.2.2.3.1 妊娠ラット(妊娠14 日)に14C-標識体の 2mg/kg を単回経口投与したときの母動物での血 漿、羊水、胎盤および胎児中放射能をLSC 法で測定し、放射能の胎盤通過および胎児への 移行について検討した(2.6.5.7.1 参照)。 母動物の血漿中放射能は投与1 時間後に最大となった(表 2.6.4-15)。放射能は羊水、胎 盤および胎児でも検出されたが、投与24 時間後には 0.1µg eq./g 未満となった。 以上のことから、妊娠ラットで薬物関連物質は胎盤を通過し、胎児に移行すると考えられ た。 表 2.6.4-15 妊娠ラットに14 C-標識体の 2mg/kg を単回経口投与したときの組織内放射能 4.2.2.3.1 の Table 11 より作成 組織内放射能 (µg eq./g または mL) 組織 0.5hr 1hr 2hr 4hr 8hr 12hr 24hr 48hr 血漿 0.869 1.377 0.991 0.201 0.389 0.037 0.032 < 2BG 羊水 0.100 0.139 0.135 0.058 0.191 < BG < BG < BG 胎盤 0.348 0.885 1.028 0.271 0.482 0.053 0.078 < 2BG 胎児 0.105 0.290 0.346 0.081 0.149 0.019 0.034 < BG n=1/時点、BG レベル:25dpm 2.6.4.4.4. その他の分布試験 2.6.4.4.4.1. 有機イオントランスポーターによる輸送 4.2.2.3.6/ref ラットのOat1(rOat1)、Oct1(rOct1)、Oatp1a1(rOatp1a1)、Oatp1a4(rOap1a4)、 Oatp1a5、Oatp1b2(rOatp1b2)およびヒトの OAT1(hOAT1)、OAT3(hOAT3)、OAT4 (hOAT4)、OCT1(hOCT1)、OATP1A2、OATP2B1、OATP1B1、OATP1B3 の発現系を用 いて、ucb 28556 の輸送に関与するトランスポーターについて検討した(2.6.5.8.1 参照)。
ucb 28556 は、rOatp1a5(VmaxおよびKm:43pmol/mg/min および 4µM)、hOAT4 および OATP1A2(VmaxおよびKm:14pmol/mg/min および 4µM)で中程度輸送されたが、rOat1、 rOct1、rOatp1a1、rOatp1a4、rOatp1b2、hOAT1、hOAT3、hOCT1、OATP2B1、OATP1B1 お よびOATP1B3 では輸送されなかった。 以上により、レボセチリジンはrOatp1a5、hOAT4 および OATP1A2 により輸送されたが、 ヒト肝臓での胆汁排泄トランスポーター(OATP1B1 および OATP1B3)および腎臓での排泄 トランスポーター(hOAT1、hOAT3 および hOCT1)では輸送されないことが示された。 2.6.4.4.4.2. 膜透過および Pgp による輸送 4.2.2.3.7 Caco-2 細胞を用いて、レボセチリジン(5~100µM)の膜透過性およびキニジン非存在/ 存在下でのPgp 輸送について検討した(2.6.5.8.2 および 2.6.5.8.3 参照)。 レボセチリジンの受動拡散は中程度(Papp:4.38×10-6cm/s)であった。レボセチリジンの efflux 比は 1.32~1.98 と basolateral から apical への輸送の方が apical から basolateral への輸送 よりも大きかった。また、レボセチリジンの Pgp による輸送はキニジン存在下で阻害された。 以上のことから、レボセチリジンはPgp の弱い基質であると考えられた。 2.6.4.4.4.3. ヒト Pgp 阻害作用 4.2.2.3.7 Caco-2 細胞を用いて、レボセチリジン(1~100µM)の Pgp を介したジゴキシン輸送に対 する阻害作用について検討した(2.6.5.8.4 参照)。 レボセチリジンはPgp を介したジゴキシン輸送を 100µM の濃度まで阻害しなかった。 以上のことから、臨床でレボセチリジンとPgp で輸送される薬剤を併用投与する際に薬物 動態学的薬物相互作用が発現する可能性は低いと考えられた。 2.6.4.5. 代謝 2.6.4.5.1. In vitro 試験 2.6.4.5.1.1. 肝ミクロソームによる代謝 4.2.2.4.1 および 4.2.2.4.2 媒体またはデキサメタゾンを投与した雄ラットより調製した肝ミクロソームに14C-標識体 (最終濃度13µM、6µg/mL)を添加し、NADPH 存在下で 1 時間インキュベートした。生成 した代謝物をradio-HPLC 法で分析し、in vitro 代謝について検討した(2.6.5.10.1 参照)。ま
ン(1~500µM)を添加し、最大 1 時間インキュベートした。生成した代謝物を LC/MS/MS 法で分析し、in vitro 代謝について検討した(2.6.5.10.1 参照)。 ラットでucb 28556 は 4%が代謝され、1 種の代謝物(M5’)が検出された。デキサメタゾ ン処理ラットでは10%が代謝され、2 種の代謝物(M5’および M10’)が検出された(表 2.6.4-16)。 た、ヒト肝ミクロソームにレボセチリジンならびにgsk002*(二塩酸塩)およびセチリジ * 新薬承認情報提供時に置き換え
表 2.6.4-16 NADPH 存在下のラット肝ミクロソームと14C-標識体をインキュベートした際 の代謝物の生成(クロマトグラム上のピーク面積 (%)) 4.2.2.4.1 の Table 3 より作成 代謝物 M5’ M10’ ucb 28556 対照群 4 ND 96 デキサメタゾン処理群 8 2 90 ND:検出されず ヒト肝ミクロソームでレボセチリジンを1 時間インキュベートしたときには、代謝物はほ とんどみられなかったが、フェニル基の水酸化体(ucb 34695 および MU)、N-脱アルキル 体(ucb 29738)、O-脱アルキル体(ucb 1410 および P026)および N-酸化体がわずかに検出 2.6.4-17)。 セチリジンの代謝速度パラメータ 4.2.2.4.2 の Table 5 より作成 代謝物 添加薬物 Km (µM) Vmax (pmol/min/mg 蛋白質) CLint (µL/min/mg 蛋白質) レボセチリジン 126 ± 16 26 ± 1 0.206 144 ± 20 28 ± 2 0.194 ucb 34695 セチリジン 167 ± 4 27 ± 0 0.162 レボセチリジン 495 ± 127 15 ± 2 0.030 257 ± 51 16 ± 1 0.062 MU セチリジン 178 ± 19 18 ± 1 0.101 レボセチリジン NC NC 0.036 #1 692 ± 61 45 ± 3 0.065 ucb 29738 セチリジン 645 ± 64 41 ± 3 0.064 レボセチリジン NC NC 0.017 #1 1153 ± 224 33 ± 5 0.029 ucb 1410 セチリジン 703 ± 80 22 ± 2 0.031 レボセチリジン 303 ± 201 5 ± 2 0.017 266 ± 65 6 ± 1 0.023 P026 セチリジン 542 ± 93 9 ± 1 0.017 平均値±標準誤差 NC:算出せず (飽和がみられなかったため、パラメータを正確に算出できなかった。) #1:in vitro での CLintはMichaelis-Menten 曲線の傾きから、その他は Vmax/Km比より算出した。
された(図 2.6.4-4)。また、ucb 28556 およびgsk002*のVmaxはいずれも同程度であった が、gsk002*のCLintはMU、ucb 29738 およびucb 1410 でucb 28556 の約 2 倍であった(表
表 2.6.4-17 ヒト肝ミクロソームにおけるレボセチリジン、gsk002*(二塩酸塩)および gsk002* (二塩酸塩) gsk002* (二塩酸塩) gsk002* (二塩酸塩) gsk002* (二塩酸塩) gsk002* (二塩酸塩) * 新薬承認情報提供時に置き換え
N N O CO2H Cl N N O CO2H Cl N NH Cl N N O CO2H Cl O H N N O CO2H Cl N N OH Cl N N Cl CO 2H O H O ucb 29738 MU ucb 34695 N-酸化体 ucb 1410 P026 ucb 28556 図 2.6.4-4 ヒト肝ミクロソームでの ucb 28556 の推定代謝経路 4.2.2.4.2 の図 14 より作成 以上のことから、ラットおよびヒト肝ミクロソームでucb 28556 は代謝されにくいものと 考えられた。また、デキサメタゾン処理ラットの肝ミクロソームで代謝物の生成量が増加し たことから、ucb 28556 は一部 CYP で代謝されると考えられた。さらに、ヒト肝ミクロソー 2.6.4.5.1.2. 肝細胞による代謝 4.2.2.4.1 雄ラットの肝細胞に14C-標識体(最終濃度 5 および 50µM)を添加し、37℃で 24 時間イン キュベートした。生成した代謝物をradio-HPLC 法で分析し、in vitro 代謝について検討した (2.6.5.10.2 参照)。 代謝物の生成率は5µM 群で約 87%、50µM 群で約 10%であった(図 2.6.4-5)。無処理群 では8 種のピークがクロマトグラム上で確認された。また、肝細胞抽出液を β-グルクロニダ ーゼおよびスルファターゼで処理した群(酵素処理群)のクロマトグラム上のピーク面積は 無処理群と比べてM2’、M3’、M4’、M11’および M12’が減少し、M1’、M5’、M6’、M7’、 M8’、M9’および M10’が増加した(表 2.6.4-18)。 以上のことから、ラットでのucb 28556 の代謝は高濃度で飽和すると考えられた。また、 ラットでucb 28556 は一部がグルクロン酸および硫酸抱合体に代謝されると考えられた。 ムでのgsk002*の CLintはMU、ucb 29738 および ucb 1410 で ucb 28556 の約 2 倍であったこ とから、gsk002*の代謝速度は ucb 28556 よりも速いと考えられた。
0 25 50 75 100 0 8 16 24 反 応時 間 (hr) 反応 液中の 割合 ( % ) 0 25 50 75 100 0 8 16 24 反 応時間 (hr) 反応 液中の 割合 ( % ) ucb 28556 M1 M2 M3 (a) 5µM (b) 50µM 図 2.6.4-5 ラット肝細胞(Hep191)と14 C-標識体をインキュベートした際の 反応液中の代謝物の割合 4.2.2.4.1 の Table 1 より作成 表 2.6.4-18 ラット肝細胞(Hep192)と14 C-標識体をインキュベートした際の 代謝物の生成(クロマトグラム上のピーク面積 (%)) 4.2.2.4.1 の Table 2 より作成 代謝物 M1’ M2’ M3’ M4’ M5’ M6’ M7’ M8’ M9’ M10’ M11’ M12’ 無処理群 4 29 14 2 13 ND ND 6 ND ND 7 25 酵素処理群 6 ND ND ND 36 18 10 16 5 9 ND ND ND:検出されず 無処理群:リン酸緩衝液 (pH 7.4)、酵素処理群:β-グルクロニダーゼ/スルファターゼ処理 (pH 4.5) 2.6.4.5.2. In vivo 試験 2.6.4.5.2.1. ラット 2.6.4.5.2.1.1. 尿糞中代謝物 4.2.2.4.3 雌雄ラットに14C-標識体の 2 および 25mg/kg を単回経口投与したときの投与 48 時間後ま での尿糞中代謝物をradio-HPLC および LC/MS/MS 法で分析し、ラットでのレボセチリジン の in vivo 代謝について検討した(2.6.5.9.1 参照)。 放射能の尿中排泄率は2mg/kg 群の雄で約 8%(投与量に対する割合)、雌で約 14%であ り、25mg/kg 群の雄で約 12%、雌で約 37%であった(表 2.6.4-19)。また、ucb 28556 の尿糞 中排泄率は2mg/kg 群の雄で約 11%、雌で約 42%であり、25mg/kg 群の雄で約 29%、雌で約 81%であった。尿糞中には 20 種以上の代謝物が検出され、12 種が同定された。主代謝経路 はクロロベンズヒドリル基の N-脱アルキル化であり、主代謝物は 4-クロロ-4’-水酸化ベンズ ヒドリル硫酸(尿糞中排泄率の最大約40%、図 2.6.4-6 の XIII)であった。その他に水酸化 メトキシ体(最大約13%、図 2.6.4-6 の IV)および p-水酸化体(未定量、図 2.6.4-6 の II)の 存在も確認された。尿糞中代謝物は2mg/kg 群の雄で約 93%、雌で約 55%であり、25mg/kg 群の雄で約58%、雌で約 13%であった。
以上のことから、ラットでのucb 28556 の主代謝経路はクロロベンズヒドリル基の N-脱ア ルキル化であると考えられた。また、雌雄での尿糞中代謝物の総計は2mg/kg 群の方が 25mg/kg 群よりも大きかったことから、2~25mg/kg の範囲で代謝が飽和すると考えられた。 さらに、雄での代謝物の総計が雌よりも大きかったことから、ucb 28556 の代謝に性差があ ると考えられた。 表 2.6.4-19 ラットに14 C-標識体を単回経口投与したときの尿糞中代謝物 (投与量に対する割合(%)) 4.2.2.4.3 の Table 7~13 より作成 2mg/kg 25mg/kg ♂ ♀ ♂ ♀ 代謝物 尿 糞 尿 糞 尿 糞 尿 糞 回収率 #1 8.2 103.9 13.7 83.1 11.8 80.7 37.4 58.0 ucb 28556 0.5 10.8 3.8 37.8 6.0 23.0 35.2 46.2 4-クロロ-4’-水酸化ベンズヒドリル メルカプツール酸 1.6 ND 4.1 ND 1.2 ND 0.7 ND 4-クロロ-4’-水酸化ベンズヒドロール 0.2 2.7 0.8 2.0 0.6 2.0 0.3 0.7 4-クロロ-4’-水酸化ベンズヒドリル硫酸 4.7 34.8 3.7 18.6 3.0 29.1 0.7 7.0 水酸化メトキシ体 ND 13.4 ND 0.9 ND 1.4 ND 0.0 N-(4-クロロ-4’-水酸化ベンズヒドリル) 尿素 0.3 ND 0.3 ND 0.3 1.1 0.1 0.3 S-(クロロ水酸化ベンズヒドリル) メチルスルホキシド ND 7.0 ND 4.9 ND 6.8 ND 0.7 4-クロロ-4’-水酸化ベンゾフェノン 0.0 20.6 0.04 8.6 0.0 9.0 0.0 1.9 クロロ水酸化ベンズヒドリル体 #2 0.1 8.0 0.4 7.9 0.1 3.6 0.0 0.9 代謝物の小計 6.9 86.5 9.3 42.9 5.2 53.0 1.8 11.5 尿糞中代謝物の総計 93.4 55.2 58.2 13.3 平均値 (n=2)、#1:0~48 時間、#2:部分的に同定された、ND:検出されず 2.6.4.5.2.2. イヌ 2.6.4.5.2.2.1. 血漿、尿糞および胆汁中代謝物 4.2.2.4.4 雌雄イヌに14C-標識体の 1mg/kg を単回または 8 日間経口投与したときの血漿、尿糞およ び胆汁中代謝物をradio-HPLC、LC/MS および LC/MS/MS 法で分析し、イヌでのレボセチリ ジンの in vivo 代謝について検討した(2.6.5.9.2 および 2.6.5.9.3 参照)。 血漿中にはおもに ucb 28556 が検出された。その他には 2 種の代謝物がわずかに検出され、 それらはucb 28556 のタウリン抱合体および未同定の成分であった。雌雄での投与 1 日の尿 糞中のおもな成分はucb 28556 であり、その他に二水素一水酸化体のグルクロン酸抱合体お よびシステイン抱合体(図 2.6.4-6 の V および VI)ならびに ucb 28556 の二水酸化体、p-水 酸化体(図 2.6.4-6 の II)、水酸化メトキシ体(図 2.6.4-6 の IV)、システイン抱合体および タウリン抱合体(図 2.6.4-6 の VII)が検出された(表 2.6.4-20)。投与 8 日の ucb 28556 の尿 糞中排泄率は雄で約58%(投与量に対する割合、以下同様)、雌で約 70%であった。雄の糞 中にはucb 28556 の p-水酸化体、水酸化メトキシ体およびタウリン抱合体が検出され、これ
らの排泄率は投与1 日よりも大きかった。また、胆汁中の ucb 28556 は 0.2~2.2%であり、 その他に6 種類以上の代謝物が検出された。 以上のことから、イヌに単回投与したときのucb 28556 は代謝されにくいものと考えられ た。イヌでの主代謝経路はタウリン抱合および芳香環の酸化であり、タウリン抱合体は直接、 芳香環の酸化体は抱合後に排泄された。また、雌雄での尿糞中代謝物の割合はいずれも同程 度であったことから、ucb 28556 のイヌでの代謝に性差はないと考えられた。 表 2.6.4-20 イヌに14 C-標識体を反復経口投与したときの尿糞中代謝物 (投与量に対する割合(%)) 4.2.2.4.4 の Table 12, 37 および 38 より作成 投与1 日 投与8 日 ♂ ♀ ♂ ♀ 代謝物 尿 糞 尿 糞 尿 糞 尿 糞 回収率 #1 18.3 20.3 22.9 17.3 24.8 66.9 28.8 93.6 ucb 28556 15.6 13.0 20.1 6.8 21.2 37.1 26.0 44.2 二水素一水酸化体のグルクロン酸抱合体 およびシステイン抱合体 0.8 0.0 0.6 1.2 0.9 0.0 0.4 0.0 二水素一水酸化体のシステイン抱合体 0.7 0.0 0.4 3.3 0.9 0.0 0.2 8.8 二水酸化体およびシステイン抱合体 0.2 0.0 0.2 0.0 0.5 0.0 0.2 0.0 p-水酸化体および水酸化メトキシ体 0.2 4.3 0.2 4.2 0.1 20.6 0.2 24.3 タウリン抱合体 0.4 2.9 0.6 2.0 0.5 9.2 0.6 14.5 代謝物の小計 2.3 7.2 2.0 10.7 2.9 29.8 1.6 47.6 尿糞中代謝物の総計 9.5 12.7 32.7 49.2 平均値 (n=2)、#1:0~24 時間 2.6.4.5.3. 代謝酵素の同定 4.2.2.4.2 ヒト肝ミクロソームおよびCYP 発現系での ucb 28556 の代謝に関与する CYP 酵素を同定 した(2.6.5.10.1 参照)。
ヒト肝ミクロソームでMU、ucb 29738、ucb 1410 および P026 の生成と CYP3A4 活性との 間には高い相関性(p<0.005)が認められ、ucb 34695 および MU の生成と CYP2C9 活性、 ucb 1410 の生成と CYP2A6 活性との間にも相関性(p<0.05)がみられた(表 2.6.4-21)。ま た、CYP 発現系での ucb 34695 の生成には CYP2C8 および CYP2C9 が、MU の生成には複数 のCYP 分子種が関与した。ucb 29738 および ucb 1410 はおもに CYP3A4 で生成した(表 2.6.4-22)。なお、ケトコナゾール(CYP3A4 阻害薬)の添加で ucb 29738、ucb 1410 および P026 の生成は 87%以上阻害された(表 2.6.4-23)。 以上のことから、ヒトでのレボセチリジンの N-および O-脱アルキル体の生成には CYP3A4 が、その他の代謝には複数の CYP 分子種(未同定)が関与すると考えられた。し かしながら、レボセチリジンは in vitro で代謝されにくいこと(2.6.4.5.1.1 参照)から、レボ セチリジンとCYP3A4 活性を阻害・誘導する薬剤と併用する際に薬物動態学的薬物相互作用 が発現する可能性は低いと考えられた。