ラジカット
®
注
30mg
ラジカット
®
点滴静注バッグ
30mg
製造販売承認事項一部変更承認申請書
添付資料
第
2 部(モジュール 2)
2.5 臨床に関する概括評価
田辺三菱製薬株式会社
目次
略語・略号一覧 ... 4 2.5 臨床に関する概括評価 ... 6 2.5.1 製品開発の根拠 ... 6 2.5.1.1 薬理学的分類の特定 ... 6 2.5.1.2 治療,予防,診断の目標となる疾患(目標適応症)の臨床的/病態生理学 的側面 ... 6 2.5.1.2.1 ALS の病態 ... 6 2.5.1.2.2 ALS の治療の現状と問題点 ... 10 2.5.1.3 目標適応症に対して申請医薬品の試験を行ったことを支持する科学的背景 . 11 2.5.1.4 臨床開発計画 ... 11 2.5.1.4.1 臨床開発の経緯 ... 12 2.5.1.4.2 臨床データパッケージ ... 16 2.5.2 生物薬剤学に関する概括評価 ... 18 2.5.3 臨床薬理に関する概括評価 ... 19 2.5.4 有効性の概括評価 ... 20 2.5.4.1 有効性を裏付ける試験の概略 ... 20 2.5.4.1.1 対象集団 ... 21 2.5.4.1.2 臨床試験デザイン ... 26 2.5.4.1.3 有効性評価項目 ... 29 2.5.4.1.4 部分集団の検討 ... 30 2.5.4.2 有効性の全般的結果 ... 31 2.5.4.2.1 検証的試験 2(MCI186-19 試験) ... 34 2.5.4.2.2 検証的試験(MCI186-16 試験) ... 40 2.5.4.2.3 継続試験(MCI186-17 試験) ... 41 2.5.4.2.4 探索的試験(ALS 重症度分類 3 度)(MCI186-18 試験) ... 41 2.5.4.2.5 探索的試験(第 II 相)(MCI186-12 試験) ... 41 2.5.4.2.6 全有効性試験の結果の比較検討 ... 42 2.5.4.3 推奨用法・用量に関する臨床情報の解析 ... 46 2.5.4.3.1 治療期間に関する検討 ... 46 2.5.4.3.2 用量に関する検討 ... 47 2.5.4.3.3 薬物相互作用に関する検討 ... 47 2.5.4.4 効果の持続,耐薬性 ... 47 2.5.4.5 有効性の結論・まとめ ... 48 2.5.5 安全性の概括評価 ... 542.5.5.1 安全性評価計画 ... 54 2.5.5.2 曝露状況 ... 56 2.5.5.3 人口統計学的特性及びその他の特性 ... 58 2.5.5.4 有害事象 ... 59 2.5.5.4.1 有害事象の概要 ... 59 2.5.5.4.2 比較的よく見られる有害事象 ... 61 2.5.5.5 死亡,その他の重篤及び他の重要な有害事象 ... 61 2.5.5.5.1 死亡 ... 61 2.5.5.5.2 その他の重篤な有害事象 ... 62 2.5.5.5.3 その他の重要な有害事象 ... 62 2.5.5.5.4 肝機能障害及び腎機能障害に関連する有害事象 ... 63 2.5.5.6 臨床検査値 ... 63 2.5.5.7 バイタルサイン ... 64 2.5.5.8 心電図 ... 64 2.5.5.9 血液ガス検査 ... 64 2.5.5.10 感覚検査 ... 64 2.5.5.11 特別な患者集団及び状況下における安全性 ... 65 2.5.5.11.1 内因性要因 ... 65 2.5.5.11.2 外因性要因 ... 65 2.5.5.11.3 薬物相互作用 ... 66 2.5.5.11.4 妊娠及び授乳時の使用 ... 66 2.5.5.11.5 過量投与 ... 66 2.5.5.11.6 薬物乱用 ... 66 2.5.5.11.7 離脱症状及び反跳現象 ... 66 2.5.5.11.8 自動車運転及び機械操作に対する影響又は精神機能の障害 ... 66 2.5.5.12 市販後使用経験 ... 66 2.5.5.13 安全性のまとめ ... 67 2.5.6 ベネフィットとリスクに関する結論 ... 69 2.5.6.1 ベネフィット ... 69 2.5.6.2 リスク ... 72 2.5.6.3 結論 ... 73 2.5.7 参考文献 ... 74
略語・略号一覧
略語・略号 略していない表現(英語) 略していない表現(日本語)
ALS Amyotrophic lateral sclerosis 筋萎縮性側索硬化症
ALSAQ40 ALS assessment questionnaire (40 items) ALS(の 40 項目の)評価質問表
ALSFRS-R Revised ALS Functional Rating Scale 改訂ALS 機能評価尺度
AMPA α-amino-3-hydroxy-5-methyl-4-
isoxazolepropionic acid
α-アミノ-3-ヒドロキシ-5-メチル -4-イソキサゾールプロピオン酸
BDNF Brain-derived neurotrophic factor 脳由来神経栄養因子
CNTF Ciliary neurotrophic factor 毛様体神経栄養因子
C9ORF72 Chromosome 9 open reading frame 72 -
CYP Cytochrome P450 チトクロームP450
EESP Efficacy Expected Sub-population -
EMG Electromyography 筋電図
FALS Familial amyotrophic lateral sclerosis 家族性筋萎縮性側索硬化症
FAS Full analysis set 最大の解析対象集団
FUS Fused in sarcoma -
GluR2 Glutamate receptor 2 AMPA 型グルタミン酸受容体サ
ブユニット 2
4-HNE 4-Hydroxy-2-nonenal 4-ヒドロキシ-2-ノネナール
ICH International Conference on Harmonisation
of Technical Requirements
for Registration of Pharmaceuticals for Human Use
日米EU 医薬品規制調和国際会議
LMN Lower motor neuron 下位運動ニューロン
LOCF Last observation carried forward -
LSMean Least squared means 最小二乗平均
MedDRA Medical dictionary for regulatory activities ICH 国際医薬用語集
MedDRA/J Medical dictionary for regulatory activities / Japanese
ICH 国際医薬用語集日本語版
NF-κB Nuclear factor-kappa B -
3NT 3‐Nitrotyrosine 3‐ニトロチロシン
OZ Ozagrel sodium オザグレルナトリウム
PaCO2 Arterial carbon dioxide tension 動脈血二酸化炭素分圧
PT Preffered term (MedDRA の)基本語
QOL Quality of life 生活の質
SALS Sporadic amyotrophic lateral sclerosis 孤発性筋萎縮性側索硬化症
S.D. Standard deviation 標準偏差
S.E. Standard error 標準誤差
SOC System organ class (MedDRA の)器官別大分類
SOD1 Cu/Zn superoxide dismutase 1 スーパーオキシドジスムターゼ
1
TDP43 Transactivation responsive region DNA-
binding protein 43 kDa
略語・略号 略していない表現(英語) 略していない表現(日本語) UGT Uridine-5’-diphospho-α-D-
glucuronosyltransferase
ウリジン-5’-二リン酸-α-D-グルク ロン酸転移酵素
UMN Upper motor neuron 上位運動ニューロン
VCP Valosin-containing protein -
2.5 臨床に関する概括評価
2.5.1 製品開発の根拠 2.5.1.1 薬理学的分類の特定 MCI-186(一般名:エダラボン,販売名:ラジカット注 30 mg,ラジカット点滴静注バッグ 30 mg,以下,本剤)は,田辺三菱製薬株式会社にて創製されたフリーラジカルスカベンジ ャーである.本剤は,in vitro において血管内皮細胞の傷害抑制作用を示し,in vivo において静脈内投 与により脳虚血動物(ラット)で脳浮腫抑制作用,組織障害保護作用,神経症候軽減作用, 遅発性神経細胞死抑制作用等が認められている.筋萎縮性側索硬化症(以下,ALS)に対し ても,神経細胞の酸化的障害を抑制することで病勢進展の抑制を示すことが期待される. 2.5.1.2 治療,予防,診断の目標となる疾患(目標適応症)の臨床的/病態生理学的側面 2.5.1.2.1 ALS の病態 2.5.1.2.1.1 病因 ALS は原因不明の疾患であるが,発症や進行には様々な仮説が報告されている.運動ニュ ーロン傷害のメカニズムについては,グルタミン酸過剰放出やトランスポーター異常による 興奮毒性,構造異常や分解系(オートファジー等)の機能異常による変異たん白の蓄積やそ の結果生じる小胞体ストレス,アポトーシスを誘発するミトコンドリア傷害,ニューロフィ ラメントの凝集や軸索輸送障害等が報告されており,フリーラジカルによる酸化ストレスの 関与もその一つである1),2),3).
ALS のうち約 5%は家族歴を伴い,家族性筋萎縮側索硬化症(Familial amyotrophic lateral sclerosis;以下,FALS)とよばれる.FALS の約 2 割では,フリーラジカルを処理する酵素で
あるCu/Zn superoxide dismutase(以下,SOD1)遺伝子の変異が報告されている4).
FALS 以外の ALS は孤発性筋萎縮性側索硬化症(Sporadic amyotrophic lateral sclerosis;以下, SALS)とよばれ,その原因はフリーラジカルの関与やグルタミン酸受容体のサブタイプであ るα-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸(以下,AMPA)受容体を
介したグルタミン酸により神経障害をきたすという仮説が有力である.ヒトALS 運動ニュー
ロンではそのAMPA 受容体のサブユニットである AMPA 型グルタミン酸受容体サブユニッ
ト 2(以下,GluR2 Q/R)部位の RNA 編集率が低下しており,SALS の病態に重要な役割を
果たしていることが報告されている5).
その他にALS 患者で Transactivation responsive region DNA-binding protein 43 kDa(TDP43), Fused in sarcoma(FUS),angiogenin, Valosin-containing protein(VCP),senataxin,optineurin,
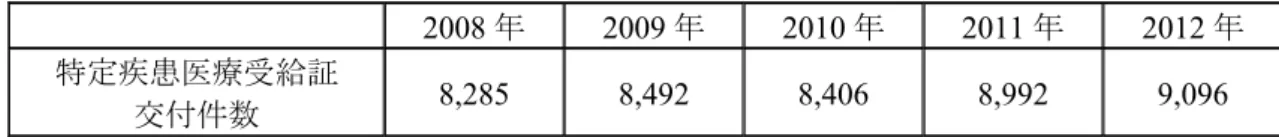
細胞内シグナル伝達に重要な役割を果たす Nuclear factor-kappa B(NF-κB)を制御する optineurin 遺伝子の変異が新たな原因遺伝子であること等が報告されている7). また,FALS,SALS 共に脳脊髄液中や血漿中等の 3‐Nitrotyrosine(以下,3NT)や 4-Hydroxy-2-nonenal(4-HNE)の上昇が確認されており8),9),これらの発生は・OH や ONOO -のフリーラジカルによる DNA やたん白質,脂質の酸化反応亢進によるものと考えられ,フ リーラジカルが細胞に傷害を与え細胞を死へ導く要因となっている可能性がある. 2.5.1.2.1.2 症状 ALS は主に 60 歳代から 70 歳代の発症が最も多く,一次運動ニューロン(上位運動ニュー ロン)と二次運動ニューロン(下位運動ニューロン)が選択的かつ進行性に変性・消失する. 主な症状は,筋萎縮と筋力低下であり,進行すると上肢の機能障害,歩行障害,構音障害, 嚥下障害,呼吸障害等が生じる.一般に感覚障害,膀胱直腸障害,眼球運動障害,褥瘡はみ られない. 一次運動ニューロン障害の症候として,痙縮,腱反射亢進,病的反射(ホフマン徴候陽性, バビンスキー徴候陽性,腹壁反射消失等)等の出現がみられ,二次運動ニューロン障害の症 候として,筋力低下,筋萎縮,線維束性収縮等が認められる.発語,嚥下に関与する筋を支 配する運動ニューロンが障害されると,構音障害,嚥下障害をきたし,呼吸筋を支配する運 動ニューロンが障害されると呼吸障害を起こす.病初期には二次運動ニューロン障害,もし くは一次運動ニューロン障害のみが前景となることがあるが,最終的には一次運動ニューロ ンと二次運動ニューロンが共に障害される.ただし,二次運動ニューロン症候が強い場合に は,一次運動ニューロン症候が覆い隠される傾向がある. 2.5.1.2.1.3 予後 症状の進行は比較的急速で,人工呼吸器を用いなければ生存期間は通常2~5 年と言われて いる10).進行は個人差が非常に大きく,球麻痺発症型では3 ヶ月以内で死亡する場合もある. 近年は,リルゾール(リルテック)や積極的な栄養補助療法,非侵襲的換気補助等の治療の 進歩やケアの改善により,生存期間が延長している可能性もある11). 2.5.1.2.1.4 患者数 近年の情報として難病情報センターのホームページ(http://www.nanbyou.or.jp)に掲載され ている2008 年から 2012 年までの ALS の特定疾患医療受給者証交付件数を表 2.5.1.2-1に示 した.2012 年の交付件数は 9,096 件であった. ALS 患者の発病率は年齢とともに増大して 60~70 歳代にかけてピークに達し,以降再び 低下する.性別では発症率,有病率ともに男性が女性より高く,おおむね1.3~1.4 倍である.
表 2.5.1.2-1 ALS の受給者証交付件数
2008 年 2009 年 2010 年 2011 年 2012 年 特定疾患医療受給証
交付件数 8,285 8,492 8,406 8,992 9,096
2.5.1.2.1.5 診断基準
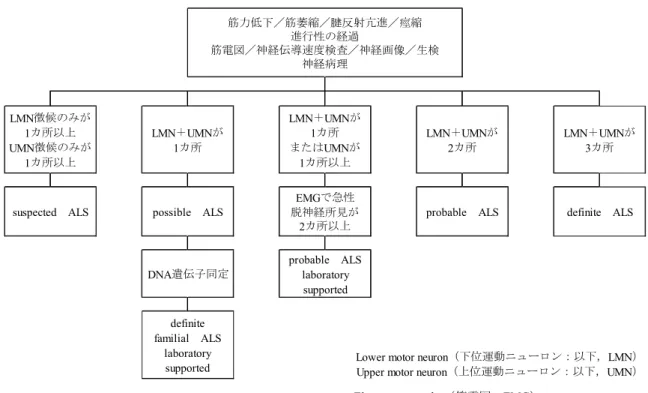
現在,国際的に最も標準的なALS 診断基準は,1998 年に提唱された El Escorial 改訂 Airlie
House 診断基準(世界神経学会運動ニューロン疾患研究委員会)である(図 2.5.1.2-1).本
診断基準では,早期に本症を診断し治療的研究を行うためには,病像が十分に完成しない段 階,あるいは運動ニューロン系が荒廃しない早期に診断できることが望まれることから,診
断確実性にグレードをつける試みが行われている.その結果,以下の5 つのグレードが提唱
されている.
1. 臨床的に確実な筋萎縮性側索硬化症(clinically definite ALS)とは,身体 3 部位において 上位運動ニューロンと下位運動ニューロン障害の臨床所見があること.
2. 臨床的に可能性大な筋萎縮性側索硬化症(clinically probable ALS)とは,少なくとも身
体2 部位において上位・下位運動ニューロン障害所見があり,さらにここの下位運動ニュ ーロン障害のレベルよりも頭側において上位運動ニューロン障害所見があること. 3. 臨床的に可能性大であり検査所見で裏づけられる筋萎縮性側索硬化症(clinically probable-laboratory-supported ALS)とは,臨床的に上位・下位運動ニューロン障害所見が 身体1 部位にのみ認めるか,身体 1 部位に上位運動ニューロン障害所見がある場合で, かつ2 肢以上に針筋電図で下位運動ニューロン障害所見を認め ,神経画像検査やその他 の検査によって他疾患を除外できるもの.
4. 臨床的に筋萎縮性側索硬化症の可能性あり(clinically possible ALS)とは,身体 1 部位の みに下位と上位運動ニューロン障害所見を認めるか,もしくは下位運動ニューロン障害
のみを身体2 部位以上に認めるものである.または上位運動ニューロン障害よりも頭側
で下位運動ニューロン障害所見があるもの.第3 の臨床的に可能性大であり検査所見で
裏づけられる筋萎縮性側索硬化症(clinically probable-laboratory-supported ALS)がここで は満たされないものであるが,他疾患は除外できているものと規定する.
5. 臨床的に筋萎縮性側索硬化症疑い(clinically suspected ALS)とは,純粋な下位運動ニュ ーロン障害を呈するものであり,筋萎縮性側索硬化症の臨床研究を目的とするグループ
として適さない.よって世界神経学会El Escorial 改訂 Airlie House 診断基準からは除外
Electromyography(筋電図:EMG)
図 2.5.1.2-1 El Escorial 改訂 Airlie House 診断基準(抜粋)
本邦においては厚生省(現厚生労働省)研究班において作成されたALS 診断基準がある.
最新の改訂は2003 年に El Escorial 改訂 Airlie House 診断基準を基に行われ,厚生労働省の
特定疾患治療研究事業における認定基準として用いられている(表 2.5.1.2-2).
Lower motor neuron(下位運動ニューロン:以下,LMN) Upper motor neuron(上位運動ニューロン:以下,UMN) 筋力低下/筋萎縮/腱反射亢進/痙縮 進行性の経過 筋電図/神経伝導速度検査/神経画像/生検 神経病理 LMN+UMNが 1カ所 LMN+UMNが 1カ所 またはUMNが 1カ所以上 LMN+UMNが 2カ所 LMN+UMNが 3カ所 possible ALS EMGで急性 脱神経所見が 2カ所以上
probable ALS definite ALS
DNA遺伝子同定 probable ALS laboratory supported definite familial ALS laboratory supported suspected ALS LMN徴候のみが 1カ所以上 UMN徴候のみが 1カ所以上
表 2.5.1.2-2 ALS の認定基準 1 主要項目 (1) 以下の 1)-4)のすべてを満たすものを,筋萎縮性側索硬化症と診断する. 1) 成人発症である. 2) 経過は進行性である. 3) 神経所見・検査所見で,下記の 1 か 2 のいずれかを満たす. 身体を,a.脳神経領域,b.頚部・上肢領域,c.体幹領域(胸髄領域),d.腰部・下肢領域の 4 領域に分ける(領域の分け方は,2 参考事項を参照).下位運動ニューロン徴候は,(2) 針 筋電図所見{1)または 2)}でも代用できる. (i) 1 つ以上の領域に上位運動ニューロン徴候をみとめ,かつ 2 つ以上の領域に下位運動ニ ューロン症候がある. (ii)SOD1 遺伝子変異など既知の家族性筋萎縮性側索硬化症に関与する遺伝子異常があり, 身体の1 領域以上に上位および下位運動ニューロン徴候がある. 4) (3)鑑別診断で挙げられた疾患のいずれでもない. (2) 針筋電図所見 1) 進行性脱神経所見:線維性収縮電位,陽性鋭波など. 2) 慢性脱神経所見:長持続時間,多相性電位,高振幅の大運動単位電位など. (3) 鑑別診断 1) 脳幹・脊髄疾患:腫瘍,多発性硬化症,頚椎症,後縦靭帯骨化症など. 2) 末梢神経疾患:多巣性運動ニューロパチー,遺伝性ニューロパチーなど. 3) 筋疾患:筋ジストロフィー,多発筋炎など. 4) 下位運動ニューロン障害のみを示す変性疾患:脊髄性進行性筋萎縮症など. 5) 上位運動ニューロン障害のみを示す変性疾患:原発性側索硬化症など. 2 参考事項 (1) SOD1 遺伝子異常例以外にも遺伝性を示す例がある. (2) 稀に初期から認知症を伴うことがある. (3) 感覚障害,膀胱直腸障害,小脳症状を欠く.ただし一部の例でこれらが認められることが ある. (4) 下肢から発症する場合は早期から下肢の腱反射が低下,消失することがある. (5) 身体の領域の分け方と上位・下位ニューロン徴候は以下のようである. a.脳神経領域 b. 頚部・上肢領域 c.体幹領域 (胸随領域) d.腰部・下肢領域 上位運動ニュ ーロン徴候 下顎反射亢進 口尖らし反射亢進 偽性球麻痺 強制泣き・笑い 上肢腱反射亢進 ホフマン反射亢進 上肢痙縮 萎縮筋の腱反射残存 腹壁皮膚反射 消失 体幹部腱反射 亢進 下肢腱反射亢進 下肢痙縮 バビンスキー徴候 萎縮筋の腱反射残存 下位運動ニュ ーロン徴候 顎,顔面 舌,咽・喉頭 頚部,上肢帯, 上腕 胸腹部,背部 腰帯,大腿,下腿,足 2.5.1.2.2 ALS の治療の現状と問題点 2.5.1.2.2.1 既承認の療法 現在,本邦では1999 年にグルタミン酸遊離抑制薬のリルゾールが ALS に対して唯一承認
さ れ て い る . リ ル ゾ ー ル は 米 国 神 経 学 会 (American Academy of Neurology
実施の基準(GCP)を遵守して実施した.
2.5.1.4.1 臨床開発の経緯
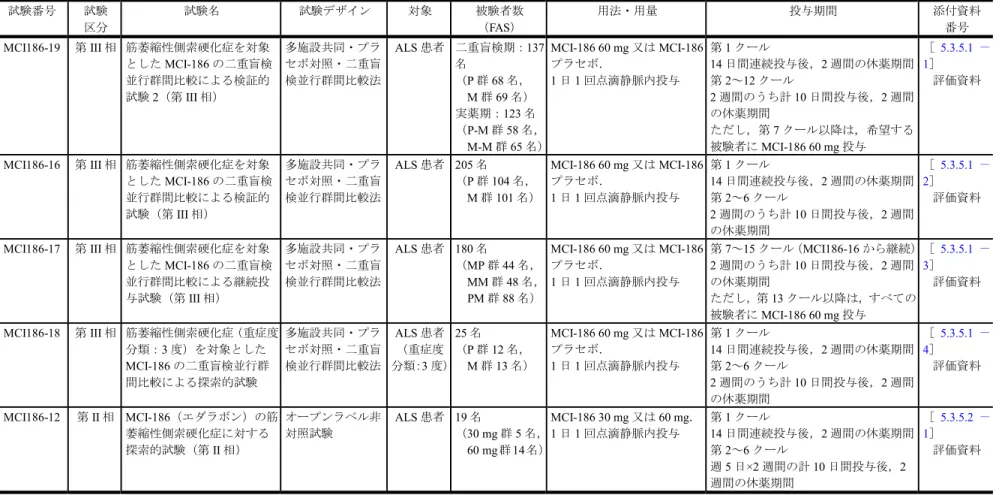
表 2.5.1.4-1 臨床試験一覧
P 群:プラセボ群,M 群:MCI-186 群,P-M 群:MCI186-19 試験二重盲検期プラセボ群 実薬期 MCI-186 群,M-M 群:MCI186-19 試験二重盲検期 MCI-186 群 実薬期 MCI-186 群,MP 群:
検証MCI-186 群 継続プラセボ群,MM 群:検証 MCI-186 群 継続 MCI-186 群,PM 群:検証プラセボ群 継続 MCI-186 群{検証:検証的試験(MCI186-16 試験),継続:継続試験(MCI186-17
試験)}. 試験番号 試験 区分 試験名 試験デザイン 対象 被験者数 (FAS) 用法・用量 投与期間 添付資料 番号 MCI186-19 第III 相 筋萎縮性側索硬化症を対象 としたMCI-186 の二重盲検 並行群間比較による検証的 試験2(第 III 相) 多施設共同・プラ セボ対照・二重盲 検並行群間比較法 ALS 患者 二重盲検期:137 名 (P 群 68 名, M 群 69 名) 実薬期:123 名 (P-M 群 58 名, M-M 群 65 名) MCI-186 60 mg 又は MCI-186 プラセボ. 1 日 1 回点滴静脈内投与 第1 クール 14 日間連続投与後,2 週間の休薬期間 第2~12 クール 2 週間のうち計 10 日間投与後,2 週間 の休薬期間 ただし,第7 クール以降は,希望する 被験者にMCI-186 60 mg 投与 [5.3.5.1 - 1] 評価資料 MCI186-16 第III 相 筋萎縮性側索硬化症を対象 としたMCI-186 の二重盲検 並行群間比較による検証的 試験(第III 相) 多施設共同・プラ セボ対照・二重盲 検並行群間比較法 ALS 患者 205 名 (P 群 104 名, M 群 101 名) MCI-186 60 mg 又は MCI-186 プラセボ. 1 日 1 回点滴静脈内投与 第1 クール 14 日間連続投与後,2 週間の休薬期間 第2~6 クール 2 週間のうち計 10 日間投与後,2 週間 の休薬期間 [5.3.5.1 - 2] 評価資料 MCI186-17 第III 相 筋萎縮性側索硬化症を対象 としたMCI-186 の二重盲検 並行群間比較による継続投 与試験(第III 相) 多施設共同・プラ セボ対照・二重盲 検並行群間比較法 ALS 患者 180 名 (MP 群 44 名, MM 群 48 名, PM 群 88 名) MCI-186 60 mg 又は MCI-186 プラセボ. 1 日 1 回点滴静脈内投与 第7~15 クール(MCI186-16 から継続) 2 週間のうち計 10 日間投与後,2 週間 の休薬期間 ただし,第13 クール以降は,すべての 被験者にMCI-186 60 mg 投与 [5.3.5.1 - 3] 評価資料 MCI186-18 第III 相 筋萎縮性側索硬化症(重症度 分類:3 度)を対象とした MCI-186 の二重盲検並行群 間比較による探索的試験 多施設共同・プラ セボ対照・二重盲 検並行群間比較法 ALS 患者 (重症度 分類:3 度) 25 名 (P 群 12 名, M 群 13 名) MCI-186 60 mg 又は MCI-186 プラセボ. 1 日 1 回点滴静脈内投与 第1 クール 14 日間連続投与後,2 週間の休薬期間 第2~6 クール 2 週間のうち計 10 日間投与後,2 週間 の休薬期間 [5.3.5.1 - 4] 評価資料 MCI186-12 第II 相 MCI-186(エダラボン)の筋 萎縮性側索硬化症に対する 探索的試験(第II 相) オープンラベル非 対照試験 ALS 患者 19 名 (30 mg 群 5 名, 60 mg 群 14 名) MCI-186 30 mg 又は 60 mg. 1 日 1 回点滴静脈内投与 第1 クール 14 日間連続投与後,2 週間の休薬期間 第2~6 クール 週5 日×2 週間の計 10 日間投与後,2 週間の休薬期間 [5.3.5.2 - 1] 評価資料
【用法・用量(ラジカット注30mg について記載)】 通常,成人に1 回 2 管(エダラボンとして 60 mg)を適当量の生理食塩液等で用時希釈し, 60 分かけて 1 日 1 回点滴静注を行う. 本剤投与と休薬の組み合わせを 1 クールとし,これを繰り返す.通常,第 1 クールは 14 日間連日投与した後14 日間休薬し,第 2 クール以降は 14 日間のうち 10 日間投与した後 14 日間休薬する.
2.5.2 生物薬剤学に関する概括評価 該当する試験は実施していない.
2.5.3 臨床薬理に関する概括評価 本剤のたん白結合を介した薬物相互作用についてin vitro で検討した結果,いずれも臨床用 量で薬物相互作用を生じる可能性は低いことが推察された.また,臨床において筋萎縮性側 索硬化症用剤として併用が想定されるリルゾールについては主要代謝酵素が Cytochrome P450(以下,CYP)1A2 であることから 12),本剤がCYP を介した薬物相互作用の原因とな る可能性は低いことが予想された.また,本剤の代謝酵素分子種を検討した結果,本剤のグ ルクロン酸抱合反応には複数のウリジン-5’-二リン酸-α-D-グルクロン酸転移酵素(UGT)分 子種が関与しており,薬物相互作用をうける可能性は低いことが示唆された.
2.5.4 有効性の概括評価
2.5.4.1 有効性を裏付ける試験の概略
本剤の ALS 患者に対する有効性評価に用いた臨床試験は,第 II 相非対照試験 1 試験
(MCI186-12 試験),第 III 相プラセボ対照比較試験 4 試験(MCI186-16 試験,MCI186-17 試
験,MCI186-18 試験,MCI186-19 試験)の計 5 試験とした. 治験薬の投与は,クールを単位として記載し,第1 クールは 1 日 1 回 14 日間連続投与後に 2 週間の休薬,第 2 クール以降は 2 週間のうち計 10 日間投与後に 2 週間の休薬とした. MCI186-12 試験は,ALS 患者に本剤を 6 クール投与したときの有効性と安全性を探索的に 検討するために実施した.30 mg 群で安全性に問題を認めず ALSFRS-R スコアから症状の進 行が極端に早まったと考えられる被験者も認めなかったことから60 mg 群に移行し,60 mg 群でも安全性に問題を認めず病勢進行の抑制を示唆した.このため,MCI186-12 試験の結果 を基にMCI186-12 試験以降に実施した第 III 相試験では,すべて本剤群の用量を 60 mg とし た. MCI186-16 試験は,試験開始当初,有効性を評価するための主たる比較対照試験の位置付 けでプラセボを対照として実施したが,P 群との比較で本剤の有効性を明確に示すことがで きなかった.そこで追加解析を実施し,本剤の有効性を見極めるための対象集団としてEESP
及びEESP よりも本剤の有効性を見極めるのに適切な対象集団として definite or probable/
EESP/2y を設定した. MCI186-17 試験は,MCI186-16 試験の 6 クールに引き続き,本剤を 6 クール投与したとき の効果の持続性,繰り返し投与時の有効性及び安全性を検討するために,プラセボを対照と して実施した.MCI186-17 試験では,プラセボ対照の 6 クールの後,3 クールの実薬投与期 を設置したため,MCI186-16 試験と併せて最長で 15 クールまで投与された.その結果,第 15 クールまでは効果の減弱は認めなかった. MCI186-18 試験は,ALS 重症度分類 3 度の患者に本剤を 6 クール投与したときの有効性及 び安全性を探索的に検討するために,プラセボを対照として実施した.ALS 重症度分類 3 度 の患者は,有効性を評価するための主たる試験であるMCI186-19 試験の選択基準には含まれ ないため,これらの患者に対する本剤の有効性に及び安全性については,主としてMCI186-18 試験で検討した.MCI186-18 試験の結果,ALSFRS-R スコアの変化量は,M 群と P 群で統計 学的に有意な差を認めなかったが,安全性において特に問題は認めなかった. MCI186-19 試験は,有効性を評価するための主たる比較対照試験として実施した.対象集
団をMCI186-16 試験の追加解析の結果から設定した definite or probable/EESP/2y とし,プラセ
ボを対照とした.有効性を検証する期間として設定した二重盲検期(第1~6 クール)で,主
要評価項目ALSFRS-R スコアの主要解析において,M 群と P 群で統計学的に有意な差を認め,
2.5.4.1.1 対象集団
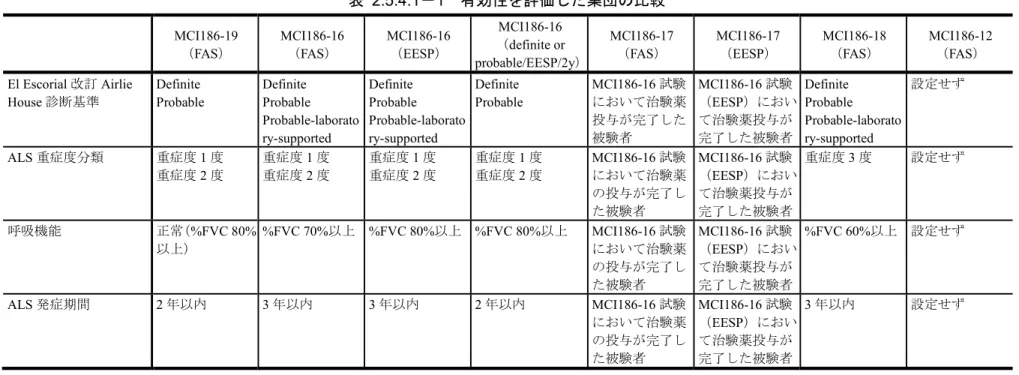
各試験で有効性を評価した集団を表 2.5.4.1-1に示した.
2.5.4.1.1.1 主たる有効性の評価対象となった MCI186-19 試験の対象集団と市販後に使用 が予想される患者集団との差異
ALS は患者数が極めて少なく目標被験者数を多く設定することが困難な希少疾病である
ことから,プラセボ対照比較試験3 試験(MCI186-16 試験,MCI186-18 試験,MCI186-19 試
験)は,約6 ヶ月(6 クール)の治験期間で,ALSFRS-R スコアの変化量を P 群と比較し, 本剤のALS 患者に対する効果を確実に見極めることを優先して対象集団を設定した. 特に,主たる有効性の評価対象であるMCI186-19 試験は,MCI186-16 試験で有効性を検証 できなかったために追加で実施した試験であるため,本剤の有効性をALSFRS-R スコアの変 化量で確実に検証することを最優先した.この様な背景から,MCI186-19 試験では,対象集 団はそれまでに実施した4 試験よりも更に限定したものとなった. 有効性及び安全性の観点から一般的に設定する選択基準及び除外基準を除き,有効性を検 証するためにMCI186-19 試験で対象外とした患者は(1)~(4)のとおりである.
(1) El Escorial 改訂 Airlie House 診断基準で「probable-laboratory-supported」,「possible」, 「suspected」
(2) ALS 重症度分類による重症度「3 度」,「4 度」,「5 度」 (3) 呼吸機能が低下している患者(%FVC80%未満など) (4) ALS の罹病期間(2 年超)
ALS の症状の現れ方や進行は患者により多様であるため,上記の El Escorial 改訂 Airlie House 診断基準,ALS 重症度分類による重症度,呼吸機能の状態,ALS の罹病期間の違いに より明確に治療方法を区別することは困難であると考える.また,ALS が人工呼吸器を用い なければ2~5 年で死亡に至る重篤な疾患であり,有効な治療法が確立していない現状を踏ま えると,患者及び治療する医師にとって,新たな治療の選択肢が必要不可欠であると考える. したがって,本剤の市販後の投与対象は,(1)~(4)に該当する患者を含めた ALS 患者全般 であると考える. ただし,本剤のALS に対する有効性が検証されているのは MCI186-19 試験の対象であり, (1)~(4)に該当する患者では必ずしも MCI186-19 試験と同等の有効性が期待できるとは限ら ないと考える.更に,(2) ALS 重症度分類による重症度「3 度」,「4 度」,「5 度」のうち「4 度」,「5 度」については既にかなり病勢が進行した状態であり,MCI186-19 試験以外の臨床 試験を含めても投与経験は少なく,有効性及び安全性は確立していないと考える.また,(3) 呼吸機能が低下している患者(%FVC80%未満など)については,ALS 患者にとって呼吸機 能低下は生命予後に大きく影響することから,ALS に対する治療より呼吸管理を優先すべき
場合があると考える.更に,呼吸機能が低下している患者のうち,%FVC70%未満の患者に ついては,MCI186-19 試験以外の臨床試験を含めても投与経験は少なく,有効性及び安全性 は確立していないと考える. 以上のことから,添付文書に以下の内容を記載する. 〈効能・効果に関連する使用上の注意〉 筋萎縮性側索硬化症(ALS)患者に使用する場合 1.臨床試験に組み入れられた患者の ALS 重症度分類,呼吸機能等の背景及び試験ごとの結 果を熟知し,本剤の有効性及び安全性を十分に理解した上で,適応患者の選択を行うこと (【臨床成績】の項参照). 2.ALS 重症度分類 4 度以上の患者及び努力性肺活量が理論正常値の 70%未満に低下して いる患者における本剤の投与経験は少なく,有効性及び安全性は確立していない.これら の患者に本剤を投与することについては,リスクとベネフィットを考慮して慎重に判断す ること. 更に,本剤はALS の病状進行の抑制を目的に使用するものであり,根治を期待するもので はないため,病状進行の抑制が見込めない状態の患者に対しては使用すべきではないと考え る. 以下に,本剤の臨床試験における(1)~(4)に該当する患者への使用経験の有無,使用経験が ある場合はその内容を記載した.これらの患者に使用する場合にはALS の知識と治療経験を 有する医師が,下記内容を十分踏まえた上で本剤の投与の可否を判断すると共に,投与後は 患者の状態を十分に観察する必要があると考える.
(1) El Escorial 改訂 Airlie House 診断基準で「probable-laboratory-supported」,「possible」, 「suspected」
MCI186-19 試験では,El Escorial 改訂 Airlie House 診断基準の 5 つのグレードの内,「definite」
と「probable」を対象としたため,「probable-laboratory-supported」,「possible」及び「suspected」
は,MCI186-19 試験の対象集団には含まれていない.
「probable-laboratory-supported」は,MCI186-16 試験,MCI186-17 試験及び MCI186-18 試験
では対象集団に含まれている.このため,これら3 試験では,「probable-laboratory-supported」 の患者に対しては本剤の使用経験がある.「probable-laboratory-supported」が含まれた対象集 団で実施したMCI186-16 試験では,FAS での有効性は検証されなかったものの,追加解析の 結果から設定したEESP では,ALSFRS-R スコアの変化量の主要解析で M 群と P 群の投与群 間で統計学的に有意な差を認めた(2.5.4.2.2).このEESP は「probable-laboratory -supported」を含む集団であった.
El Escorial 改訂 Airlie House 診断基準を選択基準に用いた第 III 相試験の 4 試験すべてで,
患者を対象とするため並びに他疾患との鑑別の観点からである. (2) ALS 重症度分類による重症度「3 度」,「4 度」,「5 度」 MCI186-19 試験では,第 1 クール投与開始時点での ALS 重症度分類による重症度「1 度」 及び「2 度」を対象としたため,「3 度」,「4 度」,「5 度」は,MCI186-19 試験の対象集団には 含まれていない. MCI186-18 試験では「3 度」のみを対象に有効性と安全性を検討したため,「3 度」の患者 に対しては本剤の使用経験がある.MCI186-18 試験では,ALSFRS-R スコアの変化量は,M 群と P 群の投与群間で統計学的に有意な差を認めなかった(2.5.4.2.4)が,本剤の安全性に おいて特に問題は認めなかった.また,MCI186-12 試験では,7/19 名(30 mg 群 3/5 名,60 mg 群 4/14 名)が「3 度」の被験者であり,ALSFRS-R スコア低下についての判定ではそのうち 抑制が3/7 名,やや抑制が 1/7 名,不変が 3/7 名であった[5.3.5.2-1 11.5.1.1 の被験者ごと の推移]. 「4 度」,「5 度」については,重症度が進行すると ALSFRS-R スコアによる評価が困難と なることから,すべての試験で対象外とした.このため,第1 クール投与開始時点では,「4 度」,「5 度」の患者に対する本剤の使用経験はない.ただし,治験期間中に,病勢が進展し 「4 度」,「5 度」となった場合でも投与が継続されたため,第 1 クール投与開始以降であれば 「4 度」,「5 度」の患者に対する本剤の使用経験がある. また,MCI186-17 試験及び MCI186-19 試験(実薬期)では,第 7 クール投与開始時点で「3 度」,「4 度」,「5 度」であった被験者に対しても投与が継続されたため[5.3.5.1-3 表 11.4.1.3.7 -1],第7 クール以上投与された患者に対しても「3 度」,「4 度」,「5 度」の患者に対する本 剤の使用経験がある. (3) 呼吸機能が低下している患者(%FVC80%未満など) MCI186-19 試験では,第 1 クール投与開始時点で呼吸機能の低下を認める患者(%FVC80% 未満,ALSFRS-R の「呼吸」に係る 3 項目のいずれかが 3 点以下)を対象外とした.また, 治験期間中に気管切開が必要となった場合,1 日中呼吸補助装置が必要となった場合,%FVC が50%以下で血液ガスの動脈血二酸化炭素分圧(PaCO2)が45mmHg 以上となった場合は中 止した.このため,呼吸機能が低下している患者は,MCI186-19 試験の対象集団には含まれ ていない. MCI186-19 試験以外のすべての試験においても,呼吸機能が低下している患者は対象外と した.これは,ALS 患者にとって呼吸機能低下は生命予後に大きく影響することから,呼吸 機能低下を認める場合は呼吸管理を優先すべきであり,呼吸機能低下による全身状態の悪化 が生じている場合には本剤の有効性の検討には適切ではないと考えたためである.このため, 第1 クール投与開始時点で呼吸機能が低下している患者に対する本剤の使用経験はない.た
だし,MCI186-16 試験,MCI186-17 試験及び MCI186-18 試験では,治験期間中に呼吸機能が
可能であると判断された被験者に対しては投与が継続されたため,この様な患者に対しては 本剤の使用経験がある. (4) ALS の罹病期間(2 年超) MCI186-19 試験では,発症から同意取得時まで 2 年以内の患者を対象としたため,発症か ら2 年を超える患者は,MCI186-19 試験の対象集団には含まれていない.ALS を発症して長 期間が経過する患者は,症状の変化が少ない患者である場合が多く,その後も緩やかに進行 する可能性が高いと考え,6 ヶ月間での ALSFRS-R スコアによるプラセボとの群間比較が困 難であると考えたためであり,本剤の有効性が期待できないためではない. MCI186-16 試験及び MCI186-18 試験では,発症から同意取得時まで 3 年以内の患者を対象 としており,また,MCI186-12 試験では,発症からの期間の基準はなく,発症から同意取得 までの期間は最長の被験者で12.4 年であった.このため,MCI186-19 試験以外では,発症か ら同意取得時まで2 年を超えた患者に対する本剤の使用経験がある.
表 2.5.4.1-1 有効性を評価した集団の比較 MCI186-19 (FAS) MCI186-16 (FAS) MCI186-16 (EESP) MCI186-16 (definite or probable/EESP/2y) MCI186-17 (FAS) MCI186-17 (EESP) MCI186-18 (FAS) MCI186-12 (FAS) El Escorial 改訂 Airlie House 診断基準 Definite Probable Definite Probable Probable-laborato ry-supported Definite Probable Probable-laborato ry-supported Definite Probable MCI186-16 試験 において治験薬 投与が完了した 被験者 MCI186-16 試験 (EESP)におい て治験薬投与が 完了した被験者 Definite Probable Probable-laborato ry-supported 設定せず ALS 重症度分類 重症度1 度 重症度2 度 重症度1 度 重症度2 度 重症度1 度 重症度2 度 重症度1 度 重症度2 度 MCI186-16 試験 において治験薬 の投与が完了し た被験者 MCI186-16 試験 (EESP)におい て治験薬投与が 完了した被験者 重症度3 度 設定せず 呼吸機能 正常(%FVC 80% 以上) %FVC 70%以上 %FVC 80%以上 %FVC 80%以上 MCI186-16 試験 において治験薬 の投与が完了し た被験者 MCI186-16 試験 (EESP)におい て治験薬投与が 完了した被験者 %FVC 60%以上 設定せず ALS 発症期間 2 年以内 3 年以内 3 年以内 2 年以内 MCI186-16 試験 において治験薬 の投与が完了し た被験者 MCI186-16 試験 (EESP)におい て治験薬投与が 完了した被験者 3 年以内 設定せず
2.5.4.1.2 臨床試験デザイン 本剤のALS 患者に対する有効性評価に用いた臨床試験一覧を表 2.5.1.4-1,各試験の試験 期間・投与クールの一覧を表 2.5.4.1-2に示した. (1) 検証的試験 2(MCI186-19 試験) 二重盲検期 ALS 患者を対象に,二重盲検並行群間比較法により,本剤 60 mg を 6 クール(第 1~6 ク ール)投与したときの有効性及び安全性について,プラセボを対照として検討した.
選択基準は,MCI186-16 試験の追加解析で設定した definite or probable/EESP/2y を基に設定
した.
主要評価項目はALSFRS-R スコアとした.主要解析は,「第1 クール投与開始前」と「第 6
クール投与終了2 週間後又は中止時{Last observation carried forward(以下,LOCF)}」の差
について,動的割付に用いた因子を共変量とした共分散分析を実施した. 有効性の主たる解析対象集団はFAS とした. LOCF を用いた解析は,第 3 クール完了被験者(投与開始 81 日後到達被験者)を対象とし た. 実薬期 第6 クールまでの二重盲検期完了後に,希望する被験者全員に本剤 60 mg を 6 クール(第 7~12 クール)投与した. 実薬期は被験者の倫理面を配慮した実薬提供の位置づけであることから,有効性はプラセ ボを対象とした二重盲検期の結果から検証し,実薬期は二重盲検期で設定した各有効性評価 項目の要約統計量及びALS 重症度分類の推移のシフトテーブルを提示し,イベントの生存時 間解析を実施した. 有効性の解析対象集団はFAS とした. (2) 検証的試験(MCI186-16 試験) ALS 患者を対象に,二重盲検並行群間比較法により,本剤 60 mg を 6 クール(第 1~6 ク ール)投与したときの有効性及び安全性について,プラセボを対照として検討した. 主要評価項目はALSFRS-R スコアとした.主要解析は,「第1 クール投与開始前」と「第 6 クール投与終了2 週間後又は中止時(LOCF)」の差について,動的割付に用いた因子を共変 量とした共分散分析を実施した.また,各時期のスコアについて,投与群,時期,投与群と 時期の交互作用効果を要因とし,「第1 クール投与開始前」,動的割付に用いた因子を共変量 とした反復測定分散分析を実施した.
有効性の主たる解析対象集団はFAS としたが,開鍵後の追加解析として,EESP 及び definite
or probable/EESP/2y の 2 つの解析対象集団を設定した.
た.
(3) 継続試験(MCI186-17 試験)
MCI186-16 試験を完了した ALS 患者を対象とした.MCI186-16 試験に引き続き,二重盲検
並行群間比較法により,本剤60 mg を投与したときの効果の持続性,繰り返し投与時の有効 性及び安全性について,プラセボを対照として検討した. 主要評価項目,副次評価項目の別は設定しなかった. 有効性の主たる解析対象集団は FAS としたが,MCI186-17 試験の開鍵前に設定した MCI186-16 試験の EESP でも同様の解析を実施した. LOCF を用いた解析は,第 9 クール完了被験者(第 1 クール投与開始 249 日後到達被験者) を対象とした. (4) 探索的試験(ALS 重症度分類 3 度)(MCI186-18 試験) ALS 重症度分類 3 度の ALS 患者を対象に,二重盲検並行群間比較法により,本剤 60 mg を6 クール(第 1~6 クール)投与したときの有効性及び安全性について,プラセボを対照と して検討した. 主要評価項目,副次評価項目の別は設定しなかった. 有効性の主たる解析対象集団はFAS とした. LOCF を用いた解析は,第 3 クール完了被験者(投与開始 81 日後到達被験者)を対象とし た. (5) 探索的試験(第 II 相)(MCI186-12 試験) ALS 患者を対象に,非対照試験により,本剤 30 mg 又は 60 mg を 6 クール(第 1~6 クー ル)投与したときの有効性及び安全性を検討した. 主要評価項目はALSFRS-R スコアとした.解析は,本剤投与前 24 週間と投与後 24 週間(第 6 クール終了時)の ALSFRS-R スコアの要約統計量を算出すると共に,第 1 クール投与前と の差の要約統計量を算出して,paired-t 検定を実施した. 有効性の解析対象集団はFAS とした.
2.5.4.1.3 有効性評価項目
各試験の有効性評価項目を表 2.5.4.1-3に示した.
表 2.5.4.1-3 有効性の評価項目
有効性評価項目 MCI186-19 MCI186-16 MCI186-17 MCI186-18 MCI186-12
ALSFRS-R スコア ◎ ◎ ○ ○ ◎ 死亡又は一定の病勢進行※まで の期間 ○ ○ ○ ○ - ドメインごとの ALSFRS-R ス コア ○ ○ ○ ○ - %FVC ○ ○ ○ ○ ○
Modified Norris Scale スコア ○ ○ ○ ○ -
ALSAQ40 スコア ○ ○ ○ ○ - 握力 ○ ○ ○ ○ - ピンチ力 ○ ○ ○ ○ - ALS 重症度分類 ○ ○ ○ ○ - 血液ガス - - - ○ ○ 徒手筋力検査 - - - - ○ 髄液たん白 - - - - ○ 髄液中3-Nitrotyrosine - - - - ○ 髄液・血液中過酸化脂質の変化 - - - - ○ ◎:主要評価項目,○:主要評価項目以外の有効性評価項目,-:該当せず. ※:死亡,独立歩行不能,上肢機能の廃絶,気管切開,レスピレータ装着,経管栄養補給,実用的会話の喪失(実用的会 話の喪失はMCI186-19 試験のみ). (1) ALSFRS-R スコア ALSFRS-R スコアは,ALS 患者の日常生活機能がどの程度損なわれているかを把握するた めに,米国で作成されバリデートされた機能障害の評価尺度であり,臨床試験にも使用され ている13),14),15),16).また,日本語版ALSFRS-R も,ALS の臨床症状を評価する上で,合計 スコア・項目別スコア共に信頼性があり,臨床評価に用いることが可能であると報告されて いる13). 臨床試験等においてALS 患者の日常生活機能評価に一般的に用いられていることから17), 本剤を用いて実施したすべての臨床試験でALSFRS-R を有効性評価項目とすると共に,主た る有効性を評価したMCI186-19 試験を含む主要評価項目を設定した 3 試験で主要評価項目と した. (2) 死亡又は一定の病勢進展までの期間 死亡又は一定の病勢進展までの期間は,リルゾールの臨床試験成績18)と比較可能な項目で
2.5.4.2 有効性の全般的結果
有効性評価に用いた臨床試験の要約を表 2.5.4.2-1に示した.また,個々の試験結果の要
約を以下に示した.
本剤のALS に対する全般的な有効性は,主たる有効性を評価した比較対照試験である検証
表 2.5.4.2-1 有効性評価に用いた臨床試験の要約(2/2) 試験番号 添付資料 番号 試験 施設 数 場所 試験開始日 登録状況 日付 総登録数/ 登録目標数 デザイン 対照の種類 (併用薬剤 の種類を含 む) 試験薬 比較対照薬 投与量 投与経路・投与方法 試験の 目的 登録時/ 完了時の 群別被験 者数 試験 期間 男性/女性 年齢の 中央値 (範囲) 診断 選択基準 主たる エンド ポイント MCI186-12 [5.3.5.2- 1] 1 国内 2001/11/1 完了 2002/11/8 19/20 オープンラ ベル非対照 試験 MCI-186 30 mg 又は 60 mg 1 日 1 回点滴静脈内投与 有効性 安全性 30 mg 群:5/4 60 mg 群:14/12 6 クール 15/4 30 mg 群:57.0(30-75) 60 mg 群:59.5(33-73) ALS 患者 ALSFRS-R スコア
P 群:プラセボ群,M 群:MCI-186 群,P-M 群:MCI186-19 試験二重盲検期プラセボ群 実薬期 MCI-186 群,M-M 群:MCI186-19 試験二重盲検期 MCI-186 群 実薬期 MCI-186 群,MP 群:
検証MCI-186 群 継続プラセボ群,MM 群:検証 MCI-186 群 継続 MCI-186 群,PM 群:検証プラセボ群 継続 MCI-186 群{検証:検証的試験(MCI186-16 試験),継続:継続試験(MCI186-17
2.5.4.2.1 検証的試験 2(MCI186-19 試験) FAS を主たる解析対象集団とした.二重盲検期の M 群 69 名,P 群 68 名,合計 137 名を解 析対象とした.なお,実薬期には,二重盲検期がM 群であった被験者(以下,M-M 群)65 名,P 群であった被験者(以下,P-M 群)58 名,合計 123 名が移行した. (1) ALSFRS-R(主要評価項目)(二重盲検期) 1) ALSFRS-R スコアの推移(二重盲検期) 本剤又はプラセボを6 クール投与したときの ALSFRS-R スコアの推移を,投与群ごとに図 2.5.4.2-1に示した. 図 2.5.4.2-1 ALSFRS-R スコアの推移{平均値±標準偏差(以下,S.D.)} (MCI186-19 試験二重盲検期,FAS) P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 68 名,M 群 69 名. 第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした. [5 3 5 1-1 図 11.4.1.1-1より引用(一部改変)] 2) 主要解析(二重盲検期) 主要評価項目ALSFRS-R スコアの主要解析の結果を表 2.5.4.2-2に示した. 「第 1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の
ALSFRS-R スコアの差{Least squared means(以下,LSMean)±標準誤差(以下,S.E.)}は, M 群:-5.01±0.64,P 群:-7.50±0.66 であった.投与群間差の LSMean±S.E.とその 95%信頼区 AL SF RS -R ス コ ア 0 10 20 30 40 50 時期
1
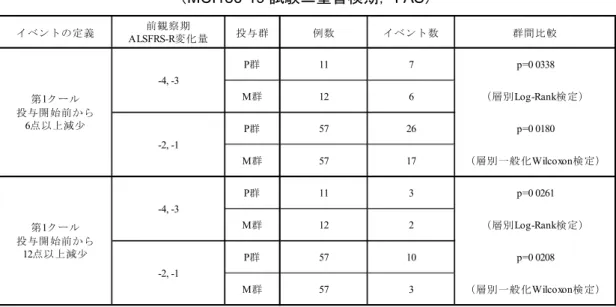
仮登録 本登録 1クール 2クール 3クール 4クール 5クール 6クール LOCF Key Code ○ P群 △ M群間は 2.49±0.76(0.99~3.98)であり,ALSFRS-R スコアの低下は投与群間で統計学的に有意 な差を認めた(p=0.0013). 表 2.5.4.2-2 ALSFRS-R の第 1 クール投与開始前と第 6 クール投与終了 2 週後(LOCF) の差についての解析(MCI186-19 試験二重盲検期,FAS) P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 66 名,M 群 68 名. 動的割付に用いた3 因子{前観察期開始時の ALSFRS-R スコアと前観察期終了時(12 週間後)の ALSFRS-R スコアの変化 量(差)(-1,-2/ -3,-4),El Escorial 改訂 Airlie House 診断基準(Definite/Probable),年齢(65 歳以上/65 歳未満)}を共 変量とした解析を実施し,群間比較を行った. 第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした. [5 3 5 1-1 表 11.4.1.1-2より引用(一部改変)] 3) ALSFRS-R スコアで定義したイベントについての生存時間解析(二重盲検期) ALSFRS-R スコアで定義したイベントについての生存時間解析を表 2.5.4.2-3に示した. ALSFRS-R スコアが第 1 クール投与開始前から 6 以上減少した場合,12 以上減少した場合 をそれぞれイベントとした生存時間解析では,いずれのイベントにおいても,イベント数は, 投与群間で統計学的に有意な差を認めた{(6 点)層別 Log-rank 検定 p=0.0338,層別一般化
Wilcoxon 検定 p=0.0180.(12 点)層別 Log-rank 検定 p=0.0261,層別一般化 Wilcoxon 検定 p=0.0208}. t値 p値 P群 -7.50 ±0.66 2.49 ±0.76 t=3.29 p=0.0013 M群 -5.01 ±0.64 (0.99 , 3.98) LSMean±S.E. 調整済み平均値 LSMean±S.E. (95%信頼区間) 投与群 調整済み平均値の投与群間差
表 2.5.4.2-3 ALSFRS-R で定義したイベントについての生存時間解析 (MCI186-19 試験二重盲検期,FAS) P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 68 名,M 群 69 名. ALSFRS-R スコアが第 1 クール投与開始前から 6 以上減少した場合,12 以上減少した場合をそれぞれイベント,それ以外 を打ち切りと定義した.「前観察期ALSFRS-R スコア変化量」を層とした.打ち切り日は観察終了日とした. [5 3 5 1-1 表 11.4.1.1-7より引用(一部改変)] (2) 死亡又は一定の病勢進展までの期間(二重盲検期) 「死亡,独立歩行不能,上肢機能の廃絶,気管切開,レスピレータ装着,経管栄養補給及 び実用的会話の喪失」について,投与群ごとの発現イベント数を表 2.5.4.2-4に示した. 表 2.5.4.2-4 死亡又は一定の病勢進展についてのイベント数 (MCI186-19 試験二重盲検期,FAS) P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 68 名,M 群 69 名. [5 3 5 1-1 表 11.4.1.1-12より引用(一部改変)] また,いずれかの状態になった場合をイベント,それ以外を打ち切りと定義したLog-Rank 検定及び一般化 Wilcoxon 検定では,投与群間で統計学的に有意な差を認めなかった イベントの定義 前観察期 ALSFRS-R変化量 投与群 例数 イベント数 群間比較 P群 11 7 p=0 0338 M群 12 6 (層別Log-Rank検定) P群 57 26 p=0 0180 M群 57 17 (層別一般化Wilcoxon検定) P群 11 3 p=0 0261 M群 12 2 (層別Log-Rank検定) P群 57 10 p=0 0208 M群 57 3 (層別一般化Wilcoxon検定) -4, -3 -2, -1 第1クール 投与開始前から 6点以上減少 第1クール 投与開始前から 12点以上減少 -4, -3 -2, -1 イベント名 P群 M群 合計 死亡 0 0 0 独立歩行不能 2 0 2 上肢機能の廃絶 0 0 0 気管切開 0 1 1 レスピレータ装着 0 0 0 経管栄養補給 1 0 1 実用的会話の喪失 3 1 4
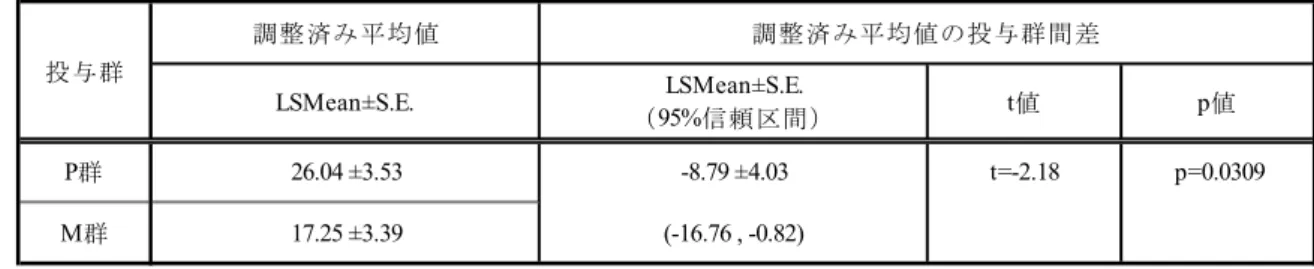
(Log-Rank 検定:p=0.1284,一般化 Wilcoxon 検定:p=0.1415). (3) %FVC(二重盲検期) %FVC に関する群間比較の結果を表 2.5.4.2-5に示した. 「第1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の%FVC の差(LSMean±S.E.)は,M 群:-15.61±2.41%,P 群:-20.40±2.48%であった.投与群間差の LSMean±S.E.とその 95%信頼区間は 4.78±2.84%(-0.83~10.40%)であり,投与群間で統計学 的に有意な差を認めなかった(p=0.0942). 表 2.5.4.2-5 %FVC の第 1 クール投与開始前と第 6 クール投与終了 2 週後(LOCF)の差 についての解析(MCI186-19 試験二重盲検期,FAS) 単位:%FVC(%). P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 66 名,M 群 67 名. 動的割付に用いた3 因子{前観察期開始時の ALSFRS-R スコアと前観察期終了時(12 週間後)の ALSFRS-R スコアの変化 量(差)(-1,-2/ -3,-4),El Escorial 改訂 Airlie House 診断基準(Definite/Probable),年齢(65 歳以上/65 歳未満)}を共 変量とした解析を実施し,群間比較を行った. 第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした. [5 3 5 1-1 表 11.4.1.1-24より引用(一部改変)] (4) ALSAQ40 スコア(二重盲検期) ALSAQ40 スコアに関する群間比較の結果を表 2.5.4.2-6に示した. 「第1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の ALSAQ40 スコアの差(LSMean±S.E.)は,M 群:17.25±3.39,P 群:26.04±3.53 であった.投与群間差 の LSMean±S.E.とその 95%信頼区間は-8.79±4.03(-16.76~-0.82)であり,ALSAQ40 スコア の上昇は,投与群間で統計学的に有意な差を認めた(p=0.0309). t値 p値 P群 -20.40 ±2.48 4.78 ±2.84 t=1.69 p=0.0942 M群 -15.61 ±2.41 (-0.83 , 10.40) 調整済み平均値の投与群間差 投与群 LSMean±S.E. (95%信頼区間) 調整済み平均値 LSMean±S.E.
表 2.5.4.2-6 ALSAQ40※の第1 クール投与開始前と第 6 クール投与終了 2 週後(LOCF) の差についての解析(MCI186-19 試験二重盲検期,FAS) ※:QOL に関連する 40 の質問に対して,被験者が 1~5 点で回答した合計スコア.スコアが大きいほど QOL は低下. P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 64 名,M 群 68 名. 動的割付に用いた3 因子{前観察期開始時の ALSFRS-R スコアと前観察期終了時(12 週間後)の ALSFRS-R スコアの変化 量(差)(-1,-2/ -3,-4),El Escorial 改訂 Airlie House 診断基準(Definite/Probable),年齢(65 歳以上/65 歳未満)}を共 変量とした解析を実施し,群間比較を行った.
第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした.
[5 3 5 1-1 表 11.4.1.1-33より引用(一部改変)]
(5) Modified Norris Scale(二重盲検期) 1) Limb Norris Scale(二重盲検期)
Limb Norris Scale に関する群間比較の結果を表 2.5.4.2-7に示した.
「第1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の Limb
Norris Scale スコアの差(LSMean±S.E.)は,M 群:-11.47±1.61,P 群:-14.91±1.68 であった.
投与群間差のLSMean±S.E.とその 95%信頼区間は 3.44±1.92(-0.36~7.24)であり,投与群間
で統計学的に有意な差を認めなかった(p=0.0757).
表 2.5.4.2-7 Limb Norris Scale の第 1 クール投与開始前と第 6 クール投与終了 2 週後 (LOCF)の差についての解析(MCI186-19 試験二重盲検期,FAS)
P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 63 名,M 群 68 名.
動的割付に用いた3 因子{前観察期開始時の ALSFRS-R スコアと前観察期終了時(12 週間後)の ALSFRS-R スコアの変化 量(差)(-1,-2/ -3,-4),El Escorial 改訂 Airlie House 診断基準(Definite/Probable),年齢(65 歳以上/65 歳未満)}を共 変量とした解析を実施し,群間比較を行った.
第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした.
[5 3 5 1-1 表 11.4.1.1-27より引用(一部改変)]
2) Norris Bulbar Scale(二重盲検期)
Norris Bulbar Scale に関する群間比較の結果を表 2.5.4.2-8に示した.
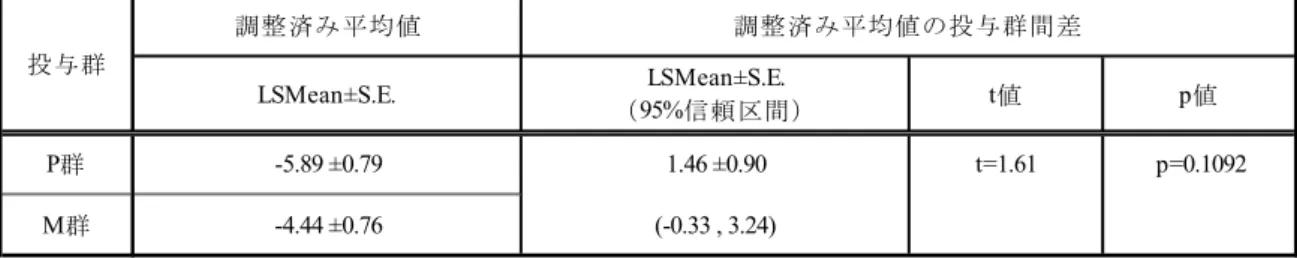
t値 p値 P群 26.04 ±3.53 -8.79 ±4.03 t=-2.18 p=0.0309 M群 17.25 ±3.39 (-16.76 , -0.82) 調整済み平均値の投与群間差 投与群 LSMean±S.E. (95%信頼区間) 調整済み平均値 LSMean±S.E. t値 p値 P群 -14.91 ±1.68 3.44 ±1.92 t=1.79 p=0.0757 M群 -11.47 ±1.61 (-0.36 , 7.24) 投与群 LSMean±S.E. (95%信頼区間) 調整済み平均値 LSMean±S.E. 調整済み平均値の投与群間差
「第1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の Norris Bulbar Scale スコアの差(LSMean±S.E.)は,M 群:-4.44±0.76,P 群:-5.89±0.79 であった.
投与群間差のLSMean±S.E.とその 95%信頼区間は 1.46±0.90(-0.33~3.24)であり,投与群間
で統計学的に有意な差を認めなかった(p=0.1092).
表 2.5.4.2-8 Norris Bulbar Scale の第 1 クール投与開始前と第 6 クール投与終了 2 週後
(LOCF)の差についての解析(MCI186-19 試験二重盲検期,FAS)
P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 63 名,M 群 68 名.
動的割付に用いた3 因子{前観察期開始時の ALSFRS-R スコアと前観察期終了時(12 週間後)の ALSFRS-R スコアの変化 量(差)(-1,-2/ -3,-4),El Escorial 改訂 Airlie House 診断基準(Definite/Probable),年齢(65 歳以上/65 歳未満)}を共 変量とした解析を実施し,群間比較を行った.
第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした.
[5 3 5 1-1 表 11.4.1.1-29より引用(一部改変)]
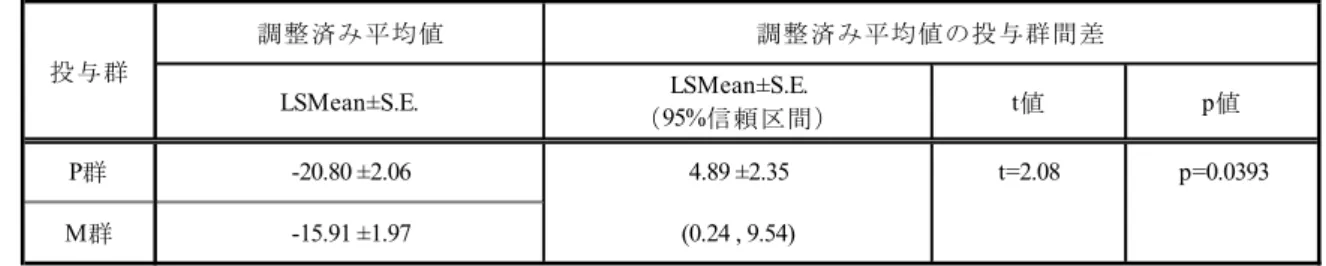
3) Modified Norris Scale(合計)(二重盲検期)
Modified Norris Scale(合計)に関する群間比較の結果を表 2.5.4.2-9に示した.
「第1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の Modified Norris Scale(合計)スコアの差(LSMean±S.E.)は,M 群:-15.91±1.97,P 群:-20.80±2.06 であった.投与群間差のLSMean±S.E.とその 95%信頼区間は 4.89±2.35(0.24~9.54)であり, 投与群間で統計学的に有意な差を認めた(p=0.0393). t値 p値 P群 -5.89 ±0.79 1.46 ±0.90 t=1.61 p=0.1092 M群 -4.44 ±0.76 (-0.33 , 3.24) LSMean±S.E. 調整済み平均値の投与群間差 投与群 LSMean±S.E. (95%信頼区間) 調整済み平均値
表 2.5.4.2-9 Modified Norris Scale(合計)の第 1 クール投与開始前と第 6 クール投与終
了2 週後(LOCF)の差についての解析(MCI186-19 試験二重盲検期,FAS)
P 群:プラセボ群,M 群:MCI-186 群. 被験者数:P 群 63 名,M 群 68 名.
動的割付に用いた3 因子{前観察期開始時の ALSFRS-R スコアと前観察期終了時(12 週間後)の ALSFRS-R スコアの変化 量(差)(-1,-2/ -3,-4),El Escorial 改訂 Airlie House 診断基準(Definite/Probable),年齢(65 歳以上/65 歳未満)}を共 変量とした解析を実施し,群間比較を行った. 第3 クール完了被験者(投与開始 81 日後到達被験者)を LOCF の対象とした. [5 3 5 1-1 表 11.4.1.1-31より引用(一部改変)] 2.5.4.2.2 検証的試験(MCI186-16 試験) FAS を主たる解析対象集団とした.M 群は 101 名,P 群は 104 名,合計 205 名を解析対象 とした.
追加解析の結果から設定した解析集団として,EESP 及び definite or probable/EESP/2y を設 定した.EESP は,M 群は 54 名,P 群は 50 名,合計 104 名,definite or probable/EESP/2y は, M 群は 40 名,P 群は 32 名,合計 72 名を解析対象とした.
主要評価項目ALSFRS-R スコアの主要解析は,『「第1 クール投与開始前」と「第 6 クール
投与終了2 週間後又は中止時(LOCF)」の ALSFRS-R スコアの差の群間比較』と,『各時期
のスコアについて,投与群,時期,投与群と時期の交互作用効果を要因とし,「第1 クール開
始前」,動的割付に用いた因子を共変量とした反復測定分散分析』とした.
FAS では,ALSFRS-R スコアの差(LSMean±S.E.)は,M 群(100 名):-5.70±0.85,P 群(99
名):-6.35±0.84,投与群間差の LSMean±S.E.とその 95%信頼区間は 0.65±0.78(-0.90~2.19) であり,投与群間で統計学的に有意な差を認めなかった(p=0.4108).また,反復測定分散分 析では,投与群×時期の交互作用を認めず(p=0.9151),各投与群の LSMean±S.E.は M 群: 38.08±0.47,P 群:37.43±0.46,投与群間差の LSMean±S.E.とその 95%信頼区間は 0.65±0.44(-0.22 ~1.52)であり,投与群間で統計学的に有意な差を認めなかった(p=0.1415).
EESP では,ALSFRS-R スコアの差(LSMean±S.E.)は,M 群(53 名):-4.85±1.24,P 群(46
名):-7.06±1.13,投与群間差の LSMean±S.E.とその 95%信頼区間は 2.20±1.03(0.15~4.26) であり,投与群間で統計学的に有意な差を認めた(p=0.0360).
definite or probable/EESP/2y では,ALSFRS-R スコアの差(LSMean±S.E.)は,M 群(39 名):
-4.58±1.55,P 群(29 名):-7.59±1.34,投与群間差の LSMean±S.E.とその 95%信頼区間は 3.01±1.33 (0.35~5.67)であり,投与群間で統計学的に有意な差を認めた(p=0.0270). t値 p値 P群 -20.80 ±2.06 4.89 ±2.35 t=2.08 p=0.0393 M群 -15.91 ±1.97 (0.24 , 9.54) 投与群 LSMean±S.E. (95%信頼区間) 調整済み平均値 LSMean±S.E. 調整済み平均値の投与群間差
2.5.4.2.3 継続試験(MCI186-17 試験) FAS を主たる解析対象集団とした.MP 群は 44 名,MM 群は 48 名,PM 群は 88 名,合計 180 名を解析対象とした. 継続試験の開鍵前に設定した MCI186-16 試験の追加解析で設定した集団である EESP は, MP 群は 25 名,MM 群は 27 名,PM 群は 44 名,合計 96 名であった. 「第 7 クール投与開始前」と「第 12 クール投与終了 2 週間後又は中止時(LOCF)」の ALSFRS-R スコアの差(LSMean±S.E.)は,FAS では,MP 群(41 名):-5.58±0.74,MM 群(44 名):-4.42±0.69,投与群間差の LSMean±S.E.とその 95%信頼区間は 1.16±0.93(-0.70~3.01) であり,投与群間で統計学的に有意な差を認めなかった(p=0.2176). EESP では,MP 群(25 名):-5.86±0.98,MM 群(27 名):-4.01±0.86,投与群間差の LSMean±S.E. とその95%信頼区間は 1.85±1.14(-0.45~4.15)であり,投与群間で統計学的に有意な差を認 めなかった(p=0.1127)が,この投与群間差 1.85 は MCI186-16 試験の EESP の P 群との投与 群間差2.20 に大きな違いを認めなかった. 2.5.4.2.4 探索的試験(ALS 重症度分類 3 度)(MCI186-18 試験) FAS を主たる解析対象集団とした.M 群は 13 名,P 群は 12 名,合計 25 名を解析対象とし た. 「第 1 クール投与開始前」と「第 6 クール投与終了 2 週間後又は中止時(LOCF)」の ALSFRS-R スコアの差(LSMean±S.E.)は,M 群(13 名):-6.52±1.78,P 群(12 名):-6.00±1.83 であった.投与群間差のLSMean±S.E.とその 95%信頼区間は-0.52±2.46(-5.62~4.58)であっ た. 2.5.4.2.5 探索的試験(第 II 相)(MCI186-12 試験) FAS を主たる解析対象集団とした.30 mg 群は 5 名,60 mg 群は 14 名,合計 19 名を解析 対象とした. 主要評価項目ALSFRS-R スコアの累積差に基づく下記の判定による抑制率は,30 mg 群で 20.0%(1/5 名),60 mg 群で 50.0%(7/14 名)であった. 評価方法 各期のALSFRS-R スコアの第 1 期投与前との差について,治験 6 ヶ月前から治験 1 ヶ月前の 6 時点の 平均,第2 期から第 6 期の各投与前及び第 6 期投与終了 2 週間後の 6 時点の平均をそれぞれ算出し,治 験前の累積差,治験期の累積差とした.治験前の累積差と治験期の累積差の比(100×治験期の累積差/ 治験前の累積差)を算出し,この比に基づいて以下の基準により被験者ごとに判定を行った. 判定基準 抑制:比が50%以下. やや抑制:比が50%より大きく,100%より小さい.
不変:比が100%以上. また,髄液中3NT の第 1 期(第 1 クール)投与前と第 6 期(第 6 クール)投与終了時との 差の平均値は,30 mg 群(4 名):-0.63 ng/mL,60 mg 群(12 名):-1.12 ng/mL であった. 60 mg 群の髄液中 3NT の推移を図 2.5.4.2-2に示した. 一部の被験者を除き,第1 期(第 1 クール)投与前と比較し第 6 期(第 6 クール)投与終 了時には,髄液中3NT は検出限界以下若しくはそれに近似した値に減少した. 図 2.5.4.2-2 60 mg 群の髄液中 3NT の推移(MCI186-12 試験) 被験者数:60 mg 群 14 名. 5.3.5.2-1 付録 16.2.6.1 より引用(作図) 2.5.4.2.6 全有効性試験の結果の比較検討 本剤の有効性を主として評価したMCI186-19 試験では,主要評価項目 ALSFRS-R スコアの 主要解析の結果は,投与群間差のLSMean±S.E.とその 95%信頼区間が 2.49±0.76(0.99~3.98) であり,投与群間で統計学的に有意な差を認めた(p=0.0013).この結果を,MCI186-19 試験
を実施するために検討した MCI186-16 試験の FAS と部分集団 EESP 及び definite or
probable/EESP/2y,MCI186-17 試験の FAS と部分集団 EESP の結果と比較した.
MCI186-19 試験の FAS,MCI186-16 試験の EESP,non-EESP,definite or probable/EESP/2y, non-definite or probable/EESP/2y 及び FAS,MCI186-17 試験の EESP,non-EESP,definite or probable/EESP/2y,non-definite or probable/EESP/2y 及び FAS の ALSFRS-R スコアの主要解析 結果を表 2.5.4.2-10に示した.
MCI186-16 試験は,FAS で投与群間差の LSMean±S.E.とその 95%信頼区間は 0.65±0.78(-0.90
~2.19)であり,投与群間で統計学的に有意な差を認めなかった(p=0.4108).このため,追
加解析の結果から,本剤の有効性の検討に適切な部分集団としてEESP,EESP よりも更に本
剤の有効性の検討に適切な部分集団としてdefinite or probable/EESP/2y を設定した.
り,投与群間で統計学的に有意な差を認めた(p=0.0360).更に,definite or probable/EESP/2y
では,投与群間差のLSMean±S.E.とその 95%信頼区間は 3.01±1.33(0.35~5.67)であり,投
与 群 間 で 統 計 学 的 に 有 意 な 差 を 認 め た (p=0.0270 ). definite or probable/EESP/2y で の ALSFRS-R スコア投与群間の差は,EESP よりも広がった.
MCI186-19 試験は,MCI186-16 試験の definite or probable/EESP/2y の結果を検証することを
目的として,definite or probable/EESP/2y と同じ集団になる選択基準及び除外基準を設定した.
その結果,MCI186-19 試験の主要評価項目 ALSFRS-R スコアの変化量の投与群間差(2.49)
は,MCI186-16 試験の definite or probable/EESP/2y の投与群間差(3.01)と,おおむね同程度
であった.
MCI186-16 試験に引き続き実施した MCI186-17 試験においても,部分集団 EESP で解析を
行うことをMCI186-17 試験の開鍵前に規定した.MCI186-17 試験の FAS では,MM 群と MP
群の投与群間差のLSMean±S.E.とその 95%信頼区間は 1.16±0.93(-0.70~3.01)であり,投与
群間で統計学的に有意な差を認めなかった(p=0.2176).MCI186-17 試験の EESP では,投与
群間差のLSMean±S.E.とその 95%信頼区間は 1.85±1.14(-0.45~4.15)であり,投与群間で統
計学的に有意な差を認めなかった(p=0.1127)が,FAS と比較して投与群間差が広がった.
MCI186-17 試験の投与群間差は,MCI186-16 試験で M 群であった被験者が,MCI186-17 試験
で本剤投与群(MM 群)とプラセボ投与群(MP 群)に変更された後の 6 クール後の差であ
るが,MCI186-17 試験 EESP の投与群間差(1.85)は,MCI186-16 試験 EESP の投与群間差(2.20)
と大きな違いは認められなかった.
MCI186-16 試験及び MCI186-17 試験の EESP で,本剤とプラセボの投与期間を区別した
ALSFRS-R スコアの推移を図 2.5.4.2-3に示した. MCI186-16 試験及び MCI186-17 試験の全期間を通して,いずれの時期であっても,本剤が 投与されている時期のALSFRS-R スコアの低下の傾きはおおむね一定であった.また,プラ セボが投与されている時期も,いずれの時期であってもALSFRS-R スコアの低下の傾きはお おむね一定であった. MCI186-19 試験では,二重盲検期完了後,実薬期として第 7 クール以降 12 クールまで本剤 が投与された.MCI186-19 試験の二重盲検期と実薬期を通した ALSFRS-R スコアの推移を, 投与群ごとに図 2.5.4.2-4に示した. 本剤を12 クール投与した M-M 群では,ALSFRS-R スコアは第 1 クールから第 12 クール まで直線的な経時的推移を示し,治験薬の効果の持続を認めた.
以上のことから,MCI186-19 試験,MCI186-16 試験の EESP,definite or probable/EESP/2y
及びFAS,MCI186-17 試験の EESP 及び FAS の ALSFRS-R スコアの推移及び主要解析結果は,

![表 2.5.4.2-1 有効性評価に用いた臨床試験の要約(2/2) 試験番号 添付資料 番号 試験施設数 場所 試験開始日 登録状況 日付 総登録数/ 登録目標数 デザイン 対照の種類(併用薬剤の種類を含む) 試験薬 比較対照薬 投与量 投与経路・投与方法 試験の 目的 登録時/ 完了時の群別被験者数 試験 期間 男性/女性 年齢の 中央値 (範囲) 診断 選択基準 主たる エンド ポイント MCI186-12 [5.3.5.2- 1] 1 国内 2001/11](https://thumb-ap.123doks.com/thumbv2/123deta/6396277.637654/33.1263.130.1151.142.310/目標数デザイン併用薬剤種類試験薬登録時中央値エンドポイント.webp)