Title
グラジオラスモザイク病防除に向けた弱毒ウイルス株の開発と実 用化Author(s)
長岡, 栄子Editor(s)
Citation
大阪府立大学, 2009, 博士論文.Issue Date
2009URL
http://hdl.handle.net/10466/6469Rights
大阪府立大学博士
(応用生命科学)学位論文
グラジオラスモザイク病防除に向けた
弱毒ウイルス株の開発と実用化
目 次
緒 言
……….……. 1第1章 グラジオラスにおけるモザイク病の発生状況と病原ウイルス
...1.1 材料と方法
...1.1.1 発生実態の調査
...1.1.1.1 簡易間接 ELISA 法
...1.1.1.2 接種
...1.1.1.3 ウイルスの純化
...1.1.1.4 二重拡散法
...1.1.1.5 ササゲを用いた生物検定法
...1.1.2 ほ場における伝染
...1.1.2.1 グラジオラス間の伝染
...1.1.2.1.1 RT-PCR 法 ...
...1.1.2.2 グラジオラス-ソラマメ間の伝染 ...
...1.1.3 栄養繁殖による伝染 ...
...1.2 結果と考察 ...
...1.2.1 発生実態の調査 ...
...1.2.2 ほ場における伝染 ...
...1
10
11
11
12
12
13
14
14
15
15
15
16
16
16
16
20
第2章 弱毒ウイルス株の作出と選抜
...2.1 BYMV 弱毒ウイルス株 ...
...2.1.1 材料と方法 ...
...2.1.2 結果と考察 ...
...2.2 CMV 弱毒ウイルス株 ...
...2.2.1 材料と方法 ...
...2.2.2 結果と考察 ...
...第3章 ウイルス株の識別検出法の確立と干渉効果の評価
...3.1 弱毒ウイルス株 BYMV-M11 の干渉効果 ...
...3.1.1 材料と方法
...3.1.1.1 ウイルス
...3.1.1.2 ウイルスゲノム塩基配列の決定と系統解析 ...
...3.1.1.3 識別検出法
...3.1.1.3.1 ウエスタンブロット法 ...
...3.1.1.3.2 RT-PCR 法
...3.1.1.3.3 SSCP 法 ...
...3.1.1.4 干渉効果試験 ...
...3.1.1.5 同一 Pathotype 株間における干渉効果試験
...3.1.2 結果と考察
...3.1.2.1 ウイルスゲノム塩基配列の決定と系統解析
...25
25
25
26
29
30
30
32
33
33
33
35
35
35
36
36
37
37
38
38
3.1.2.3 干渉効果試験 ...
...3.1.2.4 同一 Pathotype 株間における干渉効果試験 ...
...3.2 弱毒ウイルス株 CMV-CM95 の干渉効果 ...
...3.2.1 材料と方法 ...
...3.2.1.1 識別検出法 ...
...3.2.1.2 干渉効果試験 ...
...3.2.2 結果と考察
...3.2.2.1 RT-PCR-RFLP 法による識別検出
...3.2.2.2 干渉効果試験 ...
...第4章 弱毒ウイルス株 BYMV-M11 の治療的効果
...4.1 材料と方法 ...
...4.1.1
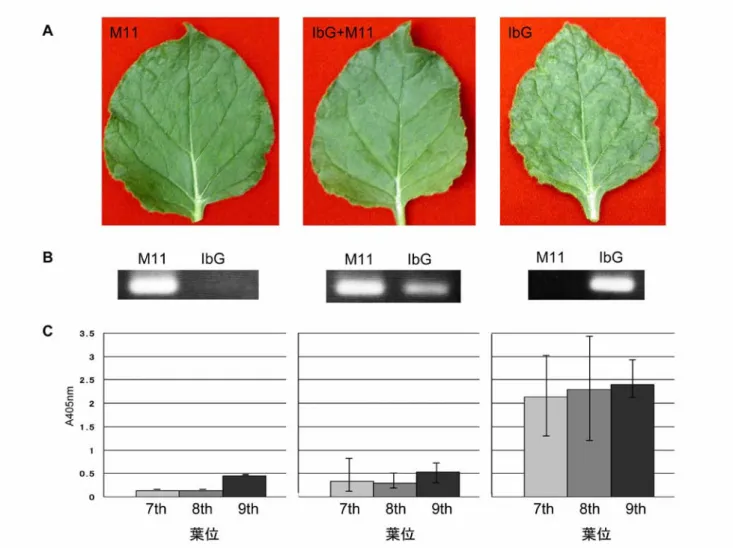
IbG に対する M11 処理の影響
...4.1.2 IbG-YFP に対する M11 処理の影響
...4.1.3 IbG-YFP に対する M11-CFP 処理の影響
...4.2 結果と考察 ...
...4.2.1
IbG に対する M11 処理の影響
...4.2.2 IbG-YFP に対する M11 処理の影響
...4.2.3 IbG-YFP に対する M11-CFP 処理の影響
...46
48
49
49
49
50
52
52
53
56
57
57
57
59
59
59
61
64
5.2.1 材料と方法
...5.2.2 結果と考察
...総合考察
...
摘 要
...
引用文献
...
71
71
75
84
89
緒 言
グラジオラス (Gladiolus spp.,アヤメ科) は 250 以上の種からなる大きな属で、アフリカ、中央 ヨーロッパ、地中海沿岸地方に分布し、そのうち約7割は南アフリカに自生している。グラジオ ラスの育種が始まったのは 18 世紀の半ばであり、わが国でのグラジオラスの切り花栽培は明治の 後半から始まり、昭和に入って多くの品種が輸入され栽培が盛んとなった。グラジオラスは他の 花き類と比較して栽培労力が少ない品目であるため経営に取り入れやすく、その栽培は球茎の出 荷を目的とした栽培型と、生産した球茎を切り花栽培に利用する栽培型に分けられる。いずれの 栽培型においても経営に占める球茎 (球根) 代の比率が高く、無病で良質の球茎の確保が重要であ る。球茎の生産は全て栄養繁殖によるもので、親球茎の基部に着生する木子 (図) により増殖を行 い、これを休眠打破・養成して球茎を生産している。平成 18 年度の国内の球茎収穫面積は約 35ha で、2340 万球が出荷され、そのうち約 8 割を茨城県が生産している (農林水産統計情報総合デー タベース)。グラジオラスの球茎の栽培には 6~7 ヶ月間、切り花栽培には約 3 ヶ月間を要し、そ の間における病害虫防除にかける作業比率は大きい。病害ではボトリチス病、赤斑病、首腐病、フザリウム腐敗病、ウイルス病などがあり、中でも 薬剤による防除が不可能なウイルス病の防除は徹底したウイルス罹病株の抜き取りしか手段は無 い。また、グラジオラス葉部での罹病程度が小さい場合はその発見が遅れて後に伝染源になる可 能性があり、また、切り花栽培では出荷後に花弁に病徴が現れて商品性が低下することなどが問 題となる。さらに、グラジオラスは連作と弱光を嫌うためにハウスでの栽培が少なく、主に露地 栽培であることが昆虫によって媒介されるウイルス病の被害を大きくしている。国内のグラジオ ラスに発生する主なウイルスとしては、インゲンマメ黄斑モザイクウイルス (Bean yellow mosaic
virus: BYMV)、 キュウリモザイクウイルス (Cucumber mosaic virus: CMV)、タバコ輪点ウイルス、
タバコモザイクウイルスおよびソテツえそ萎縮ウイルスがある (日本植物病理学会, 2000) が、こ れらのうち BYMV と CMV がモザイク病の主要な病原ウイルスであり、栽培ほ場での発生程度は 非常に高いことが報告されている (福本ら, 1982; 高津ら, 1998; 和田ら, 2000)。しかし、これらの 報告では、ウイルスの種類や病徴などの発生実態を明らかにしたに過ぎず、これらウイルスの伝 染源の特定、ほ場内におけるグラジオラス個体間の伝染・拡大の程度の調査はなされていない。 Pierce によって初めて報告された BYMV (Pierce, 1934) は Potyviridae 科、Potyvirus 属に属し (Shukla et al., 1994)、プラスの一本鎖 RNA 単一ゲノムをもつ長さ 750 nm のひも状ウイルスである。 宿主範囲は比較的狭いが、多くの植物・作物で発生が認められており、非常に広い環境条件下で 発生している (兼重ら, 1991; Sasaya et al., 1998; 土崎ら, 1981)。また、Potyvirus 属が食料生産上最 も重要な被害をもたらす原因には、種々のアブラムシによって非永続的に伝搬されることがあげ られる (Bos, 1970a)。BYMV の属する Potyvirus 属は約 180 種のウイルスからなり、47 ある植物ウ イルス属の中で最大である。この種類の多さから、同じ Potyvirus 属内にあっても理化学的性状、 生物学的性状、血清学的性状の変異幅が著しく、古典的手法による分類では種と系統を区別する
田ら, 2000)。しかし、Potyvirus 属に属する BYMV と近縁種のクローバ葉脈黄化ウイルス (Clover
yellow vein virus:ClYVV) はインゲンマメに感染し、BYMV の抗体とも反応するため、これらの
類別方法では BYMV と ClYVV を区別できず、両者を同種内の系統と誤認する可能性がある。こ のような、Potyvirus 属が抱える種と系統を区別する基準の設定不備という問題は、Potyvirus 属に 属するウイルスの研究において、大きな支障となっている。
CMV は広い宿主範囲を有し、宿主植物が 1,000 種に達すると推定される (Palukaitis et al., 1992)
Bromoviridae 科、Cucumovirus 属のタイプ種であり (Fauquet et al., 2002)、プラスの一本鎖 RNA 3
分節ゲノムをもつ直径約 30 nm の球状ウイルスである。自然界では主にモモアカアブラムシ、ワ タアブラムシ、ダイコンアブラムシなどに代表される約 80 種のアブラムシにより、非永続的に伝 搬される。CMV には、宿主範囲、病徴、血清型の違いから多くの系統が知られており、日本国内 に発生する CMV については、主にタバコにおける病徴によって分けた 5 系統 (普通系、軽症系、 黄斑系、黄色微斑系、マメ科系) (都丸と宇田川, 1970) や、宿主植物の種類によって分けた 6 系統 群 (普通系統群、マメ科系統群、アブラナ科系統群、ヒユ・アカザ系統群、マメ・アブラナ科系 統群、ラゲナリア属系統群) (小室, 1996) などが報告されている。また、血清学的性質の違いから、 Subgroup Ⅰと SubgroupⅡに大きく分類でき (Palukaitis and García-Arenal, 2003)、日本で分類されて いた Y 型と P 型は、それぞれ SubgroupⅠと SubgroupⅡに相当することが明らかにされており、ま た、この SubgroupⅠ、Ⅱの分類は、近年の塩基配列の解析による相同性の相違とも一致している (Wahyuni et al., 1992)。 これら植物ウイルスに対する防除戦略は、化学的、生物的、耕種的アプローチから研究されて いる。抗ウイルス薬剤の開発は、植物ウイルスの防除において画期的な防除戦略となりうるであ ろう。しかし、植物ウイルスは自身の代謝機能を持たず、感染した植物体の代謝に依存して増殖
一旦感染した作物の被害の拡大は防げない。ウイルス抵抗性品種の利用は植物自体の保護にあた り、環境汚染のない効果的、経済的な手段である。しかしながら、抵抗性遺伝子は、限られたウ イルスに対して限られた品種でのみ存在すること、また、抵抗性遺伝子を打破するウイルス系統 が出現する可能性が高いことなどから、ウイルス病の完全な防除戦略とはなっていない。 そこで、植物ウイルス防除に向けて残された強力な戦略として、弱毒ウイルスの利用が注目さ れている。これは、植物があるウイルスに感染すると同種あるいは近縁のウイルスに感染しにく くなる、「干渉効果」という現象を利用し、弱毒系統のウイルスを予め植物体に接種し、強毒系統
のウイルスによる感染を防ぐという方法である (Hanada, 1995; Kameya-Iwaki, 1994; Lecoq, 1998; Pennazio et al., 2001)。ウイルスの干渉効果は基本的に植物の品種やウイルス種による制限が無い こと、また自然界においてみられる現象であることから安全と考えられ、弱毒ウイルスの接種苗 や感染種苗での流通・販売は農薬取締法には抵触しないことなど実用化の際における支障は少な い。これらのことから、弱毒ウイルスは現時点では極めて有効な防除手段と考えられている。 干渉効果の機構については、1次ウイルスの外被タンパク質による2次ウイルスの脱外被阻害あ るいは2次ウイルス核酸の包み込み、遺伝子RNA間の結合あるいは両遺伝子の複製の場における競 合、2次ウイルスの増殖に必要な前駆体物質の欠乏などの説があった (Sherwood, 1987) が、いず れの説も干渉現象を一元的に説明することはできなかった (Pennazio et al., 2001)。現在では、外来 遺伝子の防除機構である転写後型ジーンサイレンシング (post-transcriptional gene silencing : PTGS) が干渉効果に関与すると考えられている (Ratcliff et al., 1997, 1999; Ruizet al., 1998)。植物のウイル スに対する防御反応としてのPTGSは、植物細胞内のヌクレアーゼによってウイルスの複製中間体 である2本鎖RNAが21から24塩基程度の短いRNA (small interfering RNA: siRNA) に分解され、これ がRISC (RNA-induced silencing complex) に取り込まれ、siRNAと相同な配列のRNAを切断すると
に対して、ウイルスがこのPTGSを抑制するサプレッサー機能を有することも明らかとなっている。 BYMVとCMVではそれぞれのウイルスのHC-Pro (Anandalakshmi et al., 1998; Kasschau et al., 1998; Valkonen et al., 2002) と2bタンパク質 (Brigneti et al., 1998)がサプレッサー機能に関与する。
わが国における弱毒ウイルスの研究は、1965年に大島らによるタバコモザイクウイルス(Tobacco
mosaic virus: TMV) トマト系統 (現在のトマトモザイクウイルス, Tomato mosaic virus) に対す
る弱毒ウイルスL11の作出に始まり、その後ダイズ (黒大豆) でのダイズモザイクウイルス
(Soybean mosaic virus: SMV) (Kosaka and Fukunishi, 1994), キュウリでのズッキーニ黄斑モザイク ウイルス (Zucchini yellow mosaic virus: ZYMV) (Kosakaet al., 2006)、キュウリやトマト、ピーマン でのCMV (Kosaka and Fukunishi, 1997; Sayama et al., 1993) など種子繁殖植物を対象にした弱毒ウ イルスや、 リンドウでのBYMV (Uga et al., 2004)、ジネンジョでのヤマノイモモザイクウイルス (Japanese yam mosaic virus: JYMV) (藤ら, 2000)、サツマイモでのサツマイモ斑紋モザイクウイル ス (Sweet potato feathery mottle virus: SPFMV) (Yamasaki et al., 2009) など栄養繁殖植物を対象に した弱毒ウイルスが開発され、高い防除効果が報告されている。また、現在では弱毒ウイルスを 接種したトマトやカラーピーマン苗がメーカーにより商品化されるなど、弱毒ウイルスは「ワク チン」と称して一般家庭レベルまで普及している。さらに2008年には、ZYMVの弱毒ウイルス株 2002 (Kosaka et al., 2006) が弱毒ウイルスでは初めての生物農薬「“京都微研”キュービオZY-02」 (登録番号第22152号) として農薬登録される (梁ら, 2007, 2008) など、国内における弱毒ウイル スへの期待は大きい。
これら弱毒ウイルスを利用したウイルス病防除のための一連の研究工程には 1) 弱毒ウイルス の作出と選抜、2) 対象植物への導入 (接種)、3) 防除 (干渉) 効果の評価がある。以下、これらの 工程を遂行する上での留意点を示す。
1996; Sasayaet al., 1998; 都丸と宇田川, 1970; Wahyuni et al., 1992)、感染性や全身移行性など系統間 での特性の違いが知られている。したがって、系統の種類によっては干渉効果に差が生じる可能 性がある。Potyvirus 属の ZYMV の弱毒株 ZYMV-WK はフランス分離株であるが、フランス、フ ロリダ、台湾よりそれぞれ分離された強毒株のうち、フランス分離強毒株に対してのみ高い干渉 効果を示した (Wang et al., 1991)。このことから Lin らは、干渉効果にはウイルスの系統的特異性 があり、その地域で流行している強毒ウイルス群から弱毒ウイルスを作出・選抜することにより 干渉効果の系統的特異性を回避できると述べている (Linet al., 2007)。したがって、弱毒ウイルス を作成・選抜にあたっては、実際に発生している系統を元にして行う必要がある。 2) 対象植物への弱毒ウイルスの導入 (接種) 工程における留意点は、その植物が種子繁殖植物 の場合と栄養繁殖植物の場合では、異なる場合がある。一般に種子繁殖植物の場合、弱毒ウイル スの接種は比較的容易であるが、植え付けごとに弱毒ウイルスを接種する必要があるため、大き な労力を要する。一方、栄養繁殖植物の場合、こすりつけ接種のような簡便な方法でのウイルス 接種は難しい (Yamasaki et al., 2009)。しかし、一旦弱毒ウイルスを導入できれば、弱毒ウイルス は栄養繁殖により後代に伝染するので、その後の接種作業は不要となる。 グラジオラスは園芸品目の一つであることから、品種による花の形状、色などの形質の相違は 商品性に大きく影響する。また、栽培においても、開花特性に関して品種間差異が極めて大きく、 各作型に適した品種の選定が重要である。このことから、グラジオラスのウイルス防除技術を考 える上で、品種特性を無視することはできない。しかしながら、グラジオラスについてもウイル ス接種は非常に困難であり (福本、高津、私信)、遺伝的に固定されていない実生苗への接種が試 みられているにすぎない (福本ら, 1982)。グラジオラスにおける弱毒ウイルスを含めたウイルス病 の研究において、品種を特定した効率的なウイルス接種技術の開発は急務といえよう。
て弱毒ウイルス処理により抑制されるならば、弱毒ウイルスの防除効果は高く評価される。一方、 グラジオラスのような栄養繁殖植物の場合、一旦強毒ウイルスが感染すれば栄養繁殖により強毒 ウイルスが後代に伝染する可能性が高く、そのような個体の後代では弱毒ウイルスの防除効果は 失われる。したがって、栄養繁殖植物においては、強毒ウイルス株の感染を完全に阻止する高度 な干渉効果が求められる。そしてまた、干渉効果の程度を判断するためには、弱毒ウイルス株と 強毒ウイルス株とを正確に識別し、それぞれを高感度に検出できる方法が必要となる。 なお、グラジオラスモザイク病の主要ウイルスである BYMV が属する Potyvirus 属には多くの 種が含まれ、種や系統の分類は必ずしも整ってはいない。そのため干渉効果試験に用いるウイル ス株の選定は難しい。古典的分類手法により分類したウイルス株を用いた過去の干渉効果試験で は、干渉効果が完全であったり (Corbett, 1957; Goodchild, 1956)、不完全であったり (Bos, 1970b; Grogan and Walker, 1948)、効果が無かったり (Thomas and Zaumeyer, 1953) と様々な結果がある。 これらは、用いたウイルス株の種や系統の分類が整っていなかったために起こるウイルス株の選 定ミスが原因と思われる。一方、ウイルスゲノムの塩基配列の情報を利用した種や系統の分類方 法は信頼性が高く、近年 Potyvirus 属についても種や系統を分類する際に利用されつつある。例え ば、Potyvirus 属の BYMV と ClYVV は宿主範囲が近く、同じタイプの管状封入体と核封入体を形 成し、互いに血清関係がある (Barnett et al., 1987; Bos et al., 1974; 井上, 1968; Jones and Diachun, 1977) ため同種とされていたが、遺伝子解析などの分子生物学的研究により現在では別種とされ ている (Tracy et al., 1992; Uyeda et al., 1991; Uyeda et al., 1992)。したがって、BYMV の干渉効果試 験には、遺伝子情報による種や系統が正確に確認された株の利用が必要である。
以上の 3 工程における留意点から、栄養繁殖植物のグラジオラスを対象にした弱毒ウイルスの
実態の調査から弱毒ウイルス株の選抜・評価項目を定め、現場に適した弱毒ウイルス株の開発、 評価および利用技術の開発を行なった。さらに、弱毒ウイルスの厳密な干渉効果の評価に向けた 高感度の識別検出法を検討し、BYMV についてはゲノムの塩基配列を決定したウイルス株を使用 して、干渉効果と遺伝子情報の関連性を調査した。また、実用段階における「弱毒ウイルス感染 球茎の増殖・供給体制作り」を考慮し、特定グラジオラス品種への弱毒ウイルス株の効率的接種 法の検討と、栄養繁殖による弱毒ウイルス株の垂直伝染性を調べた。その結果、グラジオラスの モザイク病の主要病原ウイルスである BYMV と CMV について、病徴がほとんど無く,病原ウイ ルスに対して高い干渉効果を発揮し,グラジオラス幼苗 (培養苗) へ高率に感染し,栄養繁殖によ って高率に伝染する,非常に有用性の高い弱毒ウイルス株を得ることができた。これらの知見と 技術は、グラジオラスのモザイク病防除に大いに貢献すると考えられる。
謝 辞
本研究を行うにあたり、終始懇切なご指導とご教示を賜った大阪府立大学生命環境科学研究科 教授大木 理博士に、謹んで感謝の意を表します。平成 14 年までの職場である京都府農業資源研 究センターの所長小坂能尚博士には研究を行うにあたり終始適切なご指導・ご助言を頂きました。 宇都宮大学農学部教授夏秋知英博士には本研究を遂行する上での有益なテクニックをご指導して 頂きました。また、北海道大学農学研究院教授の上田一郎博士には、BYMV-CS 株のシークエン ス情報を頂きました。現在勤務する独立行政法人中央農業総合研究センターの大村敏博博士、並 びに笹谷孝英博士には、論文を執筆するにあたり非常に有益なご助言を賜りました。これらの方々 に厚くお礼を申し上げます。また、BYMV-IbG 株を頂いた茨城県農業総合センターの高津康正博 士 (現在茨城県農業大学校勤務)、実験方法のアドバイスならびに GFP を標識した BYMV 感染性 クローンを頂いた岩手大学農学部高橋 翼博士、研究を行う上で有益な助言を頂いた元京都府農 業資源研究センターの故 小堀 崇博士ならびに株式会社微生物化学研究所の梁 宝成博士、宇都 宮大学農学部卒業生の大森 (鈴木) 雅子さん、佐藤知香子さん、研究時間の調整に協力してくれた 夫、長岡一成氏をはじめ、皆様に心から感謝いたします。 さらに、本論文を草するにあたり、論文のご校閲を賜るとともに種々ご教示を頂いた大阪府 立大学生命環境科学研究科教授小田雅行博士ならびに同小泉 望博士に深く感謝します。第1章 グラジオラスにおけるモザイク病の発生状況と病原ウイルス
弱毒ウイルスを作出・選抜するためには、現場における実際の発生状況に基づいた形質で選 抜・評価する必要がある (Lin et al., 2007)。同種のウイルスであっても系統や株によって特性が 異なる場合があり、BYMV と CMV についてもそれぞれ幾つかの系統に分類され、感染性や全身 移行性など系統間での特性の違いが知られている。また、BYMV と同じ Potyvirus 属に属する ZYMV 弱毒株の干渉効果については系統的特異性が報告されている (Wang et al., 1991)。そこで 本章では、グラジオラスモザイク病の防除に向けた弱毒ウイルス系統を作出・選定するための基 本資料として、グラジオラスほ場におけるウイルスの発生実態を詳細に調査した。 さらに、ウイルス病の防除に限らず、病原と伝搬様式の特定は、病気の防除に不可欠である。 国内のグラジオラスにはこれまでに BYMV や CMV、ソテツえそ萎縮ウイル、タバコモザイクウ イルス、タバコ輪点ウイルス等が報告されており (日本植物病理学会, 2000)、これらのうち BYMV と CMV が重要な病原ウイルスであり、栽培ほ場での発生程度は非常に高い (福本ら, 1982; 高津ら, 1998; 和田ら, 2000)。しかしながら、これらの報告ではウイルスの種類や病徴など の発生実態を明かしたに過ぎず、これらウイルスのほ場外部からの侵入、ほ場内におけるグラジ オラス個体間の伝染、拡大の程度は調査されていない。そこで、主要な病原ウイルスである BYMV と CMV のグラジオラスほ場における発生状況、伝染性を明らかにするためウイルスフリーの実 生苗を使った暴露試験、ならびに栄養繁殖による球茎や木子へのウイルス伝染程度について調査 した。
図 1-1 グラジオラス葉部(左)・花部(右)におけるウイルスモザイク病の病徴
1.1 材料と方法
1.1.1 発生実態の調査
1997 年の 4 月から 10 月にかけて、ポット栽培した市販球茎と京都府内のほ場で栽培されてい るグラジオラス (図 1-1) から葉をランダムに採取した。また、京都府内の栽培ほ場については、 病徴が軽いグラジオラス葉と激しいグラジオラス葉をそれぞれ分けて採取した。これらについて 簡易間接 ELISA 法を行い、BYMV と CMV および TMV の感染を調べた。 グラジオラス葉からのウイルスの単離は、キノア (Chenopodium quinoa) を用いて 2 回の単 病斑分離法により行い、BYMV はソラマメ (品種:ミンポー) で、CMV は Nicotiana rustica で増 殖した。単離・増殖した BYMV 分離株は、インゲンマメの 4 品種 (本金時,ケンタッキーワン ダー,マスターピース,トップクロップ) における病原性の違いによって 4 つの Pathotype (Ⅰ~ Ⅳ; Sasaya et al., 1998) に類別した。さらに、BYMV 単独感染のグラジオラス個体については、品さらに、0.1 mg/mL と 1.0 mg/mL の高濃度の CMV の純化ウイルスを用いて、グラジオラス木 子苗 (第1葉が約 10 cm 長) へのウイルス接種を試みた。それぞれ 5 株の苗に 10 μL のウイルス 液を接種し、21 日後の接種葉を採取して ELISA 法によりウイルスの感染の有無を調べた。
1.1.1.1 簡易間接 ELISA 法
Clark らの手法にしたがった (Clark et al., 1977)。ウイルス感染葉をコーティング緩衝液 (50 mM Na2CO3, pH 9.6) ですり潰し、この緩衝液で 100 倍に希釈した汁液を ELISA プレート
(Greiner bio-one; 655061) に分注した。37℃で 30~60 分間 (ウイルスにより適宜調整) 静置した のち、蒸留水でプレートを 3 回洗浄し、各ウイルスの抗体液とヤギ-ウサギ IgG (GE Healthcare Bio-Sciences) を同時に PBS-T (20 mM Na2HPO4, 20 mM NaH2PO4, 150 mM NaCl, 0.05% Tween-20
pH 7.4) で 2000 倍に希釈し、抗体反応 (37℃で 60 分間) を行った。ウイルス抗体液は、BYMV 検出には BYMV 90-2 を抗原に作成したポリクローナル抗体 (笹谷ら, 1993)、CMV 検出には CMV-Y のポリクローナル抗体 (Tochihara, 1970) 、TMV 検出には日本植物病疫協会より購入し たポリクローナル抗体を、全て 2000 倍希釈で使用した。3 回の洗浄の後、10%ジエターノール アミン液 (pH 9.8) に溶解した 0.1%酵素基質 (フォスファターゼ基質) を分注して発色させ、分 光光度計 (OD 405 nm) により測定した。
1.1.1.2 接種
純化ウイルスを 0.1 M リン酸緩衝液 (pH 7.0) で適宜希釈し、常法によりカーボランダムを接 種葉にふりかけて、綿棒を用いてこすりつけて接種した後、水道水で洗浄した。感染葉を接種源 とする場合は、0.1%メルカプト酢酸を含む 0.1 M リン酸緩衝液 (pH 7.0) で感染葉をすり潰した1.1.1.3 ウイルスの純化
BYMV:
感染葉 50 g と 4 倍量 (100 mL) のトリス抽出バッファー[0.1 M トリス: pH 7.0,0.05 M エチレ ンジアミン 4 酢酸 2 ナトリウム (EDTA): pH 7.0,0.5% メルカプトエタノール]をホモジナイザー で磨砕 (12,000 rpm, 5 min) し、二重ガーゼで濾過した後、汁液の半量 (100 mL) の四塩化炭素を 加えて強く撹拌した。遠心分離 (7,000 rpm, 10 min, 4℃) により得た上清に,4% (W/V) ポリエチ レングリコール (PEG, 平均分子量 6000)、2% TritonX-100 を加えて 30 分間以上撹拌して完全に溶 解させた後、60 分間氷上で静置した。遠心分離 (7,000 rpm, 10 min, 4℃) により得たウイルス沈殿 を 150 mL の溶解バッファー[0.01 M PB: pH 7.0, 0.5 M 尿素]を加えて、テフロンホモジナイザー で懸濁し、氷冷しながら更に 20 分間撹拌して完全に溶かした。これに半量 (75 mL) の四塩化炭 素を加えて強く撹拌した後、遠心分離 (7,000 rpm, 100 min, 4℃) して得た上清は 20%ショ糖を加え た溶解バッファーの上に重層し、超遠心分離 (32,000 rpm, 90 min, 4℃) してウイルス画分の沈殿を 得た。これに少量の溶解バッファーを加えて 4℃で1時間静置した後、100 mL の溶解バッファー を加えてテフロンホモジナイザーで乳化した。遠心分離 (10,000 rpm, 10 min, 4℃) して得た上清を さらに超遠心分離 (32,000 rpm, 90 min, 4℃) して BYMV 沈殿を得た。これを少量の 0.01 M PB で 完全に懸濁し、遠心分離 (12,000 rpm, 10 min, 4℃) した上清を部分純化ウイルス液とした。部分純 化ウイルスは C. quinoa に接種して感染性を確認した後、-80℃で凍結保存した。
CMV:
感染葉 50 g と 2 倍量 (100 mL) の抽出バッファー[0.5 M クエン酸 3 ナトリウム,0.01 M EDTA: pH 7.0,0.1% チオグリコール酸ナトリウム]をホモジナイザーで磨砕 (12,000 rpm, 5 min) し、二[0.01 M PB: pH 7.0, 0.01 M EDTA, 0.5% TritonX-100]を加えて、テフロンホモジナイザー懸濁し、 氷冷しながら更に 20 分間撹拌して完全に溶かした。これを遠心分離 (9,000 rpm, 20 min, 4℃) し、 得た上清を超遠心分離 (38,000 rpm, 90 min, 4℃) し、沈殿として粗 CMV 画分を得た。粗 CMV 画 分に少量の溶解バッファーを加え 4℃で 2 時間静置した後、更に溶解バッファーを加えながらテ フロンホモジナイザーで乳化した (最終 100 mL)。遠心分離 (10,000 rpm, 10 min, 4℃) し、得た上 清は 20%ショ糖を加えた溶解バッファーの上に重層し、超遠心分離 (38,000 rpm, 90 min, 4℃) して 沈殿を得た。これに 50 mL の溶解バッファーを加えテフロンホモジナイザーで乳化し、遠心分離 (10,000 rpm, 10 min, 4℃) し、得た上清をさらに超遠心分離 (38,000rpm, 90 min, 4℃) して CMV 沈 殿を得た。これを少量の 0.01 M PB で完全に懸濁して純化ウイルス液とした。CMV の濃度は分光 光度計で測定し、E260=5 を 1 mg/mL として計算した。純化ウイルスは C. quinoa に接種して感染 性を確認した後、-80℃で凍結保存した。
1.1.1.4 二重拡散法
常法 (大木, 1997) に従い、CMV の SubgroupⅠとⅡについてのポリクローナル抗体 (それぞれ CMV-Y,CMV-P) (Tochihara, 1970) を用いて行った。1.1.1.5 ササゲを用いた生物検定法
ジュウロクササゲ (黒種三尺) の初生葉にウイルス液を接種し、接種葉および本葉における病徴 を観察した。接種葉にのみ局部病斑が出現した場合は普通系統、病徴が全身に認められた場合は マメ科系統と判定した (都丸・宇田川, 1970)。1.1.2 ほ場における伝染
京都府農業資源研究センター内ほ場と茨城県農業総合センター生物工学研究所内ほ場において、 調査を行った。1.1.2.1 グラジオラス間の伝染
2001 年 5 月 28 日から 7 月 2 日にかけて、ウイルスが多発しているグラジオラス栽培ほ場に隣 接してプランター植えのグラジオラス実生苗 (第 2 葉展開初期) を配置し、BYMV と CMV の感 染を ELISA 法と Reverse Transcription-Polymerase Chain Reaction (RT-PCR) 法により調べた。実生 苗はグラジオラスの種子から生じた幼苗であるが、遺伝的に固定されておらず、親株とは異なる 形質であり、品種特定は不可能である。これらの実生苗は、試験開始前に BYMV と CMV が検 出されないことを確認した。京都府と茨城県のほ場について、それぞれ 240 株と 451 株の実生苗 を調べた。試験終了後、一部は球茎を回収して次代の球茎苗についてウイルスの感染を調べた。 次代苗については、当代の球茎や木子を堀あげ、1 ヶ月以上自然乾燥し、自然低温処理 (約 2 ヶ 月間) により休眠打破し、ベンレート水和剤 (住友化学) を粉衣処理して播種した。出芽後、そ の葉片についてウイルス検出を行った。1.1.2.1.1 RT-PCR 法
グラジオラス葉を採取し、全 RNA を抽出した。RNA 抽出には Perry と Francki (Perry & Francki, 1992) の方法から黒田らが改良した方法 (Kuroda et al., 1997)、もしくは RNeasy plant mini kit (Qiagen) により行った。抽出した RNA を First-Strand cDNA Synthesis kit (Amersham Biosciences) を
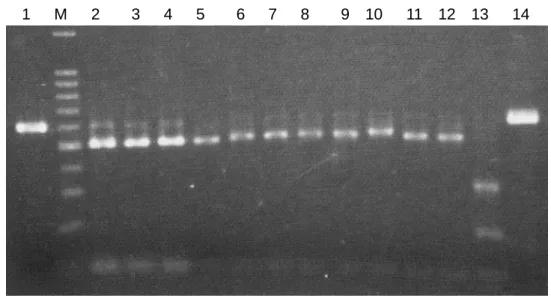
非 翻 訳 領 域 を 増 幅 す る フ ォ ワ ー ド プ ラ イ マ ー (5′-GTGTTCGTATTTAGAGTATCCGTC-3′) と BYMV-3′末端リバースプライマーにより、KOD-Dash ポリメラーゼ (TOYOBO) を用いて、PCR 反応を行った。得られた PCR 産物は 2%アガロースゲルで電気泳動を行った。
1.1.2.2 グラジオラス
―ソラマメ間の伝染
2001 年 5 月 28 日から 7 月 2 日にかけて、ウイルスが多発しているグラジオラスほ場 (京都府 農業資源研究センター内:4 月 10 日に市販グラジオラス球茎約 1,000 株を植え付けた) に隣接し て、プランター植えした健全ソラマメ (品種,ミンポー) 幼苗 (第 3, 4 展開葉期) を 24 株ずつ 5 ~9 日間隔で計 5 回配置し、ソラマメ幼苗におけるアブラムシの寄生株数及び BYMV の感染株 数を調べた。 さらに、グラジオラス栽培ほ場から分離した強毒株 BYMV-MB25 を第 3 展開葉期のソラマメ (品種,ミンポー) 6 株に機械接種し、これに隣接してプランター植えしたグラジオラスの実生苗 (第 2 葉展開初期) 40 株を 2 ヶ月以上栽培し、試験終了後に BYMV の感染の有無を簡易間接 ELISA 法と RT-PCR 法により検定した。1.1.3 栄養繁殖による伝染
BYMV 単独感染及び BYMV と CMV の重複感染が確認された計 7 株の市販球茎グラジオラス については、次代の球茎と木子を採取し、これらへのウイルスの伝染の有無を調べた。次代の球 茎と木子は回収後に風乾・休眠打破させた後、出芽してきた葉について簡易間接 ELISA 法と RT-PCR 法により BYMV と CMV の検出を行った。
オラスが BYMV に感染しており、CMV に関しては BYMV と重複感染するものが多かった (表 1-1)。また 、同様に BYMV と CMV についで発生が高いと考えられる TMV についても ELISA 法 により感染の有無を調べたが、ウイルスは検出されなかった。グラジオラス葉の病徴が軽いもの と激しいものについてそれぞれ BYMV と CMV の感染を調べたところ、症状の激しい葉の多く は両ウイルスが重複感染していた (表 1-2)。以上から、グラジオラスでは BYMV 単独感染の場 合よりも CMV との重複感染により病徴が激化すると考えられた。
表 1-1 グラジオラス市販球茎におけるウイルス検出(1997)
a) 品種 生産地 検定 株数 ウイルス感染株率 (%) BYMV CMV B + C b) - c) マスカーニ オランダ 161 96.3 0 0 3.7 トラベラ 茨城県 100 98.0 0 2.0 0 グリーンアイル 茨城県 93 6.5 0 93.5 0 スノーマス 千葉県 44 97.7 0 2.3 0 a) グラジオラス葉を採取し、ELISA 法によりウイルスを検出した. b) BYMV と CMV の混合感染.c) ウイルス検出なし.表 1-2 京都府内の栽培ほ場におけるグラジオラスからのウイルス検出(1997)
品種 葉部の 病徴a) 検定 株数 ウイルス感染株率 (%) BYMV CMV B+C b) - c) オリガミ M 23 8.7 21.7 65.2 4.3 m 22 90.9 0 4.5 4.5 トラベラ M 22 59.1 0 40.9 0 m 27 96.3 0 3.7 0 マスカーニ M 6 16.7 0 83.3 0 m 21 95.2 0 0 4.8 グリーンアイル M 3 33.3 0 66.7 0 m 20 100.0 0 0 0次に、グラジオラス葉から単離した BYMV の 50 分離株について Pathotype の調査を行ったと ころ、Sasaya ら (Sasaya et al., 1998) と和田ら (Wada et al., 2000) が報告した PathotypeⅠ と Pathotype Ⅳ以外に、グラジオラスでは初めて PathotypeⅡと Pathotype Ⅲが検出できた (表 1-3)。BYMV が単独感染しているグラジオラスの病徴と品種の関係を調べたところ、品種トラベ ラとガリレイで病徴が激しく、これらの品種では BYMV の PathotypeⅠが主要系統と考えられた (表 1-4)。また、検定植物(ソラマメ)を用いた接種試験では、Pathotype による病徴の違いは観 察されなかった。
表 1-3 グラジオラス葉から分離した BYMV の Pathotype (1997)
a) 採取地 検定 株数 Pathotype Ⅰ Ⅱ Ⅲ Ⅳ 京都府栽培ほ場 26 11 5 3 7 市販球茎 24 7 2 2 13 a) インゲンマメの 4 品種 (本金時、ケンタッキーワンダー、マスターピース、 トップクロップ) における病原性の違いで類別.表 1-4 BYMV が単独感染したグラジオラス各品種における病徴と検出された
BYMV の Pathotype
品種 花色 病徴 (葉/花) Pathotype a) Ⅰ Ⅳ スカーニ 赤 モザイク・不明瞭なモザイク / なし 0 5 トラベラ ピンク 明瞭なモザイク / 斑入り 6 2 ガリレイ 淡紫 明瞭なモザイクと条斑 / 斑入り 2 0CMV については、グラジオラスより分離した 69 株全て血清型は SubgroupⅠであり、ジュウロ クササゲの接種葉に壊疽斑点を生じる普通系統であった。 グラジオラス木子苗へのウイルス接種効率を調べるため、0.1 mg/mL と 1.0 mg/mL の高濃度の CMV 純化ウイルスをそれぞれ木子苗 5 株に接種したが、いずれも感染は認められず (表 1-5)、 木子苗へのウイルス接種はきわめて困難であると判断した。
表 1-5 グラジオラス木子苗への CMV 接種
a)純化ウイルスの濃度b) 接種苗数 ウイルス感染率 (%) 0.1 mg/mL 5 0 1.0 mg/mL 5 0 a) 木子苗葉にウイルスを接種し、21 日後の接種葉について ELISA 法によりウイルス 感染の有無を調べた. b) 1 株あたり10 μL の純化ウイルスを接種した.
1.2.2 ほ場における伝染
1.2.2.1 グラジオラス間の昆虫による伝染
グラジオラス間の昆虫による伝染を調べるため、ウイルスが多発しているグラジオラスほ場に 隣接してグラジオラス実生苗を栽培し、ウイルスの感染程度を調べたところ、BYMV と CMV の グラジオラス間の昆虫による伝染率は極めて低く、京都府の次代の苗ではウイルス感染苗数が増 えることはなかった。茨城県の苗については、当代でウイルス感染が認められた 8 株を含む約半 数の苗について次代でのウイルス感染を調べた。その結果、当代でウイルス感染が認められた 8 株以外でのウイルスの感染は認められなかった (表 1-6)。これより、BYMV と CMV についてグ ラジオラス個体間の 1 栽培期間内における昆虫によるウイルス伝染は非常に少なく、栽培上は問 題にならないと考えられた。表 1-6 ウイルス多発ほ場で栽培したウイルスフリ-グラジオラス実生苗からのウ
イルス検出 (2001)
試験ほ場a) BYMV CMV 実生苗当代 実生苗次代 実生苗当代 実生苗次代 京都府 1/240b) 1/210 0/240 0/210 茨城県 8/451 8/221 3/451 2/221 ウイルス多発ほ場に隣接して配置したプランター植の実生苗当代とその次代苗の葉を採取 し、ELISA 法または RT-PCR 法によりウイルスを検出した. a) 京都府 = 京都府農業資源研究センター内ほ場, 茨城県 = 茨城県農業総合センター生物 工学研究所内ほ場. b) ウイルス感染苗数/検定苗数.0 80 40 アブラムシ寄生株率 BYMV 感染株率
6/4 6/11 6/18 6/23 7/2
調査日 (2001)
図 1-2 グラジオラス発病株に隣接して暴露したソラマメ幼苗
における BYMV 感染率とアブラムシ寄生株率の推移.
1.2.2.2 グラジオラス-ソラマメ間の昆虫による伝染
グラジオラス―ソラマメ間の昆虫による伝染を調べるため、ウイルスが多発しているグラジオ ラスほ場に隣接してソラマメ幼苗を栽培し、アブラムシの寄生とウイルスの感染程度を調べたと ころ、ソラマメにおけるアブラムシの寄生株率が 50%以上あった時期には BYMV のソラマメへ の感染率が 25%であった (図 1-2)。また、BYMV 感染ソラマメに隣接して 2 ヶ月間以上栽培し たグラジオラス実生苗は、40 株のうち 7 株が BYMV に感染した (データ省略)。なお、寄生して いたアブラムシの種類は同定できなかった。 以上の結果から、BYMV については低率ではあるがグラジオラスとソラマメの間でアブラム シによる伝搬が起こりうると考えられた。 感染株率・ ア ブ ラ ム シ 寄生 株率 ( % )1.2.3 栄養繁殖による伝染
グラジオラスの栄養繁殖によるウイルスの伝染性を調べるため、ウイルス感染球茎の次代球茎 とそれに付着する木子からウイルスを検出したところ、次代球茎からのウイルス検出率は BYMV と CMV とも 100%であり,木子については BYMV では 50~100%,CMV では 24~100%であっ た (表 1-7)。これらの結果から、グラジオラスでは栄養繁殖によって高率にウイルスが伝染する ことが示された。表 1-7 グラジオラスの栄養繁殖によるウイルスの伝染 (1997-1998)
グラジオラス株 検出ウイルス 検定 木子数 ウイルス感染木子数 当代 球茎 次代 球茎 BYMV CMV B+C a)-
b) GB8 B+C B+C 2 0 1 1 0 GB52 B+C B+C 14 6 0 7 1 GB61 B+C B+C 17 1 3 13 0 GB91 B+C B+C 21 15 0 5 1 TB9 B+C B+C 1 0 0 1 0 TB14 BYMV BYMV 5 4 0 0 1 TB47 BYMV BYMV 5 5 0 0 0 グラジオラス葉を採集し、ELISA 法または RT-PCR 法によりウイルスを検出した. a) BYMV と CMV の混合感染.b) ウイルス検出なし.1.2.4 考察
発生実態の調査では、BYMV や CMV はグラジオラスから高率に検出されたが、ウイルスフリー の実生苗を用いた暴露試験では、これらウイルスのグラジオラスにおける水平伝染は非常に少な いことが示された。一方、次代球茎や木子への BYMV と CMV の伝染率は高かった。これらの ことより、グラジオラスにおけるウイルス伝染は、主に栄養繁殖によって垂直伝染すると考えら れた。グラジオラスとソラマメとの間における BYMV の移動について和田ら (Wada et al., 2000) は、 鹿児島県で分離したグラジオラス分離株とソラマメ分離株では Pathotype が異なり、両植物にそ れぞれ限定されることから、両植物間の移動は少ないと考察している。今回の調査では、低率で はあるが BYMV はグラジオラスとソラマメの間で伝染する可能性が示された。これは、暴露試 験にウイルス感受性の高い実生苗 (第 1,2 葉期) を用いたことが原因の一つと考えられる。グラ ジオラスのウイルス感受性は植物体が大きくなるにつれて低くなり (第5章, 表 5-1)、木子苗や 花芽形成できる球茎など養成栽培の進んだ個体へのウイルス接種は非常に困難である (表 1-5)。 このような理由から、幼苗の感受性の高い時期を除けばグラジオラスとソラマメとの間の BYMV の移動は極めて少ないと考えられた。 栄養繁殖によるウイルスの伝染は BYMV と CMV とも高率であった (表 1-7)。グラジオラス は、実生苗から少なくとも 4 回 (4 年) の養成栽培を経て花芽形成する個体に成長するが、優良 な品種に関してはその後も栽培を繰り返し、栄養繁殖によって木子を増殖する。このような栽培 体系の中で、一旦感染したウイルスは栄養繁殖によって保持され続けると考えられる。しかし、 発生実態の調査では CMV の感染株数が BYMV より少なかった (表 1-1)。病徴の激しいグラジ オラスでは BYMV と CMV の重複感染が多かった (表 1-2) ことから、CMV により病徴が激化
種の初期の幼苗の段階がもっとも重要であることを示している。一方、栄養繁殖によりウイルス が容易に伝染するため、弱毒ウイルス感染グラジオラス球茎の増殖が容易であり、このことは実 用化において非常に有効な現象である。
以上の結果を踏まえ、グラジオラスモザイク病の防除に向けた弱毒ウイルスの開発では、病徴 の激しい品種で最も発生が多かった BYMV の PathotypeⅠおよび、CMV の SubgroupⅠについて、 1) 病徴がほとんど無く、2) 病原ウイルスに対して高い干渉効果を発揮し、3) グラジオラス幼苗 (培養苗) に高率で感染し、4) 栄養繁殖によって高率で伝染する、これら 4 つの項目に重点をお いて弱毒ウイルス株を作出・選抜し、評価することとした。
第2章 弱毒ウイルス株の作出と選抜
第1章においてグラジオラスの栽培ほ場、および市販球茎についてウイルスの発生状況 を調べたところ、グラジオラスモザイク病の主要病原ウイルスは、BYMV と CMV と考え られ、グラジオラスでのこれらの主な系統が明らかとなった。そこで、これら 2 種のウイ ル ス を 防 除 す る 目 的 で 、 BYMV に つ い て は 病 徴 の 激 し い 品 種 で の 発 生 が 多 か っ た PathotypeⅠのグラジオラス分離株を、CMV については発生した SubgroupⅠの株を対象とし、 それぞれ弱毒ウイルス株の作出および選抜を行った。 本章では、病徴を弱毒ウイルスの選抜・評価の形質とし、可能な限り病徴の軽い株の選 抜を行った。弱毒化の方法には、紫外線照射、熱処理や亜硝酸処理がある。本研究では、 これまで多くのウイルスで成功例が報告されている低温処理法 (Kosaka and Fukunishi, 1993; Kosaka and Fukunishi, 1994; Kosaka and Fukunishi, 1997; Kosaka et al., 2006) によってウ イルスの弱毒化を試みた。また、自然界より分離した弱毒ウイルスは実用化における支障 が少ないと考えられることから最も理想的であるため、自然界からの選抜も試みた。2.1 BYMV 弱毒ウイルス株
2.1.1 材料と方法
茨城県のグラジオラス栽培ほ場より分離した BYMV PathotypeⅠの強毒ウイルス株 IbG
(茨城県農業総合センター生物工学研究所より分譲) を低温処理法に供試した。IbG をソラマ
メ (第 3, 4 展開葉期) に接種し、10 日後に ELISA 法 (第1章,1.1.1.1) により感染を確認した 後、15℃、16 時間日長の人工気象機内で 90 日間低温処理した。その後、ソラマメ全体から
の 4 段階に分けた。さらに、選抜した弱毒ウイルス株はキノアによる単一病斑分離を 2 回 行い、Nicotiana benthamiana (第 4, 5 葉期) とソラマメ (一寸) (第 3, 4 展開葉期)、グラジオラ スの実生苗 (第 2 葉展開初期) にこすりつけ接種 (第1章, 1.1.1.2) し、14~20 日後の病徴を 観察した。グラジオラスの実生苗は遺伝的に固定されていないので、品種の特定はできな いが、ウイルスの接種が比較的容易であるため、ウイルス接種に使用した。また、グラジ オラスの実生苗におけるウイルスの増殖量は、ウイルス株につき 7 実生苗を供試して、接 種 15 日後の接種葉の小片について ELISA 法 (第1章, 1.1.1.1) により検定した。 自然界からの探索は、4 品種の市販球茎約 350 球を温室内のポットで栽培し、無病徴から 極めて軽いモザイク症状の株を選んだ。また、1998 年 5 月下旬に、京都府宇治市の農家ほ 場から無病徴グラジオラス株を採取した。これらを ELISA 検定した後、反応陽性の株を弱 毒系統候補ウイルス感染株としてソラマメ (一寸) (第 3, 4 展開葉期) とインゲンマメ (本金 時) (第 1 本葉展開初期) に戻し接種し、病徴を観察した。
2.1.2 結果と考察
自然界からの弱毒ウイルス株の探索では、BYMV に感染しているが病徴が軽い弱毒系統 候補グラジオラス 4 個体を得たが、これらから分離した BYMV 株は検定植物で病徴を示し た。グラジオラスでの病徴の軽さは、グラジオラスの品種間差異などの宿主側の要因が大 きいと考えられ、弱毒系統候補グラジオラスで見られた病徴の軽さは弱毒ウイルスによる ものではないと判断した。したがって、本法では BYMV 弱毒系統は得られなかった (表 2-1)。 低温処理による弱毒ウイルス株の作出において、1 回目の試験では、109 株を単病斑分離 し、うち 3 株で病徴の弱毒化が認められたが、これらは軽微な病徴を呈した。2 回目の試験生苗での接種 15 日後の接種葉におけるウイルス増殖量を調べたところ、平均 ELISA 値は、 M11 では 0.24、親強毒株 IbG では 2.26 であり (健全対照は 0.067)、弱毒株 M11 のグラジオ ラス内での増殖量は親強毒株 IbG のおよそ 1/10 程度と推定された。
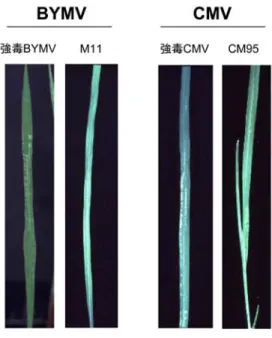
図 2-1 ソラマメ上位葉における BYMV 強毒株 IbG (左) と BYMV 弱毒株 M11 (右)
の病徴.
表 2-1 京都府内栽培ほ場および市販球茎からの BYMV 弱毒系統の選抜
分離株 Pathotype 由来 元のグラジオラスでの病徴 戻し接種による病徴 a) 本金時 ソラマメ TMB-1 Ⅳ ほ場 mM sM M,N TMB-3 Ⅰ ほ場 mM vmM M TB-47 Ⅰ 市販球茎 vmM M M表 2-2 低温処理による BYMV の弱毒ウイルス株の選抜
a)試験 番号 ウイルス分離株数b) 病徴の程度 c) ⅰ ⅱ ⅲ ⅳ 1 109 1 105 3 0 2 93 0 88 4 1 a) BYMV 強毒株 IbG を 接種したソラマメを 15℃の低温で 90 日間処理した. b) 処理葉から Chenopodium quinoa を用いて単一病斑分離を行って得られたウイル ス株数.
c)
ソラマメにおける病徴の程度:ⅰ=IbG より激しい, ⅱ=IbG と同程度, ⅲ=IbG よ り軽い, ⅳ=ⅲよりさらに軽い.選抜した弱毒ウイルス株 M11 と親株 IbG のゲノム RNA の塩基配列は、その後、佐藤ら によって解析されており (佐藤ら, 2001; Nakazono-Nagaoka et al., 2004)、M11 では 3 アミノ酸 残基 (塩基では 7 ヶ所) の変異が認められている。また、高橋らは M11 と IbG の感染性ク ローン (高橋ら, 2004; Takahashi et al., 2007) を用いて、何れのアミノ酸変異が弱毒化に影響 するかを調べている。M11 で変異していた 3 個のアミノ酸を含む M11 感染性クローンの制 限酵素 3 断片をそれぞれ IbG 感染性クローンと置換し、得られた 3 種類の感染性クローン のソラマメ葉での病徴の程度を観察したところ、HC-Pro 領域の 314 番目の1アミノ酸残基 の変異(Leu→Ser) が弱毒化に関与していることが明らかとなった (Nakazono-Nagaoka et al., 2009)。HC-Pro は、植物のウイルスに対する防御反応 (PTGS) を抑制する機能が知られてお り(Anandalakshmi et al., 1998; Kasschau et al., 1998; Valkonen et al., 2002)、この機能の変化が M11 の増殖量の低下と感染植物の無病徴化に関与していると考えられる。
本研究では、低温処理によって BYMV については弱毒ウイルス株 M11 を得ることができ た。この弱毒化は1アミノ酸残基の変異によると考えられているが、低温処理により核酸 の変異が生じたのか、低温処理により元々生じていた変異株の分離が容易になったのかは 不明である。なお、 ゲノム塩基配 列の情報はデ ータベースに登録さ れている (M11: AB079886, IbG: AB079887)。
2.2 CMV 弱毒ウイルス株
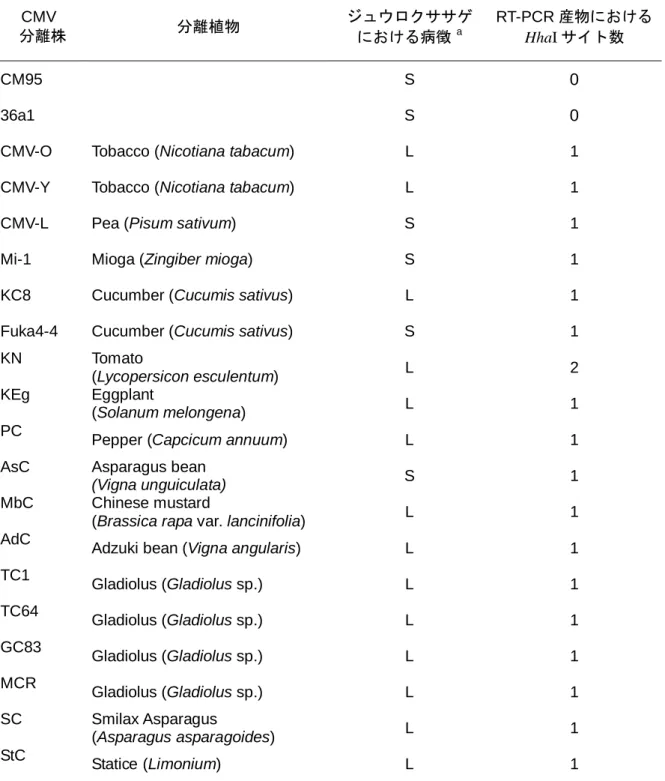
第1章の調査から、CMV では SubgroupⅠの発生が確認された。一般に弱毒ウイルスを作 出する際は、可能な限り実際の発生系統と同じ系統を用いるべきである。しかし、干渉効 果試験の際、植物への寄生性の異なる系統を用いることで、検定植物による干渉効果の判 定が可能となる。CMV の SubgroupⅠには、ササゲにおける寄生性の異なる普通系統とマメ 科系統があり、発生実態の調査ではグラジオラスでは普通系統のみの発生が確認されてい る(第1章)。そこで、キュウリやトマトなどで防除効果が期待される CMV の弱毒ウイル ス株 CM95 (マメ科系) について、グラジオラスにおける病徴を観察した。2.2.1 材料と方法
京都府のミョウガより分離された CMV 強毒株 Mi-1 (Subgroup Ⅰ、マメ科系統) を低温処 理して得られた弱毒ウイルス株 36a1 は、干渉効果が低かった。そこで、干渉効果の高い強 毒ウイルス株 (Fuka4-4) と混合接種の後、単病斑分離により得られた干渉効果の高い弱毒 ウイルス株、CM95 が選抜された (Kosaka and Fukunishi, 1997)。CM95 の有する 3 種の分節 ゲノムについて、RNA 1、2 は弱毒ウイルス株 36a1 由来、RNA 3 は干渉効果の高い強毒ウ イルス株 Fuka4-4 由来であることが示されている (鈴木ら, 1997)。本研究では、この弱毒ウ イルス株 CM95 の純化ウイルス (0.1 mg/mL) を N. rustica (第 4, 5 葉期) およびグラジオラス の実生苗 (第 2 葉展開初期) (各 3 株) に接種し、14~21 日後の病徴を観察した。
2.2.2 結果と考察
ら, 1997)、既に登録されている (36a1-RNA 1: AB079889, RNA 2: AB079890, RNA 3: AB079891; CM95-RNA 1: AB188234, RNA 2: AB188235, RNA 3: AB188236)。
図 2-3 Nicotiana rustica 上位葉 における CMV 強毒株 Fuka4-4 (左) と
CMV 弱毒株 CM95 (右)の病徴.
第3章 ウイルス株の識別検出法の確立と干渉効果の評価
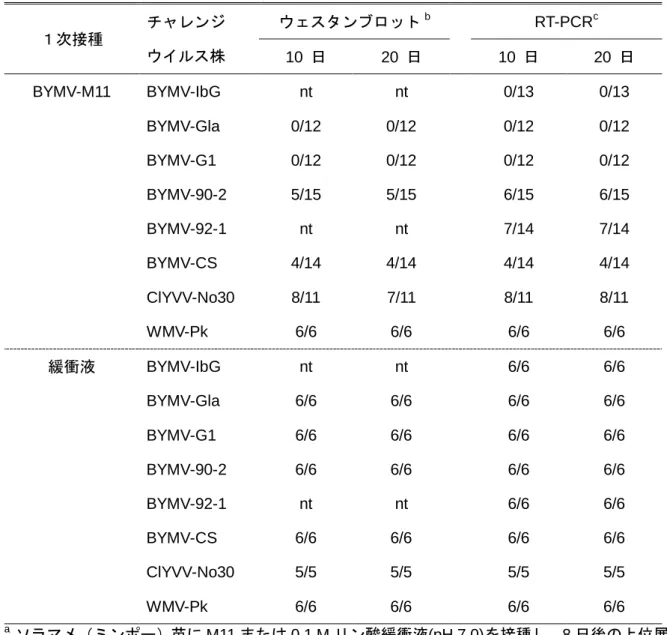
前章では、グラジオラスに有望な 2 種の弱毒ウイルス株の作出と選抜を示した。本章では、弱 毒ウイルスを評価する項目のなかで最も重要な、干渉効果の評価を検討する。 グラジオラスのような栄養繁殖植物の場合、弱毒ウイルスを接種していても一旦強毒ウイルス が感染すれば後代にそのウイルスが維持される可能性が高く、このような個体の後代では弱毒ウ イルスの防除効果は保証されない。したがって、グラジオラスにおける弱毒ウイルスの干渉効果 は、強毒ウイルスの感染を完全に阻止する程度に強力なものである必要がある。しかし、それを 判定するには、弱毒ウイルスと強毒ウイルスとを正確に識別し、高感度に両ウイルスを検出でき る方法が必要となる。近年、遺伝子診断法は、干渉効果の判定に利用され、その有用性が報告さ れている (Kurihara et al., 2003; Letschert et al., 2002; Rizos et al., 1992)。そこで、本研究で作出した 2 種弱毒ウイルスと強毒ウイルスの塩基配列の相違に着目し、遺伝子診断法による高感度な識別検 出法の確立を行った。 また、ウイルスの干渉効果の有無は、その相手となるウイルスの種や系統などの近縁性に関連 する。前章で選抜した 2 種の弱毒ウイルス株については、対象のグラジオラス強毒ウイルス株に 対する干渉効果は明らかではない。さらに、BYMV を含む Potyvirus 属には多くの種が含まれ、種 や系統の分類は必ずしも整ってはいない。したがって、干渉効果を正しく評価するためには、遺 伝子情報による種や系統の位置づけが正しく確認されたウイルス株の利用が必要である。 そこで、BYMV 弱毒株 M11 については、使用する BYMV 強毒ウイルス株のウイルスゲノムの 塩基配列を決定し、これを用いた干渉効果の試験を行うことにより、干渉効果の程度と遺伝子情 報との関連性を調べた。CMV 弱毒株 CM95 については、グラジオラス由来の CMV 強毒ウイルス3.1 弱毒ウイルス株 BYMV-M11 の干渉効果
3.1.1 材料と方法
3.1.1.1 ウイルス
BYMV 弱毒株 M11 の干渉効果を評価するため、対象ウイルス株にモザイク症状を呈したグラジ オラスから分離された 3 株、IbG、Gla (Sasaya et al., 1998)、G1 (Sasaya et et al., 1998)とソラマメ (Vicia
faba) から分離された 90-2 (Sasaya et al., 1997), ホワイトクローバ (Trifolium repens) から分離され
た 92-1 (Sasaya et al., 1998)ならびに CS (久米ら, 1970) の合計 6 株の BYMV 強毒ウイルス株と、 BYMV との類似性は高いが別種である ClYVV -No30 (Takahashi et al., 1997)、 および同じ Potyvirus 属で BYMV との類似性が低いカボチャモザイクウイルス (Watermelon mosaic virus : WMV) -Pk (Ali et al., 2006) を用いた (表 3-1)。全ての株について、C. quinoa において単病斑を分離した後、 ソラマメ (ミンポー) 苗 (第 3, 4 展開葉期) に接種した。病徴の認められた上位葉を採取し、以下 の実験に使用するまで-70°C で保存した。
干渉効
果試験に用
いたウイルス株
の由来植物、
ゲノム塩基
配列のアク
セッショ
ン番号および
RT
-PC
R
識別検
マーの配列と
PC
R
増
幅領域
由来植物 a A cce ssi o n N o. プ ラ イマ ー 増幅領域 G ladi ol us sp . A B 079 886 F or w ar d: 5 ′-C T M C A R A T GGA GA A Y C C Y GC -3 ′ 1370 -1 697 R ev er se : 5 ′-G A T A T G CT CT T T G G CCCCA A A T -3 ′ G ladi ol us sp . A B 079 887 F or w ar d: 5 ′-CT CCA A A T G G A G A A CCCCG C -3 ′ 1370 -1 697 R ev er se : 5 ′-G A T A A G CT CT T T G CCCCCA A A C -3 ′ G ladi ol us sp . A B 439 729 F or w ar d: 5 ′-GGA GC T A GC GA T T GGT A GA C T C -3 ′ 1792 -1 973 R ev er se : 5 ′-A G TC TG A T A T A A C TG C C G TT -3 ′ G ladi ol us sp . A B 439 730 F or w ar d: 5 ′-GT T A GC T A T A GGA A GA T T GA T C -3 ′ 1795 -1 973 R ev er se : 5 ′-A G TC TG A T A TG A C TG C C G TC -3 ′ V ici a f aba A B 439 731 F or w ar d: 5 ′-GGA A T T GC GGT T T T A T C T GA C -3 ′ 1952 -2 304 R ev er se : 5 ′-TG C A TTG TG C C G A G T T TG TG G -3 ′ T ri fol ium r epens A B 439 732 F or w ar d: 5 ′-GT T A GC A A T T GG T A GGC T C A -3 ′ 1795 -1 973 R ev er se : 5 ′-A A TC TG A T A T A A C TG C C G TC -3 ′ T ri fol ium r epens ⋅⋅⋅ F or w ar d: 5 ′-A CT T G CCA CA G G A CG T CT G A T A G -3 ′ 1795 -1 973 R ev er se : 5 ′-AA T C T G AC AG AA T AG C T G T C -3 ′ P hase ol us v ul gar is AB0 1 18 19 F or w ar d: 5 ′-T C GT GA GC GT T T A A GT A T GG -3 ′ 1399 -1 789 R ev er se : 5 ′-C C TTC A G A TG G A TC A A TC A C -3 ′ C ucu m is m el o A B 218 280 F or w ar d: 5 ′-G G C AG C AG C AA T T AG T C AA T C -3 ′ 1582 -1 863 R ev er se : 5 ′-G T A TC TG C A G C A T A TG TG TG C -3 ′ めて分離 された植 物3.1.1.2 ウイルスゲノム塩基配列の決定と系統解析
感染葉から RNeasy plant mini kit により抽出した RNA を First-Strand cDNA Synthesis kit とランダ ムプライマーを用いて 42°C、30 分間の処理で cDNA を合成した (第1章)。既報の BYMV2 株の 塩基配列 (D83749, U47033) を参考にしてプライマーを設計し、PCR により 5′末端非翻訳領域か ら 3′末端非翻訳領域にかけて 5 断片の重複する領域を得た。PCR 増幅産物は QIAquick PCR purification kit (Qiagen) により精製した後、BigDye Terminator v1.1 cycle sequencing kit (Applied Biosystems) を用いてダイレクトシークエンス反応を行い Applied Biosystems 3130/3130xl Genetic Analyzer (Applied Biosystems) により塩基配列を解読した。得られた結果を基にプライマーを設計 し、それによって更に塩基配列の決定領域を伸長させた。決定した塩基配列は GENETIX-WIN ver. 6.1 (Software Development) ソフトにより結合し、塩基配列のアライメント解析は CLUSTAL W (version 1.83; http://www.ddbj.nig.ac.jp) により行った。 系統解析は CLUSTAL W の neighbor-joining 法 (Saitou and Nei, 1987) を 用 い て 、 系 統 樹 は Tree View (Win32; http://taxonomy.zoology.gla.ac.uk/rod/rod.html) により作成した。なお、BYMV-CS の塩基配列の情 報は北海道大学の上田一郎博士より提供頂いた。さらに、 アメリカで塩基配列が決定されている グラジオラス由来の BYMV-GDD の塩基配列 (AY192568) を解析に加え、ClYVV-No30 の塩基配 列 (AB011819) は、系統解析時のアウトグループとした。
3.1.1.3 識別検出法
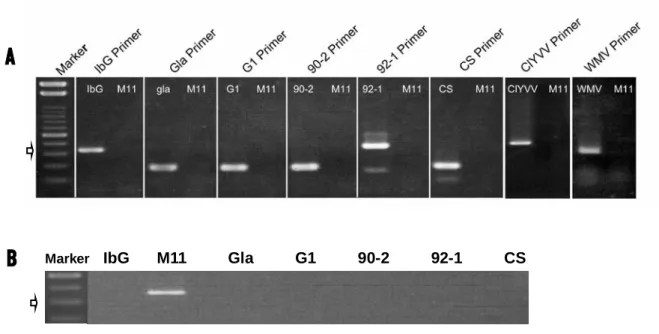
3.1.1.3.1 ウェスタンブロット法
既報 (Fujii et al., 2003) に従って感染葉より全タンパク質を抽出し、12% SDS ポリアクリルアミ ドゲル (sodium dodecyl sulfate-polyacrylamide gel) により電気泳動を行った。これをナイロンメン
1997) (1000 倍希釈)、ならび WMV の検出には WMV-9 (M) に対する ポリクローナル抗体 (岩崎 ら, 1996) (1000 倍希釈) を使用した。2 次抗体は、1 次抗体がポリクローナル抗体の場合は、ヤギ -ウサギ IgG (GE Healthcare Bio-Sciences) (2000 倍希釈)、モノクローナル抗体の場合はヤギ-マウ ス IgG (GE Healthcare Bio-Sciences) (3000 倍希釈) を用いた。バンドの可視化は、nitro blue tetrazolium / 5-bromo-4-chliro-3-indolyl phosphate によった。
3.1.1.3.2 RT-PCR 法
プライマーのマッチ、ミスマッチによる PCR 反応により、弱毒ウイルス株と強毒ウイルス株を 特異的に識別検出するため、3.1.1.2 の結果に基づき、強毒ウイルス株に特異的な塩基配列よりプ ライマーを構築した (表 3-1)。RNA の抽出並びに cDNA の合成は 3.1.1.2 にしたがった。DNA ポ リメラーゼには AmpliTaq DNA polymerase (Applied Biosystems) または Phusion High-Fidelity DNA polymerase (Finnzymes) を使用し、これらの使用マニュアルに従って反応させた。なお 、PCR 反応 の温度や時間はそれぞれの酵素やプライマーの条件に合わせた。また、M11 と IbG を特異的に検 出する際は、これらの塩基配列の相同性が極めて高いことから、非特異反応を避けるためのホッ
トスタートを行った
。
3.1.1.3.3 SSCP 法
1本鎖 DNA 高次構造多型 (Single-strand conformation polymorphism: SSCP) 法は、一本鎖に変性 させた DNA を非変性条件のポリアクリルアミドゲルで電気泳動することによって分子内高次構 造を形成させ、構造の僅かな違いを泳動パターンにより検出する方法である。これを用いて、遺 伝子のある特定領域の多型の有無を調べることができる。本試験では BYMV 分離株の識別検出の
(5′-CTCGCTCTACAAAGATCAGG-3′) を使用して、KOD-Dash ポリメラーゼ (TOYOBO) により PCR 反応を行った。PCR 産物は QIAquick PCR purification kit (Qiagen) により精製した後、1 μL を 変性液 (95%ホルムアミド, 20 mM EDTA, 0.05% BPB, 0.05% Xylene Cyanol) 10 μL に加えて 85℃ で 5 分間処理した後、1 μL を 10%グリセロールを含む 6% ポリアクリルアミドゲル (0.5M TBE pH 8.8 緩衝液使用) で、HC-Pro 領域の場合は 4℃で、3′末端非翻訳領域の場合は室温で電気泳動 (150 V 前後で約 2.5 時間) した。泳動後ゲルは銀染色 (Silver Stain Ⅱ Kit: Wako) 処理し、バンドを検出 した。