2 目次
序論
1第1章 Rhodococcus 属細菌におけるアルカンヒドロキシラーゼ遺伝子と
長鎖
c-アルカン分解の分析
1節 緒言 5 2節 実験材料および方法 10 3節 結果 1.3.1 長鎖c-アルカン分解細菌の同定と Rhodococcus 属細菌にお けるアルカンヒドロキシラーゼ遺伝子の分析 15 1.3.2 alkB R2 遺伝子を保持する Rhodococcus 属細菌による 長鎖c-アルカンの分解 19 1.3.3 non-alkB R2 遺伝子を保持する Rhodococcus 属細菌による 長鎖c-アルカン分解 22 1.3.4 alkB 遺伝子を保持しない Rhodococcus 属細菌による 長鎖c-アルカンの分解 24 4節 考察 26 5節 要約 27第2章 土壌バイオマスと微生物活性によるバイオレメディエーション効率
の向上
1節 緒言 28 2節 実験材料および方法 35 3節 結果 2.3.1 長鎖c-アルカン分解細菌の同定と特徴解析 46 2.3.2 土壌中の有機物質含有量の最適化 49 2.3.3 土壌中の有機物質調整によるバイオレメディエーション 効率の改善 51 2.3.4 リン循環活性と微生物量における関係性解析 55 2.3.5 リン循環活性に対する土壌pH と微生物量の影響 58 2.3.6 リン循環活性に対するミネラル濃度とpH の影響 62 2.3.7 高リン循環活性に適した土壌条件 72 4節 考察 75 5節 要約 773
第3章 油臭油膜を迅速解消できるバイオレメディエーションシステムの
開発
1節 緒言 78 2節 実験材料および方法 80 3節 結果 3.3.1 油臭解消に適した活性炭の評価及び選抜 87 3.3.2 活性炭とバイオレメディエーション法の組合せ浄化効果 90 3.3.3 屋外での活性炭とバイオレメディエーション法の 組合せ浄化効果 93 4節 考察 97 5節 要約 99総括と展望
100参考文献
103本論文に関する報告
114謝辞
1151
序論
現在、世界のエネルギー消費量は経済成長とともに増加を続けている。これは、石油 換算で 1965 年 の 37 億トンから、年平均約 2.6 %で増加し続け、2015 年には約 131 億 トンに達した。現在、主流である化石エネルギーは無尽蔵ではなく、また化石エネルギ ーを大量に消費すると二酸化炭素の排出量も増えてしまうことになる。さらに、世界の エネルギー消費量(一次エネルギー)の動向をエネルギー源別に見ると、石油は今日ま でエネルギー消費の中心であり、2015 年時点でのエネルギー消費全体で 32.9 %と最も 大きなシェアを依然として占めている(経済産業省・資源エネルギー庁 2017)。 石油化学の発達と経済発展によって石油の需要は拡大し続け、燃料・工業原料の両面 で本格的な石油の時代が到来することとなった。現在では、石油はエネルギー源として だけでなく、衣料品やインテリア、日用品、産業用資材に使われる合成繊維や合成樹脂 等の主原料としても大きな需要がある。 しかしながら、これらの石油利用に伴い、数々の環境汚染が引き起こされている。石 油は、採掘、輸送、保管の各過程で環境中へ漏洩する可能性がある。一例として、原油 タンカーの座礁などによる原油の流出などがある。アメリカ・アラスカ沖における1989 年のエクソン・バルディーズ号の座礁事故では、約4万kLもの原油が流出し、沿岸が800 kmにもわたって海洋が汚染された。2010年、メキシコ湾の海底油田からの原油流出事故 では、約78万kLもの原油が流出した。 一方で、国内では油による海洋汚染の件数は年々減少しているものの、2000年代はじ めまでは約6割は油汚染に起因するものであった(海上保安庁 2007)。このような石油 系炭化水素による海洋汚染の主な浄化技術としては、オイルフェンスを張って油の拡散 を防止した後、オイルマットなどの吸着剤を投入し、手作業で回収して焼却する方法が 行われている。しかし、悪天候の場合では、オイルフェンスを超えて油が拡散すること、 オイルフェンスの設置をまたずに汚染範囲が一気に拡大するといった課題がある。2019 年8月、佐賀県での集中豪雨により 、工場から約5万Lの油が流出した。佐賀県によると、 工場周辺ではオイルフェンスなどにより油の回収が進んでいるが、農地や宅地などでは 適用が難しく、直近での油除去の見通しが立っていない状況であった。このような石油 系炭化水素は自然界では非常に分解され難く、有害物性の成分を含んでいることから、 今後も長期間にわたり生態系への影響が懸念されている。 一方で、石油系炭化水素による土壌汚染も深刻な問題となっている。石油備蓄タンク やパイプライン、ガソリンスタンド埋設タンクからの漏洩による汚染が数多く発生して おり、アメリカでは有機化合物による土壌汚染の約80 %石油系炭化水素による汚染で ある(西田 2000)。土壌汚染では同時に地下水汚染を引き起こすことが多々あり、当 初の汚染範囲から予想以上に広がる可能性が指摘されている。アメリカでは世界に先駆2
けて土壌環境の保全・修復に関する法律である「スーパーファンド法」が1980年に制定 された。この法律では、石油系の全炭化水素(Total Petroleum Hydrocarbon;TPH)を100 mg/kg-soil以下まで浄化することが義務付けられている。その後、オランダでは1994年 に、ドイツでは1998年に、我が国でも2002年に土壌汚染対策に関する法律が制定され(環 境省、2002)、直近では平成31年4月1日施行の内容で改正土壌汚染対策法が制定された。 さらに、油汚染に関しては、中央環境審議会土壌農薬部会土壌汚染技術基準等専門委員 会により2006年に「油汚染対策ガイドライン」が答申された。今後は石油系炭化水素に よる土壌汚染がさらに規制されると予測されている(土壌汚染技術基準等専門委員会、 2006)。 石油系炭化水素による土壌汚染では、土壌から炭化水素等の汚染物質だけを回収する ことは困難であることから、土壌ごと掘削除去・加熱焼却し、清浄土壌を新たに埋め戻 す手法や、物理的に外界から隔離・遮断する封じ込め手法が行われてきた。実際には、 汚染土壌を掘削、回収し、処理場で加熱・焼却処分されることが多いが、これらの処理 法はいずれも高コストであり、広範囲の汚染には不向きである。また、加熱・焼却処理 では多量の残土が発生するが、この土壌中では微生物が死滅し、有機物も炭化している ために土壌を有機的な目的で再利用することが難しい。さらに、熱源としても重油を使 用するため、処理に伴って大量の二酸化炭素や燃焼ガスが発生するという課題もある。 1989年のアメリカでの原油流出事故以降、微生物機能を用いて土壌中の炭化水素などの 汚染物質を分解・除去するバイオレメディエーション技術が研究・開発され、実用化さ れてきた。汚染状況や浄化方法によって異なるが、これらの処理で時間は要するものの、 必要とされるエネルギーは加熱や焼却処理に比べて少なく、それ故に二酸化炭素の発生 量も抑えられる。このことから、アメリカやオランダではバイオレメディエーションが 積極的に導入されており、環境浄化事業の約半分にも達している状況があった(Cookson 1997、藤田 2001、日経バイオテク 2002)。 バイオレメディエーションには、微生物の栄養分を投与して土着の微生物を活性化す るバイオスティミュレーションと、そのサイトに元来生息していない汚染物質の分解能 を有する微生物を外部から投入するバイオオーグメンテーションがある。土着の生態系 への影響を懸念して、欧州等ではバイオスティミュレーションが主に開発され、米国を はじめとした乾燥地域を抱える国では乾燥などに強い耐性をもつ菌種を活用するバイ オオーグメンテーションが開発されてきた。我が国では、「微生物によるバイオレメデ ィエーション利用指針」が策定され、生態系等への影響に配慮した適正な安全性評価及 び管理手法のための基本的な考え方が指針として示された(環境省 2005)。 さらに、土木工学や環境工学の技術や知見を活用した微生物の活性化法が実用化され ており、土壌の掘り起こしや切り返しを行い通気するランドファーミング法や、畝をつ くった汚染土壌に配管を通し、空気や水分、栄養分を供給するバイオパイル工法などが 導入されている(von Fahnestock et al. 1998、Hejazi et al. 2003、Peltola et al. 2006)。これ
3 らの処理法では比較的利用しやすい直鎖状アルカン(ノルマルアルカン;n-アルカン) などの炭化水素成分は除去できるが、難分解成分である長鎖n-アルカンや長鎖環状アル カン(シクロアルカン;c-アルカン)、多環芳香族炭化水素(Polyaromatic hydrocarbon; PAH)、レジン、アスファルテンといった物質が残留してしまうことが多い。そのため、 バイオオーグメンテーションによる浄化効率の向上を目指し、我が国やアメリカではこ れらの汚染物質の分解能を有する微生物が積極的に自然界より分離され、その分解特性 に関する研究が進められてきた。しかしながら、これらの研究の実用化には難分解成分 の残留や処理時間の長さやそれに伴う費用発生等の課題がある。そのため、難分解成分 に対して高い分解活性を有する特異的な微生物の分離や、それを用いた一連の効率的な バイオレメディエーションシステムの構築が求められている。 一方で、前述の「油汚染対策ガイドライン」では、油分濃度だけでなく、油臭・油膜 に対しても問題とされている。油分濃度のように人の健康や生態系、地球環境への影響 に直結する問題だけでなく、油臭や油膜は生活環境への影響や不動産リスク、企業イメ ージの低下、地域からの信頼感の低下など、社会からの信頼を落とす対象となることが 問題となっている。石油系炭化水素は、有害成分を含み自然界では非常に分解され難い ことから、油臭、油膜などとして環境中に残留することが多いと言われており、生態系 や生活環境への影響が懸念されている。油分濃度に対しては物理的、化学的処理、炭化 水素分解能を有する微生物を用いたバイオレメディエーションなどの生物学的処理が 研究されてきた。しかし、油分濃度と油臭・油膜の迅速な解消が同時に達成できないこ とが課題であった。 本研究では、独自に自然界より単離した炭化水素分解菌やよりよい土壌環境の条件を解 析し、迅速に油分濃度と油臭・油膜を解消できるバイオレメディエーションシステムを構 築することを目的とした。第1 章では、長鎖炭化水素分解菌が分離されている Rhodococcus 属について、様々な細菌種が保持するアルカンヒドロキシラーゼ遺伝子と、長鎖c-アルカ ン分解能を解析することにより、Rhodococcus 属細菌における炭化水素分解の特徴を明ら かにすることを目的にした。Rhodococcus 属細菌について、アルカンヒドロキシラーゼ遺伝 子の有無を解析し、分類を行った。また、これらの菌株で長鎖c-アルカンの分解能を解析 した。炭化水素汚染土壌のバイオレメディエーション効率を高めるためには、適した炭化 水素分解菌(Hydrocarbon degrading bacteria;HDB)の数、増殖、および活性を高める必要
がある。第2 章では、これらの分解効率を向上させるために有機資材による HDB の維持・ 活性化を試みた。さらに、バイオレメディエーションの効果を高めるためには土壌や微生 物の活性化を行う必要がある。様々なフィールドから土壌試料を採取し、リン循環と微生 物量の関係性を解析した。第3 章では、構築した高効率なバイオオーグメンテーション技 術と、活性炭を用いた油臭油膜解消技術を組み合わせることで、油臭・油膜を迅速に解消 し、さらに油分濃度を短期間で低減できる新たなバイオレメディエーション技術の開発を 目的とした。油臭油膜解消能力の高い活性炭を選定し、Rhodococcus 属細菌による高効率バ
4
イオオーグメンテーションに適した活性炭の条件を検討した。その結果として、迅速に油 分濃度と油臭・油膜を解消できるバイオレメディエーションシステムを構築した。最後に、 総括と展望では、本論文を総括し、その成果に基づいて今後の課題をまとめた。
5
第
1 章
Rhodococcus
におけるアルカンヒドロキシ
ラーゼ遺伝子と長鎖
c-
アルカン分解の分析
1節 緒言
近年、石油炭化水素による環境汚染は世界的に深刻な問題である。炭化水素汚染地を 浄化するために、焼却、化学酸化(フェントン反応)、洗浄、蒸発など様々な処理が行わ れている。しかし、これらの処理には多くのエネルギーが必要とされる(Usman et al. 2012、Hatayama et al. 2008、Dua et al. 2002、Vidali et al. 2001)。バイオレメディエーショ ンなどの生物学的処理法は炭化水素分解の効果的なシステムとして研究されてきた (Stroud et al. 2007、Kissin et al. 1990、Korda et al. 1997、Pritchard et al. 1992、Adhikari etal. 2016)。そして、石油系炭化水素を分解する能力を持つ多くの分解菌が自然界から単
離され、その特徴が解析されてきた(Blakley et al. 1978、Blakley et al. 1982、 Komukai-Nakamura et al. 1996、Aislabie et al. 2006、Zampolli et al. 2014)。これらの処理法では比較
的利用しやすいn-アルカンなどの炭化水素成分は除去できるが、難分解成分である長鎖 n-アルカンや長鎖 c-アルカン、PAH、レジン、アスファルテンといった物質が残留して しまうことが多い(Figure 1-1)。しかしながら、これらの細菌にとって長鎖炭化水素を 分解することは困難であり、特に長鎖c-アルカンを分解することは難しい(Perry et al. 1979、Throne-Holst et al. 2007)。それゆえに、炭化水素のバイオレメディエーションに おいて、長鎖炭化水素を分解できる分解菌を自然界より単離するは重要である(Lal et
al. 1996、Sakai et al. 1994、Tancsics et al. 2015)。
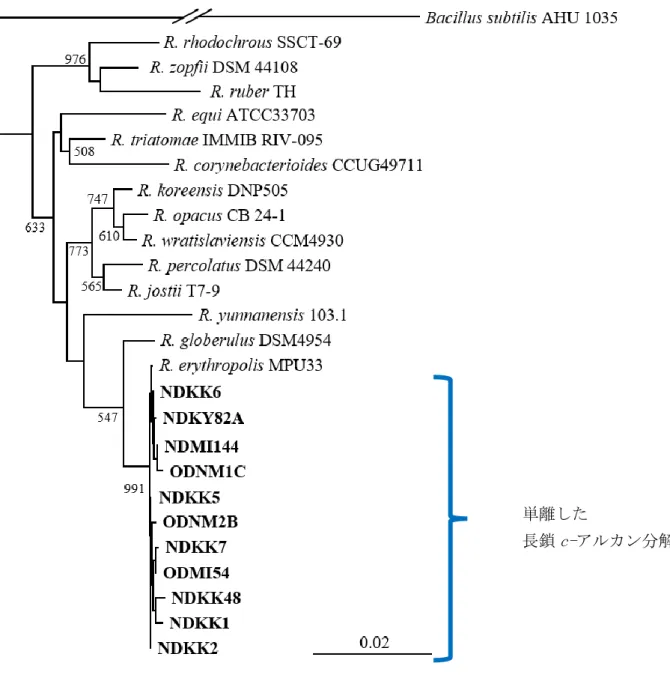
自然界より単離した炭化水素分解細菌(HDB)について、それらの系統発生的関係が 明らかにされている(Kubota et al. 2008)。その結果、これらは、Pseudomonas 属細菌、 Rhodococcus 属細菌、Gordonia 属細菌、Acinetobacter 属細菌など様々な分類群に特定さ
れた。それらのうち、Rhodococcus 属細菌に関して 16S rRNA 遺伝子の部分配列に基づ
いて系統解析をおこなった結果をFigure1-2 に示す。さらに、Rhodococcus 属細菌および
Gordonia 属細菌に属する株は n-アルカンだけでなく、唯一の炭素およびエネルギー源
としてのc-アルカンを分解した(Kubota et al. 2008、Koma et al. 2004、Kostichka et al.
2001、van Hamme et al. 2000)。長鎖 n-アルカンおよび c-アルカンは土壌中に長期間残留
するため、これらのc-アルカンを分解する菌株は炭化水素汚染を浄化する可能性がある
ことが示唆された。
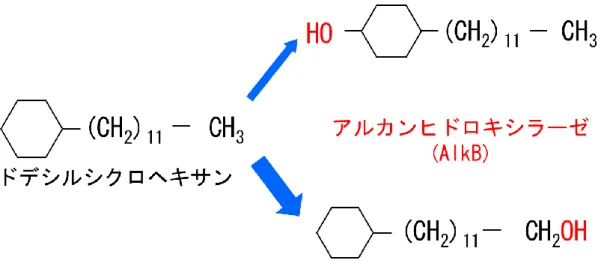
長鎖 c-アルカンを分解する最初のステップは、アルカンヒドロキシラーゼ(Alk)に
よって炭化水素の酸化が引き起こされることである(van Beilen et al. 2005、van Beilen et
6
で明らかにされている(Whyte et al. 2007、Fujii et al. 2004、Vomberg et al. 2000、Whyte
et al. 1998)。alkB 遺伝子は 7 つのタイプ(alkB1 から alkB7)に分類され、多くの
Rhodococcus 属細菌は alkB2 を持つことが知られている(van Beilen et al. 2002、 Hara et
al. 2004)。しかしながら、異なるタイプのalkB 遺伝子と c-アルカン分解能力の関係性は
それぞれの種について明らかになっていない。さらに、alkB は Rhodococcus 属細菌の中
でも様々であり、また酸化可能な基質はalkB 遺伝子のタイプによって異なる(Rehm et
al. 1981)。これまでに明らかにされているR. erythropolis NDKK48 による長鎖 c-アルカ
ンの酸化経路についてはFigure 1-3 に示す(Kubota et al. 2008)。たとえば、R. erythropolis
NDKK6 株は、alkB R2 タイプの遺伝子を持ち、高い c-アルカン分解能を示すことが明ら
かにされている。さらに、アルキル側鎖の炭素数がc-アルカン分解に影響していること
が推察されている(Perry et al. 1984、Koma et al. 2001、Koma et al. 2003a、Koma et al. 2003b)。これまでの研究より、Figure1-2 に示す Rhodococcus 属細菌に由来する 11 株の HDB が単離されてきたが(Kubota et al. 2008)、それらの特徴については明らかにされ ていない。 本研究では、単離したRhodococcus 属細菌の 11 菌株と NITE 生物資源センター(NBRC) から入手した株19 菌株について、alkB 遺伝子と長鎖 c-アルカン分解における関係性を 調査した。
7
8
Figure 1-2 単離した長鎖 c-アルカン分解菌 11 株の 16S rRNA 遺伝子に基づいた系統樹
単離した
9
10
2節 実験材料および方法
1.2.1 長鎖炭化水素分解菌の菌株
30 の細菌株は、長鎖 c-アルカン分解細菌として使用した。11 菌株(R. erythropolis NDKK1、R. erythropolis NDKK2、R. erythropolis NDKK5、R. erythropolis NDKK6、R. erythropolis NDKK7、R. erythropolis NDKK48、R. erythropolis ODNM1C、R. erythropolis NDKY82A、R. erythropolis ODMI54、R. erythropolis ODNM2B、R. erythropolis NDMI144) はこれまでの研究で単離してきたものを用いた(Kubota et al. 2008)。また 19 菌株 (R. erythropolis NBRC15567、R. rhodochrous NBRC15564、R. baikonurensis NBRC100611、R. wratislaviensis NBRC100605 、 R.opacus NBRC100624 、 R. ruber NBRC15591 、 R. equi NBRC101255、R. percoletus NBRC100626、R. jostii NBRC16295、R. triatomae NBRC103116、 R. koreensis NBRC100607、R. corynebacterioides NBRC14404、R. zopfii NBRC100606、R. tukisamuensis NBRC100609、R. maanshanensis NBRC100610、R. pyridinivorans NBRC100608、 R. kroppenstedtii NBRC103113、R. rhodnii NBRC100604、R.coprophilus NBRC100603)は NBRC から入手した。
1.2.2 炭化水素分解菌株の同定
これまでに研究で単離した11 株は、16S rRNA 遺伝子配列全長に基づいて同定し
た。これらの株は、ルリア・ベルターニ(以下、LB)培地(1 %(w/v)ポリペプト
ン、0.5 %(w/v)乾燥酵母エキス、0.5 %(w/v)NaCl)で、30℃で 200 rpm にて振とう 培養した(Koma et al. 2001)。培養物から全 DNA を抽出し、16S rRNA 遺伝子配列を決 定した(Iwamoto et al. 2001、Sanpa et al. 2006)。 配列データは DNA データバンク (DDBJ)のデータベース(https://www.ddbj.nig.ac.jp/index-e.html)にアクセッション番 号LC107434~LC107444 として登録した。また、これらの配列は、BLAST + 2.2.31 (https://www.ncbi.nlm.nih.gov/blast/)を使用して GenBank データベースのデータとも 比較した。配列決定した11 株と、GenBank データベースから配列データを取得した追 加の19 種について、ClustalW(バージョン 2.1)を使用して系統解析を行った。隣接 結合法と1000 回反復で計算したブートストラップ値より系統樹を構築した。
1.2.3 alkB と alkB [alkB R2 Type] 遺伝子のシーケンス
alkB の配列も 30 系統について決定した。それぞれ alkB および alkB 遺伝子[alkB R2 Type]の存在を確認するために、プライマーalkB-F(5'-AACTAYMTCGARCAYTAYGG-3')/ alkB-R(5'-TGRTCKSTCGYTGVARGTG-3')および alkB
11
(Hara et al. 2004)を使用して PCR を実施した。alkB および alkB 遺伝子[alkB R2type] PCR 産物は、それぞれ 140 bp および 100 bp であった。alkB プライマーは、HDB のコ ンセンサス領域を用いて設計した(Figure 1-4)。 alkB 配列は、DNA シーケンサー (ABI PRISM 3100、Applied Biosystems、CA、アメリカ)によって決定し、配列デー
12
13
1.2.4 Rhodococcus 属細菌による c-アルカン分解能の解析
長鎖c-アルカン分解能力を評価するため、Figure 1-5 に示すウンデシルシクロヘキサ ン(UDC)、ドデシルシクロヘキサン(DDC)、またはトリデシルシクロヘキサン(TDC) を基質として、それぞれの基質0.10 % (w/v)を含む改変 SW 培地で 30 菌株を培養した。 各細菌株の前培養液は LB 培地で調製した。基質である各炭化水素(0.10 g)および前 培養液(1 ml)を 100 ml の改質 SW 培地(1 L あたり:1.21 g NH4NO3、14.3 g Na2HPO4・12H2O、5.44 g KH2PO4、0.5 g NaCl、0.247 g MgSO4、2.78 mg FeSO4・7H2O、14.7 mg CaCl2・
2H2O、2.01 mg ZnSO4∙7H2O、0.15 mg [NH4]6Mo7O24・4H2O、2 mg CuSO4・5H2O、0.4 mg
CoCl2・6H2O、1.49 mg MnSO4・5H2O、0.5 g Polypeptone, 0.25 g Yeast Extract)が入ったバ
ッフルフラスコへ投与した。改質SW 培地は事前に 120 rpm で振盪しながら 30°C で 3 日間インキュベートしたものを利用した。 3 日間の培養後、30 ml のクロロホルム・メタノール(3:1)混合液を 100 ml の培養 液に添加し、十分に混合した後、4,000×g で 30 分間遠心分離した。 分離した有機層は、フレームイオン化検出器付きガスクロマトグラフ(GC-FID) (GC-2010、島津製作所、京都)で分析した。分解試験は 3 連で実施した。未植菌の系のピー ク面積と、各菌株を植菌した系のピーク面積を比較し、その減少率を分解率として算出 した。土壌中の炭化水素の濃度は、油分濃度計(OCMA-355、堀場製作所、京都)を使 用して測定した。
14
15
3節 結果
1.3.1 長鎖 c-アルカン分解細菌の同定と Rhodococcus 属細菌におけるアルカン
ヒドロキシラーゼ遺伝子の分析
炭化水素の初発酸化にはアルカンヒドロキシラーゼ遺伝子が関与しており、炭化水素 分解菌が有するアルカンヒドロキシラーゼ遺伝子の解析が行われている。これまでの 研究(Kubota et al. 2008)で新たにスクリーニングした長鎖 c-アルカン分解菌である Rhodococcus 属細菌について 16S rRNA 遺伝子(1429~1472 bp)の解析を行った。 系統解析の結果、単離された11 菌株全てが参照菌株である R. erythropolis MPU33 (DDBJ アクセッション番号: AB334770)と類似性が高く、R. erythropolis に属するこ とがわかっている。これらの菌株は長鎖c-アルカンを唯一の炭素源とする培地にて単離しており(Kubota et al. 2008)、alkB を保持することが示唆された。
本研究では、これまでの研究で単離された11 菌株と NBRC より取得した 19 菌株の Rhodococcus 属細菌について alkB 遺伝子の存在とタイプを確認した。その結果、単離 された11 菌株は全て alk 遺伝子を保持していた。さらに、NBRC より取得した 19 菌 株のうち13 菌株の Rhodococcus 属細菌についても alkB 遺伝子を保持していることが わかった(Table 1-1、Table 1-2)。 これまでの研究で自然界から単離した11 株の R. erythropolis の alkB 遺伝子配列は、
高いc-アルカン分解能力をもつ R. erythropolis NDKK6 の alkB [alkB R2 type] 遺伝子と
98.1~100%の相同性を示した(Table 1-1)。
NBRC から取得した 3 つの菌株(R. erythropolis NBRC15567、R. rhodochrous、R. baikonurensis)の alkB 遺伝子配列は alkB [alkB R2 type] 遺伝子と 95.7%以上の高い相同
性を示すalkB 遺伝子を保持することがわかった(Table 1-2)。alkB 遺伝子を保持する
それ以外の10 菌株は、alkB [alkB R2 type] 遺伝子とは 21.9~78.3%と相同性が低く、
遺伝子配列が異なることがわかった。そこで、これらのalkB 遺伝子に対してそれぞれ
固有のalkB 遺伝子名を命名した(Table 1-2)。R. opacus と R. percolatus の alkB 遺伝
子のの相同性は99.7%であったため(Figure 1-6)、どちらも alkB [alkB ROP type] 遺伝
子と名付けた。残りの6 菌株は alkB 遺伝子を保持していなかった。さらに、alkB 遺
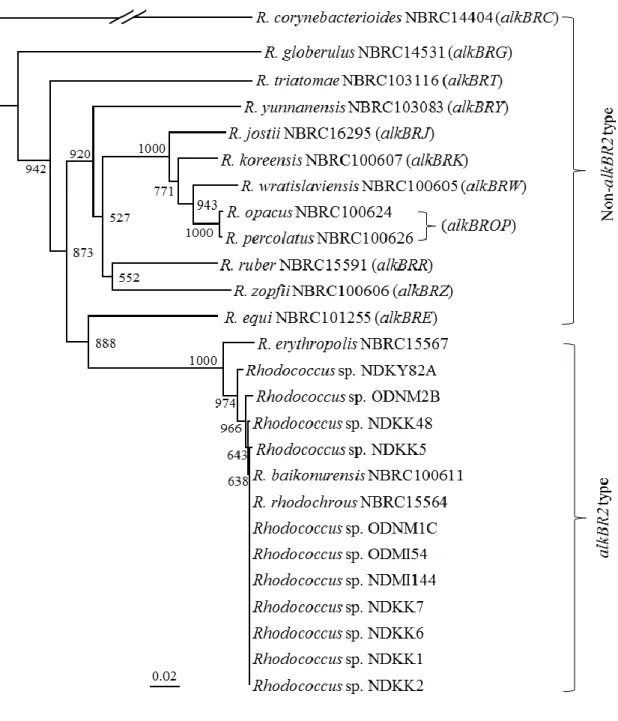
伝子を保持する24 菌株について alkB 遺伝子に基づいた系統解析をおこなった。その
結果、alkB [alkB R2 type]遺伝子をもつクラスターと、それ以外の alkB 遺伝子をもつも
のとしてalkB [non-alkB R2 type]のクラスターに分かれた(Figure 1-6)。
これらのRhodococcus 属細菌は保持する alkB 遺伝子のタイプに基づき、3 つのグル
ープに分類した。第1 のグループとして R. baikonurensis や R. rhodochrous のように
alkB [alkB R2 type] 遺伝子を保持するもの、第 2 のグループとして alkB [alkB R2 type]
以外のalkB 遺伝子を alkB [non-alkB R2 type]として、これらを保持するもの、第 3 のグ
16
* R. erythropolis NDKK6 の alkB [alkB R2 type] 遺伝子(Fukuhara et al. 2013)
菌株 alkB 遺伝子 alkB [alkB R2 type] 遺伝子*との相同性 (%)
R. erythropolis NDKK1 + 99.6 R. erythropolis NDKK2 + 100 R. erythropolis NDKK5 + 99.9 R. erythropolis NDKK7 + 99.8 R. erythropolis NDKK48 + 99.7 R. erythropolis ODNM1C + 99.8 R. erythropolis NDKY82A + 98.1 R. erythropolis ODMI54 + 99.7 R. erythropolis ODNM2B + 99.2 R. erythropolis NDMI144 + 99.7
17
Table 1-2 alkB 遺伝子の存在と alkB [alkB R2 type] 遺伝子との相同性と alkB 遺伝子の種類
* R. erythropolis NDKK6 の alkB [alkB R2 type] 遺伝子(Fukuhara et al. 2013)
菌株 alkB 遺伝子 alkB [alkB R2 type] 遺伝子*との相同性(%) 遺伝子の種類
R. rhodochrous NBRC15567 + 95.7 alkB R2
R. rhodochrous NBRC15564 + 100 alkB R2
R. baikonurensis NBRC100611 + 99.7 alkB R2
R. wratislaviensis NBRC100605 + 22.6 alkB RW
R. opacus NBRC100624 + 23.4 alkB ROP
R. ruber NBRC15591 + 30.5 alkB RR
R. equi NBRC101255 + 78.3 alkB RE
R. percolatus NBRC100626 + 21.9 alkB ROP
R. jostii NBRC16295 + 30.1 alkB RJ R. triatomae NBRC103116 + 30.1 alkB R1 R. koreensis NBRC100607 + 30.5 alkB RK R. corynebacterioides NBRC14404 + 24.1 alkB RC R. zopfii NBRC100606 + 30.7 alkB RZ R. tukisamuensis NBRC100609 - R. maanshanensis NBRC100610 - R. pyridinivorans NBRC100608 - R. kroppenstedtii NBRC103113 - R. rhodnii NBRC100604 - R. coprophilus NBRC100603 -
18
19
1.3.2
alkB R2遺伝子を保持する
Rhodococcus 属細菌による長鎖 c-アルカンの分
解
alkB [alkB R2 type] 遺伝子を保持する 14 菌株の Rhodococcus 属細菌による c-アルカ ン (UDC:ウンデシルシクロヘキサン、DDC:ドデシルシクロヘキサン、TDC:ト リデシルシクロヘキサン)の分解率をTable 1-3 に示す。 UDC、DDC、TDC の平均分解率はそれぞれ 55.5%、31.8%、55.2%であった。 ODNM2B 株は 98.9 %の最も高い UDC 分解率を示した。同様に、NDKK2 と ODNM2B 株はそれぞれ 42.9 % と 94.6 %の優れた DDC および TDC 分解率を示し た。平均としてみた場合、全体的に高い分解率を示すことがわかった。 Figure 1-7 は NDKK6 株による UDC 分解におけるガスクロマトグラフの結果を示し ている。リテンションタイム10 分付近にある UDC のピークが減少し、UDC が分解さ れていることが確認できた。
20 菌株 分解率 (%) UDC DDC TDC R. erythropolis NDKK1 16.0 ± 7.5 31.7 ± 8.7 17.9 ± 7.3 R. erythropolis NDKK2 6.7 ± 10.7 42.9 ± 10.2 23.5 ± 3.2 R. erythropolis NDKK5 66.7 ± 0.2 42.2 ± 1.8 40.6 ± 10.0 R. erythropolis NDKK6 38.8 ± 1.0 18.9 ± 6.2 75.7 ± 6.1 R. erythropolis NDKK7 53.5 ± 3.6 42.1 ± 4.0 46.7 ± 9.1 R. erythropolis NDKK48 40.4 ± 2.5 33.1 ± 12.6 81.4 ± 0.1 R. erythropolis ODNM1C 78.2 ± 2.4 41.8 ± 2.9 91.0 ± 1.1 R. erythropolis NDKY82A 52.7 ± 4.9 39.1 ± 9.2 78.4 ± 1.5 R. erythropolis ODMI54 68.2 ± 5.0 37.8 ± 8.2 46.8 ± 2.6 R. erythropolis ODNM2B 98.9 ± 0.2 30.3 ± 3.5 94.6 ± 6.7 R. erythropolis NDMI144 91.4 ± 3.9 27.7 ± 10.3 39.9 ± 8.3 R. erythropolis NBRC15567 64.5 ± 9.4 0.0 ± 0.0 75.4 ± 1.5 R. rhodochrous NBRC15564 50.6 ± 3.9 41.6 ± 9.1 39.6 ± 7.1 R. baikonurensis NBRC100611 50.4 ± 3.8 16.0 ± 3.0 20.6 ± 5.7 平均 55.5 31.8 55.2 *n=3.
21 [A]
[B]
Figure 1-7 R. erythropolis NDKK6 による UDC 分解のガスクロマトグラフ
矢印はUDC のピークを示す。[A] 未植菌 [B]R. erythropolis NDKK6 を植菌したも
の。 強度( V ) 0 5 10 15 20 リテンションタイム(分) 強度( V ) 0 5 10 15 20 リテンションタイム(分) 7 6 5 4 3 2 1 0 7 6 5 4 3 2 1 0
22
1.3.3 non-alkB R2 遺伝子を保持する Rhodococcus 属細菌による長鎖 c-アルカ
ンの分解
alkB [non-alkB R2 type] 遺伝子を持つ Rhodococcus 属細菌 10 菌株の長鎖 c-アルカン (UDC、DDC、TDC)分解率を Table 1-4 に示す。UDC、DDC、TDC の平均分解率はそ
れぞれ49.4%、29.4%、53.9%であった。
したがって、alkB 遺伝子を保持する Rhodococcus 属細菌は長鎖 c-アルカンのよう炭
化水素を分解することができることがわかった。しかし、non-alkB [non-alkB R2 type] 遺
伝子を保持する菌株はalkB [alkB R2 type] 遺伝子を保持する株と比べて、平均としてと
らえた場合、分解率が低かった (Table 1-3、Table 1-4)。
この結果は、alkB [alkB R2 type] 遺伝子が長鎖 c-アルカンの分解により適しているこ
とを示している。さらに、DDC と比べて UDC と TDC の分解率が高い傾向が示された。
これらの結果から、Rhodococcus 属細菌にとって、炭素原子数が奇数側鎖の長鎖 c-アル
23
Table 1-4 alkB genes [non-alkB R2 type] 遺伝子を持つRhodococcus 属細菌による長鎖 c-アルカンの分解
n=3.
菌株 alkB 遺伝子の種類 分解率 (%)
*
UDC DDC TDC
R. wratislaviensis NBRC100605 alkB RW 39.7 ± 5.2 58.6 ± 4.0 25.1 ± 2.1
R. opacus NBRC100624 alkB ROP 94.9 ± 1.4 56.8 ± 5.8 43.1 ± 0.4
R. percoletus NBRC100626 alkB ROP 47.1±13.5 35.7 ± 2.3 60.6 ± 11.1
R. ruber NBRC15591 alkB RR 98.2 ± 1.6 55.9 ± 3.6 43.2 ± 3.4 R. equi NBRC101255 alkB RE 48.9 ± 2.1 39.3 ± 3.4 98.4 ± 1.6 R. jostii NBRC16295 alkB RJ 29.8 ± 4.9 27.8 ± 10.7 65.0 ± 8.2 R. triatomae NBRC103116 alkB R1 34.0 ± 14.2 15.9 ± 7.4 75.3 ± 1.7 R. koreensis NBRC100607 alkB RK 6.0 ± 10.6 4.2 ± 5.4 5.5 ± 2.3 R. corynebacterioides NBRC14404 alkB RC 41.4 ± 6.5 0.0 ± 0.0 62.3 ± 0.6 R. zopfii NBRC100606 alkB RZ 53.9 ± 9.1 0.0 ± 0.0 60.3 ± 5.3 平均 49.4 29.4 53.9
24
1.3.4 alkB 遺伝子を保持しない Rhodococcus 属細菌による長鎖 c-アルカンの分
解
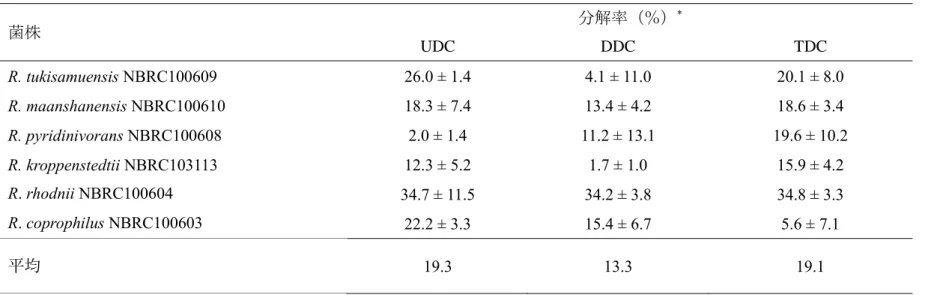
alkB 遺伝子を保持しない 6 菌株の長鎖 c-アルカン(UDC、DDC、TDC)分解率を Table 1-5 に示す。R. rhodnii NBRC100604 は 6 菌株のなかで最も高い UDC、DDC、TDC 分解
率を示した。6 菌株による UDC、DDC、TDC の分解率の平均値はそれぞれ 19.3%、13.3%、
19.1%であった。alkB 遺伝子を保持しない菌株の UDC、DDC、TDC 平均分解率は、alkB [alkB R2 type] 遺伝子や alkB [non-alkB R2 type] 遺伝子を保持する菌株と比べて低い値
を示した。alkB 遺伝子を保持する Rhodococcus 属細菌は alkB 遺伝子を保持しない菌株
より長鎖c-アルカンの高い分解能力を有することがわかった(Table 1-3、Table 1-5)。
しかしながら、alkB 遺伝子を保持しない R. rhodnii NBRC100604 は 30 %以上の分解率
25
Table 1-5 alkB遺伝子を保持しないRhodococcus 属細菌による長鎖 c-アルカンの分解
菌株 分解率(%) * UDC DDC TDC R. tukisamuensis NBRC100609 26.0 ± 1.4 4.1 ± 11.0 20.1 ± 8.0 R. maanshanensis NBRC100610 18.3 ± 7.4 13.4 ± 4.2 18.6 ± 3.4 R. pyridinivorans NBRC100608 2.0 ± 1.4 11.2 ± 13.1 19.6 ± 10.2 R. kroppenstedtii NBRC103113 12.3 ± 5.2 1.7 ± 1.0 15.9 ± 4.2 R. rhodnii NBRC100604 34.7 ± 11.5 34.2 ± 3.8 34.8 ± 3.3 R. coprophilus NBRC100603 22.2 ± 3.3 15.4 ± 6.7 5.6 ± 7.1 平均 19.3 13.3 19.1 *n=3.
26
4節
考察
本研究では、Rhodococcus 属細菌が有する様々な種のアルカンヒドロキシラーゼ遺伝
子の同定と、長鎖アルカン分解能の解析を行った。これまでの研究で単離した長鎖
c-アルカン分解能を有するRhodococcus 属細菌は全てが R. erythropolis であり、alkB [alkB
R2 type] 遺伝子を保持していることが明らかとなった。また、NBRC より取得した Rhodococcus 属細菌の中で 3 種が alkB [alkB R2 type] 遺伝子を保持していた。これらの
菌株は、alkB [alkB R2 type] 遺伝子を保持しない菌株に比べて、長鎖 c-アルカンの高い
分解能を持っており、alkB [alkB R2 type]が長鎖 c-アルカンの分解に重要な役割を持って
いることが示された。また、基質のうち、DDC と比べて UDC と TDC の分解率が高い ことから、Rhodococcus 属細菌にとって、側鎖の炭素数が奇数の長鎖 c-アルカンがより 分解しやすいことが示唆された。側鎖の炭素数が偶数のアルキルシクロヘキサンの分解 中に、主要な代謝産物であるシクロヘキシル酢酸が大量に蓄積したことが報告されてい る(Perry 1984)。このことから、今回解析したRhodococcus 属細菌についても同様に側 鎖の炭素数が偶数の長鎖c-アルカンについては、分解が停滞してしまうことが推察され
た。NBRC より取得した Rhodococcus 属細菌には、alkB [alkB R2 type] 遺伝子を保持す
る種以外に、それぞれ異なるalkB 遺伝子を保持する Rhodococcus 属細菌が存在した。こ れらの菌株についても、アルキル側鎖が奇数の長鎖c-アルカンをより分解するという特 徴が見られた。さらにNBRC より取得した Rhodococcus 属細菌には alkB 遺伝子を保持 しない菌株も含まれていた。これらの菌株は alkB 遺伝子を保持する Rhodococcus 属細 菌の分解率より、長鎖c-アルカンの平均分解率において低い値を示した。このことから、 長鎖 c-アルカン分解には AlkB をコードする alkB 遺伝子が重要な働きをしていること
が明らかとなった。しかし、alkB 遺伝子を保持しない Rhodococcus 属細菌の R. rhodnii
NBRC100604 は全ての基質において 30%以上の分解率を示した。長鎖 c-アルカンの分
解能力はアルカンヒドロキシラーゼ遺伝子に依存すると考えらえる。一方で、alkB 遺伝
子を保持しないRhodococcus 属細菌は、チトクローム遺伝子のような他の分解システム
によって長鎖c-アルカンを分解しているのかもしれない(van Beilen et al. 2006)。また、
Rhodococcus 属細菌の多くの種が alkB 遺伝子を保持することが明らかとなった。
これまでの研究で、環境中から分離されたRhodococcus 属に属する c-アルカン分解
細菌の自然界における物質循環における役割は、alkB [alkB R2 type] 遺伝子を保持する
R. erythropolis と密接に関連していた(Fukuhara et al. 2013)。Rhodococcus 属細菌の多く
のc-アルカン分解細菌は自然界に広く分布しているが、長鎖 c-アルカンは自然環境で
は限られている。これらの細菌は、直鎖状または環状の炭化水素成分を含む葉や芳香 族化合物のワックスなどの炭化水素を利用できる可能性を示唆している。 したがっ て、アルカンヒドロキシラーゼ遺伝子を保持しているこれらの細菌は、自然界で数種 類の炭化水素化合物の物質循環に寄与している可能性がある(Nie et al. 2014)。
27
5節
要約
本研究では、各種Rhodococcus 属細菌の、alk 遺伝子と、長鎖 c-アルカン分解能を解析 することにより、Rhodococcus 属細菌における炭化水素分解の特徴を明らかにすること を目的にした。 1. 長鎖炭化水素分解菌である 11 種類の Rhodococcus 属細菌と、NBRC から取得し た19 菌株のアルカンヒドロキシラーゼ遺伝子の有無を解析し、分類を行った。 また、これらすべての菌株で長鎖c-アルカン(UDC、DDC、TDC)の分解能の 解析を行った。2. 11 種の R. erythropolis は、すべて既報(Fukuhara et al. 2013)の alkB R2 遺伝子 を保持していた。また、NBRC から取得した菌株については、R. erythropolis の
他にalkB R2 を保持している菌株が確認された。解析を行った 30 菌株は、alkB
R2 遺伝子を保持している菌株、alkB R2 以外の alk 遺伝子を保持する菌株、alk
遺伝子を保持しない菌株の3 種類の菌株に分類された。
3. alkB R2 遺伝子を有する Rhodococcus 属細菌は、他の 2 種類の菌株よりも長鎖シ クロアルカン類に対して高い分解能を示した。分離菌株の炭化水素分解能を網
羅的に解析した結果、長鎖 c-アルカン成分による炭化水素汚染には alkB R2 遺
28
第
2 章 土壌バイオマスと微生物活性によるバイオ
レメディエーション効率の向上
1節 緒言
石油炭化水素汚染環境の修復に関する規制は、米国(1984)、オランダ(1994)、ドイ ツ(1998)、日本(2006)を含むいくつかの国で 1980 年代初頭から施行され始めた (Hatayama et al. 2008)。炭化水素汚染土壌の修復において、最も一般的な修復方法は焼 却などの物理化学的処理であるが、燃焼には大量の化石燃料が必要である(Matsumiya et al. 2007)。しかし、この処理方法は環境負荷が大きいだけでなく土壌有機物の除去と 微生物の死滅につながるという問題がある。そのために処理後の土壌の生物活性が回復 するには長い時間が必要となる(Bárcenas-Moreno et al. 2011)。 それに対し、汚染土壌のバイオレメディエーションによる処理は、石油系炭化水素を 含む様々な有機汚染物質を処理するための有効な方法であり、炭化水素を効果的に除去 するだけでなく、汚染によって低下した土壌の微生物活性を高めることができると考え られる。炭化水素汚染土壌の修復のために、環境への負荷を抑えられ、費用対効果の高 いいくつかのバイオレメディエーションシステムが開発されてきた(Liu et al. 2010、Jørgensen et al. 2000、Hejazi et al. 2003)。これらのシステムは、バイオスティミュレーシ
ョンとバイオオーグメンテーションの2 つのグループに大きく分類できる。バイオレメ
ディエーションの効率は、土壌の物理的、化学的、微生物学的特性の影響を受ける。ま た、 炭化水素で汚染された土壌中の微生物は、炭化水素汚染の影響を受けるため、炭化 水素汚染土壌中の微生物量が非汚染土壌よりも少なかった(Aoshima et al. 2006)。
これまで、土壌のバイオレメディエーションに適したさまざまな炭化水素分解細菌が 分離・同定され、その諸性質が解析されてきた(Pritchard et al. 1992、Lal et al. 1996、
Vidali et al. 2001、Aislabie et al. 2006)。その中で、炭化水素分解効率の向上と持続性は、
土壌の炭化水素浄化において、いまだ大きな課題となっている。バイオレメディエーシ ョンにおける汚染物質の分解効率を向上させるには、汚染土壌中のバイオマス(炭化水 素分解菌や有機物の炭素、窒素、リン成分)の量と活性を高める効果的な方法が必要で ある。 効果的なバイオスティミュレーションには、汚染土壌の土着HDB の活性と維持が必 要であると考えられる。これは、酸素、水、無機栄養素の供給により、バクテリアが炭 化水素を分解するための好ましい環境条件を整えることである(Couto et al. 2010)。炭 化水素汚染などのように、大量の炭素が存在する場合、窒素やリンなどの他の栄養素が 枯渇する傾向がある(Kvenvolden et al. 2003)。したがって、無機および有機資材を介し
29
た栄養素の添加は、土壌中の石油系炭化水素の生分解にプラスの効果を示す(Braddock et al. 1997、Bundy et al. 2002、Delille et al. 2004、Margesin et al. 2003、 Margesin et al. 2007、
Xu et al. 2004)。 つまり、土着の HDB の活性化と土壌環境におけるそれらの分布の理解 は、バイオレメディエーションの効率の改善につながる。これまで福原らは、土壌環境 における固有のHDB を定量化し、これらの細菌の分布を調査するために、炭化水素汚 染のないさまざまな土壌サンプル(粘土、シルト質土、砂質土)を分析した(Fukuhara et al. 2013)。その報告では以下の内容が明らかにされている。土壌中の炭化水素分解細 菌の定量化するためのリアルタイム PCR は、炭化水素分解に関与する重要な酵素をエ
ンコードするalkB 遺伝子を使用した(van Beilen et al. 2003、Nie et al. 2011、Fukuhara et al. 2013)。 ほとんどの HDB が alkB 遺伝子を保持するため、alkB 遺伝子を保持する HDB の分布を分析して、バイオスティミュレーションの効率を向上させた。また、炭化水素
で汚染されていない土壌を合計 23 個のサンプルを収集し、総細菌数と HDB 数を分析
した(Figure 2-1)。それぞれの土壌の HDB は 3.7×107〜5.0×108 cells/g、平均 1.3×108 cells/g
であった。HDB の平均割合は、総細菌の 0.88 %だった。炭化水素汚染のない自然な環 境においても炭化水素分解微生物の存在は報告されている(Greer et al. 2010)。土壌環 境の調整は、天然土壌におけるこれらのHDB の数と活性を高める可能性があり、HDB の数を増やすと、石油炭化水素汚染土壌のバイオレメディエーションシステムの効率が 向上することを示唆している。 油汚染環境の効果的な生分解を可能にするために、無機材料の添加により土壌のC:
N:P 比を 100:10:1 に維持することが一般的に推奨される(Dibble et al. 1979、USEPA
et al. 1994a、USEPA et al. 1994b、Leys et al. 2005)。 しかし、バイオスティミュレーショ
ンの有効性は、油成分の種類、非油有機物含有量、土着微生物の数と分解能力など、土 壌中の他のいくつかの要因に依存する可能性がある。 バイオレメディエーションでは、事前に培養された特定の炭化水素分解微生物を汚染 サイトに追加するバイオオーグメンテーションにより、さらに高い効果が見込まれる。 特に、土着の炭化水素分解微生物の存在量が少ないような環境では、効果が大きいと考 えられる。さらに、特定の難分解性化合物による汚染をバイオレメディエーションで修 復することは、効率的な炭化水素分解細菌のバイオオーグメンテーションによって可能 になる(Auffret et al. 2009、Fortin et al. 2001)。これまでの研究で、多くの環境から石油
系炭化水素を分解する能力を持つGordonia 属細菌、Acinetobacter 属細菌、Pseudomonas
属細菌、および Bacillus 属細菌などのいくつかの細菌が分離および同定されている
(Kubota et al. 2008)。その結果では、3 種類の長鎖炭化水素(c-アルカン画分を含むも
の)を使用して、いくつかのHDB 株を土壌から分離している。400 を超える分離菌株
が、唯一の炭素源が長鎖c-アルカンの培地で増殖する能力を示した。より高い成長能力
(OD600≧0.1)を示す 36 株については、16S rRNA 遺伝子配列の分析に基づいて、同定
30
およびFirmicutes(3 株) などの 4 つのグループに分類された。13 株の actinobacteria は
Rhodococcus 属に分類され、残りの 4 株は Gordonia 属であった。同様に、10 株の γ- proteobacteria は Acinetobacter 属に分類された。Rhodococcus 属と Gordonia 属は、主に
基油の c-アルカン画分を含む培地で分離された。これらの微生物の中で、Rhodococcus
属細菌と Gordonia 属細菌は石油系炭化水素のバイオレメディエーションに広く使用さ
れている(Hatayama et al. 2008、Lin et al. 2009、Auffret et al. 2015)。
石油系炭化水素の生分解には、特定の酵素とさまざまなメカニズムが必要である。石 油系炭化水素汚染のバイオレメディエーションにおいて、微生物は石油系炭化水素化合 物を炭素とエネルギーの供給源として利用することで生育する。 微生物分解を受けた 後の、不活性および有毒なアルカン化合物は、他の微生物により酸化されやすい毒性の 低い物質に変換される。活性化から最終代謝までの炭化水素分解の一般的な経路を Figure 2-2 に示す。 炭化水素の完全分解は、さまざまな化学および微生物の酵素反応に よって進む(Sierra-Garcia et al. 2013)。 炭化水素は水に不溶なため、それらの分解には、 バイオサーファクタントが関係している場合がある(Brusseau et al. 1995、Bai et al. 1997、
Barkay et al. 1999)。 微生物細胞に入った後、トリカルボン酸サイクルなどの中間代謝経 路を介していくつかの酸化反応が進む(Fritsche et al. 2008)。さらに、N や P などの無 機物質も炭化水素の分解に影響している。生分解の速度は炭化水素の構造に依存し、脂 肪族炭化水素は芳香族炭化水素よりも容易に分解される(Figure 2-3)。 いくつかの酵素 が炭化水素を分解することがわかっている。 好気性条件下での炭化水素分解の初発酸 化に必要な主要な微生物酵素をTable 2-1 に示す。 よって本章では最初に様々な炭化水素分解菌の特徴と有機資材の調整に着目し、炭化 水素汚染土壌の効果的なバイオレメディエーションシステムの構築を試みた。 さらに、土壌環境は微生物の活性に大きく関わる。中でもリンの循環は微生物を介し た有機物分解の一つであるが、微生物数や有機物量に加え、微量金属量(Fe、Al、Ca な ど)やpH などの環境条件にも影響を受ける複雑な系である。それと同時に、無機態リ ンは植物の生育にとって必須の元素であり、土壌のリン循環速度を向上させることが土 壌環境の改善にとって重要である。そこで、バイオレメディエーションのさらなる効率 化につなげることを目指した。
31 Figure 2-1 石油系炭化水素で汚染されていない土地から収集したさまざまな土壌サンプルにおける総細菌および HDB の分布 (Fukuhara et al. 2013 の実験データを改変)
試料
No.
HDB 数
総微生物数
微
生物数
(
lo
g cells/g
)
32
33 Figure 2-3 異なる種の石油系炭化水素の相対的な生分解性 短・中鎖アルカン(<C20) 長鎖アルカン(>C20) 芳香族炭化水素 (例、トルエン、ベンゼンなど) 長鎖シクロアルカン (例、ドデシルシクロヘキサン) 多環芳香族炭化水素 (例、ピレン、アスファルテンなど) 分 解 性 ( 降 順 )
34
対象の炭化水素 初発酸化のための酵素 参考文献
Short-chain alkanes (C2–C10) 1. Non-heme iron monooxygenase 2. Copper-containing monooxygenase
3. Heme-iron monooxygenase (or cytochrome P450)
van Beilen et al. 1994 Hamamura et al. 1999 Maier et al. 2001 Short to medium length chain alkanes (C5–C20) 1. AlkB related alkane hydroxylases vanBeilen et al. 2003 Long-chain alkanes (>C20) 1. Heme-monooxygenase (P450 type)
2. Non-heme iron monooxygenase (AlkB-related) 3. Flavin-binding monooxygenase (AlmA)
4. Thermophilic flavin-dependent monooxygenase (LadA)
vanBeilen et al. 2006 Nie et al. 2011 Maeng et al. 1996
Feng et al. 2007, Li et al. 2008
Aromatic hydrocarbons 1. Fe-dioxygenase
2. Fe-monooxygenase 3. Flavin-monooxygenase
Larkin et al. 1999 Kim et al. 2008 van Beilenet al. 2002
35
2節 実験材料および方法
2.2.1 長鎖 c-アルカン分解菌
長鎖c-アルカン分解菌 Rhodococcus 属細菌は、これまでの研究で単離してきた 11 菌
株(R. erythropolis NDKK1、R. erythropolis NDKK2、R. erythropolis NDKK5、R. erythropolis
NDKK6、R. erythropolis NDKK7、R. erythropolis NDKK48、R. erythropolis ODNM1C、R. erythropolis NDKY82A、R. erythropolis ODMI54、R. erythropolis ODNM2B、R. erythropolis NDMI144)を用いた(Kubota et al. 2008)。
長鎖c-アルカン分解菌 Gordonia 属細菌は、これまでの研究で単離してきた 5 菌株
(Gordonia sp. NDKK46、Gordonia sp. NDKY2B、Gordonia sp. NDKY2C、Gordonia sp.
NDKY76A、Gordonia sp. YS5)を使用した(Kubota et al. 2008)。菌株は LB 培地を用い、 30℃、120 rpm で振とう培養した。
2.2.2 炭化水素分解菌株の同定と
これまでに研究で単離した長鎖c-アルカン分解菌 Gordonia 属細菌 5 菌株(Gordonia
sp. NDKK46、Gordonia sp. NDKY2B、Gordonia sp. NDKY2C、Gordonia sp. NDKY76A、 Gordonia sp. YS5)は使用した。これらの株は、LB 培地で、30℃で 200 rpm にて振とう 培養した(Koma et al. 2001)。培養物から全 DNA を抽出し、16S rRNA 遺伝子配列を決 定した(Iwamoto et al. 2001、Sanpa et al. 2006)。配列決定した 5 株について、ClustalW
(バージョン2.1)を使用して系統解析を行った。隣接結合法と 1000 回反復で計算し
たブートストラップ値より系統樹を構築した。alkB の配列も 30 系統について決定し
た。それぞれalkB の存在を確認するために、Table2-2 に示すプライマーを使用して
PCR を実施した。alkB 遺伝子[alkB G type] PCR 産物は、約 1,300 bp であった。 DNA
シークエンスで決定した塩基配列はGenetyx Mac フォーマットで保存し、NCBI が提供し ているサービスBlast Search(http://www.ncbi.nlm.nih.gov/blast/blast.cgi)を用いて相同性の 高い遺伝子の検索を行った。
36
名称 塩基配列 Tm 値(℃) 参考文献
20-F 5’-GTAATCGTCGGCCAGTAGAGTTTGATCCTGGCTC-3’ 78 Miyake et al. 2003
1510-R alkG-F alkG-R 5’-CAGGAAACAGCTATGACCGGCTACCTTGTTACGACT-3’ 5’-GCCCGATTGTCTAGACAACGGACA-3’ 5’-TAATCGCAGCCCGGGCAACGGAATG-3’ 77 72 65 Miyake et al. 2003 西八条、2005 西八条、2005
37
2.2.3 長鎖 c-アルカン分解能の分析
バイオレメディエーションの実験では R. erythropolis NDKK6 を用いた。この細菌の 長鎖c-アルカン分解能力の評価は、第 1 章第 2 節の 1.2.3 と同様の方法で行った。2.2.4 土壌中の炭化水素分解菌の定量
いくつかの炭化水素分解菌は、炭化水素分解における初発酸化に関わる酵素であるア ルカンヒドロキシラーゼをコードする、alkB 遺伝子を有していることが報告されている(Vomberg and Klinner 2000、Hara et al. 2004)。また、R. erythropolis は、種特異的なアル
カンヒドロキシラーゼ遺伝子である alkB R2 を保持していることが分かっている
(Fukuhara et al. 2013)。そこで、alkB R2 をターゲットとした real-time PCR によって、 NDKK6 株数の定量を行った。
(1) 検量線用サンプルの調製
R. erythropolis NDKK6 株の菌数を定量するために、alkB R2 の real-time PCR における
検量線を作成した。まずR. erythropolis NDKK6 株を培養し、菌数測定を行った。次に、 ガラスピペットを用いて50 mL 容チューブへこれらの菌液 50 mL を加え、高速冷却遠 心機(Supurema 25、トミー精工、東京)で 4,000 rpm、4°C、10 分の条件で遠心分離し た。ガラスピペットを用いて45 mL の上清を除去した後、10 倍濃縮の菌液を作製した。 その後、DNA 抽出し、アガロースゲルを用いた電気泳動を行った。 (2) DNA の精製 DNA の精製では、トランスイルミネーター(MID-170、アズワン、大阪)を用いてア ガロースゲルにUV を照射した。その後、DNA バンドをカッターで切り出し、そのゲ ルを、ガラスウールを詰めた1 mL チップを用いて作製したゲル抽出キットに入れ、1.7 mL マイクロチューブにセットし、5,000 rpm、20°C、10 分の条件で遠心分離した。チュ ーブに溶液の0.1 倍量の 3 M 酢酸ナトリウム溶液及び 2.5 倍量の 100 %エタノールを加 え、遠心(14,000 rpm、20°C、10 分)した。溶液を除去し、70 %エタノール 500 µL を 加え、遠心(14,000 rpm、20°C、5 分)した。溶液を除去し、水滴が完全に無くなるまで 静置した。超純水10 µL をチューブに加え、テンプレート DNA とした。 (3) alkB R2 real-time PCR(qPCR)
alkB R2 real-time PCR(qPCR)では、まずテンプレート DNA の 101 ~ 103倍希釈液を
作製した。Real-time PCR 用の 8 連チューブを使用し、テンプレート DNA の原液及び希
釈液それぞれの反応液(Table2-3)を作製した。リアルタイム PCR(7300 Real-time PCR
38
件(Table2-4)を設定し、alkB R2 real-time PCR を行い、増幅曲線及び解離曲線を確認し
た。alkB R2 real-time PCR に用いた R. erythropolis 検出用プライマーの配列を表 Table2-5
に示す。また、使用したKAPA-SYBR 及び ROX high は KAPA-SYBR qPCR-kit(KAPA
BIOSYSTEMS、MA、アメリカ)のプロトコールに従って用いた。反応後、各 DNA の
増殖曲線の Threshold 値を 0.2 に設定して解析を行い、解析結果から各サンプルの
Threshold 値までのサイクル数(Ct 値)を求めた。
(4) NDKK6 株数の定量
NDKK6 株数の定量では、アガロースゲルの DNA バンドを切り出し、同様の方法で DNA の精製を行った。Template DNA を用いて、alkB R2 real-time PCR を行った。各サン
プルのCt 値を確認し、作成した検量線を用いて混合バイオマス 1 g 中の NDKK6 株数
39
Table2-3 alkB R2 real-time PCR の反応液
試薬 容量 (µL)
KAPA-SYBR 10.0
Forward Primer alkB R2 (10 µM) 0.4
Reverse Primer alkB R2 (10 µM) 0.4
ROX high 0.4
Template DNA 1.0
40
Table2-4 alkB R2 real-time PCR サイクル条件
PCR ステップ 温度 反応時間
Predenature 95°C 10 min
Denature 95°C 15 sec
Annealing/Extension 60°C 30 sec
41
Table2-5 プライマーalkB R2 の塩基配列
プライマー 塩基配列
Forward Primer alkB R2 5’-CGGTTGTGTCGCAGGAATC-3’
42
2.2.5 土壌中の有機物量と総細菌数、窒素循環活性の定量
様々な圃場より採取した 235 の土壌サンプルについて、土壌中の有機物量に関わる TC および TN について調べた。また、窒素循環活性に関わる総細菌数、アンモニア酸 化活性、亜硝酸酸化活性についても分析した(Adhikari et al. 2015)。2.2.6 有機物調整によるバイオレメディエーションの促進実験
野外から有機物量の多い土壌と少ない土壌の2 種類を採取した。バイオレメディエー ション実験で使用した土壌(TC 値は 10,000 mg/kg-土壌、炭化水素なし)は、砂質土(TC 値は200 mg/kg-土壌)とシルト質土壌(TC 値は 39,000 mg/kg-土壌)であった。バイオ レメディエーション実験は、土壌2 kg を使用して、次の条件でおこなった。 炭化水素汚染土壌(5,000 mg/kg)は、自動車用エンジンオイル(ENEOS タイプスー パーオイルT10、新日本石油、東京)を土壌に添加することにより調製した。バイオス ティミュレーションの無機条件は、4 倍濃縮改質 SW(4×MSW)培地改変 SW 培地(1 L あたり:1.21 g NH4NO3、14.3 g Na2HPO4・12H2O、5.44 g KH2PO4、0.5 g NaCl、0.247 gMgSO4、2.78 mg FeSO4・7H2O、14.7 mg CaCl2・2H2O、2.01 mg ZnSO4∙7H2O、0.15 mg
[NH4]6Mo7O24・4H2O、2 mg CuSO4・5H2O、0.4 mg CoCl2・6H2O、1.49 mg MnSO4・5H2O、
0.5 g Polypeptone, 0.25 g Yeast Extract)を添加した。バイオスティミュレーションの有機 条件は、鶏糞(5%w/w、アグリエヌワイ、兵庫)を添加し、土壌の TC 値は、炭化水素 を含まない約20,000 mg/kg 土壌に調整した。肥料中の総細菌数および土着の HDB 数は、 それぞれ4.3×1010 cells/g および 1.4×108 cells/g であった。 バイオオーグメンテーションの無機条件は、4×MSW(1%v/w)および R. erythropolis NDKK6(1×108 cells/g)を添加した。有機条件のバイオオーグメンテーションの条件は、 鶏糞(5%w/w)および R. erythropolis NDKK6(1×108 cells/g)を投与した。 1、3、7、14、 21、および 28 日後に、総細菌数、土着 HDB 数、R. erythropolis NDKK6 菌数および炭化 水素濃度を分析した。
2.2.7 土壌のサンプリングと準備
リン循環の評価用として用いた土壌サンプルは232 の農地から収集した。日本、アフ ガニスタン、フランスの様々な農地からサンプルを収集した。フランスのサンプルは、 果樹園の土壌サンプルであった。日本、フランス、アフガニスタンの一般的な気候は、 それぞれ温帯、温帯、亜熱帯である。サンプルは、表面の塊とリター層を除去した後、 約15 cm の深さから採取した。土壌サンプルは、いずれも乾燥させずにサンプリングし た後、立命館大学(草津、滋賀)の研究室に運び、分析まで4℃で冷蔵保存した。日本 の土壌サンプルは1 週間以内に、フランスとアフガニスタンからのサンプルはサンプリ43 ング後4 週間以内に運搬し、分析に供した。分析前には 2 mm メッシュのステンレス製 スクリーンでふるいにかけた。
2.2.8 土壌の pH および金属濃度(Fe、Al、Ca)の測定
土壌pH(土壌:水=1:2.5、w/v)は、pH メーター(LAQUA F-72、堀場製作所、京 都)で測定した。土壌からFe を抽出するために、ジエチレントリアミン五酢酸(DTPA)メソッドを使用した (Lindsay et al. 1978)。同様に、Ca は酢酸アンモニウム法 (Schollenberger et al. 1945)で抽出され、抽出物中の Fe および Ca 濃度は原子吸光分光 光度計(Z2300、日立ハイテク、東京)を使用して測定した。最後に、Al 濃度は土壌サ
ンプルKCl で抽出した後、滴定法を使用して定量した(Mclean et al. 1965)。 Fe、Ca、
およびAl の形態は、これまでの報告(Schollenberger et al. 1945、de Boer et al. 1973、Lin
et al. 1960)に従って「利用可能な Fe(Available Fe)」、「交換可能なAl(Exchangable Al)」、
および「交換可能なCa(Exchangable Ca)」と命名した。
2.2.9 微生物量とリン循環活性の分析
土壌中の微生物量は、Slow-stirring 法によって分析した(Aoshima et al. 2006)。リン 循環活性は既報に従って評価した(Horii et al. 2013)。リン循環活性は、有機リン基質 (フィチン酸)の添加後の土壌中の可溶性リンの増加率から決定する。リン循環活性は 下記の手順で測定した。 i . 1 g の土壌を 4 本の遠心管に入れた。 ii. 150 µ L のフィチン酸溶液(3.3 mg の有機リンを含む)を 2 本のチューブに追加し (チューブP)、残りの 2 本のチューブに 150 L の蒸留水を追加した(チューブ W)。
iii. フィチン酸添加チューブ(Tube P0)および蒸留水添加チューブ(Tube W0)につい て蒸留水またはフィチン酸溶液の添加直後に水抽出性リンをモリブデンブルー法 で分析した(Holman et al. 1943)。
iv. 残ったフィチン酸と蒸留水を加えたチューブ(それぞれチューブ P3 と W3)を 25℃
で3 日間インキュベートし、水で抽出可能なリンを分析した。
v. リン循環活性は、次の式を使用して計算した。
Phosphorus circulation activity (points ) =
(Soluble P in Tube P3−Soluble P in Tube P0) − (Soluble P in Tube W3−Soluble P in Tube W0) Added P in Tube P × 100
44 リン循環活性を示す概略図をFigure 2-3 に示す。リン循環活性は、鉱化作用および可 溶化作用により増加し、吸着により減少する。この方法では、フィチン酸塩添加サンプ ルと水添加サンプルの両方の可溶化係数を評価する。リン循環活性は、鉱化作用なし、 または完全な吸着の場合は0 点を、完全な鉱化作用ありの場合は 100 点に割り当てて、 吸着なしで表した。高、中、低レベルの微生物量のカテゴリを定義するリン循環活性は、 従前の研究を参照した(Araki et al. 2016)。 この研究では、高レベル(66.6〜100.0 ポイ ント)または低レベル(<33.3 ポイント)のリン循環活性を示す土壌サンプルの 75%以 上が、より高い微生物量(≥6.0×108cells/g)、またはより低い微生物量(<4.3×108 cells/g)
を保持していた(data not shown)。これらの結果をもとに、微生物量のレベルを、それ ぞれ高レベル(≥6.0×108 cells/g)、中レベル(4.3×108~5.9×108 cells/g)、低レベル(<4.3×108
45
46
2.2.9 総炭素(TC)、総窒素(TN)、および総リン(TP)の測定
土壌中の総炭素(TC)は、全有機炭素分析装置(TOC-VCPH、島津製作所、京都)お
よび固体試料燃焼装置(SSM-5000A、島津製作所、京都)を用いて定量した。土壌サン プル中の総窒素(TN)と総リン(TP)は、ケルダール法によって抽出した(Kjeldahl et al. 1883)。抽出物中の TN はインドフェノールブルー法(Scheiner et al. 1976)で、TP はモリブデンブルー法(Holman et al. 1943)でそれぞれ測定した。
3節 結果
2.3.1 長鎖 c-アルカン分解細菌の同定と特徴解析
Rhodococcus 属および Gordonia 属による長鎖 c-アルカン分解能を特徴づけるために、
アルカンヒドロキシラーゼ遺伝子(alkB)配列と長鎖 c-アルカン分解の関係を分析した
(Table2-6)。Rhodococcus 属と Gordonia 属の分離株の系統樹を Figure 2-4 に示す。
R. erythropolis、R. rhodochorus、および R. baikonurensis には、すべて alkB R2 遺伝子
のalkB [alkB R2 type] 遺伝子を保持しており、TDC 分解率は 38.8~68.2 %であった。ま
た、 Rhodococcus 属の他の種も alkB 遺伝子を保持しており、TDC 分解率は 6.0~34.0 %
であった。alkB [alkB R2 type] 遺伝子を保持する Rhodococcus 属は、高い長鎖 c-アルカ
ン分解能を示した。
Gordonia 属のうち、G. terrae には alkB GT タイプが含まれており、TDC 分解率は 76.5 ~97.8 %と高い分解率を示した。他のすべての種には他のタイプの alkB 遺伝子を保持 していたが、TDC 分解率は 0.0~84.9 %とばらつきが大きかった。また、以前の研究で は、Rhodococcus 属と Rhodococcus 属が多環芳香族炭化水素化合物などの微生物が分解 しにくい炭化水素を分解する可能性があることが示されている(Bourguignon et al. 2014)。 さらに、これらの属はフェナントレン、ピレン、ベンゾピレンなどのより難分 解性の炭化水素にも対応できる可能性があることが知られている(Pizzul et al. 2006)。



![Table 1-2 alkB 遺伝子の存在と alkB [alkB R2 type] 遺伝子との相同性と alkB 遺伝子の種類](https://thumb-ap.123doks.com/thumbv2/123deta/6579338.1133848/23.1262.201.1052.173.725/Table12alkB遺伝子の存在とalkBalkBR2type遺伝子との相同性と遺伝子種類.webp)
![Figure 1-7 R. erythropolis NDKK6 による UDC 分解のガスクロマトグラフ 矢印は UDC のピークを示す。[A] 未植菌 [B]R](https://thumb-ap.123doks.com/thumbv2/123deta/6579338.1133848/27.892.94.739.161.1031/Figure1Rによる分解ガスクロマトグラフ矢印ピーク示すA未植菌BR.webp)
![Table 1-4 alkB genes [non-alkB R2 type] 遺伝子 を持つ Rhodococcus 属細菌による長鎖 c-アルカンの分解](https://thumb-ap.123doks.com/thumbv2/123deta/6579338.1133848/29.1262.150.1106.189.540/Table14alkBgenesnonalkBR2type遺伝子を持つRhodococcus属細菌による長鎖アルカン分解.webp)