モノクローナル抗体(AF.2)結合イムノアフィニティーカラム-HPLC法による
トウモロコシおよびピーナッツ中のアフラトキシン類の測定
宮本邦裕,濱田あゆみ,川村 理
DETERMINATION OF AFLATOZINS IN CORN AND PEANUT BY AN IMMUNOAFFINITY
COLUMN BOUND AF.2 MONOCLONAL ANTIBODY-HPLC METHOD
Kunihiro MIYAMOTO, Ayumi HAMADA, and Osamu KAWAMURA
Abstract
In order to establish an immunoaffinity column-HPLC method for aflatoxins (AFs) in corn and peanut, anti-AFB1 monoclonal antibody (AF.2) was bound to Affi-Gel 10 gel (4 and 16 mg/ml), and the antibody-binding gel was packed into a mini column. Corn spiked AFs (10 g) were added 2 g NaCl and extracted with methanol : water (70+ 30) The extact were 3-fold diluted with water and cleaned-up by the IAC (4 mg antibody / ml gel). These recover-ies of AFs were 72∼88% and RSD were 0.5∼3.5%. The IAC could be re-used 8 times for clean-up. Peanut spiked AFs (10 g) and extracted with acetonitrile : water (60+40) The extact were 10-fold diluted with PBS and cleaned-up by the IAC (16 mg antibody / ml gel). These recoveries of AFs were 87∼104% and RSD were 2.7∼7.4%. The IAC could be re-used 5 times. Naturally contaminated samples were analyzed our IAC-HPLC method and multi-functional column method. The both data were highly correlated.
Key words: Aflatoxins, Monoclonal antibody, Immunoaffinity column, Corn, Peanut
緒 言 マイコトキシン(aflatoxin,AF)は,Aspergillus flavus などのカビによって生産されるマイコトキシンで,動 物や人に対して強い毒性を有し,特に発がん性は天然 物質中で最強である(1).AF類は,ピーナッツをはじめ とするナッツ類,トウモロコシ及び香辛料などの汚染 が知られており(2),食品衛生上で最も重要なマイコト キシンである.AF類は,70カ国以上で食品及び飼料に 対して規制値が設定されている.日本では,AFB1にの み全食品と乳牛用飼料と哺乳期子牛・豚用飼料に対して 10 ppb,その他の配合飼料に対して20 ppbの規制値を設 けている.一方,EU,米国やコーデックス委員会では トウモロコシなどの穀物やピーナッツなどのナッツ類 での規制値をAFB1,B2,G1とG2の合計量の4∼20 ppb で設定している(3).それゆえ,AFの分析では,AFB 1, B2,G1とG2の4つを分析するのが一般的である.ま た,近年,クロロホルムなど毒性の強い有機溶媒を使用 せず,簡便かつ高感度で,コーヒーなど物理化学的ク リーンナップ法では十分に夾雑物の除去ができない加工 食品にも適用できる方法としてイムノアフィニティーカ ラム(IAC)をクリーンナップに用いる方法が汎用され るようになってきた(4).そこで,当研究室で既に作製 済みの抗AFB1モノクローナル抗体AF.2 (5)結合IACを作 製し,トウモロコシおよびピーナッツ中のAFB1,B2, G1とG2の4つの同時検出法について検討した. 材料および方法 材料 AFB1,B2,G1とG2は, 和 光 純 薬 社 製 を, ア フ ィ ゲル10はBio-Rad社製を,hybridoma-SFMはインビトロ ジェン社製をそれぞれ用いた.HPLCの移動相は和光純 薬社製のHPLC用試薬を,その他の試薬は特級又は同等 品を用いた.ピーナッツは市販の生豆を,トウモロコシ は市販のコーングリッツをそれぞれ粉砕し,実験に用 いた.AF類自然汚染検体は,ブラジルLondrina州立大学 Elisa Youko Hirooka博士より入手した.
また,AFB1,B2,G1とG2の標準溶液は,約10μg/ml
になるようにアセトニトリルに溶解し,極大吸収の値か らモル吸光係数を用いて濃度を算出し,希釈し,調整し た(6).
AF.2抗体の大量生産と精製 抗AFB1モノクローナル 抗体産生ハイブリドーマ (AF.2)(5)を, 無 血 清 培 地 で あ るhybridoma-SFM培 地 (ベンジルペニシリン100 unit/ml, ストレプトマイシン 100μg/mlを含む)に数日間かけて馴化した後,大量培 養(10L)を行った.培養上清を回収した後,硫安を 40%飽和になるように加え,4℃で16時間ゆっくりと撹 拌し硫安分画を行った.8,000×g で30分間遠心し,抗 体画分を得た.抗体は少量のダルベッコのリン酸緩衝生 理食塩水(PBS)に溶解後,1LのPBSに対して,4回 透析した.透析後,280 nmの吸光度から抗体濃度を算出 し,SDS-PAGEを行い,純度を確認した. AF.2抗体とイムノアフィニティー担体との結合 精製した抗体とイムノアフィニティー担体(アフィ ゲル10)を添付されたプロトコールに従って結合させ た.すなわち,アフィゲル10(10 ml)をG3ガラスフィ ルター上に移し,保存液を吸引ろ過後,純水(10 ml) で3回洗浄した.洗浄したアフィゲル10 (10 ml)の精製 抗AFB1抗体AF.2(40,80及び160 mg)を加え,室温で 2時間ゆっくり撹拌しながら反応させ,抗体結合量の異 なるゲルを作製した.反応後,G3ガラスフィルター上 に移し,吸引ろ過を行った.アフィゲル10の未反応部位 のブロッキングを行うために,1Mエタノールアミン-塩酸緩衝液(pH 8.0)10 mlを加え,室温で1時間ゆっく り撹拌しながら反応させた.反応後,G3ガラスフィル ター上に移し,吸引ろ過を行った後,10 mlのPBSで10 回洗浄した.抗体を結合させたゲルは0.1% NaN3を含む PBSに懸濁し,4℃で保存した, 抽出 抽出は,AOAC法(7)に準拠して行った.すなわち, 粉砕したトウモロコシ10gに2gのNaClと50 mlのメタ ノール:水(70+30 v/v)を加え,30分間振とう抽出した. 抽出液はAdvantec 5Cのろ紙でろ過後,ろ液を蒸留水 で3倍希釈し,ガラス繊維ろ紙(Advantec GA-55)で濾 過した.このろ液10 mlをIACに負荷し,クリーンナップ を行った. ピーナッツの場合は,粉砕したピーナッツ10gに30 mlのアセトニトリル:水(60+40 v/v)を加え,30分間 振とう抽出した.抽出液はろ過し,抽出ろ液をPBSで10 倍希釈し,ガラス繊維ろ紙(Advantec GA-55)で濾過し た.このろ液10 mlをIACに負荷し,クリーンナップを 行った. IACによるクリーンナップ 抗体を結合させたゲル0.3 mlをプラスチック製のミニ カラム(ムロマックカラムS,室町化学工業)に詰め, 10 mlのPBSを流し平衡化させたIACに10 mlの抽出希釈 液を負荷した.5 mlのPBSと5 mlの蒸留水で洗浄後, 3 mlのメタノールで溶出した.溶出液は,減圧乾固後, 100μlのトリフルオロ酢酸に再溶解し,室温暗所で15分 間反応させ,誘導体化を行い,900μlのアセトニトリ ル:水(10+90 v/v)を加え希釈後,20μlを蛍光HPLC で分析した.ピーナッツの場合は,8と16 mg/ml割合 で抗体を結合させたゲルを用いたIACについても検討し た.また,使用後のIACは,さらに5 mlのメタノールで IACを洗浄した後. 10 mlのPBSで平衡化させた後, 0.1% NaN3を含むPBSに置換して4℃で保存した. HPLC いずれも島津製作所製で, LC-10ADvpポンプ,SIL-10ADvpオ ー ト イ ン ジ ェ ク タ ー,CTO-10ADvpカ ラ ム オーブン,RF-10ADXL蛍光検出器を使用した.Capcell Pak C18AQ(粒子経5μm,内径4.6mm,長さ250 mm) 資生堂(株)製を用いた.カラム温度は40℃,移動相は アセトニトリル:水(25+75 v/v),蛍光波長は,励起波 長365 nm,蛍光波長450 nmで行った.なお,ガードカ ラムは使用しなかった.この条件で,AF標準品0.03∼4 ng/mlの範囲で良好な直線の検量線を得た. 添加回収実験 各粉砕した試料10 gを110 mL容のガラス製スクリュー 管瓶に秤取り,これにAFB1,B2,G1とG2の濃度がそ れぞれ1,3および10 ng/gになるように調整したアセト ニトリル溶液を各100 μlを添加した.添加後,口をキ ムワイプで覆い,遮光してドラフト内で一晩(12∼16時 間)静置し,アセトニトリルを蒸発させた後,抽出,ク リーンナップを行った後,蛍光HPLCで定量した. 再使用回数の検討 IACの再使用回数を検討するために,3 mlのメタノー ルで溶出した後,さらに5 mlのメタノールでIACを洗浄 し, 10 mlのPBSを流し平衡化させた後,10 mlの3 ng/g 汚染相当の抽出希釈液を負荷し, PBSで洗浄後,3 mlの メタノールで溶出を10回繰り返し,溶出液中のAFB1, B2,G1とG2の濃度を測定した. 公定法との測定値の比較 自然汚染検体は,本法と公定法である多機能カラム (Multi-Sep #228, Romer Lab)を用いる方法(8)の両者で
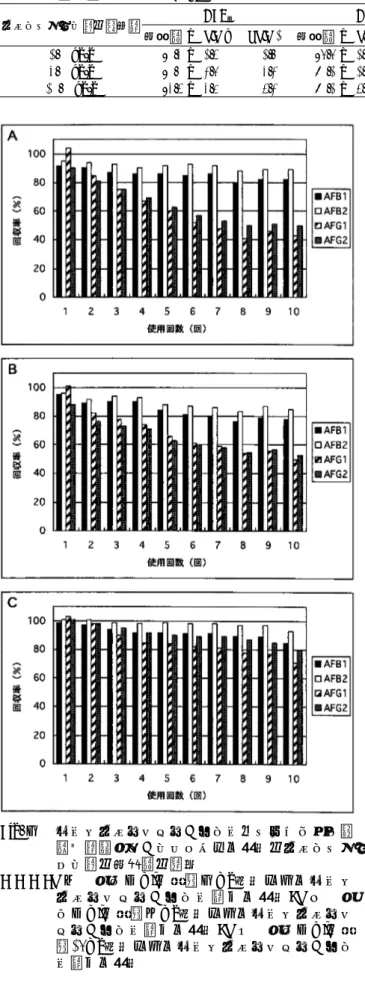
測定し,測定値の比較を行った. 結 果 及 び 考 察 AF.2モノクローナル抗体結合IAC-HPLC法によるのトウ モロコシ中のAF類の分析 競合的間接ELISAでの抗AFB1モノクローナル抗体 AF.2の各AF類との反応性は, AFB1に対する反応性を 100%とした場合,AFB2とは135%,AFG1とは14%,及 びAFG2とは15%であり,AF.2抗体は,AFB1とB2をほ ぼ同程度に認識する抗体だが,AFG1とG2と反応性はや や劣る(5).しかし,AF.2抗体をゲル1 ml当たり4 mg結 合させた抗体結合ゲルを0.3 ml詰めたIACを用いて,諸 条件を検討した結果,材料および方法に記載した方法 で, こ のIACは,PBS中 のAFB1,B2,G1とG2を ほ ぼ 100%結合させることができたので,トウモロコシ中の AF類への適用性について検討した. AF類未添加を本IACでクリーンナップを行った結 果,AFB1,B2,G1とG2のピークの位置と重なる夾雑 物ピークは認められなかった(Fig.1).そこで,AFB 1,B2,G1とG2をそれぞれ,1,3と10 ng/g添加し,回 収実験をおこなった.その結果,AFG1の回収率が70% 台でやや低い傾向が認められたが,平均回収率は,72∼ 88%で,RSDはいずれも4%以下であり,ほぼ満足でき る値であった(Table 1).また,同一検体の抽出ろ液希 釈液を連続してIACでクリーンナップを行った結果,1 ∼8回目まで,AF類の回収率にほぼ変化はなかったが, 9回目と10回目では,特に,G1とG2の回収率が低下し ていた.すなわち,本IACは,8回目までの連続使用が 可能であり,AF類分析のコスト低減への可能性が示唆 された. AF.2モノクローナル抗体結合IAC-HPLC法によるのピー ナッツ中のAF類の分析 次に,本法をピーナッツ中のAF類の分析への適応性 について検討した.トウモロコシと同様の抽出溶媒を 用いた場合AF類の回収率は,60∼76%と低かった.ま た, NaClを添加すると相分離を起こしたので,いくつか の抽出溶媒を検討した結果,粉砕したピーナッツ10 g Fig. 1 トウモロコシ試料のクロマトグラム. (A)アフラトキシン類スタンダード(1 ng/ ml),(B)AF類 無添加 トウモロコシ,(C) AF類をそれぞれ3ng/g相当添加したトウモロ コシ Table 1 トウモロコシへのアフラトキシン類の添加回収実験 ( n=3)
アフラトキシン類の添加量 AFB1 AFB2 AFG1 AFG2
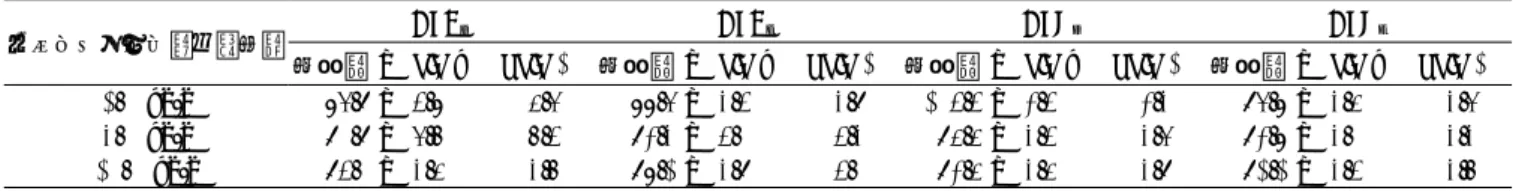
回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%) 1.0 ng/g 85.0 ± 2.7 3.1 87.0 ± 2.9 3.3 87.0 ± 2.6 3.3 88.0 ± 3.1 3.6 3.0 ng/g 81.7 ± 0.4 0.5 84.3 ± 0.5 0.6 76.7 ± 0.9 1.2 83.3 ± 1.7 2.0 10.0 ng/g 85.0 ± 2.2 2.6 80.8 ± 2.5 3.0 72.1 ± 2.2 3.0 76.8 ± 2.7 3.5
に30 mlのアセトニトリル:水(60+40v/v)を加え,30 分間振とう抽出する方法で行った.また,抽出ろ液は, 蛋白質変性作用の強いアセトニトリルの影響を低減さ せるためにPBSで10倍希釈し,ゲル1 mlに抗体4 mg結 合させたIACでクリーンナップを行った.AF類未添加 ピーナッツのクロマトグラムでは, AFB1,B2,G1とG2 のピークの位置と重なる夾雑物ピークは認められなかっ た(Fig.2).そこで,AFB1,B2,G1とG2をそれぞれ, 1,3と10 ng/g添加し,回収実験をおこなった.その結 果,平均回収率は,75∼90%で,RSDはいずれも5%以 下であり,ほぼ満足できる値であった(Table 2). そこで,3 ng/g汚染相当のAF類を添加したピーナッ ツ抽出希釈液を,ゲル1 mlに抗体4 mg結合させたIAC で10回まで連続してクリーンナップを行った.その結 果,トウモロコシの場合と異なり,AFB1とB2の回収率 は10回目までほぼ変化しなかったが,AFG1とG2の回収 率は2回目以降低下していた(Fig 4A).ゲルに結合 させたAF.2抗体は,AFB1とB2をほぼ同程認識する抗体 であるが,AFG1とG2の反応性はやや弱いために,ピー ナッツ抽出成分中に抗原抗体反応を阻害又は弱めるマト リックスが含まれたためと考えられた.そこで,ゲル への抗体結合量を増やすことで,連続使用でAF類の回 収率の低下が改善するか否かについて検討した.ゲル 1 mlに抗体8 mg結合させたIACで10回まで連続してク リーンナップを行ったが,ゲル1 mlに抗体4 mg結合さ せた場合,回収率は改善する傾向は認められたが,顕 著な差はなかった(Fig 4B).ゲル1 mlに抗体16 mg結 合させたIACでは,1回目から全てのAF類の回収率は 100%に近く,連続使用での回収率に改善が認められた (Fig 4C).AFG1の回収率が80%を下回るのが8回目で あったことから,6∼7回までの連続使用が可能である と考えられた.また,ゲル1 mlに抗体16 mg結合させた IACを用いて添加回収実験を行った結果,AF類の回収率 Fig. 2 イムノアフィニティーカラムでトウモロコシ試 料を連続クリーンナップした場合のアフラトキ シン類の回数率 Fig. 3 ピーナッツへ試料のクロマトグラム (A)アフラトキシン類スタンダード(1.5 ng/ ml),(B)AF類 無添加ピーナッツ,(C)AF 類をそれぞれ 3 ng/g相当添加したピーナッツ
Fig. 4 イムノアフィニティーカラムでトウモロコシ試 料を連続クリーンナップした場合のアフラトキ シン類の回数率の比較 (A)ゲル1mlに抗体4mg結合させたイムノ アフィニティーカラム用いた場合,(B)ゲ ル1mlに抗体8mg結合させたイムノアフィニ ティーカラム用いた場合,(C)ゲル1mlに抗 体16mg結合させたイムノアフィニティーカラ ム用いた場合 Table 2 ゲル1mlに抗体4mg結合させたイムノアフィニティーカラム用いた場合のトウモロコシへのアフラトキシン 類の添加回収実験 ( n=3)
アフラトキシン類の添加量 AFB1 AFB2 AFG1 AFG2
回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%) 1.0 ng/g 80.3 ± 1.4 1.7 86.6 ± 1.3 1.5 80.1 ± 1.6 2.0 86.6 ± 0.6 0.3 3.0 ng/g 80.0 ± 2.6 3.2 90.1 ± 1.2 1.3 75.1 ± 3.1 4.1 86.2 ± 1.3 1.5 10.0 ng/g 83.4 ± 3.5 4.2 90.1 ± 4.3 4.8 81.7 ± 2.7 3.2 90.3 ± 3.6 3.9 は,86.9∼104%であり,ゲル1 mlに抗体4 mg結合さ せたIACを用いるより,高い回収率であった(Table 3). 本IACを用いる方法と公定法である多機能カラムを用 いる方法で,自然汚染トウモロコシ8検体とピーナッ ツ3検体を分析し,測定値の比較を行った(Table 4). その結果,両者の測定値はほぼ近い値であり,AFの合 計量での相関性はr2=0.9953であった.また,トウモ ロコシ#2102での両者のクロマトグラムを比較すると, IACでは,夾雑物ピークがほとんど認められないのに対 して,多機能カラムでは,14.5分付近と17∼19分付近の ブロードな夾雑物ピークが認められ,本IACの方が夾雑 物除去能の点で優れている可能性が示唆された. 本IACを用いたトウモロコシ及びピーナッツ中のAF類 の測定法は,夾雑物除去能の点で多機能カラムより優れ ており,また,5∼7回程度までの再使用可能であり, コスト面でも多機能カラムより優れている.本法が, AF類の汚染検査に幅広く使用されると期待される. 要 約 抗アフラトキシンB1(AFB1)モノクローナル抗体 (AF.2)を結合したイムノアフィニティーカラム(IAC) を作製し,トウモロコシおよびピーナッツ中のAF類の 測定法を検討した.諸条件を検討した結果,トウモロコ シでは,試料10gに2 gのNaClと50 mlのメタノール: 水(70+30 v/v)を加え,抽出し,ろ液を蒸留水で3倍 希釈しゲル1 mlに4 mgの抗体を結合させたIACでク リーンナップを行い,蛍光HPLCで定量した.添加回収 実験の結果,1,3と10 ng/gのAF類添加での回収率は, 72∼88%で,RSDは4%以下でほぼ満足のいくもので あった.また,このIACでは,トウモロコシ抽出ろ液希 釈液を連続7回までのクリーンナップが可能であった. ピーナッツでは,試料10gに30 mlのアセトニトリル: 水(60+40 v/v)を加え抽出し,ろ液をPBSで10倍希釈 しゲル1 mlに16 mgの抗体を結合させたIACでクリーン ナップを行い,蛍光HPLCで定量した.添加回収実験の 結果,1,3と10 ng/gのAF類添加での回収率は,87∼ 104%で,RSDは8%以下でほぼ良好であった.また, このIACでは,ピーナッツ抽出ろ液希釈液を連続5回ま
Table 3 ゲル1mlに抗体16mg結合させたイムノアフィニティーカラム用いた場合のピーナッツへのアフラトキシン類 の添加回収実験 ( n=3)
アフラトキシン類の添加量 AFB1 AFB2 AFG1 AFG2
回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%)回収率 ± SD(%)RSD(%) 1.0 ng/g 86.9 ± 4.8 5.6 88.6 ± 3.4 3.9 104.4 ± 2.4 2.3 96.8 ± 3.5 3.6 3.0 ng/g 90.9 ± 6.7 7.4 92.3 ± 4.0 4.3 95.5 ± 3.4 3.6 92.8 ± 3.0 3.3 10.0 ng/g 94.0 ± 3.5 3.7 98.1 ± 3.9 4.0 92.5 ± 3.5 3.9 91.1 ± 3.4 3.7 Table 4 自然汚染トウモロコシ及びピーナツをイムノアフィニティーカラムと多機能カラムでクリーン ナップを行った場合の測定値の比較 検体 番号 イムノアフィニティーカラム(ng/g) 多機能カラム(ng/g) AFB1 AFB2 AFG1 AFG2 合計 AFB1 AFB2 AFG1 AFG2 合計
トウモロコシ 1373 0.55 0.05 0.59 0.65 0.06 0.71 2260 0.02 0.02 0.01 0.01 2079 0.02 0.02 0.05 0.05 3227 0.02 0.02 0.02 0.02 2102 0.25 0.02 0.27 0.03 0.02 0.05 A-5 5.46 0.46 0.97 6.89 6.51 0.58 2.56 9.65 2257 0.02 0.02 0.02 0.02 COR 333.04 333.04 296.4 296.45 ピーナッツ A-1 20.64 4.07 5.09 1.22 31.02 5.17 1.00 1.69 0.37 8.22 A-2 1.73 0.35 0.34 0.02 2.44 0.43 0.10 0.04 0.01 0.57 A-4 0.18 0.02 0.43 0.05 0.68 0.32 0.23 0.85 0.14 1.54 Fig. 5 自然汚染トウモロコシ(#2012)のイムノアフィニティーカラムと多 機能カラムでクリーンナップを行った場合のクロマトグラムの比較 (A)イムノアフィニティーカラムでクリーンナップを行った場合, (B)多機能カラムでクリーンナップを行った場合,
引 用 文 献
でのクリーンナップが可能であった.本IAC-HPLC法と 多機能カラム法で自然汚染検体を分析した結果,両者の
⑴ MISHRA, H. N. and DAS, C : A Review on Biological
Control and Metabolism of Aflatoxin. Critical Reviews in
Food Science and Nutrition., 43, 245-264 (2003).
⑵ RUSTOM, I. Y. S. : Aflatoxin in food and feed: occurrence,
legislation and inactivation by physical methods. Food
Chemistry, 59, 57-67 (1977).
⑶ Van EGMOND, H. P. and JONKER, M. A.:Worldwide
regu-lations on aflatoxins. IN Abbas, H. K. (ed.), Aflatoxin
and food safety. Pp77-93, CRC Press, Boca Raton. ⑷ HAGE, D. S. : Survey of recent advances in analytical
ap-plications of immunoaffinity chromatography. Journal of
Chromatography B, 715, 3-28 (1988).
⑸ KAWAMURA, O., NAGAYAMA, S., SATO, S., OHTANI, K.,
UENO, I. and UENO, Y.: A monoclonal antibody-based
測定値に高い相関性が認められた.
enzyme-linked immunosorbent assay of aflatoxin B1 in peanut products, Mycotoxin Research, 4, 75-88 (1988). ⑹ AOAC Official Method 971.22, Standards for
aflatox-ins., IN AOAC official methods of analysis, Chapter 49,
pp4-5, (2000).
⑺ AOAC Official Method 991.31, Aflatoxin in corn, raw peanuts, and peanut butter. immunoaffinity colimn (Af-latest) method., IN AOAC official methods of analysis,
Chapter 49, pp22-24, (2000).
⑻ ア フ ラ ト キ シ ンAFB1,B2,G1,G2, 厚 生 労
働 省 監 修, 食 品 衛 生 学 指 針 理 化 学 編 2005, pp550-564,財団法人食品衛生協会(2005).