13
厚生労働科学研究費補助金(創薬基盤推進研究事業)
分担研究報告書
がんに対する標的ベクターの網羅的探索
研究分担者 青木 一教 国立がん研究センター研究所遺伝子免疫細胞医学研究分野・分野長
研究要旨
腫瘍溶解アデノウイルスの効果と安全性を強化するためには、腫瘍標的化能を強化する必要があ る。我々は、多種多様なペプチドをファイバー上に提示するアデノウイルス・ライブラリーを用いて 同定した膵がん標的リガンド(SYENFSA)を、サバイビンプロモーターにより増殖を制御する腫瘍 溶解アデノウイルス(AdSur)に組み合わせた、膵がん標的腫瘍溶解ウイルス(AdSur-SYE)を構築した。
このAdSur-SYEは、ヒト膵がん皮下腫瘍モデルにおいて、腫瘍内に注入すると非標的型腫瘍溶解ウ
イルスAdSurに比べて、腫瘍内で効率良く増殖・拡散するために腫瘍溶解効果が明らかに増強した。
肝などの臓器へのウイルスの拡散は有意に減少しており、異所性感染を抑制して安全性を向上できる ことが分かった。また、実際、ヒト外科切除標本を用いた検討で、AdSur-SYE の膵がんへの感染効
率は、AdSurと比べて6倍以上上昇することも確認し、腫瘍溶解ウイルスへ標的性を付加することの
有用性を明らかにした。
A.研究目的
革新的がん治療薬として大きな期待が寄せら れている腫瘍溶解ウイルス療法には、臨床的に 2つの課題が存在する。1 つ目は、腫瘍溶解効 果を一層増強する必要があることである。これ は、腫瘍細胞への感染効率の低さや、ベクター の腫瘍組織内での拡散が不十分であることによ る。2 つ目は、腫瘍内で増殖したウイルスが血 中に漏れて臓器への異所性感染をおこすことで ある。ウイルスによる予期しない副作用を防ぐ ためには、がん細胞以外の正常細胞・組織への 感染を抑制する必要がある。そして、これらの 課題を解決するためには、ウイルスの自然の感 染域を抑制し、一方で、溶解効果は腫瘍への感 染力に依存するので、腫瘍に対する標的特異性 を高める技術の開発が必要である。
そこで、我々は、特異的に感染する腫瘍標的 化リガンドの探索を目指し、多種多様なペプチ ドをキャプシド蛋白質上に提示するアデノウイ ルス(Ad)ライブラリーを用いて、膵がん細胞を ス ク リ ー ニ ン グ し 、 膵 が ん 標 的 リ ガ ン ド
(SYENFSA)を同定することに成功した。ついで、
サバイビンプロモーターにより増殖を制御する 腫瘍溶解アデノウイルス(AdSur)に、この膵がん 標的配列を組み合わせた膵がん標的腫瘍溶解ウ イルス(AdSur‑SYE)を構築した。本年度は、前臨 床研究として、まず、動物モデルにおいて、こ の AdSur‑SYE を腫瘍内に注入した場合の腫瘍溶 解効果と、各種臓器へのウイルスの分布につい
て検討した。さらに、ヒト膵がん外科切除標本 を用いて、実際に、AdSur‑SYE がヒト膵がん組 織においても感染効率を向上させ、腫瘍溶解効 果を増強できるかどうか検討した。
B. 研究方法
B‑1. 標的リガンドを提示する腫瘍溶解アデノ ウイルスベクターの構築
まず、AsPC‑1、BxPC‑3、Panc‑1、MIAPaCa‑2 などのヒト膵がん細胞株において、survivin、
cox‑2、midkine promoter によりルシフェラー ゼ遺伝子を発現するプラスミドを導入し、遺伝 子 発 現 効 率 を 検 討 し た と こ ろ 、 survivin promoter の発現効率が全体的に高いことを確認 した。ついで、千葉県がんセンター田川雅敏博 士との連携のもと、survivin の転写調節領域に よりウイルスの増殖を制御する腫瘍溶解ウイル ス(AdSur)のファイバーノブに、膵がん標的化リ ガンド(SYENFSA)を提示する標的化腫瘍溶解ウ イルス(AdSur‑SYE)を構築した。この標的化リガ ン ドは、 AsPC‑1, BxPC‑3, Panc‑1, MIAPaCa‑2 細胞など 5 種類のヒト膵がん細胞のうち 4 種類 において感染効率を上昇させることが明らかと なっている。これらのウイルスは、欠失した E3 領域に EGFP 発現カセットが挿入されており、感 染した細胞は EGFP 陽性となる。また、AdSur と AdSur‑SYE では、ファイバーノブにおいて、自 然の感染受容体であるコクサッキーウイルス・
アデノウイルス受容体(CAR)との結合部に 4 か
14 所の点突然変異が挿入され、CAR との結合は野 生型と比べて 100 分の 1 以下に抑制されている。
B‑2. 標的化腫瘍溶解アデノウイルスの抗腫瘍 効果の検討
5 x 106個の BxPC‑3 ヒト膵がん細胞および PC3 ヒト前立腺がん細胞を BALB/c ヌードマウスの 皮下に移植して腫瘍モデルを作成し、腫瘍径が 直径 7mm 大となった時に、5 x109 ‑ 2 x1010 viral particle(vp)の AdSur や AdSur‑SYE 等を直接腫 瘍内に注入して、腫瘍径を経時的に計測した。
B‑3. 標的化腫瘍溶解アデノウイルスの生体内 分布の検討
BxPC‑3 皮下腫瘍内に、2 x 1010 vp のウイルス
(AdE1‑AP, AdSur, AdSur‑SYE, Ad‑EGFP)を注 入した。2 日後に腫瘍と臓器(肝、脾、膵、肺)
を摘出し DNA を抽出、Ad ベクターの E4 遺伝子 を認識するプライマーを用いて PCR を行い、DNA の各種臓器への分布の程度を解析した。
B‑4. 標的化腫瘍溶解アデノウイルスのヒト膵 がん外科切除標本での検討
ヒト膵がん(6 例)、十二指腸がん(1例)、胆 嚢がん(1 例)、正常膵(1 例)、正常肝(1 例)の外 科切除標本を細切してシングルセル化した後、
AdSur と AdSur‑SYE を 103および 104 vp/cell で 感染させた。24 時間後に、細胞を回収し、
Live/Dead で染色して、フローサイトメーター により、生細胞集団における EGFP 陽性細胞の割 合を解析した。また、4mm 大の組織片にスライ スして、1 x 1010 vp のウイルスを感染させ、24 時間後に膵がん組織中での EGFP 陽性の感染細 胞と蛍光顕微鏡で確認し、MUC‑1 抗体を用いて 免疫組織学的に検討した。
(倫理面への配慮)
本研究は、所属する研究施設の遺伝子組み換 え実験や動物実験に関わる各種委員会の審査を 受け理事長の承認を得た上で実施した。ヒト外 科切除標本の利用にあたっては、「疫学研究に 関する倫理指針」を遵守し試料等提供者の人権 とプライバシーを保障しつつ研究を進めた。自 己増殖型 Ad ライブラリーを用いた実験は、拡散 防止措置に関して大臣確認を得た上で実施した。
C. 研究結果
C‑1. 標的化腫瘍溶解ウイルスの抗腫瘍効果の 増強
BxPC‑3 皮下腫瘍モデルにおいて、5 x 109 vp のウイルスを腫瘍内投与した場合、AdSur 群で は、コントロールの非増殖型ベクターである
AdE1‑AP と 腫 瘍 増 殖 は ほ ぼ 同 じ で あ っ た 。 AdSur‑SYE 群では腫瘍の増殖は抑制されたもの の有意差は認められなかった。野生型ファイバ ーを有する Ad‑EGFP が最も腫瘍抑制効果は強か った。一方、2 x 1010 vp のウイルスを投与した 場合は、AdSur‑SYE 群では有意に腫瘍の増殖は 抑制され、その効果は Ad‑EGFP 群よりも強かっ た(図1)。AdSur‑SYE 群の腫瘍では、ウイルス 注入 21 日後に、EGFP 陽性細胞が多数認められ、
AdSur‑SYE が腫瘍内で効率よく増殖しているこ とがわかった。一方、SYE 配列による腫瘍標的 効果のない PC3 皮下腫瘍にウイルスを注入した 場合、AdSur‑SYE による腫瘍の増殖抑制効果は 認められなかった。このように、腫瘍溶解ウイ ルスに、標的リガンドを組み合わせることによ り、腫瘍溶解 Ad ベクターの抗腫瘍効果を増強で きることを明らかとした。
C‑2. 標的化腫瘍溶解アデノウイルスの異所性 感染の減少
ウイルス腫瘍内投与 2 日後の腫瘍及び各種臓 器を摘出、Ad の DNA を PCR 法により解析すると、
腫瘍における PCR バンドの濃さは、各種ウイル スで変わらないものの、AdSur‑SYE 群は肝臓に おいては最もバンドが薄く、Ad が生体内で臓器 にはあまり拡散しないことが分かった(図2)。
このことは、Taqman 定量的 PCR 法によっても確 認でき、AdSur‑SYE は腫瘍への感染性が高いた めに、血中には漏出しにくいものと考えられた。
C‑3. 標的化腫瘍溶解ウイルスの膵がん外科切 除標本における感染効率の上昇
ヒト膵がん外科切除標本をシングルセル化し、
AdSur‑SYE と AdSur を感染させて 24 時間後に、
EGFP 陽性細胞割合を検討した。すると、正常膵、
正 常 肝 や 膵 が ん 以 外 の が ん で は 、 AdSur と AdSur‑SYE の感染効率は同程度であったが、膵 がんでは、6 例中 5 例で感染効率が上昇してい た。103 vp/cell では平均 6.4 倍、104 vp/cell では平均 6.3 倍、AdSur‑SYE の感染効率は AdSur と比較して上昇していた(図3)。
また、組織片を用いてウイルスを感染させる と、AdSur ではほとんど感染が認められないの に対して、AdSur‑SYE では EGFP 陽性の細胞が組 織中の表面に散在して認められ、その EGFP 陽性 細胞は免疫組織学的に MUC‑1 陽性であることが 確かめられた。このことは、AdSur‑SYE が繊維 芽細胞や炎症細胞などの間質細胞ではなく、膵 がん細胞に感染することを示していると考えら れた。
15 D. 考察
本研究により、動物モデルやヒト膵がんサン プルを用いて、膵がん標的化腫瘍溶解ウイルス AdSur‑SYE が、非標的化ウイルスと比較して、
腫瘍溶解効果が強く増強されること、また、異 所性感染を抑制して安全性強化に資することが 確認でき、腫瘍溶解ウイルスに標的性を付加す る 有 用 性 を 明 ら か に す る こ と が で き た 。 本 AdSur‑SYE の臨床応用を図る上での rationale を得ることができたと考えられる。
また、ヒト膵がん細胞株を用いたスクリーニ ングにより同定した SYENFSA 配列が、実際にヒ ト膵がん外科切除標本において、膵がん特異的 に感染効率を上昇させたことは、本スクリーニ ング方法ががん標的ベクターを開発する基盤と して有用であること示している。
今後は、他のがん腫、特に悪性中皮腫などに 対する腫瘍標的ベクターを探索・開発し、分担 研究者田川雅敏博士が臨床試験を開始しようと している悪性中皮腫に対する Ad‑NK4 による遺 伝子治療に組み合わせて、標的ベクターによる 中皮腫に対する新たな治療戦略の開発に発展さ せる。
E. 結論
1) Survivin の転写調節領域で増殖を制御する 腫瘍溶解ウイルスに、膵がん標的リガンド を組み合わせることにより、腫瘍溶解 Ad ベ クターの抗腫瘍効果の強化が可能であるこ とを、動物モデルで示した。
2) 上記、標的化腫瘍溶解ウイルスが、異所性 感染を抑制し、安全性の強化に資すること を明らかとした。
3) 標的化腫瘍溶解ウイルスが、実際に、ヒト 外科切除標本においても、明らかに感染効 率を上昇させることを示し、本ウイルスの 臨床的有用性を明らかとした。
F. 健康危険情報 特になし。
G. 研究発表
●論文発表
1) Yamamoto Y, Goto N, Miura K, Narumi K, Ohnami S, Uchida H, Miura Y, Yamamoto M, Aoki K. Development of a novel efficient method to construct an adenovirus library displaying random peptides on the fiber knob.
Mol Pharm 11; 1069-1074, 2014.
2) Aida K, Miyakawa R, Suzuki K, Narumi K,
Udagawa T, Yamamoto Y, Chikaraishi T, Yoshida T, Aoki K. Suppression of Tregs by anti-GITR antibody enhances the antitumor immunity of IFN- gene therapy for
pancreatic cancer. Cancer Sci 105; 159-167, 2014.
3) Suzuki K, Aida K, Miyakawa R, Narumi K, Udagawa T, Goto N, Yoshida T, Ohshima Y, Aoki K. Pre-immunization of donor
lymphocytes enhances antitumor immunity of autologous hematopoietic stem cell
transplantation. Cancer Med 2; 636-645, 2013.
4) Udagawa T, Narumi K, Suzuki K, Aida K, Miyakawa R, Ikarashi Y, Makimoto A, Chikaraishi T, Yoshida T, Aoki K.
VEGF-D-mediated blockade of regulatory T cells within tumors is induced by
hematopoietic stem cell transplantation. J Immunol 191; 3440-3452, 2013.
5) Kimura J, Ono H, Kosaka T, Makino H, Akiyama H, Ichikawa Y, Nagashima Y, Hirai S, Ohno S, Aoki K, Davydova J, Yamamoto M, Kunisaki C, Endo I. Conditionally replicative adenoviral vectors for imaging the effect of chemotherapy on pancreatic cancer cells. Cancer Sci 104; 1083-1090, 2013.
6) Miura Y, Yamasaki S, Davydova J, Brown E, Aoki K, Vickers S, Yamamoto M.
Infectivity-selective Oncolytic Adenovirus Developed by High-throughput Screening of Adenovirus-formatted Library. Mol Ther 21;
139-148, 2013.
●学会発表
7) Yamamoto Y, Goto N, Tagawa M, Ohnami S, Aoki K. A cancer-targeting ligand strongly enhances oncolytic activity of a conditionally replicative adenovirus. The American Society of Gene Therapy’s 16th Annual Meeting. May 15-18, 2013 (Salt Lake City).
8) Yamamoto Y, Goto N, Miura K, Narumi K, Ohnami S, Miura Y, Yamamoto M, Aoki K.
New efficient method to produce a
peptide-dislaying adenovirus library. 第18回 日本遺伝子治療学会学術集会. July 4-6, 2013.
9) Yamamoto Y, Goto N, Miura K, Hiraoka N, Tagawa M, Aoki K. A cancer-targeting ligand strongly enhances oncolytic activity of a conditionally replicative adenovirus. 第72回 日本癌学会総会. Oct 4-6, 2013.
10) Aoki K, Aida K, Narumi K, Miyakawa R, N.
Goto N, Hashimoto H, Ueda R, Ikarashi Y, Ohnami S, Yoshida T. A combination of IFN gene therapy and GITR ab-induced reduction of Tregs enhances antitumor immunity for pancreatic cancer. 第72回日本癌学会総会.
Oct 4-6, 2013.
16 11) Narumi K, Miyakawa R, Ueda R, Hashimoto
H, Yoshida T, Aoki K.
S100A8/S100A9-mediated NK cell activation induces antitumor immunity after syngeneic hematopoietic stem cell transplantation. 第 72回日本癌学会総会. Oct 4-6, 2013.
12) 青木一教. 生体内で腫瘍を標的するバイ オベクター開発の新戦略(シンポジウム). 第7回日本緩和医療薬学会. Sep 15-16, 2013.
13) Yamamoto Y, Goto N, Miura K, Rin Y, Hiraoka N, Tagawa M, Aoki K. A cancer-targeting ligand strongly enhances infectivity and cytotoxicity of oncolytic adenovirus in human pancreatic cancer specimens. 第87回日本薬理学会. March 19-21, 2014.
H. 知的財産権の出願・登録状況
●特許取得状況 特になし
17
18
厚生労働科学研究費補助金(創薬基盤推進研究事業)
分担研究報告書
転写制御等を利用した腫瘍標的ベクターの構築と それによる抗腫瘍効果の検討
研究分担者 田川 雅敏 千葉県がんセンター・部長
研究要旨
腫瘍溶解性アデノウイルスによる細胞死の機構については、依然として明確ではないが、p53が変 異または欠損した膵がんを標的とした場合、オートファジーではなくアポトーシスの関与が強いと判 断できた。そこで、同じアポトーシス誘導するMDA-7分子を発現させるアデノウイルスベクターを 利用して、9種類のヒト食道がん細胞については、臨床で利用される抗がん剤(5-FU, CDDP, MMC,
VP-16)との、4種類のヒト膵がん細胞については、分子シャペロンに関するheat shock protein 90
分子の阻害剤との併用効果を検討した。その結果、ヒト食道がん細胞においては、合計 36 通りの組 合せのなかで、3 通りの場合を除くすべての組合せにおいて、併用効果が認められた。またヒト膵が ん細胞においては、2種類のheat shock protein 90阻害剤とも、相乗的な抗腫瘍効果が誘導された。
また、本研究の出口戦略が臨床研究であることから、その前段階として、悪性中皮腫を対象とした非 増殖性アデノウイルスの胸腔内投与による臨床研究を企画し、その前臨床試験を実施した。当該研究 は遺伝子治療臨床研究作業委員会によって審議を受けて承認され(厚生労働省発科0822第1号)、現 在臨床研究実施に向けて最終準備を行っている。
A.研究目的
現在のがん治療の方向性の一つが、個別化を 目指したものであり、各腫瘍別に分子標的を設 定し、その機能を制御することが主眼となって いる。これについては、バイオ医薬の展開も同 じ方向であり、特定の標的分子の発現を遺伝子 医薬で制御することは、分子標的医薬の作用機 序と何ら変わることはない。しかも、遺伝子医 薬は従来の医薬品とは異なる細胞死の機構を有 していることから、これまでの医薬品、治療法 を補完することが可能である。なかでも腫瘍に 特異性を有してウイルス増殖がおこる腫瘍溶解 性ウイルスは、腫瘍細胞の死を誘導するばかり ではなく、破壊された腫瘍より漏出する腫瘍抗 原の樹状細胞における取り込みを促進すると考 えられ、二次的な抗腫瘍免疫応答の誘導が可能 となる。この免疫応答の促進は、抗がん剤や放 射線治療などとは異なる側面であり、当該ウイ ルスによる治療の優れた点となりうる。
腫瘍溶解性ウイルスは、欧米を中心に臨床試 験が実施され、中国ではすでに医薬品として上 市されているものがあるが、本邦では僅か2種 類のタイプのウイルスが臨床研究に進んでいる だけである。このように、本邦における当該分 野の取り組みは、諸外国に比較して著しく立ち 遅れ、国際競争力を完全に失っている。これを
解消するには、法的規制面での改善のみならず、
新規ベクター系の開発によって、当該分野にお ける本邦の優位性を確立していく努力が必要で ある。
そこで本年度については、腫瘍溶解性ウイル スによる細胞死機構の解析、遺伝子医薬による 細胞死と一般的な抗がん剤との併用効果、さら にシャペロン作用の阻害剤との併用効果を検討 し、併せて臨床研究に使用するウイルスの安全 性に関して前臨床試験を実施した。本研究の最 終エンドポイントの一つが、臨床研究への移行 であるが、前述のように本邦における腫瘍溶解 性ウイルスの実績の乏しい。そこで、非増殖型 アデノウイルスではあるが、遺伝子医薬の良き 標的疾患である悪性中皮腫を対象とした臨床研 究を設定し、これを臨床試験のモデルとして胸 腔内投与系という新規投与経路で、実績を積み 重ねていくことにしている。
B. 研究方法
B‑1. 細胞傷害活性と細胞周期の検討
細胞増殖機能は WST 試薬を使用したミトコン ドリアの活性を測定する手法(WSY アッセイ)
で検討し、未処理の細胞の値を 100%とし、処理 群の測定値(吸光度 450 nm)で細胞傷害活性を 算出した。細胞周期の検討は、細胞を 70%のエ
19 タノールで固定後、RNase(50 μg/ml)で処理 し、propidium iodide (50 μg/ml)で染色後、
FACSCalibur(解析ソフト CellQuest)を用いて 解析した。
B‑2. 相乗効果の検討
複数の薬剤の作用の解析については CalcuSyn ソフト(Biosoft, Cambridge, UK)を使用した。
相対的な細胞増殖の抑制レベルに関して、各 fractions affected ポ イ ン ト に お け る combination index を計算し、同 index が 1 以 下であれば相乗効果と判定した。
B‑3. 安全性試験
GMJ 社(神戸市)で製造された GMP レベルの Ad‑NK4(1.52×1012 virus particle (vp)/ml)
を CD1(ICR)マウスの胸腔内あるいは静脈内に 投与し、経時的にマウス体重の測定、採血、各 臓器の摘出を行った。実際の臨床研究における 最大用量(1×1012vp)はヒト体重 50 kg 換算で 2×1010 vp/kg となり、胸腔内に投与できる最大 量 100 μl(試験投与量:1.52×1011 vp)は,
マウス体重 20 g 換算で 7.6×1012 vp/kg となり、
最大臨床投与量の 380 倍に相当する。摘出器官 は、脳,肺,肝臓,脾臓,腎臓,精巣であり、
その他血液についても、ウイルス DNA および NK4 mRNA に関してリアルタイム PCR 法で、発現量等 を検討した。血液生化学的検査としては、白血 球数、赤血球数、ヘモグロビン、ヘマトクリッ ト、血小板数等、総蛋白質、アルブミン、BUN、
Cre、電解質、カルシュウム、リン酸、AST、ALT、
アルカリフォスファターゼ、LDH、総コレステロ ール、中性脂肪、血糖、総ビリルビン等であっ た。また摘出臓器の病理組織学的検討も併せて 実施した。
B‑4. アデノウイルスの作製
使用したアデノウイルスはすでに作製ずみで ある。腫瘍溶解性ウイルスに関しては E1 領域の 転写調節領域を、アデノウイルス固有のものか ら、約 600bp のヒト遺伝子 midkine(MK)ある いは survivin(Sur)由来の 5 側転写調節領域 で置換しており(Ad‑MK あるいは Ad‑Sur)、mda‑7 遺伝子を発現する非増殖性アデノウイルスベク ター(Ad‑mda‑7)は、市販のキットを使用して 作製している。
(倫理面への配慮)
なお当該研究においてヒトの倫理に関する事 項はなく、また組換え DNA 実験等に関しては、
遺伝子組換え生物等の第二種使用等に当たり執 るべき拡散防止措置(大臣確認を含む)が取ら れおり、その上で実施している。
C. 研究結果
C‑1. 腫瘍溶解性ウイルスのよる細胞死の機構 アデノウイルスの増殖による細胞死誘導の機 構については、未だ明確な結論が得られていな い。そこで、MK あるいは Sur の転写調節領域で E1 領域遺伝子の発現を制御する腫瘍溶解性アデ ノウイルス、Ad‑MK、Ad‑Sur、を用いて、ヒト膵 がん細胞(PANC‑1、AsPC‑1)に感染させ、その 細胞死を検討した。PANC‑1 に Ad‑Sur を AsPC‑1 に Ad‑MK(それぞれ 1,000‑5,000 vp/cell)感染 させると、細胞増殖は低下して 2 日後には完全 に増殖は停止した。しかし細胞死は直ちには誘 導されず、トリパンブルー染色による細胞死判 定では、約 5 日で 50%程度の細胞死が観察され るに過ぎない。ウイルス増殖によって細胞の形 態が容易に変化するが、実際には細胞膜機能消 失を伴う細胞死は誘導されにくい。感染後 10 日 で細胞死は 80%となるが、この時の sub‑G1 分画 は約 50%程度である。さらに、caspase‑8 および
‑9 さらに PARP の cleavage は弱く、一方オート ファジーのマーカーである Beclin‑1, Atg5 の発 現は変化せず、また LC3A/B I から II への変換 もなかった。また DNA 傷害のマーカーである histon H2AX 発現は僅かに上昇したが、使用し た 2 種類の膵がん細胞とも、p53 が変異あるい は欠損しているため、p53 経路の活性化はない。
以上の結果からは、腫瘍溶解性ウイルスによる 細胞死には、p53 によらないアポトーシスが関 与しているが、p53 非依存性非アポトーシス経 路による細胞死の関与も想定される。
C‑2. 遺伝子医薬と抗がん剤との併用効果 アデノウイルスによる殺細胞効果と、化学療 法剤による細胞傷害活性が併用効果を示すこと は報告されているが、包括的にこれを調べた報 告はないと思われた。そこで、9 種類のヒト食 道がん細胞(日本人由来の扁平上皮がん:TE‑1, TE‑2, TE‑10, TE‑11, YES‑2, YES‑4, YES‑5, YES‑6, TTn)に、細胞死を誘導する MDA‑7 分子 を発現する Ad‑mda‑7 と、食道がん治療等に利用 される 4 種類の抗がん剤(5‑FU, CDDP, MMC, VP‑16)との併用効果(合計 36 通りの組合せ)
を検討した。併用効果については、抗がん剤単 独による IC50値が Ad‑mda‑7 との併用によって 20%以上改善するかどうかで判定した。その結果、
TE‑1 細胞における VP‑16, YES‑6 細胞における MMC、T.Tn 細胞における CDDP の組合せ以外は、
すべて IC50値が 20%以上低下していた。また、
食道がん細胞における p53 遺伝子の変異と感受 性亢進レベルとは相関していなかった。この抗 がん剤との併用効果については、細胞周期の検 討で sub‑G1 分画の増加を指標にした場合でも
20 同様な結果が得られた。細胞内刺激伝達系を検 討すると、併用効果の誘導とリン酸化 Akt レベ ルの低下が相関していた。Ad‑mda‑7 による細胞 死の誘導が、必ずしも腫瘍溶解性アデノウイル スと同一とは限らないが、Ad‑mda‑7 は上記食道 がん細胞において、caspase 依存性のアポトー シスを誘導し、オートファジーによる細胞死を 誘導しないことが判明しているので、その細胞 死の機構は腫瘍溶解性アデノウイルスと近似で あると考えられる。したがって、アポトーシス を誘導する細胞死においては、臨床で使用され ている抗がん剤との併用は有用であると考えら れた。
C‑3. 遺伝子医薬と分子標的との併用効果 上記 Ad‑mda‑7 の抗腫瘍効果を、4 種類のヒト 膵 が ん 細 胞 ( PANC‑1 、 AsPC‑1 、 MIA‑PaCa‑2 、 BxPC‑3)を対象に検討したところ、細胞傷害活 性が誘導されていたものの、その活性は食道が ん細胞に比較して著しく低いものであった。そ こで、遺伝子発現に影響を与えると考えられる heat shock protein 90(HSP90)分子の阻害剤 で herbimycin A(HA)geldanamycin(GA)との 併用効果を検討した。HSP90 はシャペロン作用 を有しており、そのためアデノウイルスによっ て外来遺伝子産物を過剰に発現させると、当該 蛋白質発現が減少する可能性すらある。HA ある いは GA 単独使用による殺細胞効果は僅かに認 められたが、Ad‑mda‑7 と併用すると、殆んどの fraction affected のポイントで combination index が 1 以下となり、相乗的な抗腫瘍効果が 得られた。この時、HSP90 阻害剤および Ad‑mda‑7 による細胞傷害活性が、n‑acetyl‑l‑cysteine
(NAC)によって消失したことから、活性酸素が これらの殺細胞効果に関与していることが明ら かとなった。一方ウエスタンブロットによる細 胞死関連蛋白の発現を検討すると、GA はユビキ チン化を阻害して MDA‑7 発現を上昇させるが、
GA 自体による細胞死は、caspase 非依存的なア ポトーシスあるいはオートファジーが関与して いた。さらに膵がんを標的とした場合、食道が ん細胞に感染させた時とは異なり、Ad‑mda‑7 に よる細胞死は、非アポトーシス・非オートファ ジー経路によると判断された。
C‑4. 臨床研究用ベクターの前臨床試験
本研究の最終目的の一つが臨床試験の実施で ある。しかし、本邦における遺伝子医薬による 臨床研究の数は少なく、とりわけ腫瘍溶解性ウ イルスを使用したものは、2種類の研究が進行 しているのみである。そこで、当初は腫瘍溶解 性でなく、まず非増殖型で切除不能悪性中皮腫
を対象に、臨床研究の実績を積み重ねることが 肝要だと判断した。しかもアデノウイルスの胸 腔内投与という新規性を加味し、今後の当該疾 患に対する臨床研究に寄与する点を含めた。悪 性中皮腫は稀な疾患ではあるが、その患者数は 今後とも増加する傾向にあり、しかも経済新興 国では石綿が依然として使用されているため、
世界的にみれば重要な疾患の一つである。手術 適応例は早期症例に限られ、しかも第一選択薬 に耐性となった後は第二選択薬がないため、多 くの症例ではベスト・サポーティブ・ケアに移 行せざるを得ない。当該疾患への遺伝子治療の 臨床試験は、米国で 70 数例の第一相試験があり、
同試験では重篤な有害事象は報告されていない。
これらの状況を踏まえて、悪性中皮腫で機能亢 進が知られている hepatocyte growth factor
(HGF)/c‑Met 系を、競合的に阻害する NK4 分 子の発現を可能にするアデノウイルスベクター
(Ad‑NK4)を用いた臨床研究を計画した。しか し、NK4 分子による遺伝子治療は世界で最初で あるため、胸腔内投与における安全性検討が必 要であった。最大臨床用量(1x1012 vp)の 380 倍に相当するウイルスを、マウスの胸腔内(対 照として静脈内)に投与し、経時的に各臓器の ウイルス量ならびに NK4 発現等について検討し た。その結果、(ア)マウスの体重は、胸腔内投 与で一過性に減少したが、その後順調に増加し、
2 週間後には非投与群と有意差がなくなった。
(イ)血液一般検査、肝機能を除く生化学検査 においては、非投与群と投与群との差は検出さ れなかった。一方肝機能のおいては、AST・ALT ともに投与後 7 日目で最大値を示したが,その 後肝機能は改善していた。胸腔内投与群におけ る AST・ALT 値は,同じ用量を投与した静脈内投 与群に比較して低値であったが,投与後 71 日目 においても正常値まで回復しておらず、肝機能 障害が遷延化している可能性が考えられた。
(ウ)ウイルス DNA の取り込みは、静脈内投与 の場合、投与後 24 時間では肝臓が最大で,次に 肺,脾臓,腎臓の順で高く,その後各臓器にお けるウイルス DNA は急速に減少するが、投与後 28 日でも肝臓が最も高い値を示した。一方胸腔 内投与の場合、投与 24 時間では肺が最大である が急速に減少し、投与後 14 日目では,脾臓,肝 臓,肺で当該 DNA が検出されたが、やはり次第 に減少していた。しかし、71 日目においても肝 臓でウイルス DNA が検出されていた。しかし、
胸腔内投与で検出される DNA 量は、静脈内投与 よりも低値であった。(エ)NK4 発現に関しては、
投与後 24 時間に肺で mRNA の高発現が確認され たが、時間の経過と共に減少し、脳,胃,脾臓,
腎臓,大腸,精巣においては、投与 14 日後まで に対照である静脈内投与と同じレベルまで低下
21 した。(オ)病理学的検査所見としては、胸腔内 投与でも脾臓において軽度のリンパ濾胞の肥大 が認められたが,投与後 14 日には消失していた。
肝臓では個体差が大きいものの,肝細胞の変性 と炎症性細胞浸潤を認めたが、壊死は観察され なかった。またこの肝臓所見の程度は軽微で、
経時的に回復傾向を示した。
上記結果を纏めると、胸腔内投与の場合、投 与直後は肺に多くのウイルスが検出され、その 後血中を通じて体循環に吸収され、時間経過と ともに肝臓に移行した。その結果、投与後 2 カ 月以上にわたる肝機能異常を認めたが、これが 増悪することはなかった。これは、マウスの体 重あたり 380 倍の大量のウイルスを投与した結 果であり、実際に臨床用量ではその有害事象の 程度は軽いと想定される。基本的には、胸腔内 投与であたっても、ウイルスの静脈内投与と同 じ biodistribution を示すと考えられた。
D. 考察
細胞内におけるアデノウイルス増殖による細 胞死の機構については、依然として不明のまま である。ヒト膵がん細胞を用いた本研究では、
アポトーシスが関与しており、オートファジー は無関係と考えられる。しかし、実際に細胞死 が誘導されるにはかなりの時間を要し、p53 遺 伝子を発現させるアデノウイルスが、比較的短 時間で細胞死を誘導するのとは好対照をなす。
また、アポトーシスの指標として、細胞周期に おける sub‑G1 分画の上昇も遅延しており、かつ caspase や PARP 分子の cleavage も強いもので はない。一方、本研究で使用した Ad‑MK、Ad‑Sur と同様に、E1 遺伝子の発現をヒト由来の転写制 御領域で制御させた制限増殖型アデノウイルス に関して、肺がん細胞を用いた場合、アポトー シスではなくオートファジーが誘導されている、
という報告があり(Mol Cancer Ther 12: 314, 2013)、どのような細胞死機構によるかは、細胞 によって異なることが考えられる。もっとも上 記論文では、p53 の強制発現を追加すると、ア ポ ト ー シ ス も 誘 導 さ れ て お り 、 p53 や DRAM
(damage‑regulated autophagy modulator)の 発現や両者の相互制御によって、細胞死の機構 が規定される可能性がある。また necroptosis が関与するということも否定はできないが、ウ イルス増殖による細胞内栄養の枯渇や、ウイル ス DNA 増加による DNA 傷害機構の活性化も関与 して、細胞死が選択されるものと想定される。
MDA‑7 蛋白は p53 非依存性で腫瘍特異的に細 胞死を誘導することから、この遺伝子を発現す る Ad‑mda‑7 を用いて、抗がん剤および HSP90 阻
害剤を例にとり併用効果を検討した。食道がん 細胞 9 種類と、作用機序が異なる 4 種類の抗が ん剤の合計 36 種類の組合せのなかで、3 種類の 組 合 せ 以 外 は 、 す べ て 抗 が ん 剤 の 効 果 が Ad‑mda‑7 によって増強する結果となった。その 理由については深く検討できていないが、ウイ ルス製剤と、多様な作用機点を有する抗がん剤 が併用効果を示すことは、単にウイルス製剤と 抗がん剤の作用機序が同一でないという理由以 外に、基本的に両者の併用は臨床的意義がある ことを予期させることとなった。抗がん剤は細 胞周期を停止させることから、ウイルス増殖に 対して阻害的に作用することが考えられたが、
これまでの研究からウイルス増殖を阻害しても、
細胞死誘導全体からみれば、両者は相乗作用を 惹起ことが多いことが報告されている。また、
発現した遺伝子産物の安定性も重要である。そ こで、Ad‑mda‑7 を用いて、シャペロン作用があ る HSP90 分子に対する阻害剤を併用したところ、
MDA‑7 蛋白質が増加して、殺細胞効果が相乗的 となった。このように、発現された蛋白質の安 定性を図ることも、遺伝子医薬の効果と高める 方法として考慮すべきである。例えば、p53 蛋 白はユビキチン機能を有する MDM2 分子と結合 することによって、プロテアソームを介した分 解を受けるが、この MDM2 と p53 蛋白との結合を 阻害する低分子化合物(例えば、nutlin‑3a)が 介在すると、Ad‑p53 による抗腫瘍効果が増強す ることなどが、その例である。なお、HSP90 阻 害剤は p53 の転写活性化能を阻害する機能が知 られているが、実際には p53 非依存的に細胞傷 害活性を誘導する。本研究では p53 遺伝子が変 異型あるいは p53 遺伝子が欠損している膵がん 細胞を使用しており、MDA‑7 による細胞死も p53 非依存的である。
本研究の成果である腫瘍溶解性ウイルスを用 いて、臨床研究を本邦で開始することは容易で はない。一つには遺伝子医薬に関しての経験が 乏しいため、安全性について十分に検討する知 見が揃っていないためである。一方、悪性中皮 腫は、遺伝子医薬の良き標的疾患である。胸腔 内は陰圧であり、呼吸運動によって、胸腔内に 投与されたアデノウイルスは胸腔内面に均一に 分布することが可能である。また悪性中皮腫は 末期に至るまで、遠隔転移が少なく、胸腔内に 留まることが多く、当該病巣を標的とするだけ でも、十分に治療効果や QOL の改善が得られる 可能性がある。また高齢者や、石綿暴露によっ て呼吸器機能に劣る患者に対しても、投与可能 である。その一方で、胸腔内に投与されたアデ ノウイルスは、最終的に体循環系に移行し肝臓 に蓄積することには、静脈内投与の場合と変わ らない。しかし、肝機能の悪化が遷延化する半
22 面、静脈内投与と比較して肝障害自体が軽微と 推定される。また NK4 分子は分泌蛋白であり、
胸腔内に蓄積されるため、当該分子の生体内に おける安定性にもよるが、胸腔内濃度が一定の 期間維持されるはずである。さらに NK4 分子は HGF/c‑Met 系阻害ばかりではなく、悪性中皮腫 で高発現の VEGF/VEGFR 系をも阻害する可能性 があり、悪性中皮腫に対する Ad‑NK4 による遺伝 子治療は合理性が高いと想定される。
胸腔内投与においてもアデノウイルスに対す る抗体の上昇はみられ、同抗体の産生について は、静脈内投与の場合と変わらないことが知ら れている(Cancer Gene Ther 20: 150, 2013)。
したがって、アデノウイルスの複数回投与は、
遺伝子導入効率を減弱させる可能性があり、そ の場合は投与間隔を短くするなど、何らかの対 応が必要である。胸腔内投与の場合、胸水貯留 例でしか適応症例とならないため、腫瘤形成が 著しい場合、十分に遺伝子導入が出来ない場合 も想定される。上記の状況を考えると、次の段 階としては、抗がん剤との併用を考慮せざるを 得ない局面が出てくるはずである。しかし、本 邦ではまた Ad‑NK4 自体の安全性が不明で、胸腔 内投与の実績のなさを考えると、本臨床研究で 一定の経験を積み重ねる必要があることは言う もでもない。このような実績を踏まえて、次の 腫瘍溶解性ウイルスの適応症例を模索すること は肝要と考えられる。
E. 結論
難治性の膵がん細胞を標的として、腫瘍特異 的に増殖する腫瘍溶解性アデノウイルスによる 細胞死を検討すると、アポトーシスが関与して おり、オートファジーの関与はなかった。また、
細胞死を誘導するアデノウイルスは、現在使用 されている抗がん剤と併用効果を示し、またシ ャペロン作用を阻害する HSP90 阻害剤との併用 によって相乗効果を示した。悪性中皮腫に対す るアデノウイルスの胸腔内投与による臨床研究 を計画し、安全性試験を実施した。胸腔内投与 であっても、基本的には静脈内投与と同じ生体 内分布動態を示し、肝臓には比較的長期にわた ってウイルスが検出された。
F. 健康危険情報 特記すべきことなし
G. 研究発表
●論文発表
14) Wu D, Hiroshima K, Matsumoto S, Nabeshima K, Yusa T, Ozaki D, Fujino M,
Yamakawa H, Nakatani Y, Tada Y, Shimada H, Tagawa M. Diagnostic usefulness of
p16/CDKN2A FISH in distinguishing between sarcomatoid mesothelioma and fibrous pleuritis. Am. J. Clin. Pathol. 139:
39-46, 2013.
15) Tada Y, Shimada H, Hiroshima K, Tagawa M.
A potential therapeutic strategy for malignant mesothelioma with gene medicine. BioMed.
Res. Int. 2013: 572609, 2013.
16) Gotoh A, Nagaya H, Kanno T, Tagawa M, Nishizaki T. Fiber-substituted conditionally replicating adenovirus Ad5F35 induces oncolysis of human bladder cancer cells in in vitro analysis. Urology. 81: 920.e7-920.e11, 2013.
17) Tagawa M, Tada Y, Shimada H, Hiroshima K.
Gene therapy for malignant mesothelioma:
Current prospects and challenges. Cancer Gene Ther. 20; 150-156, 2013.
18) Fukamachi T, Ikeda S, Wang X, Saito H, Tagawa M, Kobayashi H. Gene expressions for signal transduction under acidic
conditions. Genes 4: 65-85, 2013.
19) Okamoto S, Jiang Y, Kawamura K, Shingyoji M, Fukamachi T, Tada Y, Takiguchi Y, Tatsumi K, Shimada H, Hiroshima K, Kobayashi H, Tagawa M. Zoledronic acid produces combinatory anti-tumor effects with cisplatin on mesothelioma by increasing p53 expression levels. PLoS ONE 8; e60297, 2013.
20) Li Q, Kawamura K, Tada Y, Shimada H, Hiroshima K, Tagawa M. Novel type III interferons produce anti-tumor effects through multiple functions. Front. Biosci. 18;
909-918, 2013.
21) Li Q, Kawamura K, Yang , Okamoto S, Kobayashi H, Tada Y, Sekine I, Takiguchi Y, Shingyouji M, Tatsumi K, Shimada H, Hiroshima K, Tagawa M. Interferon-
produces synergistic combinatory anti-tumor effects with cisplatin or pemetrexed on mesothelioma cells. PLoS ONE. 8: e72709, 2013.
22) Kawamura K, Hiroshima K, Suzuki T, Chai K, Yamaguchi N, Shingyoji M, Yusa T, Tada Y, Takiguchi Y, Tatsumi K, Shimada H, Tagawa M. CD90 is a diagnostic marker to
differentiate between malignant pleural mesothelioma and lung carcinoma with immunohistochemistry. Am. J. Clin. Pathol.
140:544-549; 2013.
23) Takagi-Kimura M, Yamano T, Tamamoto A, Okamura N, Okamura H,
Hashimoto-Tamaoki T, Tagawa M, Kasahara N, Kubo S. Enhanced antitumor efficacy of fiber-modified, midkine promoter-regulated oncolytic adenovirus in human malignant mesothelioma. Cancer Sci. 104: 1433-1439,
23 2013.
24) Zhang M, Kawamura K, Jiang Y, Shingyoji M, Ma G, Li Q, Hu J, Qi Y, Liu H, Zhang , Kang, S, Shan B, Wang S, Chada S, Tagawa M.
Heat-shock protein 90 inhibitors synergistically enhance melanoma
differentiation-associated gene-7-mediated cell killing of human pancreatic carcinoma.
Cancer Gene Ther. 20: 663-670, 2013.
25) Ma G, Kawamura K, Yang S, Okamoto S, Li Q, Namba M, Shingyoji M, Tada Y, Tatsumi K, Hiroshima K, Shimada H, Tagawa M.
Combination of adenoviruses expressing melanoma differentiation-associated gene-7 and chemotherapeutic agents produces enhanced cytotoxicity on esophageal carcinoma. Cancer Gene Ther. 21: 31-37, 2014.
26) Tagawa M. Gene therapy in malignant pleural mesothelioma. Lung Cancer Manage. 3:
29-33, 2014.
27) Takagi-Kimura M, Yamano T, Tagawa M, Kubo S. Oncolytic virotherapy for osteosarcoma using midkine
promoter-regulated adenoviruses. Cancer Gene Ther. (in press)
28) Fukamachi T, Ikeda S, Saito H, Tagawa M, Kobayashi H. Expression of
acidosis-dependent genes in human cancer nests. Mol. Clin. Oncol. (in press) 29) Tagawa M, Shirane K, Yu L, Sato T,
Furukawa S, Mizuguchi H, Kuji R, Kawamura K, Takahashi N, Kato K, Hayakawa S, Sawada S, Furukawa K.
Enhanced expression of the
4-galactosyltransferase 2 gene impairs the mammalian tumor growth. Cancer Gene Ther. (in press)
●学会発表
17) Tagawa M, Chai K, Jiang Y, Kawamura K, Yang S, Ogino A, Yamaguchi N, Kato K, Tada Y, Takiguchi Y, Tatsumi K, Shimada H, Hiroshima K, Kubo S. Anti-tumor effects of Ad-p53 on INK4A/ARF-defective
mesothelioma are influenced positively by small G protein inhibitors but negatively by heat shock protein 90 inhibitors. 16th annual meeting of American Society of Gene and Cell Therapy, May 15-18 2013, Salt Lake City.
(May 16, 2013)(Molecular Therapy 21:
S84, 2013)
18) Kubo S, Takagi-Kimura M, Tamamoto A, Hashimoto-Tamaoki T, Kasahara N, Tagawa M. Development of doubly regulated oncolytic adenovirus for human malignant mesothelioma. 16th annual meeting of American Society of Gene and Cell Therapy, May 15-18 2013, Salt Lake City.(May 18,
2013)(Molecular Therapy 21: S243, 2013)
19) Yamamoto Y, Goto N, Ohnami S, Tagawa M, Aoki K. A Cancer-targeting ligand strongly enhances oncolytic activity of a conditionally replicative adenovirus. 16th annual meeting of American Society of Gene and Cell Therapy, May 15-18 2013, Salt Lake City.
(May 18, 2013)(Molecular Therapy 21:
S245, 2013)
20) Tagawa M, Tada Y, Shimada H, Hiroshima K.
Updated gene therapy for malignant
mesothelioma: Challenges for the intractable caner. 19th annual meeting of Japan Society of Gene Therapy, July 4-6, 2013, Okayama.
(July 6, 2013)(Abstract p102)
21) Tagawa M, Kawamura K, Yang S, Jiang Y, Chai K, Yamaguchi N, Tada Y, Takiguchi Y, Tatsumi K, Shimada H, Hiroshima K.
Activation of p53 pathways produces combinatory effects with chemotherapeutic agents on p53 wild-type mesothelioma. 19th annual meeting of Japan Society of Gene Therapy, July 4-6, 2013, Okayama.(July 5, 2013)(Abstract p140)
22) Kubo S, Takagi-Kimura M, Tamamoto A, Okamura N, Tagawa M, Kasahara N, Okamura H, Hashimoto-Tamaoki T. Midkine promoter-driven oncolytic adenovirus with Ad35 fiber modification achieves enhanced transduction of human osteosarcoma cells.
19th annual meeting of Japan Society of Gene Therapy, July 4-6, 2013, Okayama.(July 6, 2013)(Abstract p153)
23) Nagaya H, Kanno T, Hiwasa K, Nakagawa Y, Shimomura K, Nakano T, Nishizaki T, Tagawa M, Gotoh A. Oncolytic effects of a fiber knob substituted adenovirus vector to human lung cancer cells. 19th annual meeting of Japan Society of Gene Therapy, July 4-6, 2013, Okayama.(July 5, 2013)(Abstract p174)
24) Tagawa M, Ma G, Yang S, Li Q, Kawamura K, Okamoto S, Tada Y, Hiroshima K, Shimada H.
Possible applications of gene medicine to esophageal carcinoma. Internatinal Socieity for Cell and Gene Therapy of Cancer 2013 China Conference, September 13-16, 2013, Shijarzhuang, China(September 14, 2013)
25) Tagawa M, Yang S, Kawamura K, Okamoto S, Kubo S, Tada Y, Hiroshima K, Shimada H.
Cytotoxicity of replication-competent adenoviruses are enhanced by co-transduced p53 gene. 21st Annual Congress of the European Society of Gene and Cell Therapy, October 25-28, 2013, Madrid, Spain(October 26, 2013)(Abstract A155)
26) 田川雅敏、川村希代子、由佐俊和、多田裕 司、巽浩一郎、島田英昭、廣島健三:CD90
24 は中皮腫と肺腺がんを鑑別できるマーカ ーである。第20回石綿・中皮腫研究会 平 成25年9月28日(東京都)(9月28日)
(抄録p14)
27) 呉迪、廣島健三、由佐俊和、尾崎大介、中 谷行雄、多田裕司、島田英明、田川雅敏:
p16遺伝子欠失解析(FISH法)による二 相型中皮腫と上皮型中皮腫の鑑別。第20 回石綿・中皮腫研究会 平成25年9月28 日(東京都)(9月28日)(抄録p12)
28) 岡本慎也、江媛媛、久保秀司、多田裕司、
関根郁夫、滝口裕一、巽浩一郎、島田英昭、
廣島健三、田川雅敏:Topoisomerase IIと Rab機能の阻害によりビスフォスフォネ ートは悪性中皮腫に対する細胞傷害活性 を発揮するBisphosphonates produce cytotoxic effects on mesothelioma through inhibiting topoisomerase II and Rab functions.
第72回日本癌学会学術総会 平成25年 10月3-5日(横浜市)(10月4日)(日本 癌学会総会Proceedings p189, 2013)
29) 柴寛、荻野敦史、多田裕司、関根郁夫、滝 口裕一、巽浩一郎、島田英昭、廣島健三、
加藤和則、山口直人、田川雅敏:p53の蛋 白分解を抑制するHSP90阻害剤は、アデ ノウイルスによるp53合成を減少させむ しろその抗腫瘍効果を低下させるAn HSP90 inhibitor, which blocks p53 degradation, suppresses
adenoviruses-mediated p53 production and the apoptosis. 第72回日本癌学会学術総会 平成25年10月3-5日(横浜市)(10月5 日)(日本癌学会総会Proceedings p206, 2013)
30) 久保秀司、木村(高木)美智、山野智基、
吉川良恵、江見充、田川雅敏、笠原典、玉 置(橋本)知子:二重制御型腫瘍溶解アデ ノウイルスのヒト骨肉腫細胞に対する効 果Dual targeted adenovirus for oncolytic virotherapy in experimental human
osteosarcoma. 第72回日本癌学会学術総会 平成25年10月3-5日(横浜市)(10月5 日)(日本癌学会総会Proceedings p206, 2013)
31) 山本由姫、三浦和樹、後藤尚子、鳴海兼太、
大浪俊平、吉田輝彦、田川雅敏、青木一教:
腫瘍標的リガンドによる腫瘍溶解ウイル スの効果の増強 A cancer‑targeting ligand strongly enhances oncolytic activity of a conditionally replicative adenovirus. 第 72 回日本癌学会学術総会 平成 25 年 10 月 3‑5 日(横浜市)(10 月 5 日)(日本癌学会総会 Proceedings p206, 2013)
32) 島田英昭、谷島聡、小池淳一、田川雅敏、
日和佐隆樹、松下一之、野村文夫:食道癌 における血清 SEREX 抗体の臨床的意義 Clinical significance of serum SEREX antibody in esophageal carcinomas. 第 72 回日本癌学会学術総会 平成 25 年 10 月 3‑5 日(横浜市)(10 月 5 日)(日本癌 学会総会 Proceedings p418, 2013)
H. 知的財産権の出願・登録状況 なし
25
厚生労働科学研究費補助金(創薬基盤推進研究事業)
分担研究報告書
標的ベクターに関する細胞表面分子の探索
研究分担者 内田 宏昭 東京薬科大学生命科学部・准教授
研究要旨
アデノウイルスベクターのがん標的化デリバリーに好適な表面抗原の系統的・網羅的探索を目的 に、抗体結合変異型アデノウイルスを用いた抗体スクリーニングを施行した。抗原同定を完了した抗 体(431 クローン)の抗原は 62 種類(重複を除く)に及んだ。本標的分子探索系に加え、抗体にタ ンパク合成阻害毒素を結合させたイミュノトキシン(iTox)の殺細胞効果を指標とした抗体スクリー ニング系を新たに樹立し、この探索系(iTox系)を用いた抗体スクリーニングを昨年度より進めてい る。本年度も引き続き、iTox系を用いた抗体スクリーニングにより様々なタイプのヒトがん細胞に対 する高性能標的化抗体を選抜し、その抗原同定を進めた。その結果、これまでに優れたiTox活性を有 するモノクローナル抗体を301クローン樹立することに成功し、そのうち203クローンの抗原同定を 完了した。その抗原リストにはがん標的化治療の候補分子として有望なものが高い比率で含まれてい た。その中でも特に有望な抗原分子としてinterleukin 13 receptor alpha 2(IL13RA2), prostate stem cell antigen(PSCA), CD276 molecule(CD276), solute carrier family 3 [amino acid transporter heavy chain] member 2(SLC3A2), 5 -nucleotidase ecto(NT5E), claudin 6(CLDN6)
などが挙げられ、今後の標的ベクター開発におけるターゲット分子の候補になりうると考えられた。
A.研究目的
膵がん・悪性中皮腫を含む難治性が んに対する効果的な遺伝子治療・ウイ ルス療法の開発のためには、ベクター をがん細胞へ特異的にデリバリーでき るかどうかが鍵となる。我々は、アデ ノウイルスベクターのがん標的化デリ バリーに好適な表面抗原の系統的・網 羅的探索を目的に、抗体の Fc 部分に結 合する黄色ブドウ球菌プロテイン A の Z33 モチーフを組み込んだファイバー 変異型 Adv‑FZ33 アデノウイルスを作 製した。Adv‑FZ33 の抗体依存的な細胞 侵入を指標とした抗体スクリーニング 系を樹立し、選抜された高性能抗体の
抗原分子の同定を免疫沈降・質量分析にて行っ た。その結果、昨年度までに抗原同定を完了し た 431 クローンの抗原は 62 種類(重複を除く)
に及んだ。
Adv‑FZ33 系に加え、がん標的化抗体の新たな 探索方法として、抗体にタンパク合成阻害毒素 を結合させたイミュノトキシ(iTox)の殺細胞 効果を指標とした抗体スクリーニング系を樹立 した。ジフテリアトキシン(DT)と連鎖球菌プ ロテイン G 由来の抗体結合ドメイン 3C を持つ DT3C は簡便に抗体へ結合させることができ、抗
体と DT3C の結合体すなわち iTox が表面抗原と の結合を介してエンドサイトーシスで細胞内へ 取り込まれると強力な殺細胞活性を示す。昨年 度よりこの探索系(iTox 系)を用いた抗体スク リーニングを進めており、有望ながん標的化抗 原・抗体を同定・樹立してきた。本年度も引き 続き iTox 系を用いた抗体スクリーニングを施 行し、様々なタイプのヒトがん細胞に対する高 性能標的化抗体を選抜し、その抗原同定を進め た。
モノクローナル抗体の樹立 および抗原の同定
Immunoprecipitation and SDS-PAGE
TOF/MS
10 0 10 1 10 2 10 3 10 4 FL2-H 0 50 100 150
# Cells
Immunized with cancer cell lines
BA LB/c
10 days interval
Spleen
H AT se lectio n B cells M yelo m a (P3 U 1 )
Ce ll f u sio n (PEG m eth o d )
9 6 w ell x 1 0 = 9 6 0 w ell
免疫マウスから抗体ライブラリーの作製
Antibody library!
スクリーニング(iTox法)
Confirmation by cDNA transfection and/or siRNA inhibition Antibody
(supernatant)
1.561.469 1.641.2711.1751.5310.1931.1121.4421.7721.4431.563 1.6021.536 1.570.1911.5062.0111.1881.4891.4071.5550.9980.782 1.5891.4351.7291.5631.6242.0191.6581.703 1.771.2451.0751.228 1.6251.494 1.79 1.441.418 1.761.7950.1871.7351.2941.1771.343 1.5741.439 1.710.1932.0521.8081.7251.7611.6531.1121.2221.465 1.4980.669 1.681.8492.0270.1881.6711.6721.6491.1671.168 1.43 1.5551.6251.6841.6731.6561.6511.494 1.541.4590.7661.2120.202 1.6311.7081.6591.4781.492 1.41.6411.3941.4531.1571.2721.502
26 B. 研究方法
前ページの図は iTox 系を用いたがん標的化 モノクローナル抗体樹立の方法と、対応する抗 原の同定・特異性の確認など、実験の一連の流 れを示す概念図である。本年度は、昨年度まで の膵がん細胞株、肺がん細胞株、精巣がん細胞 株、メラノーマ細胞株、白血病細胞株などに加 え、食道がん細胞株、グリオーマ細胞株、肝が ん細胞株、胆管がん細胞株、腎がん細胞株、骨 肉腫細胞株、と多彩な種類のヒトがん細胞株を 用いてマウスを免疫し、新規の標的化抗体のス クリーニングを進めた。選抜される抗体はすべ て、高い効率の iTox 活性を示すがん標的化抗 原・抗体である点で、臨床応用の際の治療効果 が十分に期待できる。
抗原同定に際しては、免疫原として用いたが ん細胞株または抗体が強く結合するがん細胞株 の表面タンパク質をビオチンにて標識後、1%
NP40 などを含む可溶化バッファーにて膜タンパ クを可溶化し、抗体と Protein G セファロース ビーズの結合複合体を用いて免疫沈降を行った。
沈降サンプルを SDS‑PAGE により分離した後に 膜転写し、認識抗原および共沈分子の分子量を アビジン‑HRP 酵素を用いて決定した。その上で 非標識細胞を用いた免疫沈降を行い、沈降サン プルを SDS‑PAGE により分離した後に CBB 染色し、
すでに決定した分子量を示すバンドをゲルより 切り取り、質量分析を行った。質量分析にて予 想された抗原に関しては全長の cDNA を購入ま たは RT‑PCR にてクローニングして発現プラス ミドに組み込み、CHO‑K1 または 293T 細胞に遺 伝子導入した後、フローサイトメーターにて抗 体の反応性を確認した。
(倫理面への配慮)
本研究では、がんの遺伝子治療・抗体療法な どに関する基礎的な検討のみを行う。すでに樹 立された細胞株と動物を用いて行う実験である ため、人権の保護などの問題に該当する留意事 項は特にない。本研究に関連した組換え DNA 実 験に関しては、課題名「抗体医薬・遺伝子治療・
再生医療の基礎的研究」として、東京薬科大学 で承認済みである。動物実験に関しても課題名
「癌細胞に対するモノクローナル抗体の作製お よび癌の診断・治療の研究」として、東京薬科 大学で承認済みである。
C. 研究結果
膵がん細胞株、肺がん細胞株、精巣がん細胞 株、メラノーマ細胞株、白血病細胞株、食道が ん細胞株、グリオーマ細胞株、肝がん細胞株、
胆管がん細胞株、腎がん細胞株、骨肉腫細胞株
など、合計 19 種類のヒト細胞株を免疫原とした 抗体スクリーニングを行った。その結果、高い iTox 活性を呈するモノクローナル抗体を合計 301 クローン樹立することに成功した。このう ち 203 クローンに対する抗原決定を完了した。
抗原の種類は 36 種類(重複を除く)に及び、
その中にはがん標的化治療の候補分子として有 望なものが高い比率で含まれていた。特に有望 な 抗 原 分 子 と し て interleukin 13 receptor alpha 2(IL13RA2), prostate stem cell antigen
(PSCA), CD276 molecule(CD276), solute carrier family 3 [amino acid transporter heavy chain] member 2 ( SLC3A2 ) , 5
‑nucleotidase ecto(NT5E), claudin 6(CLDN6)
などが挙げられ、今後の標的ベクター開発にお ける標的分子の候補になりうると考えられた。
D. 考察
本年度は、昨年度に引き続き、新たに立ち上 げた iTox 系を駆使して、多数の抗体を樹立して その抗原の決定を精力的に進め、新たに 136 ク ローンの高性能モノクローナル抗体を樹立する ことに成功した。さらに、抗原同定についても 今年度だけで 147 クローンの抗体に対して完了 することができた。実験は当初の計画以上に順 調に進捗し、その結果として、がんの標的化治 療への応用につながりうる有望ながん抗原を複 数提案するに至った。
今後も様々なタイプのがん細胞を免疫原とし て、これら独自のスクリーニング系で抗体を選 抜・樹立してゆくことにより、新たなターゲッ ト分子を同定できる可能性が高い。
さらに、本研究の成果は、作動分子機構が異 なる探索プラットフォームを適用することによ り、がん標的化治療に好適な抗原・抗体ペアを さらに広く同定してゆける可能性を示している。
そこで今後は、新たな試みとして、アデノウイ ルスあるいはイミュノトキシンとは細胞内侵入 の分子メカニズムが大いに異なる単純ヘルペス ウイルスをプラットフォームとした抗体スクリ ーニング系を独自に開発してゆく予定である。
すでに探索プローブの樹立を進めている。
E. 結論
ファイバー変異型アデノウイルス(Adv‑FZ33)
系ならびにイミュノトキシン(iTox)系を用い た高効率がん標的化抗体のスクリーニングは順 調に稼働するとともに、すでに多くの成果をも たらした。今後も、本プロジェクトを進めるこ とにより、がん標的化治療への応用が有望な抗 原・抗体セットの樹立が十分に見込まれる。
27
F. 健康危険情報 特になし。
G. 研究発表
●論文発表
30) Yamamoto Y, Goto N, Miura K, Narumi K, Ohnami S, Uchida H, Miura Y, Yamamoto M, Aoki K. Development of a novel efficient method to construct an adenovirus library displaying random peptides on the fiber knob.
Molecular Pharmaceutics.
11:1069-1074,2014.
31) Wang PY, Currier MA, Hansford L, Kaplan D, Chiocca EA, Uchida H, Goins WF, Cohen JB, Glorioso JC, Kuppevelt TH, Mo X, Cripe TP.
Expression of HSV-1 receptors in
EBV-associated lymphoproliferative disease determines susceptibility to oncolytic HSV.
Gene Therapy. 20:761-769,2013.
32) Uchida H, Marzulli M, Nakano K, Goins WF, Chan J, Hong CS, Mazzacurati L, Yoo JY, Haseley A, Nakashima H, Baek H, Kwon H, Kumagai I, Kuroki M, Kaur B, Chiocca EA, Grandi P, Cohen JB, Glorioso JC. Effective treatment of an orthotopic xenograft model of human glioblastoma using an
EGFR-retargeted oncolytic herpes simplex virus. Molecular Therapy. 21:561-569,2013.
33) Uchida H, Chan J, Shrivastava I, Reinhart B, Grandi P, Glorioso JC, Cohen JB. Novel mutations in gB and gH circumvent the requirement for known gD receptors in HSV-1 entry and cell-to-cell spread. Journal of Virology. 87:1430-1442,2013.
H. 知的財産権の出願・登録状況 なし
28
厚生労働科学研究費補助金(創薬基盤推進研究事業)
分担研究報告書
アデノウイルスベクターに対する生体反応の解析
研究分担者 水口 裕之 大阪大学大学院薬学研究科分子生物学分野・教授
研究要旨
制限増殖型アデノウイルス(Ad)を含め、Ad ベクターは、その優れた特性から革新的がん治療薬 として大きな期待が寄せられている。しかしながら、Ad ベクターによる遺伝子治療(導入)の際に は、自然免疫が強く惹起されることによって、組織障害および遺伝子発現効率の低下が誘導される。
従って、Ad ベクターによる自然免疫活性化機構の解明は極めて重要な課題であるが、依然として不 明な点が多く残されている。そこで、本研究では、種々の細胞質内核酸センサーの下流に共通で存在 するシグナル分子であるTANK-bindingkinase 1 (TBK1)の関与について検討した。TBK1の欠損に より、ウイルス由来の核酸による全ての自然免疫シグナルが遮断されることから、ウイルス由来の核 酸が自然免疫活性化に及ぼす影響について評価可能であると思われる。また、非増殖型 Adベクター は、自己増殖に必須のE1 遺伝子を欠損させることで、理論上Ad 遺伝子が発現しないよう設計され ている。しかし、Adベクター作用後、わずかにAdタンパク質が発現し、組織障害が誘導される。そ こで、我々は、microRNA(miRNA)を利用してAd遺伝子の発現を抑制可能な新規Adベクターを 開発した。本年度は、本 Ad ベクターをマウスに静脈内投与し、マウス肝臓におけるAd 遺伝子の発 現および肝障害マーカーを検討した。
A.研究目的
Ad ベクターを生体に投与すると、自然免疫応 答 に よ っ て I 型 Interferon (IFN) や Interleukin (IL)‑6、IL‑12 などの炎症性サイ トカインの産生および抗原提示細胞の活性化が 引き起こされ、その結果、Ad ベクターや搭載遺 伝子に対する抗体産生や細胞傷害性 T 細胞の誘 導といった獲得免疫応答が誘導される。これら の免疫応答は Ad ベクターによる遺伝子治療の 大きな障壁となっており、免疫応答の回避が重 要な検討課題となっている。さて、Ad ベクター により誘導される自然免疫応答の活性化には myeloid differentiation factor 88 (MyD88) や IFN‑β promoter stimulator‑1 (IPS‑1) が関与 することが報告されているが、これら以外の分 子を介した活性化経路も示されており、免疫応 答の活性化メカニズムは未解明な部分も多い。
また、自然免疫を活性化させる Ad ベクター側の 因子としては、ウイルス構成タンパク質である カプシドタンパク、Ad ベクターのゲノム DNA や non‑coding RNA といった核酸が挙げられる。
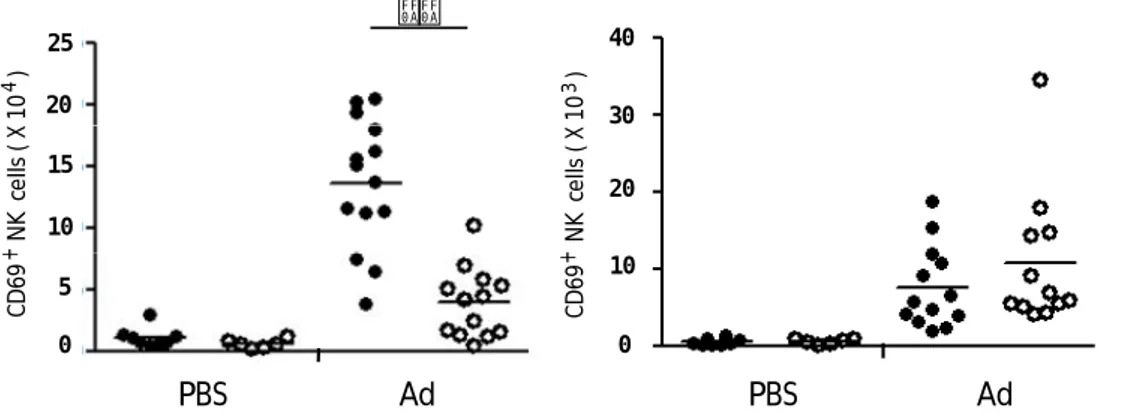
種々の細胞質内核酸センサーの下流に共通に存 在するシグナル分子で TANK‑binding kinase1 (TBK1)、TBK1 の欠損によりウイルス由来の核酸 による自然免疫シグナルが遮断される。そこで 本研究では Ad ベクター由来核酸が生体での免
疫応答に与える影響を検討するため、細胞質の 核酸認識シグナルに焦点をあて、Ad ベクター投 与後の生体免疫応答における TBK1 の機能を解 析することとした。
一方、非増殖型 Ad ベクターは、自己増殖に必 須の E1 遺伝子を欠損させることで、理論上 Ad 遺伝子が発現しないよう設計されている。しか しながら Ad ベクター作用後、わずかに Ad タン パク質が発現することにより、Ad タンパク質に 対する細胞性免疫や Ad タンパク質そのものに よる組織障害が誘導され、遺伝子発現が徐々に 減弱することが問題となっている。そこで我々 は昨年度、microRNA(miRNA)を利用して、Ad ベクター作用後の Ad 遺伝子の発現を抑制可能 な新規 Ad ベクターを開発した。本年度は、マウ スにおける本 Ad ベクターの機能解析を行った。
B. 研究方法
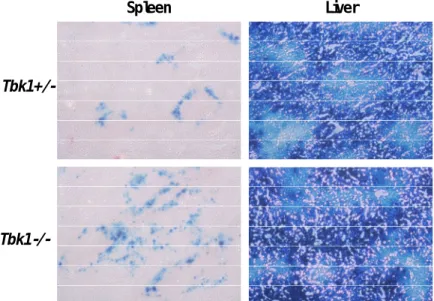
B‑1. TBK1ノックアウトマウスにおけるAdベ クターによる遺伝子発現効率
Ad ベクター投与後の TBK1 の機能を明らかに するため、TBK1 ノックアウト(KO)マウスを用い た。モデル遺伝子として LacZ を搭載した Ad ベ ク タ ー (5 × 1010 Vector Particle (VP) /mouse)を静脈内投与し、2日後の脾臓と肝臓で の搭載遺伝子発現について X‑gal 染色により検