平成
25 年度新潟薬科大学薬学部卒業研究Ⅱ
リシンのリチウム付加イオン生成を用いた
MALDI 過程の新規モデル構築と検証
Model verification for the MALDI process based on Lithiated Lys yield
薬品物理化学研究室
6 年
08P013
永高 幸
要 旨
MALDI(マトリックス支援レーザー脱離イオン化)法は、多くがアミノ酸から構 成される生体分子の定性分析に用いられてきた。さらに近年、定量分析の手法として も着目されてきている。しかしながら、MALDI 法を用いた定量分析技術が一般に利 用されるに至るには、未だ完全には理解されていないMALDI 法のイオン化メカニズ ムを解明し、問題点を解決していく必要がある。本研究では、Lys と LiCl 及び 3 種 類のマトリックス剤(CHCA、DHB、SA)を用いて、LiCl の濃度を変化させながら MALDI-MS スペクトルの測定を行い、LysH+、LysLi+、MH+及びMLi+(M はマトリックス剤)の強度の定量的解釈を試みた。旧モデルと比較した場合、一致する濃度 領域としない領域が存在したため、仮定部分を除いた新モデルを用いて検証する必要 が生じた。新モデルを用いて検証を行った結果、どのマトリックス剤を用いた場合で も傾きは一致し旧モデルにおける逸脱が補正された。一方、ΔG に関わる絶対値にお いてモデルとの不一致が見られた。ΔG1に現在最も信頼できるGB の値を用い、最適 なΔG2を求めたところ、誤差は計算精度の向上により縮まると考えられた。また、用 いた新モデルに仮定部分が存在するため、誤差が生じている可能性も示唆された。
キーワード
1.MALDI 2.リシン 3.CHCA 4.DHB 5.SA 6.リチウム付加イオン 7.プロトン移動 8.熱平衡 9.レーザー照射 10.気相塩基性度 11.付加エネルギー目 次
1.はじめに ・・・・・・・・・・・・・・・・・・・・・・・ 1 2.理論モデル ・・・・・・・・・・・・・・・・・・・・・・ 3 3.量子化学計算 ・・・・・・・・・・・・・・・・・・・・・ 4 4.実験 ・・・・・・・・・・・・・・・・・・・・・・・・・ 7 5.結果 ・・・・・・・・・・・・・・・・・・・・・・・・・ 8 ⅰ)Lys/LiCl/CHCA ⅱ)Lys/LiCl/DHB ⅲ)Lys/LiCl/SA 6.考察 ・・・・・・・・・・・・・・・・・・・・・・・・・ 14 7.結論 ・・・・・・・・・・・・・・・・・・・・・・・・・ 16 謝 辞 ・・・・・・・・・・・・・・・・・・・・・・・・・・ 18 引用文献 ・・・・・・・・・・・・・・・・・・・・・・・・・ 191
論 文
1.はじめに MALDI(マトリックス支援レーザー脱離イオン化)法は、生体分子など高分子 量で熱に不安定な化合物を分解せずにソフトにイオン化することができる。生体分 子の多くは主にアミノ酸で構成されており、MALDI 法はそれらの定性分析に用い られてきた。さらに近年、定量分析の手法としても着目されてきている。しかしな がら、MALDI 法を用いた定量分析技術が一般に利用されるに至るには、未だ完全 には理解されていないMALDI 法のイオン化メカニズムを解明し、問題点を解決し ていく必要がある。 MALDI 法のプロセスは、「レーザー照射による脱離過程」、「レーザー光による 一次イオン化過程(マトリックス剤のイオン化)」、「イオン分子反応による二次イ オン化過程(試料のイオン化)」の三段階に分けることができる1。「レーザー照射 による脱離過程」では、測定対象物質とマトリックス剤(光吸収物質)の混合試料 にレーザーを照射することにより、マトリックス剤が熱を吸収し気化して気相中に 放出される。放出された混合試料は、MALDI プルームと呼ばれる分子集団を形成 する。 次に「レーザー光による一次イオン化過程」では、MALDI プルーム内で マトリックス剤がイオン化され、プロトン化マトリックス(MH+)とラジカルカ チオン(M+)が生成する2,3。そして、プロトン化マトリックス(MH+)と測定対 象物質(A)の間で、分子間反応によりサンプル分子がイオン化される、「イオン 分子反応による二次イオン化過程」が起きる。この過程では主に、カチオン化サン プル分子([A+C]+)、ラジカル化サンプル分子(A+・)、プロトン化サンプル分子 (AH+)の3 種類の正イオンが形成される。MALDI-MS スペクトルでは、プロト ン化サンプル分子(AH+)が主に観測されるため、プロトン移動反応(1)が重要 だと考えられる。 A MH++ ⇄M+ AH+ (1) 式(1)の反応は MALDI プルーム内で熱平衡状態に達し、AH+の生成量は測定2 マトリックス分子のGB に対して測定対象試料の GB が大きいとき、式(1)の平 衡は右に傾くためAH+の生成量は増大する。 Kinsel らは 5 種のアミノ酸(Gly、Ala、Val、Ile、Phe)について、マトリック ス剤にα-シアノ-4-ヒドロキシケイ皮酸(CHCA)を用いて MALDI スペクトルを 測定し、このプロトン化モデルを立証した5。アミノ酸のGB が高いほどそのプロ トン化アミノ酸の生成量が増加するという相関関係から、MALDI プルーム内では マトリックス剤とアミノ酸のプロトン化反応が起こっており、熱平衡状態になって いると結論付けた。同様に、西風と高山は20 種類のアミノ酸を対象にアミノ酸の プロトン親和力PA(proton affinity)とプロトン化生成の相関性について研究し た6。この研究ではLys のみがその相関性から外れることがわかったが、その原因 については言及されていない。その後、柘植と星名は20 種類のアミノ酸とマトリ ックス剤にCHCA と 2,5-ジヒドロキシ安息香酸(DHB)を用いて、幅広い混合比 についてMALDI スペクトルを測定し、プロトン化モデルの検証を行った7。その 結果、3 つのアミノ酸(Arg、His、Lys)は GB から予想されるよりもプロトン化 されにくく、原因として塩基性アミノ酸のアミノ基とカルボキシ基の分子内結合と、 MALDI プルーム中でのアミノ酸の両性イオンと標準的な形の違いによる実効的 なGB によるものだと推測した。さらにアミノ基とカルボキシル基の共存によるプ ロトン化の影響を観察するため、11 種類のアミノ酸をメチルエステル化し、CHCA で測定した。その結果、9 つのアミノ酸試料とマトリックス剤の MALDI スペクト ルのシグナル強度比[AH+]/[MH+]とそのメチルエステルのシグナル強度比 [AOMeH+]/[MH+]は誤差範囲内で一致した。しかし2 つのアミノ酸(His、Lys) のシグナル強度比は一致せず、それぞれのアミノ酸メチルエステルはアミノ酸の熱 平衡プロトン化モデルの回帰直線に近付いた。この結果から、His/CHCA と Lys/CHCA においてアミノ基とカルボキシ基の共存によって HisH+とLysH+の形
成が抑制されたと考えられるが、そのはっきりとした原因は不明である。
本論文ではLys と塩化リチウム、及び CHCA、DHB、シナピン酸(SA)といっ た3 種類のマトリックス剤を用いて測定を行った。理論モデルとの不一致には、仮 定部分の存在が原因であると考えられるため、それを省くことのできる新しいモデ ルが必要となる。そこで新しいモデルとしてLi+を用い、検証を行った。
3 2.理論モデル 2-1.プロトン付加イオン生成モデル 測定対象のアミノ酸(A)及びマトリックス剤(M)からなる試料より生成する MALDI プルーム中では、次の反応が起きると考えられる。 A MH++ ⇄ M+ AH+ (1) この反応はMALDI プルーム中で平衡状態に達しているため、反応式(1)につ いて以下の関係が得られる。 A � MH AH � M K + + = (2) RTlnK G =− ∆ (3) ここでΔG は Gibb’s エネルギー変化、R は気体定数、T は MALDI プルームの 温度を示す。次に(2)(3)式より、以下の関係が得られる。 RT G M A ln MH AH ln + = −∆ + (4) MALDI プルーム中ではほとんどが中性分子のため、A≫AH+、M≫MH+と考え られている。すなわち、以下の式のようにMALDI プルーム中での濃度比は初濃度 比と近似することができる。 M A MH M AH A M A 0 ≈ + + + + = + + (5) 式(4)と(5)より、 RT G M A ln MH AH ln 0 ∆ − = + + (6) の関係が得られる。 2-2.リチウム付加イオン生成モデル Lys/Li/M 系においては、 Lys MH+ + ⇄M+ LysH+ (7) Lys MLi+ + ⇄M+ LysLi+ (8) の反応が起きていると考えられ、式(7)と(8)よりそれぞれ、以下の式が求めら れる。
4 Lys � MH LysH � M K1 + + = (9) Lys � MLi LysLi � M K2 + + = (10) RT ΔG M Lys ln MH LysH ln = − 1 + + (11) RT ΔG M Lys ln MLi LysLi ln = − 2 + + (12) 式(11)と(12)より、 RT ΔG RT ΔG MLi LysLi ln MH LysH ln − =− 1 + 2 + + + + RT ΔG ΔG MLi LysLi ln MH LysH ln = + 2 − 1 + + + + (13) また、ΔG1はLys と M の GB、ΔG2はLys と M の Li+付加エネルギーG(LysLi+)
とG(MLi+)を用いて、それぞれ以下の関係が得られる。 GB(Lys) GB(M) ΔG1 = − (14) ) GB(LysLi ) G(MLi ΔG2 + + − = (15) すなわち式(13)は、式(14)及び(15)を用いて以下のように表すことがで きる。
(
) (
)
(
)
(
( )
( )
)
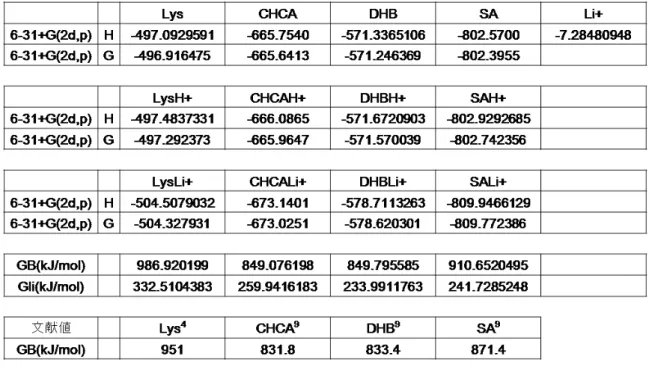
RT Lys GB M GB LysLi G MLi G MLi LysLi ln MH LysH ln = + − − − + + + + + + (16) 3.量子化学計算 前節式(16)の切片に必要な物理量を、量子化学計算によって求めた。量子化学 計算を行うにあたってGaussian098を使用した。構造計算は、試料(A)、プロト ン化Lys(LysH+)、リチウム付加Lys(LysLi+)、マトリックス(M)、プロトン化 マトリックス(MH+)、リチウム付加マトリックス(MLi+)を対象として、密度汎関数法(Density Functional Theory:DFT)の B3LYP 法を用いて、基底関数 6-31+G (2d,p)レベルで、構造最適化を行った。さらに、得られた構造の振動計算を行い、
5
標準状態(298K)におけるギブス自由エネルギー(G)の値を求め、その値に 2625.5 を乗じて(Hartree)から(kJ/mol)に変換した。
これらの得られたギブス自由エネルギー(G)の値を用いて、プロトン化マトリ
ックス(MH+)からLys への H+付加エネルギー(気相塩基性度:GB)、リチウム
付加マトリックス(MLi)から Lys への Li+付加エネルギー(GLi)を計算した。
(表1)
GB については最も信頼できる値を表 1 に示した。しかし、GLi については文献 値がなく、全てを同じ土俵で計算しなければ誤差が大きくなるため、GLi と同じ計 算レベルで得られたGB を用いた。
6
Lys LysH+ LysLi+ Li
CHCA CHCAH+ CHCALi+
DHB DHBH+ DHBLi+
SA SAH+ SALi+
7 4.実験 4-1.マトリックスと試料と溶媒の購入 MALDI マトリックス(CHCA、DHB、SA)とアミノ酸(Lys)、LiCl は和光純 薬から購入した。溶媒(超純水、アセトニトリル、0.1%トリフルオロ酢酸)は和 光純薬から購入した。 4-2.MALDI 試料調整
Lys をアセトニトリル:超純水=1:1 で溶解して 10μmol/mL とし、LiCl は超 純水で100×10-4~100μmol/mL に調整した。CHCA はアセトニトリル/0.1%トリフ
ルオロ酢酸:超純水=1:1、DHB は超純水、SA はアセトニトリル/0.1%トリフル オロ酢酸:超純水=7:3 でそれぞれ 50μmol/mL に調整した。
本研究におけるMALDI 試料は Dried-Droplet 法により調整した。Lys と LiCl を1:1 で混合した試料 1μL と、3 種類のマトリックス剤(CHCA、DHB、SA)1μL をターゲットプレートに滴下し、自然乾燥することによってMALDI 試料を作成し た。また、濃度比はLys/LiCl/M=5/50×10-4~50/50 となるようにし、MALDI 試料 をそれぞれ3 つずつ調整した。同様に LiCl/M=50×10-4~50/50 となる MALDI 試 料も調整した。 4-3.MALDI-MS の測定法 MALDI-MS スペクトルは、MALDI-TOF(time-of-flight)スペクトロメーター (Autoflex Ⅲ、Bruker Daltonics)により測定した。測定は 19kV の加圧電圧でリ フレクションモードによって行い、2000 レーザーショット(355nm、<100μJ、 200Hz)を積算することでそれぞれのスペクトルを得た。MALDI 試料の結晶が不 均一であることによってシグナルにばらつきが生じるため、10 レーザーショット 毎に照射スポットをランダムに移動させた。また、1 つの条件で合計 15 回スペク トルを測定し、信号強度の平均値を求めて誤差を見積もった。
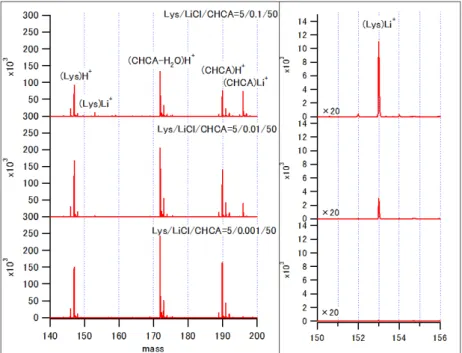
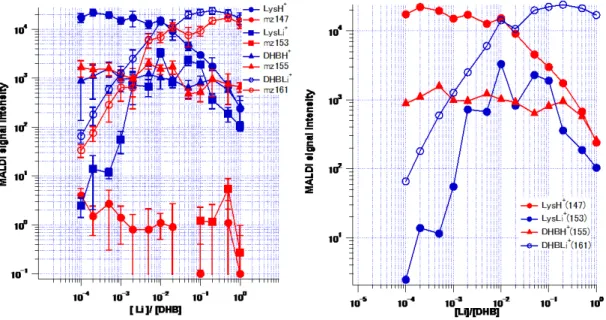
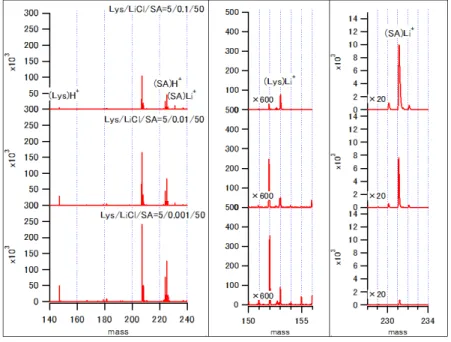
8 5.結果 ⅰ)Lys/LiCl/CHCA 図2 は、Lys/LiCl/CHCA の MALDI-MS スペクトルを示す。マトリックス剤で あるCHCA 由来のピークとして、プロトン化 CHCA(CHCAH+ m/z=190)、リ チウム化CHCA(CHCALi+ m/z=196)、CHCA のフラグメンテーションに由来
するピークとして(CHCA-H2O)H+ m/z=172 が観測された。Lys 由来のピーク
としては、プロトン化Lys(LysH+ m/z=147)とリチウム化 Lys(LysLi+
m/z=153)が観測された。LiCl 濃度の増加に伴い、CHCALi+とLysLi+は増加し、
CHCAH+とLysH+はわずかに減少した。
図2 Lys/LiCl/CHCA の MALDI-MS スペクトル
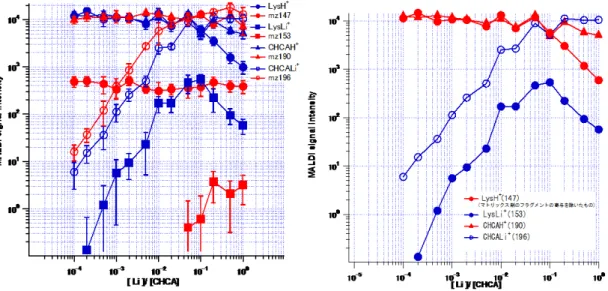
次に、各種濃度に対して測定したMALDI-MS スペクトルからの信号強度を読 み取り、横軸LiCl/CHCA に対してプロットした(図 3)。LiCl/CHCA が 10-4~10-1
の間ではCHCALi+とLysLi+は増加したが、その後CHCALi+は一定、LysLi+は減
少した。また、CHCAH+とLysH+はLiCl/CHCA が 10-4~10-1の間ではほぼ一定値
9
図3 Lys/LiCl/CHCA におけるシグナル強度の Li 濃度依存性
(左):Lys/LiCl/CHCA における LysH+、LysLi+、CHCAH+、及びCHCALi+のシグナル(青)、及
びLiCl/CHCA において対応する m/zに観測されたシグナル(赤)をプロットしたもの(右):m/z=147 のCHCA のフラグメントの寄与を差し引いて LysH+、LysLi+、CHCAH+、及びCHCALi+のシグナ
ルをプロットしたもの
また、LiCl/CHCA に対して LysH+/CHCAH+とLysLi+/CHCALi+をそれぞれプロ
ットしたところ(図4)、LiCl/CHCA が 10-4~10-1の間ではほぼ一定値を示し、式 (11)及び(12)と一致した。すなわち、Lys/CHCA が混合比と等しいという仮 定が成立している。しかし、それ以上では減少しモデルから外れるため、その仮定 が成立しないことを示している。つまり、Lys/M≪(Lys/M)0となっており、Lys の脱離量が減っている。したがって、仮定部分を除いた新モデルを用いて検証する 必要がある。
10
図4 LiCl/CHCA に対する LysH+/CHCAH+とLysLi+/CHCALi+のプロット
ⅱ)Lys/LiCl/DHB
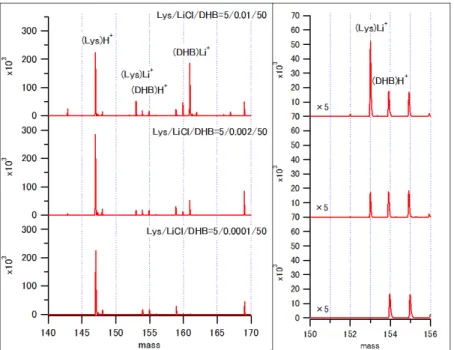
図5 は、Lys/LiCl/DHB の MALDI-MS スペクトルを示す。マトリックス剤で あるDHB 由来のピークとして、プロトン化 DHB(DHBH+ m/z=155)、リチウ
ム化DHB(CHCALi+ m/z=161)が観測された。Lys 由来のピークとしては、プ
ロトン化Lys(LysH+ m/z=147)とリチウム化 Lys(LysLi+ m/z=153)が観測
された。LiCl 濃度の増加に伴い、DHBLi+とLysLi+は増加し、DHBH+とLysH+
はほぼ一定値を示した。
11
次に、各種濃度に対して測定したMALDI-MS スペクトルからの信号強度を読 み取り、横軸LiCl/DHB に対してプロットした(図 6)。LiCl/DHB が 10-4~10-2
の間ではDHBLi+とLysLi+は増加したが、その後DHBLi+は一定、LysLi+は減少
した。また、LysH+はLiCl/DHB が 10-4~10-2の間ではほぼ一定値を示したがその
後減少し、DHBH+は常にほぼ一定となった。
図6 Lys/LiCl/DHB におけるシグナル強度の Li 濃度依存性
(左):Lys/LiCl/DHB における LysH+、LysLi+、DHBH+、及びDHBLi+のシグナル(青)とLiCl/DHB
において対応するm/z に観測されたシグナル(赤)をプロットしたもの(右):LysH+、LysLi+、
DHBH+、及びDHBLi+のシグナルをプロットしたもの
また、LiCl/DHB に対して LysH+/DHBH+とLysLi+/DHBLi+をそれぞれプロット
したところ(図7)、LiCl/DHB が 10-4~10-2の間ではばらつきはあるものの、ほぼ
一定とみなすことができ、式(11)及び(12)と一致した。しかし、それ以上で は減少しモデルから外れるため、仮定部分を除いた新モデルを用いて検証する必要 がある。
12
図7 LiCl/DHB に対する LysH+/DHBH+とLysLi+/DHBLi+のプロット
ⅲ)Lys/LiCl/SA
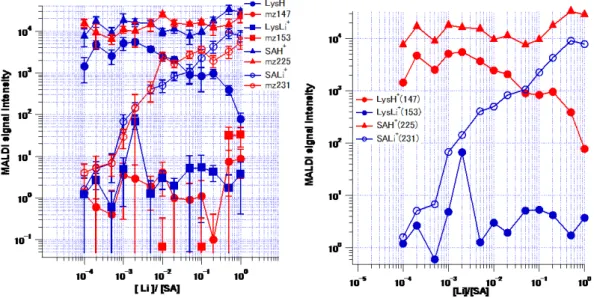
図8 は、Lys/LiCl/SA の MALDI-MS スペクトルを示す。マトリックス剤であ るSA 由来のピークとして、プロトン化 SA(SAH+ m/z=225)、リチウム化 SA
(SALi+ m/z=231)が観測された。Lys 由来のピークとしては、プロトン化 Lys
(LysH+ m/z=147)とリチウム化 Lys(LysLi+ m/z=153)が観測された。LiCl
濃度の増加に伴い、SALi+は増加し、LysH+は減少、SAH+とLysLi+はほぼ一定値
を示した。
13
次に、各種濃度に対して測定したMALDI-MS スペクトルからの信号強度を読 み取り、横軸LiCl/SA に対してプロットした(図 9)。SALi+は常に増加し、LysLi+
はばらつきはあるがほぼ一定値を示した。また、LysH+はLiCl/DHB が 10-4~10-1
の間ではほぼ一定値を示したがその後減少し、SAH+は常にほぼ一定となった。
図9 Lys/LiCl/SA におけるシグナル強度の Li 濃度依存性
(左):Lys/LiCl/SA における LysH+、LysLi+、SAH+、及びSALi+のシグナル(青)とLiCl/SA に
おいて対応するm/z に観測されたシグナル(赤)をプロットしたもの(右):LysH+、LysLi+、SAH+、
及びSALi+のシグナルをプロットしたもの
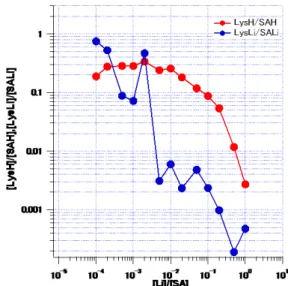
また、LiCl/SA に対して LysH+/SAH+とLysLi+/SALi+をそれぞれプロットした
ところ(図10)、LiCl/SA が 10-4~10-1の間ではLysH+/SAH+はほぼ一定値をとり、
式(11)と一致したが、それ以上では減少しモデルから外れた。しかし、LysLi+/SALi+
14
図10 LiCl/SA に対する LysH+/SAH+とLysLi+/SALi+のプロット
6.考察 量子化学計算より得た値とR=8.31J/K・mol、T=1500K を用いて式(16)から 求めたモデルと、実験値との比較を行った。 Lys/LiCl/CHCA では実験値の傾きは 1 とみなせ、モデルと一致した。しかし、 切片はモデルよりも大きい値を示した。(図11)すなわち、図 3 において LiCl 濃 度上昇に伴い傾向が減少に転じているが、図11 では新モデルにてその変化が見ら れない。このことは、図3 の変化は(A/M)=(A/M)0の近似に帰着していること を示唆していると同時に、新モデルの有効性を示している。 図11 新モデルとの比較(Lys/LiCl/CHCA)
15 同様にLys/LiCl/DHB においても実験値の傾きは 1 とみなせ、モデルと一致し た。しかし、切片はモデルよりも小さい値を示した。(図12) 図12 新モデルとの比較(Lys/LiCl/DHB) また、Lys/LiCl/SA においても実験値の傾きは 1 とみなせ、モデルと一致した。 しかし、切片はモデルよりも小さい値を示した。(図13) 図13 新モデルとの比較(Lys/LiCl/SA)
16 どのマトリックス剤を用いた場合でも、ばらつきはあったが傾きは1 となり、新 モデルの有効性を示している。しかし切片はどの場合も一致しなかった。可能性と して、量子化学計算の精度の問題が考えられる。 ΔG1に、3 節で示した現在最も信頼できる値を用いたモデルと、実験値を一致さ せるためにはΔG2をいくつにするべきか考えた。(図11、12、13)Lys/LiCl/CHCA では量子化学計算から求めた場合ΔG2=-72.6kJ/mol となったが、最適と考えられ
る値はΔG2=-82kJ/mol であり、約 10kJ/mol の誤差があった。Lys/LiCl/DHB で
は量子化学計算から求めた場合ΔG2=-98.5kJ/mol となったが、最適と考えられる
値はΔG2=-58kJ/mol であり、約-40kJ/mol の誤差があった。Lys/LiCl/SA では
量子化学計算から求めた場合ΔG2=-87.6kJ/mol となったが、最適と考えられる値 はΔG2=-30kJ/mol であり、約-57kJ/mol の誤差があった。これらの誤差は、量 子化学計算の精度を上げていけば縮まる可能性は大いにあると考えられる。 また、図11、12、13 では傾き 1 の直線にのらない群がある。それらは Li+濃度 が低い条件のものである。そのずれの理由の一つとして、式(13)は同じ領域で生 成されると仮定した上で成立するため、式(7)及び(8)が完全に同じ領域で起こ っていないとしたら、式(11)と式(12)の ln(Lys/M)を打ち消すことができ ない。リチウム付加体が生成する領域とそれ以外の領域において、Lys/M が異なる 可能性がある。その場合、式(7)と(8)で Lys/M 値を打ち消すことができずに 残った値が、式(13)の切片に乗る可能性が考えられる。 7.結論
本研究では、Lys と LiCl 及び 3 種類のマトリックス剤(CHCA、DHB、SA) を用いて、LiCl の濃度を変化させながら MALDI-MS スペクトルの測定を行った。
Lys/LiCl/CHCA 及び Lys/LiCl/DHB では、LiCl/M が 10-4~10-1または10-4~10-2
の間ではほぼ一定値を示し、式(11)及び(12)といった旧モデルと一致したが、 それ以上の濃度ではモデルから外れた。(図4、7)また、Lys/LiCl/SA の場合は LiCl/SA が 10-4~10-1の間ではLysH+/SAH+はほぼ一定値をとり、式(11)と一致
したが、それ以上では減少しモデルから外れた。しかし、LysLi+/SALi+はLiCl 濃
度の増加に伴って減少し、式(12)には従わなかった。(図 10)したがって、仮定 部分を除いた新モデルを用いて検証する必要が生じた。
17 しかし、式(16)から求めた新モデルを用いて検証を行った結果、どのマトリッ クス剤を用いた場合でも傾きは一致したが、切片は一致しなかった。可能性として、 量子化学計算の精度の問題が挙げられた。ΔG1に現在最も信頼できるGB の値を用 いたモデルと、実験値を一致させるためにはΔG2をいくつにするべきか考えた。(図 11、12、13)どのマトリックス剤の場合でも誤差は生じたが、量子化学計算の精 度を上げていけば縮まる可能性は大いにある値だと考えられる。 また、式(13)は同じ領域で生成されると仮定した上で成立するため、式(7) 及び(8)が完全に同じ領域で起こっていないとしたら、式(11)と式(12)の ln (Lys/M)を打ち消すことができない。その場合、打ち消すことができずに残った 値が式(13)の切片に乗り、値が変化することになる。このような知見は、結晶化 と信号強度の関係を解明する上で有用である。 また、今後量子化学計算の精度をさらに上げ、式(7)及び(8)がどの領域で起 こっているのかを追及していく必要がある。また、今回はLys を用いて実験を行っ たが、その他のアミノ酸でもデータを集め検討していくことによって、切片のよう な不確定的な値を実験的に決定できる可能性もある。そこから新モデルを確立でき れば、MALDI 内で起きている現象が定量的に説明できるだろう。
18
謝 辞
本研究を進めるにあたり、ご指導下さった新潟薬科大学薬学部 薬品物理化学研 究室 教授 星名賢之助先生に深く感謝いたします。また、量子化学計算にあたり ご協力下さった新潟薬科大学 薬品物理化学研究室 助手 城田起郎先生に深く 感謝いたします。19
引 用 文 献
1. Knochenmuss,R, Analyst 131,966(1996)
2. Wang B.H., Dreisewerd K., Bahr U., Karas M., Hillinkamp F., J.Am.Soc.Mass Spectrom. 4,393(1993)
3. Lio P.-C., Allison J. J.Mass Spectrom. 30,408(1995)
4. Harrison A.G. Chemical Ionization Mass Spectrometry. CRC Press: Bcoca Raton,(1992)
5. G.R.Kinsel et al., Eur.J.Mass Spectrom. 12, 359 (2006)
6. Nishikaze,T and Takayama,M, Rapid Comm Mass Spectrom. 20, 376 (2006).
7. Tsuge,M, Hoshina,K, Investigation ofProtonation Efficiency for Amino Acids in Matrix-Assisted Laser Desorption/Ionization, Bull. Chem. Soc. Jpn 83, 1188(2010)
8. Frisch, M. J. T., G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, Jr., J. A.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, N. J.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.;
Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, Ö.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J. , Gaussian 09, Revision A.1. Gaussian, Inc.: Wallingford CT,(2009)
20