一12一 食 物 学 会 誌 ・第44号
研 究 報 告
VMOIの
キ モ ト リ プ シ ン 断 片 の ア ミ ノ酸 配 列
金
喜
美
Amino Acid Sequence Analysis of Chymotryptic Fragments of VMOI
Kim Fimi
は じ め に
鳥 類 の 卵 黄 膜(vitelline membrane)は,機 械 的 な 損 傷 か ら卵 を 保 護 した り多 受 精 に対 す る障 壁 を つ く る機 構 を 持 つ1)。 この膜 は,構 成 成 分 の異 な る 内 層(Lami-na pervitelli層(Lami-na)と 外 層(La mi層(Lami-na extravitelli層(Lami-na)の2層 か ら成 り,内 層 はGP-1,GP¶, 'IIと 呼 ば れ る 3種 類 の 糖 タ ンパ ク質 を 含 む2^・4)。外 層 で は,オ ボ ム シ ンと 思 わ れ る 糖 タ ンパ ク質 が 骨 格 繊 維 を 形 づ くっ て お り,こ の 骨 格 に 水 可 溶 性 の タ ンパ ク質 で あ る リ ゾ チ ー ム と本 研 究 の テ ー マ で あ るvitelline membrane outer I(VMOI)と い う タ ンパ ク質 が 吸 着 して い る こ と が 明 らか に さ れ た5・6)。 リゾ チ ー ム は溶 菌 活 性 を 持 つ 古 くか ら知 られ た 酵 素 で あ り,N一 ア セ チ ル グ ル コ サ ミン重 合 体 の 加 水 分 解 を 行 な う分 解 活 性 とそ の逆 反 応 と考 え られ る糖 転 移 反 応 を 触 媒 す る能 力(合 成 活 性)が あ る。 基 質 と の結 合 に は6個 あ るTrp残 基 の う ち少 な く と も3個 が 重 要 な 役 割 を 果 た して い る こ とが 立 体 構 造 の解 析 か ら明 ら か に さ れ て い る7)。一 方VMOIはBackら に よ って 初 めて 発 見 され,特 に活 性 を 持 た な い 単 純 タ ンパ ク質 と して報 告 さ れ た5)。 しか し最 近,木 戸 らに よ って, VMOIは リゾ チ ー ム様 活 性 を 持 つ こ と が 見 い 出 さ れ8),そ の 分 解 活 性 は リゾ チ ー ム と 比 べ て 数%以 下 で あ る が,合 成 活 性 は む しろ 高 い とい う結 果 が 得 られ て 京 都 女 子 大 学 家 政 学 部 食 物 学 科 栄 養 学 第3研 究 室, 京 都 市 東 山 区 今 熊 野 北 日 吉 町35
Department of Food Science, Kyoto Women's
University, Higashiyamaku, Kyoto 605
い る(木 戸 私 信,1989)。VMOIは, N末 端 の ア ミノ 酸 配 列,分 子 量,等 電 点 な ど 化 学 的 諸 性 質,円 二 色 性 ス ペ ク トル な どの 分 光 学 的 諸 性 質 が,リ ゾ チ ー ム と は 大 き く相 違 して お り,リ ゾ チ ー ム と は触 媒 機 能 の 発 現 機 構 が 全 く異 な って い る 可 能 性 が 考 え られ る 。 も し VMOIが リゾ チ ー ム 活 性 を持 つ とす れ ば, VMOIの 活 性 部 位 は リゾ チ ー ム活 性 部 位 と ど の よ うな 相 同性 を 示 す の だ ろ うか 。 本 実 験 で は,リ ゾ チ ー ム 活 性 に 関 与 して い るTrpに 注 目 し,芳 香 族 ア ミノ酸 の カ ル ボ キ シ ル 基 側 を 切 断 す る キ モ ト リプ シ ンを 用 い て 得 た 断片 の 配 列 を 調 べ る こ と に した 。 ま た,一 次 構 造 決 定 の 際, 手 動 式 エ ドマ ン法 を 中心 に 用 い た の で,そ の 実 験 法 の 詳 細 に つ い て も述 べ る。
方
法
1.VMOIの 精 製9) (1)卵黄 膜 の 可 溶 成 分 の抽 出 卵 黄 膜 は,温 度 が 上 が る と外 層 の 剥 離 やVMOIの 膜 か らの 解 離 が起 こ る の で10),卵 黄 膜 を と りだ す ま で の 一 連 の 操 作 は4℃ で 行 な い,操 作 時 間 は1枚 あ た り 4分 以 内 とす る 。 ニ ワ トリの 新 鮮 卵 を 割 卵 し,卵 黄 を分 離 し,1% NaClの 入 った シ ャー レ に入 れ る 。 卵 黄 膜 の 表 面 に 残 って い る カ ラザ や 卵 白を 注 意 深 く取 り除 く。 シ ャ ー レ の 食 塩 水 を2∼3回 交 換 して 卵 黄 を す す い だ 後,膜 に 穴 を あ け 中 の卵 黄 を 取 りだ す 。 ピ ンセ ッ トで 膜 を つ ま み 食 塩 水 で 卵 黄 を 洗 い流 す 。 こ の 操 作 を2∼3回 操 り 返 し,白 い 膜 の み に な った ら,キ ム ワイ プ で 水 分 を と り,卵1個 に対 して1.5mlの10%NaClを 用 い て 室平成元年12月(1989年) 温で1"-'2時間浸す。膜を取り除いたものが卵黄膜可 溶成分抽出液である。この10局 NaClによる浸漬で卵 黄膜外層成分が特異的に抽出される乙とは,木戸らに よって見いだされているの。 (2)イオン交換クロマトグラフィー 上記のようにして得られた卵黄膜可溶成分抽出液を, 0.1 M 酢酸緩衝液 (pH4. 6)に 40 Cで透析する。生じ た沈殿はろ過してとり除く。 抽出成分の分離は, 陽イオン交換体である CM-ト ヨパール650Mを使用し, 1. 6 cm
x
25 cmのカラムを 用いる。約50個の卵から得た 75.0mlの抽出液をカラ ムにのせ, O.lM酢酸緩衝液 (pH4.6)でカラムを洗 浄する。 VMOIの溶出は同緩衝液中で 0.25-0.35M NaCl (各200ml)の直線的塩濃度勾配をかけて行なう。 タンパク質の溶出は 280nmの紫外線吸収により確認 し,分画した VMOI は,水透析後,凍結乾燥して冷 凍保存する。 VMOIの純度は, SDS*ーポリアクリル アミド電気泳動により確認する11)。2
.
還元力ルボキシメチル化12) 凍結した VMOI(500μg)を 1mlの 8 M尿素, 25 m Mエチレンジアミン四酢酸ナトリウム (pH8
.
0
)
溶 液で溶かす。乙れに2-メlレカプトエタノーノレを 6mM になるように加えて, 8時間室温で放置する。その後 遮光しながら 1N-NaOH に溶かしたモノヨード酢酸 (1. 5M)を加えて 12mM!こする。この時, pHが下が るので 6N-NaOHで pHを8.5に保つ。暗所で30分 間放置後,脱塩のため水透析する。3
.
アミノ酸分析 試料 (0.1,,-,5.0nmol)を, 6N一塩酸にとかし加水分 解用試験管に入れて完全に脱気し封管後, 1000 C 24時 間で加水分解を行なう。還元カjレボキシメチノレ化した VMOI については24時間に加えて 48時間の加水分解 も行なう。反応終了後,酸を完全に除去し0.2N-塩酸 に溶かす。乙れをメンプレンフィノレターでろ過し,835 形日立高速アミノ酸分析計を用いて分析する口4
.
vl¥宣01のキモトリプシン消化 VMOIは還元カlレボキシメチjレ化により緩衝液で は不溶性となるので,未処理の VMOIを用いてキモ トリプシン消化を行なった。凍結乾燥した VMOI (750μg)を 0.1M トリス, 10 mMCaClz(pH 8. 0)の緩 衝液で,1.5mg/mlの濃度に溶かす。同緩衝液で溶か したキモトリプシンを VMOI溶液に加え反応を開始 させる(重量比, VMOI:キモトリプシン =100:1)。 反応温度は 250 C とし,消化時間は, 0.7.2.5,15時間と *SDS: ラウリJレ硫酸ナトリウム - 13-する。反応の停止には,最終濃度1.5mM になるよ うにエタノーノレに溶かしたフッ化フェニノレメチルスル ホン酸液 (0.1M)
を氷中で加える。 キモトリプシン 消化した VMOIは, 高速液体クロマトグラフィー (HPLC)によって分離する。5
.
キモトリプシン断片の分離 HPLCによる分離は,ウォーターズ社600多溶媒送 液システムに481型分光光度計及び740データモジュー lレの整備されたものを使用する。キモトリプシン消化 した VMOIは μBONDAPAKカラム (0.78X30 cm) で分離する。流速は 2.0ml/minである。ペプチドを 含んだ画分をあつめ,それぞれ凍結乾燥した後,試料 をO
.
15話トリフlレオロ酢酸水溶液でとかし, μBOND-ASPHEREカラム (0.39X 15 cm)を用いて再クロマ トグラフィーを行う。乙の時の流速は1.0 ml/minで ある。どちらのカラムの場合も溶出は溶液Aに対して 溶液 Bの濃度を直線的に上げていくことによって行う。 溶液A
はO
.1
勉トリフノレオロ酢酸水溶液で,溶液B
は 0.1箔トリフノレオロ酢酸アセトニトリル溶液である。 直線勾配は,試料によって異るが,溶液 Bの最終濃度 は30-40%の範囲にある。ペプチドの検出は通常 230 nmの紫外線吸収によるが, Trpを含むペプチドを確 認する時は 280nmの吸収も併わせて測定する。6
.
トリプトファン含量の測定13) 凍結乾燥した VMOIを 6Mグアニジン塩酸, 0.05 M 酢酸緩衝液(pH4. 6)に溶かし完全変性を行なう。 紫外吸収スペクトルを測定し, 280nmおよび 288nm におけるモル吸光係数を求める。トリプトファン誘 導体のモデル化合物を用いて得られた式, N=(ε288/ 3103)一(ε280/10318) に代入して VMOl1モノレあたり のTrpの数 (N)を求める。ここで ε2叫 ε280はそれぞ れ, 288nmおよび 280nmでの VMOIのモノレ吸光係 数であり, Cysに由来する吸収(S288= 73, S280 = 120)を 補正しである。 Cys含量は還元カノレボキシメチノレ化し た VMOIのアミノ酸分析結果より推定した。 VMOI の分子量は17,000と仮定し8〉,タンパク質濃度はアク チンを標準として色素結合法によって測定する14)。7
.
アミノ酸配列決定 アミノ酸配列は,手動式又は自動式エドマン法を用 いて決定する。 (1)手動式エドマン法 手動式エドマン法は,ペプチドの大きさによって2 つの方法に分ける。小さなペプチド(アミノ酸残基数 1 "-'15) にはパーティショニング法を,大きいペプチ ド(同10残基以上)およびタンパク質にはフィルム法-
14-を用いる。試料の量としては1
-
-
-
-
5
nmol が最適であ る。以下の方法は,小林と Tarr による一次構造決定 法に基づいている15)。 ①試料及び試薬の調製HPLC
に よ り 精 製 し た ペ プ チ ド を 試 料 と し て 用 いる。乙れを,0
.
1
~ちトリフノレオロ酢酸水溶液に溶 かしエドマン用試験管(
6
X
5
0
mm)に移し凍結乾燥し ておく。乙の時,回収率は予備実験より 50"'80~ちであ る。 試薬は,アミノ酸配列分析用に調製されたものを購 入する。酸を除いては,すべて窒素ガス下で保存する。 洗浄用および抽出用溶液(アセトンを除く)には,少 量のエタンチオールを加える。転換に用いる塩酸ーメ タノーノレ溶液は,混和して 2週間以上経たものは使用 しない。 ②パーティショニング法 a) カップリング カップリング混液の組成は,エタノーノレ:トリエチ ノレアミン:水:PITC*=7 :
1
:
1
:
1
である。始めにエ タノーノレとトリエチノレアミンと水を混合してねじ口試 験管に入れておき,専用のシリンジでPITC
を窒素ガ ス下で加える。乙の混合液は, 1分以内に使用する。 乾燥試料のはいったエドマン用試験管に1
0
μ
l
のカッ プリング用混液を加える。試験管をノイイアJレ(
2
5
ml) に移し,1
0
秒間窒素ガスを吹き込み,ふたをしてマン トルヒーター(
5
5
.
5
0 C)に入れ7
.
5
分間反応させる。反 応終了後,このパイアノレを真空装置につなぎ,5
5
.
5
0C
で加温したまま過剰の試薬を除く。減圧下で5分間以 上乾燥し続ける。配列分析を中断する際はとの段階で 停止する。 b)洗浄 土記で得られた乾燥試料に3
μ
l
の水を加え,混合後 遠心する。次に0
.
5
勉トリメチノレアミンを含んだへプ タン:酢酸エチノレの混合液(15:
1
)
を約2
0
0
μ
l
加え, サーモミキサーで約5
秒間撹持後遠心し(2000xG
,3
0
秒間),上層部を捨てる。さらに,へフ。タン:酢酸エチ ノレの混合液(
7
:
1
)
を約2
0
0
μ
l
加え,同じ操作を繰り 返す。洗浄のおわった試験管をパイアノレに入れ水流ア スピレーターで約 3分間乾燥した後,真空装置に接続 して完全に乾燥する。 c)切断 乾燥した試料に約1
0
μ
I
の濃塩酸をガラス製マイク ロピペットで加える。軽く振った後,パイアノレに入れ 窒素ガスを約5
秒間吹きつけ,ふたをし5
5
.
5
0C
で3
呼I
T
C
:
フェニノレイソチオシアン酸塩 食物学会誌・第4
4
号 分間加熱する。反応後,水流アスピレーターに約4
分 間接続した後,パイアル中に残っている酸臭気を窒素 ガスを吹きつけてとばす。次に真空装置に接続して完 全に乾燥する (6分間以上〉。 d)抽出 との乾燥物に3
μ
l
の水を加え,さらに4
0
μ
l
のへプ タン:酢酸エチル混液(1:5)を加え,サーモミキサ ーで撹持後,遠心し,上澄を新たに用意した試験管に 移す。乙の操作をもう一度繰り返した後,4
0
μ
l
の2
0
m Mヘキサフノレオロアセトンおよび16mMトリメチ ノレアミンを含むへプタン:酢酸エチノレ混液(1:5)を 加え同様に操作する。上層の抽出液および下層のペプ チドの入った試験管をパイアノレに入れ,水流アスピレ ーターに1
0
分間接続し,次に真空装置に接続して完全 に乾燥させる。下層の乾固物はアセトン約5
0
μ
I
で洗 浄後乾燥して次のエドマンサイクノレへ移す。 e)転換 上記の操作で得られた上層の乾因物l乙 濃 塩 酸 : メ タノーノレ混液(
1
:
1
0
)
を3
滴加え,パイアルに入れ, 窒素ガスを吹きつけ,ふたをして7l0C
で1
0
分間加熱 する。反応後,水流アスピレーターに約3分間接続し, 続いて真空装置で完全に乾固する。生成したフェニノレ チオヒダントインアミノ酸(PTH-
アミノ酸)はメタノ ールで溶かしHPLC
で分析する。 ③フィノレム法 a) 試料の調整 乾燥試料の入った試験管に1
0
μ
]
のトリフノレオロ酢 酸を加える。サーモミキサーで混和し,パイアルに入 れ水流アスピレーターに約1
0
分間接続後,窒素ガスで 酸臭気をとばし,さらに真空装置に接続し完全に乾燥 させる。この操作で管底に薄いタンパク質の膜が出来 る。洗浄操作(下記参照)を一度行なった後乾燥する。 とれにトリエチJレアミンを5
μ
l
加え,真空装置で完全 に乾燥する。 b)カップリング 操作はパーティショニング法同様に行なうが,カッ プリング混液の組成はジメチノレホルムアマイド:トリ エチノレアミン:水:PITC=7:1:1:1
である口反応 は5
5
.
5
0C
で5
分間行ない, その後減圧下で乾燥す るo c)洗浄 それぞれの試験管に約2
0
0
μ
l
の洗浄液を加え,軽く 振った後洗浄液を捨てる。洗浄液は,次の順に使用す る。 (1)へプタン:酢酸エチノレ(
1
5:
1
)
(
2
)
酢酸エチノレ(
3
)
ア平成元年12月(1989年) セトン 乙の洗浄を2回繰り返した後,水流アスピレーター, 真空装置の順で完全に乾燥させる。 d) 切 断 上記の操作で得られた乾燥物に,10μlのトリフルオ ロ酢酸を加え,55.50 Cで 3分間加熱する。操作はパー ティショニング法と同様に行なう。 e)抽出 試験管に 60μlの0.1労酢酸を含むベンゼン:アセ トニトリル混液 (1:1)を加え,軽く振った後抽出液 を新たに用意した試験管に移す。この操作を2回操り 返した後,以下の操作はパーティショニング法と同様 に行なう。 f)転換 パーティショニング法と同様に行なう。 ④HPLC による PTHーアミノ酸の分析 HPLCの装置については前述しである。カラムは, YMC社製の R-ODS-5カラム (0.46
x
25 cm)を用い, カラム温度は 370 C とする。 PTHーアミノ酸の検出は 264nmの紫外線吸収によって行なう。溶媒は 25mM 酢酸,1.4mM トリエチルアミン (pH4. 9)の緩衝液を 用い,溶出はアセトニトリルの直線的濃度勾配で行な う。流速は1.0 ml/minで,サイクルは35分とする。 (2)自動式エドマン法 アミノ酸配列分析は,自動気相シークエンサー (Applied Biocystem社製モデル 470A)を用いて行う。 試料は1.0~3. 0 nmolのペプチドを使用する。 PTH-アミノ酸は,Spectra Physics model SP 8100 HPLCシステムを用いて, Toyosoda TSK-GEL ODS-80 T M
Fhd (0.46
x
15 cm) カラムで分析する。尚,自動分析機は 側蛋白質工学研究所のものを借用した。 結 果,
.
VMOIの精製 VMOIの精製は,木戸らによって開発された方法 に従って行なったヘつまり,卵黄膜の10勉 NaCl可 溶画分をむM-トヨパーlレ650Mイオン交換クロマト グラフィーにより分離した。 Fig.1 に 示 す よ う に NaCl濃度が 0.28Mと 0.32Mのところで 2つの大 きなピークが溶出された。 SDS-電気泳動で調べた結 果(Fig.2),前半のピークが VMOI,後半のピークが リゾチームを含む乙とが確認された。 VMOI 両分は, リゾチームを少量含むもののゲ、jレの染色の度合し可から 純度90%以上と推定できた。標準タンパク質を使って 求めた分子量は約17,000であり, Back らの結果と一 致した。鶏卵1個から約 O.4~0. 6mgの VMOIが得 られた。2
.
VMOIのアミノ酸組成 還元カルボキシメチル化後,6N一塩酸で加水分解し て得た VMOIのアミノ酸組成を Back らの実験値5) およびリゾチームのアミノ酸組成と比較して Table1 に示す。酸加水分解で崩壊する Trpは‘グアニジン塩 酸で完全変性後紫外吸収スペクトルを測定して推定し た。 6個の Trpはリゾチームと同数であり, VMOI の高いモノレ吸光係数をよく説明できる。全体的にはGly, Proの含量の多い特徴が見られる。 Back らの結
果と比べて, Asp, Gly, Lysはやや低く Gluはやや高
い。また,Trp含量は,本実験で約1.5倍高いが,これ 0.4ト I ¥
,
0.4 _ 2l
J
¥
1
¥
0
6
Fraction volume (ml)Fi邑.1 Puri五cationof VMOI by CM-Toyopearl chromatography. The protein fraction (46.5 mg) solubilized by 10% NaCl from vitelline membrane was loaded on a CM-Toyopearl 650 M column (1. 6X25 cm) previously equilibrated with 0.1 M acetate buffer
,
pH 4.6. After washing with 0.2 M N aCl in the same buffer,
elution was performed by a linear gradient of O. 25-0. 35 M N aCJ10 the same buffer over 400 ml. A flow rate was 38. 0 ml/hr.食物学会誌・第44号 数を参考までに示した。乙の時の最小分子量は17,016 である。 キモトリプシン処理した VMOI断片の分離 キモトリプシン消化した VMOI断片を逆相 HPLC で分離した。カラムは,オクタデシル鎖を結合相とし て持つ μBONDAPAKを使用した。 Fig.3は消化処
3
.
は測定手段が違うことからきていると思われる。塩基 性アミノ酸の含量は 11.9%と高いが, リゾチームの 14箔よりは少なく, VMOIの等電点 (pI=10.0)がリゾ チームのもの (pI=11. 0)より小さいことと一致した加。また VMOI には Metが含まれていない。 Table1 には, Proを 5個持つと仮定した場合のアミノ酸残基 16 -7 4 4 4 ¥ 時 、6、 保 持
d
c
b
a l
SDS-polyacrylamide gel electrophoresis. Samples applied to the gradient polyacrylamide gel (10-15%) were as follows; marker proteins (lane a),
the SDS-soluble fraction obtained from vitelline membrane (lane b),
the fraction eluted at 230 ml (lane c) and 400 ml (lane d) in CM-Toyopearl Chromatography as depicted in Fig.1. The marker proteins used for estimation of molecular weight were, from the top, phosphorylase b (94,000), bovine serum albumin (67,000), ovalbumin (43,000), carbonic anhydrase (30,000), soybean trypsin inhibitor (20,100),α-lactalbumin (14,400)・- 17-﹀¥﹀, d p ) ∞ 吉 宮 一
o
ω
ハ u n V 4 2。
(c)。
(0) 。 トυ
∞ トυ
11-ω
トυ
の トυ
N ト 0。
↑
0 1 ﹄ 寸 トυ
戸 ﹂F O (b) R d R J VU
2
O E C O 向 N ↑0@OCOD ﹄ O 帥 D d 平成元年12月(1989年)Table 1 Amino Acid Composition of VMOI. The results are expressed by the resid ues per 100 residues. In comparison
,
the amino acid composition of VMOI determined by Back5> and that of hen egglysozyme are shown. The numbers of residues per molecule of VMOI are calculated by taking PrO as the base and given in parentheses. Minol E C O f() C¥I ... 0 Q) 0.5 (.) C 0 .0 ' -o lfI iコ d Lysozyme 円 台 UA 苛 只 U Q d F D n J 円 。 9 h M ヴ ' F b ヴ 4
っ
“
q d 円 ぺ U 可 t Q U F H υ ヴ 4 ↑ 1 ム -6 5 7 3 1 9 9 6 4 1 4 6 2 2 4 0 v 8 4 一 o u-ム
一
O一
一 司 t ・ 4 -4 9 4 9 5 0 6 8 9 0 6 9 3 6 7 9 2 6一
2一
乙 ら & 1 1 4 4 Z ら Z 1 乙 F L 4 仏 ふ2
一 仏 一 司i 守i 一 円 U -一 I一
¥J , 、 1 ノ ¥J ノ 、 1 ノ 、 、 ‘ ノ 、 1 ノ 、 、 , ノ 、 1 ノ 、 、 , , , 、 1 ノ 、 1 ノ 、 、 , ノ 、 、 , ノ 、 1 ノ 、 、 l , 、 1 ノ 、 1 ノ 、 、 , ノ 一 、 1 ノ 同 円 o n u q J q ο F D Q U 司 d n t ハ v n U F O n J A 吐 門 i F b ワ h M 噌i 氏 U 一 q u -141141A 可 i 可 i 1 i 1 4 1 よ 一 F h u -一 司 i -〆 t k 〆 f¥/t¥/f¥ 〆 t ¥ / t k , r t 、 / t ¥ / ' K 〆 t¥/a 、 、 〆 FK 〆 tk 〆 tk 〆 t¥/tk 〆 6 1 ノ f k 一 / t k -p h u q u ゥ , Q U 円 ペ U Q U 氏 U F H d q u n u n u q u 4 a 門 t F b n u λ T n u 一 司 i -o h O 8 8 q d 2 4 4向 。
3 8 2 4 q u 1 7 4 ↑ n u -J 1 i 可 i ↑ n u -﹁ D 一 守 ' ・ -一 -︽ 4i 一 E ρ し一一
R 一 1 i 一 泡 叩 K T H 刀 竹 h W 4 4 d e m 戸 児 戸 ・ 凶 昭 叩 一 伽 一 円 以 A T 門 出 G h G A C V M E L T 日 L H A T 一 T一
υ VMOP> VMOI ﹀ ¥ ﹀ , d r )∞
L F C O﹀- o ω
O O A ﹃ 内 〆 ﹄ 10 20 30 Retention time (min) Separation of the peptides obtained from chymotryptic digestion at 250 C for 0.7 hr (a),
2.5 hr (b) and 15 hr (c)・ The chymotryptic digests were directly loaded on aμBONDAPAK reverse-phase column (0. 78X30 cm) equilibrated with solvent A. Elution was performed by raising linerly the concentration of solvent B in solbent A from 16% to 36% over 25 min. Solvent A was aq. 0.1% trifluoroacetic acid and solvent B was acetnitrile containingO. 1% trifluoroacetic acid. A flow rate was 2. 0 ml/min. The isolated fragments that were subjected to amino acid sequence analysis were designated as CT1,
CT2,
and so on.。
E C ~ 0.5 c¥l。
@ O C 0 .0主
0.25 正 コ 《 Fi邑.3 理時聞による経過を見たもので, (a), (b), (c)はそれぞ れ0.7,2.5, 15時間反応させたものである。 Fig.3では 230nmでの吸収を示しているが,Trpを含むペプチド に注目するため先に 280nmで測定し吸収の大きかっ たピークを全て教え, CT1",,--,CT9と名づけた。消化時 間を0.7から2.5時間に延ばすと,CT2, CT3, CT6, CT9 が増え, CT4, CT7が新しく現れた。この結果より十 分に分解するには2.5時間程度必要だと思われる。さ らに15時間消化した場合, CT3, CT4が増えるが CT 8は減少し, CT9は消失する。この場合,キモトリプ シンの特異性が失われる可能性もある。従って,ピー ク数が多く,また芳香族アミノ酸残基で特異的な切断 が行なわれたと思われる2.5時間消化の断片を用いて 後の実験をすることとした。尚,溶出時間から考えて CT2, CT3などのピークは短いペプチドで, CT8,CT9 などのピークは疎水性アミノ酸を含む長いペプチドと 推定される17>。 次に CT3,CT4, CT7, CT8, CT9の画分について- 18-は,
2
つ以上のペプチドを含む乙とがわかったので, 再クロマトグラフィーを行なった。使用したカラムは, 先程のカラムと同じオクタデシノレ鎖を結合相として持 つが,多少吸着力の違う μBONDASPHEREを使用 した。CT9は分離できなかったが,他のペプチドでは Fig.4のように少なくとも2つのピークが見られた。 分離されたピークは溶出時間の早いほうから a,b
と 名付けた。CT3bとCT4aはほぼ同じ溶出位置にあり, 同じペフ。チドと思われる。尚, CT8では後述するよう にCT8aを含むより長いペプチドを得ており,これを CT8Aと呼ぶ。4
.
キモトリプシン断片のアミノ酸組成 Table 2に CT1から CT9までのアミノ酸組成と 推定アミノ酸残基数をまとめた。 CT1から CT5まで のペプチドは5残基以下の短いペプチド, CT6から ( 1 ) b E Co
0.5 r<) N 4・ 0 @2
0 20.25 的 iコ <t 〉 、 、 、 〉 《 、 、U40
∞
﹄ F E @ ﹀ 一 。ω
ハ V 2。
(
2
)
bε
o
0.5 向 ω 場問。
@ (.) 50.252
<t40
∞
炉 CO ﹀ 一 。ω
n v 司 ζ。
。
10 20 Retention ti問 (min) 食物学会誌・第44号 CT9までのペプチドは11残基以上の長いペプチドと 思われる。 TyrやPheを含むペプチドは CT1,CT7b, CT8a, CT8b, CT9の5つで,残りのペプチドは吸光 度が高いととからも考えてC末端は Trpで終わって いるものと思われる。 尚, CT4aはCT3bと同じ組成を持つため,表には あげていない。 CT8Aは試料が少なくアミノ酸分析は 行なうことができなかった。5
.
VMOIとキモトリプシン断片のアミノ酸配列 手動式エドマン法によって決定した配列を Table3 にまとめた。 CT1から CT5はパーティショニング法 で,残りはフィルム法を用いて行なった。どちらの 方法でも収量はあまり変わらなかった。各断片の配列 は,CT8bとCT6の一部を除き,アミノ酸分析の結果 と一致した。キモトリプシン断片のC末端に期待され (3)。
ε
長
0.5 N O ﹀ ¥ ﹀8
cz
OO.252
《 b。
。
(4)。
﹀¥﹀ ES
05 N {﹀¥﹀ 4回・ 0 b 、、向 ‘' } , 、 、 、 M ) R U 2。
@ O C O D ﹄ O 帥 ad ﹄ F C @ ﹀ 一 o mo
ク ﹄40
∞
。
。
10 20 Retention time (min)Fig. 4 Rechromatography of the chymotryptic peptides. The chymotryptic peptides
,
CT3 (1), CT4 (2), CT7 (3) and CT8 (4), obtained from the first chromatography (Fig. 2) were loaded on aμBONDASPHERE reverse-phase column (O.39x15cm) equi -librated with solvent A. The concentration of solvent B in solvent A was linearly raised as indicated. The composition of solvents A and B were described in the legend to Fig. 3. A flow rate was maintained at1. 0 ml/min.同 相 司 抑 凶 有 H N b
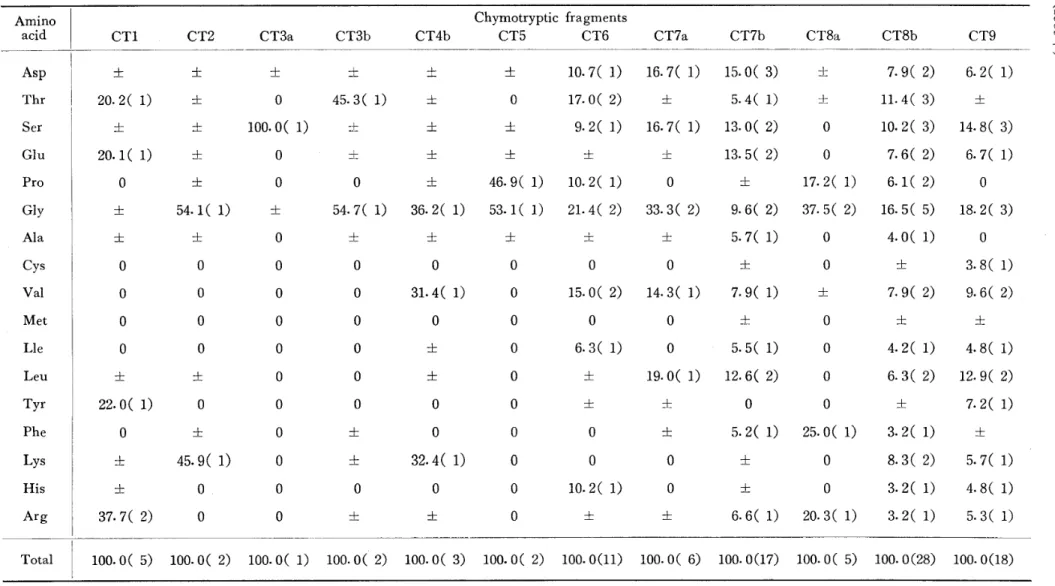
Table 2 Amino Acid Composition of The Chymotryptic Fragments.
Residues per 100 residues are shown. The numbers of residues estimated for the chymotryptic peptides are given in parentheses. A trace amount of amino acid detected is indicated by :l:. ( 凶 器 。 有 ) Chymotryptic fragments CT5 CT6 Amino
acid CT1 CT2 CT3a CT3b CT4b CT7a CT7b CT8a CT8b CT9
6.2( 1) 7.9(2) 士 15.0( 3) 16.7( 1) 10.7( 1) 士 土 土 士 士
±
Asp ± 11. 4( 3) 十 5.4(1) ± 17.0( 2)。
土 45.3( 1)。
土 20.2( 1) Thr 14.8( 3) 10.2( 3)。
13.0( 2) 16.7( 1) 9.2(1) 土 土 十 100.0( 1) 土 土 Ser 6.7(1) 7.6(2)。
13.5( 2) 土 土 士 士 土。
±
20.1( 1) Glu。
6.1(2) 17.2( 1) 土。
10.2( 1) 46.9( 1) 土。
。
士。
PrO 18.2( 3) 16.5( 5) 37.5( 2) 9.6( 2) 33.3( 2) 21. 4( 2) 53.1 ( 1) 36.2( 1) 54.7( 1) 士 54.1( 1) 士 Gly。
4.0( 1)。
5.7( 1) 土 土 土 土+
。
士 土 Ala 3.8( 1) 土。
士。
。
。
。
。
。
。
。
Cys 9.6( 2) 7.9( 2) 士 7.9( 1) 14.3( 1) 15.0( 2)。
31.4( 1)。
。
。
。
Val 土 土。
土。
。
。
。
。
。
。
。
Met 4.8( 1) 4.2( 1)。
5.5( 1)。
6.3( 1)。
士。
。
。
。
Lle 12.9( 2) 6.3( 2)。
12.6( 2) 19.0( 1) 土。
士。
。
+
± Leu 7.2( 1) 士。
。
士 土。
。
。
。
。
22.0( 1) Tyr 士 3.2( 1) 25.0( 1) 5.2( 1) 士。
。
。
土。
土。
Phe 5.7( 1) 8.3( 2)。
士。
。
。
32.4( 1) 土。
45.9( 1)+
Lys 4.8( 1) 3.2( 1)。
±
。
10.2( 1)。
。
。
。
。
土 His 5.3( 1) 3.2( 1) 20.3( 1) 6.6( 1) ± ±。
±。
37.7( 2) Arg。
土1
5
1
100.0(18) 100.0(28) 100.0( 5) 100.0(17) 100.0( 6) 100.0(11) 100.0( 2) 100.0( 3) 100.0( 2) 100.0( 1) 100.0( 2) 100.0( 5) Totalたことがわかる。 CT9は, 1段目が Arg,2段目が His, 3段目からは2つのアミノ酸が現れ, 6段目以降 は再び1つのアミノ酸であった。 2段目から5段目で 検出されたアミノ酸のうち, VMOIの27段目から30段 目にみられる HSGYに相当するものを CT9-2とし, 残りの配列を CT9-1と し て 推 定 し た 。 未 変 性 の VMOIは40段目の PrOまで決定できた。この中には 5段目の Tyr,17段目と20段目の Trp,25段目の Phe が含まれていた。 食物学会誌・第44号 - 20-る芳香族アミノ酸のうち Trpは CT2,CT3a, CT3b, CT5及び CT6の各断片で, Tyrは CTlで確認され た。芳香族アミノ酸の確認されなかった CT4a,CT4b, CT7aのうち, CT4aは先に述べたように CT3bと同 一断片と判断できるのでこのC末端は Trpであるだ ろう口 CT4b,CT7aはアミノ酸分析の結果と考え併せ るとC末端は Trpである可能性が高い。 本研究では,VMOIのキモトリプシン処理によって 得られた芳香族アミノ酸を合む14本の断片についてア ミノ酸配列分析を行ない,また同時に VMOIのN末 端からの配列も一部決定した。 同定できたアミノ酸残基数はキモトリプシン断片で 94, VMOIのN末端からは39であった。一部不明な点 は残るが,これら同定したアミノ酸配列のうち重複す 察 考 尚, CT7bの分析では PTH-アミノ酸を検出する事 ができなかった。これは,試料をフィノレム状に乾燥し た際に不溶性になったためと考えられた。 CT8bの配 列決定は6サイクル以上進まず,決定された部分の配 列は CT6と一致した。アミノ酸分析の結果とあわせ て考えると,CT8bはCT6をN末端に含む,より長い ペプチドと思われる。 自動式エドマン法によって決めた配列はTable4に まとめた。 CT8Aは37残基のアミノ酸より成り,その 末端は Pheであり, 3段目と6段 目 に あ ら わ れ た Pheのところでは,キモトリプシンで切断されなかっ
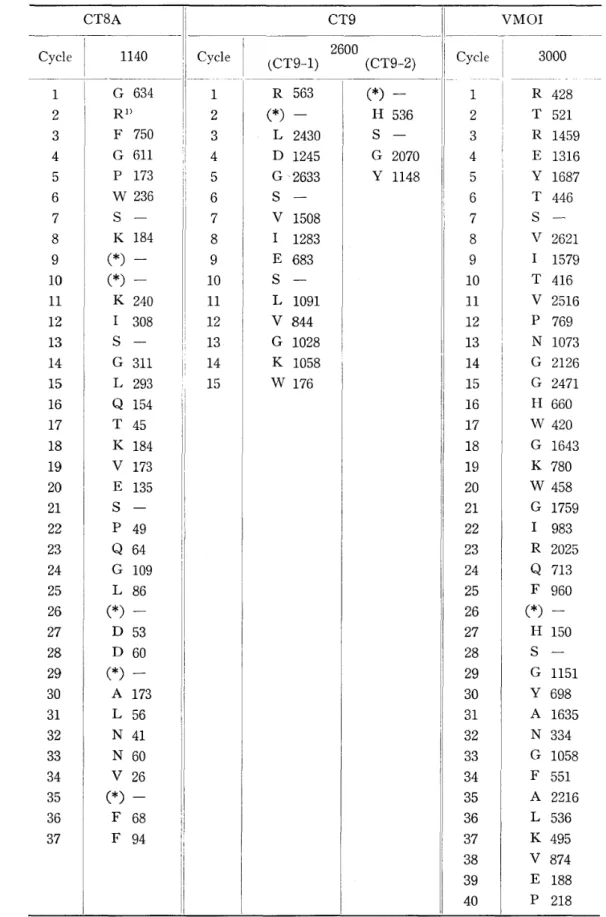
Amino Terminal Sequences of The Chymotryptic Peptides Determined by The Manual Edman Degradation Method. Amounts of peptides used for sequence analysis are given under the fragment names. The values in each cycle show the yields in nmols. Table 3 - 一 8 一 6 3 一 ﹀ 一 0 生 一 仏 一 仏 向 山 一 割 一 L m d ゴ 一 一 ( ( 一 T 一 d ( 一 一 G T 一 仁 一 叩 一 一 z q 士 一 1 1 1 1 一 │ │ C 一 一 一 a b 一 5 一 6 3 8 二 a 一 1 一 0 3 3 5 3 0 m
u
一 1 一 L L 仏 一 一 切 一 L 一 L a 仏 仏 仏 仏 . m 一 一一
L G T W一
c
一 一 V G D G L S 川 一一﹂J
I
-一 間 2 一 7 2 一一一 1 一 2 5 0 9 5 7 一 刀一L
一 円 仙 仏 一 刻 一 弘 一 F L Z ふ 忠 弘4
L
n
ル 仏 仏 戸 仏 一 町 一 一 -C 一 一sw
一 仁 一
一
T S V I T V P N G G 何w
一 一
一 一 -r i 一 一 一 JU -Eし
i u
ー
っ
し
一
一
ー
ト
し
l
i
l
i
-J
M
-一 ・ ・ = F b 一 ・ 一 ・ ・ -C T 一 7 -6 2 1 一 一 T 一 2 一 3 1 1 一 心 C 一 G K W一
C 一 一 G p w 一 山 = 一 -a L i l i -一 ﹁ l I L i -一 lili--ill[!llili--w 5 一 9 3 7 9 3 一 一 ﹀ 一 7 一 4 8 7 m 一 一 1jl 一 -R 6 A T ゆ 一 3 4 3 2 2 二月一 4 一 4 1 1 0c
:
一 R T R E Y 一 一 む 一 一 V G K 白 n 一 P A 一 e 一 1 2 3 4 5 6 7 8 m Cycle 1 2 3 4 5T
0.3s
O
.
1
V
0.2 1 0.2T
0.1 V 0.1 Cycle 、7 n U 可i 円 L , ‘ . 1 E A 噌BATE-A平成元年12
月
(1989年) - 21-Table 4 Amino Terminal Sequences of The Chymotryptic Peptides and VMOIDetermined by An Automated Sequencer.
The values show the yields in pmoles. In the case of Ser residues, rnost of PTH-Ser were converted to PTH-dehydro Ser
,
and were not quantitated,
but clearly iden -tified. The amino acid residues indicated by asterisks were not identi自ed.CT8A 11 CvyU'-! cle i _1._1_4._.0v
i
i
I1 ~y\AC Cvcle 1 (CT9-1) 1 G 6341
1
1 R 563 21R1}112│(*)-3F
750 3L
2430 4G
611 4 D 1245 5 P 173 5 G、2633 6W
2361
!
6 S -7 8 9 0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 司1 1 ょ 1 4 1 ム 1 4 τ i 1 4 1 A 可 i 1 ょ っ “ っ “ ヮ “ っ “ q ム ワ ム ワ 中 ワ 白 ワ ﹄ ワ U M q u q u q u つ d 円 べ uqd 円 J n . δS
-K
184 (*)一 (*) -K 240 1 308 S-G
311 L 293 Q 154 T 45 K 184 V 173 E 135S
-P
49 Q 64 G 109 L 86 什) -D 53 D 60 (*) -A 173 L 56 N 41 N 60 V 26 (*) -F 68 F 94 7 8 9 0 1 2 3 4 5 市 i 1 i 1 i 可 i 可 i t i V 1508 1 1283 E 683S
-L
1091 V 844 G 1028 K 1058 W 176 CT9 2600 (CT9-2) ( 勺 -H 536S
-G
2070 y 1148 一 9 6 7 1 9 一 良 U 1 i F D 1 A Q U 円 り つ 何 月 i n b 一 0 2 2 4 3 6 4 一 6 5 1一 ∞
4 5 1 1 1 4 一 2 1 4 日 一 3 R T R E Y T S V I T M 一V
一 │ I l l i -I l l i -I l -一 ρ L 一 戸 一 1 2 3 4 5 6 7 8 9 m 一 C 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 8 1 i 1 4 1 ょ 1 4 1 4 1 4 1 A -i ー よ り 由 。 白 ワ 白 り 白 ワ 白 の 由 。 白 っ “ ヮ ム り 山 内 onononoqunoquququ V 2516 P 769N
1073 G 2126 G 2471 H 660 W 420 G 1643 K 780 W 458 G 1759 1 983R
2025Q
713 F 960 (*) -H 150S
-G 1151 y 698 A 1635 N 334 G 1058 F 551 A 2216 L 536 K 495 V 874- 22-るものを除き,まとめて整理したのが Fig.5である。 ここに示すように CT1,CT6, CT2はVMOIのN末 端とよく一致した。ただし CT6の第11段目の Hisは 配列分析では同定できなかったが,アミノ酸組成より 明らかである。 Cysと Trpを除外すれば, CT9のアミ ノ酸分析の結果は CT9-1 と CT9-2のアミノ酸配列 の結果と一致した。 Cysの含量がアミノ酸分析で低 かった理由を,還元カノレボキシメチル化していない VMOIを試料としたためであるとすれば, CT9-1 の 2段目と CT9-2の 1段目は Cysと推定される。さ らにこの 2つのペプチドは,再クロマトグラフィーで も分離されなかったことから,ジスフィノレド結合して いることが考えられる。 CT5は CT8Aの 3段目から 5段目に位置する。 CT8aの配列分析は今回行なわな かったが,アミノ酸分析の結果より CT8A の 1段目 から 5段目と推定された。 CT7aは 6段固まで解析さ れ,アミノ酸分析の結果と一致する。しかしC末端が Serで終わることは考えにくく Trp と推定される。 また CT3aは Ser-Trpとなっており CT7aの C末端 と重複すると考えられる。 CT4bはアミノ酸分析の結
VMOI
食物学会・誌第44号 果と一致するが,やはり C末端が Lysで終わること は考えにくい。また,とれは CT9-1の12段目からの 配列によくあてはまる。このことからとのペプチドの C末端は Trpであると推定された。 以上より,結局,本実験では VMOIの95残基の配 列を決定したことになり,アミノ酸分析より推定され た全アミノ酸残基数 153の 62%が決定されたことにな る。特に 6個ある Trpの周辺のアミノ酸配列は全て 決定された。 Fig.6にはリゾチームのアミノ酸配列を示してあ り,特に活性部位及び基質結合部位に存在し,活性発 現に重要とされているアミノ酸残基は枠で囲んで示し であるわ。本研究で解明されたVMOIの部分配列,つまり VMOIのN末端部, CT8A, CT9-1, CT7aの各
フラグメントをこのリゾチームの配列と比較してみた。 各フラグメントの配列順序を考慮せずに比較してみて も明らかな類似性は見当らない。そこでジペプチドで 類似する箇所を捜してみると Fig.6に点線で示すよう に数十箇所あった。しかし, リゾチームの活性発現に 重要となる部位では 2箇所 (Glu35と Gln57)だけしか 10 20
A,-g Thr-A,-g-G 1 u-Ty,--Thr-Scr-Va 1-11 c-Thr-Va I-Pro--Asn-(j1 y-(j1 y-IIi s-'・n)-(jIy-Lys-T,-p
同 -_. 斗 同 CT6 1て CT2 .. I
片 一 一 両
30 40
-Gly-Ilc-Arg-Gln-Phc-'"ー11i s--Scr-li 1 y-Ty,--Ala-A別,-(j1)トI'hc-A 1 a-Lcu-しys-Va I-li lu-P,-o
同 ーー-_---1
CT8A
10 20 GIy-Arg-Phc-Gly-Pro-T,
-p_-Scr-Lys- '"-ホーしys-1 1 c-Scr -(j1 y -Lcu -G 111-Th r-Lys-Va 1-G I u t-一一一一-~CT51
-
…・... ー一一 .---1 CT8a 30Ser-P・,o-Gln-Gly-Lcu- ' -Asp-Asp- '" "-Ala-I~ ・ II-AS Il -Asn-Val 伺'" -Phc ..Phe
CT9-1
10
Arg- '"ーLeu-Asp-Gly-Ser-Val-IIc-Glu-Ser-Lcu~Val-Gly ーし ys- Tn~
I - CT4b CT7a
-I
'
o
ia-2u ト 一 T m ト C F D 4 H u p ﹂' し
V J ρ u c d a A V J P u a H V CT3b(CT4a) Gly-Thr-TrpFi邑.5 Summary of the chymotryptic fragment analysis ofVMOI. Peptides indicated by solid lines were determined by sequence analysis. Peptides shown by dotted lines were estimated from the results of amino acid composition analysis. The amino acid residues indicated by asterisks were not identified.
平成元年12
月
(1989年) 見当らず,一致の見られた配列を含む CT8AとCT 9-1のそれぞれの対応する部分でもその周辺における 配列は全く異なっていた。さらにトリペプチドに拡げ て調べてみると 1箇所しか一致する部分はなく,その 周辺の配列は全く対応が見られなかった。乙のように これまでに判明した限りでは,VMOIとリゾチームと はそれらの一次構造には部分的にも類似性が見当らず, 活性部位に関してもほとんど類似性はないといえる。 また, リゾチームの Trp62とTrp63は,水素結合 によって基質を安定化させており, Trp108はGlu35 の活性の発現に必要とされている乙とが示されてい る7)。そこで Trpの周辺についても注目してみたが, リゾチームと一致すると乙ろは全くないことがわかっ た。今後,配列の決定できなかった残りのお労の部分 にリゾチームとの一次構造上の類似点が見つかる可能 性は否定できないが,現時点では VMOIはリゾチー ムと全く異なる一次構造を持っていると結論できるだ ろう。 VMOIの二次構造は, 円二色分光測定の結果によ るとリゾチームとは大きく異なっていると思われる1630 もし VMOIにリゾチーム様活性があるとすれば,こ れら 2つの酵素は異なる一次,二次構造を持ちながら も共通する N-アセチJレクツレコサミンダーゼ活性を持 - 23-つ乙とになり,VMOI触媒機能の発現機構を解明する ことは極めて興味深い。 VMOIの全一次構造の解析を進めてゆく際に参考 になると思われるいくつかの知見が本研究で明らかに なった。 VMOIのN末端部に Asn心ly結合が2箇所 あり,ヒドロキシアミンを用いてこの結合を選択的に 切断することは可能である。またアミノ酸分析によれ ばLysが 5個あり,今回決めたペプチドの配列中にそ の全てが存在したのでリジJレエンドペプチターゼを用 いてキモトリプシン断片と重複するペプチドを得るこ とが出来るだろう。お わ り に
本実験で,VMOIの約625ちに相当するアミノ酸配列 を決定する乙とが出来た。特に,キモトリプシン処理 によって得られる 6個の Trpを含むペプチドについ ては全て決定した。決定された VMOIの部分配列と リゾチームの一次構造とを比較すると,VMOI にはリ ゾチームの活性に必須とされる Trp周辺の配列にも 類似性は見あたらず,判明した限りではリゾチームと 全く異なる一次構造を持つと結論出来た。また二次構 造も異なっていることを考慮すると,もし VMOIIこ リゾチーム様活性があるとすれば, VMOIの触媒機能 20 Lys吟Va_I-_Phe-G 1 y-_Arg-Cys-G 1 u-Leu-A 1 a-A 1 a-A 1 a-Me t -Lys-Arg-II i s-G 1 y-Leu-Asp-Asn-Tyr卜..,・H ・..11...….:tI・H・H ・-…i f....・H ・..i ト・・・一一一1
l・ h ・-…~ 1………・4
-A
吋
!.T;;?.TJJFET;;!?l-Gl y-ASIB-T山 al-い
l山 山s{Phe-Glutseぺ玉砕
h日 s r J1
.
.
.
.
.
.
.
.
・・4
-Gln-Ala-ThrfAsnt
川
~Th
けs
川
y~
加
fAsP
Jr
y
叩 y_l1e-Leu~lle~se6rO
-Argt Trp-TrptCys-Asn-Asp-.G 1 y-Arg司Thr-Pro-Gly-Ser-Arg-Asn-Leu-Cys-Asn-lle-Pro-Cys」
一
一
一
一
l ト…・・…・│ │…・・・・・・・・│ 100 -Ser-Al a-Leu-Leu-Ser-Ser-Asp-ll e-Thr.-A 1 a-.Ser-Va J.-Asn-Cys-A 1 a-Lys-.Lys-) 1 e,-Va l-Ser 十...・H・.., -1
.
.
.
.
.
…・・1
I
……・…│ ト…-…ー│iAsptf.~:.~.~::~.~?~河川
et-A
叶
ーGln-Ala-Trp-Ile町Arg-Gly-Cys-Arg-Leu 卜...:1Fig.6 Sequence comparison between hen egg lysozym巴andthe chymotryptic peptides ofVMOI.
The amino acid residues surrounded by lines are those found in the catalytic site and the substrate binding site of lysozyme. The peptides indicated by dotted lines corres. pond to a part of chymotryptic fragments ofVMOI.
- 24-の発現機構はリゾチームと大きく異なる可能性が示唆 された。 最後になりましたが,御指導頂いた土居幸雄先生, 並びに木戸詔子先生,そしてアミノ酸配列自動分析機 による解析でお世話頂いた脚蛋白工学研究所の金谷茂 則さんに心からのお礼を申し上げます。
文 献
1) B. Alberts, D. Bray,
J
.
Lewis, M. Raff, K. Roberts andJ
.
D. Watson: Molecular Bi・'ology0
/
The Cell
,
(Garland Pub.,
New York),
Chap. 14 (1983)・2
の
)
S. Ki吋do,
M. Janado and H. Nuno旧ou旧1江ra引:ノ.Bi白ochem.
,
78,
261-268 (1975).3)S.Kido
,
M. Janado and H. N unoura: ノ• Bio・chem.
,
79,
1351-1356 (1976)・4
心
)
S.Ki凶do,
M. Jana凶adoand H. Nuno旧ou江rra似 :J
.
Bi均:0 Cんem匁t.,
81,
1543-1548 (1977)・5) J.F.Back
,
J
.
M. Bain,
D. V. Vadehra and R. W. Burley: Bi・'ochim. Biophys. Acta 705,
12-19(1982).
6)S.Kido and Y. Doi: Poultry Science, 67
,
476 -486 (1988).食物学会誌・第44号
7) Taiji Imoto, L.N. Johnson, A. C. T. North, D. C. Phillips
,
andJ
.
A. Rupley: The Enzymes vol.VII
,
(Academic Press,
New York and london),
Chap.21 (1972)・ 8)木戸詔子,金喜美,土居幸雄:生化学, 60, 992 (1988). 9)木戸詔子,土居幸雄,謝名堂昌信:生化学, 59, 737 (1987). 10) J.
F
.
Back: Bi・ochz'm. Biophys. Acta 799,
319 -321 (1984)・ 11) U. K. Laemmli: Nature,
227,
680-685 (1970)・ 12)高橋礼子:生化学実験講座,第1巻,タンパク質 の化学 II,日本生化学編, (東京化学同人), 76-81 (1977). 13) H. Ed巴lhock: Biochemistry,
6,
1948-1954 (1967). 14) Marion M. Bradford: A nual. Bz'ochem.,
72,
248-254 (1976). 15)小林龍二, G.E. Tarr: 蛋白質核酸酵素,31,991 -1003 (1986)・ 16)木戸詔子,土居幸雄,金喜美:未発表データ17)