LAMP 法を用いた食中毒原因菌の簡便かつ迅速検出法の開発
p. i 目次 page 緒論 1 第 1 章 LAMP を利用した腸管出血性大腸菌(EHEC)の高感度かつ迅速検出 8 実験の部 9 第 1 節 EHEC 検出用 LAMP の構築 18 第 2 節 EHEC 汚染検体での評価 20 第 3 節 従来の EHEC 検査法との比較 23 考察 26 第 2 章 腸炎ビブリオ検出用 LAMP の開発と MPN 測定への応用 31 実験の部 32 第 1 節 腸炎ビブリオ検出用 LAMP の構築 38 第 2 節 MPN-rpoD-LAMP の評価 40 考察 41 第 3 章 LAMP を利用した TDH 産生腸炎ビブリオの高感度かつ迅速検出 44 実験の部 44 第 1 節 tdh-LAMP の構築 51 第 2 節 カキからの TDH 産生腸炎ビブリオの検出 51 考察 53 総括 56 謝辞 59 論文目録 60 引用論文 61
p. ii
略語
・APW:アルカリペプトン水(Alkaline peptone water) ・ATCC:American Type Culture Collection
・CFU:Colony Forming Unit
・CT-RMAC:Rhamnose MacConkey agar に Cefixime(0.05 mg/L)と Potassium tellurite (2.5 mg/L)を添加した培地
・CT-SMAC:Sorbitol MacConkey agar に Cefixime(0.05 mg/L)と Potassium tellurite (2.5 mg/L)を添加した培地
・EHEC:腸管出血性大腸菌(Enterohemorrhagic Escherichia coli) ・gyrB : DNA gyrase B subunit
・HUS:溶血性尿毒症症候群(Hemolytic Uremic Syndrome) ・IMS:免疫磁気ビーズ
・LAMP :Loop-mediated isothermal amplification ・mEC+n:ノボビオシン加 mEC
・MPN:最確数(Most Probable Number)
・NCBI: National Center for Biotechnology Information ・PCR :Polymerase Chain Reaction
・RPLA:逆受身ラテックス凝集反応法 ・rpoD : RNA polymerase σ70 factor
・SNP:一塩基多型(Single Nucleotide Polymorphism) ・TE buffer:10mM Tris-HCl, 1mM EDTA pH 8.0
・TSA:Trypticase soy agar ・TSB:Trypticase soy broth ・VT:ベロ毒素 (Verotoxin)
p. iii
・3% NaCl-PB: 3% NaCl, 10 mM phosphate buffer pH 7.2
・3% NaCl-TSA:NaCl を終濃度 3 %に調製した Trypticase soy agar ・滅菌 PBS:滅菌した 0.85 % NaCl, 10 mM phosphate buffer pH 7.5
1 緒論 1992 年から 1993 年にかけて,米国で大腸菌 O157 による大規模な食中毒が発生した. 直接の原因は,外食チェーン店でのハンバーガーの加熱調理が不十分であったためだ が,畜場や精肉包装出荷業者の食肉処理工程も注目されることとなった.また,1996 年に米国で起きたりんごジュースの大腸菌 O157 食中毒では,低温殺菌せずに販売さ れたことが直接の原因であったが,原料のりんごが農場で大腸菌 O157 を含む堆肥と 接触したことが汚染原因と考えられ,農場での衛生管理が注目された.一方,1999 年のベルギーでは,鶏肉・鶏卵から高濃度のダイオキシンが検出され,その原因は飼 料への汚染と考えられている1).こうした問題を背景として,2000 年頃より,米国や EU では,「農場から食卓まで(第一次生産から最終消費者に至るまで:フードチェー ン)」の一貫した食品安全の確保が求められるようになった2-3). 近年,国内でも,食品に関わる様々な事件により,食品の品質に対して厳しさが増 し,フードチェーン全体を通じた食品安全が求められるようになった.食品関連の製 造加工業者は,製品の安全性の管理はもとより,迅速なクレーム対応や素早い工程の 修正・改善を行う必要もあるため,検査時間が短縮できる試験法や,労力の軽減がで きる試験法を望んでいる.試験項目の中で,残留農薬・添加物・重金属など定性・定 量分析を行う検査分野は,高速液体クロマトグラフィーや質量分析など新しい分析方 法が導入され,検出感度の向上や検出時間の短縮が進んでいる.しかし食中毒菌汚染 を検査する検査分野に限っては,増菌培養・分離培養・確認培養試験といった培養法 を基本としているため,検査時間の大幅な短縮は難しい.さらに大量かつ多種培地の 作製,目視による判定,判定後の培地の廃棄など,自動化が難しい作業工程が多いた め,人力不足が問題となっている.論文・学会など基礎検討の報告では,Polymerase Chain Reaction(PCR)が注目されており,迅速性に優れた結果が示されている 4-6). しかし,PCR は 正確な温度制御を必要とする専用の増幅装置が必要であるため,培養 法に比べ試験場所の制約が厳しい.さらに増幅物をアガロースゲル電気泳動で分析 し,確認試験を行う必要もあるため,実質作業時間を削減できないのが実状である. 確認試験が不要なリアルタイム PCR を用いた場合,1 時間以内の迅速検出が可能にな るが,装置と試薬が高価である 7).したがって,食品検査に限っては,PCR やリアル タイム PCR は不向きと考えられ,広くは普及しなかった.
Loop-mediated isothermal amplification(LAMP)は,2000 年に納富らが報告した
迅速遺伝子増幅法 8)で,60 から 65℃の一定温度で反応が進む特徴がある.最小検出 感度は 1~10 コピー/test tube と高感度で9-12),反応時間は 15 分から 1 時間と短い. PCR と同様,DNA 増幅時に二リン酸(ピロリン酸)を副産するが,LAMP の増幅倍率は 109~1010倍で,PCR の 107倍より高いため,ピロリン酸の濃度も高くなる.この高濃 度のピロリン酸が,反応 buffer 中のマグネシウムイオン(Mg2+)と結合し,不溶性の ピロリン酸マグネシウムを生成することになるので,増幅の進行に伴い反応液が白濁
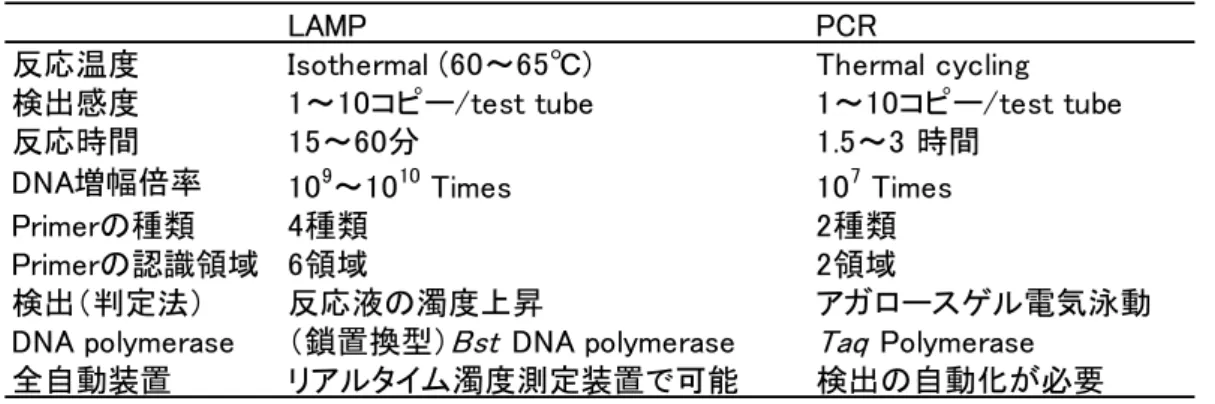
2 するユニークな特徴がある 13).さらに LAMP は,鋳型を認識する特異性が極めて高い 特徴も有する.これは,反応に用いる 4 種類の Primer が,標的遺伝子の 6 領域を認 識するためであり,2 領域のみを認識する PCR と異なり,非特異増幅物が発生しにく い.したがって,増幅の確認を濁度の上昇で確認できる遺伝子増幅法である.当然, PCR の様なアガロースゲル電気泳動による確認試験が不要となり,作業時間や労力の 大幅削減が可能である13, 14).一定温度で反応し,かつ増幅の有無を反応液の白濁で検 出できるので,ウォーターバスやヒートブロックのような安価な保温装置で 1 時間反 応させた後,目視で判定できる手軽さもある.さらに,市販のリアルタイム濁度測定 装置を用いれば,設定温度に保温しながら,6 秒間隔で濁度が測定され,1 時間の反 応終了と同時に判定結果が表示される.この装置は,遺伝子の専門知識を必要としな い全自動判定装置であるため,実質作業時間を削減できる(Table i-1).リアルタイ ム PCR 装置に比べ安価であるため,食品検査に応用できると考えた. Table i-1 LAMP と PCR の比較.
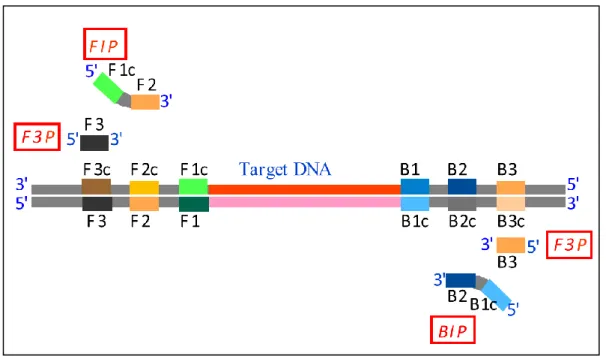
しかしながら LAMP は,Primer の設計が複雑であるため,これまであまり普及 していない.LAMP 用 Primer は,Forward Inner Primer (FIP),Backward Inner Primer (BIP),Forward Outer Primer (F3P),Backward Outer Primer (B3P)の 4
種類で構成されており,FIP は F2 領域と同じ配列を 3’末端側に持ち,5’末端側
に F1c 領域と同じ配列を持つ.BIP は,B2 領域と同じ配列を 3’末端側に持ち,5’
末端側に B1c 領域と同じ配列を持つ一次構造である.F3P は,F3 領域と同じ配列
で,B3P は,B3 領域と同じ配列である(Figure i-1)15).また Primer の配列は,
Table i-2 に示す 5 つの条件を全て満たす必要がある.
本研究では,食品検査のなかで,特に食中毒として重要な腸管出血性大腸菌 (Enterohemorrhagic Escherichia coli:EHEC),および腸炎ビブリオとその病原 因子について,それぞれの検出方法の開発に着目した.
LAMP PCR
反応温度 Isothermal (60~65℃) Thermal cycling
検出感度 1~10コピー/test tube 1~10コピー/test tube
反応時間 15~60分 1.5~3 時間
DNA増幅倍率 109~1010 Times 107 Times
Primerの種類 4種類 2種類
Primerの認識領域 6領域 2領域
検出(判定法) 反応液の濁度上昇 アガロースゲル電気泳動
DNA polymerase (鎖置換型)Bst DNA polymerase Taq Polymerase
3
Figure i-1 標的遺伝子(Target DNA)と Primer 認識領域,Primer の構造.
(EikenGENOME SITE 15)より引用)
・LAMP 用 Primer はFIP,BIP,F3P,B3P の 4 種類で構成されている.
①FIP の構造は,F2 領域と同じ配列を 3’末端側に持ち,5’末端側に F1c 領域と同じ配列を持つ一次構造である. ②BIP の構造は,B2 領域と同じ配列を 3’末端側に持ち,5’末端側に B1c 領域と同じ配列を持つ一次構造である. ③F3P は,F3 領域と同じ配列である. ④B3P は,B3 領域と同じ配列である. ・増幅物は,F2 領域の外側から B2 領域の外側までの繰り返し配列になる. F2 と B2 の間が離れ過ぎていると,酵素の伸長反応が律速となり,増幅反 応が遅くなる.また近すぎると,FIP と BIP による立体障害が発生するた め,反応し難くなる.したがって,F2 領域の外側から B2 領域の外側まで の距離は 120 から 180 塩基が望ましい.
4
Table i-2 Primer 設計上の 5 つの条件.
EHEC は,志賀毒素(Shiga toxin:Stx=Verotoxin:VT)を産生するE. coli で,志
賀毒素産生性大腸菌(Shiga toxin-producing E.coli:STEC)とも呼ばれている.血 清型で分類すると,約 70% は O157 で,約 20% は O26,数% は O111 である.1982 年 に米国でハンバーガーを原因とする出血性大腸炎が集団発生した事例において,大腸 菌 O157 が下痢の原因菌として分離された.その後,北米,欧州,オーストラリアな どでも集団発生が相次いで発生している.国内最初の事例は,1990 年埼玉県浦和市 の幼稚園における井戸水を原因とした大腸菌 O157 集団発生事件で,園児 2 名が亡く なった.その後,1996 年に大阪府堺市を中心とした 1 万名を超える大流行により, TV 等マスコミを通じて,一般家庭にまで広く認知されるようになった.1997 年以降, 集団事例の報告数は減ったものの,散発事例における患者数はほぼ横ばい状態で年間 千数百人の患者が発生している.また,現在の複雑な流通事情を反映して,同一汚染 食品が広範囲に流通した結果,一見散発事例と思われる同時多発的な集団事例が発生 しており,1998 年には北海道産のイクラを原因食品として 7 都府県で患者 49 名が 条件1.プライマー間の距離 □ F2領域の外側からB2領域の外側までの距離を120から180塩基とする. □ F2とF3領域間,B2とB3領域間は0から20塩基程度とする. □ F2の5’末端からF1の5’末端までの距離は40から60塩基程度とする. □ B2の5’末端からB1の5’末端までの距離は40から60塩基程度とする. □ F1領域からB1領域までの間は無くても良い. 条件2.プライマー領域のTm値 □ GC rich,Normalの場合,Tm値は60から65℃とする. □ AT richの場合,Tm値は55から60℃程度とする. 条件3.各プライマー領域の末端安定性 □ F1c,B1cの5’末端6塩基のdGを,-4 kcal/mol以下とする. □ F2,B2,F3,B3の3’末端6塩基のdGを,-4 kcal/mol以下とする. 条件4.GC含量 □ 40から60%とする. 条件5.二次構造
□ Inner Primer(FIPとBIP)の3’末端4塩基と5’末端4塩基は,Primer内 に,相補的配列が存在しないようにする.
(Primer内アニーリングを避けるため)
□ Inner Primer(FIPとBIP)の3’末端4塩基と5’末端4塩基は,他のPrimer 内に,相補的配列が存在しないようにする.
(Primer間アニーリングを避けるため)
5 発生した事例が報告されている.一方,EHEC 感染症は,家族内発生と二次感染が多い ことも特徴である.2004 年から 2010 年までは,死者の発生を抑えることができたが, 2011 年に 7 名,2012 年に 8 名もの死者が発生し,近年感染事例が深刻化している (Table i-3).感染ルートは,EHEC で汚染された食物などを経口摂取することによっ ておこる腸管感染が主で,50 個程度の少量でヒトを発症させることが報告されてい る.食の品質管理において,重要な検査項目であるが,Stx 産生能を指標とした分離 培地は,開発されていない.血清型 O157,O26 を指標とした分離培地が,ほとんどの 検査に使用されている.食品衛生法(平成 19 年 7 月 4 日付け衛食第 207 号及び衛乳 第 199 号)による EHEC の検査法は,ノボビオシン加 mEC(以下,mEC+n と示す)で増菌 培養を行った後,血清型 O157 の検出・分離を目的とした寒天平板培地に画線法で塗 布(以下,画線塗布と示す)し,血清型 O157 と疑われるコロニーを釣菌し,免疫学 的試験方法で確認する試験方法である16).この試験法は,検査時間が 3 日以上と長い ことと,O157 以外の血清型を見逃してしまうことが課題であった6).厚生科学研究事 業で行われた全国調査では,抗菌剤を使用した群の中で,早期投与された EHEC 感染 者ほど,重篤な溶血性尿毒症症候群(Hemolytic Uremic Syndrome:HUS)の発症率が 低かったとの結果が報告されており,迅速検査が求められている検査項目の一つであ る.
Table i-3 EHEC による食中毒の発生状況.
(厚生労働省ホームページより引用) 腸炎ビブリオは,ビブリオ属に属する好塩性のグラム陰性桿菌の一種で,主に海水 中に生息する細菌である.5 類感染症定点把握疾患である感染性胃腸炎の起炎菌の一 つで,食中毒が疑われる場合は,保健所に届け出る義務がある.1950 年 10 月,大阪 南部で発生した‘シラス干し’による患者 272 名,死者 20 名の大規模食中毒の原因 菌として,腸炎ビブリオが初めて分離された.腸炎ビブリオによる食中毒の原因食品 は,ほとんどが魚介類で,6 月から 9 月の海水温が 20℃を超える時期に多く発生する. 欧米諸国での発生は少ないことから,魚介類を生食することが多い日本の食文化と大 発生件数 患者数 死者数 1998年 16 183 3 1999年 8 46 0 2000年 16 113 1 2001年 24 378 0 2002年 13 273 9 2003年 12 184 1 2004年 18 70 0 2005年 24 105 0 2006年 24 179 0 2007年 25 928 0 2008年 17 115 0 2009年 26 181 0 2010年 27 358 0 2011年 25 714 7 2012年 16 392 8
6 きく関連すると認識されている.原因食品としては,イカや貝類が比較的多いが,そ の他の一般の魚など,ほとんどの魚介類の生食が原因になりうる.腸炎ビブリオの感 染が成立するには,約 100 万個以上の生きた菌の経口摂取が必要と言われ,食中毒性 サルモネラと同様,経口感染症の起因菌の中では比較的,感染・発病に多数の菌を必 要とする部類に属する.しかし腸炎ビブリオは,食中毒菌の中で増殖の早い細菌の一 つとしても知られ,至適な培養条件下では,およそ 10 分間に 1 回の割合で分裂する. 4 時間後には 1 個の腸炎ビブリオが 1,000 万個以上に増殖する計算になる.夏期に常 温で放置した魚介類などでは 2~3 時間のうちに発病菌数にまで増殖することがある. また好塩菌であるため,漬け物などの塩分を含む食品に二次感染し,それが感染源と なることも多い.低温に弱い菌であるため,冷蔵保存することが感染防御の上で重要 である.また,真水や高温などに弱い菌であるため,生魚を真水でよく洗浄すること や,十分に加熱調理することでも感染を予防することが出来る.潜伏期間は 12 時間 前後で,主症状としては堪え難い腹痛があり,水様性や粘液性の下痢で,まれに血便 がみられることもある.下痢は日に数回から多いとき十数回で,しばしば発熱(37~ 38℃)や嘔吐・吐き気がみられる.下痢などの主症状は一両日中に軽快し回復するが, 高齢者では低血圧,心電図異常などがみられることもあり,死に至った例もある.1996 年頃に,以前に国内で主流であった血清型(O4:K8)から新しい血清型(O3:K6)への 変化が見られた.同時期に,インドやタイなどの東南アジア,あるいは米国や韓国で も同型菌の流行が起こっている.パルスフィールド電気泳動法による遺伝子型を比較 しても,各国で発生しているものは極めてよく似たパターンを示し,同一クローンの O3:K6 型菌が世界的に流行した可能性が示唆されている.この O3:K6 型菌はtdh 遺伝 子陽性・trh 遺伝子陰性であり,かつウレアーゼ非産生の特徴を持つことが報告され ている.TDH(耐熱性溶血毒:thermostable direct hemolysin)と TRH(耐熱性毒素関 連溶血毒:TDH-related hemolysin)は,腸炎ビブリオが産生する溶血毒である.TDH は糖及び脂質を含まない単純タンパクで,100℃,15 分間の加熱に耐性である.TDH は溶血性,細胞毒性,腸管毒性及び心臓毒性を示し,我妻培地で明確なβ溶血反応(神 奈川現象)を示すことが特徴である.一方 TRH は,TDH と生物学的及び免疫学的に類 似しているが,易熱性である.食中毒原因菌として分離される腸炎ビブリオのほとん どが,どちらかを産生していることから, これら溶血毒が本菌の主な病原因子と考え られている.しかし,自然界に生息する腸炎ビブリオのほとんどは,TDH・TRH を産生 していない株である.食材魚介類に付着した腸炎ビブリオの内,TDH 産生腸炎ビブリ オは 1% 程度と報告されており17),培養法で検出することは極めて難しい.厚生労働 省は 2001 年 6 月,食品衛生法施行規則および食品添加物等の規格基準の一部を改正 し,「切り身,むき身の生食用魚介類加工品,生食用カキ,冷凍食品(生食用冷凍鮮 魚介類)からの腸炎ビブリオの最確数(Most Probable Number:MPN)を,製品 1 g あ たり 100 MPN 以下であること」を規制した.この改正後,事件数は抑えられ,2011 年には,ついに発生事件数を一桁まで減少した(Figure i-2).したがって,MPN 値で
7 規制した効果が現れたと考えられている.ただし MPN 測定は,試験方法が複雑である ことと,試験期間が 5 日以上と長いことが課題である. Figure i-2 食中毒発生状況. (厚生労働省 食品安全委員会 リスクプロファイルより引用) ・1991 年から 2012 年までに発生した腸炎ビブリオ,サルモネラ属菌,カン ピロバクター・ジェジュニ/コリ,ブドウ球菌,EHEC 以外の病原大腸菌に よる食中毒発生事件数を示す. これらの社会的な背景のもと,本研究では LAMP を食品衛生微生物検査に応用する ことを目的とし,第 1 章では EHEC を検出する LAMP 用 Primer を設計し,stx-LAMP を 構築することで,血清型による見逃しの無い,迅速検出法を開発した.第 2 章では,
腸 炎 ビ ブ リ オ を 検 出 す る rpoD-LAMP を 構 築 し , 従 来 の MPN 法 に 融 合 さ せ た
MPN-rpoD-LAMP 法を開発し,作業労力を大幅に削減し,さらに検出までの時間を 19
時間に短縮した. 第 3 章では,TDH 産生腸炎ビブリオを検出するtdh-LAMP を構築し,
8 第 1 章 LAMP を利用した腸管出血性大腸菌(EHEC)の高感度かつ迅速検出 EHEC は,軽度の下痢から血便,稀に HUS など重篤な症状まで引き起こす食中毒原因 菌で,Stx を産生する特徴がある.したがって,Stx を検出することが,EHEC の検出 に等しい18).Stx は大別すると,Stx1 と Stx2 に分類され,それぞれに変異型(Stx1a, Stx1b,Stx1c,Stx1d と Stx2a,Stx2b,Stx2c,Stx2d,Stx2e,Stx2f,Stx2g)が報 告されている4, 19-23).構造は分子量約 30,000 の A サブユニット1分子と分子量約 7,000 の B サブユニット 5 分子から成り,A サブユニットは,真核細胞の 28S リボソーム RNA の 4,324 番目のアデノシンに作用し,その糖鎖を切断しアデニンを切り出す活性(RNA N-glycosidase 活性)を持つ.この作用で,新しいアミノアシル tRNA がリボソームに 結合できなくなり,タンパク質合成が阻害され,最終的に細胞が死滅する.B サブユ ニットは,細胞のレセプターであるグロボトリオシルセラミドへの結合に関与してい る. Stx を検出する方法は,生物学的検出方法,免疫学的検出方法,遺伝学的検出方法 が存在する.生物学的検出方法は,アフリカミドリザルの腎臓由来細胞であるベロ細 胞に対する毒性を検出する方法で,本毒素の存在を初めて発見した方法でもある4). この方法は細胞培養用の実験設備が必要な上,操作が煩雑であるばかりか,判定に約 1 週間を要する.また,他の毒素産生菌による偽陽性も生じるため,一般的な検査に 不向きである.免疫学的検出方法は,逆受身ラテックス凝集反応法(reversed passive latex agglutination:RPLA)とエライザ法(enzyme-linked Immunosorbent assay: ELISA)がある.RPLA は手技が簡単で,一度に多数の検体を処理できるので,日常の スクリーニング検査として便利な方法である.しかし,検出感度が不十分なため,被 検菌の毒素産生量が低い場合は検出できないケースがある.また変異型である Stx2e を検出できないケースも報告されている24).ELISA は反応時間に制約があるため,作 業スケジュールが束縛され,操作も複雑である.免疫学的検出方法は抗体の特異性を 基にしているので偽陰性が発生する事,作業時間が長い事,操作が複雑である事など, 検査法としては問題が残されている.遺伝学的検出方法は,DNA プローブ法や,コロ ニーハイブリダイゼーション法が報告されているが,専用の反応装置が必要で,技術 的にも高度であるため,一般的な検査に不向きである.PCR を利用した迅速検査法も 報告されているが,PCR 増幅物をアガロースゲル電気泳動で分析する確認試験が必要 であるため,実質作業時間を削減できない 4, 6).確認試験を不要とするリアルタイム PCR を用いた場合,簡易・迅速検出が可能になるが,装置と試薬が高価である.食中 毒菌汚染検査に限っては,PCR やリアルタイム PCR は不向きと考えられ,広くは普及 していない.
本研究では,Stx の検出に LAMP を利用した.Primer は,A サブユニットをコードす
る遺伝子を標的に定め設計した.構築した stx-LAMP の特異性試験と検出感度試験に
9 ついて,第 3 節では人為的に EHEC を汚染させた食材を調製後,stx-LAMP,stx-PCR, 培養法を使用した従来の EHEC 検査法 25-28)で検出を試み,操作性・作業時間・検出感 度の比較試験について示した. 第 1 章 実験の部 1.Primer の設計 本研究では,2003 年までにヒトへの感染が報告されている Stx(Stx1,Stx1a,Stx1b, Stx1c,Stx1d,Stx2,Stx2a,Stx2b,Stx2c,Stx2d,Stx2e,Stx2g)を検出対象とし た.はじめに Stx1,Stx1a,Stx1b,Stx1c のサブユニット A をコードする遺伝子を検 出する Primer(以下,stx1 検出用 Primer)を設計した.stx1,stx1a,stx1b,stx1c の配列は,National Center for Biotechnology Information(NCBI)の DNA データベ ースに 33 配列(AB015056,AB030485,AB035142,AB048231,AB048232,AB048234, AB048235,AB048237,AB071623,AE005442,AF153317,AF461166,AF461168,AF461169, AF461172,AJ132761,AJ251325,AJ271153,AJ279086,AJ304858,AJ312232,AJ314838, AJ314839,AP000400,AP002560,AY135685,L04539,M19437,M24352,X07903,Z36899, Z36900,Z36901)登録されていたので,アライメント分析により,変異する塩基の位 置を確認し,Primer 認識領域に入らないように考慮した.鋳型 DNA と Primer の間に ミスマッチが発生した場合,LAMP 増幅が進まない危険があるための対応である.しか し,Primer 間の距離など Primer 設計条件(Table i-2)を満たすために,FLP 認識領
域の T or A 29),B2c 領域の A or T 29),B3c 領域の T or C 30)を避けることができなか
った.そこで,その塩基に変異を有する菌またはゲノム DNA を入手し,LAMP 増幅でき る事を確認した.次に,Stx2,Stx2a,Stx2b,Stx2c,Stx2d,Stx2e,Stx2g のサブユ ニット A をコードする遺伝子を検出する Primer(以下,stx2 検出用 Primer)を設計 した.stx2,stx2a,stx2b,stx2c,stx2d,stx2e,stx2g の配列は,NCBI の DNA デ ータベースに 72 配列(AB012101,AB012102,AB015057,AB017524,AB030484,AB035143, AB046175,AB048222,AB048223,AB048224,AB048225,AB048226,AB048228,AB048229, AB048230,AB048233,AB048239,AB048240,AB048835,AB048836,AB048837,AB052227, AB071845,AE005296,AF043627,AF175707,AF291819,AF298816,AF329817,AF461165, AF461167,AF461170,AF461171,AF461173,AF461174,AF479828,AF479829,AF500187, AF500188,AF500189,AF500190,AF500191,AF500192,AF500193,AF521641,AF524944, AF524945,AF525039,AF525040,AF525041,AF548456,AJ272135,AJ313015,AJ313016, AP000422,AP002554,AY095209,AY143336,AY143337,L11078,L11079,M21534,M36727, M59432,U72191,X61283,X65949,X81415,X81416,X81417,X81418,Z37725)登録 されており,こちらも変異が認められた位置が,Primer 認識領域に入らないように考 慮した.しかし F3 領域に T or C31),FLP 領域に C or T31)と T or A31)と A or G31)と A or
10 C31),F1 領域に C or A32),B1c 領域に A or G33)と G or C34)と G or T34),B2c 領域に G or A31,32)と A or G35),B3c 領域に G or C36)と C or A31,32)を避けて設計することはできな かった.これら 13 塩基の変異に関しても,その変異を有する菌株またはゲノム DNA を入手し,増幅できる事を確認した.最後に,stx1 検出用 Primer と stx 2 検出用 Primer を均等に混ぜることで,stx1,stx1a,stx1b,stx1c,stx2,stx2a,stx2b,stx2c, stx2d,stx2e,stx2g の全てを検出できる Multiplex-LAMP Primer を作製し,stx-LAMP
試薬とした.stx-LAMP の Primer 認識領域には,合計 16 か所の変異塩基が登録されて
いたが,変異の影響を受けずに増幅できる Primer を設計した.Figure 1-1(a)に, stx1 の 1 例(GenBank accession no. AP002560)を示し,Primer 認識領域と遺伝子変
異の部位を示す.Figure 1-1(b)に,stx2 の 1 例(GenBank accession no. AE005296)
を示し,Primer 認識領域と遺伝子変異の部位を示す. 2.stx-LAMP 1)鋳型 DNA 溶液調製方法(stx-LAMP 用) 検体 50μL に,50 mM NaOH を 42 μL 添加し,100℃ 5 分加熱処理.直ちに 1 M Tris-HCl pH 7.0 を 8 μL 添加し,2,000×g にて 1 分間遠心した上清を LAMP 測定用鋳型 DNA 溶 液とした37). 2)stx-LAMP 反応液
基質および Buffer を含む 2×Universal LAMP Reaction Mixture(2×RM)とBst DNA
polymerase は,Loopamp DNA 増幅試薬キット(栄研化学(株))を使用した.Primer
の認識領域を Figure 1-1 に示す.stx1 および stx1a,stx1b,stx1c,stx1d 検出用の LAMP Primer 4 種類(stx1-FIP,stx1-BIP,stx1-F3P,stx1-B3P)と,LAMP 反応の増 幅速度を加速する Loop Primer(stx1-FLP)を Table 1-1(a)に示した.stx2 および stx2a,stx2b,stx2c,stx2d,stx2e,stx2g 検出用の LAMP Primer 4 種類(stx2-FIP, stx2-BIP,stx2-F3P,stx2-B3P)と,LAMP 反応の増幅速度を加速する Loop Primer (stx2-FLP1,stx2-FLP2)を Table 1-1(b)に示した.反応チューブに,12.5 μL の 2 ×RM と超純水を添加後,Table 1-1 に示す 11 種類の Primer を添加し,液量を 19 μL にした.Primer の添加量は Inner Primer と Loop Primer が各 40 pmol,Outer Primer 各 10 pmol に調製した.その後,Bst DNA polymerase 1 μL と LAMP 測定用鋳型 DNA 溶液 5 μL を添加し,25 μL の反応液とした. 3)増幅反応条件と確認方法 反応液を,リアルタイム濁度測定装置 LA-200(テラメックス(株))に設置し,65℃ で 60 分間の保温と,80℃,2 分間の加熱処理を行った.保温中の増幅反応は,LA-200 で 6 秒間隔に濁度 650 nm を測定し,60 分以内に濁度 0.1 に達した検体を陽性と判定, 60 分後に濁度が 0.1 に満たない検体を陰性とした.さらに反応停止後の反応液は目視 でも観察した.また反応液の一部を 2% アガロースゲル電気泳動で分析し,増幅パタ
11
ーンを確認した8).
(a) stx1 gene (GenBank accession no. AP002560)
(b) stx2 gene (GenBank accession no. AE005296)
Figure 1-1 EHEC 検出用 LAMP の Primer 認識領域. ・Primer 認識領域を編み掛で示す.
・Loop Primer の認識領域を矢印で示す.
12
Table 1-1 EHEC 検出用 LAMP の Primer 配列.
・赤文字はスペーサーとして付加した塩基を示す. ・小文字は遺伝子レベルでのバリアントのため改良した塩基を示す. (a)stx1,stx1a,stx1b,stx1c,stx1d 検出用に設計した Primer 配列を 示す. (b)stx2,stx2a,stx2b,stx2c,stx2d,stx2e,stx2g 検出用に設計した Primer 配列を示す. 3.stx-PCR 1)鋳型 DNA 調製方法(PCR 用) 菌希釈液または培養検体を 95℃ 10 分加熱後,直ちに 10,000×g にて 5 分間の遠心. 遠心上清を PCR 測定用鋳型 DNA 溶液とした. 2)stx-PCR 反応液
タカラ社のstx 検出用 Primer セット‘Primer Set EVC-1,EVC-2’を使用し38),50
μL の反応スケールで調製した. 3)増幅反応条件と判定方法
反応液をサーマルサイクラー ABI7000(Applied Bio Systems,Foster City,CA. USA) に設置し,94℃ 1 分 / 55℃ 1 分 / 72℃ 1 分の温度変化を 35 サイクル繰り返した後, 72℃にて 10 分加温した.PCR 増幅物は 3% アガロースゲル電気泳動で分離後,エチジ ウムブロマイドで染色し,UV ライトで DNA を発光させた.stx 産物の特徴である鎖長 171 bp のバンドを目視で検出できた検体を陽性と判定し,目視で検出できなかった検 体を陰性と判定した. Prime r の名称 Se qu e n c e (5 '- 3 ') (a) stx1および stx1a, stx1b, stx1c, stx1d検出用
stx1-FIP GCTCTTGCCACAGACTGCACATTCGTTGACTACTTCTTATCTGG
stx1-BIP CTGTGACAGCTGAAGCTTTACGCGAAATCCCCTCTGaATTTGCC
stx1-F3P GCTATACCACGTTACAGCGTG
stx1-B3P ACTACTCAACCTTCCCCAGTTC
stx1-FLP AGGTTCCgCTATGCGACATTAAAT
(b) stx2および stx2a, stx2b, stx2c, stx2d, stx2e, stx2g検出用
stx2-FIP GCTCTtGATGCATCTCTGGTACACTCACTGGTTTCATCATATCTGG
stx2-BIP CTGTCACAGCAGAAGCCTTACGGACGAAATTCTCcCTGTATCTGCC
stx2-F3P CAGTTATACCACTCTGCAACGTG
stx2-B3P CTGATTCGCCgCCAGTTC
stx2-FLP1 TGTATTACCACTGAACTCCATTAACG
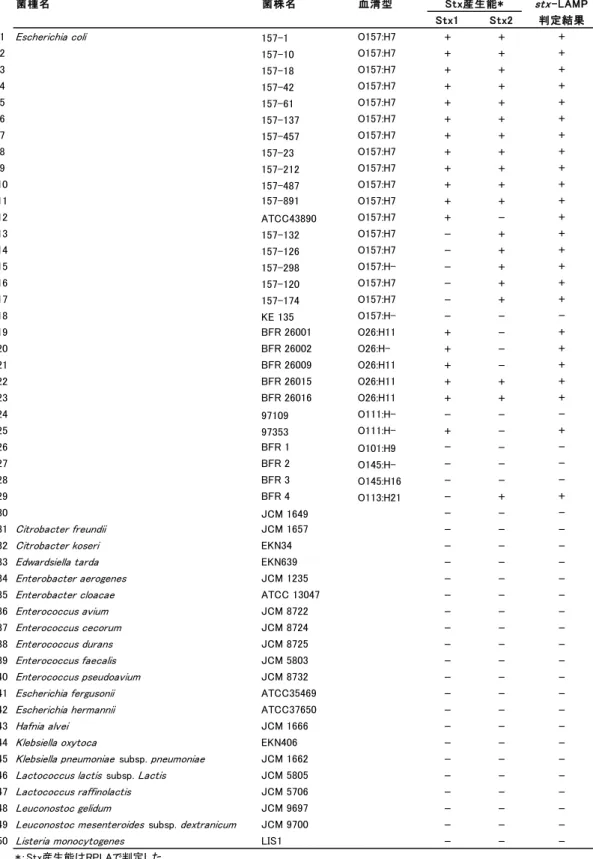
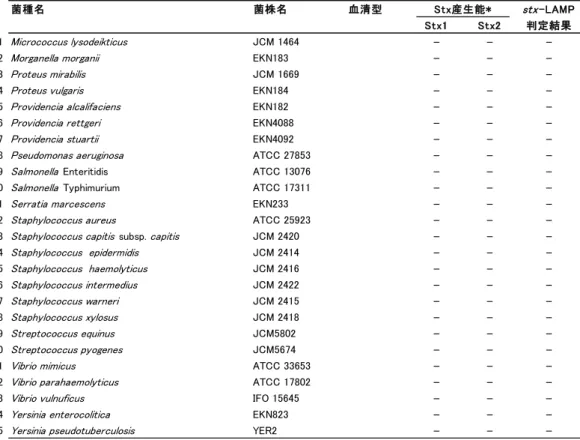
13 4.stx-LAMP の特異性 1)供試菌株 stx-LAMP の特異性確認試験は,EHEC 24 株と Stx 非産生大腸菌 6 株,大腸菌以外の Stx 非産生菌 45 菌種 45 株を使用した(Table 1-2).大腸菌以外の Stx 非産生株は, 食品検査,臨床検査,糞便検査で,検体に共存する可能性がありうる菌種を選択した. 2)検体調整
ビブリオ属の菌株は,NaCl を終濃度 3% に調製した Trypticase soy agar(Becton
Dickinson 社)(以下,3% NaCl-TSA と示す)に接種し,ビブリオ属以外の供試菌株は
Brain heart infusion agar(Becton Dickinson 社)に接種した.培養温度 37℃で 18 時間培養後に出現したコロニーを,滅菌した 0.85% NaCl, 10 mM phosphate buffer pH
7.5(以下, 滅菌 PBS と示す)に懸濁し, McFarland 標準液 No.2(6.0 X 108 CFU/mL)
と同じ濁度を調製.さらに滅菌 PBS で希釈し,約 1.0 X 106 CFU/mL の菌懸濁液を調製 し,stx-LAMP の特異性確認試験の検体とした. 3)検出方法 鋳型 DNA 調製方法および増幅反応の条件と確認方法は,2.stx-LAMP と 3.stx-PCR に示した. 5.最小検出感度 1)供試菌株 stx-LAMP の最小検出感度は,Stx1 および Stx2 産生大腸菌 2 株(157-891 [血清型 O157:H7],BFR26015 [血清型 O26:H11]),Stx1 産生大腸菌 2 株(ATCC 43890 [血清型 O157:H7],97353 [血清型 O111:H-]),Stx2 産生大腸菌 1 株(157-120 [血清型
O157:H7]),計 5 株より求めた.ATCC 43890 は,American Type Culture Collection
(ATCC)より購入した. 2)検出と生菌数測定
供試菌株を 100 mL Trypticase soy broth(TSB;Becton Dickinson 社)で 37℃ 18
時間培養し,その新鮮培養液 500 μL を,滅菌 PBS で 10-3倍,10-4倍,10-5倍,10-6 倍,10-7倍希釈した.作製した 10 倍希釈系列の内,10-3倍,10-4倍,10-5倍,10-6倍希 釈液は stx-LAMP と stx-PCR で検出を試みた.stx-LAMP と stx-PCR は,各希釈液で 2 チューブ行い,2 回とも増幅した場合を陽性と判定した.また生菌数測定は,10-5倍, 10-6倍,10-7倍希釈液を,各 2 枚の TSA に 100 μL ずつ塗抹し,37℃18 時間培養後の コロニー数が,30 個から 300 個を信頼できる値として集計した.stx-LAMP および stx-PCR の各反応チューブ中に含まれる生菌数(Cell number in test tube : CFU/test tube)は,生菌数測定結果と希釈倍率を基に理論値として算定した.
14
Table 1-2 供試菌株.
菌種名 菌株名 血清型 Stx産生能* stx-LAMP
Stx1 Stx2 判定結果
1 Escherichia coli 157-1 O157:H7 + + +
2 157-10 O157:H7 + + + 3 157-18 O157:H7 + + + 4 157-42 O157:H7 + + + 5 157-61 O157:H7 + + + 6 157-137 O157:H7 + + + 7 157-457 O157:H7 + + + 8 157-23 O157:H7 + + + 9 157-212 O157:H7 + + + 10 157-487 O157:H7 + + + 11 157-891 O157:H7 + + + 12 ATCC43890 O157:H7 + - + 13 157-132 O157:H7 - + + 14 157-126 O157:H7 - + + 15 157-298 O157:H- - + + 16 157-120 O157:H7 - + + 17 157-174 O157:H7 - + + 18 KE 135 O157:H- - - -19 BFR 26001 O26:H11 + - + 20 BFR 26002 O26:H- + - + 21 BFR 26009 O26:H11 + - + 22 BFR 26015 O26:H11 + + + 23 BFR 26016 O26:H11 + + + 24 97109 O111:H- - - -25 97353 O111:H- + - + 26 BFR 1 O101:H9 - - -27 BFR 2 O145:H- - - -28 BFR 3 O145:H16 - - -29 BFR 4 O113:H21 - + + 30 JCM 1649 - - -31 Citrobacter freundii JCM 1657 - -
-32 Citrobacter koseri EKN34 - -
-33 Edwardsiella tarda EKN639 - -
-34 Enterobacter aerogenes JCM 1235 - -
-35 Enterobacter cloacae ATCC 13047 - -
-36 Enterococcus avium JCM 8722 - -
-37 Enterococcus cecorum JCM 8724 - -
-38 Enterococcus durans JCM 8725 - -
-39 Enterococcus faecalis JCM 5803 - -
-40 Enterococcus pseudoavium JCM 8732 - -
-41 Escherichia fergusonii ATCC35469 - -
-42 Escherichia hermannii ATCC37650 - -
-43 Hafnia alvei JCM 1666 - -
-44 Klebsiella oxytoca EKN406 - -
-45 Klebsiella pneumoniae subsp. pneumoniae JCM 1662 - -
-46 Lactococcus lactis subsp. Lactis JCM 5805 - -
-47 Lactococcus raffinolactis JCM 5706 - -
-48 Leuconostoc gelidum JCM 9697 - -
-49 Leuconostoc mesenteroides subsp. dextranicum JCM 9700 - -
-50 Listeria monocytogenes LIS1 - -
15
Table 1-2 continued.
・EHEC 検出用 LAMP(stx-LAMP)の特異性確認に供試した 75 菌株と,RPLA
およびstx-LAMP の判定結果を示す. ・+は RPLA またはstx-LAMP で陽性判定を示す. ・-は RPLA またはstx-LAMP で陰性判定を示す. 6.EHEC 汚染検体での評価 食品検体の中には,PCR など高感度遺伝子検査法で陽性と判定されたが,培養法で 原因菌が分離できない検体が存在し,これらを‘汚染疑いの検体’と呼んでいる.本 研究では,stx-PCR で陽性と判定されたが,EHEC が分離されない牛塊肉 4 検体 (03-150,03-156,03-266,03-304)を,EHEC 汚染検体と同等試料と見なし,stx-LAMP の評価に使用した.stx-LAMP 反応の陰陽判定は,リアルタイム濁度測定装置による判 定の他,目視でも判定した. さらに,stx-LAMP 反応で出現した濁りが,stx 遺伝子を鋳型に LAMP 増幅した結果 であることを,アガロースゲル電気泳動解析と DNA 配列シークエンス解析で確認した. LAMP 増幅物は,アガロースゲル電気泳動でラダー状の泳動パターンを示すことが報告 されているので 8),stx-LAMP 増幅物の泳動パターンを確認した.また,増幅産物の DNA 配列をシークエンス解析し,既報のstx 遺伝子配列と照合した. 菌種名 菌株名 血清型 Stx産生能* stx-LAMP Stx1 Stx2 判定結果 51 Micrococcus lysodeikticus JCM 1464 - -
-52 Morganella morganii EKN183 - -
-53 Proteus mirabilis JCM 1669 - -
-54 Proteus vulgaris EKN184 - -
-55 Providencia alcalifaciens EKN182 - -
-56 Providencia rettgeri EKN4088 - -
-57 Providencia stuartii EKN4092 - -
-58 Pseudomonas aeruginosa ATCC 27853 - -
-59 Salmonella Enteritidis ATCC 13076 - -
-60 Salmonella Typhimurium ATCC 17311 - -
-61 Serratia marcescens EKN233 - -
-62 Staphylococcus aureus ATCC 25923 - -
-63 Staphylococcus capitis subsp. capitis JCM 2420 - -
-64 Staphylococcus epidermidis JCM 2414 - - -65 Staphylococcus haemolyticus JCM 2416 - - -66 Staphylococcus intermedius JCM 2422 - - -67 Staphylococcus warneri JCM 2415 - - -68 Staphylococcus xylosus JCM 2418 - - -69 Streptococcus equinus JCM5802 - - -70 Streptococcus pyogenes JCM5674 - -
-71 Vibrio mimicus ATCC 33653 - -
-72 Vibrio parahaemolyticus ATCC 17802 - -
-73 Vibrio vulnuficus IFO 15645 - -
-74 Yersinia enterocolitica EKN823 - -
-16 1)増菌培養 ストマックバックに EHEC 汚染検体 25 g と mEC+n 225 mL を分取後,ホモジナイズ 処理を施し,42℃にて 18 時間培養した.陽性コントロールは,EHEC 株 157-212 を mEC+n に接種し培養した.陰性コントロールは,EHEC 株を接種せずに mEC+n を培養した. 2)鋳型 DNA 溶液の調製方法 エッペンチューブに増菌培養液 50 μL を分取し,50 mM NaOH を 42 μL 添加後に 100℃ 5 分加熱処理.その後直ちに 1 M Tris-HCl pH 7.0 を 8 μL 添加し,2,000×g にて 1 分間遠心.遠心上清を LAMP 測定用鋳型 DNA 溶液とした. 3)stx-LAMP 反応と判定方法
鋳型 DNA 溶液 5 μL をstx-LAMP 反応液に添加し,リアルタイム濁度測定装置 LA-200
を用いて,65℃にて 60 分反応させた. (a)リアルタイム濁度測定装置による判定 60 分以内に濁度 0.1 に達した検体を陽性と判定,60 分反応させても濁度 0.1 に満 たない検体を陰性と判定した. (b)目視判定 65℃ 60 分反応終了後の反応液を観察し,濁りが確認できた検体を陽性と判定し, 濁りを確認できない検体を陰性と判定した. (c)アガロースゲル電気泳動 反応終了後の反応液 0.1 μL を 2% アガロースゲル電気泳動で分析し,LAMP 増幅物 の特徴であるラダー状の増幅パターンの有無で判定した8). 4)stx-LAMP 増幅物の DNA シークエンス解析
stx-LAMP 反応で濁度の上昇が認められた反応液を,QIAquick PCR purification kit (Qiagen)で精製処理し,BigDye Terminator v. 3.1 cycle sequencing kit(Applied Biosystems)と ABI 310 genetic analyser(Applied Biosystems)で DNA 配列をシー
ク エ ン ス 解析 し た . シ ー ク エ ンス 用 Primer (stx1 解 析用 Cy5 標 識 Primer :
5’-CATTCGTTGACTTCTTATCTGG-3’ , stx2 解 析 用 Cy5 標 識 Primer :
5’-CACTCACTGCTGGTTTCATCATATCTGG-3’)は,オペロン社に合成を依頼した. 7.従来の EHEC 検査法との比較
牛挽肉およびカイワレ大根に,EHEC を人為的に接種し,EHEC で汚染した食材を調
製した.この EHEC 汚染食材を検体とし,stx-LAMP と stx-PCR で EHEC の検査を試みた.
同時に,培養法を使用した従来の EHEC 検査法も行い,それぞれの検出感度と作業時 間を比較した.
17 1)人為的に EHEC を汚染させた食材の調製 (a)食材の準備 スーパーマーケットで購入した牛挽肉およびカイワレ大根を,ストマックバックに 25g ずつ分取した. (b)接種菌の準備
血清型 O157 の EHEC 157-212 と血清型 O26 の EHEC BFR26015 を TSB で 37℃ 18 時間
培養後,滅菌 PBS で 10-5倍,10-6倍,10-7倍,10-8倍の希釈液を作製した.
(c)食材への接種
10-6倍希釈液 100 μL を,ストマックバックに分取した牛挽肉 25 g およびカイワレ
大根 25 g に接種し,EHEC で汚染した食材を調製した.EHEC 157-212(血清型 O157) を接種した牛挽肉は 5 検体,EHEC BFR26015(血清型 O26)を接種した牛挽肉は 5 検体, EHEC 157-212(血清型 O157)を接種したカイワレ大根は 5 検体,EHEC BFR26015(血 清型 O26)を接種したカイワレ大根は 5 検体調整した.また,EHEC を接種しない牛挽 肉 5 検体とカイワレ大根 5 検体も調整し,購入した食材が EHEC 陰性であることの確 認に使用した.各条件の汚染食材を 5 検体ずつ調整した(n=5). (d) 接種菌数の測定 10-5倍,10-6倍,10-7倍,10-8倍希釈液を,各 2 枚の TSA に塗抹し,37℃18 時間培養 後のコロニー数が,1 枚の TSA に 30 個から 300 個の結果を信頼性のある値とし,生菌 数を算出した.さらに,食材に接種した菌液の希釈倍率(10-6倍希釈)と接種菌液量 (100 μL)を計算に入れ,接種した菌数を算定した. 2)増菌培養 各ストマックバックに mEC+n 225 mL を添加し,EHEC で汚染させた食材を懸濁後, 42℃ 18 時間の培養した. 3)増菌培養液からの検出
増菌培養液を試験検体とし,EHEC 157-212(血清型 O157)と EHEC BFR26015(血清 型 O26)を,stx-LAMP,stx-PCR,従来の検査法で検出した.それぞれ二重測定で試験 した(n=2). (a)stx-LAMP による検出 増菌培養液 50 μL を遠心チューブに分取し,Loopamp DNA 増幅試薬キット添付の Extraction solution を 50 μL 添加.直ちに 100℃ 5 分加熱処理した後,2,000×g にて 1 分間遠心した上清を LAMP 測定用鋳型 DNA 溶液とした.反応条件と判定方法は, stx-LAMP に記載した.5 検体ずつ調整した汚染食材を,stx-LAMP で二重測定したので 10 回ずつの試験になる. (b)stx-PCR による検出 増菌培養液 0.1 mL を遠心チューブに分取し,10,000×g にて 10 分間遠心.上清を 除去後に超純水 0.1 mL で懸濁し 95℃ 5 分間加熱.直ちに 10,000×g にて 10 分間遠
18 心し,上清を stx-PCR 測定用鋳型 DNA 溶液とした.反応条件と判定方法は,stx-PCR に記載した.5 検体ずつ調整した汚染食材を,stx-PCR で二重測定したので 10 回ずつ の試験になる. (c)従来の EHEC 検査法 増菌培養液 10 μL を分離培地に画線塗布する試験方法(以下,直接塗布法と示す) と,増菌培養液を免疫磁気ビーズ分離法(immunomagnetic separation:IMS)で濃縮処 理 39)し,その濃縮液 10 μL を分離培地に画線塗布する試験方法(以下,IMS 塗布法
と示す)で分離検出を試みた.EHEC 157-212(血清型 O157)は,血清型 O157 検出用 の分離培地および IMS を使用し,EHEC BFR26015(血清型 O26)は,血清型 O26 検出用 の分離培地および IMS を使用した.
血清型 O157 検出用の分離培地は,Sorbitol MacConkey agar に Cefixime(0.05 mg/L) と Potassium tellurite(2.5 mg/L)を添加した培地(以下,CT-SMAC と示す)と CHROMagar O157(関東化学)を使用した.IMS は抗 O157 抗体を感作した Dynabeads
(dynal)を使用した39).直接塗布法および IMS 塗布法で出現した血清型 O157 と疑わ
れるコロニーは,釣菌し,免疫学的方法で確認試験を行った.
血清型 O26 検出用の分離培地は,Rhamnose MacConkey agar に Cefixime(0.05 mg/L) と Potassium tellurite(2.5 mg/L)を添加した培地(以下,CT-RMAC と示す)と Rx ViO26
(栄研化学(株))を使用した.IMS は抗 O26 抗体を感作した Beads(デンカ生研(株))
を使用した.直接塗布法および IMS 塗布法で出現した血清型 O26 と疑われるコロニー は,釣菌し,免疫学的方法で確認試験を行った.5 検体ずつ調整した汚染食材を,分 離培地に二枚ずつ画線塗布したので,10 回ずつの試験になる. 第 1 節 EHEC 検出用 LAMP の構築 1.特異性 stx-LAMP の特異性を確認するため,Table 1-2 に示す 75 株を供試した.Stx1 と Stx2 の両方を産生している EHEC は血清型 O157 11 株と血清型 O26 2 株を陽性と判定で
きた(Table 1-3).Stx1 産生株は血清型 O157 1 株,血清型 O26 3 株,血清型 O111
1 株を陽性と判定できた.Stx2 産生株は血清型 O157 5 株,血清型 O113 1 株を陽性 に判定できた.さらに Stx 非産生株は血清型 O157,血清型 O111,血清型 O145,血清 型 O101 であっても陰性と判定できた.対照に使用した CT-SMAC は,培養法による EHEC 検出に使用されている分離培地である.血清型 O157 を指標としているため,Stx 産生 株であっても検出不可の株(Table 1-3 の*2)や,Stx 非産生株であっても血清型 O157 の株(Table 1-3 の*3)を陽性と誤判定していた.
19 Table 1-3 stx-LAMP の特異性の培養法との比較. ・Stx 産生大腸菌 24 株と Stx 非産生大腸菌 6 株,大腸菌以外の Stx 非産生 菌 45 株,計 75 株を供試した結果を示す. *1:stx-LAMP と CT-SMAC 培養法で検査し,陽性と判定した株数を示す. *2:stx-LAMP で陽性と判定したが,CT-SMAC で陰性と誤判定した株. *3:stx-LAMP で陰性と判定したが,CT-SMAC で陽性と誤判定した株. 2.最小検出感度 Stx1 および Stx2 産生大腸菌 2 株(EHEC 157-891 [血清型 O157:H7],EHEC BFR26015 [O26:H11] ), Stx1 産 生 大 腸 菌 2 株 ( EHEC ATCC 43890 [O157:H7] , EHEC 97353
[O111:H-]),Stx2 産生大腸菌 1 株(EHEC 157-120 [O157:H7]),計 5 株を用いて,
stx-LAMP と stx-PCR の最小検出感度を求めた(Table 1-4).
生菌数測定は,1 枚の TSA に 30 から 300 個のコロニーが出現した場合を信頼性のあ
る値とした.EHEC 157-891,EHEC ATCC43890,EHEC 157-120,EHEC 97353 は 10-6希釈
で,EHEC BFR26015 は 10-5希釈で計測できたので,各反応チューブに含まれる生菌数
(CFU/test tube)は,その生菌数測定結果と希釈倍率から算定した.
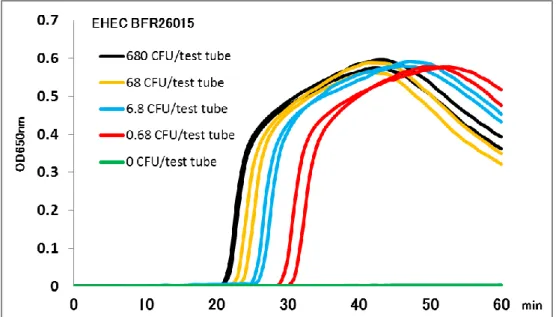
stx-LAMP は EHEC BFR26015 において 0.68 CFU/test tube を検出でき(Figure 1-2), stx-PCR より感度が優れていた(Table 1-4).
判定結果*1
stx-LAMP
Escherichia coli Stx1/Stx2 O157 11 11 11
Stx1/Stx2 O26 2 2 0 *2 Stx1 O157 1 1 1 Stx1 O26 3 3 0 *2 Stx1 O111 1 1 0 *2 Stx2 O157 5 5 5 Stx2 O113 1 1 0 *2 非産生 O157 1 0 1 *3 非産生 O111 1 0 0 非産生 O145 2 0 0 非産生 O101 1 0 0 非産生 その他 1 0 0 E. coli 以外 非産生 45 0 0 合計 75 24 18 血清型 試験 株数 CT-SMAC 培養法 菌種 Stx 産生能
20
Table 1-4 EHEC 検出用 LAMP と PCR の最少検出感度の比較.
・検出する遺伝子としてstx1,stx2 を用い,供試菌の濃度を多段階に変化
させ,stx-LAMP,stx-PCR で検出を試みた.菌株 5 株を用いて比較した.
・最も小さな値を示したのは,stx-LAMP で 0.68 CFU/test tube(BFR26015),
stx-PCR で 6.8 CFU/test tube(BFR26015)であった.
Figure 1-2 EHEC BFR26015 のstx-LAMP での増幅における濃度依存性.
・EHEC BFR26015(血清型 026)を培養し,培養直後の新鮮な菌液を PBS で 希釈し,10 倍希釈系列を作製した.680 CFU/test tube~0.68 CFU/test tube の新鮮な菌を用いて,stx-LAMP で増幅した. ・0 CFU/test tube(ネガティブコントロール)で,濁度の上昇は観察され ず,0.68 CFU/test tube 以上で,濁度の上昇が観察された. 第 2 節 EHEC 汚染検体での評価 本研究では,stx-PCR で陽性と判定されたが,EHEC が分離されない牛塊肉を,EHEC 汚染検体と同等の試料と見なし,stx-LAMP の評価に使用した. 供試菌株 最小検出感度 (CFU/test tube) stx gene 菌株名 血清型 stx -LAMP stx -PCR stx1 and stx2 157-891 O157 1.1 1.1×102 BFR26015 O26 0.68 6.8 stx1 ATCC43890 O157 0.80 8.0×10 97353 O111 2.2 2.2×10 stx2 157-120 O157 1.3 1.3×10
21
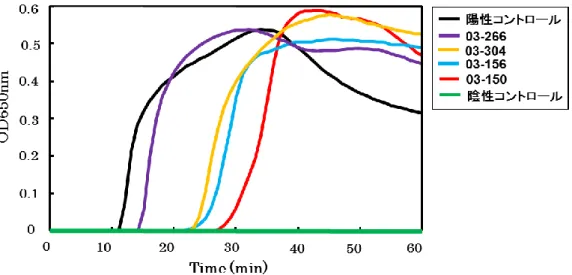
リアルタイム濁度測定装置 LA-200 で測定した濁度の変化を Figure 1-3 に示す.陽 性コントロールと牛塊肉 4 検体(03-266,03-304,03-156,03-150)は 60 分以内に 濁度の上昇が観察されたので陽性と判定できた.
Figure 1-3 EHEC 汚染検体を用いたstx-LAMP の評価(LA-200).
・EHEC に汚染した牛塊肉 4 検体を用いて,stx-LAMP 検出を試みた. ・濁度はリアルタイム濁度測定装置 LA-200 で測定した. 黒色,陽性コントロール(EHEC 株 157-212)は,反応開始 12 分で濁度の上 昇が観察された. 紫色,牛塊肉 03-266 は,反応開始 15 分で濁度の上昇が観察された. 橙色,牛塊肉 03-304 は,反応開始 22 分で濁度の上昇が観察された. 水色,牛塊肉 03-156 は,反応開始 23 分で濁度の上昇が観察された. 赤色,牛塊肉 03-150 は,反応開始 28 分で濁度の上昇が観察された. 緑色,陰性コントロールは,濁度の上昇が観察されなかった.
Figure 1-4 は,stx-LAMP 生成物の目視像を示す,陽性コントロール(No.1)と 4 種類の牛塊肉(No.2~5)で白濁が確認され,陰性コントロール(No.6)は透明で あった.目視でも判定できた.
Figure 1-5 は,stx-LAMP 増幅物をアガロースゲル電気泳動で確認した結果を示す. LAMP 増幅物に典型的なラダー状のバンドが観察され,そのパターンが陽性コントロー ル(No. 1)と同じであった.
Figure 1-6 に増幅物の DNA シークエンス解析結果を示す.Figure 1-6(a)は, stx1 の F1 領域から B1 領域の配列を示し,Figure 1-6(b)は stx2 の F1 領域から
B2 領域の配列を示す.図中に示す‘理論上の配列’とは,stx1 GenBank accession
no. AP002560 と stx2 GenBank accession no. AE005296 の配列を LAMP 原理に当
てはめ,理論的に予測された配列を示す.検体より LAMP 増幅した DNA 配列は,理 論的に予測された配列と,ほぼ一致した.
22 1,陽性コントロール (EHEC 157-212) 2,牛塊肉 03-150 3,牛塊肉 03-156 4,牛塊肉 03-266 5,牛塊肉 03-304 6,陰性コントロール
Figure 1-4 EHEC 汚染検体におけるstx-LAMP 生成物の目視像.
・EHEC に汚染した牛塊肉 4 検体を用いて stx-LAMP 増幅を試み,反応停止 後のチューブの目視像を示す. ・陽性コントロール(1)および EHEC 汚染検体(2~5)で濁りが観察され, 陰性コントロール(6)は濁りが観察されなかった. 1,陽性コントロール (EHEC 157-212) 2,牛塊肉 03-150 3,牛塊肉 03-156 4,牛塊肉 03-266 5,牛塊肉 03-304 6,陰性コントロール M,100bp マーカー
Figure 1-5 EHEC 汚染検体におけるstx-LAMP 増幅物の電気泳動像.
・LAMP 増幅物をアガロースゲル電気泳動で検出した.
・EHEC に汚染した牛塊肉より増幅した DNA(2 から 5)は,LAMP 産物特有の ラダー状のパターンを示し,陽性コントロール(1)で増幅した DNA と同 じパターンを示した.
23
Figure 1-6 LAMP 増幅物の DNA シークエンス.
・(a)はstx1 の F1 領域から B1 領域の配列を示し,(b)はstx2 の F1 領域か ら B2 領域の配列を示す. ・図中に示す‘理論上の配列’は,stx1(AP002560)と stx2(AE005296) の配列を LAMP 原理に当てはめ,理論的に予測された配列を示す. ・配列中の「-」は,理論上の配列と同じ塩基を示す. ・配列中の「*」は,理論上の配列には存在するが,検体では欠損してい た塩基部位を示す. ・EHEC 汚染検体(牛塊肉)4 検体で増幅した DNA は,理論上の配列と高い 相同性を示した. 第 3 節 従来の EHEC 検査法との比較 牛挽肉およびカイワレ大根に EHEC を人為的に接種し,EHEC で汚染した食材を調製 した.食材に接種した菌希釈液は,接種と同時に TSA に塗抹し,37℃18 時間培養後の コロニー数から,前日に接種した生菌数を算定した.その結果,牛挽肉に接種した EHEC 157-212(血清型 O157)は 0.40 CFU/g,EHEC BFR26015(血清型 O26)が 0.20 CFU/g であった.また,カイワレ大根に接種した生菌数は EHEC 157-212(血清型 O157)が 1.5 CFU/g,EHEC BFR26015(血清型 O26)が 0.80 CFU/g であった.
この EHEC 汚染食材を検体とし,stx-LAMP と stx-PCR で EHEC の検査を試みた.同時
に,培養法を使用した従来の EHEC 検査法も行い,それぞれの検出感度と作業時間を 比較した.牛挽肉を用いた実験概略図と結果を,Figure 1-7 に示し,カイワレ大根を 用いた実験概略図と結果を,Figure 1-8 に示す.それぞれ,stx-LAMP による検査法 (a) stx 1 F1 B1 理論上の配列(AP002560) G C A G T C T G T G G C A A G A G C G A T G T T A C G G T T T G T T A C T G T G A C A 陽性コントロール(EHEC 157-212) - - - * - - - -牛塊肉 03-150 - - - -牛塊肉 03-156 - - - C -牛塊肉 03-266 - - - T - - - - -牛塊肉 03-304 - - - * -(b) stx 2 F1 B1 理論上の配列(AE005296) A C C A G A G A T G C A T C C A G A G C A G T T C T G C G T T T T G T C A C T G T C A C 陽性コントロール(EHEC 157-212) - - - -牛塊肉 03-150 - - - * - * * * - - - G G T -牛塊肉 03-156 - - - G - - * - - - - G G T -牛塊肉 03-266 - - - G - - - -牛塊肉 03-304 - - - * * * - - - -B1 B2 理論上の配列(AE005296) A G C A G A A G C C T T A C G C T T C A G G C A G A T A C A G A G A G A A T T T C G T C 陽性コントロール(EHEC 157-212) -牛塊肉 03-150 - - - G -牛塊肉 03-156 - - - G -牛塊肉 03-266 -牛塊肉 03-304 - - - G
-24
(a)牛挽肉に含まれる大腸菌 O157 の検出方法の概略
(b)牛挽肉に含まれる大腸菌 O26 の検出方法の概略
Figure 1-7 EHEC を人工的に汚染させた牛挽肉からの EHEC 検出.
・上段(a)は牛挽肉に EHEC 157-212(血清型 O157)を接種し,下段(b)
は EHEC BFR26015(血清型 O26)を接種した.接種菌量はそれぞれ 0.40 CFU/g
(10 CFU/25 g),0.20 CFU/g(5 CFU/25 g)であった.
・mEC+n で増菌培養を行い,LAMP 法(図中①,⑦)と PCR 法(②,⑧)と 培養法(③~⑥,⑨~⑫)で検出率を比較した. ・EHEC 157-212(血清型 O157)を接種した場合,①~⑥で 100% の検出率 を示した. ・EHEC BFR26015(血清型 O26)を接種した場合,⑦,⑧,⑪,⑫は 100% の検出率であったが,⑨と⑩は 90% の検出率であった. 牛挽肉 25 g EHEC汚染食材 EHEC 157-212 の調整方法 (血清型O157) 10 CFU (接種菌量=0.4 CFU/g) mEC+n 225 mL 増菌培養(42℃ 22±2h) 増菌培養液 検出方法
DNA Extraction IMS LAMP PCR CT-SMAC CHROMag ar O157 CT-SMAC CHROMag ar O157 ① ② ③ ④ ⑤ ⑥ 陽性検出率 100% 100% 100% 100% 100% 100% 牛挽肉 25 g EHEC汚染食材 EHEC BFR26015 の調整方法 (血清型O26) 5 CFU (接種菌量=0.2 CFU/g) mEC+n 225 mL 増菌培養(42℃ 22±2h) 培養液 検出方法
DNA Extraction IMS LAMP PCR CT-RMAC RX O26 CT-RMAC RX O26
⑦ ⑧ ⑨ ⑩ ⑪ ⑫
25
(a)カイワレ大根に含まれる大腸菌 O157 の検出方法の概略
(b)カイワレ大根に含まれる大腸菌 O26 の検出方法の概略
Figure 1-8 EHEC を人工的に汚染させたカイワレ大根からの EHEC 検出. ・上段(a)はカイワレ大根に EHEC 157-212(血清型 O157)を接種し,下
段(b)は EHEC BFR26015(血清型 O26)を接種した.接種菌量はそれぞ
れ 1.5 CFU/g(38 CFU/25 g),0.80 CFU/g(20 CFU/25 g)であった.
・mEC+n で増菌培養を行い,LAMP 法(図中①,⑦)と PCR 法(②,⑧)と 培養法(③~⑥,⑨~⑫)で検出率を比較した. ・EHEC 157-212(血清型 O157)を接種した場合,①,②,③,⑤で 100% の 検出率であったが,④で 30%,⑥で 70% の検出率であった. ・EHEC BFR26015(血清型 O26)を接種した場合,⑦,⑪,⑫は 90% の検出 率であったが,⑨と⑩は 80%,⑧は 50% の検出率であった. カイワレ大根 25 g EHEC汚染食材 EHEC BFR26015 の調整方法 (血清型O26) 20 CFU (接種菌量=0.8 CFU/g) mEC+n 225 mL 増菌培養(42℃ 22±2h) 培養液 検出方法
DNA Extraction IMS LAMP PCR CT-RMAC RX O26 CT-RMAC RX O26
⑦ ⑧ ⑨ ⑩ ⑪ ⑫ 陽性検出率 90% 50% 80% 80% 90% 90% カイワレ大根 25 g EHEC汚染食材 EHEC 157-212 の調整方法 (血清型O157) 38 CFU (接種菌量=1.5 CFU/g) mEC+n 225 mL 増菌培養(42℃ 22±2h) 増菌培養液 検出方法
DNA Extraction IMS LAMP PCR CT-SMAC CHROMag ar O157 CT-SMAC CHROMag ar O157 ① ② ③ ④ ⑤ ⑥ 陽性検出率 100% 100% 100% 30% 100% 70%
26 を①,⑦で示し,stx-PCR 法による検査法を②,⑧,従来の検査法を③,④,⑤,⑥, ⑨,⑩,⑪,⑫で示した.またその下に,10 回試験した時の陽性検出率(%)を示し た. (A)牛挽肉に EHEC を接種した場合 EHEC 157-212(血清型 O157)を牛挽肉に接種した検体は,全ての試験法(①~⑥) において差は見られず,100% の検出率であった. EHEC BFR26015(血清型 O26)を牛挽肉に接種した検体は,LAMP 法(⑦),PCR 法(⑧), IMS 塗布法(⑪,⑫)で 100% の検出率であったが,CT-RMAC での直接塗布法(⑨), RX O26 での直接塗布法(⑩)でそれぞれ 90% に減少していた. (B)カイワレ大根に EHEC を接種した場合
EHEC 157-212(血清型 O157)7 をカイワレ大根に接種した検体は,LAMP 法(①),
PCR 法(②),CT-SMAC での直接塗布法(③),CR-SMAC での IMS 塗布法(⑤)で 100% の
検出率であったが,CHROMagar O157 での直接塗布法(④)で 30%,CHROMagar O157 での IMS 塗布法(⑥)で 70% に減少していた. EHEC BFR26015(血清型 O26)をカイワレ大根に接種した検体は,LAMP 法(⑦)と IMS 塗布法(⑪,⑫)で 90% の検出率であったが,PCR 法(⑧)では 50%,直接塗布 法(⑨,⑩)では 80% に減少していた. 第 1 章 考察 stx-LAMP は,Stx 産生株 24 株を全て陽性に判定し,Stx 非産生株 51 株を全て陰性 に判定できたので,一致率は 100% であった(Table 1-5).一方 CT-SMAC は,Stx 産 生株 24 株中 18 株を陽性に判定し,6 株は陰性に誤判定していた.産生株での一致率 は 75% であった.Stx 非産生株 51 株中 50 株を陰性に判定し,1 株は陽性に誤判定し ていた.非産生株での一致率は 98% であった.stx-LAMP は,特異性試験で供試した
Table 1-5 stx-LAMP と CT-SMAC の比較(一致率の比較).
・Stx 産生株 24 株と Stx 非産生株 51 株を用いて,stx-LAMP と CT-SMAC 培養法の 検出特異性について比較した. ・stx-LAMP は,Stx 産生株で 100% の一致率を示し,Stx 非産生株でも 100%であっ た. ・CT-SMAC 培養法は,Stx 産生株で 75% の一致率を示し,Stx 非産生株は 98%であ った. 供試菌株 stx-LAMP CT-SMAC培養法 Stx産生能 株数 陽性 陰性 (一致率) 陽性 陰性 (一致率) Stx産生株 24 24 0 (100%) 18 6 (75%) Stx非産生株 51 0 51 (100%) 1 50 (98%)
27
EHEC 24 株の内,血清型 O157 の 17 株,O26 の 5 株,O111 の 1 株,O113 の 1 株を全て
陽性に判定できた(Table 1-3).分離培地 CT-SMAC では,血清型 O26,O111,O113 を
見逃してしまうが,stx-LAMP は検出できた.EHEC の血清型は,O1,O2,O5,O18,O25,
O26,O55,O74,O91,O103,O104,O105,O111,O113,O114,O115,O117,O118,O119, O121,O128,O143,O145,O153,O157,O161,O165,O172 などが報告されているが, これら血清型であっても Stx 非産生株が存在する.供試した KE135 は大腸菌 O157 で あるが Stx 非産生株で,血清型を指標に検出する CT-SMAC の場合,陽性と判定してし まうが,stx-LAMP は陰性と正確に判定できた(Table 1-2).その他,大腸菌 97109 は血清型が O111,大腸菌 BFR2 と大腸菌 BFR3 は血清型 O145 であるが Stx 非産生株で あるため,血清型識別では EHEC 偽陽性となるが,stx-LAMP で陰性と正確に判定でき た.stx-LAMP は,血清型の影響を受けずに,EHEC のみを正確に検出できるものと考 えられた.大腸菌以外の Stx 非産生株は,45 菌種を試験した(Table 1-3).これら 45 菌種は,食品検査,臨床検査,糞便検査で,検体に共存する可能性がありうる菌種 を選択している(Table 1-2).stx-LAMP で偽陽性の増幅は見られなかったことから, stx-LAMP は食品検体だけでなく,臨床検体,便検体でも,EHEC の検査に利用可能と 考えられた. stx-LAMP の最小検出感度は,EHEC 5 株(Stx1 と Stx2 産生大腸菌 2 株(157-891 [血
清型 O157:H7],BFR26015 [O26:H11]),Stx1 産生大腸菌 2 株(ATCC 43890 [O157:H7],
97353 [O111:H-]),Stx2 産生大腸菌 1 株(157-120 [O157:H7])の希釈液を用いて求
めた.その結果,最小検出感度は,EHEC BFR26015 で求めた 0.68 CFU/test tube であ った.一方,stx-PCR の最小検出感度は 6.8 CFU/test tube(EHEC BFR26015)であり, stx –LAMP は 10 倍の高感度を示した.本研究では,加熱処理による簡便な DNA 抽出方 法を用いたため,鋳型 DNA 溶液の中に,PCR 反応を阻害する成分が含まれていた可能 性がある.一般に PCR 阻害物質としては主に DNase,各種 protease,各種の金属イオ
ンが考えられる38, 40).PCR に使用するTaq DNA polymerase と,LAMP に使用する Bst DNA
polymerase には,阻害の受け方に差があり,結果として最小検出感度に影響したので はないかと推測した. 本研究では,stx-PCR で陽性と判定された牛塊肉を,EHEC 汚染検体と見なし, stx-LAMP の評価に使用した.リアルタイム濁度測定装置で観察した結果,4 検体とも 濁度が上昇し,30 分の短時間で判定が可能であった(Figure 1-3).また,反応停止 後の反応液を目視で観察すると,stx-LAMP 増幅により生成されたピロリン酸マグネシ ウムの濁りが確認できた(Figure 1-4)ことから,手軽な目視判定も可能と考えられ た.さらに本研究では,観察された濁りが,stx 遺伝子を鋳型にして,LAMP 増幅した 結果であると証明するため,アガロースゲル電気泳動解析と DNA 配列シークエンス解 析を行った.アガロースゲル電気泳動解析では,LAMP 増幅物特有のラダーパターンが 観察され(Figure 1-5),そのパターンが陽性コントロールと類似していたので,stx 遺伝子を認識して LAMP 増幅した増幅物と考えられる.さらに,増幅物の DNA 配列を
28 解析し,理論上の配列および陽性コントロール(EHEC 157-212)の配列と比較した結 果(Figure 1-6),高い相同性を示したので,stx-LAMP 増幅による濁度上昇は,検体 中のstx 遺伝子を Primer が認識し,LAMP 増幅した結果であると確認できた.牛塊肉 に汚染した EHEC の検出方法として,stx–LAMP が利用可能と考えられた. DNA 配列の解析結果から,検体中のstx1 遺伝子には 3 か所の塩基に変異が発見され, stx2 遺伝子には 10 か所の塩基に変異が発見された(Figure 1-6).これら塩基の中で, stx2 遺伝子の B2 認識領域内の A > G 変異は 3 つの検体(牛塊肉 03-150,牛塊肉 03-156,牛塊肉 03-304)に存在している.リアルタイム濁度測定装置の結果(Figure 1-3)を見ると,牛塊肉 03-266 のみ陽性コントロールとほぼ同じ速度で,牛塊肉 03-150,牛塊肉 03-156,牛塊肉 03-304 の 3 検体とは約 2 倍の速度差があるが,B2 認識領域内の A > G 変異が,Primer の認識力に影響し,反応速度を遅らせたと考える. 牛挽肉およびカイワレ大根に EHEC 157-212(血清型 O157)または EHEC BFR26015 (血清型 O26)を接種し,人為的に汚染させた検体を調製後,stx-LAMP,stx-PCR,培 養法を使用した従来の検査法で検出率を比較した.牛挽肉に EHEC 157-212(血清型
O157)を接種した場合(Figure 1-7(a)),stx-LAMP,stx-PCR,直接塗布法,IMS 塗
布法に差は無く,100% の検出率を示した.牛挽肉に EHEC BFR26015(血清型 O26)を 接種した場合(Figure 1-7(b)),stx-LAMP,stx-PCR,IMS 塗布法で 100% の検出率 であったが,直接塗布法は 90% に減少していた.牛挽肉に接種した EHEC BFR26015(血 清型 O26)は,mEC+n で十分に増菌できなかったため,IMS 処理で濃縮する必要があっ たと考える.stx-LAMP および stx-PCR が IMS 未処理でも検出できたのは,培養法より 検出感度が優れていたためと考える.カイワレ大根に EHEC 157-212(血清型 O157)
を接種した場合(Figure 1-8(a)),stx-LAMP,stx-PCR,直接塗布法の CT-SMAC,IMS
塗布法の CT-SMAC は 100% の検出率であったが,直接塗布法の CHROMagarO157 は 30%, IMS 塗布法の CHROMagarO157 は 70% の検出率であった.検出率の差は,2 種類の寒天 培地(CT-SMAC と CHROMagarO157)の検出感度に影響したものと考える.カイワレ大
根に EHEC BFR26015(血清型 O26)を接種した場合(Figure 1-8(b)),stx-LAMP で
90% の検出率で,stx-PCR は 50% であった.この差は,カイワレ大根に stx-PCR 反応 を阻害する成分が混入しているのではないかと考える.ただし,カイワレ大根に EHEC
157-212(血清型 O157)を接種した場合(Figure 1-8(a)),stx-PCR と stx-LAMP の
検出率に差がなく,100% を示している.EHEC 157-212(血清型 O157)はカイワレ大 根の成分の影響,またはカイワレ大根に付着した一般細菌の影響を受けずに増菌でき たが,EHEC BFR26015(血清型 O26)は増菌が抑制され,stx-PCR および stx-LAMP の 検出率に悪影響を及ぼした可能性が考えられる.
培養法は,結果を得るまで 5 日間必要であったが,stx-LAMP と stx-PCR は 2 日間に
短縮できた.さらに stx-LAMP は,操作が簡便であるため,労力も軽減できる方法で
あった.したがって,食品中の EHEC を検出する方法として,stx-LAMP は有用である ことが確認できた.しかし,食中毒原因菌を特定するためには,EHEC を分離すること
29 が不可欠である.この事は,全ての遺伝子検査法における課題である.我々は, stx-LAMP を一次スクリーニングに用いる検査方法を提案した.実験概略図を Figure 1-9 に示す.食品検体 25g を mEC+n 225 mL で 22 時間培養し,増菌培養液をstx-LAMP で判定する.ここで陰性であった検体は検査終了とし,陽性であった検体のみ分離培 養を試みる検査方法である.ほとんどの食品検体が EHEC 陰性である事を考えると, この検査方法は分離培養の工程を大幅に省略できるため,検査時間の短縮と労力の大 幅な軽減になると考える. 国内の EHEC の検査法は,血清型 O157,O26,O111 の検査法である.しかし米国農 務省(USDA)は,2011 年 9 月 13 日,「腸管出血性大腸菌血清型 O157:H7 を対象として いるゼロトレランスポリシーを他の 6 種の血清型(O26,O103,O45,O111,O121 及び O145)にも拡大する」案を発表した.さらにドイツ連邦リスク評価研究所は,2011 年 11 月 29 日,「腸管出血性大腸菌(EHEC)血清型 O104:H4 集団感染:スプラウトに 関する推奨事項」を公表した.国外では,より多くの血清型も EHEC の対象となりつ つある.一方では,患者より分離された EHEC の中で,血清型 O165 は重症者の割合が 高いことが報告されている41).以上の結果を踏まえると,今後,国内では血清型 O157, O26,O111 に加えて,血清型 O103,O45,O111,O121,O145,O104,O165 も検査対象 になる可能性があると考える.stx-LAMP は血清型に影響されずに,EHEC を検出でき るので,食品検査に役立てるものと期待する.