ヘテロ環構造を有する生物活性天然有機化合物の合
成研究
著者
高橋 和暉
学位授与機関
Tohoku University
学位授与番号
11301甲第19327号
URL
http://hdl.handle.net/10097/00127872
ヘテロ環構造を有する生物活性
天然有機化合物の合成研究
東北大学大学院農学研究科
生物産業創成科学専攻
髙橋
和暉
指導教員
榎本
賢 准教授
略語表
Ac acetyl aq. aqueous Bn benzyl Boc tertiary-butoxycarbonyl n-Bu, nBu normal-butyl s-Bu, sBu secondary-butyl t-Bu, tBu tertiary-butyl ca. circaCAN ceric ammonium nitrate cat. catalyst cod 1,5-cyclooctadiene conc. concentrated D—A Diels—Alder DCC dicyclohexylcarbodiimide DCE 1,2-dichloroethane
DET diethyl azodicarboxylate DMAP 4-(dimethylamino)pyridine DMF N,N-dimethylformamide
DMP Dess-Martin periodinane DMSO dimethyl sulfoxide
dppb 1,4-bis(diphenylphosphino)butane dppp 1,3-bis(diphenylphosphino)propane dr diastereomeric ratio ee enantiomeric excess EE ethoxyethyl eq. equivalent Et ethyl
HIV human immunodeficiency virus HMDS hexamethyldisilazide
HMPA hexamethylphosphorictriamide HOBt hydroxybenzotriazole
IBX 2-iodoxybenzoic acid LLS the longest linear sequence
Me methyl
MS molecular sieves
NADH nicotinamide adenine dinucleotide NBS N-bromosuccinimide
NCS N-chlorosuccinimide
NMR nuclear magnetic resonance
o- ortho o-tol ortho-tolyl p- para Ph phenyl Phen phenanthroline Phth phthaloyl Pin pinacol Piv pivaloyl PPTS pyridinium p-toluenesulfonate i-Pr, iPr isopropyl quant. quantitative rt room temperature sat. saturated sp. species TBHP tertiary-butyl hydroperoxide TBS tertiary-butyldimethylsilyl Tf trifluoromethanesulfonyl TFA trifluoroacetic acid TFAA trifluoroacetic anhydride TFE 2,2,2-trifluoroethanol THF tetrahydrofuran TIPS triisopropylsilyl TMEDA tetramethylethylenediamine TMS trimethylsilyl TS transition state
目次
緒言 1 第一章 Aurachin B および H の合成研究 5 1 研究背景 6 1.1 抗菌薬の歴史と課題 1.2 NQR と aurachin 類 2 Aurachin 類について 9 2.1 Aurachin 類の構造および生合成経路 2.2 過去の合成例 3 合成戦略 14 4 Aurachin B の全合成 15 5 Aurachin H の全合成 16 6 小括 18 参考文献 19 実験の部 20 第二章 Agelamadin C および D の合成研究 41 1 研究背景 42 2 Agelamadin C および D について 44 3 合成戦略:生合成模倣反応 45 4 逆合成解析:分子内Diels—Alder 反応 47 5 アミノ酸セグメントの調製 48 5.1 Boc 保護体の調製 5.2 フタロイル保護体の調製 6 DMP/D—A 反応による 1,4-ベンゾオキサジン構造の形成 50 7 逆合成解析:分子間Diels—Alder 反応 54 8 Oroidin の合成 57 9 L-3-hydroxykynurenine の合成 58 9.1 Heck 反応による合成の検討 9.2 その他の連結法による合成の検討 9.3 生合成を模倣した合成10 芳香環の酸化/Diels—Alder 反応 67 10.1 無保護での検討 10.2 保護体での検討 10.3 モデル化合物による酸化剤の検討 11 小括 73 参考文献 75 実験の部 77 総括 116 謝辞 117
1
緒言
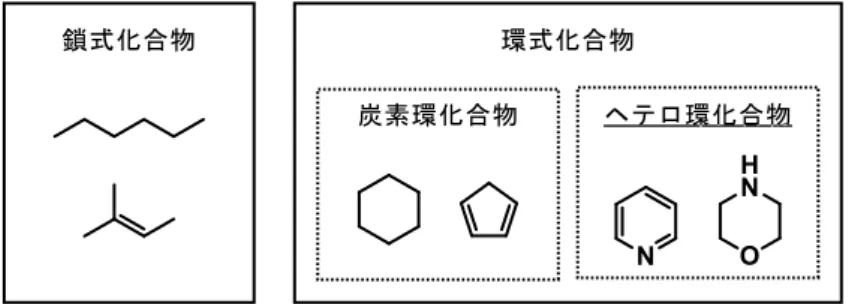
有機化合物は炭素原子の結合形式によって鎖式化合物と環式化合物に大別でき、環式化合 物はさらに炭素原子のみからなる炭素環化合物とヘテロ環化合物に分けられる(Figure 1)。 ヘテロ環化合物は環骨格にN, O, S などのヘテロ原子を一つ以上持つ環状化合物である。 Figure 1. 有機化合物の結合様式による分類 ヘテロ環化合物には自然界において重要な役割を担う化合物が非常に多く存在する。例え ば adenine や guanine などの核酸塩基、tryptophan や serotonin などのアミノ酸およびアミノ 酸誘導体、その他にも porphyrin など、生命の維持に欠かせないものだけでもヘテロ環化合 物の数は枚挙に暇がない程である(Figure 2)。Figure 2. 生体内のヘテロ環化合物
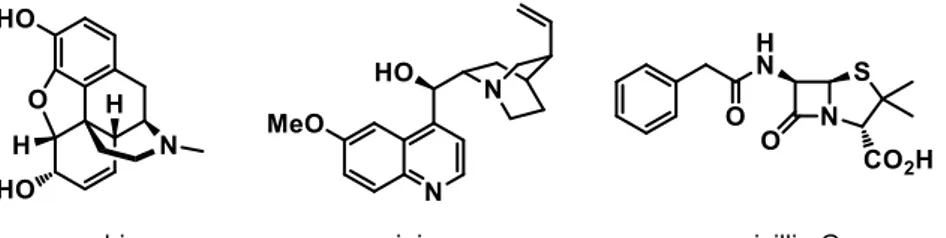
また、morphine、quinine、penicillin G などのように医薬として歴史的に重要な役割を果たし てきた化合物にもヘテロ環を持つものが多く見られる(Figure 3)。
2
Figure 3. 医薬品におけるヘテロ環化合物
さらに、より生活に近いものでは藍色染料indigo、コーヒーの香味成分 furfuryl mercaptan、 次世代太陽電池として期待される色素増感太陽電池の材料N-3 dye などもヘテロ環化合物で ある(Figure 4)。 Figure 4. 身近に存在するヘテロ環化合物 このように既に実用化されている化合物も多い一方で、ヘテロ環を持つ新たな生物活性天然 物の発見は現在も続いている。しかし先述の例からもわかるようにヘテロ環化合物の構造は 多種多様であり、合成法の確立していないものも多く、天然物の実用化に向けた研究が進め にくい状況にある。そのためヘテロ環構造を持つ天然物は多くの有機合成化学者の興味を惹 いている。 さて、有機合成技術や合成生物学が発展した昨今では有機化学的手法による天然物合成の 意義を疑問視する風潮もあるが、天然物合成は科学の発展および創薬研究において依然とし て重要な役割を担っていると言える。天然有機化合物の中には微量しか得られないものや微 生物が生産を止めてしまったものが存在し、そのような化合物の化学構造の決定や標品供給 においては有機合成が威力を発揮する。例えば bryostatin 1 は HIV、がん、糖尿病、アルツ ハイマー病などに対し効果がある有用な天然物であるが(Figure 5)、度重なる治験によって
3
標品はほぼ枯渇し、単離や合成生物学的手法による安定供給も困難であった。そのような中、 2017 年に Wender らがグラムスケールの化学合成を達成し標品供給を可能とした(P. A. Wender et al., Science, 2017, 358, 218-223.)。
Figure 5. Wender らによる bryostatin 1 の合成
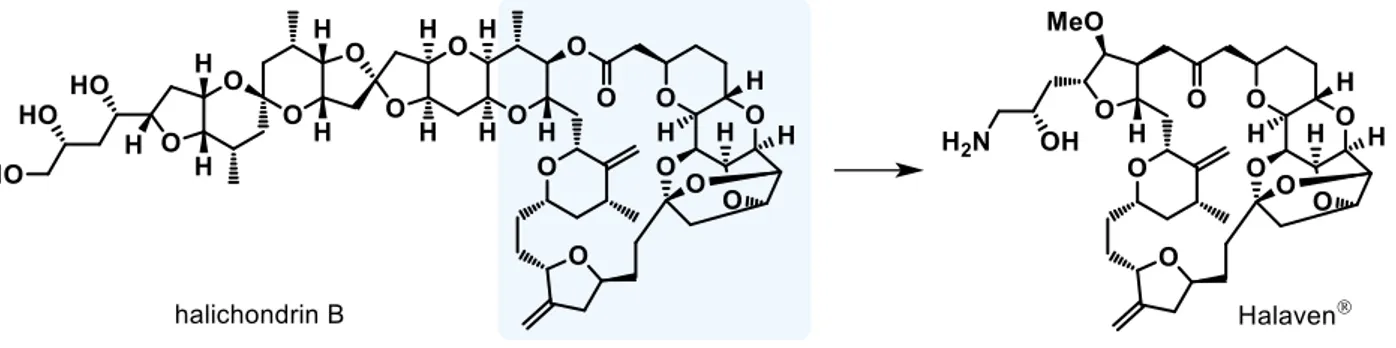
また、天然物は複数の官能基を併せ持つものが多いため望みの部分構造へ分解するのは難し いとされるが、天然物を化学合成した場合には中間体および誘導体を用いることで構造活性 相関研究や構造単純化を行いやすくなる。例えば抗がん活性を持つ海洋天然物 halichondrin B は 1992 年に岸らによって全合成されたが(Y. Kishi et al., J. Am. Chem. Soc. 1992, 114, 3162-3164.)、研究の過程で構造右側部分のみでもほぼ同様の生物活性を示すことが判明した。岸 らとエーザイの研究陣はこの研究における知見を基に構造を単純化し、抗がん剤『ハラヴェ ン®(エリブリンメシル酸塩)』を創出した(Figure 6)。このように、現在でも有機合成(天
然物合成)だからこそ科学ひいては社会に貢献できることは多いと言える。
Figure 6. halichondrin B と Halaven®
以上の背景を踏まえ本博士論文では、多様な生物活性と構造を持ちながら合成例がほとん どないヘテロ環化合物の合成法の確立および生物学的研究に貢献すべく、第一章ではキノリ
4
ン N-オキシド構造を持つ天然物 aurachin B および H の合成研究を、第二章では 1,4-ベンゾ オキサジン構造を持つ天然物agelamadin C および D の合成研究を行った(Figure 7)。
5
第一章
6 1. 研究背景 1.1. 抗菌薬の歴史と課題1) 古代から人類は植物や動物、鉱物に由来する生薬を用いて病気や傷に対処してきた。その 後数千年を経た1803 年に Sertürner がアヘンから有効成分の morphine (1)を単離したことで、 生薬の作用は化学物質によるものであると示された(Figure 1)。 Figure 1. アヘンと morphine
さらに1828 年には Wöhler が NH4Cl と KOCN から urea (2)を合成し、有機化合物が化学合成
できることを示した(Figure 2)。この二つの発見により生薬の有効成分を化学合成できるこ とが示唆された。
Figure 2. Wöhler による urea の合成
一方 1928 年、Fleming はブドウ球菌の培養中に混入したアオカビの周囲に阻止円が発生 していることを発見し、その原因物質が penicillin であることを明らかにした。これが世界 初の抗生物質の発見である。以後、-ラクタム系、マクロライド系、キノロン系、テトラサ イクリン系、アミノグリコシド系のいわゆる5大抗生物質をはじめとした数多くの抗菌薬が 開発され、人類を病から救ってきた(Figure 3)。
7 Figure 3. 抗菌薬の代表例 第二次世界大戦中は、怪我や栄養不足により発症した感染症に対しペニシリンが多用され た。これにより多くの人々が救われたが、一方で多用されたことによりペニシリン耐性菌が 出現した。その後もメシチリン耐性黄色ブドウ球菌(MRSA)やバンコマイシン耐性黄色ブ ドウ球菌(VRSA)など次々に強力な抗菌薬に対する耐性菌が出現し、現在も新規抗菌薬の 開発と耐性菌出現のいたちごっこが続いている。また、発展途上国ではコレラ、赤痢、HIV、 結核などの感染者数が多く未だ解決には程遠い。 これらの課題を抱えている一方で抗菌薬開発数は年々減少傾向にあり(Figure 4)3)、先述 の課題に対処しきれていないことが大きな問題となっている。よって、新規創薬ターゲット および新規創薬シード化合物の継続的な発見が求められている。 Figure 4. 日本における抗菌薬の開発品目数3)
8 1.2. NQR と aurachin 類 現在多くの研究者の興味を惹いている創薬ターゲットのひとつとして、NQR(ナトリウム 輸送性NADH-キノン酸化還元酵素)が挙げられる。NQR は細菌の細胞膜に存在する電子伝 達酵素であり、Nqr A~F の6つのサブユニットから構成される(Figure 5)4)。1977 年にコレ ラ菌で発見されて以降、現在まで約100 種類の細菌において存在が確認されており、さらに 細菌のエネルギー代謝全般を担うことから、NQR 阻害剤は強力な抗菌薬になると言える。 しかしヒトのミトコンドリアにも類似の電子伝達酵素が存在することから、NQR を選択的 に阻害するのは困難であるとされ、創薬研究は進んでいなかった。 Figure 5. NQR の構造4) そのような中、2017 年に三芳らは電子伝達系阻害物質 aurachin D (8)の誘導体を用いた光 親和性標識法によりNQR と阻害剤の結合部位を明らかにしており、それが基質であるキノ ンの結合部位とは異なることを報告している(Figure 6)4)。ヒトを含む他の電子伝達酵素で は一般的にキノンと阻害剤の結合部位が同一なので、aurachin 類を基にして NQR 選択的阻 害剤のドラッグデザインが進められると言える。すなわちaurachin 類は有望な抗菌薬シード 化合物である。 Figure 6. Aurachin D と NQR の結合部位 (赤:阻害剤結合部位、青:キノン結合部位)5) そこで本研究では、魅力的な生物活性を持ちながらも合成報告の少ないaurachin 類の合成方 法を確立することで生物学的研究および創薬研究に寄与することを目的とした。
9
2. Aurachin 類について
2.1. Aurachin 類の構造および生合成経路
Aurachin 類は 1987 年に Höfle らにより粘液細菌 Stigmatella aurantiaca Sg a15 から単離・構 造決定された化合物群である(Figure 7)6,7)。構造的特徴として多くの類縁体がキノリン N-オキシド構造もしくはN-ヒドロキシキノロン構造を持つことが挙げられ、また、aurachin B (10)のように C4 位に炭素鎖を持つ C4 型 aurachin と、aurachin H (12)のように C3 位に炭素鎖 を持つC3 型 aurachin の二種類に分類することができる。 Figure 7. Aurachin 類の構造 Aurachin B-D (8, 10, 11)および H (12)の生合成経路は Höfle らによって以下のように提唱さ れている(Scheme 1)7)。まずanthranilic acid (14)から 15 を経由し、酢酸ユニットの開裂と
炭素鎖の導入を経てaurachin D (8)が生じた後、アミン部位の酸化により aurachin C (11)へと 変換される。このもののC2-C3 位二重結合が酸化され 17 が生じると、転位反応と続く芳香 環化によりaurachin B (10)となる。一方、aurachin C (11)において側鎖の酸化およびエポキシ ドの開環が起きるとaurachin H (12)が生じる。
10 Scheme 1. Aurachin 類の生合成経路 2.2. 過去の合成例 Aurachin 類はこれまで述べたように抗菌薬シード化合物として魅力的な電子伝達系阻害 活性を示すが、その一方でaurachin H (12)を含むいくつかの類縁体は未だ生物活性および絶 対立体配置が不明であり、さらに合成例もわずかであるため、aurachin 類の詳細な解析およ び創薬研究を進められていないのが現状である。合成例が少ない理由のひとつとして、既存 のキノリン N-オキシド形成法では aurachin 類全体を合成することができないという問題点 が挙げられる(Scheme 2)。すなわち、通常用いられる MeReO3-H2O28)やCH3CO3H9)などのよ うな酸化的手法を利用した場合、激しい反応条件を必要とするか、二重結合部分での望まな い過剰酸化が進行するといった課題があり、aurachin 類の合成には不向きである。
11
Scheme 2. N-オキシド構造の一般的な形成法
実例として、2013 年に Nay らは Conrad—Limpach キノリン合成および mCPBA を用いた酸化 によるaurachin 誘導体の合成研究を報告しているが、側鎖部分の二重結合における酸化を抑 制することができず合成には至っていない(Scheme 3)10)。また、本手法においてはC4 型 の合成が困難である。 Scheme 3. Nay らによる合成研究 2017 年には、福山らにより aurachin A および B の全合成が報告された(Scheme 4)11)。本 合成においてはケトンα位からニトロ基への求核付加によりキノリン N-オキシド構造の形 成に成功している。しかしながら C3 型の合成は困難であり、aurachin 類全体に適用可能と は言い難い。 Scheme 4. 福山らによる aurachin B の合成
12 一方、2009 年に長澤らにより報告された(+)-saxitoxin の全合成において、金属試薬を使い 分けることでニトロ基の還元反応を制御できることが見出された(Scheme 5)12)。 Scheme 5. 長澤らによるニトロ基の還元 2014 年、榎本らは同様の還元法を鍵とした aurachin L (13)の全合成を報告している (Scheme 6)13)。すなわち、ケトン部位を有するニトロベンゼン誘導体 34 を亜鉛によってヒドロキシ ルアミン35 へと還元し、続くカルボニル基への求核付加によりワンポットでキノリン N-オ キシド構造を構築する方法である。 Scheme 6. 榎本らによる aurachin L の合成 本手法は従来の酸化的手法と比べ反応条件が穏やかであり官能基共存性も優れている。そこ で本研究では、この還元的手法により種々の対応するニトロベンゼン誘導体からaurachin B (10)、aurachin H (12)を合成することにした(Figure 8)。また、これにより本手法が C3 型・ C4 型の両方、つまり aurachin 類全般に適用可能な手法であることが実証でき、他の類縁体 の合成ひいてはその詳細な物性・生物活性評価に寄与できると考えた。
13
14
3. 合成戦略
以下に合成戦略を示す (Scheme 7)。まず aurachin B (10)については、ケトン 36 と farnesyl bromide (37)の連結により 38 を得た後、亜鉛を用いた還元的キノリン N-オキシド形成反応 を行うことで合成できると考えた。またaurachin H (12)は、既知化合物であるジケトン 3913) とエポキシヨージド 4014)を連結することで続く生合成模倣的なエポキシドの開環まで一挙 に進行すると予想し、得られる 42 に対し同様に亜鉛を作用させることで合成できると考え た。 Scheme 7. Aurachin B および H の合成戦略
15
4. Aurachin B の全合成
まずaurachin B の合成に着手した(Scheme 8)。市販の ethyl pyruvate から既知の手法に より得たアルデヒド4415)に対し、o-nitrotoluene (43)を塩基性条件下で作用させることでア ルコール45 を得た。このものを Dess—Martin 酸化によりケトン 36 とした後、炭酸セシウ ムおよびfarnesyl bromide (37)を作用させることで炭素鎖の導入された 46 を得た。続いて脱 アセタール化によりジケトン38 とし、亜鉛および塩化アンモニウムを作用させることで還 元的キノリン N-オキシド形成反応を試みたところ、反応は円滑に進行し、収率 83%で aurachin B (10)を得た。これにより 43 から 5 工程・総収率 60%で aurachin B の全合成を達 成した。 Scheme 8. Aurachin B の全合成
16 5. Aurachin H の全合成 まず、市販のfarnesol (47)から Sharpless 不斉エポキシ化と続く 2 工程でのヨウ素化によ り既知化合物4014)を得た(Scheme 9)。続いて 40 と既知化合物であるジケトン 3913)を用い てアルキル化と続くエポキシドの開環を伴う環化反応の検討を行った(Table 2)。まず塩基 としてNaH、添加剤として HMPA を用いたところ、ヨウ化物 40 が分解する結果となった (entry 1)。また、塩基性条件下におけるジケトン 39 同士の縮合も懸念されたため以降は 39 を過剰量用いることとした。続いて KOt-Bu を用いた際には、ジケトン 39 に由来する望 まない反応がアルキル化よりも優先的に進行し、目的物は得られなかった(entry 2)。次に より塩基性の低い炭酸セシウムを用いたところ、痕跡量ながら目的物42 を得ることに成功 した(entry 3)。最終的に炭酸カリウムを用いた条件において収率を改善することができた が、この際収率は12%に留まり、さらに望まない位置で環化が進行した 49 も収率 24%で 得られる結果となった(entry 4)。しかし、反応温度などの条件を種々検討するも改善には 至らず、ひとまず得られた42 を用いて合成を進めることにした。 Scheme 9. ケトン 42 の合成 調製した42 に対し、aurachin B の際と同様に亜鉛および塩化アンモニウムを作用させた ところ、こちらも反応は円滑に進行し収率75%で aurachin H (12)を得た(Scheme 10)。これ により、40 から 2 工程・総収率 9%で aurachin H の初の全合成を達成した。今後天然より
17
単離されたaurachin H の比旋光度が測定されれば、合成標品の測定値と比較することで絶 対立体配置を決定することができると考えられる。
18
6. 小括
第一章では還元的キノリン N-オキシド反応を利用することで強力な電子伝達系阻害物質 aurachin B (10)および H (12)の合成研究を行った(Scheme 11)16)。まずケトン36 と farnesyl
bromide (37)の連結後、榎本らの手法に倣い還元的キノリン N-オキシド形成反応を行うこ とで、5 工程・総収率 60%で aurachin B (10: C4 型)の全合成を達成した。また、既知化合物 であるジケトン3913)とエポキシヨージド4014)の連結と続く生合成模倣的なエポキシドの開 環により42 を得たのち、同様に還元的キノリン N-オキシド形成反応を行うことで、2 工 程・総収率9%で aurachin H (12: C3 型)の初の全合成を達成した。これにより本手法を用い てC3 型・C4 型両方を合成できることが実証できたため、今後は他の類縁体の合成ひいて はその生物活性評価や絶対立体配置の決定に寄与できると考えられる。 Scheme 11. 小括
19
参考文献
1) 長野哲雄 編 『創薬化学 —メディシナルケミストへの道―』 東京化学同人 (2018) 2) 大麻・けしの見分け方 – 厚生労働省 (https://www.mhlw.go.jp/houdou/2007/04/dl/h 0427-1b.pdf) より 3) 舘田一博, 日本内科学会雑誌 2013, 102, 2908-2914.4) T. Ito, M. Murai, S. Ninokura, Y. Kitazumi, K. G. Mezic, B. F. Cress, M. A. G. Koffas, J. E. Morgan, B. Barquera and H. Miyoshi, J. Biol. Chem. 2017, 292, 7727-7742.
5) 京都大学プレスリリース (2017 年 4 月 5 日, http://www.kyoto-u.ac.jp/ja/research/res earch_results/2016/170315_2.html) より
6) B. Kunze, G. Höfle and H. Reichenbach, J. Antibiot. 1987, 40, 258-265. 7) G. Höfle and B. Kunze, J. Nat. Prod. 2008, 71, 1843-1849.
8) C. Copéret, H. Adolfsson, T. V. Khuong, A. K. Yudin and K. B. Sharpless, J. Org. Chem. 1998,
63, 1740-1741.
9) H. S. Mosher, L. Turner and A. Carlsmith, Org. Synthesis, coll. 1963, 4, 828-830.
10) X. Li, J. Herrmann, Y. Zang, P. Grellier, S. Prado, R. Müller and B. Nay, Beilstein J. Org. Chem.
2013, 9, 1551-1558.
11) H. Hattori, S. Yokoshima and T. Fukuyama, Angew. Chem. Int. Ed. 2017, 56, 6980-6983. 12) O. Iwamoto, R. Shimohara and K. Nagasawa, Chem. Asian J. 2009, 4, 277-285.
13) M. Enomoto, W. Kitagawa, Y. Yasutake and H. Shimizu, Biosci. Biotechnol. Biochem. 2014, 78, 1324-1327.
14) H. Kigoshi, M. Ojika, Y. Shizuri, H. Niwa and K. Yamada, Tetrahedron 1986, 42, 3789-3792. 15) B. M. Trost, A. Fettes and B. T. Shireman, J. Am. Chem. Soc. 2004, 126, 2660-2661.
16) K. Takahashi, S. Kuwahara and M. Enomoto, Biosci. Biotechnol. Biochem. 2017, 81, 1466-1469.
20
実験の部
General
IR spectra were recorded by a Jasco FT/IR-4100 spectrometer using an ATR (ZnSe) attachment. NMR spectra were recorded with TMS as an internal standard in CDCl3 by a Varian 400-MRTT
spectrometer (400 MHz for 1H and 100 MHz for 13C) or a Varian 600TT spectrometer (600 MHz for 1H and 150 MHz for 13C) unless otherwise stated. Optical rotation values were measured with a Jasco
P-2200 polarimeter. Mass spectra were obtained with a Bruker Daltonics micrOTOF-Q II in the ESI mode or a Jeol JMS-700 spectrometer operated in the EI or FAB mode. Merck silica gel 60 (63–200 m) was used for column chromatography unless otherwise stated. Analytical thin-layer
chromatography was performed using Merck silica gel 60 F254 plates (0.25 mm thick). Solvents for
reactions were distilled prior to use: THF from Na and benzophenone; CH2Cl2, DMF and DMSO
from CaH2; EtOH from Na and diethyl phthalate. Acetone was dried over CaCl2 prior to use. All air-
21
3,3-diethoxy-1-(2-nitrophenyl)butan-2-ol (45).
To a stirred solution of 44 (1.00 g, 6.84 mmol) in 5.7 mL of DMSO were
successively added o-nitrotoluene (43, 267 L, 2.28 mmol) and a solution of KOH (320 mg, 5.70 mmol) in 814 L of water at room temperature. After being stirred for 3 h at room temperature, the reaction was quenched with saturated aq. NH4Cl, and the aqueous
layer was extracted with EtOAc. The combined organic extracts were successively washed with water and brine, dried over Na2SO4, filtered, and concentrated in vacuo. The residue was purified by
silica gel column chromatography (hexane/EtOAc = 9:1) to give 45 (543 mg, 84%) as a colorless oil.
Rf 0.39 (hexane/EtOAc = 3:1); IR max: 3496 (w), 2977 (m), 1528 (s), 1358 (m), 1057 (m); 1H NMR
δ: 1.18 (3H, t, J = 7.2 Hz), 1.19 (3H, t, J = 7.2 Hz), 1.36 (3H, s), 2.35 (1H, dd, J = 2.4, 1.6 Hz, OH),
2.99 (1H, dd, J = 14.4, 10.4 Hz), 3.23 (1H, ddd, J = 14.4, 2.4, 1.6 Hz), 3.51–3.58 (4H, m), 3.92 (1H, ddd, J= 10.4, 2.4, 2.4 Hz), 7.36 (1H, ddd, J = 8.0, 6.4, 2.4 Hz), 7.48–7.54 (2H, m), 7.86 (1H, dd, J = 8.0, 1.2 Hz); 13C NMR δ: 15.5, 15.5, 17.6, 34.0, 56.2, 56.6, 73.4, 102.2, 124.5, 127.3, 132.6, 133.1,
134.4, 150.3; HRMS (ESI) m/z: calcd. for C14H21NO5Na ([M+Na]+) 306.1312; found, 306.1306.
3,3-diethoxy-1-(2-nitrophenyl)butan-2-one (36).
To a stirred solution of 45 (11.7 mg, 41.3 mol) in 210 L of CH2Cl2 was added
DMP (26.3 mg, 61.9 mol) at room temperature. After being stirred for 3 h at room temperature, the mixture was diluted with Et2O, then the resulting solution was
successively washed with saturated aq. Na2S2O3/saturated aq. NaHCO3 (1:1) and brine, dried over
MgSO4, filtered, and concentrated in vacuo to give 36 (12.6 mg, quant.) as a yellow oil. Rf 0.50
(hexane/EtOAc = 3:1); IR max: 2978 (m), 1737 (m), 1528 (s), 1349 (m), 1052 (m); 1H NMR δ: 1.20
(6H, t, J = 7.2 Hz), 1.45 (3H, s), 3.42–3.60 (4H, m), 4.37 (2H, s), 7.20 (1H, dd, J = 7.6, 1.2 Hz), 7.39 (1H, dt, J = 7.6, 7.6, 1.6 Hz), 7.51 (1H, ddd, J = 7.6, 7.6, 1.2 Hz), 8.03 (1H, dd, J = 7.6, 1.6 Hz); 13C
NMR δ: 15.3, 20.9, 44.4, 57.7, 102.6, 125.1, 128.2, 130.3, 133.4, 133.4, 149.2, 205.0; HRMS (FAB)
m/z: calcd. for C14H19NO5Na ([M+Na]+) 304.1161; found 304.1160.
(6E,10E)-2,2-diethoxy-7,11,15-trimethyl-4-(2-nitrophenyl)hexadeca-6,10,14-trien-3-one (46).
To a stirred solution of 36 (10.7 mg, 38.0 mol) in 380 L of DMF were added Cs2CO3 (18.6 mg, 57.0 mol) and farnesyl bromide (37,
12.4 L, 45.6 mol) at room temperature. After being stirred for 5.5 h at room temperature, the reaction was quenched with saturated aq. NH4Cl. The resulting aqueous layer was extracted with EtOAc. The combined extracts were
successively washed with water and brine, dried over Na2SO4, filtered, and concentrated in vacuo.
The resulting residue was purified by silica gel column chromatography (hexane/EtOAc = 49:1 to 29:1) to give 46 (16.2 mg, 88%) as a colorless oil. Rf 0.42 (hexane/EtOAc = 9:1); IR max: 2976 (m),
2929 (m), 1730 (m), 1530 (s), 1354 (m), 1052 (m); 1H NMR δ: 1.05 (3H, t, J = 7.2 Hz), 1.07 (3H, t, J
22
(1H, ddd, J = 13.6, 7.2, 5.6 Hz), 2.77 (1H, ddd, J = 13.6, 9.2, 8.0 Hz), 3.05–3.30 (3H, m), 3.41–3.48 (1H, m), 4.98 (1H, dd, J = 9.2, 5.6 Hz), 5.04–5.14 (3H, m), 7.33–7.38 (2H, m), 7.50 (1H, ddd, J =8.4, 8.0, 1.6 Hz), 7.83 (1H, dd, J = 8.0, 1.2 Hz); 13C NMR δ: 15.1, 15.1, 16.1, 16.2, 17.8, 21.6, 25.8, 26.7,
26.9, 32.0, 39.8, 39.9, 47.3, 57.6, 57.7, 102.9, 120.6, 124.2, 124.5, 124.9, 127.6, 129.5, 131.4, 132.4, 133.0, 135.2, 138.4, 150.1, 208.3; HRMS (ESI) m/z: calcd. for C29H43NO5Na ([M+Na]+) 508.3033,
found 508.3027.
(6E,10E)-7,11,15-trimethyl-4-(2-nitrophenyl)hexadeca-6,10,14-triene-2,3-dione (38).
To a stirred solution of 46 (60.0 mg, 124 mol) in 620 L of acetone was added 620 L of 80% aq. AcOH at room temperature. After being stirred for 4 h at 60 °C, the reaction was quenched with saturated aq. NaHCO3, and the resulting mixture was extracted with
EtOAc. The combined organic extracts were washed with brine, dried over Na2SO4, filtered and
concentrated in vacuo to give 38 (49.5 mg, 97%) as a yellow oil. Rf 0.31 (hexane/EtOAc = 9:1); IR max: 2924 (m), 1718 (s), 1528 (s), 1352 (s); 1H NMR δ: 1.54 (3H, s), 1.57 (3H, s), 1.59 (3H, s), 1.68
(3H, s), 1.89–2.05 (8H, m), 2.33 (3H, s), 2.54 (1H, ddd, J = 14.8, 14.4, 8.0 Hz), 2.79 (1H, ddd, J = 14.8, 13.6, 6.4), 4.96 (1H, dd, J = 8.0, 6.4 Hz), 4.98–5.09 (3H, m), 7.40–7.44 (2H, m), 7.59 (1H, ddd,
J = 7.6, 7.6, 1.2 Hz), 7.92 (1H, dd, J = 8.0, 1.2 Hz); 13C NMR δ: 16.1, 16.3, 17.8, 24.1, 25.8, 26.5,
26.9, 29.5, 39.8, 39.8, 46.7, 119.8, 123.4, 124.4, 125.2, 128.3, 130.7, 131.4, 132.8, 133.3, 135.3, 138.9, 149.3, 196.7, 196.7; HRMS (ESI) m/z: calcd. for C25H33NO4Na ([M+Na]+) 434.2302, found
434.2290.
Aurachin B (10).
To a stirred solution of 38 (29.5 mg, 71.7 mol) in EtOH/H2O (1:1,
430 L) were successively added NH4Cl (19.2 mg, 359 mol) and
zinc dust (37.5 mg, 574 mol) at room temperature, and the mixture was stirred for 15 min at 40 ˚C. The reaction mixture was cooled to room temperature, saturated aq. NaHCO3 was then added to the
mixture. The resulting mixture was filtered through a pad of Celite®, and the filtrate was extracted
with EtOAc. The combined organic extracts were washed with brine, dried over Na2SO4, filtered,
and concentrated in vacuo. The residue was purified by silica gel column chromatography
(EtOAc/MeOH = 9:1) to give 10 (22.4 mg, 83%) as a white solid. Rf 0.33 (CH2Cl2/acetone/MeOH =
14:4:1); mp 186–187 °C; IR max: 2924 (s), 1377 (w), 1121 (s), 1095 (m); 1H NMR δ: 1.58 (3H, s),
1.60 (3H, s), 1.66 (3H, s), 1.90 (3H, s), 1.95-1.99 (2H, m), 2.02–2.09 (2H, m), 2.14–2.18 (4H, m), 2.70 (3H, s), 3.76 (2H, d, J = 7.2 Hz), 5.04–5.10 (2H, m), 5.30 (1H, t, J = 6.8 Hz), 5.98 (1H, s), 7.56– 7.62 (2H, m), 7.89–7.92 (1H, m), 8.77–8.79 (1H, m); 13C NMR δ: 12.6, 16.2, 16.7, 17.8, 24.7, 25.8,
26.5, 26.8, 39.7, 39.8, 119.9, 120.8, 123.2, 123.7, 123.9, 124.4, 127.5, 127.6, 128.0, 131.4, 135.6, 137.0, 138.7, 142.3, 147.5; HRMS (ESI) m/z: calcd. for C25H33NO2Na ([M+Na]+) 402.2409, found
23 402.2415.
1-{(S)-5[(R,E)-1-hydroxy-1,5,9-trimethyldeca-4,8-dienyl]-2-(2-nitrophenyl)-4,5-dihydrofuran-3-yl}ethan-1-one (42).
To a stirred solution of 40 (66.9 mg, 192 mol) in 1.9 mL of DMF were successively added 39 (119 mg, 576 mol) and K2CO3 (79.6
mg, 576 mol) at room temperature. After being stirred for 21 h at 60 °C, the mixture was cooled to room temperature, then the reaction was quenched with saturated aq. NH4Cl. The resulting aqueous layer was extracted with
EtOAc, and the combined organic extracts were successively washed with water and brine, dried over Na2SO4, filtered, and concentrated in vacuo. The residue was purified by silica gel column
chromatography (hexane/EtOAc = 4:1 to 2:1) to give 42 (10.0 mg, 12%) as a brown oil, along with
49 (19.9 mg, 24%) as a brown oil. Rf 0.44 (hexane/EtOAc = 1/1); [α] 20
D +50.1 (c = 0.72, CHCl3); IR max: 3441 (w), 2926 (m), 1626 (m), 1598 (s), 1531 (s), 1350 (m); 1H NMR δ: 1.29 (3H, s), 1.45– 1.54 (1H, m), 1.56–1.63 (1H, m), 1.61 (3H, s), 1.63 (3H, s), 1.68 (3H, s), 1.93 (3H, s), 1.95 (1H, s), 1.99 (2H, t, J = 8.0 Hz), 2.05–2.21 (4H, m), 3.06 (1H, dd, J = 14.8, 10.8 Hz), 3.22 (1H, dd, J = 14.8, 9.6 Hz), 4.69 (dd, J = 10.8, 9.6 Hz), 5.07–5.16 (2H, m), 7.56 (1H, dd, J = 7.6, 1.6 Hz), 7.65 (1H, ddd, J = 8.0, 7.6, 1.6 Hz), 7.71 (1H, ddd, J = 7.6, 7.6, 1.2 Hz), 8.13 (1H, dd, J = 8.0, 1.2 Hz); 13C NMR δ: 16.2, 17.8, 22.0, 23.2, 25.8, 26.8, 29.0, 31.5, 37.1, 39.8, 73.7, 89.8, 116.3, 123.9, 124.4, 124.9, 126.8, 131.2, 131.6, 132.2, 133.5, 136.0, 148.2, 161.4, 193.6; HRMS (ESI) m/z: calcd. for C25H33NO5Na
([M+Na]+) 450.2251, found 450.2261. {(S)-5-[(R,E)-1-hydroxy-1,5,9-trimethyldeca-4,8-dienyl]-2-methyl-4,5-dihydrofuran-3-yl}(2-nitrophenyl)methanone (49). Rf 0.56 (hexane/EtOAc = 1:1); [α] 20 D +51 (c = 0.35, CHCl3); IR max: 3452 (w), 2925 (m), 1599 (s), 1530 (s), 1348 (m), 1232 (m); 1H NMR δ: 1.24 (3H, s), 1.50 (1H, dd, J = 8.0, 1.2 Hz), 1.52 (1H, d, J = 8.0 Hz), 1.60 (3H, s), 1.62 (3H, s), 1.65 (1H, s), 1.68 (3H, s), 1.76 (3H, s), 1.98 (2H, t, J = 8.0 Hz), 2.04–2.21 (4H, m), 2.90 (2H, d, J = 10.0 Hz), 4.56 (1H, t, J = 10.0 Hz), 5.06–5.15 (2H, m), 7.38 (1H, dd, J = 7.6, 0.8 Hz), 7.58 (1H, ddd, J = 8.4, 7.2, 0.8 Hz), 7.72 (1H, ddd, J = 7.6, 7.2, 1.2 Hz), 8.15 (1H, dd, J = 8.4, 1.2 Hz); 13C NMR δ: 14.7, 16.2, 17.8, 21.9, 22.4, 25.8, 26.8, 30.8, 36.8, 39.8, 73.7, 88.7, 113.5, 123.9, 124.3,
124.7, 128.1, 130.0, 131.7, 134.4, 136.1, 138.2, 146.0, 167.0, 188.8; HRMS (ESI) m/z: calcd. for C25H33NO5Na ([M+Na]+) 450.2251, found 450.2251.
24
Aurachin H (12).
To a stirred solution of 42 (14.4 mg, 33.7 mol) in EtOH/water (1:1, 600 L) were added NH4Cl (9.0 mg, 169 mol) and zinc dust (17.6
mg, 269 mol) at room temperature, and the mixture was stirred for 30 min at 40 ˚C. The reaction mixture was cooled to room
temperature, saturated aq. NaHCO3 was then added to the reaction
mixture. The resulting mixture was filtered through a pad of Celite®, and the filtrate was extracted
with EtOAc. The combined organic extracts were washed with brine, dried over Na2SO4, filtered,
and concentrated in vacuo. The residue was purified by silica gel column chromatography (CH2Cl2/MeOH = 29:1 to 9:1) to give 12 (10.0 mg, 75%) as a yellow solid. Rf 0.14
(CH2Cl2/acetone/MeOH = 14:4:1); [α] 20 D+14 (c = 0.30, CHCl3); mp 190–191 °C; IR max: 3236 (m), 2926 (s), 1227 (m), 1071 (m); 1H NMR δ: 1.40 (3H, s), 1.56-1.67 (1H, m), 1.60 (3H, s), 1.65 (3H, s), 1.67 (3H, s), 1.71-1.82 (1H, m), 2.00 (2H, t, J = 7.2 Hz), 2.05–2.26 (4H, m), 2.65 (3H, s), 3.29 (1H, dd, J = 15.6, 9.6 Hz), 3.45 (1H, dd, J = 15.6, 8.8 Hz), 4.98 (1H, dd, J = 9.6, 8.8 Hz), 5.09 (1H, t, J = 7.2 Hz), 5.16 (1H, t, J = 7.2 Hz), 7.54 (1H, dd, J = 7.6, 7.2 Hz), 7.71 (1H, dd, J = 8.0, 7.2 Hz), 7.91 (1H, d, J = 8.0 Hz), 8.71 (1H, d, J = 7.6 Hz); 13C NMR δ: 16.2, 16.2, 17.9, 22.0, 22.8, 25.8, 26.7, 29.7, 37.6, 39.8, 73.7, 91.3, 116.0, 117.3, 120.4, 122.0, 123.8, 124.3, 127.1, 130.5, 131.7, 136.3, 141.1, 144.4, 153.6; HRMS (ESI) m/z: calcd. for C25H33NO3Na ([M+Na]+) 418.2353, found
41
第二章
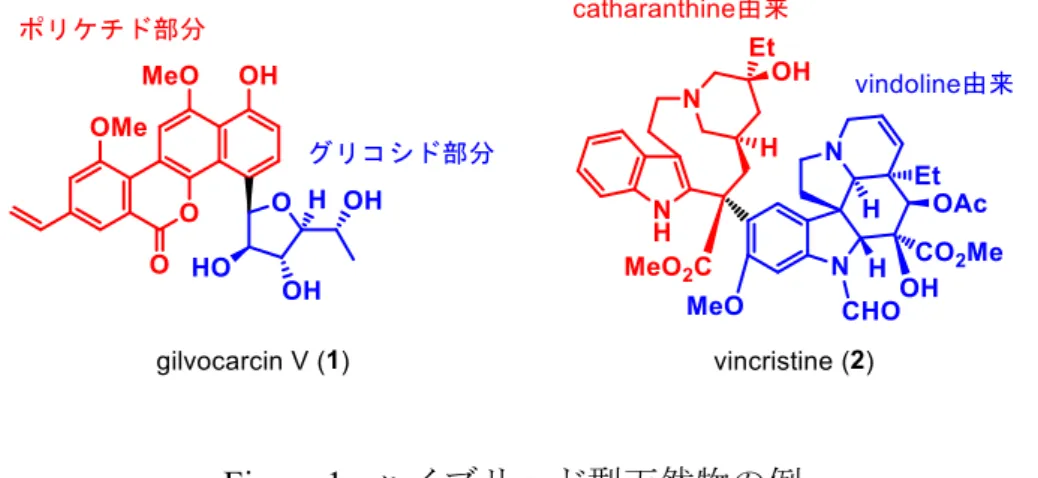
42 1. 研究背景 天然有機化合物はその生合成様式によってポリケチド、テルペノイド、グリコシド、ペプ チドなどに大別できるが、それらのうち生合成様式の異なる二種類以上の化合物が複合化す ることで生じる天然物は特に“ハイブリッド型天然物”と呼ばれ、構造の多様さから近年多 くの研究者の興味を惹いている(Figure 1)1)。例えばgilvocarcin V (1)はポリケチド部分とグ リコシド部分からなる。また広義には、類似した生合成様式でも異なる構造を持つ化合物同 士の複合化によって生じる天然物を指すこともあり、その例としては二種類のインドールア ルカロイドcatharantine と vindoline からなる vincristine (2)が挙げられる。
Figure 1. ハイブリッド型天然物の例
これらハイブリッド型天然物においては新規生物活性の発現や生物活性の強化が見られ ることがある2)。例えば、特に表立った生物活性を示さないcatharantine (3)と vindoline (4)の
複合化により生合成されるvincristine (2)は抗がん剤として利用されている(Figure 2)。
Figure 2. Vincristine の構造
また、抗菌作用を持つ holothin (6)は pseudomonic acid C 誘導体 5 と複合化することで thiomarinol (7)となり、より強力な抗菌作用を示すことが知られている(Figure 3)。
43 Figure 3. Thiomarinol の構造 このようにハイブリッド型天然物は大変興味深い化合物群と言えるが、構造の多様さ・複 雑さ故に、未だ合成法が確立されておらず生合成経路や生物活性などの詳細な研究がなされ ていない化合物も多い。そこで、ハイブリッド型天然物の合成研究を行うことでこのような 現状の打破に貢献できると考え、さらに合成過程において複合化に由来する新奇構造の合成 法を開発できれば、構造活性相関研究や構造単純化にも寄与できると考えた。そのような包 括的研究の一環として、ハイブリッド型天然物agelamadin C (8)および D (9)の合成研究を行 った(Figure 4)。 Figure 4. Agelamadin C および D の構造
44 2. Agelamadin C および D について Agelamadin C (8)および D (9)は 2014 年に小林らによって沖縄県慶良間諸島産の海綿 Agelas sp. か ら 単 離 ・ 構 造 決 定 さ れ た ハ イ ブ リ ッ ド 型 天 然 物 で あ る 3)。 本 化 合 物 は 、 L-3-hydroxykynurenine (12)の芳香環が酸化されたのちに oroidin (10)の二重結合部分とヘテロ Diels—Alder 反応を起こすことで生合成されると予想されている(Scheme 1)。また、このと き形成される 1,4-ベンゾオキサジン構造は天然物としては稀な骨格であり類例がほぼ知ら れていない。これらの構造的特徴から agelamadin C および D の実際の生合成経路に興味が 持たれる。 Scheme 1. Agelamadin C および D の予想生合成経路
現在agelamadin C および D について知られている生物活性は真菌 Cryptococcus neoformans に対する抗菌活性(IC50 = 33 g/mL)のみであるが、ハイブリッド型天然物であることを考
慮すると、ハイブリッド構造の基となる化合物oroidin (10)およびL-3-hydroxykynurenine (12) と同様の強力な活性、あるいはそれらと異なる新規活性を持つことが期待される。なお、 oroidin (10)は抗マラリア活性4)や真正細菌Rhodospirillum salexigens に対する菌膜形成阻害活
性5)、L-3-hydroxykynurenine (12)は神経毒性6)やヒトの水晶体の保護作用7)などといったよう
に、多様な生物活性を示すことが知られている。これらのことからagelamadin C および D の 詳細な生物活性評価が望まれる。
45 3. 合成戦略:生合成模倣反応 前節で述べたように agelamadin C および D の生合成経路および生物活性に興味が持たれ るが、その詳細な研究を行うにあたり生合成模倣反応を用いた全合成を行うことで寄与でき ると考えた。生合成模倣反応は生合成反応を有機合成化学的手法により再現する手法である。 以下に実例として林らによるepoxyquinol A および B の全合成を示す(Scheme 2)8)。林ら は予想生合成経路に倣いアルコール13 をアルデヒド 14 へと酸化することで、続く 6π電子 環状反応とDiels—Alder 反応を一挙に進行させ、epoxyquinol A (17)および B (18)の合成を良好 な収率で達成している。これにより、予想された生合成反応が酵素の非存在下で実際に進行 することが明らかとなった。また、単純な化合物からひとつの反応をきっかけとして一挙に 複雑な構造を構築することに成功しており、効率的な合成経路を確立している。 Scheme 2. 林らによる epoxyquinol A および B の合成 このように生合成模倣反応を用いることで生合成について知見を得ることができ、さらに複 雑な構造および複数の不斉点を円滑に形成できることが多いことから、合成標品を用いた生 物活性評価・構造活性相関研究にも貢献が可能となる。 生合成模倣Diels—Alder 反応による agelamadin C および D の合成研究に着手するにあたっ て、2002 年に Nicolaou らにより報告された Dess—Martin ペルヨージナンによる芳香環酸化/ 分子内Diels—Alder 反応(DMP/D—A 反応)を利用できると考えた9)。すなわち、Nicolaou ら
はウレア誘導体19 に対し DMP および H2O を作用させることで芳香環の酸化と続く分子内
Diels—Alder 反応が一挙に進行し、1,4-ベンゾオキサジン構造が形成できることを見出してい る(Scheme 3)。
46
Scheme 3. DMP/D—A 反応
そこで、oroidin とL-3-hydroxykynurenine の部分構造を併せ持つ 25 のような化合物に対して 本反応を行うことでagelamadin C および D の主骨格を形成できると考えた(Scheme 4)。
47 4. 逆合成解析:分子内 Diels—Alder 反応 以下に逆合成解析を示す (Scheme 5)。Agelamadin C (8)および D (9)は既知化合物 2810)、 1,4-ベンゾオキサジン構造を持つ29、アミノ酸セグメント 30 を連結することで収束的に合成で きると考えた。29 については Heck 反応による 30 との連結を想定してトリフラートとし、 前章で述べたDMP/D—A 反応を用いて 31 から合成できるとした。31 はイソシアナート 32 と アミン33 から合成できると考えた。アミノ酸セグメントについてはL-methionine (34)から数 工程の変換で合成できると考えた。 Scheme 5. 逆合成解析:分子内 Diels—Alder 反応
48
5. アミノ酸セグメントの調製 5.1. Boc 保護体の調製
まず、合成終盤において各保護基を TFA によって一挙に脱保護できるようアミノ基の保 護基として Boc 基を選択し、アミノ酸セグメント 39 の合成に着手した (Scheme 6)。L-methionine (34)から既知の手法によりL-homoserine (35)へと導き11)、アミノ基のBoc 保護と
続くメチルエステル化により36 を望まないラクトン 37 との分離困難な混合物として得た。 この混合物に対しDMP 酸化と続くアセタール化を行うことで 36 から 38 を得た。この際カ ラムクロマトグラフィーで精製することによりラクトン37 を分離している。得られた 38 を -脱離の反応条件に付したところ目的物 39 はごくわずかしか得られず、主生成物は Boc 基 に由来する分子内アセタール40 および 41 であった。 Scheme 6. Boc 保護体 39 の調製
49 このことから生成した 39 についても 42a→42b のような反応機構による光学純度の低下が 懸念されたため、保護基を見直すことにした (Scheme 7)。 Scheme 7. 懸念されるエピメリ化の機構 5.2. フタロイル保護体の調製 新規合成経路においては、保護基をカルバマート系ではなく分子内アセタールを形成しに くいイミド系に変更することにした (Scheme 8)。まず、L-methionine (34)よりメチルエステ ル化とフタロイル保護により44 を得た。続いて NCS を用いた Pummerer 転位型の反応を行 うことで既知化合物45 へと導いた 12)。このものを-脱離の反応条件に付したところ反応は 定量的に進行し、E:Z = 5:1 の混合物として目的のアミノ酸セグメント 46 の調製を完了した。 Scheme 8. アミノ酸セグメントの調製
50 6. DMP/D—A 反応による 1,4-ベンゾオキサジン構造の形成 既知の手法 13)に倣い、2-aminoethanol (47)からアミノ基の保護とヒドロキシル基の酸化に よりアルデヒド49 とした後、Wittig 反応と続くシリルエノールエーテルを経由したα-ブロ モ化によって51 を得た(Scheme 9)。このものに対し 2-aminopyrimidine (52)を作用させるこ とで 53 とした後、酸性条件に付すことで複素環部位の形成及びフタロイル基の除去が一挙 に進行し、アミン塩酸塩54 を得た。この際 54 は極性の高さから精製が困難であったため粗 生成物のまま合成を進めることにした。 Scheme 9. アミン塩酸塩 54 の調製 続いて、o-nitrophenol (55)からヒドロキシル基のトリフラート化およびニトロ基の還元に より57 とした後、triphosgene を用いてイソシアナート 58 とし、アミン塩酸塩 54 を作用さ せることでウレア誘導体59 を得た(Scheme 10)。このものに対し Nicolaou らの手法9)に倣
ってDMP と H2O を作用させ DMP/D—A 反応を試みたところ(Table 1)、entry 7 の条件にお
51
Scheme 10. 1,4-ベンゾオキサジン構造の形成
しかしながらこれ以上収率の改善が見込めず、また 59 の調製についても反応条件を種々検
討したが収率の改善が見られなかったため(Scheme 11)、このまま合成を進めるのは困難で あると判断した。
52 Scheme 11. ウレア誘導体 59 の調製の検討 そこで低収率の原因がトリフラート部分の不安定性にあると仮定し、比較的安定なヨウ化 物64 を用いて検討を行うことにした(Scheme 12)。o-iodoaniline (62)よりイソシアナート 63 へと導き、アミン塩酸塩54 を作用させた。種々検討を行った結果、entry 5 の条件において 51 から 3 工程・収率 31%で目的物 64 が得られた。 Scheme 12. ウレア誘導体 64 の調製
53
しかし、本化合物に対するDMP/D—A 反応は進行せず、新たな合成戦略へ移行することにし た(Scheme 13)。
54
7. 逆合成解析:分子間 Diels—Alder 反応
新規合成戦略として分子間 Diels—Alder 反応による合成経路を立案した(Scheme 14)。す なわち、agelamadin C (8)および D (9)は oroidin (10)とL-3-hydroxykynurenine 酸化体の分子間 Diels—Alder 反応によって合成できると考えた。また、oroidin (10)は前章で述べたアミン塩酸 塩54 より調製できるとし、L-3-hydroxykynurenine (12)はアミノ酸セグメント 46 と芳香環セ グメント 66 の連結により調製できると考えた。本戦略においてはより生合成反応に近い条 件下で Diels—Alder 反応を行うことが可能であるため、生合成に関する知見がより多く得ら れると考えられる。 Scheme 14. 逆合成解析:分子間 Diels—Alder 反応 しかし、分子間 Diels—Alder 反応を行うにあたっては位置選択性の制御が困難になること が予想される(Scheme 15)。反応が TS1 に示す位置関係で進行した場合の生成物は望みの agelamadin C (8)もしくは D (9)となるのに対し、TS2 に示す位置関係で進行した場合の生成 物はいずれも望まない化合物となる。そのため分子間 Diels—Alder 反応においては位置選択 性を如何に制御するかが課題となる。
55 Scheme 15. 分子間 Diels—Alder 反応における位置選択性 ここで、2002 年に Nicolaou らにより報告された類似の Diels—Alder 反応において、ジエノ フィルのより電子豊富な炭素原子がオルトアザキノンの窒素原子と結合するという知見が 得られている(Scheme 16)14)。すなわち、agelamadin C および D の合成にとって望ましい 位置選択性で反応が進行しているということである。
Scheme 16. Nicolaou らによって報告されたヘテロ Diels—Alder 反応
また、agelamadin C および D の単離文献3)において位置異性体にあたる化合物の単離報告
がなされていないということからも、Diels—Alder 反応が望みの位置選択性で進行すると期 待される(Figure 5)。
56
Figure 5. Diels—Alder 反応の位置異性体
以上のことから分子間 Diels—Alder 反応を用いた合成戦略が適用可能であると考え、合成に 着手した。
57 8. Oroidin の合成 まずoroidin (10)の合成に着手した(Scheme 17)。51 から 2 工程でアミン塩酸塩 54 へと導 き、既知化合物2810)と連結させることで72 を得た。このものに対しヒドラジンを作用させ ることで、47(cf. Scheme 9)から 9 工程・総収率 20%で oroidin (10)の合成を完了した。な お、これまでで最も効率的と言われるRasapalli らによる合成経路は 8 工程・総収率 8.2%で あることから10)、本合成経路によりoroidin の改良合成を達成できたと言える。 Scheme 17. Oroidin の合成
58 9. L-3-hydroxykynurenine の合成 9.1. Heck 反応による合成の検討 アミノ酸セグメントとして調製済みの 46 を用いることにし(cf. Scheme 8)、芳香環セグ メントの調製を行った。まずo-aminophenol 誘導体 73 および 75 の C-H 酸化反応による調製 を試みたが、いずれも目的物を得ることができなかった(Scheme 18)。 Scheme 18. C-H 酸化反応による調製の検討
そこで2-nitroresorcinol (78)からの調製を試みた(Scheme 19)。すなわち、2-nitroresorcinol (78)をモノアセチル化と続くトリフラート化によって 79 とした。また、ニトロ基の還元およ びアセチル保護によってアニリン誘導体80 も調製した。
59 Scheme 19. 芳香環セグメントの調製 反応基質の調製を完了したので Heck 反応の検討を行った。まず 79 に対しアミノ酸セグ メント46 とのカップリングを試みたが、反応は進行せず 79 の分解に終わった(Scheme 20)。 Scheme 20. ニトロベンゼン誘導体の Heck 反応 そこでまずモデル基質としてアリールトリフラートとの Heck 反応の例が知られている 70 を用いて常法によるカップリングを試みた(Scheme 21)19)。しかしながらこちらも反応は進 行せず、79 が分解する結果となった。このことから、79 に対する Pd (0)の酸化的付加まで は進行し、立体的もしくは電子的な要因からカップリングが進行せず、79 の分解のみが進 行したと考えられる。 Scheme 21. モデル実験 続いて80 を基質として反応を行った。まずモデル化合物 70 とのカップリングを試みたと ころ、痕跡量ながら83 を得ることができた(Scheme 22)。続いて実際の基質 46 とのカップ リングを試みた(Table 5)。しかしながらいずれの条件においても望みの反応は進行せず、 目的物を得ることはできなかった。このことからアミノ酸セグメント 46 を用いてカップリ
60 ングを行うのは困難であると考え、新たな戦略へ移行することにした。 Scheme 22. アニリン誘導体の Heck 反応 9.2. その他の連結法による合成の検討 新たな戦略として、まず既知化合物であるチオエステル 8520)を用いた合成を検討するこ とにした(Scheme 23)。 Scheme 23. チオエステルを用いた戦略 既知化合物 8821)をオルトリチオ化した後、種々の求電子剤を作用させることでカップリ
ング反応の基質の調製を試みた(Scheme 24)。有機ホウ素化合物(Table 6, entry 1)および有 機スズ化合物(entry 2, 3)への誘導においては満足な結果を得ることができず、Liebeskind— Srogl カップリングによる合成を進めるのは困難であると判断した。そこで福山カップリン グによる連結を意図し有機亜鉛化合物へ直接変換しようと試みたが反応は進行せず(entry
61 4)、最終的にヨウ素を作用させることでヨウ化物を得ることができた(entry 5)。 Scheme 24. 求核付加による芳香環セグメントの調製 しかしながら、得られた91 を用いて 85 との福山カップリングを試みたところ反応は進行せ ず、目的物を得ることはできなかった(Scheme 25)。 Scheme 25. ヨウ化物 91 とチオエステル 85 の福山カップリング そこで 92 をモデル化合物として有機亜鉛化合物への誘導を試みたところ、反応が進行し ないか Boc 基の除去が進行する結果となり、91 を用いた福山カップリングは困難であると 判断した(Scheme 26)。
62 Scheme 26. モデル基質を用いた有機亜鉛化合物の調製 続いてヨウ化物91 に対しハロゲン-リチウム交換を行い、Weinreb アミド 9522)もしくはアル デヒド9620)への求核付加を試みたが、反応がほとんど進行せずプロトン化した88 が得られ る結果となった(Scheme 27)。 Scheme 27. 求核付加による連結の検討 以上の結果を踏まえ、両セグメントの連結位置を変更することにした。すなわち、98 から
63 2 工程で誘導したチオエステル 99 に対し、既知の手法23)により調製した有機亜鉛化合物101 との福山カップリングを試みた(Scheme 28)。しかしながら反応は進行せず 103 が得られる 結果となったため、99 は福山カップリングにおいて反応性が低いことが示唆された。 Scheme 28. ヨウ化物 100 とチオエステル 99 の福山カップリング 続いて88 から調製したアルデヒド 104 とヨウ化物 100 の Barbier 反応を試みたが、複雑な混 合物を与える結果となり目的物は得られなかった(Scheme 29)。 Scheme 29. ヨウ化物 100 とアルデヒド 104 の Barbier 反応 以上のことからアミノ酸セグメントと芳香環セグメントの連結による合成は困難である と判断し、新たな合成戦略に移ることとした。 9.3. 生合成を模倣した合成 新たな戦略として生合成を模倣した合成経路を立案した。L-3-hydroxykynurenine は L-tryptophan (106)の C2-C3 位二重結合の酸化的開裂と芳香環の酸化によって生合成される (Scheme 30)24)。そこで生合成経路と同様にL-tryptophan (106)の酸化的開裂およびヒドロキ シル基の導入による合成を試みることとした。
64 Scheme 30. L-3-hydroxykynurenine の生合成経路 C2-C3 位二重結合の開裂は Stoltz らによる報告を基に行った。すなわち 108 をオキシイン ドール110 とし、カルボニルα位の酸化によって過酸化物 111 へと導いた後、メタノール中 で塩基を作用させることでオキシインドール環を開裂し既知のkynurenine 保護体 11225)を得 た(Scheme 31)。しかし、このものに対し C-H 酸化反応を試みるも目的物を得ることができ なかったため(Table 8)、先にヒドロキシル基を導入してから酸化的開裂を行うことにした。 Scheme 31. C-H 酸化反応による調製の検討 まず既知の L-tryptophan 保護体 11626)から C2・C7 位のホウ素化と続く酸化によってオキ シインドール117 を調製し、ヒドロキシル基を保護した(Scheme 32)。Entry 1-4 では TBS 保 護を試みたが満足のいく結果を得ることはできなかった。そこでentry 5 ではアセチル保護、
65 entry6 ではエトキシエチル保護を試みたところ、それぞれ目的物が得られた。 Scheme 32. オキシインドール 118 の調製 続いてアセチル保護体 119 のカルボニルα位を酸化して含水条件下で塩基を作用させた ところ、予想に反して目的物は得られず、主生成物は反応中間体122 において分子内で環化 が進行したと予想されるカルバマート123 であった(Scheme 33)。 Scheme 33. アセチル保護体でのオキシインドール環の開裂 一方、エトキシエチル保護体124 についても同様の変換を施したところ、目的物 121 は得ら
66 れたもののカルバマート123 も 1:1 の比率で得られ、両者は分離困難であった(Scheme 34)。 Scheme 34. エトキシエチル保護体でのオキシインドール環の開裂 そこで分子内環化反応を抑制するためBoc 保護体を用いることとした(Scheme 35)。117 をBoc 保護した後、同様の変換により 126 とし、含水条件下で塩基を作用させたところカル バマートを生成することなくL-3-hydroxykynurenine 保護体 127 が得られた。このものに対し TFA を作用させることで L-3-hydroxykynurenine (12)の世界初の不斉合成を達成した。また、 127 に対しピペリジンを作用させることで芳香環部分のみが無保護の状態となった 121 を経 由し、このものにTFA を作用させL-3-hydroxykynurenine (12)を得ることも可能であった。 Scheme 35. L-3-hydroxykynurenine の合成
67
10. 芳香環の酸化/Diels—Alder 反応 10.1 無保護での検討
Oroidin (10)とL-3-hydroxykynurenine (12)の調製を完了したので芳香環の酸化と続く Diels— Alder 反応の検討に取りかかった(Scheme 36)。まず entry 1-3 において酸化剤としてそれぞ れ空気、O2、Ag2O を用いたが、望みの反応は進行しなかった。続いて entry 4-6 においては、 より生合成反応に近い条件としてH2O を溶媒、空気を酸化剤とし、pH = 3, 9, 11 でそれぞれ 反応を試みたが、こちらも望みの反応は進行しなかった。 Scheme 36. 芳香環の酸化/生合成模倣 Diels—Alder 反応 このように生合成模倣反応が進行しなかったことから、実際の生合成反応に何らかの酵素が 関与しているか、予想されている生合成経路と異なる可能性が示唆された。 10.2. 保護体での検討 L-3-hydroxykynurenine (12)が複数の異なる官能基を併せ持ち、取り扱いが難しく可溶な溶媒 も限られていることから、以降の検討には合成中間体である 121 を用いることとした。
Oroidin (10)と 121 に対し種々の酸化剤を作用させたところ(Scheme 37)、MnO2(entry 2)も
しくはPhI(OAc)2(entry 3)を作用させた際にマススペクトルで一致する値([M+H]+ found:
766.1199 / calcd.: 766.1194 for C30H3879Br2N7O7)を示す128 と思しき化合物が得られた。しか
68 得られた化合物は121 の二量体 129 であった。 Scheme 37. 保護体での芳香環の酸化/Diels—Alder 反応 そこでより多くの知見を得るため121 だけに対して種々の酸化剤を作用させたところ、望 みのオルトアザキノン130 は得られず二量体 129 のみが得られた(Scheme 38)。 Scheme 38. 芳香環の酸化 この結果より、121 から酸化体 130 への付加による二量化が 121 の酸化よりも早く進行する ことが示唆されたため、121 のアミノ基をアシル化することで求核力を抑制することにした
(Scheme 39)。しかし、Scheme 38 と同様に MnO2もしくは PhI(OAc)2を作用させたものの
69
Scheme 39. トリフルオロアセチル化体の酸化
10.3. モデル化合物による酸化剤の検討
131 でのさらなる検討を行う前に、既知化合物 13327)から誘導した 134 をモデル化合物と
して酸化剤の検討を行った(Scheme 40)。Entry 1-3 においてそれぞれ O2、PhI(O2CCF3)2、
Ag2O を用いたところ、反応はほとんど進行せず二量体 136 がわずかに得られるのみであっ た。Entry 4 において Pb(OAc)4を用いた際には原料134 が消失したものの生成物はやはり二 量体136 であった。 Scheme 40. モデル化合物 134 の酸化 以上の結果を受け、唯一原料が消失したentry 4 の条件を基に Pb(OAc)4を酸化剤として詳細 な検討を進めることにした(Scheme 41)。なおこのとき、反応停止時に二量化が進行してい る可能性も考慮し、酸化後にワンポットでジエノフィルのモデル化合物として butyl vinyl ether を加えることにした。Entry 1 では室温で反応を行ったが、目的物は得られず複雑な混 合物を与える結果となった。Entry 2 では−78 ℃の低温条件下で酸化を行い、butyl vinyl ether を加えてから室温に昇温したところ目的物 137 を主生成物として得ることに成功した。ま
70 様に進行することが確認された。なお、この際に二量体 136 が観測されなかったことから、 低温条件下で反応を行うと Diels—Alder 反応が二量化よりも優先的に進行することが明らか となった。Entry 4, 5 においては実際の基質である oroidin が可溶な溶媒を用いたが複雑な混 合物を与える結果となった。 Scheme 41. モデル化合物 134 の芳香環の酸化/Diels—Alder 反応 続いて実際の基質である oroidin 誘導体をジエノフィルとして Diels—Alder 反応を試みた。 なお、先述の通りoroidin (10)が反応溶媒の THF に難溶であるため 2-アミノイミダゾール部 分を Boc 保護した 2 種類の基質について検討を行うことにした。まず oroidin (10)に対し環 内のアミノ基をBoc 保護することで 138 を得た(Scheme 42)。 Scheme 42. Oroidin 保護体 138 の調製 一方、51 に対し N-Boc-guanidine (139)28)を作用させることで140 とし、さらに一級アミン部 分をBoc 保護することで 141 を得た(Scheme 43)。このものより既知の手法で一級アミン部 分のみがBoc 保護された oroidin 誘導体 143 を得た28)。
71
Scheme 43. Oroidin 保護体 143 の調製
しかし、調製した138 および 143 を用いて 134 との芳香環酸化/Diels—Alder 反応を試みたと
ころ目的物は得られず、複雑な混合物を与えるのみであった(Scheme 44)。
72
Butyl vinyl ether を用いた Scheme 41 と比較したとき、反応が進行しなかった要因の一つとし てジエノフィル 138 および 143 の嵩高さに由来する立体障害が予想される。よって今後は 134 の保護基をより立体障害の少ないホルミル基などとし、反応を試みる予定である
(Scheme 45)。
73 11. 小括 第二章では生合成模倣Diels—Alder 反応によるハイブリッド型天然物 agelamadin C (8)およ びD (9)の合成研究を行った。まずウレア誘導体 59 を反応基質とした DMP/D—A 反応(分 子内Diels—Alder 反応)による合成を試みたところ、1,4-ベンゾオキサジン構造を形成する ことはできたものの収率を改善することができず、新たな合成戦略へと移行した(Scheme 46)。 Scheme 46. DMP/D—A 反応 新規合成戦略ではより生合成反応に近い分子間Diels—Alder 反応による合成を試みること にし、生合成前駆体と予想されるoroidin (10)の改良合成およびL-3-hydroxykynurenine (12) の世界初の不斉合成を達成した(Scheme 47)。両化合物を生合成反応に近い条件に付した ところ望みの反応は進行せず、このことから生合成反応に酵素が関与しているか、予想さ れた生合成経路と実際には異なることが示唆された。
Scheme 47. Oroidin およびL-3-hydroxykynurenine の合成と生合成模倣 Diels—Alder 反応
現在までにモデル化合物において芳香環の酸化と続くDiels—Alder 反応の最適条件を見出し ているが(Scheme 48)、実際の基質である oroidin 誘導体との連結には至っておらず、今後 は保護基の選択などにより最適な反応基質の検討が必要となる。
74