銅輸送タンパク質Ctrにおける金属結合モチーフの
分光分析とその応用
著者
岡田 毬子
学位授与機関
Tohoku University
学位授与番号
11301甲第18614号
URL
http://hdl.handle.net/10097/00125873
銅輸送タンパク質 Ctr における
金属結合モチーフの分光分析とその応用
東北大学大学院 薬学研究科
分子薬科学専攻
1
目次
1. 序論 4 2. 実験 2. 1. Cys/Trp モチーフモデルペプチドの合成と精製 2. 1. 1. Fmoc 固相合成法によるペプチドの合成 2. 1. 2. ペプチドの切り離しと脱保護 2. 1. 3. HPLC による精製 2. 1. 4. 定量 2. 1. 5. 還元型 SH 基の定量 2. 2. 銅添加前後の Cys/Trp モチーフの蛍光スペクトル測定2. 2. 1. Cu(II)を添加した Cys/Trp モチーフの SCu(I)由来の蛍光の検出 2. 2. 2. Cys/Trp モチーフへの Cu(I)の滴定 2. 3. 銅前後の Cys/Trp モチーフの非共鳴ラマンスペクトル測定 2. 3. 1. Cu(II)を添加した Cys/Trp モチーフの 488 nm 励起ラマンスペクトル測定 2. 3. 2. Cu(I)を添加した Cys/Trp モチーフの 488 nm 励起ラマンスペクトル測定 2. 4. 質量分析スペクトル 2. 5. BCA (ビシンコニン酸) を用いた Cu(II)の還元量の測定 2. 6. 紫外吸収スペクトル測定によるトリプトファン側鎖環境の測定 2. 7. 紫外共鳴ラマンスペクトルの測定 2. 8. Ctr4(113-136)の CD スペクトル測定 2. 9. Cys/Trp モチーフと Cu(I)との結合定数の算出 2. 10. リポソームストック溶液の調製 2. 11. リポソームの有無による Cys/Trp モチーフの蛍光スペクトルの変化 2. 12. Stern-Volmer 消光実験 2. 13. 蛍光寿命測定 2. 14. 脂質膜存在下における CD スペクトル測定 2. 15. ラマンスペクトル測定 10 10 11 12 13 13 15 15 15 16 16 17 17 18 19 19 20 20 22 23 23 25 25 26
2 3. Cys/Trp モチーフによる Cu(II)の還元 3. 1. 序 27 3. 2. 結果 30 3. 2. 1. Cu(II)の添加による S-Cu(I)由来の蛍光の出現 30 3. 2. 2. Cys/Trp モチーフにより還元された Cu(I)の定量 31 3. 2. 3. 銅添加による S-S 結合の形成 33 3. 2. 4. 質量分析 35 3. 2. 5. 分子内 S-S 結合を生成した分子種の分離・定量 37 3. 3. 考察 39 4. Cys/Trp モチーフと Cu(I)の結合構造 4. 1. 序 43 4. 2. 結果 45 4. 2. 1. Cys/Trp モチーフと Cu(I)の結合の化学量論 45 4. 2. 2. S-Cu(I)結合由来の蛍光に関する励起スペクトルの測定 46 4. 2. 3. 銅の添加に伴うトリプトファン側鎖環境の変化 47 4. 2. 4. 非共鳴ラマンスペクトルによる His-Metal のラマンバンドの観測 51
4. 2. 5. BCA を用いた Cys/Trp モチーフの Cu(I)結合定数の算出 53
4. 3. 考察 56 4. 3. 1. Ctr4 と Ctr5 の Cys/Trp モチーフにおける Cu(I)の結合構造 56 4. 3. 2. Cys/Trp モチーフと Cu(I)の結合定数と、Ctr の銅輸送機構との関連 58 5. Cys/Trp モチーフと脂質二重膜の相互作用 5. 1. 序 60 5. 2. 結果 62 5. 2. 1. 脂質二重膜存在下におけるトリプトファン残基の蛍光 62
5. 2. 2. Red edge excitation shift による Cys/Trp モチーフ周辺環境の評価 63
5. 2. 3. Stern-Volmer 消光実験 66
3 5. 2. 5. Cu(I)との相互作用による二次構造変化 69 5. 3. 考察 72 6. Cys/Trp モチーフを用いた新規機能性分子の設計 6. 1. 序 75 6. 2. Cys/Trp モチーフ修飾型環状ペプチドの合成 77 6. 2. 1. 鎖状ペプチドの合成 77 6. 2. 2. 希酸によるペプチドの脱樹脂 77 6. 2. 3. Head-to-tail 環状ペプチドの合成 78 6. 2. 4. (KA)3に修飾する Cys/Trp モチーフの合成 78 6. 2. 5. Cys/Trp モチーフと (KA)3の縮合 79 6. 3. Cys/Trp モチーフと Cu(I)が結合することの確認 80 6. 4. Cys/Trp-(KA)3のチャネル活性の評価 81 6. 4. 1. Dehydration-Rehydration 法による色素内包リポソームの調製 81 6. 4. 2. 色素内包リポソームを用いた Cys/Trp-(KA)3のチャネル活性の評価 82 6. 4. 3. SH 基の酸化によりチャネル活性が低下することの確認 6. 5. 考察 85 87 7. 結論 89 謝辞 94 参考文献 95 発表論文リスト 106
4
1. 序論
銅は、生命機能の維持に必要不可欠な元素である。銅は生体内において、一価と二価の 二つの酸化状態を取りうるため、スーパーオキシドジスムターゼや、シトクロム c など、 様々な酵素の活性中心として機能している[1,2]。このため、生体内における銅の不足は重 篤な障害をもたらす。銅の欠乏症として、メンケス病が知られており、これは銅輸送 ATPase である ATP7A の遺伝子異常により、腸管粘膜から体内に銅が取り込まれないことが原因 で発症する[3]。一方、その反応性の高さから、生体内の銅が過剰になった場合にも、活性 酸素種の生成や、細胞成分の酸化などが発生し、生体にとって有害となる。銅の過剰症は ウィルソン病と呼ばれ、これも銅輸送 ATPase である ATP7B の遺伝子変異により、胆汁中 に銅が適切に排泄されないことが原因で発症する[3]。このため、生体内における銅の濃度 は様々なトランスポーターによって厳密に制御されており、また細胞内に取り込まれた銅 はフリーの状態では存在せず、銅シャペロンなどのタンパク質やグルタチオンなどに捕捉 され、反応性を制限された状態で存在している[1,2,4]。 銅とタンパク質の相互作用は、興味深い分光学的特性を示すものが多く、分光スペクト ルの測定から銅の配位構造などを詳細に解析できる[5]。吸収スペクトルでは、主に Cu(II) とタンパク質の複合体について構造解析できる。これは、二価の銅は d 軌道が空いており 可視域に d-d 遷移吸収を示すためであり、Cu(II)が結合したタンパク質はその配位子に応じ て異なる波長・強度の d-d 遷移吸収を可視域に示す[6]。Cu(II)が結合したタンパク質は、タ イプ 1 銅、タイプ 2 銅、タイプ 3 銅などに分類され、それぞれ電子伝達系、酸化還元、酸 素運搬などに関与している[7]。この中でタイプ 1 銅は、d-d 遷移吸収のみならず、Cys 残 基のチオレートアニオンから Cu(II)への電荷移動吸収に由来する大きな吸収帯が 600 nm 付 近に存在し、溶液が濃い青色を呈する[7,8]。この電荷移動吸収は d-d 遷移吸収よりも遥か に吸光度が大きく、容易に観測できる。このような分光特性から、アズリン、プラストシ アニンなどのタイプ 1 銅を含むタンパク質はブルー銅タンパク質と呼ばれ、その配位環境 や分光特性、酸化還元活性などが幅広く調べられている[5,8-10]。5 一方、Cu(I)は d 軌道が埋まっているので可視域には吸収帯が存在しない。しかし Cu(I) 錯体は、非常に興味深い蛍光、CD スペクトルを示し、またラマンを用いることでその構 造を詳細に解析できる。蛍光スペクトルでは、S 原子とCu(I)が多核の錯体を形成する場合、 この錯体由来の蛍光が観測される[11]。配位子の種類やクラスターの大きさ等によってこ の蛍光の波長は変化するが、チオレートアニオンと Cu(I)で形成される錯体の場合、この蛍 光は 300 nm 付近で励起され、500 nm よりも長波長側の領域で観測される場合が多い[11-18]。 この蛍光は、低分子と Cu(I)のクラスター[12-13]での報告が多いが、メタロチオネインのよ うなペプチド鎖中に存在する Cu(I)イオンでもこのような蛍光は観測されている[14-18]。こ れらの錯体は µs オーダーの長い蛍光寿命を有し、溶存酸素によって容易に消光されうるこ とから、励起状態は三重項状態であると考えられている[18]。このような特徴的な蛍光が タンパク質中で観測されることは分光学的に興味深く、また生体親和性の高い発光材料と なる可能性を有している。 多核の Cu(I)錯体の CD スペクトルを測定すると、d 軌道が埋まっている遷移金属同士の 相互作用である d10-d10相互作用が存在する場合、近紫外域に特徴的な CD が観測されるこ とが知られており、S-Cu(I)クラスター由来の蛍光同様、主に金属結合タンパク質であるメ タロチオネインにおいてよく研究されている[19,20]。強度はあまり大きくないものの、ペ プチド主鎖の二次構造由来の CD とは異なる領域に観測されるため、ペプチドの主鎖構造 と同時に d10-d10相互作用を分光学的に検出できる。一方、Cu(II)とタンパク質の CD スペク トルでは、Cu(II)とトリプトファンのカチオン-π 相互作用のマーカーバンドとして、223 nm に観測される特徴的な負の CD が報告されている[21]。 蛍光、CD に加えて、芳香族性アミノ酸残基と金属の結合を解析する場合、ラマンスペ クトル測定は非常に強力な手段となる。トリプトファンのインドール環は正電荷とカチオ ン-π 相互作用をすると、Bb吸収帯と呼ばれる 220 nm にある吸収バンドが僅かな強度減少 を伴って長波長シフトするが、この吸収スペクトルのシフトは、紫外共鳴ラマンを用いる ことで主鎖アミドの吸収や他の芳香族性アミノ酸残基の変化と分離できる[22]。実際に、
6 銅シャペロン CusF において、Cu(I)と Trp 残基とのカチオン-π 相互作用が、紫外共鳴ラマ ンを用いて共鳴効果によるバンド強度の変化から確認されている[23]。また、His 残基と金 属イオンの結合は、Nτ 位と Nπ 位のどちらの N 原子で配位しているかをそれぞれの異性体 のラマンバンドから決定できる[24-27]。また、His の C2位を D 化すると、銅の結合に伴う His のラマンバンドの変化を 2300-2450 cm-1の領域で観測できる[28]。His 残基の C2位の D 化は D2O 中でのインキュベートによって比較的簡便に達成され[29]、1900-2700 cm-1には他 の官能基由来のラマンバンドが存在しないため[30,31]、金属タンパク質のラマンイメージ ングなどに応用できる可能性がある。 このように、タンパク質と銅の結合は興味深い分光特性を持っている。本研究では、こ のような銅とタンパク質の分光スペクトルを用いて、タンパク質中の金属結合モチーフに ついて銅イオンとの結合構造を解析した。 金属タンパク質中には、タンパク質全長でなくても、部分配列のみで金属結合能を持つ、 数残基から数十残基ほどの配列が存在する場合があり、これを金属結合モチーフと呼ぶ。 例えば、ペプチド鎖の N 末端によく見出される ATCUN (Amino Terminal Cu(II)- and Ni(II)-Binding) モチーフでは、N 末端のアミノ基、主鎖アミドの N 原子と、His 残基のイミ ダゾール環が Cu(II)や Ni(II)を平面構造で配位する[32,33]。また、亜鉛イオンに応答して DNA への結合能が変化する Zinc-Finger protein は、C2-H2モチーフと呼ばれる、2 つの Cys
残基と 2 つの His 残基で構成される亜鉛結合モチーフが存在する[34,35]。Cys 残基と His 残基の間は10 残基以上空いており、C2-H2モチーフ全体は 20 残基ほどの長さを持つ[34,35]。 このような金属結合モチーフは、部分配列のみで金属結合能を持つため、全長のタンパク 質で構造解析を行わなくとも、モチーフ周囲の配列をモデルペプチドとして合成し、構造 を解析できる[33,35]。 このような部分配列の構造解析において、局所構造解析に強みを持つ蛍光・ラマン分光 法は有用な手段となりうる。X 線結晶構造解析や NMR 分光法のような、原子座標レベル での構造解析が可能である分析手法は、構造が不均一な化学種では測定が困難であり、ま
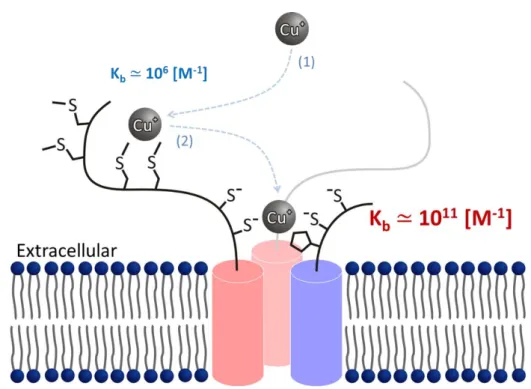
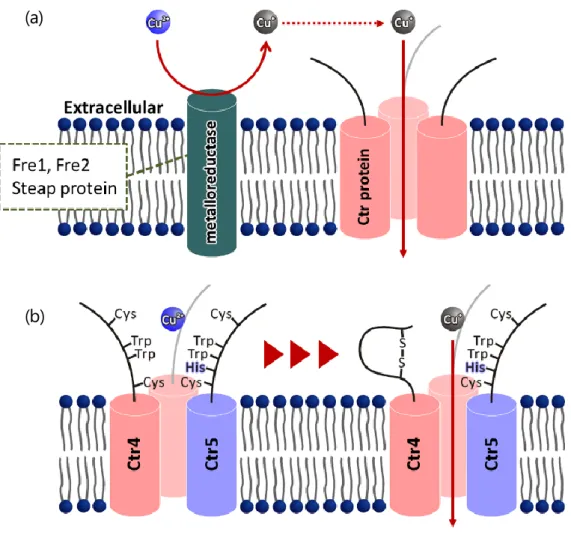
7 たそれぞれ結晶条件、高濃度条件のみに測定条件が限られている。さらに、生細胞でのイ メージングが現時点では不可能であり、時間分解能が低い、または無いなどの欠点も存在 する。一方、蛍光・ラマンスペクトル測定は、得られる情報が発色団周囲の情報 (局所構 造) やペプチド主鎖の全体構造など限定的である一方、希薄溶液中や、脂質二重膜存在下、 生細胞中など、様々な条件での測定が可能である。また、複数の化学種が混ざっており、 不均一な系においても、目的の官能基や発色団のみに着目しての測定が可能である。この ような蛍光・ラマンスペクトルの特徴は、部分配列の局所構造解析において非常に有用で ある。単に構造解析の利点になるだけではなく、構造解析を行った配列を用いて新規機能 性分子を合成したり、生細胞中で目的の配列を観測したりする場合に、構造解析の過程で 発見したマーカーバンドを、機能性分子の特性の評価や、生細胞でのイメージングにその まま応用できるという利点がある。特に、生細胞中のタンパク質は、分子クラウディング 効果などによって緩衝溶液中とは異なった構造安定性や相互作用特性を有する場合がある [36-38]。分光測定によって発見したタンパク質の構造マーカーを用いて、例えば創薬の過 程で、新薬の候補化合物の結合に伴うタンパク質の構造変化を in situ で観測できるだろう。 本研究では、ペプチド鎖と銅との相互作用を示す系の一つとして、細胞外から細胞内へ 銅を輸送するタンパク質である、Ctr (Copper transporter) タンパク質の金属結合モチーフに 着目し、構造解析を行った。Ctr タンパク質は、銅の恒常性維持に関与する金属輸送タン パク質の一種であり、Cu(I)を細胞外から細胞内へ輸送するチャネルタンパク質である [1,3,39-43]が、銅輸送の詳細な機構は不明である。単量体は 3 回膜貫通型のタンパク質であ り、これがホモまたはヘテロ三量体として機能する[44,45]。Ctr タンパク質は、N 末端側を 細胞外 (あるいは小胞体のルーメン側) に、C 末端側を細胞内に露出している[44-46]。膜 タンパク質である Ctr は、結晶化が難しく、X 線結晶構造解析による三次元構造の研究が 困難である。近年、低温電子顕微鏡法による構造解析の結果をもとに、計算によってヒト Ctr1 の全原子モデル[46]が作成された (図 1-1)。現在、Ctr タンパク質に関する研究は、こ の全原子モデルに基づいて進められている。ヒト Ctr タンパク質は、銅の取り込みだけで
8 はなく、シスプラチンなどの抗がん剤の取り込みへの関与が明らかになっており[47,48]、 Ctr タンパク質の医療における重要性が明らかになりつつある。 Ctr タンパク質において、細胞外へ露出している N 末端領域には、Met 残基、His 残基な どの銅親和性が高いアミノ酸残基や、いくつかの金属結合モチーフが存在している [33,49-53]。私は、Ctr タンパク質の N 末端ドメインについて、3 章以降に示すように銅結 合を行う新たなモチーフを見出し、このモチーフを Cys/Trp モチーフと定義した。新規金 属結合モチーフを同定し、その結合構造や結合定数等を明らかにすることは、Ctr タンパ ク質の構造機能相関を明らかにするだけではなく、医薬品や発光材料などの新規機能性分 子の開発につながる知見を得るために重要である。従って本研究では、Ctr タンパク質中 に発見した新規銅結合モチーフである Cys/Trp モチーフについて、分光学的手法を用いて その構造を解析し、構造の分光マーカーを得ることを目的とした。 図 1-1 ヒト Ctr1 の全原子モデル[46]。図の上側が細胞外、図の下側が細胞内領域に 露出している。赤、青、シアンで示されているのは単量体の Ctr 分子であり、3 つの 単量体が複合体を形成して三量体を形成している。ペプチド主鎖がα ヘリックスを 形成している部分は膜貫通ドメインである。一部のアミノ酸残基は充填モデルを用 いて示されており、緑色が炭素原子、黄色が硫黄原子、青が窒素原子である。細胞 外にはメチオニン残基がよく保存されており、分子間で集合して細孔を形成してい る。同様に、細胞内にはヒスチジン残基がよく保存されている。Reprinted by permission
from Springer Nature: Springer-Verlag Cell Biochemistry and Biophysics [46], Springer Science Business Media, LLC (2012)
9
この Cys/Trp モチーフについて、第 3 章では Cu(II)と、第 4 章では Cu(I)との相互作用を 主に蛍光、ラマンを用いて検討した。また、細胞外ドメインである N 末端領域は、細胞膜 と相互作用する可能性がある。第 5 章では、この細胞膜との相互作用について、モデル膜 としてリポソームを用い、金属結合モチーフのモデルペプチドとリポソームを混在した条 件で分光測定を行い、検討した。これらの構造解析で得られた結果をもとに、第 6 章では 銅イオン応答性を有する新規機能性分子を設計し、合成した結果について考察を行ってい る。
10
2. 実験
2. 1. Cys/Trp モチーフモデルペプチドの合成と精製
2. 1. 1. Fmoc 固相合成法によるペプチドの合成
ペ プ チ ド 合 成 機 (Applied Biosystems, Model 431A) を 用 い て 、 Fmoc (9-Fluorenylmethoxycarbonyl) 固相合成法により、分裂酵母 (Schizosaccharomyces pombe) の Ctr4 と Ctr5 の Cys/Trp モチーフに対応する下記のペプチドを得た。Ctr4 の 113 残基目から 136 残基目に対応するペプチドを Ctr4(113-136)、Ctr5 の 22 残基目から 45 残基目に対応す るペプチドを Ctr5(22-45)とする。下線部は、ペプチドを水溶化するために配列を改変した 残基である。 Ctr4(113-136) Ac-KKDSSCKLSMYWNWYTIDACFKKK-COOH Ctr5(22-45) Ac-KKDATCRMSMLWNWYIHDSCFKKK-COOH 合成に用いた試薬は以下の通りである。 (1) Fmoc アミノ酸 各 1 mmol (渡辺化学工業) (2) 樹脂
Fmoc-Lys(Boc)-Wang resin (200–400 mesh) 0.25 mmol (BACHEM) (3) 反応試薬 (Applied Biosystems)
アミノ酸の活性化
2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate (HBTU) 1-hydroxybenzotriazol (HOBt)
N,N-dimethylformamide (DMF) N,N-diisopropylethylamine (DIEA)
脱保護 Piperidine
11 N 末端アセチル化 無水酢酸 DIEA (4) 溶媒 N-methylpyrrolidone (NMP) dichloromethane (DCM)
まず、Fmoc-Lys(Boc)-Wang resin を piperidine で脱保護し、NMP で洗浄を行った。HBTU、 HOBt、DIEA により活性化された次のアミノ酸を樹脂に導入して、縮合反応を行った。再 び NMP で洗浄した後、piperidine を用いて導入されたアミノ酸の Fmoc 基を脱保護した。 上記の手順を繰り返すことで、アミノ酸を C 末端から順番に導入し、ペプチドを合成した。 反応の最後に、無水酢酸と DIEA 用いて N 末端に露出したアミノ基をアセチル化した。一 連の合成において、溶媒としては NMP を用いた。 2. 1. 2. ペプチドの切り離しと脱保護 50 ml ナス型フラスコ内で、以下の脱離反応液を氷上で調製した後、2. 1. 1. で合成した ペプチド付樹脂を加えて室温で 100 分撹拌した。 脱離反応液 Phenol 0.375 g Ethanedithiol 0.125 ml Thioanisole 0.25 ml 脱イオン水 0.25 ml
Trifluoroacetic acid (TFA) 5 ml
グラスフィルターを用いて反応液を減圧濾過し、樹脂を取り除いた。得られた濾液を、 t-butyl methy ether (t-BME) が入った 2 本の遠心チューブに氷冷しながら少量ずつ滴下する
12 と、樹脂から切り離され、側鎖の脱保護を受けたペプチドが白色の沈殿として得られた。 t-BME 懸濁液を 2300 g で 15 分遠心し、上清を除去した。沈殿を t-BME で懸濁し、同様に 遠心して上清を除去する操作をさらに 2 回行い、真空ラインで沈殿を乾燥させた。 上記の脱離反応液を再び作製し、乾燥させたペプチドの沈殿を加え、室温で 120 分撹拌 した後、反応液を氷冷した t-BME に少量ずつ滴下した。1 回目と同様に、遠心して上清を 除く操作を 3 回行った後、沈殿を真空ラインで乾燥させた。乾燥後、4–6 ml の脱イオン水 で沈殿を溶解させ、0.5 ml ずつ 1.5 ml チューブに分注し、再び凍結乾燥をして保存した。 2. 1. 3. HPLC による精製 2. 1. 2.で脱保護したペプチドは、逆相 HPLC によって精製した。 ペプチド粉末を 900 µl のイオン交換水で溶解させ、NaOH 水溶液を用いて pH 7–8 付近に 調整した。Dithiothreitol 0.006 g をペプチド水溶液に添加して 40℃で 1 時間加熱することで、 S-S 結合の還元処理を行った。反応が終わった溶液は TFA 水溶液を用いて pH を 2.6 付近に 調整した後、100 µl の CH3CN を添加して、溶媒を移動相の初期の組成に合わせた。 逆相カラムを用い、表 2-1 のグラジエントでペプチドを溶出させ、メインピークを分離 し、凍結乾燥させた。 得られたペプチド粉末は、0.1 %の塩酸に溶解させて凍結乾燥し、TFA 塩から塩酸塩へ置 換した後、イオン交換水に溶解させて凍結乾燥し、過剰な HCl を除いた。 精製して得られたペプチドが目的のものであること、Cys が還元型であることは、質量 分析で確認した。 HPLC 装置: 日本分光、1580-PU ポンプ、970 検出器
カラム: Nacalai Tesque、Cosmosil 5C18AR300 (サイズ 10×250 mm) 流速: 2.0 mL/min
13 表 2-1 移動相のグラジエント 時間 (min) 0 15 35 50 A 液 (%) 80 20 20 80 B 液 (%) 20 80 80 20 2. 1. 4. 定量 それぞれのペプチドに含まれる Trp 残基と Tyr 残基、および S-S 結合の数をもとに以下 の式 2-1[54,55]から 280 nm におけるモル吸光係数を算出し、Lambert-Beer の法則から濃度 を決定した。ただし式 2-1 において、(#Trp)、(#Tyr)、(#S-S)はそれぞれ、Trp 残基数、Tyr 残基数、形成されている S-S 結合の数とする。 ε280 = 5500 × (#Trp) + 1490 × (#Tyr) + 125 × (#S − S) (2-1) Ctr4(113-136)の場合 ε280 = 5500 × 2 + 1490 × 2 + 125 × 0 = 13980 Ctr5(22-45)および Ctr3(11-34)の場合 ε280 = 5500 × 2 + 1490 × 1 + 125 × 0 = 12490 定量を行ったペプチド水溶液は、ペプチドが 0.5 µmol または 0.05 µmol ずつになるよう に分注し、凍結乾燥処理をしたのち保存した。 2. 1. 5. 還元型 SH 基の定量 (1) 50 mM リン酸 buffer (pH 7.4) を調製した。
(2) 10 mM DTNB (5,5’-Dithiobis (2-nitrobenzoic acid)) / 50 mM リン酸 buffer を調製した。 (3) 0.05 µmol のペプチドを 1 ml のリン酸 buffer に溶解させた。
(4) (3)の溶液を 4 倍希釈した (ペプチド 12.5 µM、SH 基 25 µM)。
14 30 分静置した。 (6) 300–550 nm の範囲で吸収スペクトルを測定した。 (7) 10 mM DTNB / 50 mM リン酸 buffer の吸収スペクトルを 300–550 nm の範囲で測定した。 (8) (6) で得られたスペクトルから、(7) で測定した DTNB のみのスペクトルを、未反応の DTNB のバンドが消えるように差し引き、差スペクトルを得た。 測定条件 (Jasco, U3300) 測定波長: 300–550 nm 走査速度: 120 nm/min スリット幅: 2 nm セル長: 1 cm DTNB は、SH 基と式 2-2 のような反応をし、410 nm に吸収極大を持つ化合物 TNB を生 成する[56,57]。その吸光度により、溶液中の SH 基の濃度を定量できる。過剰量の DTNB を添加したサンプル溶液のスペクトルを得た後、そのスペクトルから DTNB のみで測定し たスペクトルを差し引き、得られた差スペクトルの吸光度を用いて還元型 SH 基の定量を 行い、SH 基の還元率が 100±2 %であることを確認してから全ての実験を行った。モル吸光 係数としてはε412 = 14150 の値を用いた[57]。 2RSH + DTNB → RS − SR + 2TNB (2-2)
15
2. 2. 銅添加前後の Cys/Trp モチーフの蛍光スペクトル測定
2. 2. 1. Cu(II)を添加した Cys/Trp モチーフの SCu(I)由来の蛍光の検出
(1) 0.5 mM CuCl2水溶液を調製した。 (2) 0.05 µmol のペプチド粉末を 1000 µl のイオン交換水に溶解させた。NaOH 水溶液で pH 5.0 に調整し、Cu 0 eq.のサンプルとした。 (3) 0.05 µmol のペプチド粉末を 900 µl のイオン交換水に溶解させ、100 µl の CuCl2水溶液 を添加した (終濃度: ペプチド 0.05 mM、Cu 0.05 mM)。NaOH 水溶液で pH 5.0 に調整し、 Cu 1 eq.のサンプルとした。 (4) 3 mm×3 mm のミクロセル用い、蛍光スペクトルおよび蛍光励起スペクトルを測定した。 蛍光スペクトル測定条件 (Jasco, FP-6500) 励起波長: 305 nm 測定波長: 400–600 nm 励起バンド幅: 3 nm 蛍光バンド幅: 3 nm 感度: High 走査速度: 500 nm/min 蛍光励起スペクトル測定条件 (Jasco, FP-6500) 蛍光波長: 550 nm 測定波長: 220–400 nm 励起バンド幅: 3 nm 蛍光バンド幅: 3 nm 感度: High 走査速度: 500 nm/min 2. 2. 2. Cys/Trp モチーフへの Cu(I)の滴定 (1) 溶媒として CH3CN を用いて 8 mM [Cu(CH3CN)4]PF6ストック溶液を調製した。
(2) 0.5 µmol のペプチド粉末を 1000 µl の MES buffer (50 mM, pH 5.0) に溶解させ、500 µM ペプチド溶液とした。
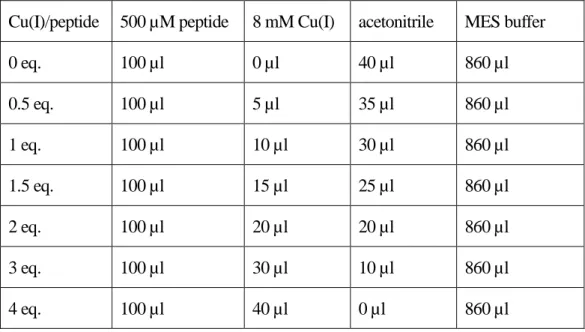
(3) 500 µM ペプチド溶液、8 mM Cu(I)ストック、CH3CN、MES buffer (50 mM, pH 5.0) を表
2-2 の組成で混合し、Cu(I)添加量が 0–4 当量のサンプルとした。ペプチドの終濃度は 50 µM、 Cu(I)の終濃度は 0–200 µM、CH3CN の終濃度は 4 v/v %である。
(4) 3 mm×3 mm のミクロセル用い、以下の測定条件で蛍光スペクトルを測定した。 測定条件 (Jasco, FP-6500)
16
励起波長: 295 nm 測定波長: 300–580 nm 励起バンド幅: 3 nm 蛍光バンド幅: 3 nm 感度: Medium 走査速度: 500 nm/min 表 2-2 Cu(I)滴定実験におけるサンプルの組成
Cu(I)/peptide 500 µM peptide 8 mM Cu(I) acetonitrile MES buffer 0 eq. 100 µl 0 µl 40 µl 860 µl 0.5 eq. 100 µl 5 µl 35 µl 860 µl 1 eq. 100 µl 10 µl 30 µl 860 µl 1.5 eq. 100 µl 15 µl 25 µl 860 µl 2 eq. 100 µl 20 µl 20 µl 860 µl 3 eq. 100 µl 30 µl 10 µl 860 µl 4 eq. 100 µl 40 µl 0 µl 860 µl
2. 3. 銅前後の Cys/Trp モチーフの非共鳴ラマンスペクトル測定
2. 3. 1. Cu(II)を添加した Cys/Trp モチーフの 488 nm 励起ラマンスペクトル測定 (1) 50 mM CuCl2水溶液を調製した。 (2) 0.5 µmol の Ctr4(113-136)の粉末を 100 µl のイオン交換水で溶解させ、2M NaOH で pH を 5.0 に調整したものを、Cu 0 eq.のサンプルとした。 (3) 0.5 µmol の Ctr4(113-136)の粉末を 90 µl のイオン交換水で溶解させ、50 mM CuCl2を 10 µl混合した。これを 2M NaOH で pH を 5.0 に調整し、Cu 1 eq.のサンプルとした。 (4) (3)のサンプルを 24 時間放置したものを、Cu 1eq. (24 h) のサンプルとした。 (5) キャピラリー管に溶液試料を入れ、各サンプルのラマンスペクトルを測定した。
測定条件 (Jasco, NRS-3100AR)
励起波長: 488.0 nm、露光・積算時間: 60 分、減光器: オープン、 対物レンズ: UMPLEF20×、スリット: 0.2×6 mm
17 2. 3. 2. Cu(I)を添加した Cys/Trp モチーフの 488 nm 励起ラマンスペクトル測定 (1) 溶媒として CH3CN を用いて 8 mM [Cu(CH3CN)4]PF6ストック溶液を調製した。 (2) 0.5 µmol のモデルペプチドを 250 µl の H2O または D2O に溶解させ、2M NaOH または 2M NaOD で pH を 5.0 に調整したものを、Cu なしのサンプルとした。 (3) 0.5 µmol のモデルペプチドを 250 µl のイオン交換水に溶解させ、8 mM [Cu(CH3CN)4]PF6 ストック溶液を 125 µl 添加した。2M NaOH で pH を 5.0 に調整したのち、凍結乾燥して溶 媒の CH3CN を除いたのち、250 µl の H2O または D2O で溶解させ、Cu ありのサンプルとし た。 (4) 各サンプルのラマンスペクトルを測定した。得られたラマンスペクトルは、H2O また は D2O のラマンバンドを強度標準としてバックグラウンドのスペクトルを引き、解析した。 測定条件 (Jasco, NRS-3100AR) 励起波長: 488.0 nm、露光・積算時間: 60 min、減光器: オープン、 対物レンズ: UMPLEF20×、スリット: 0.2×6 mm
2. 4. 質量分析スペクトル
(1) 5 mM CuCl2水溶液を調製した。 (2) 0.25 µmol のペプチド Ctr4(113-136)を 950 µl のイオン交換水で溶解させた。 (3) 50 µl の 5 mM CuCl2水溶液をペプチド溶液に添加した。終濃度は、ペプチド・銅共に 0.25 mM である。 (4) NaOH 水溶液を用いて pH 5.0 に調整した。 (5) (4)の溶液を 500 µl ずつ 2 つに分注した。一方は N2 purge した後凍結乾燥処理を行った。 (6) 質量分析スペクトルは、東北大学大学院理学研究科付属巨大分子解析研究センターに 依頼測定を行った。凍結乾燥処理した粉末を、H2O:CH3CN=1:1 の溶媒で溶解させ、エレク トロスプレーイオン化質量分析を行った。銅添加直後 (1 eq.) および銅添加 30 時間後のサ18 ンプルを測定する際には、酢酸を添加している。
2. 5. BCA (ビシンコニン酸) を用いた Cu(II)の還元量の測定
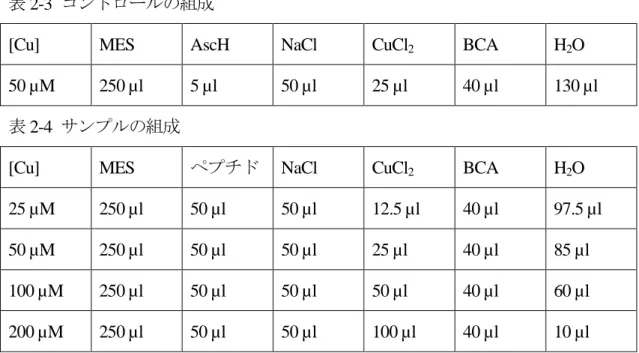
(1) 50 mM MES buffer (pH 5.0)、1.5 M NaCl 水溶液、10 mM ビシンコニン酸水溶液、1 mM CuCl2水溶液、5 mM アスコルビン酸水溶液をそれぞれ調製した。 (2) 0.1 µmol のペプチド粉末を 200 µl のイオン交換水で溶解させ、0.5 mM ペプチド水溶液 を調製した。 (3) 表 2-3 および表 2-4 の組成で混合した。 (4) NaOH 水溶液で pH を 5.0 に調整し、吸収スペクトルを測定した。 測定条件 (Jasco, U3300) 測定波長: 400–800 nm 走査速度: 120 nm/min スリット幅: 2 nm セル長: 1 cm 表 2-3 コントロールの組成
[Cu] MES AscH NaCl CuCl2 BCA H2O
50 µM 250 µl 5 µl 50 µl 25 µl 40 µl 130 µl 表 2-4 サンプルの組成
[Cu] MES ペプチド NaCl CuCl2 BCA H2O
25 µM 250 µl 50 µl 50 µl 12.5 µl 40 µl 97.5 µl 50 µM 250 µl 50 µl 50 µl 25 µl 40 µl 85 µl 100 µM 250 µl 50 µl 50 µl 50 µl 40 µl 60 µl 200 µM 250 µl 50 µl 50 µl 100 µl 40 µl 10 µl
19
2. 6. 紫外吸収スペクトル測定によるトリプトファン側鎖環境の測定
(1) 10 mM CuCl2水溶液を調製した。 (2) 0.05 µmol のペプチド粉末をイオン交換水 500 µl で溶解させ 1 mM とし、Cu 非添加のサ ンプルとした。 (3) 0.05 µmol のペプチド粉末をイオン交換水 450 µl で溶解させ、10 mM CuCl2を 50 µl 添加 し、ペプチドと CuCl2の終濃度を共に 1 mM とした。 (4) NaOH 水溶液で、サンプルの pH を 5.0 に調整し、吸収スペクトルを測定した。 測定条件 (Jasco, U3300) 測定波長: 200–350 nm 走査速度: 120 nm/min スリット幅: 2 nm セル長: 1 mm2. 7. 紫外共鳴ラマンスペクトルの測定
(1) 1 mM CuCl2水溶液を調製した。 (2) 0.5 µmol の Ctr4(113-136)ペプチドをイオン交換水 2.5 ml で溶解させ 0.2 mM とし、Cu 非 添加のサンプルとした。 (3) 0.5 µmol の Ctr4(113-136)ペプチドをイオン交換水 2.0 ml で溶解させ、1 mM CuCl2水溶液 を 0.5 ml 添加し、ペプチドと CuCl2の終濃度を共に 0.2 mM とした。 (4) NaOH 水溶液でサンプルの pH を 5.0 に調整し、試料を回転しながら測定する回転セル を用いてラマンスペクトルを測定した。 測定条件 励起: 229 nm 分光器: TR-600UV 検出器: LN/CCD-1752 露光時間: 30 秒 測定回数: 2 回×10 レーザー強度: 1.7 mW20
2. 8. Ctr4(113-136)の CD スペクトル測定
(1) 溶媒として CH3CN を用いて 8 mM [Cu(CH3CN)4]PF6ストック溶液を調製した。
(2) 0.5 µmol のペプチド粉末を 1000 µl の MES buffer (50 mM, pH 5.0) に溶解させ、500 µM ペプチド溶液とした。
(3) 500 µM ペプチド溶液、8 mM Cu(I)、CH3CN、MES buffer (50 mM, pH 5.0) を表 2-5 の組
成で混合し、Cu(I)添加なしおよび Cu(I)添加ありのサンプルとした。ペプチドの終濃度は 50 µM、Cu(I)の終濃度は 0 または 100 µM、CH3CN の終濃度は 4 v/v %である。
(4) 以下の条件で CD スペクトルを測定した。 測定条件 (Jasco, J-820)
セル長: 1 mm 測定波長: 190–300 nm 積算回数: 8 回 スリット幅: 4 nm 感度: Standard (100 mdeg) 走査速度: 50 nm/min レスポンス: 4 sec
(3) 得られた CD スペクトルから、緩衝溶液のみのスペクトルまたはリポソームのみのス ペクトルを減算し、サンプルのスペクトルを得た。
表 2-5 CD スペクトル測定におけるサンプルの組成
Cu(I)/peptide 500 µM peptide 8 mM Cu(I) acetonitrile MES buffer Cu(I)なし 100 µl 0 µl 40 µl 860 µl Cu(I)あり 100 µl 20 µl 20 µl 860 µl
2. 9. Cys/Trp モチーフと Cu(I)との結合定数の算出
(1) 50 mM MES buffer (pH 5.0) を調製した。
(2) 5 mM BCA 水溶液、5 mM [Cu (CH3CN)4]PF6 / CH3CN 溶液をそれぞれ調製した。
(3) 0.5 µmol のペプチドを 1 ml の MES buffer で溶解させ、0.5 mM ペプチドとした。 (4) 表 2-6 の組成で混合した。
21 測定条件 (Jasco, U3300)
測定波長: 400–800 nm 走査速度: 120 nm/min スリット幅: 2 nm セル長: 1 cm
表 2-6 結合定数算出実験におけるサンプルの組成
Peptide 濃度 5 mM [Cu(CH3CN)4]PF6 5 mM BCA 0.5 mM peptide MES buffer
0 (µM) 10 µl 40 µl 0 µl 950 µl 5 10 µl 40 µl 10 µl 940 µl 10 10 µl 40 µl 20 µl 930 µl 25 10 µl 40 µl 50 µl 900 µl 50 10 µl 40 µl 100 µl 850 µl 100 10 µl 40 µl 200 µl 750 µl この実験で決定する結合定数は、ペプチドと Cu(I)の結合比を 1:2 と仮定した場合の見か けの結合定数 (K1K2)0.5である (式 2-3)。測定は N2雰囲気下で行った。
Cu(I)の結合定数の算出には、競合するリガンドとして BCA を用いた。BCA は Cu(I)と 2:1 で結合し、562 nm に吸収 (ε562= 7900) を示す (式 2-4)。銅の終濃度が 100 µM、BCA の 終濃度が 400 µM となるように pH 5.0 の MES buffer (50 mM) を用いてサンプル溶液を調製 した。この溶液に、ペプチドの終濃度が 2.5–25 µM となるようにペプチドのストック溶液 を添加し、ペプチドとの競合による BCA2-Cu(I)錯体の吸収の減少を測定した。この時の平 衡反応 (式 2-5)の平衡定数 K を求め、K と KBCAの値を用いてペプチドと Cu(I)の結合定数 を求めた (式 2-6)。
peptide + 2Cu(I) ⇄ peptide-Cu(I)2
𝐾1𝐾2 =[𝑝𝑒𝑝𝑡𝑖𝑑𝑒−𝐶𝑢(𝐼)2]
[𝑝𝑒𝑝𝑡𝑖𝑑𝑒][𝐶𝑢(𝐼)]2 (2-3)
22 𝐾𝐵𝐶𝐴= [𝐵𝐶𝐴2−𝐶𝑢(𝐼)]
[𝐵𝐶𝐴]2[𝐶𝑢(𝐼)] (2-4)
2BCA2-Cu(I) + peptide ⇄ peptide-Cu(I)2 + 4BCA
𝐾 =[𝑝𝑒𝑝𝑡𝑖𝑑𝑒−𝐶𝑢(𝐼)2][𝐵𝐶𝐴]4
[𝐵𝐶𝐴2−𝐶𝑢(𝐼)]2[𝑝𝑒𝑝𝑡𝑖𝑑𝑒] (2-5)
𝐾1𝐾2 = 𝐾 × 𝐾𝐵𝐶𝐴2 (2-6)
2. 10. リポソームストック溶液の調製
(1) 3.0 mg の POPC (1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine) (Avanti Pola lipids, Inc) を秤量した。 (2) 秤量した脂質を、クロロホルム:メタノール=1:1 の溶媒で溶解した。 (3) 溶解した脂質を、50 ml ナスフラスコの底面に置いた。 (4) ロータリーエバポレーターでナスフラスコを回転させながら溶媒を留去し、ナスフラ スコ底面に脂質薄膜を形成した。 (5) 形成した脂質薄膜を、20 Pa 以下で 2 時間以上 (一晩まで) 乾燥した。 (6) 乾燥した脂質薄膜に、2 ml の 50 mM MES pH 5.0 を滴下した。 (7) 40℃の湯浴で緩衝液を温め、その後ナスフラスコを 30 秒ほどボルテックスミキサーで 攪拌し、脂質薄膜をナスフラスコ内壁から剥がした。この操作は 7 回繰り返した。 (8) 加熱と攪拌によって得られた MLV (Multilamellar vesicle) を試験管に移し、超音波処理 を行うことで単層 (Unilamellar) のリポソームを形成した。超音波処理中、溶液の温度が極 端に上昇しないように、一定時間ごとに氷水に漬けて温度のコントロールを行った。 (9) 超音波処理後、2本のマイクロチューブに溶液を均等に入れ、8000 rcf で10 分間遠心し、 残存している MLV とプローブ由来の細かな金属片を除いた。
23
2. 11. リポソームの有無による Cys/Trp モチーフの蛍光スペクトルの変化
(1) 2 mM POPC リポソームのストック溶液を、2. 9.の手順に従って調製した。
(2) 0.05 µmol の Ctr4(113-136)を 1 ml の 50 mM MES buffer で溶解し、50 µM ペプチドのス トック溶液を調製した。
(3) 1.5 mg の[Cu(CH3CN)4]PF6を 2 ml の N2 purge した CH3CN で溶解し、2 mM Cu(I)ストッ
ク溶液を調製した。 (4) 表 2-7 の組成で溶液を混合し、「リポソームなし、Cu(I)なし」「リポソームなし、Cu(I) あり」「リポソームあり、Cu(I)なし」「リポソームなし、Cu(I)あり」のサンプルを調製した。 表 2-7 脂質膜存在下での蛍光スペクトル測定におけるサンプルの組成 2 mM POPC or buffer 50 µM peptide 2 mM Cu(I) or acetonitrile buffer 100 µl 40 µl 2 µl 158 µl (5) 3×3 mm のミクロセルを用い、以下の測定条件で蛍光スペクトルを測定した。 測定条件 (Jasco, FP-6500) 励起波長: 295 nm または 305 nm 測定波長: 305–580 nm または 315–580 nm 励起バンド幅: 5 nm 蛍光バンド幅: 5 nm 感度: Medium 走査速度: 500 nm/min (6) 得られた蛍光スペクトルから、緩衝液またはリポソーム溶液のスペクトルを差し引く ことによって、レイリー散乱を補正した。補正したスペクトルは、320–380 nm の範囲で 15 次の多項式でフィッティングし、得られたフィッティングカーブの 1 次微分が 0 になる 波長を蛍光ピーク波長とした。
2. 12. Stern-Volmer 消光実験
(1) 2 M のアクリルアミドストック溶液を調製した。 (2) 2 mM POPC リポソームのストック溶液を、2. 9. の手順で調製した。24
(3) 0.05 µmol の Ctr4(113-136)を 1 ml の 50 mM MES buffer で溶解し、50 µM ペプチドのス トック溶液を調製した。
(4) 1.5 mg の[Cu(CH3CN)4]PF6を 2 ml の N2 purge した CH3CN で溶解し、2 mM Cu(I)ストッ
ク溶液を調製した。
(5) 「リポソームなし、Cu(I)なし」「リポソームなし、Cu(I)あり」「リポソームあり、Cu(I) なし」「リポソームなし、Cu(I)あり」のそれぞれのサンプルについて表 2-8 の組成で混合し、 アクリルアミドの濃度を 0–0.2 M の範囲で変化させた。 表 2-8 Stern-Volmer 消光実験におけるサンプルの組成 acrylamide (M) 2 mM POPC or buffer 50 µM peptide 2 mM Cu(I) or acetonitrile buffer H2O 2 M acrylamide 0 100 µl 40 µl 2 µl 138 µl 20 µl 0 µl 0.04 100 µl 40 µl 2 µl 138 µl 16 µl 4 µl 0.08 100 µl 40 µl 2 µl 138 µl 12 µl 8 µl 0.12 100 µl 40 µl 2 µl 138 µl 8 µl 12 µl 0.16 100 µl 40 µl 2 µl 138 µl 4 µl 16 µl 0.2 100 µl 40 µl 2 µl 138 µl 0 µl 20 µl (6) 3×3 mm のミクロセルを用い、以下の測定条件で蛍光スペクトルを測定した。 測定条件 (Jasco, FP-6500) 励起波長: 295 nm 測定波長: 305–580 nm 励起バンド幅: 5 nm 蛍光バンド幅: 5 nm 感度: Medium 走査速度: 200 nm/min (7) 得られた蛍光スペクトルは、320〜380 nm の範囲で 15 次の多項式でフィッティングし、 ピーク強度を求めた。 (8) アクリルアミド濃度に対する F0 / F のプロット (Stern-Volmer プロット) を作成し、こ のプロットから Stern-Volmer 定数を得た。ここで、F 0および F はアクリルアミドの非存在 下および存在下における蛍光強度である。
25
2. 13. 蛍光寿命測定
(1) サンプル溶液は 2. 10.の (1) ~ (4) と同じ方法で調製した。 (2) 蛍光寿命は、時間相関単一光子計数法を用いて測定した。励起光源としてパルス LED (PicoQuant GmbH、10MHz、300nm、~500 ps) を使用した。分光器を用いて 350 nm の蛍光 を得、ディスクアノードマイクロチャネルプレート光電子増倍管 (Biomedical instruments, PSC-01) によって蛍光を検出した。時間軸は、異なる光路を有する 2 つのパルス間の差を 用いて校正した。 (3) 分光器の直前に偏光子を配置した。励起光の偏光方向に対してマジックアングル (54.7 度) の角度にすることによって、蛍光分子の配向に伴う蛍光減衰曲線の変化が生じないよ うにした。 (4) 得られた蛍光減衰曲線のうち、励起パルスの形状が無視できる 1–20 ns の範囲を、2 成 分の指数関数でフィッティングした。2. 14. 脂質膜存在下における CD スペクトル測定
(1) サンプル溶液は 2. 10.の (1) ~ (4) と同じ方法で調製した。 (2) 以下の条件で CD スペクトルを測定した。 測定条件 (Jasco, J-820) セル長: 1 mm 測定波長: 190–300 nm 積算回数: 8 回 スリット幅: 4 nm 感度: Standard (100 mdeg) 走査速度: 50 nm/min レスポンス: 4 sec(3) 得られた CD スペクトルから、緩衝溶液のみのスペクトルまたはリポソームのみのス ペクトルを減算し、サンプルのスペクトルを得た。
26
2. 15. ラマンスペクトル測定
(1) 2. 9. と同様の手順で 5 mM POPC リポソームのストック溶液を調製した。
(2) 0.5 µmol の Ctr4(113-136)を 50 µl の 50 mM MES buffer に溶解し、10 mM のペプチドス トック溶液を調製した。 (3) 14.9 mg の[Cu(CH3CN)4]PF6を 4 ml の N2 purge した CH3CN に溶解し、10 mM のペプチ ドストック溶液を調製した。 (4) 表 2-9 の組成で混合し、「リポソームあり、Cu(I)なし」「リポソームあり、Cu(I)あり」 のサンプル溶液を調製した。 表 2-9 脂質膜存在下でのラマンスペクトル測定におけるサンプルの組成 5 mM POPC 10 mM peptide 10 mM Cu(I) or acetonitrile
40 µl 5 µl 5 µl
(5) 各サンプルのラマンスペクトルを測定した。 測定条件 (Jasco, NRS-3100AR)
励起波長: 488.0 nm、露光・積算時間: 30 min、減光器: オープン、 対物レンズ: UMPLEF20×、スリット: 0.2×6 mm
27
3. Cys/Trp モチーフと Cu(II)との反応
3. 1. 序
生命の維持に必要不可欠な必須微量元素の一種である銅は、様々な輸送タンパク質によ って細胞内の濃度が厳密に制御されている[1-4]。それらの銅輸送タンパク質のうち、主に 細胞内への銅の取り込みを担っているのが Ctr (Copper transporter) と呼ばれる一群のタン パク質である。銅は、細胞外では主に二価の状態で存在するが、細胞内には一価の状態で 取り込まれる。Ctr タンパク質は、金属還元酵素と共発現して機能しており、金属還元酵 素が還元した銅を受け取って、細胞内に輸送しているとされている[39-43]。 Ctr タンパク質は、3 回膜貫通型のトポロジーを取っており、ホモまたはヘテロ三量体と して機能する[44,45]。Ctr タンパク質の膜貫通ドメインは α へリックス構造をとっており、 N 末端側は細胞外 (あるいは小胞体のルーメン側) に、C 末端側は細胞内に露出している [46]。Ctr タンパク質は、ATP の加水分解などのエネルギーを必要とせず、濃度勾配に従っ て銅を輸送するチャネルタンパク質であるが、輸送の詳細な機構は明らかになっていない [1,3,39-43]。現在、Ctr タンパク質に関する研究は、クライオ電子顕微鏡像をもとに計算で 得られた全原子モデル[46]に基づいて進められている。 Ctr タンパク質は、細胞外ドメイン、膜貫通ドメイン、細胞内ドメインにそれぞれ銅の 輸送に重要な金属結合モチーフを有している。N 末端側の細胞外ドメインには、Met 残基 と芳香族性残基 (特に His 残基) が豊富に存在しており、Cu(I)選択的な銅輸送に重要であ るとされている[33,49-53]。膜貫通ドメインにおいては、MxxxM モチーフ (x は任意のアミ ノ酸) が銅輸送活性に必須であり[51]、また C 末端細胞内ドメインのヒスチジン-システイ ン-ヒスチジンモチーフも重要な銅結合モチーフであることが示唆されている[58,59]。上述 のヒト Ctr1 の全原子モデル[46]によると、細胞外ドメインの Met 残基がスタッキングして Cu(I)が通過する細孔を形成し、細胞内のヒスチジン-システイン-ヒスチジンモチーフが取 り込まれた Cu(I)を受け取ると考えられている (図 1-1)。S 原子はソフトな配位子であるた め、Cu(II)よりも Cu(I)に対して高い選択性を有しており、メチオニンのチオエーテルが形28 成する細孔は、Cu(I)選択的なフィルターとして重要な機能を持つと考えられている。実際、 ソフトな金属イオンである Ag(I)は Ctr による Cu(I)輸送を競合的に阻害するが、二価の金 属イオンは競合しない[50,60]。 このように、Ctr タンパク質の細胞外ドメインは、Cu(I)の選択的な捕捉に重要な役割を 有している。細胞外ドメインに存在する Met 残基のうち、膜貫通領域から約 20 残基上流 の Met 残基は特によく保存されており、銅輸送活性に重要である[51,52]。発芽酵母 Ctr1 で は、この Met 残基 1 つの変異で銅輸送活性が大きく損なわれることが報告されている[51]。 分裂酵母 Ctr4 では、膜貫通領域から 22 残基上流の Met122 残基が存在すると、N 末端側細 胞外領域に存在する他の 5 つの金属結合モチーフが無くても銅輸送が可能である[52]。 この、膜貫通領域から約 20 残基上流の Met 残基の近傍に、特徴的な配列をもつ Ctr タン パク質がいくつか存在する。分裂酵母における Ctr4、Ctr5、また発芽酵母 Ctr3 がそれに該 当する。これらの Ctr タンパク質は、MxWNWY という、芳香族アミノ酸残基が集中した 嵩高い配列と、それを挟む 2 つの Cys 残基を有している (表 3-1)。BLAST を用いて、Ctr4 におけるこの特徴的な配列 CKLSMYWNWYTIDAC のホモロジー検索を行うと、多くの菌 類の、銅輸送タンパク質ではないかと推定されているタンパク質において同様の配列が保 存されていることが明らかになった (表 3-1)。そのため、このモチーフは銅輸送において 重要な機能を有するのではないかと推測し、Asp 残基を中心に、Trp 残基と Cys 残基が対 称な配列で存在するこのモチーフ CxxSMxWNWYxxDxC を、Cys/Trp モチーフと定義した。 ところで、近年、メタン資化性菌から分泌されるペプチドであるメタノバクチンが、Cu(II) を Cu(I)に還元する能力と、Cu(I)に対する結合能を共に有することが明らかになった[61]。 メタノバクチンは、メタン資化性菌に銅を取り込むために分泌されるペプチドである [62,63]。メタノバクチンはその配列中に Cys 残基を有し、β 炭素がオキサゾロン環の一部 を形成する際に Cys 残基の SH 基がチオアミド基に変化するが、銅イオンとはこのチオア ミド基を介して結合する[63]。高い銅結合能を持つメタノバクチンは、銅過剰症であるウ ィルソン病の新たな治療薬として期待されている[64]。
29 Cys/Trp モチーフも、メタノバクチンと同様に金属還元能と捕捉能を共に有する可能性が ある。分裂酵母において、金属還元酵素はいまだ発見されていないため、分裂酵母の Ctr4 と Ctr5 が、Cu(I)のみならず Cu(II)とも相互作用しているのではないかと考えた。この章で は、実際に Cys/Trp モチーフと Cu(II)がどのような反応を起こすのかを解析し、銅の恒常性 維持機構に関する新たな知見を得ることを目的としている。 表 3-1 BLAST による検索で得られた菌類の Ctr における Cys/Trp モチーフ
Ctr4 (Schizosaccharomyces pombe)
SSCKLSMYWNWYTIDACFITK
Ctr5 (Schizosaccharomyces pombe)ATCRMSMLWNWYIHDSCFLAK
Ctr3 (Saccharomyces cerevisiae)ATCKISMLWNWYTIDTCFIAR
Ctr3 (Aspergillus udagawae)SSCKISMLWNWYTIDACFLSS
Ctr Copper transporter (Metarhizium guizhouense)SSCKISMLWNWYTIDACFLTP
Ctr Copper transporter (Candida tenuis)PACKISMLWNWYTIDSCFIAK
Copper transporter (Colletotrichum gloeosporioides)ADCKMSMLWNWYTVDACFLAE
30
3. 2. 結果
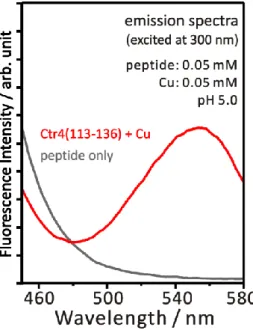
3. 2. 1. Cu(II)の添加による S-Cu(I)由来の蛍光の出現 ペプチド Ctr4(113-136)に対して、Cu(II)して CuCl2を添加し、300 nm を励起波長として 蛍光スペクトルを測定した結果を図 3-1 に示す。500 から 600 nm の領域には、多核構造を 有する S-Cu(I)錯体由来の蛍光が観測されることが、メタロチオネインや各種の低分子化合 物を用いた研究により知られている[11-18]。 図 3-1 において、Ctr4(113-136)に銅を添加していない場合は、300 nm に吸収を示す Trp 残基由来の蛍光の裾が短波長側に観測されるのみで、S-Cu(I)由来の蛍光は見られなかった。 一方、CuCl2を添加したサンプルでは、550 nm 付近にピークを有する蛍光バンドが観察さ れた。蛍光波長が、過去に報告されている S-Cu(I)結合由来の蛍光と一致することから、ペ プチドへの CuCl2の添加によって、S-Cu(I)結合が生成したことが示された。 二価の銅イオンを添加したにもかかわらず、Cu(I)由来の蛍光が観察されていることから、 添加した Cu(II)は、ペプチドによって Cu(I)に還元されたことがわかる。また、Cu(I)には同 時に S-Cu(I)結合が生成したと考えられる。 図3-1 Ctr4(113-136)にCuCl2を添加する前後の蛍光スペクト ル。ペプチドおよび銅イオンの終濃度は 0.05 mM。イオン 交換水で溶解したペプチドに CuCl2のストック溶液を添加 した後、NaOH 水溶液で pH を 5.0 に調整し、測定を行った。31
3. 2. 2. Cys/Trp モチーフにより還元された Cu(I)の定量
3. 2. 1. に示した蛍光スペクトルの結果より、Cys/Trp モチーフを含むペプチドに Cu(II) を添加すると、Cu(II)は Cu(I)に還元されることが明らかになった。この還元反応の化学量 論について、Cu(I)選択的な比色定量試薬であるビシンコニン酸 (Bicinchoninic acid, BCA) を用いて、BCA2-Cu(I)錯体の吸収強度から、生成した Cu(I)を定量することにより、Cys/Trp
モチーフによる Cu(II)の還元反応の化学量論について定量を行った。BCA2-Cu(I)錯体は 562 nm に 7900 M-1 cm-1の吸収を有する[65]。 ペプチドと BCA を含む水溶液に、ペプチドに対して 0.5 当量、1 当量、2 当量、4 当量 の CuCl2を添加した。得られた吸収スペクトルを図 3-2 に示す。銅の添加後 1 分以内に Cu(I) の生成は完了しており、その後少なくとも 30 分までの間は、Cu(I)の濃度に変化がないこ とを確認した。ペプチドに対して 4 当量 CuCl2を添加したサンプルの吸収スペクトルは、 ベースラインの上昇によって、吸光度から直接 Cu(I)の生成量を見積もることができなかっ たため、あらかじめ測定しておいた BCA2-Cu(I)錯体のコントロールのスペクトルを、サン プルのスペクトルの BCA2-Cu(I)錯体のバンドが消えるように引き、得られた差スペクトル をベースラインとした。元のスペクトルからベースラインのスペクトルを引き、ビシンコ ニン酸-Cu(I)錯体のバンド強度を求めた (図 3-3)。
吸光度から、生成した Cu(I)の濃度を算出すると、Cu(II) 0.5 eq.では 19 μM、1 eq.では 44 μM、 2 eq.では 88 μM、4 eq.では 87 μM であった。これをプロットすると、図 3-4 のようになる。 銅の添加量がペプチドに対して 0.5 当量から 2 当量の濃度範囲では、Cu(II)の添加量が増加 するにつれて、Cu(I)の生成量は線形的に増加していったが、4 当量では、2 当量の場合と 同量の Cu(I)しか生成しなかった。ペプチドは自身に対しておよそ 2 当量までの銅を還元で きると考えられる。 一般に、Cys 残基の SH 基は、チオレートアニオンからの一電子移動によって Cu(II)を Cu(I)に還元することが知られている。1 つの SH 基は、一原子の銅イオンを還元できるこ とから、ペプチドに対して二当量の銅を還元できることは、Cys 残基が銅の還元を担って
32 いることを示唆する。
なお、BCA によって定量された Cu(I)の濃度は、添加した Cu 濃度の 80–90%の Cu(I)まで しか検出できていない。これは、4. 2. 5.で述べるように、Cys/Trp モチーフと Cu(I)の結合 定数が非常に大きく、BCA と競合しているためであると考えられる。
図 3-2 50 mM MES buffer (pH 5.0)中で、50 µM の Ctr4(113-136)に 25, 50, 100, 200 µM の
CuCl2を反応させ、生成した Cu(I)を 800 µM の BCA で検出した。562 nm に観測されて
いるのが BCA2-Cu(I)錯体由来の吸収である[2L]。
図 3-3 図 3-2 で得られたスペクトルのベースライン処理の方法を示した。表 2-4 の組成のコ ントロールのスペクトルを Cu 4 eq.のスペクトルから差し引き、点線で示したベースライン
を得た。Cu 4 eq.のスペクトルから、得られたベースラインを引くことで BCA2-Cu(I)錯体の
33
3. 2. 3. 銅添加による S-S 結合の形成
3. 2. 2.に示した Cu(I)生成量の定量実験から、1 分子の Cys/Trp モチーフは 2 原子の Cu(II) を Cu(I)へ還元することが示された。 ペプチドによる Cu(II)から Cu(I)への還元機構として、Cys 残基の S-S 結合形成と共役す る機構を仮定し、ラマンスペクトルを測定した。 Ctr4(113-136)に対して 1 当量の CuCl2を添加する前後のラマンスペクトルを図 3-5A,B に 示す。図 3-5 A のスペクトルは、2932 cm–1の CH 伸縮振動バンドの面積強度で規格化して いる。また図 3-5 B のスペクトルは、756 cm–1のトリプトファンの W18 バンドの面積強度 で規格化している。図 3-5A より、銅の添加によってペプチドの SH 伸縮振動強度が著しく 低下しており、添加した Cu(II)と SH 基が反応したことがわかる。また、図 3-5 B より、Cu 0 eq.では観測されなかった S-S 伸縮振動バンドが、銅の添加によって出現しており、Cu(II) の添加によって S-S 結合が生成していると考えられる。 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 Cu (I) 濃度 / µ M Cu/peptide 図 3-4 BCA2-Cu(I)錯体の 562 nm におけるモル吸光係数を 7900 M -1 cm-1として、得られた 吸光度から算出した Cu(I)濃度を、Ctr4(113-136)に対する Cu(II)添加量のモル比に対して プロットした。
34
Cys/Trp 中に存在する Cys 残基の数は 2 残基であり、また 1 mol の S-S 結合が生成する際 に 2 mol の Cu(II)が還元される。この実験で Ctr(113-136)に添加した CuCl2はペプチドに対
して 1 当量であるため、Cu(II)の還元によって消費され、S-S 結合を形成する SH 基は全体 の 50%であると考えられる。しかし、図 3-5 A において SH 伸縮振動バンドはほとんど残 っていない。また3. 1.の蛍光スペクトルでS-Cu(I)結合由来の蛍光が観測されたことから、 還元に関与しなかった残りの SH 基はすべて Cu(I)に配位していると考えられる。 また、Cu(II)の添加後、24 時間が経過したサンプルについてラマンスペクトルを測定す ると、S-S 伸縮振動バンド強度が増大した。この結果については、Cu(I)に配位している Cys 残基も、サンプル溶液中の溶存酸素によって徐々に酸化され、S-S 結合が生成したと 考察した。S-S 伸縮振動バンド強度の定量を試みたが、バンド強度があまり強くないこと、 他のラマンバンドのオーバーラップがあることから精確な定量を行うことはできなかっ た。 図 3-5 イオン交換水中で測定した、5 mM の Ctr4(113-136)に 5 mM の CuCl2を反応させ る前(黒)、反応させた直後(赤)、反応させてから 24 時間経過後(青)のサンプルのラマンス ペクトル。A が高波数領域、B が低波数側の指紋領域を測定したもの。いずれのスペク トルもキャピラリー中で測定し、露光時間と積算回数の積は 60 分とした[1L]。
35 3. 2. 4. 質量分析 銅の還元と同時に形成された S-S 結合が、分子内であるか分子間であるかを確認するた めに、Ctr4(113-136)に対して 1 当量の CuCl2を添加し、質量分析に付した (図 3-6)。図 3-6 (a) において m/z 503.25、603.69、754.37、1005.5 に観察されたピークは、全てモノアイソトピ ック質量が 3012.5 の化学種の、6 価、5 価、4 価、3 価のピークである。代表して m/z 603.69 のピークを拡大した図を図 3-6 (b) に示す。同位体ピークの分裂幅が 0.2 であるため、この ピークは 5 価のイオンである。Ctr4(113-136)のモノアイソトピック質量は 3014.5 であるた め、分子量 3012.5 は、Ctr4(113-136)が分子間ではなく分子内で S-S 結合を形成した場合の 分子量と一致する。銅の還元に伴って形成される S-S 結合は、分子内 S-S 結合であること が示された。 また、m/z 628.87、785.83 のピークは、ともにモノアイソトピック質量が 3138.3 の化学 種の 5 価、4 価のピークであった。代表して、m/z 785.83 のピークを拡大した図を図 3-6 (c) に示す。同位体ピークの分裂幅が 0.25 であるため、このピークは 4 価のイオンである。分 子量 3138.3 は、Ctr4(113-136)の 2 つの SH 基が脱プロトン化し、Cu(I)イオンが 2 原子付加 した化学種の分子量と一致する。 得られた質量分析スペクトルに、分子内で S-S 結合を形成したペプチドのピークと、ペ プチドに銅が付加した化学種のピークが同時に存在している。ペプチドに Cu(II)を添加す ると、一部のペプチドが銅を還元して分子内 S-S 結合を形成し、銅の還元に関わらなかっ た残りのペプチドが銅を捕捉すると考えられる。ペプチドに対して、主に 2 原子の銅が結 合していることから、0.5 当量のペプチドが 1 当量の Cu(II)を Cu(I)に還元し、残り 0.5 当量 のペプチドが、生成した 1 当量の Cu(I)を捕捉していると考えられる (3014.5-2×1.0078+ 2×62.929=3138.3)。 また、m/z 862.13 のような分子間 S-S 結合形成種のピークも分子間 S-S 結合形成種も若干 存在する (図 3-6 (d)) が、分子内 S-S 結合形成種のピークと比較して強度が小さいことか ら、これは副反応であると考えられる。
36 図 3-6 Ctr4(113-136)に対し 1 当量の CuCl2を添加したサンプルの質量分析スペクトル。(a) 観測されたすべてのピークを含む領域を示す。(b) m/z=603.69 周囲を拡大した図。(c) m/z=785.83 周囲を拡大した図。(d) m/z=862.13 周囲を拡大した図[2L]。 (a) (b) (c) (d)
37 3. 2. 5. 分子内 S-S 結合を形成した分子種の分離・定量 3. 2. 2.で得られた化学量論から、ペプチドに対して 1 当量の Cu(II)を添加すると、0.5 当 量のペプチドが 1 当量の Cu(II)を Cu(I)に還元し、残り 0.5 当量のペプチドが、生成した 1 当量の Cu(I)を捕捉していると考えられるという仮説を立てた (3. 2. 4.)。この仮説を検証す るため、HPLC による分離分析を行った。 Ctr4(113-136)に 1 当量の Cu(II)を添加し、添加直後 (0 時間後)、15 時間後、30 時間後に ついてクロマトグラフィーによる分離分析を行った結果を図 3-7 に示す。図 3-7 (a) は、下 から順番に、銅添加無し、銅添加 (1 当量) 直後、銅添加 15 時間後、銅添加 30 時間後のク ロマトグラムを示している。検出器は紫外-可視吸光度計であり、検出波長を 280 nm とす ることでペプチドの定量を行なった。 銅添加無しのクロマトグラムは、ほぼ 1 本のピークのみを示した。このピークは、すべ ての Cys 残基が還元型のペプチドのピークに対応する。銅添加直後には、還元型のペプチ ドが約半分に減少し、21.5 分に新たなピークが出現した。このピークが、S-S 結合が酸化 されたペプチドのピークであると考えられる。15 時間後には還元型ペプチドのピークはさ らに減少し、酸化型ペプチドのピークが増加した。30 時間後には還元型ペプチドのピーク はほぼ完全に消失した。15 時間後、30 時間後で観測された変化は、3. 2. 3.で述べた溶存酸 素による S-Cu(I)を形成したチオレートアニオンの酸化によるものであると考えらえる。銅 添加 30 時間後のサンプルを質量分析に付し、溶出時間 21.5 分のサンプルが分子内 S-S 結 合を形成した化学種であることを確認している (data not shown)。
銅添加直後のクロマトグラムについて、ピークを Voigt 関数でフィッティングし、面積 強度からそれぞれの化学種の定量を行った結果を図 3-7 (b) に示す。定量の結果、S-S 結合 を形成したペプチドは全体の 53.8%であると算出された。ペプチドに対して 1 当量の Cu(II) を添加すると、0.5 当量のペプチドが 1 当量の Cu(II)を Cu(I)に還元し、分子内 S-S 結合を 形成することが確かめられた。 また、得られたクロマトグラムには、銅の添加後、より短い溶出時間 (19.5 分から 20.5
38 分) に微弱なピークが観測された。このピークは、銅との反応により酸化したペプチドの ピークであると考えられる。また、合成した Cys/Trp モチーフは Cys 残基の近傍に塩基性 アミノ酸残基が存在するため、システインプロテアーゼ様のプロテアーゼ活性を有してい る可能性がある。観測された微弱なピークは長時間の反応によって自己消化したペプチド 鎖であることも考えられる。 図 3-7 (a) Ctr4(113-136)に対し 1 当量の CuCl2を添加したサンプルのクロマトグラム。逆 相カラムを用い、水-アセニトリル系で分離を行った。(b) 銅添加直後(0 h)のクロマトグ ラムについて、Voigt 関数を用いてフィッティングを行い、面積強度を求めた結果。 (a) (b)
39
3. 3. 考察
Cys/Trp モチーフに 1 当量の Cu(II)を添加すると、速やかに Cu(I)が生成したことが、蛍 光スペクトル測定 (3. 2. 1.) により示された。また、比色定量試薬であるビシンコニン酸を 用いた Cu(I)の定量 (3. 2. 2.) から、Cys/Trp モチーフに 1 分子対して 2 原子までの銅が還元 されることが示された。Cys 残基の SH 基は一電子移動によって銅を還元することが知ら れている (式 3-1)。
2RSH + 2Cu(II) → 2RS・ + 2Cu(I) → RSSR + 2Cu(I) (3-1) Cys/Trp モチーフ中には Cys 残基が 2 残基存在する。したがって、モチーフ 1 分子あた り 2 原子の銅イオンを還元するという化学量論は、Cys 残基による還元機構を示唆する結 果である。したがって、Cys/Trp モチーフによる銅の還元は、Cys 残基によって行われたと 考えられる。一電子移動による銅の還元では、チオレートラジカルが生成する。非共鳴ラ マンスペクトルによって検出された S-S 結合は、2 つのチオレートラジカルが結合して生 成したものだと考察される。 結果 3. 2. 1.で測定した蛍光スペクトルから、Cys/Trp モチーフに 1 当量の Cu(II)を添加す ると、S-Cu(I)結合が生成することが示された。したがって、Cys/Trp モチーフは Cys 残基 のチオレートを介して Cu(I)を捕捉すると考えられる。また、結果 3. 2. 4. の質量分析スペ クトルから、Cys/Trp モチーフ 1 分子には 2 原子の銅が結合することが示された。一方、 S-S 結合を形成したペプチドの定量 (3. 2. 5.) より、銅の添加直後におよそ半分のペプチド が分子内ジスルフィドを形成した。式 3-1 より、S-S 結合が 1 つ形成される際に、2 原子の 銅が還元される。したがって、1 当量のペプチドに 1 当量の Cu(II)を添加すると、0.5 当量 のペプチドが Cu(II)を Cu(I)に還元し、残り 0.5 当量のペプチドが、S-Cu(I)結合を介して還 元された銅を捕捉していると考えられる (図 3-8)。
このように、Ctr タンパク質中に新たに発見した Cys/Trp モチーフは、Cu(II)の還元能と Cu(I)の結合能を同時に持つことが示された。この結果から、Ctr タンパク質の銅輸送機構 について次のように考察できる。
40
従来、Ctr タンパク質は、金属還元酵素と共発現して機能しており、金属還元酵素が還 元した銅を受け取って、細胞内に輸送するとされていた。実際、哺乳類の Ctr と共発現し て機能する金属還元酵素として Fre1, Fre2, Steap protein などが同定されている[40,42]。しか し、Ctr4 が発現している分裂酵母 Schizosaccaromyces pombe では、そのような金属還元酵 素はいまだ発見されていない。Cys/Trp モチーフが Cu(II)の還元能を持つという結果から、 Ctr4 が自ら Cu(II)を Cu(I)に還元し、輸送すると考えられる (図 3-9)。 この機構には、銅の還元によって酸化された S-S 結合が再び還元されないと Ctr が銅を 輸送できないという問題点がある。酸化された S-S 結合を還元する機構として、Ctr4 と Ctr5 が形成する Ctr 三量体 (Ctr4,Ctr5 複合体) の細胞内への取り込みが考えられる。Ctr4,Ctr5 複合体は、過剰な銅の輸送を防ぐための防御機構の一種として、細胞内の銅の濃度が上昇 すると、細胞膜中から細胞内へ取り込まれるという報告がある[66]。Ctr4,Ctr5 複合体が細 胞内に取り込まれることによって、Cys/Trp モチーフは多数のグルタチオン分子にさらされ ることになる。上述の問題点を解消する仮説の一つとして細胞内に存在する多数のグルタ チオン分子が、Cys/Trp モチーフで形成された S-S 結合を還元することが考えられる。
図 3-8 Cys/Trp モチーフと Cu(II)の反応スキーム。全体の半分の Cys/Trp モチーフ分子が、 1 分子あたり 2 原子の Cu(II)を還元する。残りの半分の Cys/Trp モチーフが、還元によっ て生成した Cu(I)を 1 分子あたり 2 原子捕捉する[2L]。
41
Cys/Trp モチーフの構造解析に必要な一連の分光測定は全て酸性側の pH を選択して行っ た。これは酵母の生理的 pH が酸性側に存在するためである。pH を 5.0 にしたのは、金属 イオンとの相互作用が少ない Good’s buffer のうち、もっとも酸性側で緩衝能を示す MES buffer を用いて実験を行ったためである。
pH 7.4 で Cys/Trp モチーフが Cu(I)を結合すると、速やかに S-S 結合が形成され、Cu(I) は二価にもどってしまい、S-Cu(I)結合は安定には保持されない。SH 基は OH 基と比較し て pKa が小さく、9-12 程度であり、また、S-S 結合の交換反応は中性付近 (pH 7-8) で容易
図 3-9 (a) Ctr タンパク質と金属還元酵素が協働する銅輸送機構。金属還元酵素とし て、発芽酵母では Fre1, Fre2 などが、哺乳類では Steap protein などが同定されている。 (b) Cys/Trp モチーフが Cu(II)の還元に関与する銅輸送機構。
(a)
42 に発生する。このようなチオレートアニオンの反応性の高さが中性付近での S-Cu(I)結合の 不安定性に寄与していると考えられる。 酵母などの菌類ではCys/Trp モチーフが保存されている一方で、哺乳類のCtrにはCys/Trp モチーフが存在しないのは、生理的 pH の違いによるものであると考えられる。生理的 pH が低い菌類では SH 基が安定に存在するため Cys/Trp モチーフが Cu(II)の還元能を発揮でき、 また Cu(I)を安定に結合できる。しかし、哺乳類では SH 基が安定に存在せず、S-S 結合形 成と共役した還元機構を利用できないため、Met 残基や His 残基中心の配位構造が選択さ れるようになり、銅を輸送するタンパク質とは別に金属を還元するタンパク質が必要にな ったと考えられる。

![図 3-2 50 mM MES buffer (pH 5.0)中で、50 µM の Ctr4(113-136)に 25, 50, 100, 200 µM の CuCl 2 を反応させ、生成した Cu(I)を 800 µM の BCA で検出した。 562 nm に観測されて いるのが BCA 2 -Cu(I)錯体由来の吸収である[2L]。](https://thumb-ap.123doks.com/thumbv2/123deta/5896251.1048818/34.892.114.717.140.572/図3µMµM反応生成µM検出観測いるCuI錯体由来吸収ある.webp)

![図 4-7 50 mM MES buffer (pH 5.0)中で、 50 µM の(a) Ctr4(113-136)および(b) Ctr5(22-45)に 0.1 mM の Ctr5(22-45)に対して 2 当量の[Cu(CH 3 CN) 4 ]PF 6 を添加する前後のサンプルについて、CD ス ペクトルを測定した。縦軸は α 炭素のモル濃度で規格化した[2L]。](https://thumb-ap.123doks.com/thumbv2/123deta/5896251.1048818/55.892.120.739.596.818/µMおよびに対し当量CuCHCNPF添加するサンプルについてペクトル.webp)
![図 4-8 50 mM MES buffer (pH 5.0)中で、400 µM の BCA と 100 µM の[Cu(CH 3 CN) 4 ]PF 6 が存在す る系に、 (a) Ctr4(113-136)および(b) Ctr5(22-45)を添加し、Cys/Trp モチーフモデルペプチドによ](https://thumb-ap.123doks.com/thumbv2/123deta/5896251.1048818/57.892.106.743.480.736/µMµMCuCHCNPF存在るおよび添加CysTrpモチーフモデルペプチド.webp)