治療法が明らかにされていない疾病が多くある。例え ば,老化により引き起こされる認知症やアルツハイマー 病は,脳の記憶学習中枢である海馬におけるニューロン もしくは神経ネットワークの変化に起因していることは 明らかであり,その治療法として性ホルモン補充療法が 有効であることが知られているが,それらのメカニズム はあまり解明されていない。さらに,他の器官と同様に, 脳における疾病の原因や状態は個々人で千差万別であ り,同じ疾病であっても同じ治療法が適用できるとは限 らない。 このような問題に鑑み,脳における疾病の個々人の原 因や状態を把握し,個々人に対する治療法やその効果を 明らかにするテーラーメイド医療に向けた基盤技術の確 立が望まれている。我々は,そのような基盤技術として, 1.はじめに 脳は多数の神経細胞(ニューロン)が相互に情報交換 できる神経ネットワークから構成されている極めて複雑 なシステムである。ニューロンの細胞体からは多くの突 起(樹状突起)と1 本の長い突起(軸索)が伸びており, これらの突起はさらに枝分かれしている。枝分かれした 軸索の末端は他のニューロンの細胞体や樹状突起と接 し,シナプスと呼ばれる結合部を形成する。ヒトの脳に は,このようなニューロンが約1 千億個もあり,1 個の ニューロンはシナプスを介して数千個の他のニューロン と結合している。軸索を伝搬したパルス状の電気信号 (活動電位)は化学物質(神経伝達物質)に変換され,多 数の他のニューロンに情報伝達される。 脳にはその複雑さゆえ,未だ発症メカニズムや有効な
Recently, non-invasive, real-time and multi-point measurement of neural activities has become possible by using a multi-electrode array (MEA). Another method for such a measurement is the fluorescent imaging technique using calcium indicator dyes. In this study, we constructed a measurement apparatus combining the MEA system and laser confocal calcium imaging which enables simultaneous measurement of electric signals and calcium signals. Because the brain function is based on complicated interactions among electric neural activities, intracellular calcium signals and intercellular communications by neurotransmitters, such an apparatus can be a powerful tool to elucidate the brain function. It can also lead to future personalized medicine technique for brain disease. To demonstrate the availability of the constructed apparatus, we first measured neural activities of acute mouse hippocampal slices using it. We next measured neural activities of human induced pluripotent stem (iPS) cell-derived neurons to examine its possibility of application for the future personalized medicine.
Keywords: multi-electrode array system, laser confocal calcium imaging, simultaneous measurement, iPS cell, personalized medicine
多点細胞外電位記録とレーザー共焦点カルシウムイメージングによる
神経活動の同時測定技術の確立
― 脳疾病のテーラーメイド医療に向けた基盤技術として―
Natsumi HABA
*, Yuta HAMAZAKI
**and Minoru SAITO
*,**(Accepted November 30, 2017)
* 日本大学大学院総合基礎科学研究科相関理化学専攻:
〒156-8550 東京都世田谷区桜上水3-25-40
** 日本大学文理学部生命科学科:
〒156-8550 東京都世田谷区桜上水3-25-40
* Graduate School of Integrated Basic Sciences, Nihon
University:3-25-40, Sakurajosui, Setagaya-ku, Tokyo, 156-8550, Japan
** Department of Biosciences, College of Humanities and Sciences, Nihon
University:3-25-40, Sakurajosui, Setagaya-ku, Tokyo, 156-8550, Japan
幅 菜摘
*・浜崎 雄太
**・斎藤 稔
*, **Simultaneous measurement technique of neural activities using multi-electrode
array system and laser confocal calcium imaging :
ライスを用いた実験で使用した以下に述べる溶液はすべ て同様に,常に95% O2/5% CO2ガスでバブリングしてお いた。次に,摘出した脳から海馬を取り出し,スライサー (DTK-1000,堂阪イーエム)を用いて海馬スライス (transverse,厚さ 350 μm)を作製した。スライス作製 はダメージを低減するためスクロース溶液(2.6 mM KCl,0.5 mM CaCl2,27 mM NaHCO3,7 mM MgSO4,1.5
mM NaH2PO4,0.1 mM アスコルビン酸,222 mM スク ロース,pH 7.4)中で行い7),チャンバの周りを氷冷し て代謝を低下させておいた。作製したスライスは30℃ のACSF中で60分間代謝回復した。代謝回復後,スライ スを4 mLのカルシウム感受性蛍光色素Cal-520/AM溶液 の中に移し,室温で30 分間染色した。Cal-520/AM 溶液 は 界 面 活 性 剤0.005% Cremophor EL,0.01% Pluronic F-127存在下で4 μMの濃度になるように調整した。染色 し た ス ラ イ ス は 多 電 極 ア レ イ(multi-electrode array; MEA)チップ上に置き,スライスおさえで動かないよ うに固定した。MEA チップはガラス基板に 50 μm×50 μm 角の白金黒電極が 150 μm 間隔で 8 × 8 に配列された もの(MED-P515A,アルファメッドサイエンティフィッ ク)(図1A)を用いた。 多点細胞外電位記録とレーザー共焦点カルシウムイメー ジングによって神経活動の同時測定を行うことができる 実験系を構築してきた。多点細胞外電位記録は多電極ア レイ基板により数10 ヵ所の細胞外電位を測定できる手 法である1-5)。レーザー共焦点カルシウムイメージング はレーザー共焦点顕微鏡を用い,カルシウム感受性蛍光 色素の蛍光変化によって単一細胞レベルの解像度を保ち ながら多数のニューロンにおける細胞内カルシウム流入 を同時に観察できる手法である6-8)。脳機能はシナプス からの神経伝達物質の放出や,それから引き起こされる 電気シグナル・カルシウムシグナルが複雑に相互作用し て発現するものであり,そのような各現象を同時測定で きる技術は脳疾病のテーラーメイド医療に向けた基盤技 術になり得るものと期待される。 本研究ではまず,多点細胞外電位記録とレーザー共焦 点カルシウムイメージングによって,マウスの海馬スラ イスにおける神経活動の同時測定を行い,構築した実験 系 の 有 用 性 を 確 か め た。 次 に, ヒ トiPS(induced pluripotent stem)細胞由来ニューロンの培養系を用い て,このような技術が将来的にヒトの脳疾病のテーラー メイド医療に適用できるかを検討した。 2.実験方法 2-1 薬 品 カ ル シ ウ ム 感 受 性 蛍 光 色 素Cal-520/AM は AAT-Bioquest製のものを用いた。その他の薬品は市販で最も 高純度のものを用いた。 2-2 実験動物 実験動物として用いたマウス(1 週齢雄 ddY マウス) は日本エスエルシーより購入した。購入後のマウスはス トレスがかからないように留意し,実験に使用するまで 滅菌した床敷を敷いたケージの中で,一定の室温(22 ∼ 23℃),湿度(50 ∼60%)のもとで飼育し,飼料および水 は自由摂取させた。動物を用いたすべての実験は日本大 学動物実験運営内規に基づき,日本大学動物実験委員会 の承認を得て行われた(承認番号:AP16HS001)。 2-3 マウス海馬スライスの作製 マウスを頸椎脱臼法により安楽死させた後,すばやく脳 を摘出し,氷冷した人工脳脊髄液(artificial cerebrospinal fluid; ACSF)(124 mM NaCl,5 mM KCl,2 mM CaCl2,22
mM NaHCO3,2 mM MgSO4,1.24 mM NaH2PO4,10 mM
グルコース,pH 7.4)の中に入れた。ACSF は常に 95% O2/5% CO2ガスでバブリングしておいた。また,海馬ス
白金黒
電極
ウェル
A
B
100 m図1
図 1 (A)MEAチップの電極部分,(B)MEAチップの全体像2-5 多点細胞外電位記録 MEA チップ(MED-P515A,アルファメッドサイエン ティフィック)の64電極で検出された細胞外電位シグナ ルは64 チャネルのメインアンプ(MED-D64A32,アル ファメッドサイエンティフィック)と64チャネルのヘッ ドアンプ(MED-A64HEIS,アルファメッドサイエンティ フィック)で増幅し,各チャネルとも20 kHzのサンプリ ングレートでコンピュータ(PRECISION T1700,DELL) に取り込んだ。また,いくつかの実験では,それらの電 極の1 つを電気刺激のために用いた。 2-6 レーザー共焦点カルシウムイメージング 図2 のように,染色されたスライスが置かれた MEA チップを正立顕微鏡(E600FN,ニコン)のステージ上 に置き,30℃に保たれ95% O2/5% CO2ガスでバブリング
したACSF(124 mM NaCl,5 mM KCl,2 mM CaCl2,22
mM NaHCO3,1.3 mM MgSO4,1.24 mM NaH2PO4,10
mMグルコース,pH 7.4)(前記のACSFとはMgSO4濃度 が少し変更されている)で還流した。スライスにArレー ザー(488 nm; 532-BS-AO4,Melles Griot)を用い10% ND フィルタを通して励起光を照射した。レーザー出力は 15 mWとした。そして,520 nm の蛍光画像を16倍の蛍 光測定用対物レンズ(0.75 NA,S Fluor,ニコン),ニポ ウ式共焦点ユニット(CSU-10,横河電機),EM-CCD カ メラ(iXon3 897,Andor)を通し,150 ms間隔で連続的 2-4 ヒト iPS 細胞由来ニューロンの培養 本研究では,また,上記のMEAチップ(MED-P515A, アルファメッドサイエンティフィック)上にヒトiPS 細 胞由来ニューロン(RCDN001N,リプロセル)の培養を 行った。 MEAチップ上のウェル(図1B)内に血清入り培地を 1 mL 滴下し,37℃で一晩以上インキュベーションした。 そ の 後, 培 地 を 除 去 し 滅 菌 水 で 洗 浄 し た。0.003% polyethylenimine(PLL)溶液をウェル内に500 μL滴下し, 37℃,5% CO2インキュベータ内で2 時間インキュベー ションした。その後,PLL 溶液を取り除き,phosphate buffer saline(PBS) で 2 回 洗 浄 し た。 次 に,0.003% coating solution(RCDN201,リプロセル)をウェル内に 500 μL滴下し,37℃,5% CO2インキュベータ内で2時間 インキュベーションした後,coating solutionを取り除い た。
次に,coating solution を取り除いた MEA チップの中 心にクローニングリング(内径3.4 mm)を立て,そこに 細胞懸濁液(約1.0×106 cells/mL)を100 μL加えて細胞 を播種した。maturation培地(RCDN102,リプロセル)1 mL をクローニングリングの周囲に静かに注ぎ,37℃, 5% CO2インキュベータ内でインキュベーションした。 培養3 日目,7 日目,14 日目には培地交換を行った。培 養した細胞は測定前に,海馬スライスと同様にして Cal-520/AMで染色した。 メインアンプ ヘッドアンプ サンプル ダイクロイック ミラー Ar レーザー 16蛍光対物レンズ 共焦点ユニット EM-CCD カメラ 励起光 (488 nm) 蛍光 (520 nm) MEA チップ
図2
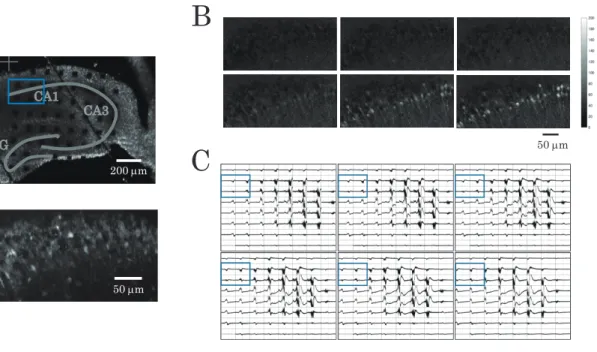
図 2 多点細胞外電位記録とレーザー共焦点カルシウムイメージングによって神経活動を同時測定するための実験系3.実験結果および考察 3-1 マウス海馬スライスの神経活動の同時測定 まず,本研究の実験系を用いて,マウス海馬スライス における細胞外電位シグナルと細胞内カルシウムシグナ ルを同時測定することを試みた。その際,カルシウム感 受性蛍光色素として,最近開発されOregon green のよ うな従来の色素より大きな蛍光強度変化とSN 比を示す Cal-520を用いた9, 10)。本研究では正立顕微鏡を用いたが, 実験によっては倒立顕微鏡を用いる場合がある。倒立顕 微鏡を用いた場合,ガラスチップを通して蛍光強度変化 を検出する必要があるので,そのような場合には特に Cal-520は有用である。 図4 に自発的な神経活動を測定した例を示す。海馬ス ライスでは,何も刺激を与えなくても,度々このような 自発的な神経活動が生じる。この例では,細胞外電位シ グナルは海馬全体で測定され(図4A上,図4C),蛍光画 像はCA1 領域で取得された(図 4A 下,図 4B)。なお, 対応する動画がウェブサイト(URLは図 4 の説明文中に 示した)で見られるので参照されたい。CA1領域(図4A 上と図4C および動画で青い四角で囲まれた部分)では 細胞外電位シグナルと細胞内カルシウムシグナルの両方 が測定されており,電極近傍の多数の神経細胞に同時に カルシウムシグナルが生じた際,すなわち多数の神経細 胞が同期して活動した際に,バースト的な電位シグナル が測定されることが分かる。図5 には,電位シグナルと カルシウムシグナルに対するラスタープロットを示し た。歯状回(DG)領域,CA3領域にバースト的な電位シ グナルが生じると,CA1領域にもバースト的な電位シグ ナル,カルシウムシグナルが見られ,各領域間が結合し ている様子が捉えられた。時間スケールを拡大すると, カルシウムシグナルは電位シグナルから数100 ms 遅れ ており(図6 ),電気的な神経活動から遅れて細胞内カ ルシウム流入が生じている様子が捉えられた。 次に,海馬スライスに電気刺激を行い,このときに生 じる細胞外電位シグナルと細胞内カルシウムシグナルを 同時測定することを試みた。MEAチップ電極は刺激電極 として用いることも可能であり,ここではシャーファー 側枝の下の1 つの電極を通し,電気刺激としてθ バース ト刺激を与えた。θ バースト刺激は図7に模式的に示した 刺激であり,それをシャーファー側枝に与えるとCA1領 域にシナプスの長期増強(Long-term Potentiation; LTP) が誘導されることが知られている。電位シグナルは海馬 全体で測定され,テスト刺激(図7 )によってCA1領域 の1 つの電極に生じた電位シグナル(興奮性シナプス後
場 電 位(field excitatory postsynaptic potential; fEPSP)) にコンピュータ(PRECISION T3500,Dell)に取得した。 得られた蛍光画像は解析ソフトAndor Solis(Ver. 4.18, Andor)で解析した。このとき,上記の多点細胞外電位 記録も同時に行った。 以上のような多点細胞外電位記録とレーザー共焦点カ ルシウムイメージングによる神経活動の同時測定は, MEA チップ上に培養されたヒト iPS 細胞由来ニューロ ンに対しても試みた。 2-7 データ解析 得られた蛍光画像から,次のようにして細胞内カルシ ウムシグナルのピークのラスタープロットを作成した。 まず,カメラの各ピクセルのフォトカウントを蛍光強度 (F)とし,ベースラインからの蛍光強度変化(ΔF/F0 = (F-F0)/F0)を求めた。ここで,F0はベースラインの蛍光 強度である。次に,蛍光画像から細胞体をその輪郭から 識別し,個々の細胞体にROI(region of interset)を置い た。そして,各ROIのピクセルの蛍光強度変化(ΔF/F0) を平均して細胞内カルシウムシグナルとした。図3A は 得られたカルシウムシグナルの時間変化の一例である。 そのピークをMATLAB(Mathworks)のカスタムプログ ラムで検出した。 図3Bは細胞外電位シグナルの一例を示す。その上向き と下向きのピークを,同様にしてMATLAB(Mathworks) のカスタムプログラムで検出し,ラスタープロットを作 成した。 0.01 V 10 % 5 s 100 ms
A
B
図3
図 3 (A)細胞内カルシウムシグナル,(B)細胞外電位シグ ナルの一例。検出されたシグナルのピークは,それぞ れ青丸と黒丸で示されている。図5
100 s
CA1
CA3
DG
その他
CA1
細 胞 外 電 位 シ グ ナ ル電
極
No
.
細 胞 内 カ ル シ ウ ム シ グ ナ ルROI
No.
200 m CA1 CA3 DG 50 mA
50 mB
C
図4
F /F0 (%) 図 4 (A)上:MEA チップ上の海馬スライス。小さい黒い四角は64 個の白金黒電極である。下:CA1 領域の蛍光画像。(B) CA1領域におけるカルシウムシグナル(ΔF/F0)の連続画像。それらの画像はグレースケールで表わされている。時間は左 上から右下の画像に向かって150 ms 間隔で進んでいる。(C)64 電極から得られた連続的な細胞外電位シグナル。64 個の ウィンドウがそれぞれの電極に対応する。各ウィンドウの横軸,縦軸のフルスケールはそれぞれ1s,0.1 µVである。時間 は左上から右下の画像に向かって150 ms 間隔で進んでいる。各ウィンドウの中の青い四角で囲まれた部分が(B)の画像 に 対 応 し, 中 心 の 時 間( 点 線 ) で そ れ ら の 画 像 が 取 得 さ れ た。 ウ ェ ブ サ イ ト(http://saitolab-chaos.com/Papers/ NUCHSkiyou/Supplemental-movie1.html)で動画( 2 倍速)が見られるので参照されたい。図 5 CA1,CA3,歯状回(DG)領域の 64電極における細胞外電位シグナルと CA1領域の 135のROIにおける細胞内カルシウム シグナルから得られたラスタープロット。上図の青い点はカルシウムシグナルのピーク位置,下図の黒い点は電位シグナ ルのピーク位置を示す。海馬スライスは図4 と同じものである。
の傾きの増加からLTPが誘導されたかを確認した。図 8 の例では,θ バースト刺激によるfEPSP の傾きの増加が 3 時間以上持続し,LTP が誘導されたことが分かる。図 9 に,このようなLTP誘導時にCA1領域で同時に測定さ れたカルシウムシグナルを示す。なお,対応する動画が ウェブサイト(URLは図 9 の説明文中に示した)で見ら れるので参照されたい。図10 にはカルシウムシグナル に対するラスタープロットを示した。上記の通り,海馬 スライスでは度々,自発的な神経活動が見られるが,こ のスライスでは自発的な神経活動はあまり見られなかっ た。また,θ バースト刺激の前,テスト刺激(図9 およ び動画の黄丸出現時)によって引き起こされるカルシウ ムシグナルもあまり見られなかった。一方,θ バースト 刺激中(図9 および動画の赤丸出現時)には顕著なカル シウムシグナルが見られた。細胞内カルシウム流入は LTP誘導に深く関わることはよく知られているが,その 様子が捉えられた。一方,LTP誘導後にテスト刺激によ るカルシウムシグナルが増加することはなかった。 500 ms 0.025 V 0.025 V 0.1 V
DG
CA3
CA1
CA1
図6
50 ms 1 s 200 msθバースト 刺激
×20 2 msテスト刺激
図7
θバースト刺激前 θバースト刺激後 時間 (ms) fEPSP ( V) 0.8 0 0.8 0 10 20 0.4 0.4 30 40 50 60 時間(min) fEPSP の 傾 き 0.5 1.0 1.5 0 60 120 180 240 θバースト刺激図8
A
B
図6 CA1,CA3,歯状回(DG)領域のそれぞれ 1 つの電極 における細胞外電位シグナル波形とCA1 領域の 135 の ROI における細胞内カルシウムシグナルのピーク位置 の関係。海馬スライスは図4 と同じものである。 図7 テスト刺激(左)とθ バースト刺激(右)。テスト刺激 は幅0.1 ms の− 100 µA と+ 100 µA のパルス電流から 成る。θ バースト刺激では,同様な刺激が間隔10 ms で4 回繰り返されるバースト刺激(右下)が, 間隔200 msで10回繰り返され(右中),さらにその10回のバー スト刺激列が5 s間隔で20回繰り返される(右上)。 図8 (A)θバースト刺激前後のfEPSPの時間波形。(B)θバー スト刺激前後のfEPSP の傾きの時間変化。傾きは刺激 前の値で規格化してある。51 s
76 s
100 s
104 s
26 s
50 m
0 s
25 s
49 s
75 s
図9
図10
θバースト刺激
200 s
ROI
No.
図9 LTP 測定時の CA1 領域におけるカルシウムシグナル(∆ F/F0)の連続画像。それらの画像はグレースケールで表わされて いる。各画像の下に示した時間はθ バースト刺激を与え始めたときからの時間である(マイナスは刺激前)。黄丸はテスト 刺激を与えたタイミングで,赤丸はθ バースト刺激を与えたタイミングである。丸印が表れていない時間には何の刺激も 与 え ら れ て い な い。 海 馬 ス ラ イ ス は 図8 と 同 じ も の で あ る。 ウ ェ ブ サ イ ト(http://saitolab-chaos.com/Papers/ NUCHSkiyou/Supplemental-movie2.html)で動画( 2 倍速)が見られるので参照されたい。 図10 LTP 測定時の CA1 領域の 112 の ROI における細胞内カルシウムシグナルから得られたラスタープロット。縦点線はテスト 刺激を与えたタイミングである。青い点はカルシウムシグナルのピーク位置を示す。海馬スライスは図8 と同じものであ る。ΔFF
0(%)
ニューロンに分化した細胞が見られ,そこから神経突起 が伸びている様子が確認できる。丸い粒状のものは未分 化の細胞であると考えられるが,培養開始21 日目でも 未分化の細胞は同程度に残っていた。その後も未分化の 細胞が分化することはなく,逆に分化した細胞の数が 減っていく傾向になった。そこで,培養開始14 日目か ら21日目の間に測定を行うことにした。 結果として,測定された細胞外電位シグナルと細胞内 カルシウムシグナルに自発的な神経活動は見られなかっ た。自発的な神経活動は単一ニューロンの特性として生 じる場合もあるが,多数のニューロンによって形成され た神経ネットワークの特性として生じる場合が多い。そ のような場合には多数のニューロンが同期して活動して いる場合が多く,その集合電位として細胞外電位シグナ ルが測定される。本研究において,海馬スライスに見ら れた上記のような自発的な神経活動も後者の例と考えら れる。図11では,電極近傍において,iPS細胞からニュー ロンに分化したいくつか細胞がそれぞれから伸びた神経 突起で互いに結合している様子が確認できるが,自発的 に同期した神経活動が生じ,その結果として生じた細胞 3-2 ヒト iPS 細胞由来ニューロンの神経活動の同時測定 次に,本研究の実験系を用いて,MEA チップ上に培 養したヒトiPS 細胞由来ニューロンに対して細胞外電位 シグナルと細胞内カルシウムシグナルを同時測定するこ とを試みた。図11 に培養開始 14 日目の 1 つの電極近傍 の 様 子 を 示 し た。 矢 印 で 示 し た 部 分 にiPS 細 胞 か ら 10 m
図11
図12
図11 MEA チ ッ プ の 1 つ の 電 極 近 傍 の ヒ ト iPS 細 胞 由 来 ニューロン(矢印) 図12 θ バースト刺激が与えられた電極近傍における細胞のカルシウムシグナル(∆ F/F0)の連続画像。左上は蛍光画像である。 それらの画像では,∆F/F0がグレースケールで表わされている。各画像の真中の赤い正方形は刺激電極の位置である。また, 各画像の下に示した時間はθ バースト刺激を与え始めたときからの時間である(マイナスは刺激前)。赤丸はθ バースト刺 激を与えたタイミングである。なお,サンプルは図11 とは違うものある。ウェブサイト(http://saitolab-chaos.com/ Papers/NUCHSkiyou/Supplemental-movie3.html)で動画(10倍速)が見られるので参照されたい。外電位シグナルをMEA チップ電極で捉えられるように するには,さらに神経ネットワークを成熟させる必要が あると思われる。 そこで次に,MEA チップ電極の 1 つを刺激電極とし て用い,電気刺激に伴う細胞外電位シグナルと細胞内カ ルシウムシグナルを測定することを試みた。図12 に, 電気刺激としてθ バースト刺激を与えた際の細胞内カル シウムシグナルを示す。刺激電極の近傍の細胞にカルシ ウムシグナルが生じる様子が捉えられた。なお,対応す る動画がウェブサイト(URL は図 12 の説明文中に示し た)で見られるので参照されたい。一方,細胞外電位シ グナルはθ バースト刺激を与えた際も捉えることはでき なかった。 4.結 論 本研究ではまず,多点細胞外電位記録とレーザー共焦 点カルシウムイメージングによって,マウスの海馬スラ イスのおける神経活動を同時測定した。その結果,自発 的な神経活動が生じているときやLTP が誘導されたと きの細胞外電位シグナルと細胞内カルシウムシグナルを 同時に捉えることができた。ここで,細胞外電位記録を 行うためのMEAチップ電極は刺激電極として用いること も可能であり,LTP 誘導にはその電極の 1 つを電気刺激 のために用いた。本研究ではまた,この実験系を用いて ヒトiPS 細胞由来ニューロンの培養系に対しても同様な 測定を行った。その結果,MEAチップ電極を通して電気 刺激を与えることにより,その電極近傍にある細胞にカ ルシウムシグナルが生じる様子を捉えることができた。 脳機能はシナプスからの神経伝達物質の放出や,それ から引き起こされる電気シグナル・カルシウムシグナル が複雑に相互作用して発現するものである。本研究の技 術によれば,そのような電気シグナル・カルシウムシグ ナルを同時測定できることがマウスの海馬スライスを用 いて確かめられた。ヒトiPS 細胞由来ニューロンの培養 系では,MEAチップ電極を通して電気刺激を行った際に 生じるカルシウムシグナルを捉えることができた。MEA チップ電極を通して電気シグナルを捉えるためには,神 経ネットワークをさらに成熟させる必要があるが,本研 究の技術はヒトiPS 細胞由来ニューロンの培養系にも適 用し得ると思われる。将来的には,例えば脳疾病の治療 薬の個々人に対する効果の差異をチェックするといった テーラーメイド医療に応用されることが期待される。 謝辞 本研究は平成27・28年度自然科学研究所総合研究(課題名: 脳疾病のテーラーメイド医療に向けた基盤技術の確立,代表 者:斎藤稔)の助成を受け行われたものである。ここに深く 感謝致します。
1) J. Pine, Recording Action Potentials from Cultured Neurons with Extracellular Microcircuit Electrodes, Journal of Neuroscience Methods, 2(1980)19-31.
2) Y. Jimbo, T. Tateno, H.P. Robinson, Simultaneous Induction of Pathway-Specific Potentiation and Depression in Networks of Cortical Neurons, Biophysical Journal, 76(1999)670-678.
3) H. Oka, K. Sugimoto, R. Ogawa, H. Sugihara, M. Taketani, A New Planar Multielectrode Array for Extracellular Recording: Application to Hippocampal Acute Slice, 93(1999)670-678.
4) A.H. Alhebshi, M. Gotoh, I. Suzuki, Thymoquinone Protects Cultured Rat Primary Neurons against Amyloid Beta-Induced Neurotoxicity, Biochemical and Biophysical Research Communications, 433(2013) 362-367.
5) A. Odaira, Y. Saitoh, A.H. Alhebshi, M. Gotoh, I. Suzuki, L o n g - Te r m E l e c t r o p h y s i o l o g i c a l A c t i v i t y a n d Pharmacological Response of a Human Induced Pluripotent Stem Cell-Derived Neuron and Astrocyte Co-Culture, Biochemical and Biophysical Research Communications, 443(2014) 1176-1181.
6) Y. Ikegaya, G. Aaron, R. Cossart, D. Aronov, I. Lample, D. Ferster, R. Yuste, Synfire Chains and Cortical Songs: Temporal Modulates of Cor tical Activity, Science, 304(2004)559-564.
7) Y. Ikegaya, M.L. Bon-Jero, R. Yuste, Large-Scale Imaging of Cortical Network Activity with Calcium Indicators, Neuroscience Research, 52(2005)132-138.
8) N. Takahashi, T. Sasaki, A. Usami, N. Matsuki, Y. Ikegaya, Watching Neuronal Circuit Dynamics through Functional Multineuron Calcium Imaging (fMCI), Neuroscience Research, 58(2007)132-138.
9) K.L. Ellefsen, B. Settle, I. Parker, I.F. Smith, An Algorithm for Automated Detection, Localization and Measurement of Local Calcium Signals from Camera-Based Imaging, Cell Calcium, 56(2014)147-156.
10) M. Tada, A. Takeuchi, M. Hashizume, K. Kitamura, M. Kano, A Highly Sensitive Fluorescent Indicator Dye for Calcium Imaging of Neural Activity in Vitro and in Vivo, European Journal of Neuroscience, 39(2014)1720-1728. 参考文献