MEDICAL & BIOLOGICAL LABORATORIES CO., LTD.
Non Radioisotopic Kit for Measuring PKA and PKC Activities
MESACUP
®
Protein Kinase Assay Kit
CODE No.5230
For Research Use Only. Not for use in diagnostic procedures.
1. Introduction
Phosphorylation and dephosphorylation of proteins, which are catalyzed by protein kinases and protein phosphatases respectively, were reported to regulate major cell functions(1-5). Therefore the
measurement of kinase activities is indispensable for study of cell function.
The radioactive method which utilizes radioactive ATP is presently used for measuring protein kinase activities. However, there are inherent drawbacks to this method. These involve limitation of installation and affection of cold ATP in the samples. MBL has developed the MESACUP® Protein
Kinase Assay Kit to provide a simple, reliable and non-radioactive method for measuring the activities of cAMP-dependent protein kinase (PKA) and protein kinase C (PKC).
The kit is based on an enzyme linked immunosorbent assay (ELISA) that utilizes a synthetic peptide and a monoclonal antibody recognizing the phosphorylated form of the peptide (Fig. 1).
This method is as sensitive as the radioactive one and is less affected by concentrations of ATP present in the reaction mixture.
The assay can be performed on crude cell extracts, column fractions or purified enzymes.
The assay kit is of value for
purification of PKA/PKC
screening of inhibitors or activators of PKA/PKC detecting pharmacological effects on PKA/PKC.
Fig.1 MESACUP® Protein Kinase Assay Kit
PKA or PKC present in samples catalyze phosphorylation of the PS peptide that is coated on the microwells. The biotinylated monoclonal antibody 2B9 binds to the phospho-PS peptide and is subsequently detected with streptavidin conjugated to peroxidase. A peroxidase substrate is then added to the microwell and the intensity of the color is measured photometrically at 492 nm.
2. Assay Methodology
Users are recommended to read this entire section before starting the assay.
(1) Contents of the MESACUP
®Protein Kinase Assay Kit
The assay kit contains the following components.1) Microwell strips coated with PS peptide 8 wells x 12 strips 2) 10 x Sample preparation buffer concentrate 10 mL x 1
3) Reaction buffer 1.5 mL x 3
4) Calcium solution (20 mM CaCl2) 1.5 mL x 1
5) Phosphatidylserine (PS) (500 μg/mL) 1.2 mL x 1 6) Biotinylated antibody 2B9 6.0 mL x 2 7) POD-conjugated streptavidin 6.0 mL x 2 8) 10 x Wash concentrate (10 x PBS(-)) 50 mL x 2 9) Substrate A (o-phenylenediamine) 3 tablets 10) Substrate B (H2O2) 50 mL x 1
11) Stop Solution (20% H3PO4) 40 mL x 1
(2) Materials and equipment required
The following materials and equipments are required but not provided:
1) Adenosine 3',5'-cyclic monophosphate sodium salt (for PKA Assay) 2) Adenosine 5'-triphosphate disodium salt (ATP)
3) Water bath at 25ºC
4) Multichannel pipette 50-200 μL
5) Adjustable pipettes, 2-20 μL, 10-100 μL, 20-200 μL, 100-1000 μL 6) Microplate reader (optical density at 492 nm)
7) 96-well polyvinyl plate (for example, multiwell plate for ELISA Code No. MS-7196F, Sumitomo bakelite Co. Ltd)
8) Reagent reservoir (for example, cat. no. 224-4872, Bio-Rad) 9) Plate washer or washing bottle
(3) Recommended assay procedure
A. Preparation of reagents1) Sample preparation buffer
Prepare only a sufficient amount for the assay because the Sample preparation buffer can not be stored.
Sample preparation buffer must be prepared prior to cell preparation.
Dilute 1 part of the Sample preparation buffer concentrate with 9 parts of distilled or deionized water and place it at 4ºC.
Add 2-mercaptoethanol and PMSF (final concentration: 50 mM 2-mercaptoethanol and 1 mM PMSF) to the diluted sample preparation buffer, and cool it at 4ºC.
Final concentration of Sample preparation buffer:
50 mM Tris-HCl pH 7.5, 5 mM EDTA, 10 mM EGTA, 50 mM 2-mercaptoethanol, 1 mM PMSF, 10 mM Benzamidine
2) ATP (0.1 M)
Dissolve 60 mg ATP in 0.8 mL of H2O. Adjust the pH to 7.0 with 0.1 M NaOH. Adjust the volume
to 1 mL with H2O.
Dispense the solution into small aliquots and store at -20ºC.
The molar absorption coefficient of ATP ε 259 = 15.4 X 103 (pH 7.0)
Just prior to the assay, dilute 0.1 M ATP with distilled water and prepare 1 mM ATP. 3) Wash solution
The Wash Concentrate must be diluted prior to use. Dilute 1 part Wash Concentrate with 9 parts distilled or deionized water. The diluted wash solution is stable for 1 month at 4ºC.
4) Substrate Solution
Just prior to color development, dissolve one tablet of Substrate A in 12 mL of Substrate B. Keep the solution in the dark and use as soon as possible.
If necessary, prepare the following reagents.
5) cAMP (10 mM)
Dissolve 4 mg cAMP in 0.8 mL of H2O. Adjust the volume to 1 mL with H2O. Dispense the
solution into small aliquots and store at -20ºC.
The molar absorption coefficient of cAMP ε 259 = 15.4 X 103
Just prior to the assay, dilute it with distilled water and prepare 20 μM cAMP. 6) PKA
7) PKC
Prepare according to “Preparation of PKC” described later in the appendix. 8) Phosphatidylserine (PS) (500 μg/mL)
Agitate vigorously by sonicator or Vortex mixer prior to use. 9) 200 mM EGTA
Dissolve 7.6 g of [ethylenebis (oxyethylenenitrilo)] tetraacetic acid (EGTA) in 80 mL of H2O by
gradual addition of solid NaOH (at pH 5.0, EGTA is dissolved completely). Adjust the pH to 7.0 using 0.2 N NaOH and make up to 100 mL with H2O.
Just prior to assay, dilute it with distilled water and prepare 20 mM EGTA.
(4) Sample preparation
Sample preparation must be done on ice and kept at 4ºC.
The activities of PKA or PKC may be lost when the sample is not kept cold.
Sub-confluent cultured cell were washed three times with cold PBS and scraped with a rubber policeman. After two washing with cold PBS, the cell pellet (1.0 - 2.0 x 107 cells) is suspended in 1
mL of cold sample preparation buffer, and sonicated for 30 - 60 seconds (ex. 15 seconds x 4 times). Some sonicators generate heat during cell sonication. Keep samples cool and never warm the cells during the sonication.
Avoid foaming cell suspensions during the sonication.
The optimal conditions for cell sonication will vary with the equipment used. Each lab should confirm the optimal conditions for their equipment.
Cytosol fraction was separated by centrifugation at 100,000 x g for 1 hour at 4ºC. The activities of PKA and PKC were measured as described below.
B. Preparation of Component Mixture
Prepare Component Mixture by mixing as described below.
PKA (1 assay) PKC (1 assay)
(+) (-) (+) (-)
Reaction buffer 13 13 13 13 (μL)
Calcium solution (20 mM CaCl2) − − 13 − (μL)
20 μM cAMP*, ** 13 − − − (μL)
1 mM ATP*** 13 13 13 13 (μL)
500 μg/mL phosphatidylserine**** − − 13 − (μL)
H2O 78 91 65 78 (μL)
20 mM EGTA − − − 13 (μL)
*Note: cAMP is not required for the assay using the catalytic subunit of cAMP-dependent protein kinase. Add equal volume (13 μL) of H2O instead of cAMP solution.
**Note: Negative control for assay of holo-PKA, add equal volume (13 μL) of H2O instead of
cAMP solution.
***Note: The concentration of ATP can be raised up to 2 mM in the “Reaction Mixture”.
****Note: Negative control for assay of PKC, add equal volume of 20 mM EGTA (pH 7.0) instead of 500 μg/mL phosphatidylserine.
Final concentration of reaction mixture for PKA:
25 mM Tris-HCl pH 7.0, 3 mM MgCl2, 0.1 mM ATP, 2 μM cAMP, 0.5 mM EDTA,
1 mM EGTA, 5 mM 2-mercaptoethanol Final concentration of reaction mixture for PKC:
25 mM Tris-HCl pH 7.0, 3 mM MgCl2, 0.1 mM ATP, 2 mM CaCl2,
50 μg/mL phosphatidylserine, 0.5 mM EDTA, 1 mM EGTA, 5 mM 2-mercaptoethanol
C. Assay Protocol
1) Prepare the reagents as described.
2) Place 108 μL component mixture in each well of polyvinyl plate and pre-incubate at 25ºC for 5 minutes.
3) Add 12 μL of kinase sample to each well and mix them.
4) Transfer 100 μL solution of reaction mixture to each PS-peptide coated well with a multichannel pipettor.
5) Incubate at 25ºC for 5 - 20 minutes (use water bath). 6) Add 100 μL of stop solution to each well.
7) Aspirate or discard the well contents. Fill the well with Wash Solution and then completely aspirate or discard the contents. Wash 5 times. Tap the plate on a paper towel to remove any remaining Wash Solution. Be carefully not to dry the well.
8) Add 100 μL of biotinylated antibody 2B9 to each well. 9) Incubate at 25ºC for 60 minutes.
10) Wash the microplate following the STEP 7 procedure. 11) Add 100 μL of POD-conjugated streptavidin to each well. 12) Incubate at 25ºC for 60 minutes.
13) Wash the microplate following the STEP 7 procedure. 14) Add 100 μL of Substrate solution to each well.
15) Incubate at 25ºC for 3 - 5 minutes. 16) Add 100 μL of Stop solution to each well.
17) Read the O.D. of each well at 492 nm with a microplate reader.
3. Storage and Stability
2-8ºC, 18 months
References
1. Montimity, M. R. and Bilezikjian, L. M. Nature 56, 175-178 (1987) 2. Wolf, M. et al. Nature 317, 546-549 (1985)
3. Nishizuka, Y. Science 233, 305-312 (1986) 4. Nishizuka, Y. Nature 334, 661-665 (1988)
5. Edelman, A. M. et al. Ann. Rev. Biochem. 56, 567-613 (1987) 6. Beavo, J. A. et al. Methods Enzymol. 38, 299-308 (1974) 7. Inagaki, M. et al. J. Biol. Chem. 260, 2922-2925 (1985)
Warning:
For research use only. Not recommended or intended for diagnosis of disease in humans or animals. Do not use internally or externally in humans or animals.
Biotinylated antibody 2B9 contains 0.09% sodium azide as a preservative. Sodium azide may react with copper or lead in plumbing systems to form explosive metal azides. Therefore, be sure to flush drain with plenty of water when disposing materials containing azide into a drain.
Appendix
Preparation of PKA
Dissolve 500 units of the catalytic subunit of PKA (Sigma Chemical Co., St. Louis, MO., Cat. No. P-2645) in 1 mL of 1 mg/mL bovine serum albumin, 50 mM 2-mercaptoethanol, 50% (w/v) sucrose and 2 mM EGTA. Dispense the solution into small aliquots and store at -70ºC. The PKA solution should be stable up to three months at -70ºC. Before use, dilute the PKA solution further to 10 - 50 units/mL with “Component Mixture”.
Alternatively PKA can be prepared from bovine heart according to the method of Beavo et al.6).
Preparation of PKC
PKC is prepared from rat brain by the method of Inagaki et al.7). Five rat brains (9 g) are
homogenized with a Potter-Elvehjem Teflon-glass homogenizer with 90 mL of Buffer A. The homogenate is centrifuged for 90 min. at 75,000 x g. The soluble supernatant, used as the crude extract (70 mL, 105 mg of protein), is applied to a DEAE-cellulose column (2.0 x 17 cm) equilibrated with Buffer B at a flow rate of 36 mL/h. The column is washed with 300 mL of Buffer B. The sample is eluted from the column by application of 0.0-0.4 M linear concentration gradient of NaCl in 500 mL of Buffer B at a flow rate of 20 mL/h. Fractions of 5.5 mL are collected. Using the MESACUP®
Protein Kinase Assay Kit, each fraction is assayed for protein kinase C activity in the presence of CaCl2 and phosphatidylserine or in the presence of EGTA. PKC is eluted as a sharp peak between
80 and 130 mM NaCl.
Buffer A: 25 mM Tris-HCl, pH 7.5 containing 50 mM 2-mercaptoethanol, 2 mM [ethylenebis(oxyethylenenitrilo)] tetraacetic acid (EGTA),
1 mM phenylmethylsulfonyl fluoride (PMSF), 0.005% leupeptin, and 0.25 M sucrose. Buffer B: 25 mM Tris-HCl, pH 7.5 containing 50 mM 2-mercaptoethanol, 2 mM EGTA, and 0.002%
leupeptin.
DEAE-cellulose (DE52) from Whatman Bio Systems Ltd., England. Phosphatidylserine (pig brain) from Serdary Research Laboratories, Inc.
Chloroform is removed from this phospholipid by a stream of nitrogen, and the phospholipid is sonicated in water for 1 min to produce a suspension of 0.5 mg/mL.
Fig. 2
A. MgCl2 dependence of phosphorylation of PS peptide by protein kinase C. (Left)
The PS peptide plate was phosphorylated by incubation with 100 μg/mL cell cytosol, 2 mM CaCl2,
0.1 mM ATP, 50 μg/mL phosphatidylserine, 0.5 mM EDTA, 1 mM EGTA, 5 mM 2-mercaptoethanol, 25 mM Tris-HCl pH7.0 and various concentrations of MgCl2 (activity: ●), or by incubation with
100 μg/mL cell cytosol, 0.1 mM ATP, 0.5 mM EDTA, 3 mM EGTA, 5 mM 2-mercaptoethanol, 25 mM Tris-HCl pH 7.0 and various concentrations of MgCl2 (basal: ○) at 25ºC for 5 min.
B. CaCl2 dependence of phosphorylation of PS peptide by protein kinase C. (right)
The PS peptide plate was phosphorylated by incubation with 100 μg/mL cell cytosol, 3 mM MgCl2,
0.1 mM ATP, 50 μg/mL phosphatidylserine, 0.5 mM EDTA, 1 mM EGTA, 5 mM 2-mercaptoethanol, 25 mM Tris-HCl pH 7.0 and various concentrations of CaCl2 at 25ºC for 5 min.
A: PKC
B: PKA
Fig. 3 Measurement of activities of cAMP-dependent protein kinase (PKA) and protein kinase C in cell cytosol using the MESACUP® Protein Kinase Assay Kit
A. Protein kinase C activities were measured by the MESACUP® Protein Kinase Assay Kit.
The PS peptide plate was phosphorylated by incubation with 30 μg/mL cell cytosol, 3 mM MgCl2,
2 mM CaCl2, 0.1 mM ATP, 50 μg/mL phosphatidylserine, 0.5 mM EDTA, 1 mM EGTA,
5 mM 2-mercaptoethanol and 25 mM Tris-HCl pH 7.0 (+), or by incubation with 30 μg/mL cell cytosol, 3 mM MgCl2, 2 mM CaCl2, 0.1 mM ATP, 0.5 mM EDTA, 3 mM EGTA, 5 mM
2-mercaptoethanol and 25 mM Tris-HCl pH 7.0 (-) at 25ºC for 10 min.
B. cAMP-dependent protein kinase activities were measured by the MESACUP® Protein Kinase
Assay Kit. The PS peptide plate was phosphorylated by incubation with 30 μg/mL cell cytosol, 3 mM MgCl2, 0.1 mM ATP, 2 μM cAMP, 0.5 mM EDTA, 1 mM EGTA, 5 mM 2-mercaptoethanol and
25 mM Tris-HCl pH 7.0 (+), or by incubation with 30 μg/mL cell cytosol, 3 mM MgCl2, 0.1 mM ATP,
0.5 mM EDTA, 1 mM EGTA, 5 mM 2-mercaptoethanol and 25 mM Tris-HCl pH 7.0 (-) at 25ºC for 10 min.
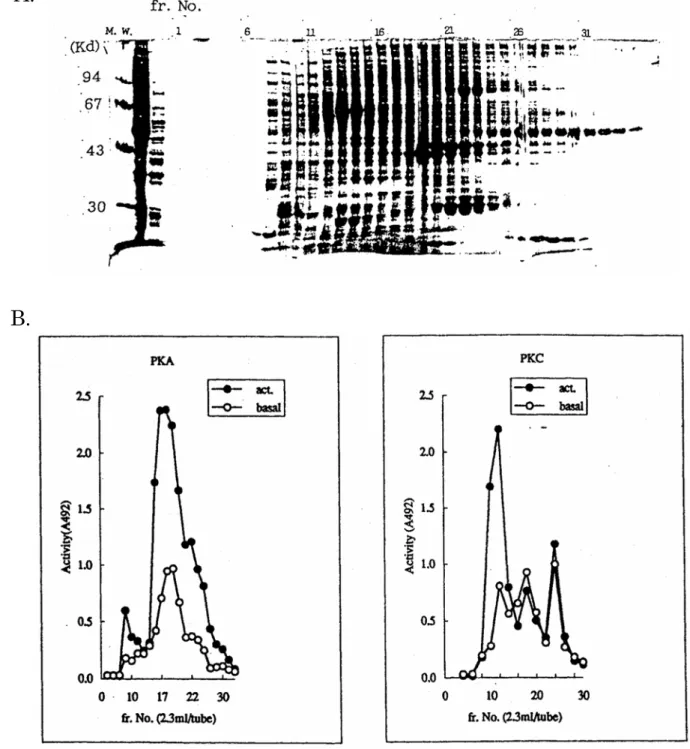
Fig. 4 Elution profiles of cAMP-dependent protein kinase and protein kinase C. The crude extract from rat brain was applied on a DEAE-cellulose column. A. The results of SDS-PAGE of fractions.
B. Activities of cAMP-dependent protein kinase (left) or protein kinase C (right) were measured by the MESACUP® Protein Kinase Assay Kit.
C. Western blot analysis of PKC
Each fraction was run on a 12.5% polyacrylamide gel. The protein bands were transferred to a nitrocellulose membrane. The membrane was stained with monoclonal antibody against PKC.
A.
はじめに
MESACUP® Protein Kinase Assay Kit は、ラジオアイソトープを必要としない cAMP 依存性蛋白質
リン酸化酵素(PKA)とカルシウム・リン脂質依存性蛋白質リン酸化酵素(PKC)活性測定試薬です。 cAMP 依存性蛋白質リン酸化酵素(PKA)とカルシウム・リン脂質依存性蛋白質リン酸化酵素(PKC) は細胞内情報伝達機構において、重要な役割を果たしています1)。PKA および PKC の機能を解明する うえで、両キナーゼの活性を測定する事は必須です。 PKC のアイソタイプは 11 種類報告されており、いずれも C 末端側にキナーゼドメイン、N 末端側に レギュレタリードメインを配した形になっています。PKC の SDS-PAGE におけるみかけの分子量は最 も小さいPKCλで 71~74 kDa、最も大きい PKCμで 110 kDa と報告されています2, 3)。 レ ギ ュ レ タ リ ー ド メ イ ン に は 、PKCμを除くすべてのアイソフォームにおいて偽基質配列、 R-F-A-R-K-G-A-L-R-Q-K-N-V、と呼ばれる部分が存在し、この部分が分子内でキナーゼドメインの活性 中心と相互作用することにより、キナーゼ活性を常時 OFF に保っているものと考えられます。この偽 基質配列の7 番目の A を S に置換したペプチドは PKC の非常によい基質であることが報告されていま す4)。また、このA を S に置換したペプチド、R-F-A-R-K-G-S-L-R-Q-K-N-V:PS ペプチド、には PKA に最もリン酸化されやすいと考えられている配列、R-R/K-X-S/T、が存在します。そこで、この PS ペプ チドのリン酸化体を化学合成し、抗原にしてリン酸化状態を特異的に認識するモノクローナル抗体、2B9 を得ました。そして、PS ペプチドとモノクローナル抗体 2B9 とを用いて、新たな PKA、PKC 活性測 定用試薬MESACUP® Protein Kinase Assay Kit の開発を行いました。
MESACUP® Protein Kinase Assay Kit は、crude cell extracts、組織抽出物での活性を測定することが
できます。ラジオアイソトープを必要としないため、RI 施設のない研究室においてのキナーゼ研究に利
用できます。
特徴
1) ラジオアクティブATP を必要としないため、RI 施設のない研究室でも PKA、PKC の 活性測定ができ、廃液等の処理も通常に行えます。
2) 高濃度ATP (2 mM)存在下でも測定できます。 3) 多数サンプルを短時間で測定が可能です。
測定原理
図1 MESACUP® Protein Kinase Assay Kit の測定原理を示します。
PS ペプチドを感作したマイクロプレートにサンプルを反応させます。リン酸化された PS ペプチドとビ
オチン標識モノクローナル抗体2B9 を反応させ、さらに、ストレプトアビジン-ペルオキシダーゼを反
応させた後、o-フェニレンジアミン(OPD)と過酸化水素を添加してペルオキシダーゼにより発色させ
キット構成
構成品名 容量
1) Microwell strips coated with PS peptide 8 wells x 12 strips 2) 10 x Sample preparation buffer concentrate 10 mL x 1
3) Reaction buffer 1.5 mL x 3
4) Calcium solution (20 mM CaCl2) 1.5 mL x 1
5) Phosphatidylserine (PS) (500 μg/mL) 1.2 mL x 1 6) Biotinylated antibody 2B9 6.0 mL x 2 7) POD-conjugated streptavidin 6.0 mL x 2 8) 10 x Wash concentrate (10 x PBS(-)) 50 mL x 2 9) Substrate A (o-phenylenediamine) 3 tablets 10) Substrate B (H2O2) 50 mL x 1
11) Stop Solution (20% H3PO4) 40 mL x 1
操作法
□
準備する試薬・器具
1) Adenosine 3',5'-cyclic monophosphate sodium salt;cAMP (for PKA assay) 2) Adenosine 5'-triphosphate disodium salt;ATP (pH 7.0)
3) ウォーターバス
4) 8 あるいは 12 連式マルチチャネルピペット 50-200 μL 5) 可変式ピペット 2-20 μL, 10-100 μL, 20-200 μL, 100-1000 μL 6) マイクロプレートリーダー(O.D. at 492 nm)
7) 96 穴ポリビニルプレート(ex, Sumitomo bakelite Co. Ltd, Cat. No. MS-7196F) 8) リザーバー(ex, Bio-Rad, Cat. no. 224-4872)
9) プレートウォッシャーまたは洗浄ビン 10) 精製水
□ 試薬の調製
1) Sample preparation buffer(操作前に実施)
Sample preparation buffer は、サイトゾル画分抽出用およびキナーゼサンプル希釈用として使用し ます。Sample preparation buffer は保存できませんので、用時調製して下さい。
① 10 x Sample preparation buffer concentrate(10 倍濃縮品)を精製水で 10 倍希釈します。 ② 希釈した溶液に、最終濃度 50 mM 2-mercaptoethanol 及び 1 mM PMSF になるように、
2-mercaptoethanol 及び PMSF を加え、Sample preparation buffer とし、4ºC に冷却します。 ※Sample preparation buffer の組成及び最終濃度
50 mM Tris-HCl pH 7.5, 5 mM EDTA, 10 mM EGTA, 50 mM 2-mercaptoethanol, 1 mM PMSF, 10 mM Benzamidine
2) 洗浄液(操作前に実施)
3) 酵素基質溶液(反応直前に実施) 酵素基質溶液は保存できないので発色反応直前に調製します。 室温に戻した12 mL の Substrate B に 1 錠の Substrate A を加えて溶解し、酵素基質溶液とします。 ※注意:酵素基質溶液はできる限り遮光して下さい。また、酵素基質溶液は金属イオンによって酸化 されやすいので精製水で十分にすすいだきれいな器具を使用して下さい。 4) 0.1 M ATP ATP 60 mg を 0.8 mL の精製水に溶解し、0.1 M NaOH で pH 7.0 にあわせ、1 mL にします。使用 直前に、精製水で1 mM に調製して下さい。 0.1 M ATP は、凍結融解の繰り返しを避けるため、小分けして-20ºC で凍結保存して下さい。 モル分子吸収係数ATP ε 259 = 15.4 X 103 (pH 7.0) 必要に応じて下記の試薬を調製して下さい。 5) 10 mM cAMP の調製 cAMP 4 mg を 1 mL の精製水に溶解します。使用直前に、精製水で 20 μM に調製して下さい。 10 mM cAMP は、凍結融解の繰り返しを避けるため、小分けして-20ºC で凍結保存して下さい。 モル分子吸収係数ATP ε 259 = 15.4 X 103 (pH 7.0)
6) 200 mM [ethylenebis (oxyethylenenitrilo)] tetraacetic acid (EGTA) 溶液の調製 ① EGTA 7.6 g に蒸留水 80 mL を加え、攪拌します。 ② NaOH 錠剤を少量ずつ、ゆっくりと加えます(pH 5.0 で溶解します)。 ③ 0.2 N NaOH で pH 7.0 に合わせたのち、精製水で 100 mL にします。 ④ 使用直前に精製水で希釈し、20 mM EGTA に調製します。 7) Phosphatidylserine (PS) (500 μg/mL) 使用直前にソニケーターあるいはボルテックスミキサーで十分攪拌して下さい。 8) PKA 後述のAppendix を参照して下さい。 9) PKC 後述のAppendix を参照して下さい。
□
cell cytosol の調製
cell cytosol に熱が加わった場合、cell cytosol 中の PKA、PKC が失活する場合がありますので、cell cytosol の調製は、必ず氷中で行なって下さい。
1) 抽出用緩衝液には、Sample preparation buffer を使用します。
培養した細胞を、冷却したPBS で 3 回洗浄し、rubber policeman を用いて細胞を集めます。 集めた細胞を冷却したPBS で 2 回洗浄し、細胞数を 1.0 - 2.0 x 107個に調整します。
調整した細胞を冷却したSample preparation buffer 1 mL に加え、氷中で 30 - 60 秒間(ex. 15 秒 x 2~4 回)ソニケーションします。
注意:ソニケーターの機種により、ソニケーション時にサンプルに熱が発生する機種があります。 cell cytosol をソニケーションするときには、cell cytosol に熱がかからないように注意して下さい。 また、ソニケーションするときには、サンプルを泡立てないで下さい。
ソニケーターの最適設定条件は機種によって異なります。各施設にて、最適設定条件を設定する事 をお勧めします。
2) 4ºC で 100,000 x g、60 分間遠心します。
3) 上清をサンプルとします。サンプルは必要に応じて、Sample preparation buffer を用いて希釈して 下さい。
□
リン酸化反応用溶液の調製
下記試薬を混合し、リン酸化反応用溶液とします。
PKA (1 assay) PKC (1 assay)
(+) (-) (+) (-)
Reaction buffer 13 13 13 13 (μL)
Calcium solution (20 mM CaCl2) − − 13 − (μL)
20 μM cAMP*, ** 13 − − − (μL) 1 mM ATP*** 13 13 13 13 (μL) 500 μg/mL phosphatidylserine**** − − 13 − (μL) H2O 78 91 65 78 (μL) 20 mM EGTA − − − 13 (μL) 注意*:PKA 触媒サブユニットのアッセイには cAMP は添加せずに同量の精製水を加えます。 注意**:PKA のコントロールは cAMP の代わりに精製水を加えます。 注意***:ATP の濃度は、サンプルとして 2 mM まで影響を受けません。 注意****:PKC のコントロールは phosphatidylserine の代わりに phosphatidylserine と 同量の20 mM EGTA (pH 7.0)を加えます。 ※リン酸化反応溶液の組成と最終濃度
PKA 用:25 mM Tris-HCl pH 7.0, 3 mM MgCl2, 0.1 mM ATP, 2 μM cAMP, 0.5 mM EDTA,
1 mM EGTA, 5 mM 2-mercaptoethanol
PKC 用:25 mM Tris-HCl pH 7.0, 3 mM MgCl2, 0.1 mM ATP, 2 mM CaCl2,
50 μg/mL phosphatidylserine, 0.5 mM EDTA, 1 mM EGTA, 5 mM 2-mercaptoethanol
□
PKA または PKC 活性の測定方法
1) サンプル、リン酸化反応用溶液、その他の試薬を調製、準備します。 2) リン酸化反応 ① 前処理用のプレート1 ウェルにつき、リン酸化反応用溶液 108 μL を分注して、25ºC で 5 分間 インキュベートします。 ② インキュベートしたリン酸化反応用溶液108 μL にサンプル 12 μL を加えて混合します。混合 したサンプルをMicrowell strips coated with PS peptide 1 ウェルにつき 100 μL 分注し、リン 酸化反応を開始させます。3) 25ºC で 5 – 20 分間インキュベート後、Stop solution を 1 ウェルにつき 100 μL 分注し、リン酸化 反応を停止させます。
4) マイクロプレートを洗浄液で 5 回洗浄します。
マイクロカップ内の反応液を完全に除去後、カップ内に洗浄液を十分に満たし洗浄液を捨てます。 同様に4 回行ないます(5 回洗浄)。
注意:洗浄中にマイクロカップを乾燥させないで下さい。
洗浄後、Microwell strips をペーパータオル等で包み、Microwell strips を下向きにして軽 く叩いて、残っている洗浄液を完全に除去します。この場合も、乾燥しないように十分注意 して下さい。 5) Biotinylated antibody 2B9 を 1 ウェルにつき 100 μL 分注し、25ºC で 60 分間反応させます。 6) 4)と同様に Microwell strips を洗浄液で 5 回洗浄します。 7) POD-conjugated streptavidin を 1 ウェルにつき 100 μL 分注し、25ºC で 60 分間反応させます。 8) 4)と同様に Microwell strips を洗浄液で 5 回洗浄します。 9) 酵素基質溶液を 1 ウェルにつき 100 μL 分注し、25ºC で 3-5 分間反応させます。 10) Stop solution を 1 ウェルにつき 100 μL 分注し、酵素反応を停止させ、492 nm の吸光度を測定し ます。
操作上または使用上の注意事項
1) 本試薬は研究用試薬です。ヒトの体内に用いたり、診断の目的に使用しないで下さい。2) 本試薬の構成品のうち、Biotinylated antibody 2B9 には 0.09%アジ化ナトリウム(NaN3)を添
加してあります。濃度は 0.09%ですので毒物には該当しませんが、誤って目や口に入ったり、 皮膚に付着した場合は水で十分に洗い流すなどの応急措置を行い、必要があれば、医師の手当て を受けて下さい。またアジ化ナトリウムは、配管中で爆発性のアジ化銅やアジ化鉛を形成するこ とが報告されています。これらの物質の形成を防ぐため、アジ化ナトリウムを含んだ廃液は十分 量の水で洗い流して下さい。
貯法・有効期間
2~8ºC, 18 months参考文献
1. Edelman, A. M. et al. Ann. Rev. Biochem. 56, 567-613 (1987) 2. Nishizuka, Y. et al. Science 258, 607-614 (1992)
3. Johannes, F-J. et al. J. Biol. Chem. 269, 6140-6148 (1994) 4. House, C. and Kemp E. B. Science 238, 1726-1728 (1987) 5. Beavo, J. A. et al. Methods Enzymol. 38, 299-308 (1974) 6. Inagaki, M. et al. J. Biol. Chem. 260, 2922-2925 (1985)
Appendix
1) A-キナーゼサンプル
Protein Kinase: Catalytic subunit (Sigma Cat. No. P-2645) を用います。
Sigma Cat. No. P-2645 は凍結乾燥品ですので 1 mg/mL bovine serum albumin, 2 mM EGTA, 50 mM 2-mercaptoethanol, 50% (w/v) sucrose を含む溶液で溶解(たとえば、50 U/mL)して使用して 下さい。残った酵素は、凍結融解の繰り返しを避けるため適当に小分け分注し、-70ºC に保存して下 さい。活性は約3 ヶ月間安定です。 また、牛の心臓からBeavo らの方法5)で精製が可能です。 2) C-キナーゼの精製 稲垣らの方法6)に従って行って下さい。 ① ポッター型テフロンホモジナイザーを用いてラット脳をホモジナイズします。 (5 個/90 mL Buffer A、5 ストローク) ② 4ºC で、75,000 x g、90 分間遠心します。 ③ 上清をDEAE-cellulose column サンプルとします。
④ DEAE-cellulose column (2.0 x 17 cm) を Buffer B で平衡化します。
⑤ ③のサンプル(70 mL, 蛋白量 105 mg)を DEAE-cellulose column にアプライし、流速 36 mL/h で流します。
⑥ Buffer B 300 mL で DEAE-cellulose column を洗浄します。
⑦ Buffer B 500 mL で、流速 20 mL/h、0-0.4 M NaCl の濃度勾配で溶出させ、各 tube 5.5 mL で溶出分画を集めます。
⑧ MESACUP® Protein Kinase Assay Kit を用いて各分画を CaCl2及びphosphatidylserine 存在
下あるいはEGTA 存在下で C-キナーゼの活性を測定します。
C-キナーゼは、80~130 mM NaCl の間をピークとして溶出されます。
Buffer A: 25 mM Tris-HCl (pH 7.5), 50 mM 2-mercaptoethanol,
2 mM [ethylenebis(oxyethylenenitrilo)] tetraacetic acid (EGTA),
1 mM phenylmethylsulfonyl fluoride (PMSF), 0.005% leupeptin, 0.25 M sucrose.
Buffer B: 25 mM Tris-HCl (pH 7.5), 50 mM 2-mercaptoethanol, 2 mM EGTA, 0.002% leupeptin.
DEAE-cellulose (DE52); Whatman Bio Systems Ltd., England.
Phosphatidylserine (pig brain); Serdary Research Laboratories, Inc.