緒 言
現在,麻薬および向精神薬,1 年以内の新薬な ど特定の薬剤を除き,薬剤投与期間の日数制限が ない.そのため,医師の判断で長期処方が可能で ある.実際,最も多い処方期間が「5 週以上」で あるという医師が 3 割近くおり,処方期間が長期 化している.1)また慢性疾患等の患者に限ってみ ると,最も多い処方期間が「12 週以上」である と い う 医 師 が 26.1% お り, 特 に 脂 質 異 常 症 (hydroxymethylglutaryl-coenzyme A:HMG-CoA 還 元酵素阻害剤)や高血圧症(ジヒドロピリジン系 Ca拮抗剤)等については,処方期間が「8 週以上」 と回答した医師は約 8 割に達していたというアン ケート調査報告がある.1) 生活習慣病などの慢性疾患を有する患者や高齢 者は一般に服用する薬剤数が多く,薬剤の管理が 煩雑になるため,飲み忘れや飲み間違いを防ぐ等, 患者の服薬コンプライアンス向上を目的として一 包化調剤されることがある.しかしながら一包化 は, press through package(PTP)シート等を開封 し錠剤を取り出すことになるため,薬剤の吸湿, * 〒060-0812 北海道札幌市北区北12条西6丁目 40(3) 135―146 (2014)開封後のスタチン製剤の安定性に及ぼす
光・温度・湿度の影響
武隈 洋*1,高地里佳2,石坂 悠2,佐藤夕紀1,鷲見正人1,菅原 満1 北海道大学大学院薬学研究院1,北海道大学薬学部2Effects of Light, Temperature, Humidity on the
Stability of Each Opened Tablet Formula
Yoh Takekuma*1, Rika Takachi2, Haruka Ishizaka2, Yuki Sato1, Masato Sumi1 and Mitsuru Sugawara1 Faculty of Pharmaceutical Sciences, Hokkaido University 1,
School of Pharmaceutical Sciences and Pharmacy, Hokkaido University 2 Received September 19, 2013
Accepted January 24, 2014
This study determined the effects of long-term storage under various conditions after opening press through package (PTP) sheets on the stability of each tablet formula of statin for treatment of dyslipidemia and clarified the difference in stability between brand-name drugs and generic drugs.
It was demonstrated that opened Crestor® tablets were stable for one year under the conditions of diffused light at
room temperature and shielded light at room temperature. Although the content of rosuvastatin in ground Crestor®
tablets was greatly decreased after only 1 month under the condition of diffused light, it was stable for at least 3 months under shielded light, indicating that shielded light is necessary for storage of ground Crestor® tablets. Of the four tablet
formulae of simvastatin tested, only Lipola®M was within the stability standards after storage for 6 months under all
conditions. The other tablet formulae of simvastatin showed changes in hardness or elution pattern even under the condition of shielded light at room temperature, indicating that care is needed in preparing one-dose packages of these formulae. Four tablet formulae of pravastatin used in this study were stable for 6 months under shielded light at room temperature. It was also found that three of the five formulae with decreasing elution velocity contained crospovidone and that the other formulae contained no crospovidone. This decrease in elution velocity appears to be due to reduction in porosity of the tablet caused by high humidity.
含量の低下,溶出性の変化,光による変色等,多 くの問題点がある.それにもかかわらず,開封あ るいは分包状態での製剤の品質試験データは少な く,一包化調剤後の安定性が明確ではない薬剤が 多い.さらに,近年普及してきている後発医薬品 には,先発品と同じ添加剤を使用することは要求 されていないため,添加剤の組成が先発品と異な るものが多く存在し,先発品と後発品とで安定性 が異なる可能性がある. そこで本研究では,慢性疾患である脂質異常症 の治療薬であるスタチン製剤(ロスバスタチン, シンバスタチン,プラバスタチン)の PTP シー トを開封した後,種々の条件下での長期保存が製 剤に及ぼす影響を検討し,その安定性および先発 品と後発品で長期保存時の安定性が異なるのか否 かを明らかにすることを目的とした.現在市販さ れているクレストール®の剤形は錠剤のみであ り,粉末剤などほかの剤形はない.従って錠剤を 飲み込むことが困難な患者に対しては,一般的に は錠剤を粉砕し投与することになる.しかしなが ら,ロスバスタチンは吸湿性が高く,2)粉砕不可 の製剤に分類されているのが現状である.3)そこ でさらに,実際にクレストール錠を粉砕し,先の 条件で保存した場合の安定性を評価し,各保存条 件における粉砕調剤の可否についても評価した.
方 法
1.試薬ア セ ト ニ ト リ ル(high performance liquid chromatography:HPLC 用),酢酸アンモニウム(特 級)は,和光純薬工業(株)(大阪)から購入した. メタノール(HPLC 用)は関東化学(株)(東京) から,リン酸(特級)はナカライテスク(株)(京都) から購入した.その他の試薬は,すべて生化学用 または特級品を用いた. 2.対象薬剤 安定性評価の対象とした薬剤は,ロスバスタチ ン製剤 1 銘柄 2 規格(クレストール®錠 5 mg,ク レストール®錠 2.5 mg:アストラゼネカ(株),大 阪),シンバスタチン製剤 4 銘柄(リポバス®錠: MSD(株),東京;シンバスタチン錠「MEEK」: 小林化工(株),あわら;リポラ®M錠:エルメッド エーザイ(株),東京;シンバスタチン錠「マイラ ン」:マイラン製薬(株),東京),プラバスタチン 製剤 4 銘柄(メバロチン®錠:第一三共(株),東京; プラバスタチン錠「KH」:協和発酵キリン(株), 東京;リダック®M錠:エルメッドエーザイ(株), 東京;アルセチン®錠:テバ製薬(株),名古屋) である.表 1 に本研究に用いた各製剤の特徴や使 用されている添加剤の一覧を示した.2, 4-11) 3.保存方法 安定性評価の対象薬剤を,一包化した状態を想 定して PTP シートから出し,薬包紙(パラピン, 120 mm× 120 mm;(株)博愛社,東京)を用い て 1 錠ずつ包んだ.また散光条件下のみセロポリ 分包紙(薄口 20 µm;(株)ユヤマ,大阪)を用い て 1 錠ずつ分包した.それらを室温遮光条件,室 温散光(蛍光灯下,平均約 1000 lx)条件,高温 遮光(40 ºC)条件,高温遮光多湿(40 ºC,75% relative humidity: RH)条件下で一定期間保存した 後,実験に用いた. 錠剤粉砕物は,クレストール®錠 2.5 mg 錠剤を 乳棒乳鉢を用いて粉砕し,粉砕物として 60 mg ず つ秤量し,薬包紙を用いて分包した.それらを室 温遮光,室温散光,高温遮光,高温遮光多湿条件 下で 3 カ月間保存した. 4.溶出試験 溶出試験は,第十六改正日本薬局方の溶出試験 法パドル法に準拠してパドル回転速度 50 rpm で 行った.12)試験液には 20 分以上超音波処理器を用 いて脱気した超純水(37 ºC に加温)を 900 mL 用 いた.サンプリング時間は,ロスバスタチン製剤お よびプラバスタチン製剤では錠剤投入後 2,5,10, 15,30,45,60 分,シンバスタチン製剤では錠剤 投 入後 5,10,15,30,45,60,120,180 分とし, 各時点で 10 mL ずつサンプリングした.速やかに 試験液を同量補充し,採取したサンプルはただち に孔径 0.45 µm のメンブレンフィルター(mixed cellulose ester type membrane filter;アドバンテック 東洋(株),東京)でろ過した.ろ液のうち初めの 5
mLは除き,残りを薬物量の定量に供した.試験は 各製剤につき 6 錠ずつ行い,結果は製剤含量に対 する溶出量(%)で表した.なお,PTP シートのま ま室温遮光条件下で保存した錠剤をコントロール として用いた. 5.錠剤の外観観察 目視でコントロールの錠剤と比較するととも に,写真撮影した. 6.重量測定 錠剤の重量は精密天秤を用いて秤量した.測定 は各製剤につき 5 錠ずつ行い,PTP シートのまま 室温遮光条件下で保存した錠剤をコントロールと して重量変化率を求めた. 表 1 各種スタチン製剤の概要と添加剤 一般名 ロスバスタチン シンバスタチン プラバスタチン 先発品・後発品 先発品 後発品 先発品 後発品 製品名 クレスト ール®錠 5 mg クレスト ール®錠 2.5 mg リポバ ス®錠 5 mg シンバスタチン錠 「MEEK」 5 mg リポラ® M錠 5 mg シンバスタチン錠 「マイラン」 5 mg メバロ チン®錠 5 mg プラバスタ チン錠「KH」 10 mg リダック® M錠 5 mg アルセ チン®錠 5 mg 製造販売 アストラゼネカ MSD 小林化工 エルメッドエーザイ マイラン 第一三共 協和発酵キリン エルメッドエーザイ テバ 剤形 うすい赤みの黄色から くすんだ赤みの黄色の フィルムコーティング錠 白色裸錠 白色素錠 白色素錠 白色素錠 白色素錠 色素錠微紅 白色~ 微黄白色 素錠 白色素錠 直径(mm) 7 5.5 6.4 7.1 8.5 6.5 6.5 8 8 6.5 暑さ(mm) 3.8 3.1 2.4 2.8 3.5 2.3 2.1 3.5 3.2 2.2 重量(mg) 150 80 100 140 200 100 90 180 165 90
製造番号(ロット) 4890 20190 2BK18M T9DZ15 99A48S M102CRB MRA0308 150RB 95A36S A70781
添加剤 - - - - - - - - - - D-マンニトール ○ ○ ○ l-メントール ○ アスパルテーム ○ ○ オレンジ油 ○ 加工デンプン ○ 加水分解ゼラチン ○ クエン酸 ○ クロスカルメロース Na ○ クロスポビドン ◯ ◯ ○ ○ 軽質無水ケイ酸 ○ ケイ酸 Ca ○ 酸化チタン ◯ ◯ ジブチルヒドロキシトルエン ○ ジメチルポリシロキサン ○ ステアリン酸 Mg ◯ ◯ ○ ○ ○ ○ ○ ○ ステビア抽出精製物 ○ セルロース ◯ ◯ ○ 結晶セルロース ○ ○ 第三リン酸 Ca ◯ ◯ 無水リン酸水素 Ca ○ トリアセチン ◯ ◯ 乳糖水和物 ◯ ◯ ヒドロキシプロピルスターチ ○ ○ ヒドロキシプロピルセルロース ○ ○ 低置換度ヒドロキシプロ ピルセルロース ○ ○ トウモロコシデンプン ○ ヒプロメロース ◯ ◯ ブチルヒドロキシアニソール ○ ○ ○ ポリビニルアルコール ○ ○ メタケイ酸アルミン酸 Mg ○ ○ 黄色三二酸化鉄 ○ 三二酸化鉄 ◯ ◯ ○ 乳糖 ○ 乳糖水和物 ○ ○ ○ ○ 部分アルファー化デンプン ○ 香料 ○
7.硬度測定 錠剤の硬度はモンサント硬度計を用いて測定し た.測定は各製剤につき 5 錠ずつ行い,PTP シー トのまま室温遮光条件下で保存した錠剤をコント ロールとして硬度変化率を求めた. 8.粉砕したクレストール®錠の含量測定 クレストール®錠粉砕物を 10 mg 秤量し,50 mLメスフラスコを用いて超純水で溶解,メス アップした.この溶液 10 mL を,孔径 0.45 µm の メンブレンフィルターでろ過し,不溶性残渣を除 去した.ろ液のうち初めの 5 mL は廃棄し,残り を薬物量の定量に用いた.定量には HPLC 法を 用いた.なお PTP シートのまま室温遮光条件下 で保存した錠剤を粉砕し,同様の操作を行ったも のをコントロールとして用いた.コントロールの HPLCピーク面積を 100%として,含量を示した. 9.薬物の定量 薬物の定量は,すべて HPLC 法により行った. 分析カラムには,Inertsil ODS-4(3 µm, 3.0 mm × 150 mm;ジーエルサイエンス(株),東京)を用い, 40 ℃で使用した.移動相には,2.5 mM 酢酸アン モニウム水溶液:アセトニトリル = 2:1(ロス バスタチン),0.1% リン酸水溶液:アセトニトリ ル = 1:4(シンバスタチン),2.5 mM 酢酸ア ンモニウム水溶液:アセトニトリル = 72:28(プ ラバスタチン)をそれぞれ用い,流速 0.4 mL/min で送液した.HPLC 注入量は 17 µL とし,波長 238 nmで検出した. 10.評価基準 本研究での溶出試験の規格基準には,後発医薬 品の生物学的同等性試験ガイドラインの基準を採 用した.13)すなわち,標準製剤(本試験ではコン トロール)が 15 分以内に平均 85%以上溶出する 場合,試験製剤が 15 分以内に平均 85%以上溶出 するか,又は 15 分における試験製剤の平均溶出 率が標準製剤の平均溶出率 ± 15%の範囲にあれ ば溶出挙動は規格基準内であるとした.製剤中の 成分含量については,コントロールの 95%以上 を規格基準内とした.錠剤の硬度については,日 本病院薬剤師会学術第 5 小委員会による「錠剤・ カプセル剤の無包装状態での安定性試験法につい て(答申)」14)に記載された評価基準を採用した. すなわち,硬度変化が 30%未満の場合を変化な し,硬度変化が 30%以上で,硬度が 2.0 kgf 以上 の場合を変化あり(規格内),硬度変化が 30%以 上で,硬度が 2.0 kgf 未満の場合を変化あり(規 格外)と評価した.
結 果
1.ロスバスタチン製剤 室温散光,室温遮光,高温遮光,高温遮光多湿 の各条件下で 12 カ月間保存したロスバスタチン 製剤(クレストール®錠 5 mg,2.5 mg)の溶出試 験の結果を図 1 に示す.両規格ともコントロー 図 1 各種条件下で 12 カ月間保存したクレストール®錠の溶出試験結果 (A)5 mg 錠,(B)2.5 mg 錠.■コントロール,◯室温散光,●室温遮光,▲高温遮光,△高温遮光多湿. 各点は平均 ± 標準偏差を示す.(n = 6)ルは崩壊および溶出が非常に速く,約 10 分で完 全に溶出した.室温散光,室温遮光条件下で保存 した錠剤の溶出挙動はコントロールと比較して変 化がなかった.一方,高温遮光多湿条件下で保存 した錠剤は溶出速度が著しく低下し,両規格とも 溶出試験終了時でも完全には崩壊していなかっ た.また高温遮光保存した錠剤においては 60 分 での累積溶出率が 5~10%低下しており,含量の 低下が示された. 次に溶出速度が低下した高温遮光多湿保存およ び含量が低下した高温遮光保存について,溶出挙 動の経時変化を検討するため,1,3,6 カ月間保 存した錠剤の溶出試験を行った.その結果,高温 遮光多湿保存では溶出速度が経時的に低下してい ることが明らかとなった(図 2-A, C).一方,高 温遮光条件下では含量が経時的に低下しているこ とが示された(図 2-B, D). 各条件下で 1 年間保存したクレストール®錠の 外観は,いずれの保存条件下においても変化はみ られなかった(データは示さない).また,同様 に 1 年間保存したクレストール®錠の重量変化は, いずれの規格,保存条件下でも± 1.5%以内であ り,著しい変化は認められなかった(表 2).ま た硬度変化は,いずれも「変化なし」あるいは「変 化あり(規格内)」であった(表 3). クレストール®錠 2.5 mg の粉砕後の安定性につ いては,各種条件下で 1~3 カ月間保存した結果, いずれのサンプルもコントロールと比較して色調 に著しい変化はなかった.しかしながら,粉砕し たこれらの製剤中の含量を測定したところ,室温 散光条件下で保存した粉末中の含量が 1 カ月間保 存で 81.1%,3 カ月間保存では 50.6%と経時的に 著しく低下していた(図 3).一方,室温遮光, 高温遮光,高温遮光多湿条件下で保存した粉末の 含量はほとんど変化していなかった. 図 2 高温遮光多湿および高温遮光条件下で保存したクレストール錠の溶出挙動の経時変化 (A)高温遮光多湿 2.5 mg 錠,(B)高温遮光 2.5 mg 錠,(C)高温遮光多湿 5 mg 錠 ,(D)高温遮光 5 mg 錠. ◯ 2.5 mg コントロール,◇ 2.5 mg 錠 1 カ月保存,□ 2.5 mg 錠 3 カ月保存,△ 2.5 mg 錠 6 カ月保存,× 2.5 mg錠 1 年保存;● 5 mg 錠コントロール,◆ 5 mg 錠 1 カ月保存,■ 5 mg 錠 3 カ月保存,▲ 5 mg 錠 6 カ月保存, × 5 mg 錠 1 年保存.各点は平均 ± 標準偏差を示す.(n = 6)
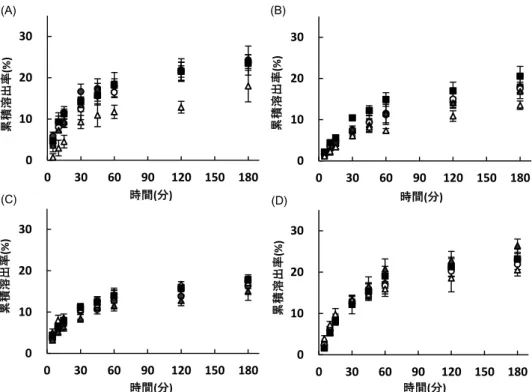
2.シンバスタチン製剤 各種シンバスタチン製剤をロスバスタチンと同 じ条件で 6 カ月間保存した後,溶出試験を行った 結果を図 4 に示す.シンバスタチンは水にほと んど溶けないため,15)いずれも累積溶出率は低い 結果となった.この中でも高温遮光多湿保存した リポバス®錠,シンバスタチン錠「MEEK」の試 験開始後 180 分での累積溶出率がコントロールと 比較して大きく低下した.なお,いずれの保存条 件下においても製剤含量は 95%以上(規格内) であることを確認した(データは示さない). 高温遮光多湿条件下で溶出速度が低下したリポ バス®錠,シンバスタチン錠「MEEK」について, 溶出挙動の経時変化をみるため,1 および 3 カ月 間保存した錠剤の溶出試験を行った.その結果, 両製剤ともに高温遮光多湿条件下で保存した場 合,経時的に溶出速度が低下することが明らかと なった(図 5). さらに,高温遮光多湿保存したリポバス®錠, シンバスタチン錠「MEEK」に著しい外観変化 が認められた.両製剤ともに,白色から淡褐色に 変色し,保存期間が長くなるにつれその色は濃く なっていた(図 6).またシンバスタチン錠「マ イラン」にも若干の外観変化がみられた(図 6). 各条件下で 6 カ月間保存したシンバスタチン製 剤の重量測定の結果,重量変化はいずれの保存条 件下でも± 1.1%以内であり,著しい変化は認め られなかった(表 4). 各種条件下で 6 カ月間保存したシンバスタチン 製剤の硬度測定の結果を表 5 に示す.硬度が低 図 3 各種条件下におけるクレストール®錠粉末の 含量の経時変化 表 2 各種条件下で 6 カ月および 12 カ月間保存したクレストール®錠の重量(上段)およびその変化率(下段) 保存期間 単位 コントロール 室温遮光 室温散光 高温遮光 高温遮光多湿 クレストール®錠 5 mg 6カ月 mg 156.0 ± 0.9 155.4 ± 0.6 155.7 ± 1.2 154.8 ± 1.6 158.0 ± 1.2 % - - 0.4 - 0.2 - 0.8 1.3 12カ月 mg% 157.2 -± 1.3 156.1 ± 1.3 155.2 ± 0.5 155.3 ± 0.8 158.8 ± 2.4 - 0.7 - 1.3 - 1.2 1.0 クレストール®錠 2.5 mg 6カ月 mg 78.3 ± 0.7 78.2 ± 0.8 77.8 ± 0.6 77.3 ± 0.8 79.5 ± 0.6 % - - 0.1 - 0.6 - 1.3 1.5 12カ月 mg% 79.0 ± 2.3- 78.8 ± 0.7 78.3 ± 1.0 79.1 ± 1.3 79.1 ± 1.2 - 0.3 - 0.9 0.1 0.1 重量値は平均 ± 標準偏差を示す.(n = 5) 表 3 各種条件下で 6 カ月および 12 カ月間保存したクレストール®錠の硬度(上段)およびその変化率(下段) 保存期間 単位 コントロール 室温遮光 室温散光 高温遮光 高温遮光多湿 クレストール®錠 5 mg 6カ月 kgf% 7.16 ± 1.05- 6.09 ± 0.63 7.79 ± 1.47 7.94 ± 1.70 5.17 ± 0.52 - 14.9 8.8 11.0 - 27.7 12カ月 kgf 8.18 ± 1.11 6.95 ± 0.79 6.24 ± 0.32 8.32 ± 0.78 4.82 ± 0.77 % - - 15.3 - 23.7 1.7 - 41.1 クレストール®錠 2.5 mg 6カ月 kgf% 4.74 ± 0.76- 3.51 ± 0.56 4.06 ± 0.73 3.97 ± 0.61 3.62 ± 0.35 - 25.9 - 14.3 - 16.2 - 23.6 12カ月 kgf 4.86 ± 0.42 4.03 ± 0.69 3.52 ± 0.30 4.73 ± 0.72 2.46 ± 0.24 % - - 17.1 - 27.6 - 2.7 - 49.4 重量値は平均 ± 標準偏差を示す.(n = 5)
図 4 各種条件下で 6 カ月間保存したシンバスタチン製剤の溶出試験結果 (A)リポバス®錠,(B)シンバスタチン錠「MEEK」,(C)リポラ®M錠,(D)シンバスタチン錠「マ イラン」.■コントロール,◯室温散光,●室温遮光,▲高温遮光,△高温遮光多湿.各点は平均 ± 標準偏差を示す.(n = 6) 図 5 高温遮光多湿条件下で保存した(A)リポバス®錠および(B)シンバスタチン錠「MEEK」 の溶出挙動の経時変化 ■コントロール,◇ 1 カ月保存,▲ 3 カ月保存,◯ 6 カ月保存 .各点は平均 ± 標準偏差を示す.(n = 6) 下した製剤・保存条件は多数存在し,なかでもリ ポバス®錠とシンバスタチン錠「マイラン」で規 格外の変化が認められた.しかしながら,硬度変 化と溶出速度に相関はみられなかった. またシ ンバスタチン錠「MEEK」は著しい硬度変化は 認められなかったものの,コントロールの硬度が 2.0 kgf未満であり,物理的に弱い可能性が示唆 された. 3.プラバスタチン製剤 各種プラバスタチン製剤をロスバスタチンと同 様の条件で 6 カ月間保存した後,溶出試験を行っ た(図 7).その結果,コントロールはいずれの 製剤も溶出が速かったものの,高温遮光多湿保存 したプラバスタチン錠「KH」の溶出速度がコン トロールと比較して著しく低下した(図 7-B). また,高温遮光多湿保存したメバロチン®錠の溶
表 5 各種条件下で 6 カ月間保存したシンバスタチン製剤の硬度(上段)およびその変化率(下段) コントロール 室温遮光 室温散光 高温遮光 高温遮光多湿 リポバス®錠 kgf 3.04 ± 0.78 1.53 ± 0.17 2.39 ± 0.24 1.68 ± 0.13 1.03 ± 0.13 % - - 49.8 - 21.3 - 44.7 - 66.3 シンバスタチン錠 「MEEK」 kgf 1.65 ± 0.25 1.33 ± 0.11 1.33 ± 0.11 1.44 ± 0.17 1.78 ± 0.16 % - - 19.5 - 19.8 - 12.9 7.9 リポラ®M錠 kgf 5.43 ± 0.30 5.06 ± 0.28 5.29 ± 0.24 5.22 ± 0.28 5.01 ± 0.28 % - - 6.9 - 2.5 - 3.9 - 7.8 シンバスタチン錠 「マイラン」 kgf 3.44 ± 0.27 1.82 ± 0.07 3.10 ± 0.21 1.65 ± 0.04 1.14 ± 0.13 % - - 46.9 - 9.9 - 52.1 - 67 硬度値は平均 ± 標準偏差を示す.(n = 5) 表 4 各種条件下で 6 カ月間保存したシンバスタチン製剤の重量(上段)およびその変化率(下段) コントロール 室温遮光 室温散光 高温遮光 高温遮光多湿 リポバス®錠 mg 99.8 ± 0.6 100.5 ± 0.5 99.9 ± 1.0 99.4 ± 0.5 100.2 ± 0.9 % - 0.7 0.1 - 0.4 0.4 シンバスタチン錠 「MEEK」 mg 142.2 ± 0.8 141.2 ± 1.2 141.4 ± 0.15 140.6 ± 0.6 143.2 ± 1.0 % - - 0.7 -0.5 - 1.1 0 リポラ®M錠 mg 200.3 ± 2.0 199.6 ± 1.8 199.7 ± 3.4 199.5 ± 1.8 199.3 ± 1.9 % - - 0.3 - 0.3 - 0.4 - 0.5 シンバスタチン錠 「マイラン」 mg 100.4 ± 2.4 101.1 ± 1.2 100.8 ± 1.4 100.3 ± 0.6 100.5 ± 0.7 % - 0.7 0.4 - 0.1 0.1 重量値は平均 ± 標準偏差を示す.(n = 5) 図 6 高温遮光多湿保存により着色が視認されたシンバスタチン製剤の外観変化 (A)リポバス®錠,(B)シンバスタチン錠「MEEK」,(C)シンバスタチン錠「マイラン」.左 1 カ月保存,中央 3 カ月保存,右 6 カ月保存.
出速度の低下および室温散光保存したリダック® M錠の含量の低下が観察された(図 7-C). 高温遮光多湿条件下で溶出速度が低下したメバ ロチン®錠およびプラバスタチン錠「KH」につ いて,溶出挙動の経時変化をみるため,1 および 3カ月間保存した錠剤の溶出試験を行った.その 結果,メバロチン®錠は,高温遮光多湿条件下に おいて 1 カ月間および 3 カ月間保存した場合と 6カ月間保存した場合とでは,溶出挙動に大きな 差異はみられず,1 カ月間でも高い湿気に曝され ると溶出速度が低下する製剤であることが明らか となった(図 8-A).またプラバスタチン錠「KH」 は,コントロールは非常に溶出が速いものの,高 温遮光多湿条件下において経時的に溶出速度が低 下し,1 カ月間の保存でも溶出試験開始 15 分で の溶出率が 85%以下となり,コントロールとの 溶出挙動の同等性が失われていた(図 8-B). プラバスタチン製剤でも,外観に変化が認めら 図 7 各種条件下で 6 カ月間保存したプラバスタチン製剤の溶出試験結果 (A)メバロチン®錠,(B)プラバスタチン錠「KH」,(C)リダック®M錠,(D)アルセチン®錠. ■コントロール,◯室温散光,●室温遮光,▲高温遮光,△高温遮光多湿.各点は平均 ± 標準 偏差を示す.(n = 6) 図 8 高温遮光多湿条件下で保存した(A)メバロチン®錠および(B)プラバ スタチン錠「KH」の溶出挙動の経時変化 ■コントロール,◇ 1 カ月保存,▲ 3 カ月保存,◯ 6 カ月保存.各点は平均 ± 標準偏差を示す. (n = 6)
れた製剤が複数あった.室温散光保存したアルセ チン®錠に著しい外観変化が認められ,光に曝され ていた面が白色から灰色に変色していた.またコン トロールと比較すると室温散光保存したリダック® M錠も若干白色からくすんだ灰色~淡桃色に変色 していることが視認できた(データは示さない). 各条件下で 6 カ月間保存したプラバスタチン製 剤の重量変化はいずれの保存条件下でも± 2.2% 以内であり,著しい変化は認められなかった (表 6).またそれぞれの製剤において硬度が低下 した保存条件があったものの,いずれも規格内の 変化であった(表 7).
考 察
クレストール®錠の安定性の検討において, 1年保存で規格外となった保存条件は,高温遮光 多湿および高温遮光条件であった.高温遮光多湿 条件下で保存したクレストール®錠の溶出率は試 験開始 15 分で 85%以下となり,コントロールと の溶出挙動の同等性が失われていた.しかしなが ら,6 カ月以内の保存であれば高温遮光多湿条件 下でも 15 分での溶出率が 85%以上となったこと から,クレストール®錠は高温遮光多湿条件下で 2.5 mgおよび 5 mg の両規格とも少なくとも 6 カ 月間は規格基準内であった.一方,高温遮光条件 下では溶出挙動に変化は認められなかったものの 5~10%の含量低下が観測された.しかしながら, 6カ月以内の保存であれば高温遮光条件下でも含 量が 95%以上となったことから,クレストール® 錠は高温遮光条件下でも少なくとも 6 カ月間は規 格基準内であった. 高温遮光多湿条件は高温遮光条件より苛酷であ るため,高温遮光保存した製剤より高温遮光多湿 保存した製剤の含量がより大きく低下すると予測 していたが,本検討では高温遮光保存した製剤の ほうがより含量が低下していた.クレストール® 錠に含有されているクロスポビドンは高分子化合 物であり,この物質中には合成過程や保存中に生 じた過酸化物やフリーラジカルが存在している. この過酸化物について,「クロスポビドンの構造 類似物であるポリビニルピロリドン(ポビドン) 中の過酸化物濃度は,多湿な環境で保存すると低 下し,乾燥した環境で保存すると上昇する,また 表 6 各種条件下で 6 カ月間保存したプラバスタチン製剤の重量(上段)およびその変化率(下段) コントロール 室温遮光 室温散光 高温遮光 高温遮光多湿 メバロチン®錠 mg 91.1 ± 1.2 91.6 ± 1.0 90.0 ± 0.5 90.3 ± 1.0 91.3 ± 0.7 % - 0.5 - 1.2 - 0.9 0.2 プラバスタチン錠 「KH」 mg 180.1 ± 1.1 182.0 ± 1.0 179.6 ± 1.0 181.2 ± 0.8 181.0 ± 1.0 % - 1.1 - 0.3 0.6 0.5 リダック®M錠 mg 164.8 ± 1.2 166.4 ± 1.0 167.4 ± 1.9 165.0 ± 1.5 166.4 ± 0.7 % - 0.9 1.6 0.1 0.9 アルセチン®錠 mg 91.7 ± 0.7 90.5 ± 0.3 92.2 ± 0.2 89.7 ± 0.1 90.9 ± 0.7 % - - 1.4 0.5 - 2.2 - 1.0 重量値は平均 ± 標準偏差を示す.(n = 5) 表 7 各種条件下で 6 カ月間保存したプラバスタチン製剤の硬度(上段)およびその変化率(下段) コントロール 室温遮光 室温散光 高温遮光 高温遮光多湿 メバロチン®錠 kgf 3.48 ± 0.03 2.25 ± 0.12 2.37 ± 0.19 2.28 ± 0.04 2.69 ± 0.13 % - - 35.5 - 32 - 34.6 - 22.8 プラバスタチン錠 「KH」 kgf 4.67 ± 0.21 3.14 ± 0.16 4.03 ± 0.29 2.63 ± 0.13 3.08 ± 0.17 % - - 32.8 - 13.7 - 43.7 - 34.2 リダック®M錠 kgf 3.99 ± 0.77 4.20 ± 0.58 3.94 ± 0.87 4.80 ± 0.59 4.38 ± 0.64 % - 5.2 - 1.4 20.1 9.7 アルセチン®錠 kgf 2.43 ± 0.12 2.22 ± 0.08 1.80 ± 0.15 2.61 ± 0.31 1.83 ± 0.07 % - - 8.4 - 25.9 7.7 - 24.8 硬度値は平均 ± 標準偏差を示す.(n = 5)保存温度が高いほど多湿環境では過酸化物濃度の 低下幅,低湿度環境では過酸化物濃度の上昇幅が 大きくなる」との報告がある.16)従って,本検討 でクレストール®錠の成分含量が多湿条件下より も常湿条件下のほうが大きく低下した要因とし て,上記の報告と同様に錠剤中のクロスポビドン の過酸化物量が常湿条件下の方が多湿条件下より も多く発生し,そのためロスバスタチンの酸化分 解が進み,含量の低下が引き起こされた可能性が 考えられる. 一方,クレストール®錠を粉砕して保存した場 合,光による影響が顕著に現れ,散光条件下での み著しい含量の低下が認められた.ロスバスタチ ンを,紫外光透過蓋付シャーレに入れ,25 ºC, 120万 lx・h の光を照射したところ有機不純物の 増加,主薬含量の低下がみられたとの報告がある が,2)本研究においても光に対して不安定である ことが示された.さらに,クレストール®錠はフィ ルムコート製剤であるため,粉砕によりフィルム が破砕されたことが,錠剤に比べ著しい含量の低 下につながったものと考えられる.以上のことか ら,クレストール®錠を粉砕した場合,光により 著しく含量は低下するが,遮光すれば少なくとも 3カ月間は安定であり,粉砕調剤可能であること が示唆された. 高温遮光多湿条件保存下で外観に変色のみられ たシンバスタチン製剤のうち,シンバスタチン錠 「MEEK」の変色は報告されているが,6)リポバス® 錠,シンバスタチン錠「マイラン」については報 告がない.変色の明確な原因は不明であるが,シ ンバスタチン錠「MEEK」の変色の報告と共に, 類縁物質の規格外の増加が認められたとの記載が あることから,錠剤の変色は主薬が分解したため に発生した可能性も考えられる.一方,室温散光 条件保存下で外観に変色が見られたプラバスタチ ン製剤のアルセチン®錠とリダック®M錠のうち アルセチン®錠の変色は報告されているが,8)変色 の明確な原因は不明である.両製剤に共通してい る特徴的な添加剤はないものの,主薬が同一でも 変色しない銘柄もあることから,添加剤の組成を 調整する等,製剤化の工夫で防ぐことができるも のと考えられる. シンバスタチン製剤,プラバスタチン製剤の安 定性試験結果より,主薬が同一でも製剤によって 安定性が異なることが明らかとなった.各製剤に 含まれている添加剤を比較したところ,高温遮光 多湿条件下で保存した場合に溶出速度が大きく低 下した製剤のなかでクレストール®錠(ロスバス タチン製剤),リポバス®錠(シンバスタチン製剤), プラバスタチン錠「KH」(プラバスタチン製剤) の 3 製剤に,崩壊剤であるクロスポビドンを含有 しており,ほかの製剤には使用されていないこと が判明した.クロスポビドンは N-ビニル-2-ピロリ ドンが架橋重合した高分子化合物であり,水には 溶解しないが水を吸収して膨潤する性質がある. 膨潤速度が速く,膨潤圧が大きいため超崩壊剤と して広く用いられている.17, 18)Fitzpatrickらは,ポ ビドン(クロスポビドンの構造類似物であり,錠 剤の賦形剤や結合剤に用いられる)を含む製剤を 高温多湿条件下で保存すると孔構造が失われるこ とで溶出率・溶出速度が低下すると報告してい る.19)本研究において,クロスポビドンを含む製 剤に関しても同様の現象によって溶出速度が低下 した可能性があるが,さらに詳細な検討が必要で ある. また,高温遮光多湿条件下で保存した場合に溶 出速度が低下した製剤のなかでクロスポビドンが 含まれていないのはメバロチン®錠とシンバスタ チン錠「MEEK」である.メバロチン®錠と添加 剤の成分構成が全く同一のアルセチン®錠が溶出 速度の低下が見られておらず,製造工程もしくは 含量組成の違いが要因と考えられる.今回検討し た製剤の中でシンバスタチン錠「MEEK」のみ に使用されている添加剤は,オレンジ油,無水リ ン酸水素カルシウム,部分アルファー化デンプン であった.一般に,オレンジ油は矯臭剤として, 部分アルファー化デンプンは結合剤や崩壊剤とし て錠剤に添加される.20)無水リン酸水素カルシウ ムは,一般的に賦形目的で用いられるが,比表面 積を高めたフジカリン®(富士化学工業(株),富 山県中新川郡)では崩壊剤として用いられること も あ る(http://www.fujicalin.com/product/). 製 薬 メーカーから公開されている情報だけでは,無水 リン酸水素カルシウムの種類までは不明である
が,多湿により崩壊能に変化が生じた可能性も考 えられる. 本研究の結果から,今回検討対象としたロスバ スタチン製剤は PTP から開封しても室温散光条 件下で 1 年間安定であることが示され,一包化調 剤後でも患者が通常家庭内で保存する分には大き な問題は生じないことが示唆された.一方,粉砕 調剤時には遮光保存が必須条件であることが示さ れ,臨床現場でやむを得ず粉砕調剤後に交付する 場合には,患者に対し保管条件を十分に説明する 必要があると考えられる.今回検討対象としたシ ンバスタチン製剤については,6 カ月間保存した 場合,すべての条件下で安定であったのは 1 製剤 のみであった.本検討では,PTP から開封した錠 剤を分包紙で密封せずに薬包紙で包み保存してい るので,一般の保管条件よりは厳しいため,必ず しも一包化調剤に不適であるわけではないが,シ ンバスタチン製剤については個別に十分留意が必 要になると思われる.一方,今回検討対象とした プラバスタチン製剤については,すべての製剤に おいて室温遮光条件下で 6 カ月間安定であること が示されたが,散光条件下では一部の製剤に変色 が確認されたことから,薬剤交付時には遮光状態 が望ましいと考えられる.
引用文献
1) 前田由美子, 長期処方についてのアンケート調 査報告- 6 道県におけるパイロットスタディ-, 日医総研ワーキングペーパー, 2010, No225. 2) クレストール®インタビューフォーム改訂第10 版, アストラゼネカ株式会社, 2011. 3) 佐川賢一, 木村利美, “錠剤・カプセル剤粉砕ハ ンドブック第 6 版”, じほう, 東京, 2012, pp120-121. 4) シンバスタチン錠「マイラン」インタビュー フォーム第10版, マイラン製薬株式会社, 2012. 5) リポラ®M錠インタビューフォーム第 6 版, エル メッドエーザイ株式会社, 2012. 6) シンバスタチン錠「MEEK」インタビューフォー ム改訂第10版, 小林化工株式会社, 2013. 7) リポバス®錠インタビューフォーム改訂第18版, MSD株式会社, 2012. 8) アルセチン®錠インタビューフォーム改訂第 3 版, テバ製薬株式会社, 2012. 9) リダック®M錠インタビューフォーム第 3 版, エ ルメッドエーザイ株式会社, 2011. 10) プラバスタチン錠「KH」インタビューフォー ム2011年11月改訂版, 協和発酵キリン株式会社, 2011. 11) メバロチン®錠インタビューフォーム第 8 版, 第 一三共株式会社, 2011. 12) “第十六改正日本薬局方”, 日本公定書協会編, じ ほう, 東京, 2011, pp117-121. 13) 平成24年 2 月29日, 0229 第10号, 医薬品の生物 学的同等性試験ガイドライン, (薬食審査発). 14) 西岡 豊, 平成11年 8 月20日付「錠剤・カプセル 剤の無包装状態での安定性試験法について(答 申)」, 錠剤・カプセル剤の無包装状態での安定 性情報改訂 5 版, 医薬ジャーナル社, 大阪, 2007, pp369-371. 15) “第十六改正日本薬局方”, 日本公定書協会編, じ ほう, 東京, 2011, pp735-736.16) Narang AS, Rao VM and Desai DS, Effect of anti-oxidants and silicates on peroxides in povidone,
J Pharm Sci, 2012, 101, 127-139.
17) Shah U, Augsburger L, Evaluation of the functional equivalence of crospovidone NF from different sources. I. Physical characterization, Pharm Dev
Technol, 2001, 6, 39-51.
18) Bühler V, ed “Kollidon® - Polyvinylpyrrolidone
ex-cipients for the pharmaceutical industry”. 9th re-vised edition, Ludwigshafen, Germany, 2008, pp11-14.
19) Fitzpatrick S, McCabe JF, Petts CR, Booth SW, Ef-fect of moisture on polyvinylpyrrolidone in acceler-ated stability testing, Int J Pharm, 2002, 246, 143-151.
20)上釜兼人, 川島嘉明, 松田芳久, “最新製剤学”, 廣 川書店, 東京, 2001, pp348-359.