■
オリザセラミド
®-PT,PCD,P8T,P20CD
(粉末,食品用途)
■オリザセラミド
®-WSP,WSP8
(水溶性粉末,食品用途)
■オリザセラミド
®-PC,PC8,PC20
(粉末,化粧品用途)
■オリザセラミド
®-LC,LC0.8
(液体,化粧品用途)
■オリザセラミド
®-L,L0.8
(液体,食品用途)
■オリザセラミド
®-WSPC,WSPC8
(水溶性粉末,化粧品用途)
美容食品素材
化粧品素材
オリザセラミド
®
ORYZA CERAMIDE
美容食品素材
オリザセラミド
®ORYZA CERAMIDE
1. はじめに
米は,わが国において唯一の穀物資源として昔から多く栽培され,人々の食生活
を支えてきました。近年,米及び米ぬかに含まれている生理活性物質について多く
の関心が集まっています。我々は米ぬか及び米胚芽に関して長年に渡って研究開発
を行い,その中から,γ-オリザノール,トコフェロール,トコトリエノール,ス
テロール,フェルラ酸及びスクワラン等数多くの有効成分を抽出し,製品化してき
ました。これらの製品がすでに医薬品,健康食品,食品添加物,化粧品用素材とし
て高く評価され,広い分野で応用されています。
化粧品用素材としては,合成セラミドやウシ由来セラミドが利用されていますが,
動物愛護の観点や狂牛病の原因であるプリオン型ウイルス感染を予防するため,米
や小麦など植物性セラミドが利用されています。セラミドは化粧品だけでなく,美
容食品素材としても多く利用されています。弊社は,植物セラミドのパイオニアと
して,十余年にわたってコメ由来セラミド(オリザセラミド
®)を販売してまいり
ました。
2. オリザセラミド
®とは
オリザセラミド
®は米ぬか及び米胚芽から抽出,精製された製品です。この製品
には米由来スフィンゴ糖脂質が多く含まれています。米由来スフィンゴ脂質は動物
性スフィンゴ脂質と同様に,長鎖塩基スフィンゴシンに脂肪酸が酸アミド結合した
疎水性セラミドが基本骨格となっています。米由来スフィンゴ脂質は長鎖塩基ス
フィンゴシン及び脂肪酸の炭素数の違い,水酸基や二重結合の有無により分子種に
多様性があり,帯広畜産大学
藤野教授らの報告では少なくとも 20 種類以上のス
フィンゴ脂質分子種が存在します。
我々は各種クロマトグラフィー及び
NMR 分析よりオリザセラミドの構造解析を
行い,
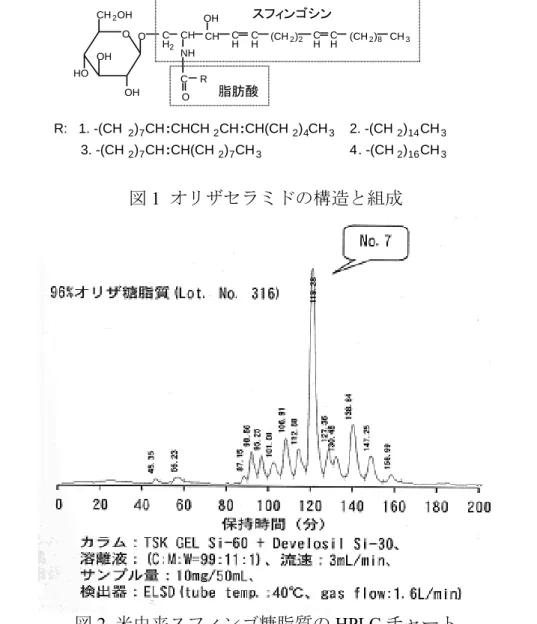
4 種類のスフィンゴ糖脂質 (図 1) の化学構造を明らかにしました。
図
1 オリザセラミドの構造と組成
図
2 米由来スフィンゴ糖脂質の HPLC チャート
さらに近年,北海道大学大学院薬学研究科
五十嵐教授らとの共同研究により,
含量が多いと予想される米由来スフィンゴ糖脂質 (図 2 の No.7) について化学構造
の解析を試み,主スフィンゴ糖脂質の平面構造を決定しました。その後,京都薬大
との共同研究により,コメ由来セラミドの主成分の構造を図
3 のように決定してい
ます。
R: 1. -(CH 2)7CH :CHCH2CH:CH(CH2)4CH3 3. -(CH2)7CH :CH(CH2)7CH3 4. -(CH2)16CH3 2. -(CH2)14CH3 O O OH OH HO CH2OH C H2 CH NH C R O CH C H OH C H (CH2)2 C H C H (CH2)8 CH3 スフィンゴシン 脂肪酸3. 生体内におけるセラミドの役割
セラミドは
1884 年にドイツの医師 Thudichum によってヒト脳中から単離同定さ
れました。その後,120 年あまりの間で皮膚や細胞膜にもセラミドが存在すること
が明らかにされ,生体における生理的役割や薬理的応用に関する研究が進められて
きました。
人の皮膚は皮下組織,真皮,表皮からなります。表皮はさらに,生体内部側 (真
皮側
) より基底層,有棘層,顆粒層,角質層に分類されます。
各層毎に脂質の構成成分は異なり,基底層ではリン脂質及びコレステロールが主
成分として存在します。基底層から顆粒層の間ではグルコシルセラミド含量が増加
し,角質層ではほとんど消失します。グルコシルセラミドを前駆体として生成した
セラミドは角質層に蓄積し (図 4),角質細胞間脂質の主成分として 40~60 %を占め
ます
(図 5)。
図
4 表皮の構造及びセラミドの代謝
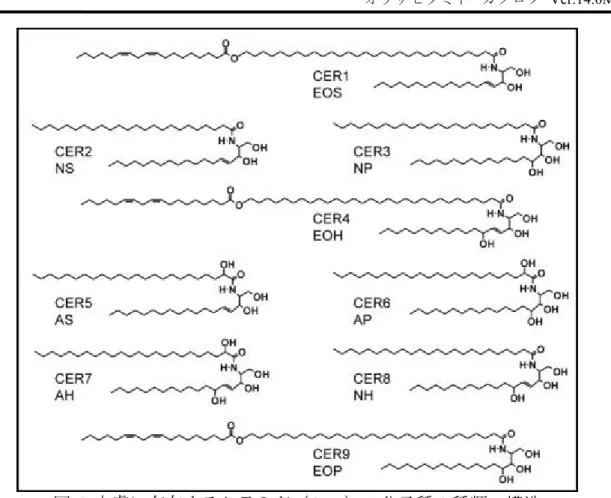
また,皮膚に存在するセラミドは単一分子種ではなく,
9 種類以上の異なったセ
ラミド分子種から構成されています (図 6)。これらのセラミドが,表皮のラメラ構
造の形成と安定,水分の保持及び異物侵入防止などのバリアー機能維持に重要な役
割を果たしています。
角質層 (角質細胞) 顆粒層 (顆粒細胞) 有棘層 (有棘細胞) 基底層 (基底細胞) セラミド 糖 UDP-Glc Acyl-CoA 糖セラミド セラミド スフィンゴ シン 主成分 主成分セラミド
40%
24%
コレステロールエステル
10%
その他
26%
図
5 角質層細胞間脂質の組成
コレステロール
図
6 皮膚に存在するセラミド(CER)の分子種 9 種類の構造
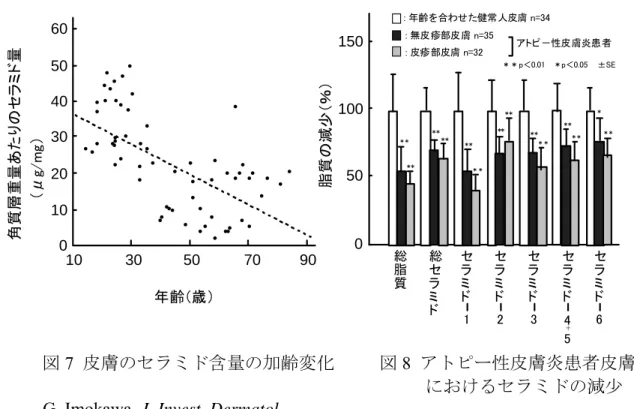
また芋川らは,加齢に伴って角質層重量あたりの角質細胞間脂質量は有意に減少
し,中でも主成分のセラミドの減少が最も多いことを報告しています (図 7) 。そ
の結果,角質層の保水及びバリアー機能が低下し,皮膚は乾燥,しわ,肌荒れ状態
になりやすいと考えられています。
さらに,芋川らは,乾燥落屑皮膚疾患の一つであるアトピー性皮膚炎患者におい
て,皮疹部および非皮疹部におけるセラミド含量が健常者よりかなり減少している
こと,及びセラミドの補充によって皮膚の乾燥症状や角質層の過度の剥離が改善さ
れることを確認し,角質層セラミドの不足がアトピー性皮膚炎の一員であると考え
ています
5)(図 8)。
よって,皮膚のセラミド含量は皮膚の健康や若さの指標になり得ると考えられ,
日常のセラミドの補充が皮膚恒常性維持に最も効果的,かつ必要と思われます。
以上に述べた機能性のほか,セラミドは皮膚に優れたアレルゲン耐性を付与する
こと
(Lati ら,臨床試験
4)),植物性セラミドには遊離基抑制活性 (抗酸化作用) や
エラスターゼ,コラゲナーゼ,チロシナーゼなどの酵素抑制活性もあることから,
オリザセラミド
®の利用は皮膚の老化やストレスの予防にも役立つことが期待され
ます。
図
7 皮膚のセラミド含量の加齢変化 図 8 アトピー性皮膚炎患者皮膚
におけるセラミドの減少
G. Imokawa, J. Invest. Dermatol.,
96, 523, 1991 より
4. スフィンゴ脂質の消化,吸収,代謝
食物由来スフィンゴ脂質の消化,吸収,代謝について,
Schmelz らは,ラベルし
たスフィンゴミエリンをモデルマウスに投与し,腸管におけるスフィンゴ脂質の代
謝と分布を検討しました。その結果,腸管のどの部位でもスフィンゴミエリンが出
現し,スフィンゴミエリンの多くはセラミド及び,その代謝物に分解されることが
見いだされました。スフィンゴ脂質の種類によって吸収,代謝に差があることが分
かりました。また,投与後
30~60 分の間に腸管から肝臓に移動したスフィンゴミエ
リンの量は
1%以下でした。これらの結果から,腸管から他の組織へのスフィンゴ
ミエリン及びその代謝物の輸送は効率的ではないこと,スフィンゴミエリンが腸管
で生体複合スフィンゴ脂質の合成原料として加水分解,吸収されることが示唆され
ました。
さらに,
Nyberg らは,スフィンゴミエリンの消化部位と消化能力を調べました。
その結果,スフィンゴミエリンの消化がスフィンゴミエリナーゼにより主に小腸の
中部と下部で起こること,またこの酵素がスフィンゴミエリン消化の第一段階にお
ける重要な役割を果たしていることを報告しています。
角質 層重 量あた り のセ ラ ミ ド 量 (μg / m g ) 0 10 20 30 40 50 60 90 70 50 30 10 ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ●● ● ● ● ● ● ● ● ● ● ● ● ● ● ●●● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ●● ● ● ● ● 年齢(歳) 0 50 100 150 * ** ** ** ** ** ** ** ** ** ** ** ** ** *p<0.05 **p<0.01 ±SE : 年齢を合わせた健常人皮膚 n=34 : 無皮疹部皮膚 n=35 : 皮疹部皮膚 n=32 アトピ-性皮膚炎患者 セ ラ ミ ド 総 セ ラ ミ ド 総 脂 質 セ ラ ミ ド セ ラ ミ ド セ ラ ミ ド セ ラ ミ ド 1 2 3 4 6 + 5 脂 質 の 減少(%)5. オリザセラミド
®
の機能性と応用
5-1 保湿作用およびセラミド増加作用
5-1-1 マウスにおける保湿およびセラミド増加作用
(in vivo)
へアレスマウスにコメ由来スフィンゴ糖脂質(GCFr, グルコシルセラミド含量:
99%以上)またはオリザセラミド
®-PT(FGC)を9日間経口投与し(図 9A),背部
の経表皮水分蒸散量(
TEWL)を測定しました。その結果,図 9B 左に示すように
FGC(256 mg/kg)で有意な改善がみられました。その後,10%SDS を 1 日 1 回 3 日
間背部右側に塗布し,再び
TEWL を測定したところ(12 日目),正常部位,SDS
塗布部位ともに,TEWL の改善が認められました(図 9B)。図 9C はこの時の正常
部位と
SDS 塗布部位の TEWL の差をグラフにしております。GCFr,FGC ともに有
意な
TEWL の改善作用を示しました。
図
9. コメセラミド(GCFr)およびオリザセラミド
®-PT(FGC)のマウスにおける
経表皮水分量(
TEWL)改善作用
A) 投与,SDS 塗布スケジュール,B) 正常部位,SDS 塗布部位の TEWL,C) 投与
12 日目における正常部位と SDS 塗布部位の TEWL の差
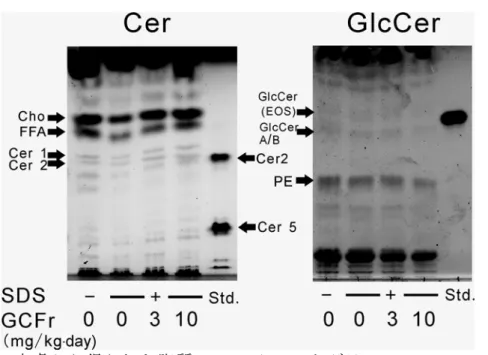
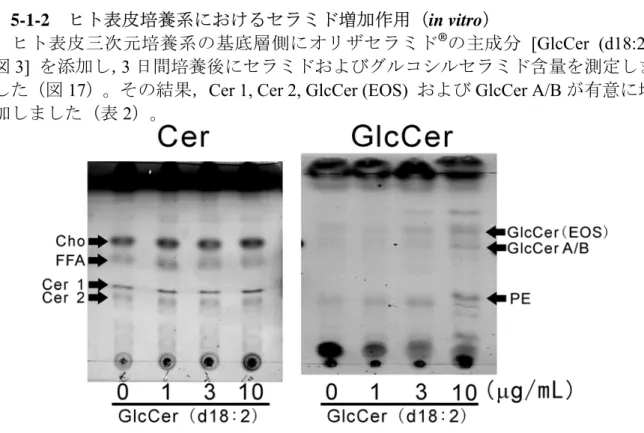
投与
16 日目に SDS 塗布部位の皮膚を採取し,脂質を抽出後に TLC による脂質の
分離解析を行いました(図
10)。その結果,セラミド 1, 2(Cer 1, 2)およびグルコ
シルセラミド(
GlcCer)EOS (セラミド 1 の前駆体),A/B(4 種類の GlcCer の混合
物)のスポットが確認できました。クロマトスキャナーによる定量の結果,コメ由
来スフィンゴ糖脂質(
GCFr)の投与により,セラミド 1 の含量が有意に増加し,逆
にグルコシルセラミド
EOS, A/B の含量が低下しました(表 1)。この結果は,SDS
の塗布により低下した表皮セラミドを補うため,GCFr の投与により表皮グルコシ
ルセラミドからセラミドの変換が促進したものと考えられます(下の絵を参照)。
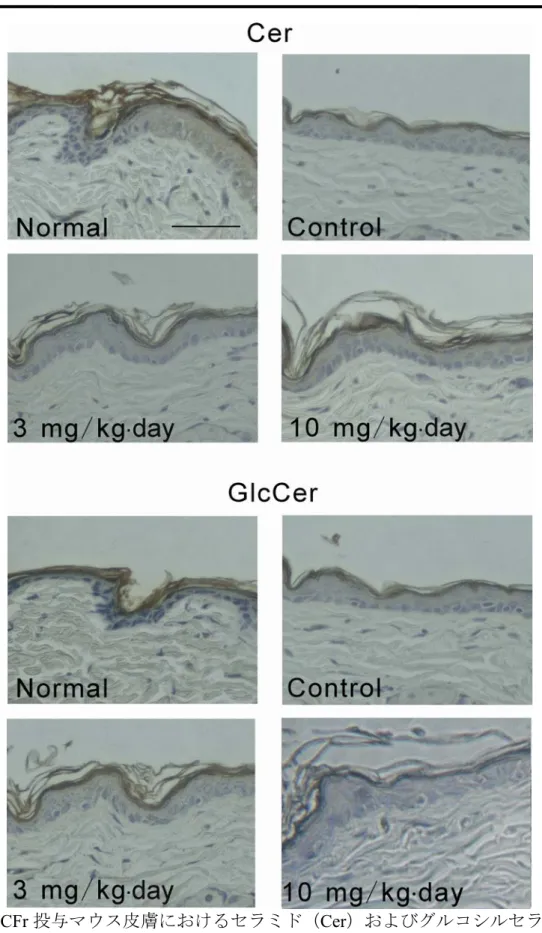
図
11 には,マウス皮膚のセラミドとグルコシルセラミドの免疫染色像を示して
います。免疫染色においても,セラミド含量が増加し,グルコシルセラミド含量が
低下していることが示されました。
図
10. マウス皮膚から得られた脂質の TLC クロマトグラム
Cho: コレステロール,FFA: 遊離脂肪酸,PE: フォスファチジルエタノールアミン
展開条件
セラミド(Cer): 溶媒 クロロホルム:メタノール:酢酸 (190:9:1), 発色: 10%硫
酸銅含有
8%リン酸, グルコシルセラミド(GlcCer): クロロホルム:メタノール:酢
酸 (40:12:1), 0.1%オルシノール含有 10%硫酸
表 1. GCFr 投与による SDS 塗布部位皮膚の脂質量の変化
スポット面積
Cho
FFA
Cer 1
Cer 2
Normal 0.711±0.094
0.469±0.097
0.139±0.028
0.112±0.024
Control 0.669±0.057
0.390±0.054
0.158±0.028
0.126±0.022
GCFr (3 mg/kg)
0.732±0.026
0.623±0.096
0.184±0.026
0.137±0.021
GCFr (10 mg/kg)
0.840±0.119
0.724±0.088*
0.211±0.036*
0.135±0.020
スポット面積
GlcCer (EOS)
GlcCer A/B
PE
Normal 0.035±0.005
0.044±0.007
0.071±0.020
Control 0.034±0.007
0.042±0.005
0.064±0.008
GCFr (3 mg/kg)
0.032±0.009
0.033±0.008
0.103±0.018
GCFr (10 mg/kg)
0.016±0.004*
0.017±0.006* 0.069±0.011
Cho: コレステロール,FFA: 遊離脂肪酸,PE: フォスファチジルエタノールアミ
ン,Cer: セラミド,GlcCer: グルコシルセラミド
図
11. GCFr 投与マウス皮膚におけるセラミド(Cer)およびグルコシルセラミド
(
GlcCer)の免疫染色画像
一方,電子顕微鏡による観察の結果,図
12 に示すように顆粒層に存在するケラ
トヒアリン顆粒(
KG)の成長・拡大が認められました。KG はフィラグリンの前駆
体のプロフィラグリンの貯蔵部位であり,フィラグリンはケラチンと結合するで強
固なケラチン構造の構築に寄与しています。したがって,
GCFr の投与による表皮
角質層の強化が期待できます。
Control GCFr
(10 mg/kg)
図
12.マウス皮膚断面(3,000 倍)
SC: 角質層,SL: 淡明層,SG: 顆粒層,KG: ケラトヒアリン顆粒
図
13 には角質層に存在するラメラ構造(脂質二重層)の変化を示しています。
ラメラ構造は,セラミドそのものの存在様式です。GCFr の投与により,ラメラ構
造が明瞭になっていることから,セラミドの含有量や存在様式に変化がみられるこ
とが明らかになりました。
Control GCFr(10 mg/kg)
Control GCFr(10 mg/kg)
図
14 は顆粒層に存在する層板顆粒(ラメラ顆粒)の写真です。層板顆粒は角質
層に存在するラメラ構造と同様に脂質二重構造をとり,グルコシルセラミドの貯蔵
部位になっています。
GCFr の投与により,層板構造が明瞭に変化していることか
ら,グルコシルセラミドの存在様式にも変化を与えていることが示唆されました。
Control GCFr(10 mg/kg)
図
14.顆粒層にみられる層板顆粒(300,000 倍)
図
15 は角質細胞のケラチン模様(細胞内の線維状の構造)を示しております。
その細胞膜を
cornified envelope(別名:周辺帯,破線部分)と呼び,強靭な細胞膜
を形作っています。GCFr の投与により,その電子密度が上昇し(濃くなっている)
その構造が強化されている様子が分かります。
Control GCFr(10 mg/kg)
図
15. 角質のケラチン模様と cornified envelope(周辺帯, 破線の細胞膜)(3,000 倍)
周辺帯はインボルクリンやロリクリンから構成される強靭な角質細胞膜。GCFr
投与により高電子密度化がみられる。
図
16 は表皮のグルコシルセラミドの合成とセラミドへの変換に関与する酵素の発現を示
した
Western blotting 像です(7 ページ参照)。それぞれグルコシルセラミド合成酵素
(
GCSase)およびβ-グルコセレブドシダーゼ(GCase)と呼びます。実験の結果,GCFr の
投与により,
GCase,GCSase の発現量が増加しました。この結果より,GCFr の投与により,
表皮のグルコシルセラミドの合成と分解(セラミドへの変換)が亢進したものと考えられ,表
1 や図 11 に示したグルコシルセラミドやセラミドの変化を反映する結果が得られました。
図
16. GCFr 投与マウス皮膚におけるグルコシルセラミド合成酵素(GCSase)およびβ-グ
ルコセレブドシダーゼ(GCase)の発現
A) 10% SDS-PAGE での Western blotting 像. B) 各タンパクの発現量をアクチンで補正
後
control を 1 としてグラフ化した。
以上の結果より,オリザセラミドは経口摂取により表皮のセラミド含量を高めることで,角
質層の保湿やバリアー機能を補う働きがあることが判明しました。
5-1-2 ヒト表皮培養系におけるセラミド増加作用(in vitro)
ヒト表皮三次元培養系の基底層側にオリザセラミド
®の主成分 [GlcCer (d18:2),
図
3] を添加し,3 日間培養後にセラミドおよびグルコシルセラミド含量を測定しま
した(図
17)。その結果,Cer 1, Cer 2, GlcCer (EOS) および GlcCer A/B が有意に増
加しました(表
2)。
図
17. ヒト表皮培養系から得られた脂質の TLC クロマトグラム
Cho: コレステロール,FFA: 遊離脂肪酸,Cer: セラミド,GlcCer: グルコシルセラミド,PE: フォ スファチジルエタノールアミン
展開条件は図 10 参照
表
2. GlcCer (d18:2) 添加によるヒト表皮培養系における脂質量の変化
スポット面積 濃度
(µg/mL) Cho FFA Cer 1 Cer 2
Control - 0.238±0.036 0.053±0.006 0.048±0.021 0.109±0.011 GlcCer (d18:2) 1 0.247±0.016 0.066±0.010 0.091±0.003* 0.071±0.015
3 0.263±0.025 0.108±0.018* 0.076±0.001 0.113±0.003 10 0.308±0.016 0.108±0.018* 0.076±0.006 0.132±0.002*
スポット面積
GlcCer (EOS) GlcCer A/B PE
Control - 0.034±0.004 0.020±0.004 0.052±0.017 GlcCer (d18:2) 1 0.049±0.010 0.020±0.009 0.069±0.007
3 0.081±0.009* 0.067±0.003** 0.117±0.017* 10 0.084±0.005* 0.049±0.010* 0.104±0.010
Cho: コレステロール,FFA: 遊離脂肪酸,PE: フォスファチジルエタノールアミン,Cer: セ ラミド,GlcCer: グルコシルセラミド
セラミドおよびグルコシルセラミドの各面積は,それぞれの標品で補正した。平均値±標準誤差,n=3, *: p<0.05, **: p<0.01.
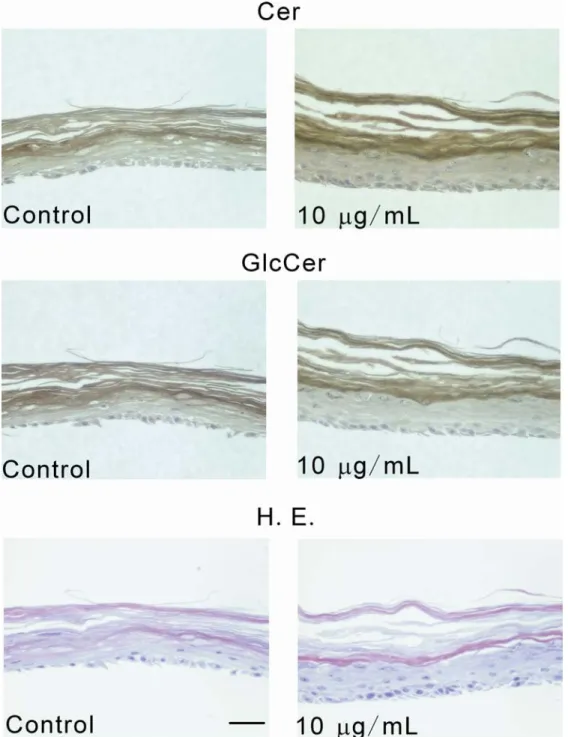
下図に示すように,免疫染色像においても
GlcCer (d:18:2) によるセラミドとグル
コシルセラミドの増加が認められました。
図
18. GlcCer (d:18:2) 添加によるヒト表皮におけるセラミド(Cer)およびグルコシ
ルセラミド(GlcCer)の免疫染色画像
さらに
GlcCer (d:18:2) は,GCase の発現に影響を与えませんでしたが,GCSase
や表皮の成熟指標であるインボルクリンやトランスグルタミナーゼの発現を高め
ました(図
19)。
図
19. GlcCer (d:18:2) 添加によるヒト表皮培養系におけるグルコシルセラミド合成酵
素(GCSase),β-グルコセレブドシダーゼ(GCase),トランスグルタミナーゼ(TGase)およ
びインボルクリンの発現
A) 10% SDS-PAGE での Western blotting 像. B) 各タンパクの発現量をアクチンで補正
後
control(サンプル未添加群)を 1 としてグラフ化した。 C) トランスグルタミナーゼおよび
C) TGase
Control 3
µg/mL
Involucrin
5-2 美白作用 (in vitro)
5-2-1 マウス B16 メラノーマ細胞におけるメラニン生成抑制作用
B16 メラノーマ細胞を用いて,米由来スフィンゴ糖脂質のメラニン生成抑制作用
(美白作用) を検討しました。その結果,米由来スフィンゴ糖脂質は濃度依存的にメ
ラニンの生成を抑制し,コウジ酸の活性には及ばなかったものの,他の既存美白剤
よりも強い抑制作用が認められました(図
20)。
米由来スフィンゴ糖脂質を経口摂取した場合,吸収されたスフィンゴ糖脂質は
皮膚に到達してメラニン生成抑制作用を発揮し,美白効果をもたらすことが期待さ
れます。
図
20. 米由来スフィンゴ糖脂質のメラニン生成抑制作用
【実験方法】 マウスB16 メラノーマ細胞 (2×103 cells/mL) をシャーレ (60 mm dish) に播種し,10%牛胎児血 清を含むD-MEM 培地で 24 時間培養後,サンプル含有培地 (スフィンゴ糖脂質は乳化して添加) に 交換した。4 日後,新鮮なサンプル含有培地に交換し,さらに 2 日後に細胞を回収した。回収した 細胞の生細胞数を数えた後,細胞を2N NaOH で融解 (37℃,1 時間) し,450 nm における吸光度 を測定した。 【各サンプル純度】 コウジ酸,エラグ酸,ビタミンC,アルブチン : 100 % 米由来スフィンゴ糖脂質 : 95 %以上 コウジ酸 米由来スフィンゴ糖脂質100
10
1
0
-1
0
10
20
30
40
50
µg/ml
B
メラニン生成抑制率 (%) 1.コウジ酸 2.エラグ酸 3.ビタミン C 4.アルブチン 5.米由来スフィンゴ糖脂質 100μg/ml0
10
20
30
40
1
2
3
4
5
A
メラニン生成抑制率 (%)5-2-2 マウスメラノサイト (melan-a) におけるメラニン生成抑制作用
北海道大学薬学部 五十嵐教授,光武助手のグループにおいて,マウスメラノサ
イト細胞での米由来スフィンゴ糖脂質及びその酸分解物
*のチロシナーゼ活性及び
メラニン色素生成に及ぼす影響を検討しました。その結果,米由来スフィンゴ糖脂
質及びその酸分解物には,濃度依存的なチロシナーゼ活性阻害作用及びメラニン生
成抑制作用がみられました(図
21, 22)。
*
米由来スフィンゴ糖脂質を1 N HCl 含有含水メタノール溶液で加水分解 (70℃/18 時間) した。 n-ヘキサン/メタノールによる液-液分配で得られたメタノール層を回収し,濃縮乾燥した。図
21. メラニン生成に対する米由来スフィンゴ糖脂質の影響
図
22. メラニン生成に対する米由来スフィンゴ糖脂質酸分解物の影響
チロシナーゼ活性 メラニン生成量 % o f c o n tr o l % o f c o n tr o l 0 5 10 20 (µg/mL) 0 5 10 20 (µg/mL) チロシナーゼ活性 メラニン生成量 % o f c o n tr o l % o f c o n tr o l 0 5 10 20 (µg/mL) 0 5 10 20 (µg/mL) チロシナーゼ活性 メラニン生成量1. 米由来セラミド 2. コンニャク由来セラミド 3. 小麦由来セラミド 4. コントロール 【実験方法】 1) チロシナーゼ活性の測定
マウスメラノサイト細胞株 (melan-a cells, 1×104 cells/well) を 96well plate に播種し,200 nM TPA
および10%ウシ胎児血清を含む RPMI1640 培地で 24 時間培養後,サンプル (米由来スフィンゴ糖 脂質純度:95%以上) を含む培地に交換し,4 日培養を行った。培養上清を除去した後,1% tritonX-100 含有PBS (90µl/well) を添加し,1 分間振盪後,基質として 10mM L-DOPA 含有 PBS (10µl/well)
を添加し,インキュベート (1 時間,37℃) 後,475nm における吸光度を測定した。チロシナーゼ 活性は各群のタンパク量で補正を行った。
2) メラニン生成量の測定
melan-a cells (3×105 cells/well) を 90 mm plate,又は 6 well plate に播種し,1)と同様の培養を行っ
た。終了後,細胞を回収し,細胞ペレットに1N NaOH 溶液 (500µl) を加えて溶解した。溶解液を 加温 (100℃,30 分) 後,405nm における吸光度を測定した。メラニン生成量は各群のタンパク量で 補正を行った。
5-3 保湿作用 (in vitro)
セラミドの保湿作用については,多くの臨床実験により証明されています。
Merrill と Futerman らは,植物性セラミドを経口摂取した場合,セラミドは消化管
から吸収されて血中に入り,毛細血管を介して角質層に取り込まれ,角質層の保水
機能及びバリアー機能改善に効果があることを報告しています
1-3)。
我々は,米由来オリザセラミド
®の保湿効果を,in vitro 保水能を指標に小麦,ま
たはコンニャク由来のセラミドと比較しました。その結果,米由来セラミドは,小
麦,またはコンニャク由来セラミドより優れた水分保持機能を有することが明らか
となりました。
水分保 持 率( %) 2 8 2 9 3 0 3 1 3 2 3 3 3 4 3 5 3 6 1 2 3 4図
23. オリザセラミド
®の水分保持効果
【実験方法】 各植物由来セラミドの乳化液 (市販品で 3%) を調製し,35℃,相対湿度 40%における重量変化を 8 時間後に測定し,水分保持率を算出した。 注) 各試験サンプルは 3%セラミド含有の市販品5-4 ヒト皮膚線維芽細胞賦活作用
以下に示した各植物由来スフィンゴ糖脂質のヒト皮膚線維芽細胞賦活作用を検
討しました。その結果,小麦以外の
3 種類のスフィンゴ糖脂質に,濃度依存的な線
維芽細胞増殖促進活性が認められました。特に米由来スフィンゴ糖脂質は,300
µg/mL の濃度下で,他のスフィンゴ糖脂質より強い線維芽細胞増殖促進活性 (163%)
を示しました。
試料 :
1. オリザ油化㈱製造,米由来,純度 95%以上
2. 他社製造,コンニャク由来,純度 95%以上
3. 他社製造,コーン由来,純度 95%以上
4. 他社製造,小麦由来,純度 95%以上
100 163 129 128 59 0 20 40 60 80 100 120 140 160 180 1 2 3 4 5 試料 線維芽細胞増殖率 ( % )図
24. 各種スフィンゴ糖脂質 (300 µg/mL) の皮膚線維芽細胞の賦活作用
【実験方法】 理化学研究所から購入したHS-K 細胞を,10 %ウシ胎児血清,1000 unit/mL ペニシリン,100 µg/mL ストレプトマイシン含有RITC80-7 培地で継代培養 (5 %CO2, 37 ℃) した。継代後,96 穴平底マイクロプレートに細胞数を1×105 cells (100 µL/well) 播種し,1%ウシ胎児血清 (FBS) ,1000 unit/mL
ペニシリン,100 µg/mL ストレプトマイシン含有 RITC80-7 培地で 24 時間培養後,11 µL の各試料溶 液3 mg/mL (EtOH 最終濃度 0.5 %) を添加し,72 時間培養後,Cell Counting kit-8 で呈色反応を行 い, マイクロプレートリーダーで 450 nm の吸光度を測定した。
5-5 バリアー機能の強化
皮膚は生体最外層に存在するため,絶えず外界から様々な刺激を受けています。植
物性セラミドの摂取により,皮膚のラメラ構造,及び水分蒸散や有害物侵入を防止するバ
リアー機能が強化され,乾癬や接触性皮膚炎の軽減に有効であることが報告されていま
す
4)。
1. コントロール 2. 米由来スフィンゴ糖脂質 3. コンニャク由来スフィンゴ糖脂質 4. コーン由来スフィンゴ糖脂質 5. 小麦由来スフィンゴ糖脂質5-6 アトピー性皮膚炎症状の緩和
5-6-1 感作 RBL-2H3 マスト細胞を用いた抗原誘発脱顆粒試験
感作
RBL-2H3 マスト細胞における各種スフィンゴ糖脂質の脱顆粒抑制作用を検
討した結果,米由来スフィンゴ糖脂質に高い抑制活性が認められました。
表
3 各スフィンゴ糖脂質の感作 RBL-2H3 マスト細胞における脱顆粒抑制作用
由来原料
脱顆粒阻害率 (%)
米
87.3
±
2.2
小麦 82.2
± 5.9
コンニャク 70.8
± 5.9
トウモロコシ
64.2 ± 5.4
サンプル濃度 : 1 µg/mL, 平均値±S.E., n = 6 【実験方法】 IgE (抗ジニトロフェニル抗体)で感作した RBL-2H3 細胞にスフィンゴ糖脂質(終濃度 1 µg/mL)を添 加して10 分間インキュベート後,抗原ジニトロフェニル化ウシ血清アルブミンを加えて 30 分間反 応させた。上清中の遊離ヘキソサミニダーゼ活性を測定し,脱顆粒率を求めた。5-6-2 マウス compound48/80 誘発掻痒モデルに対する作用
マウス (ddY, 雄) に米由来スフィンゴ糖脂質配合飼料を継続摂取させたところ,
compound 48/80 によって惹起された引っ掻き行動が,コントロール群より減少する
傾向が認められました
(図 25)。compound 48/80 によるヒスタミン遊離を抑制するこ
とで,引っ掻き行動を抑制するものと考えられました。
図
25. 米由来スフィンゴ糖脂質の compound 48/80 誘発掻痒マウスに対する作用
【実験方法】 マウス (ddY, 雄) を 4 群に分け,米由来スフィンゴ糖脂質 (0,0.15,0.3 および 0.5%) 配合飼料を 3 日間自由摂取させた。次に,3%compound 48/80 溶液を頚背部に皮内投与して引っ掻き行動を惹起 し,掻きはじめから30 分間ビデオ撮影して引っ掻き回数を数えた。 40 42 44 46 48 50 52 54 56 control 0.15%群 0.3%群 0.5%群引 っ 掻 き 回数 ( 回)
5-7 美肌作用 (ヒト臨床)
詳細は『米由来セラミド含有食品における美肌効果の臨床的検討-乾燥肌を対象
とした顕微鏡的
3 次元的画像解析による客観的評価-』を参照下さい。
5-8 キウイ種子エキスとの併用による美肌作用
オリザセラミド
®は,保湿作用や線維芽細胞賦活作用など美容作用を有しており,
経口摂取による肌状態改善作用が認められている素材です。またキウイ種子エキス
は,生体内でニキビ発症に関与している5α-レダクターゼおよび P. Acnes 産生リ
パーゼの活性阻害作用を有しており,塗布によるニキビ改善作用や経口摂取による
皮脂量の改善作用が認められている素材です。
これまでの研究結果から,オリザセラミド
®とキウイ種子エキスの併用摂取は,
ニキビを含めた肌状態を総合的に改善するのに非常に優れた組み合わせであると
予想されます。その効果をヒト臨床試験によって検証したところ,ニキビ菌に作用
して皮脂量が減少し,ニキビの症状改善と肌状態の改善による
QOL の向上が認め
られました。
オリザセラミド
®は美容成分として知名度の高いセラミドを主成分としており,
キウイ種子エキスは健康フルーツとしてよく好まれるキウイの種子が原料である
ため,情緒的にも女性からの高評価が期待できます。したがって,オリザセラミド
®とキウイ種子エキスの組み合わせは,低年代の女性に対し,ニキビを含めたお肌
の状態を総合的に改善する機能的価値と素材の持つ情緒的価値を同時に提供でき,
QOL の向上にも貢献できると考えられました。
5-8-1 方法
顔面にニキビのある
18~34 歳の日本人の女性を対象に非盲検試験を行い,キウ
イ種子エキスおよびオリザセラミド
®含有食品を4週間継続摂取した時の効果を検
証しました。主な評価項目は,医師による目視判定と
VISIA によるポルフィリン測
定,顔面画像解析,Skindex-16 による皮膚疾患特異的 QOL 評価,皮脂量です。
5-8-2 結果
① 師による目視判定
ニキビは,症状の程度によって軽い方から面疱,丘疹,膿疱,膿瘍,結節に分類
されます。1個につき面疱を1点,丘疹を2点,膿疱を3点,膿瘍を4点,結節を
5点とし,医師の目視により各被験者の症状をスコア化したところ,4週間目でス
コアの有意な減少が認められました(図
26)。
したがって,キウイ種子エキスおよびオリザセラミド
®含有食品の摂取により,
ニキビの症状改善が認められました。
200 250 300 350 400 450 0週 2週 4週 ポル フ ィ リ ン ( 個 ) 正面 左顔 右顔 0 5 10 15 20 25 30 0週 2週 4週 皮脂 量( µ g/ cm 2 ) 額部中央 左頬骨頂点部位 * 0 5 10 15 20 25 30 0週 2週 4週 スコ ア( 点 ) *
図26. ニキビ症状スコアの変化(*: p<0.05)
② ルフィリン
ポルフィリンは,P. Acnes に特徴的な代謝産物であり,ニキビ菌が存在する証拠
の一つです。ポルフィリンは,試験期間を通じて,正面・左顔・右顔において経時
的に減少する傾向が認められました(図
27)。
したがって,キウイ種子エキスおよびオリザセラミド
®含有食品の摂取により,
ニキビの原因菌である P. Acnes が減少する可能性が示唆されました。
図
27. ポルフィリン個数の変化
③
脂量
皮脂量は,額部中央および左頬骨頂点部位において,経時的に減少する傾向が認
められました。左頬骨頂点部位では2週間目で有意な減少が認められました(図
28)。
したがって,キウイ種子エキスおよびオリザセラミド
®含有食品の摂取によって
皮脂量は減少すると考えられました。
図
28. 皮脂量の変化(*: p<0.05)
0
200
400
600
800
0週
2週
4週
キメ
(
個
)
正面
左顔
右顔
0
20
40
60
80
0週
2週
4週
スコ
ア(
点
)
感情
総合
*④
キメ
キメは,左顔および右顔で経時的に増加する傾向が認められました(図
29)。
したがって,キウイ種子エキスおよびオリザセラミド
®含有食品の摂取により,
肌状態が改善される可能性が示唆されました。
図
29. キメ個数の変化
⑤
Skindex-16 による皮膚疾患特異的 QOL 評価
Skindex-16 は,症状・感情・機能の3つの領域に属する 16 項目の質問からなり,
皮膚疾患特異的
QOL 評価尺度の一つです。領域ごとに0-100 点で評価し,点数が
高いほど
QOL が低いとされます。
本試験では,「感情」および「総合」において経時的にスコアが減少する傾向が
認められました。さらに,2週間目では感情スコアの有意な減少が認められました
(図
30)。
スコアの減少は各項目の改善を意味するため,キウイ種子エキスおよびオリザセ
ラミド
®含有食品の摂取により,ニキビに悩む方々の
QOL が改善したと考えられま
した。
図
30. QOL の変化(*: p<0.05)
5-9 抗腫瘍作用
5-9-1 大腸癌抑制作用
我が国の大腸癌による死亡率は消化器癌の中で胃癌に次いで高く,欧米型の食習
慣化により発症率が急増しています。琉球大学 吉見教授のグループとの共同研究
で大腸発がんの変抑制効果を検討した結果,米由来スフィンゴ糖脂質が天然物由来
の安全な大腸癌予防物質になりうる可能性が示唆されました。
7)F344 ラット (5 週齢,雄) に,アゾキシメタン (AOM) を週 1 回 2 週間皮下注射
し,大腸癌の前癌病変である
aberant crypt foci (ACF) および mucin depleted foci
(MDF) を誘発させ,これに対する米由来スフィンゴ糖脂質 (G
1CM) の作用を検討
しました。その結果,実験開始
4 週目における第 2,3 群 (G
1CM initiation 期投与群)
の
ACF と MDF 発生数は,第 1 群 (陽性対照群) に対し,有意な抑制を示しました。
また,実験開始
8 週目における各群の ACF と MDF 発生数を調べると,第 1 群と比
較して,第
4,5 群 (G
1CM post-initiation 期投与群) においても有意な抑制が認め
られました (表 4)。
また,腫瘍マーカーである
PCNA 及び Caspase-3 染色より,細胞増殖抑制のみな
らず,アポトーシス誘導の可能性が示唆されました
(図 31)。
以上より,同時投与でなくても腫瘍形成プロモーション期の投与で,前癌病変の
発生低下が認められたことから,大腸粘膜内における
2 種類の前癌病変 (ACF と
MDF) 発生数をマーカーとした場合,スフィンゴ糖脂質の混餌投与には,癌予防作
用がある可能性が示唆されました。
表
4 米由来スフィンゴ糖脂質の AOM 誘発ラット大腸癌モデルに対する作用
Group Conc. N Number of ACF Number of MDF
(ppm) 4 w 8w 4w 8w 1 0 12 75±17 111±33 9.2±5.2 17.1±6.6 2 100 12 46± 9 p<0.01 90±28 0.8±8 p<0.05 10.8±5.9 p<0.05 3 250 12 45±14 p<0.01 75±20 p<0.05 0.8±0.4 p<0.05 6.8±2.7 p<0.05 4 100 12 - 89±28 - 10.0±5.1 5 250 12 - 78±15 p<0.05 - 9.6±3.1 p<0.01 6 250 3, 6 0 0 0 0 7 0 3, 6 0 0 0 0 測定値は平均値と標準偏差で示した。
図
20 PCNA 及び Caspase-3 染色
【実験方法】
F344 ラット (5 週齢,雄) を 7 群に分け,図 32 のように飼料およびアゾキシメタン (AOM 20 mg/kg) を週 1 回 2 週間皮下注射し,ACF と MDF を誘発した。実験開始4週目および8週目に大腸 を摘出してホルマリン固定後,アルシアン青染色 (pH 2.5) を行い,ACF と MDF の数を光学顕微鏡 下で測定した。さらに,腫瘍マーカーであるproliferating nuclear antigen (PCNA) と cleaved caspase-3 抗体を用いて免疫染色を行い,腫瘍の発生とアポトーシス誘導の有無を確認した。 第1 群 : 基礎飼料を AOM 投与 1 週間前から実験終了まで与えた。 第2,3 群 : 純度 約 90%のスフィンゴ糖脂質 (G1CM) 100, 250 ppm 含有飼料を AOM 投与 1 週間前か ら実験4 週目まで,基礎飼料を実験終了まで与えた。 第4,5 群 : 基礎飼料を AOM 投与 1 週間前から実験 2 週目まで,G1CM 含有 (100, 250 ppm) 飼料を 実験3 週目から実験終了まで与えた。 第6,7 群 : AOM 非投与群。250 ppm G1CM 含有飼料または基礎飼料を通期で与えた。 0 1 2 4 8 weeks 第1 群 (24rats) 第2 群 (24rats) 第3 群 (24rats) 第4 群 (12rats) 第5 群 (12rats) 第6 群 (9rats) 第7 群 (9rats)
; AOM s.c. injection (20mg/kg body weight) CE-2 CE-2 CE-2+100ppm G1CM CE-2 CE-2+100ppm G1CM CE-2 CE-2+250ppm G1CM CE-2+250ppm G1CM CE-2 CE-2+250ppm G1CM CE-2
x 200
x 200
PCNA 陽性細胞核 Caspase-3 陽性細胞断片PCNA 染色
Caspase-3 染色
図
31.
0 500 1000 1500 2000 2500 3000 3500 4000 4500 5000 0 7 14 day tu mo r vo lu me ( m m 3 ) control glucosylceramide
5-9-2 扁
平上皮性悪性腫瘍成長抑制作用
鳥取大学医学部の岡崎教授、藤原助教らとの共同研究の結果、オリザセラミド
®が経口投与により、扁平上皮性悪性腫瘍の成長抑制効果とマウスの寿命延長効果を
示すことが明らかとなりました。
8)NOD/SCID マウスの頸部または背中に悪性腫瘍を移植し、腫瘍が約 5 mm まで成長
した後、オリザセラミド
®の経口投与 (300 mg/kg/day、米由来スフィンゴ糖脂質とし
て
24 mg/kg/day) を開始しました。
その結果、オリザセラミド
®経口投与群では、
① 投与
14 日後における扁平上皮性腫瘍体積の有意な減少 (図 33)
②
TUNEL 染色による腫瘍の組織学的所見におけるアポトーシスの促進(図 34)
③ 腫瘍を移植された
NOD/SCID マウスの寿命延長 (図 35)
が認められました。
したがって、マウスにおいて、オリザセラミド
®には扁平上皮性悪性腫瘍の成長を
抑制し、延命効果を示すことが明らかとなりました。
図
33. 扁平上皮性悪性腫瘍体積の比較
0 0.2 0.4 0.6 0.8 1 0 20 40 60 80 100 120 140 day su rv ival rat e 0 0.2 0.4 0.6 0.8 1 0 20 40 60 80 100 120 140 day su rv ival rat e
図
34. オリザセラミド
®投与によるアポトーシス促進
図
35. オリザセラミド
®投与が寿命に与える影響
参考文献
1)
Eva-Maria S. et al., J. Nutr., 124 (5), 702 (1994).
2) Merrill A. H. Jr. et al., FASEB, 3A, 469 (1989).
3) Futerman A. H., CHAPTER 4, Current Topics in Membranes, Vol.40, 93 (1994).
4) Elian L. Fragrance Journal, 23 (1), 81 (1995).
5) 芋川 玄爾, 油化学, 44 (10), 751 (1995).
6) Lena N. et al., J. Nutr. Biochem., 8 (3), 122 (1997).
7) Inamine M. et al., Cancer Sci., 96, 876-881 (2005).
glucosylceramide
control
6. オリザセラミド
®の熱安定性
オリザセラミド
®に含まれるスフィンゴ糖脂質は,通常の食品加工温度に対して
安定です。
7. オリザセラミド
®の pH 安定性
オリザセラミド
®に含まれるスフィンゴ糖脂質は,幅広い
pH 領域で安定です。
。 *90%エタノール溶液 (pH 6.8) のスフィンゴ糖脂質を 100%とした0
20
40
60
80
100
1
3
5
7
9
11
13
スフ ィ ン ゴ 糖 脂 質濃度 (% )pH
オリザセラミドのpH安定性
図
37 オリザセラミド
®の
pH 安定
100 ℃ 140 ℃図17 オリザセラミドの熱安定性
0 20 40 60 80 100 0 30 60 時間(分) ス フ ィ ン ゴ 糖脂質濃 度( %) 100 ℃ 140 ℃図
36 オリザセラミドの熱安定性
8. オリザセラミド
®の推奨摂取量
美白効果あるいは保湿効果を期待する場合には,以下に示している摂取量をおす
すめします。
製品名
美白効果
保湿効果
オリザセラミド
®-PT, PCD
(粉末タイプ)30~50 mg/day
20~40 mg/day
オリザセラミド
®-P8T (粉末タイプ)
11~19 mg/day
7.5~15 mg/day
オリザセラミド
®-P20CD (粉末タイプ)
4.5~7.5 mg/day
3~6 mg/day
オリザセラミド
®-WSP (粉末タイプ)
30~50 mg/day
20~40 mg/day
オリザセラミド
®-WSP8 (粉末タイプ)
11~19 mg/day
7.5~15 mg/day
オリザセラミド
®-L (乳化液タイプ)
300~500 mg/day
200~400 mg/day
オリザセラミド
®L0.8 (乳化液タイプ) 113~188 mg/day
75~150 mg/day
※オリザセラミドは厚生労働省より食品として認められた製品です。
食品として安心してお使いいただけます。
9.
オリザセラミド
®
の栄養成分
項目
オリザセラミド
®‐
PT PCD P8T
P20CD
WSP8
WSP
L0.8
L
水分 (/100 g)
1.2 g
1.8 g
1.1 g
2.2 g
1.8 g
40.2 g
タンパク質 (/100 g)
5.3 g
3.8 g
7.3 g
4.7 g
3.8 g
0.4 g
脂質 (/100 g)
19.6 g
33.8 g
21.8 g
42.2 g
33.8 g
5.9 g
灰分 (/100 g)
66.3 g
2.5 g
67.2 g
3.1 g
2.5 g
0.2 g
糖質 (/100 g)
5.6 g
58.3 g
0.4 g
47.8 g
58.3 g
53.3 g
食物繊維 (/100 g)
2.0 g
0.0 g
2.2 g
0.0 g
0.0 g
0.0 g
ナトリウム (/100 g) 337 mg 524 mg
328 mg
655 mg
524 mg
52 mg
エネルギー (/100 g) 224kcal 552kcal
232kcal
590kcal
552kcal 268kcal
オリザセラミド®-PT は実測値を記載 試験依頼先 : 財団法人日本食品分析センター 試験成績書発行年月日 平成19 年 5 月 17 日 試験成績書発行番号 第307040849-001 号 他製品は米抽出物の栄養成分分析値からの計算値 米抽出物 試験依頼先 : 財団法人日本食品分析センター 試験成績書発行年月日 : 平成 11 年 9 月 7 日
10. オリザセラミド
®の安全性
(1) 残留農薬
残留農薬について一斉分析
(447 項目 (456 物質)) を行った結果,全項目におい
て検出されず,との結果が得られました。
試験依頼先 株式会社マシス 食品安全評価分析センター 試験成績書発行年月日 平成18 年 9 月 5 日(2) 急性毒性 (LD
50)
体重
30 g 前後,5 週齢の ICR 系雄性マウスにオリザセラミド
®を
5000 mg/kg の用
量で経口投与し,温度
23±2℃,湿度 50±10%,エサ,水自由摂取の条件下で 14 日間
飼育しました。コントロール群との比較をおこなったところ,異常な体重変化はみ
られず,また試験終了後の剖検においても臓器に異常は認められませんでした。従っ
て,マウスに対するオリザセラミド
®の
LD
50値は
5000 mg/kg 以上です。
(3) 無毒性量 (28 日間反復経口投与試験)
4 週齢の Slc:ddy マウス雌雄にスフィンゴ糖脂質を 60 mg/kg (ヒトの体重を 60 kg
として
3.6 g/ヒト) の用量で反復経口投与し,温度 22±3 ℃,湿度 50±20 %,エサ,
水自由摂取の条件下で
28 日間飼育しました。コントロール群との比較をおこなった
ところ,異常な体重変化はみられず,また試験終了後の血液検査及び剖検において
も異常は認められませんでした。従って,マウスに対するスフィンゴ糖脂質の無毒
性量は
60 mg/kg と推定されます。
(4) -1 その他
オリザセラミド
®中のスフィンゴ糖脂質
(米ぬかから得られた,スフィンゴシン
誘導体を主成分とするものをいう) は,食品添加物の乳化剤としても登録されてい
ます。種々な起源のセラミドが存在する中で唯一,厚生労働省が許可した安全性の
高い製品です。
(4) -2 塗布試験について
オリザセラミド
®中のスフィンゴ糖脂質は日本の医薬部外品原料規格
Japanese
Standards of Quasi-drug Ingredients (JSQI)に登録されており,その安全性は日本の厚
生労働省により担保されています。弊社のオリザセラミドはその外原規規格に合致
することから,安全性データ(塗布)の自社データはとっておりません。
11. オリザセラミド
®の応用例
利用方法
具体例
健康食品
ソフトカプセル,錠剤,ハードカプセル等
食品
キャンディー,グミ,錠菓,クッキー,ウエハース,ドリンク等
化粧品
シャンプー,リンス,ファンデーション,クリーム,乳液,石鹸,
洗顔料,化粧水,口紅,ローション等
12. 荷姿
オリザセラミド
®-PT,PCD,P8T,P20CD (粉末,食品用途)
オリザセラミド
®-WSP,WSP8 (水溶性粉末,食品用途)
オリザセラミド
®-PC,PC8,PC20 (粉末,化粧品用途)
オリザセラミド
®-WSPC,WSPC8 (水溶性粉末,化粧品用途)
1kg 内装:ポリビニリデンコート袋,缶
外装:ダンボール包装
オリザセラミド
®-L,L0.8 (液体,食品用途)
オリザセラミド
®-LC,LC0.8 (液体,化粧品用途)
5kg 内装:キュービーテナー
外装:ダンボール包装
13. 保管方法
高温多湿を避け,室温,暗所にて密封状態で保管してください。
14. 表示例
<食品>
製品名 表示名 オリザセラミド® −PT,P8T セラミド含有米抽出物,セラミド含有米エキス,米抽出物,又は 米エキス,及び炭酸カルシウム,カゼインナトリウム (乳由来) (原料の一部に大豆を含む) オリザセラミド® −PCD,P20CD セラミド含有米抽出物,セラミド含有米エキス,米抽出物,又は 米エキス,及びシクロデキストリン オリザセラミド® −WSP,WSP8 セラミド含有米抽出物,セラミド含有米エキス,米抽出物,又は 米エキス,及びシクロデキストリン オリザセラミド® −L,L0.8 セラミド含有米抽出物,セラミド含有米エキス,米抽出物,又は 米エキス,及びグリセリン,グリセリン脂肪酸エステル* 食品表示については所轄の保健所,及び地方農政局にご確認下さい。
<化粧品>
製品名 表示名称 INCI 名 オリザセラミド® −PC,PC8,PC20 シクロデキストリン コメヌカ油 コメヌカスフィンゴ糖脂質 CyclodextrinOryza Sativa (Rice) Bran Oil Glycosphingolipids オリザセラミド® −WSPC,WSPC8 マルトシルシクロデキストリン シクロデキストリン マルトース コメヌカ油 コメヌカスフィンゴ糖脂質 Maltosyl Cyclodextrin Cyclodextrin Maltose
Oryza Sativa (Rice) Bran Oil Glycosphingolipids オリザセラミド® −LC グリセリン 水 オレイン酸ポリグリセリル−10 レシチン コメヌカ油 コメヌカスフィンゴ糖脂質 Glycerin Water Polyglyceryl−10 Oleate Lecithin
Oryza Sativa (Rice) Bran Oil Glycosphingolipids オリザセラミド® − LC0.8 グリセリン 水 オレイン酸ポリグリセリル−10 コメヌカ油 コメヌカスフィンゴ糖脂質 Glycerin Water Polyglyceryl−10 Oleate Oryza Sativa (Rice) Bran Oil Glycosphingolipids
製品規格書
製品名
オリザセラミド
®-PT
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からヘキサン及び エタノール抽出して得られたものを,粉末化したものである。本品は定量するとき,スフィンゴ 糖脂質を3.0 % 以上含む。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおい スフィンゴ糖脂質含量 3.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 5.0 % 以下 (衛生試験法、1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 米抽出物 25.00 % 澱粉分解物 1.13 % 炭酸カルシウム 65.60 % カゼインナトリウム (乳由来) 5.00 % プルラン 2.00 % 酵素分解レシチン (大豆由来) 0.57 % グリセリン脂肪酸エステル 0.50 % キサンタンガム 0.20 % 合 計 100.00 % 賞味期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。
製品規格書
製品名
オリザセラミド
®-PCD
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からヘキサン及び エタノール抽出して得られたものを,粉末化したものである。本品は定量するとき,スフィンゴ 糖脂質を3.0 % 以上含む。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおい スフィンゴ糖脂質含量 3.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 8.0 % 以下 (衛生試験法、1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 米抽出物 40 % シクロデキストリン 60 % 合 計 100 % 賞味期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。
製品規格書
製品名
オリザセラミド
®-P8T
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からヘキサン及び エタノール抽出して得られたものを,粉末化したものである。本品は定量するとき,スフィンゴ 糖脂質を8.0 % 以上含む。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおい スフィンゴ糖脂質含量 8.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 5.0 % 以下 (衛生試験法、1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 米抽出物 25.00 % 澱粉分解物 1.13 % 炭酸カルシウム 65.60 % カゼインナトリウム (乳由来) 5.00 % プルラン 2.00 % 酵素分解レシチン (大豆由来) 0.57 % グリセリン脂肪酸エステル 0.50 % キサンタンガム 0.20 % 合 計 100.00 % 賞味期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。 使用基準 カルシウムとして食品の1.0%以下の量 (製品として3.8%以下) にてご
製品規格書
製品名
オリザセラミド
®-P20CD
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からヘキサン及び エタノール抽出して得られたものを,粉末化したものである。本品は定量するとき,スフィンゴ 糖脂質を20.0 % 以上含む。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおい スフィンゴ糖脂質含量 20.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 5.0 % 以下 (衛生試験法、1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 米抽出物 50 % シクロデキストリン 50 % 合 計 100 % 賞味期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。
製品規格書
製品名
オリザセラミド
®-WSP
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からヘキサン及び エタノール抽出して得られたコメヌカスフィンゴ糖脂質を粉末化したものである。本品は定量す るとき,スフィンゴ糖脂質を 3.0 % 以上含む。本品は水溶性である。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおい スフィンゴ糖脂質含量 3.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 5.0 % 以下 (衛生試験法、1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 米抽出物 40 % シクロデキストリン 60 % 合 計 100 % 賞味期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。
製品規格書
製品名
オリザセラミド
®-WSP8
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からヘキサン及び エタノール抽出して得られたコメヌカスフィンゴ糖脂質を粉末化したものである。本品は定量す るとき,スフィンゴ糖脂質を 8.0 % 以上含む。本品は水溶性である。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおい スフィンゴ糖脂質含量 8.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 5.0 % 以下 (衛生試験法、1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 米抽出物 40 % シクロデキストリン 60 % 合 計 100 % 賞味期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。
製品規格書
製品名
オリザセラミド
®-L
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽よりエタノールで 抽出して得られたものを,乳化させた水溶性液体である。本品は定量するとき,スフィンゴ糖脂質 を0.30 % 以上含む。 性 状 淡黄色の粘性液体であり,わずかに特有なにおいがある。 スフィンゴ糖脂質含量 0. 30 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 精製水 40 % 米抽出物 4 % グリセリン 46 % グリセリン脂肪酸エステル 10 % 合 計 100 % 賞味期限 製造後1年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態で 保管する。
製品規格書
製品名
オリザセラミド
®-L0.8
食品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽よりエタノールで 抽出して得られたものを,乳化させた水溶性液体である。本品は定量するとき,スフィンゴ糖脂質 を0.80 % 以上含む。 性 状 淡黄色の粘性液体であり,わずかに特有なにおいがある。 スフィンゴ糖脂質含量 0. 80 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 純度試験 (1) 重金属 10 ppm 以下 (硫化ナトリウム比色法) (Pb として) (2) ヒ素 1 ppm 以下 (食品添加物公定書、第 3 法、装置 B) (As2O3として) 一般生菌数 1×103 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 精製水 40 % 米抽出物 4 % グリセリン 46 % グリセリン脂肪酸エステル 10 % 合 計 100 % 賞味期限 製造後1年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状 態で保管する。
製品規格書
製品名
オリザセラミド
®-PC
化粧品本品は,イネ科イネ (Oryza sativa Linne) の種子から生ずる米ぬか及び米胚芽からエタノール抽出 して得られたコメヌカスフィンゴ糖脂質 (外原規) を,粉末化したものである。本品は定量すると き,スフィンゴ糖脂質を3.0 % 以上含む。 性 状 淡黄色~黄色の粉末で,わずかに特有なにおいがある。 確認試験 本品 0.2 g をとり,ヨウ素試液 2 ml を加え,水浴上で加温して溶かした 後,室温に放置するとき,紫かっ色の沈澱を生じる。 スフィンゴ糖脂質含量 3.0 % 以上 (デンシトメトリー法) (HPLC 光散乱検出法) 乾燥減量 8.0 % 以下 (1 g,105℃,2 時間) 純度試験 (1) 重金属 10 ppm 以下 (第 2 法) (Pb として) (2) ヒ素 1 ppm 以下 (第 3 法) (As2O3として) 一般生菌数 1×102 個/g 以下 (衛生試験法,標準寒天培地) 真菌数 1×102 個/g 以下 (衛生試験法,ポテトデキストロース寒天培地 クロラムフェニコール添加) 大腸菌群 陰 性 (衛生試験法,BGLB 培地) 組 成 成 分 含有量 シクロデキストリン 60 % コメヌカ油 37 % コメヌカスフィンゴ糖脂質 3 % 合 計 100 % 保証期限 製造後2年間 保管方法 高温、直射日光を避け、換気が可能な湿気のない暗所にて密封状態 で保管する。 本品は上記の成分よりなる複合原料である。