大腸がん細胞において
PLCδ1 はオートファジーを制御する
ゲノム病態医科学研究室
略語一覧
AKT : v-akt murine thymoma viral oncogene homolog ATG 14 : autophagy related 14
Baf.A1 : bafilomycin A1
C2 : protein kinase C conserved region 2 DAG : diacylglycerol
EBSS : earle’s balanced salt solution EGFR : epidermal growth factor receptor ERK : extracellular signal-regulated kinase FITC : fluorescein isothiocyanate
GDP : guanosine diphosphate GTP : guanosine triphosphate IP3 : inositol 1,4,5-trisphosphate
KRAS : kirsten rat sarcoma viral oncogene homolog MEK : mitogen-activated protein kinase kinase PBS : phosphate buffered saline
PH : pleckstrin homology PI : propidium iodide
PI3K : phosphatidylinositol-3 kinase PI3P : phosphatidylinositol 3-phosphate PI4P : phosphatidylinositol 4-phosphate PIP2 : phosphatidylinositol 4, 5-bisphosphate
PLC : phospholipase C
PRIP1 : phospholipase C-related catalytically inactive protein type 1 qRT-PCR : quantitative real-time polymerase chain reaction
RA : ras-associating
RasGEF : ras guanine nucleotide exchange factor siRNA : small interfereing RNA
1. 序論
大腸がんは世界的にがん関連死の主な原因の一つであり,特に先進国においてその 傾向は顕著である。臓器別の罹患率では,大腸がんは男性では肺がん,前立腺がんに
続く第 3 位,女性では乳がんに続く第 2 位である[1]。大腸がんは多段階の遺伝的及
びエピジェネティックな変異の蓄積が原因で引き起こされることが知られている[2]。 Kirsten rat Sarcoma viral oncogene homolog (KRAS) は大腸がんにおいて最も頻繁
に変異が認められる遺伝子の一つで,大腸がん患者のおよそ 40 %に変異が認められ ている[3]。 RAS 遺伝子は約 21kDa の低分子量グアノシン三リン酸 (GTP) 結合タンパクを コードしており,RAS タンパクには KRAS,NRAS,HRAS の 3 種類のアイソフ ォームが存在する。上皮成長因子受容体 (EGFR) などからの刺激により,グアノシ ン二リン酸 (GDP) 結合型から GTP 結合型へと変換されると RAS タンパクは活 性化する。通常,活性化 RAS タンパクは自らの GTP 加水分解活性によって GTP を GDP へ変換し不活性化するが,変異による GTP 加水分解活性の低下が RAS の恒常的な活性化へとつながる[4]。KRAS 活性変異は下流の mitogen-activated protein kinase kinase (MEK)/extracellular signal-regulated kinase (ERK) シグナ ル及び/または phosphatidylinositol-3 kinase (PI3K)/v-akt murine thymoma viral oncogene homolog (AKT) 経路を恒常的に活性化し,MEK/ERK シグナルの活性化
については未だ不明な点が多い。 哺乳動物細胞のオートファジーは大きく分けて 3 つのステップから構成される (Fig. 1)。第 1 ステップでは隔離膜と呼ばれる二重の脂質膜が形成される。第 2 ステ ップでは,形成された隔離膜が伸長し細胞質成分を包み込みオートファゴソームを形 成する。第3 ステップではオートファゴソームにリソソームが融合し,リソソームの 加水分解酵素によってオートファゴソームの内容物と内膜が分解される。オートファ ジーの各ステップにおいて幾つかのリン脂質が重要な役割を担っている。例えば, class III PI3K に よ っ て phosphatidylinositol か ら 産 生 さ れ る phosphatidylinositol 3-phosphate (PI3P) はオートファゴソーム形成やオートファ ゴソームとリソソームの融合に,phosphatidylinositol 4-phosphate (PI4P) もオート ファゴソームとリソソームの融合に必須である[11]。更に phosphatidylinositol 4, 5-bisphosphate (PIP2) は細胞膜の膜成分が隔離膜へ移行することに関与し,オート ファゴソーム形成を促進するとの報告もある[12]。隔離膜の膜成分の起源については 議論の余地があるが,他のリン脂質同様にオートファジーにおいて PIP2 が重要な役 割を担っていることが推測される。 Fig. 1 オートファジーの概略 Phospholipase C (PLC) はイノシトールリン脂質代謝においてセカンドメッセン ジャー産生のトリガーとなる酵素である。活性化された PLC は PIP2 を分解し 2
つのセカンドメッセンジャー,inositol 1,4,5-trisphosphate (IP3) と diacylglycerol
(DAG) を産生する。IP3 は小胞体からのカルシウムイオンの遊離を促し,DAG は
の調節が細胞機能維持に重要と考えられる。現在までに哺乳動物では13 種類の PLC が同定されており,それらは構造的にβ,γ,δ,ε,ζ 及び η の6つの型に大別される (Fig. 2)[13]。全ての PLC は高く保存された活性中心である X/Y ドメイン,protein kinase C conserved region 2 (C2) ドメイン,E-F hand モチーフ,pleckstrin homology (PH) ドメイン (ζ を除く) を有している。また,型特有のドメインは特異 的な調節機構に寄与している。我々はこれまでにPLC の最も基本的なアイソザイム の1 つである PLCδ1 が大腸がん組織において発現抑制されていることに着目し,大 腸がんにおける PLCδ1 の機能解析を行ってきた。その結果,MEK/ERK シグナル が PLCδ1 の発現を抑制することや,PLCδ1 は ERK のリン酸化を抑制し, KRAS/MEK/ERK シグナルと PLCδ1 にはネガティブフィードバック制御が存在す ることを明らかとしてきた。また,PLCδ1 が大腸がん細胞の増殖・移動能を抑制す ることを見出し,PLCδ1 が大腸がんの新たな治療ターゲットとなることを報告して きた[15]。 Fig. 2 PLC は構造的に 6つの型に大別される
本研究では,大腸がん細胞においてKRAS/MEK シグナルがオートファジーを促 進しがん細胞の生存能を亢進させるとの報告と KRAS/MEK シグナルが PLCδ1 の
発現を抑制することから,PLCδ1 の発現抑制がオートファジーの亢進に寄与し大腸
2. 材料と方法
2.1 細胞培養KRAS 活性変異大腸がん細胞株である SW620 及び HCT116 細胞は American Type Culture Collection より購入した。PLCδ1 を安定発現させ クローン化した SW620 細胞及びコントロール SW620 細胞は先行研究にお いて樹立した細胞を使用した[15]。各細胞は 10 % (vol/vol) 牛胎児血清添加 RPMI 1640 培地 (Invitrogen) を用いて 37 ℃,5 % (vol/vol) CO2 存在下
にて培養した。 2.2 PLCδ1 を安定発現させた SW620 細胞 (バルク) の樹立 先行研究においてクローニングしたヒト PLCδ1 遺伝子をレトロウイルス ベクター pMXs-IN へサブクローニングし,パッケージング細胞である Platinum-A 細胞へポリエチレンイミンを用いて導入した。48 時間後に細胞 の培養上清を回収しレトロウイルス溶液とした。SW620 細胞にレトロウイ ルス溶液を用いて PLCδ1 遺伝子を導入し,GENETICIN (Thermo Fisher) によって薬剤選択した。
2.3 Small interfering RNA (siRNA) 及びトランスフェクション
PLCδ1 に対する siRNA (siδ1-1 : Hs_PLCD1_3 FlexiTube siRNA ,siδ1-3 : Hs_PLCD1_8 FlexiTube siRNA) 及びネガティブコントロール siRNA (AllStars Negative Control siRNA) は QIAGEN より購入した。また, PLCδ1 に対する siRNA (siδ1-2 : GCUUCUUGGUGGAAGAUUATT) は 北 海 道 シ ス テ ム ・ サ イ エ ン ス か ら 購 入 し た 。KRAS に対する siRNA (Hs_KRAS_2563) 及びネガティブコントロール siRNA (MISSION siRNA Universal Negative Control) は Sigma より購入した。SiRNA の細胞への 導入は Lipofectamine RNAi Max (Invitrogen) を用いて,製品プロトコー ルに従って行った。
2.4 蛍光免疫染色
ッキングを行い,抗 LC3 抗体 (MBL, M152-3) を 4 ℃にて一晩反応させた。 その後,Alexa Fluor 抗マウス IgG 抗体 (Invitrogen) を室温にて 30 分間 反応させた。核は Hoechst 33342 (同仁化学研究所) を室温にて 4 分間反応 させて染色した。蛍光顕微鏡 BZ-X710 (Keyence) にて観察した。
2.5 ウェスタンブロッティング
細胞を PBS で洗浄し,細胞に可溶化バッファー (25 mM Tris-HCl pH 8.0, 150 mM NaCl, 1 % (vol/vol) Nonidet P-40, 1 % (wt/vol) sodium deoxycholate, 0.1 % (wt/ vol) SDS, protease inhibitor mixture (Roche, 11873580001), phosphatase inhibitor (Sigma, P5726 and P0044)) を加え て回収し,超音波処理により細胞を破砕した。20,000 ×g,4 ℃で 15 分間 遠心し,上清に SDS サンプルバッファーを加えた。100 ℃で 5 分間加熱し ウェスタンブロッティングのサンプルとした。サンプルを SDS-PAGE にて 展開後,polyvinylidene difluoride メンブレン (BIO-RAD,162-0177 また は Merck Millipore,IPVH00010) へセミドライ型トランスファー装置を用
いて転写した。タンパクが転写されたメンブレンを5 %スキムミルク/TTBS
にて室温で1 時間ブロッキングし,5 %スキムミルク/TTBS または Can Get Signal solution 1 (TOYOBO) で希釈した一次抗体を 4 ℃にて一晩反応させ た。TTBS で 5 分間,3 回洗浄後,5 %スキムミルク/TTBS または Can Get Signal solution 2 (TOYOBO) で 希 釈 し た 1/2000 量 の horseradish peroxidase-conjugated anti-rabbit または anti-mouse immunoglobulins 抗体 (DAKO) を室温で 40 分反応させた。その後,メンブレンを TTBS で 5 分間 1 回,10 分間 2 回洗浄し,ECL または ECL prime western blotting detection reagents (GE Healthcare) を用いて検出した。使用した抗体は以 下に示す。
抗 ATG14 抗体 (MBL,M184-3),抗 LC3 抗体 (MBL,PM036),抗 β-actin 抗体 (Santa Cruz Biotechnology,sc-1616), 抗 Beclin-1 抗体 (Santa Cruz Biotechnology,sc-48341), 抗 PLCδ1 抗体 (Santa Cruz Biotechnology, sc-30062)。
キ ッ ト の プ ロ ト コ ー ル に 従 い 精 製 し た 。 精 製 し た total RNA か ら ReverTra Ace qPCR Master Mix (TOYOBO) を用いて cDNA を合成し, cDNA を テ ン プ レ ー ト と し て THUNDERBIRD SYBR qPCR Mix (TOYOBO) を用いてキットプロトコールに従い qRT-PCR を行なった。使 用したプライマーは以下に示す。
ACTB (β-actin) F: GCCCTGGCACCCAGCACAAT R: GGAGGGGCCGGACTCGTCAT ATG14 F: CCGCTGTGCAACACTACCC R: AGTAGACGAAATCGCCGCTC BECN1 (Beclin-1) F: GGTTGCGGTTTTTCTGGGAC R: TTGATGGAATAGGAGCCGCC KRAS F: GGGCTTTCTTTGTGTATTTGCCA
R: ACTAGGACCATAGGTACATCTTC 2.7 FACS による死細胞の検出
栄養飢餓への抵抗性の検討では,細胞を 10 % (vol/vol) 牛胎児血清添加 RPMI 1640 培地 または Earle’s balanced salt solution (EBSS) で 72 時間 培養した。抗がん剤への抵抗性の検討では,細胞を溶媒 (DMSO) のみ, Oxaliplatin 10 µM または 15 µM 含んだ 10 % (vol/vol) 牛胎児血清添加 RPMI 1640 培地で 48 時間培養した。細胞を回収し氷冷した PBS で洗浄し た。細胞を 85 µL の 1× binding バッファー (10 mM HEPES pH7.4,140 mM NaCl,2.5 mM CaCl2) に懸濁し,10 µL の Annexin V-fluorescein
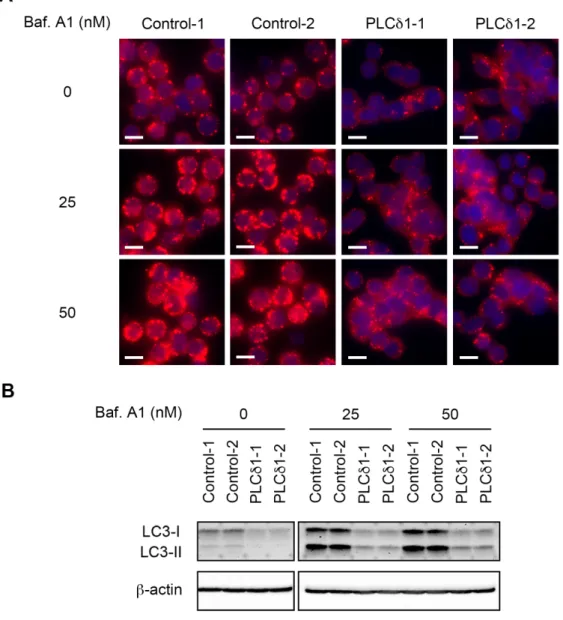
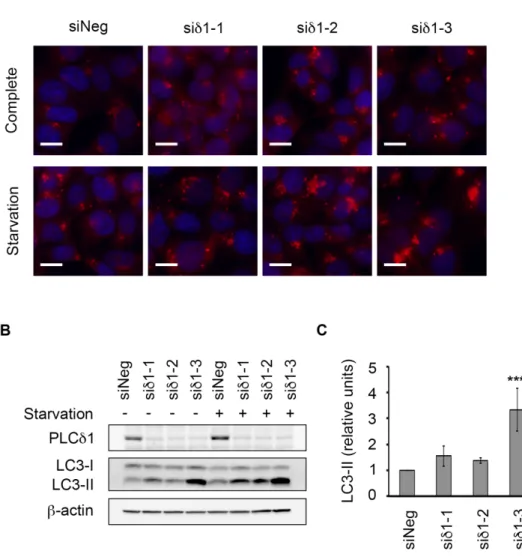
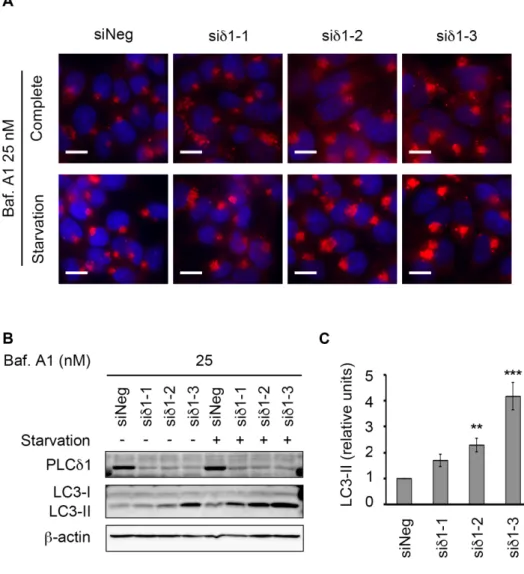
3.4 内在性 PLCδ1 の発現抑制はオートファジーを促進する PLCδ1 過剰発現がオートファジーを抑制したことから,次に内在性 PLCδ1 のオートファジーでの役割を検討した。塩基配列の異なる 3 種類の PLCδ1 に対する siRNA によって KRAS 活性変異のある大腸がん細胞 HCT116 の内在性 PLCδ1 を発現抑制し (siδ1-1, -2, -3),飢餓条件下で誘 導されるオートファゴソームをLC3 の免疫染色によって観察した。使用し た3 種類のうち 2 種類の siRNA (siδ1-2, -3) による PLCδ1 の発現抑制によ って飢餓条件下でのオートファゴソーム数の増加が認められた (Fig. 6A)。 また同様の条件で培養した細胞の PLCδ1 発現量と LC3-II 量をウェスタ ンブロッティングによって検出した。いずれの配列においても PLCδ1 の発 現抑制が確認され,飢餓条件下においてコントロール細胞 (siNeg) に比べ て PLCδ1 発現抑制細胞 (siδ1-1, -2, -3) で LC3-II 量の増加が認められた (Fig. 6B, 6C)。 次に内在性 PLCδ1 を発現抑制した HCT116 細胞を Baf.A1 で処理し, オートファゴソームの分解を抑制した際のオートファゴソーム蓄積量を LC3 の免疫染色によって比較した。その結果,siδ1-1 では 1 つの細胞内に 蓄積するオートファゴソームが siNeg と比べて若干増加し,siδ1-2 及び siδ1-3 ではオートファゴソームが顕著に増加した (Fig. 7A)。また,LC3-II 量をウェスタンブロッティングによって検出したところsiRNA (siδ1-1, -2, -3) による PLCδ1 の発現抑制によって LC3-II 量の増加が認められ,siδ1-2 及び siδ1-3 では有意に LC3-II 量が増加した (Fig. 7B, 7C)。
PLCδ1 過剰発現がオートファジーを抑制し内在性 PLCδ1 の発現抑制
がオートファジーを促進したことから,PLCδ1 は大腸がん細胞においてオ
Fig. 6 内在性 PLCδ1 の発現抑制はオートファゴソーム数を増加させる (A) HCT116 細胞にネガティブコントロール siRNA (siNeg) 及び 3 種類の PLCδ1
に対する siRNA (siδ1-1,-2,-3) をトランスフェクションし,通常培地または EBSS
Fig. 7 内在性 PLCδ1 の発現抑制はオートファジーを促進する
(A) HCT116 細胞にネガティブコントロール siRNA (siNeg) 及び 3 種類の PLCδ1
に対する siRNA (siδ1-1,-2,-3) をトランスフェクションし,Baf.A1 を添加した通
常培地または EBSS (飢餓) で 1 時間培養し,LC3 を抗 LC3 抗体で,核を Hoechst 33342 で染色した。Complete : 通常培地,Starvation : EBSS (飢餓),赤 : LC3,青 : 核,スケールバー : 20 µm。(B) PLCδ1 を抗 PLCδ1 抗体,LC3-I 及び LC3-II を抗 LC3 抗体を用いたウェスタンブロッティングによって検出した。Starvation (-) : 通常
培地,starvation (+) : EBSS (飢餓),β-actin をローディングコントロールとして用い
3.6 PLCδ1 の過剰発現は Beclin-1 の発現を抑制する
PLCδ1 によるオートファジー抑制機構を解明するため,次に私はオート
ファジーの開始に必須である PI3P を産生する class III PI3K 複合体に 着目した。Class III PI3K 複合体は class III PI3K である VPS34, Autophagy related 14 (ATG14) 及び Beclin-1 からなり, KRAS の発現 抑制によって Beclin-1 の発現が低下することが報告されている[10]。そこ で PLCδ1 過 剰 発 現 及 び コ ン ト ロ ー ル SW620 細 胞 の ATG14 及 び Beclin-1 の発現量をウェスタンブロッティングにより検討した。PLCδ1 の 過剰発現は ATG14 の発現量には変化を与えなかったが,Beclin-1 の発現 量を低下させた (Fig. 9A, 9B)。また qRT-PCR により mRNA 量を比較し
たところ,ウェスタンブロッティングの結果と同様に PLCδ1 の過剰発現は
ATG14 の mRNA 量には変化を与えなかったが,Beclin-1 の mRNA 量
を有意に減少させた。以上のことから,PLCδ1 によるオートファジーの抑
制は Beclin-1 の転写レベルでの制御を介していることが示唆された。
Fig. 8 KRAS ノック ダウンに よって抑制 されるオ ートファジ ーは PLCδ1 ノ ックダウンに よって回復する
(A) HCT116 細胞にネガティブコントロール siRNA のみ (siNeg /siKRAS(-)), KRAS に対する siRNA のみ (siNeg/siKRAS(+)),PLCδ1 及び KRAS に対する siRNA (siδ1-1,-2,-3/siKRAS(+)) をトランスフェクションし,通常培地または EBSS
(飢餓) で 1 時間培養した。KRAS の mRNA レベルを qRT-PCR によって検出した。
3.7 PLCδ1 の過剰発現によるオートファジーの抑制は,大腸がん細胞の 栄養飢餓への抵抗性を低下させる オートファジーが大腸がん細胞の栄養飢餓への抵抗性に寄与しているこ とが知られているため[7],次に私は PLCδ1 によるオートファジー抑制が 大腸がん細胞の飢餓条件下での生存能へ影響を与えるか検討した。PLCδ1 過剰発現及びコントロール SW620 細胞を飢餓条件下で 72 時間培養し,死 細胞数を FITC 標識 Annexin V 及び PI による二重染色によって定量し Fig. 9 PLCδ1 の過剰発現は Beclin-1 の発現を抑制する (A) PLCδ1 過剰発現 (PLCδ1-1, -2)及びコントロール SW620 細胞 (Control-1, -2) を通常培地または EBSS (飢餓) で 3 時間培養した。ATG14,Beclin-1,LC3-I 及び LC3-II をそれぞれ抗 ATG14 抗体,抗 Beclin-1 抗体及び抗 LC3 抗体を用いたウェ スタンブロッティングによって検出した。β-actin をローディングコントロールとして 用いた。Starvation (-) : 通常培地,starvation (+) : EBSS (飢餓),Beclin-1 のバンド
下の数値は Control-1 のバンドを 1 として算出した定量値。(B) ATG14 及び BECN1
(Beclin-1) の mRNA レベルを qRT-PCR によって検出した。ATG14 及び BECN1
の mRNA レベルは ACTB (β-actin)の mRNA レベルで標準化し,通常培地の
た。通常培地では PLCδ1 過剰発現細胞とコントロール細胞の死細胞数に 大きな差は認められなかったが,飢餓条件下ではコントロール細胞と比較し て PLCδ1 過剰発現細胞で死細胞数が約 2 倍に増加し,栄養飢餓への抵抗 性が低下していることが明らかとなった (Fig. 10A, 10B)。 3.8 PLCδ1 の過剰発現によるオートファジーの抑制は,大腸がん細胞の 抗がん剤への抵抗性を低下させる オートファジーは大腸がん細胞の抗がん剤への抵抗性を増大させること も知られているため[8],PLCδ1 によるオートファジー抑制が大腸がん細胞 の抗がん剤処理下での生存能へ影響を与えるか検討した。まず,抗がん剤に よって誘導されるオートファジーを PLCδ1 が抑制するか検討するため PLCδ1 過剰発現 SW620 細胞を大腸がん治療で一般的に使用されている Fig. 10 PLCδ1 の過剰発現は,大腸がん細胞の栄養飢餓への抵抗性を低下させ る (A) PLCδ1 過剰発現 (PLCδ1-1, -2)及びコントロール SW620 細胞(Control-1, -2) を 通常培地または EBSS (飢餓) で 72 時間培養した。死細胞数の割合を Annexin V-FITC 及び PI の二重染色を用いたフローサイトメトリーによって解析した。 Starvation (-) : 通常培地,starvation (+) : EBSS (飢餓)。(B) 棒グラフは死細胞数の
割合を示す。死細胞数はA のサイトグラムの右上段 (Annexin V-FITC 陽性/PI 陽性)
Oxaliplatin で 48 時間処理し,誘導されるオートファジーを LC3-II を指 標としたウェスタンブロッティングにより検討した。コントロール細胞では Oxaliplatin の用量依存的に LC3-II 量が増加しオートファジーが誘導さ れた一方で,PLCδ1 過剰発現細胞では LC3-II 量の増加は限定的でありオ ートファジーの抑制が確認された (Fig. 11A)。続いて Oxaliplatin で 48 時 間処理した際の死細胞数を FITC 標識 Annexin V 及び PI による二重染 色によって定量した。Oxaliplatin 処理によりコントロール及び PLCδ1 過
剰発現細胞共に死細胞数の増加が認められたが,増加率は PLCδ1 過剰発現
細胞で有意に高く,PLCδ1 の過剰発現が大腸がん細胞の抗がん剤に対する
Fig. 11 PLCδ1 の過剰発現は,大腸がん細胞の抗がん剤への抵抗性を低下させ る
(A) PLCδ1 過剰発現 (PLCδ1-1, -2) 及びコントロール SW620 細胞 (Control-1, -2) を10 µM または 15 µM の Oxaliplatin で 48 時間処理し,LC3-I 及び LC3-II を抗 LC3 抗体を用いたウェスタンブロッティングにより検出した。β-actin をローディン グコントロールとして用いた。(B) 10 µM または 15 µM の Oxaliplatin で 48 時間処 理し,死細胞数の割合を Annexin V-FITC 及び PI の二重染色を用いたフローサイ
トメトリーによって解析した。(C) 棒グラフは死細胞数の割合を示す。死細胞数は A
を誘導し,がんの悪性化に寄与する種々の間葉系遺伝子の発現を抑制することを明ら
かとしている[15]。また,microRNAs によって引き起こされる大腸がん細胞の上皮
間葉転換が,Beclin-1 の発現上昇とオートファジーの亢進につながることが報告さ れている[22]。以上より,PLCδ1 による上皮間葉転換の抑制が Beclin-1 の発現及び オートファジーの抑制メカニズムであると考えられる。さらに PLCδ1 による Class III PI3K 複合体の制御については Beclin-1 の発現抑制以外のメカニズムも考えら れる。PLCδ1 の基質である PIP2 が class III PI3K 複合体の安定性を高めオートフ
ァジーを促進するとの報告がある[23]。PLCδ1 による PIP2 の分解が Beclin-1 を
5. 参考文献
[1] L.A. Torre, F. Bray, R.L. Siegel, J. Ferlay, J. Lortet-Tieulent and A Jemal, Global cancer statistics, 2012, CA Cancer J Clin. 65 (2015) 87-108.
[2] G. Binefa, F. Rodríguez-Moranta, À. Teule and M. Medina-Hayas, Colorectal cancer: from prevention to personalized medicine, World J Gastroenterol. 20 (2014) 6786-6808.
[3] K. Zenonos and K. Kyprianou, RAS signaling pathways, mutations and their role in colorectal cancer, World J Gastrointest Oncol. 5 (2013) 97-101.
[4] Y. Pylayeva-Gupta, E. Grabocka and D. Bar-Sagi, RAS oncogenes: weaving a tumorigenic web, Nat Rev Cancer. 11 (2011) 761-774.
[5] J.Y. Guo, H.Y. Chen, R. Mathew, J. Fan, A.M. Strohecker, G. Karsli-Uzunbas, J.J. Kamphorst, G. Chen, J.M.S. Lemons, V. Karantza, H.A. Coller, R.S. DiPaola, C. Gelinas, J.D. Rabinowitz and E. White, Activated Ras requires autophagy to maintain oxidative metabolism and tumorigenesis, Genes Dev. 25 (2011) 460-470. [6] E. White, The role for autophagy in cancer, J Clin Invest. 125 (2015) 42-46. [7] K. Sato, K. Tsuchihara, S. Fujii, M. Sugiyama, T. Goya, Y. Atomi, T. Ueno, A. Ochiai and H. Esumi, Autophagy is activated in colorectal cancer cells and contributes to the tolerance to nutrient deprivation, Cancer Res. 67 (2007) 9677-9684.
[8] M. Selvakumaran, R.K. Amaravadi, I.A. Vasilevskaya and P.J. O'Dwyer,
Autophagy inhibition sensitizes colon cancer cells to antiangiogenic and cytotoxic therapy, Clin Cancer Res. 19 (2013) 2995-3007.
[10] S. Alves, L. Castro, M.S. Fernandes, R. Francisco, P. Castro, M. Priault, S.R. Chaves, M.P. Moyer, C. Oliveira, R. Seruca, M. Côrte-Real, M.J. Sousa and A. Preto, Colorectal cancer-related mutant KRAS alleles function as positive regulators of autophagy, Oncotarget. 6 (2015) 30787-30802.
[11] S. Martens, S. Nakamura and T. Yoshimori, Phospholipids in autophagosome formation and fusion, J Mol Biol. 428 (2016) 4819-4827.
[12] K. Moreau, B. Ravikumar, C. Puri and D.C. Rubinsztein, Arf6 promotes autophagosome formation via effects on phosphatidylinositol 4,5-bisphosphate and phospholipase D, J Cell Biol. 196 (2012) 483-496.
[13] J.B. Park, C.S. Lee, J.H. Jang, J. Ghim, Y.J. Kim, S. You, D. Hwang, P.G. Suh and S.H. Ryu, Phospholipase signaling networks in cancer, Nat Rev Cancer. 12 (2012) 782-792.
[14] Y. Nakamura and K. Fukami, Regulation and physiological functions of mammalian phospholipase C, J Biochem. 161 (2017) 315-321.
[15] R. Satow, T. Hirano, R. Batori, T. Nakamura, Y. Murayama and K. Fukami, Phospholipase Cδ1 induces E-cadherin expression and suppresses malignancy in colorectal cancer cells, Proc Natl Acad Sci USA. 111 (2014) 13505-13510.
[16] D.J. Klionsky, K. Abdelmohsen, A. Abe, et al., Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition), Autophagy. 12 (2016) 1-222.
[17] N. Mizushima and T. Yoshimori, How to interpret LC3 immunoblotting, Autophagy. 3 (2007) 542-545.
Auberger and Arnaud Jacquel, Autophagy during CSF1-induced human monocyte differentiation and is a potential target in CMML, Autophagy. 11 (2015) 1114-1129.
[19] L. Dai, X. Chen, X. Lu, F. Wang, Y. Zhan, G. Song, T. Hu, C. Xia and B. Zhang, Phosphoinositide-specifc phospholipase Cγ1 inhibition induces autophagy in human colon cancer and hepatocellular carcinoma cells, Sci Rep. 7 (2017) 13912. [20] C.V. Dang and G.L. Semenza, Oncogenic alterations of metabolism, Trends Biochem Sci. 24 (1999) 68-72.
[21] A.E. Lo Ré, M.G. Fernández-Barrena, L.L. Almada, L.D. Mills, S.F. Elsawa, G. Lund, A. Ropolo, M.I. Molejon, M.I. Vaccaro and M.E. Fernandez-Zapico, Novel AKT1-GLI3-VMP1 pathway mediates KRAS oncogene-induced autophagy in cancer cells, J Biol Chem. 287 (2012) 25325-25334.
[22] X. Yu, W. Shi, Y. Zhang, X. Wang, S. Sun, Z. Song, M. Liu, Q. Zeng, S. Cui and X. Qu, CXCL12/CXCR4 axis induced miR-125b promotes invasion and confers 5-fluorouracil resistance through enhancing autophagy in colorectal cancer, Sci Rep. 7 (2017) 42226.
[23] X. Tan, N. Thapa, Y Liao, S. Choia and R.A. Anderson, PtdIns(4,5)P2 signaling regulates ATG14 and autophagy, Proc Natl Acad Sci USA. 113 (2016) 10896-10901.
[24] H. Umebayashi, A. Mizokami, M. Matsuda, K. Harada, H. Takeuchi, I. Tanida, M. Hirata and T. Kanematsu, Phospholipase C-related catalytically inactive protein, a novel microtubule-associated protein 1 light chain 3-binding protein, negatively regulates autophagosome formation, Biochem Biophys Res Commun. 432 (2013) 268-274.
to phospholipase C-δ1, Biochem J. 318 (1996) 561-568.
[26] T. Kanematsu, K. Yoshimura, K. Hidaka, H. Takeuchi, M. Katan and M. Hirata, Domain organization of p130, PLC-related catalytically inactive protein, and structural basis for the lack of enzyme activity, Eur J Biochem. 267 (2000) 2731-2737.
[27] S.T. Pan, Z.L. Li, Z.X. He, J.X. Qiu and S.F. Zhou, Molecular mechanisms for tumour resistance to chemotherapy, Clin Exp Pharmacol Physiol. 43 (2016) 723-737.
[28] N. Chen and V. Karantza, Autophagy as a therapeutic target in cancer, Cancer Biol Ther. 11 (2011) 157-168.
[29] M. Yun, H.Y. Bai, J.X. Zhang, M. Yun, H.Y. Bai, J.X. Zhang, J. Rong, H.W. Weng, Z.S. Zheng, Y. Xu, Z.T. Tong, X.X. Huang, Y.J. Liao, S.J. Mai, S. Ye and D. Xie, ULK1: a promising biomarker in predicting poor prognosis and therapeutic response in human nasopharygeal carcinoma, PLoS One. 10 (2015) e0117375. [30] O. Adams, B. Dislich, S. Berezowska, A.M. Schläfli, C.A. Seiler, D. Kroell, M.P. Tschan and R. Langer, Prognostic relevance of autophagy markers LC3B and p62 in esophageal adenocarcinomas, Oncotarget. 7 (2016) 39241-39255.
[31] S. Lefort, C. Joffre, Y. Kieffer, A.M. Givel, B. Bourachot, G. Zago, I. Bieche, T. Dubois, D. Meseure, A. Vincent-Salomon, J. Camonis and F. Mechta-Grigoriou, Inhibition of autophagy as a new means of improving chemotherapy efficiency in high-LC3B triple-negative breast cancers, Autophagy. 10 (2014) 2122-2142.