開発と天然物合成
著者 津吹 政可
雑誌名 星薬科大学紀要
号 51
ページ 129‑137
発行年 2009
URL http://id.nii.ac.jp/1240/00000135/
1. はじめに
Wittig転位はオキシカルボアニオンによる1,2ある いは2,3転位の総称であり、 分子内での炭素−炭素結 合形成反応のひとつである。 とりわけ、 2,3転位は5 員環遷移状態を経由して進行することから、 立体特異的 に炭素−炭素σ結合を形成しうる特徴を有している1)。 一般に、 基質としてはカルボアニオンの安定化基である ビニル、 エチニル、 アリール、 カルボニル基等をもつア リルエーテル系が用いられるが、 芳香族複素環化合物を 安定化基に用いるWittig転位の例はピリジン等のπ電 子欠如系芳香族複素環化合物に限られている。
我々は、 アリルフリルメチルエーテル系でのWittig 転位が進行するならば、 フラン誘導体の新規合成法の開 発につながるものと考え、 2-並びに3-フリルメチルエー
テル類のWittig転位を検討した。 これまでにフランを
用いるWittig転位はシアノヒドリンを安定化基とする
3 -フリルメチルエーテルの1例のみであり、 π電子過
剰系芳香族複素環化合物フランを安定化基に用いる例は 知られていない。
2. 3-フリルメチルエーテル類のWittig転位反応 まず、 3-フリルメチルエーテル類のWittig転位を検
討した。 3-フリルメチルエーテル類を塩基で処理した場
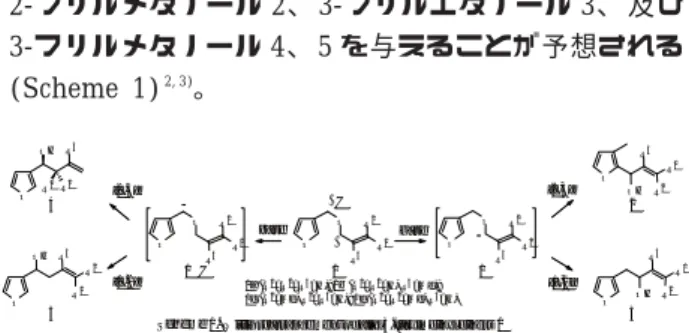
合、 対応するアニオン1と1’を生成しうる。 これら アニオン1と’が2,3あるいは1,2転位すると、
2-フリルメタノール2、 3-フリルエタノール3、 及び
3-フリルメタノール4、 5を与えることが予想される
(Scheme 1)2, 3)。
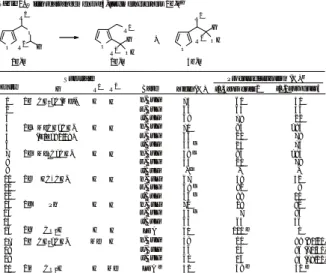
そこで、 アリル3-フリルメチルエーテル1aを基質と して用い種々の条件を検討した結果、 THF中でn-, s−,
及び t−BuLiで処理すると、 アリル位ので脱プロト
ン化が起こり、 さらに2,3-および1,2転位が進行し 生成物2a並びに3aを与えた (Table 1)。 この位で の優先的な脱プロトン化は、 ab initio計算による位 のアニオンが対応する’アニオンに比べて17.9kJ/mol ほど相対的に安定であるとの計算結果ともよく合致して いる。
さらに、 3-フリルメチルエーテル1b-iの同条件下で
総 説
芳香族複素環化合物を利用する
Wittig
転位反応の開発と天然物合成津 吹 政 可
星薬科大学 医薬品化学研究所 生体分子有機化学研究室
Development of Wittig rearrangement of arylmethyl ethers and its application to natural product synthesis
Masayoshi TSUBUKI
Bioorganic Chemistry, Institute of Medicinal Chemistry, Hoshi University
!"
#$ "%& "'( )%(&*%!+)&
O CH2OH
O O
R2 R1
O O
R2 O R2
OH R1
O O
R1 R2
O O
R1 R2
O R2 R1
OH R1
α α'
α'
α'
α α α'
α
O
O base
R3 R1 R2
O O
R3 R1 R2 O
O
R3 R1 R2
base α
α'
O R1
OH R2 R3
O R1 OH R2
R3 O
R3 OH
R2R1
O R2 OH R3
R1
1 1α
1α'
[2,3]
[1,2]
[2,3]
[1,2]
2
3 4
5
Scheme 1.Wittig rearrangement of allyl 3-furylmethyl ethers1 1a(R1=R2=R3=H);1b(R1=R2=H, R3=Me);
1c(R1=Me, R2=R3=H);1d(R1=R2=Me, R3=H)
O O
O OH
+
O OH
1a 2a 3a
Table 1. Wittig rearrangement of allyl 3-furylmethyl ether1a
Conditions
Base (equiv.) Solvent Additive Temp.
Product distribution (%)a
2a 3a 1ab
n-BuLi (2 eq)
s-BuLi (5 eq) t-BuLi (4 eq) n-BuLi (5 eq) n-BuLi (5 eq)
THF THF pentane-THF
(v/v=9:1) THF LDA (10 eq)
THF THF
TMEDA (12 equiv.)
-78→0°C -78→0°C -78→0°C -78→0°C -78°C -78°C
34 16 50
67 33
72 28
35 18 18c
70 30
>95 <5 aDetermined by 270 MHz NMR analysis of the crude products.
bRecovered starting material.cUndentified products were formed.
Entry others
1 2 3 4 5 6
29
の転位も検討した (Table 2)。 アリル、 メタリル、 プ ロパルギルエーテル1a,b,e及びフリルメチルオキシ酢 酸1 gでは2,3転位が有利であるのに対して、 クロチ ル、 プレニル、 ベンジルエーテル1c,d,fでは1,2転位 が主に進行した。 n−BuLiを用いる条件では−78から 0℃に昇温するため、 1,2転位体の生成量はt-BuLiに 比べて多くなり、 逆に2,3転位体ではt-BuLiのほうが
n-BuLiよりも優先する傾向が見られる。
以上のように、 3-フリルメチルエーテル類のWittig 転位反応の開発に成功したので、 本転位反応の天然物合 成への応用の一環としてdendrolasin並びにnaginata ketone の 合 成 を 行 っ た 。 セ ス キ テ ル ペ ン で あ る dendrolasin10の合成は、 次のように行った(Scheme 2)。
原料として3-フランメタノールを用い、 これを3-フリ ルメチルゲラニルエーテル7とした。 エーテル7を THF中-78℃で過剰のs-BuLiと処理したところ、 目的
とする3-フリルエタノール8が好収率で得られた。
Barton 法 に よ る 水 酸 基 の 除 去 を 検 討 し た が 、 dendrolasinは得られなかった。 そこで、 アセテート9 を経由することで達成した。
ついで、 naginata ketone11の合成を行った(eq. 1)。
3-フリルメチルプレニルエーテルの転位により得られた フリルメタノール2dを二酸化マンガンで酸化すること により目的物を得た。
3. 2-フリルメチルエーテル類のWittig転位反応
2-フリルメチルエーテル12の転位反応における生成
物は、 脱プロトン化により生ずるアニオン12及び12 ’が2,3転位することにより13と15を与え、 また 1,2転位により14と16を生成するものと考えられる (Scheme 3)4)。
3-フリルメチルエーテルの場合と同様の条件で2-フ
リルメチルエーテル類12a-eのWittig転位を検討した (Table 3)。 塩基としてt-BuLiを用いた場合、 フラン 環部が安定化基となり位にアニオン12が選択的に 生成し、 2,3転位することで2-フランメタノール13a- eを主生成物として与えた。 これに対して、 相対的によ り弱い塩基であるn-BuLiやs-BuLiを用いると、 12a-d の反応では’位での脱プロトン化が優先して12’の 2,3-及び1,2転位体である15a-dと16a-dを与えた。
本反応の特徴は、 (E)-及び(Z)-クロチルエーテルの 2,3転位がベンジルエーテル系に比べてより高い立体 選択性をもって進行し、 基質のオレフィン部の幾何異性 を制御することでsyn-及びanti-体が優先的に作り分け られる点である。 興味深いことに、 クロチルエーテル
12c,dの転位反応は顕著な溶媒効果を受けることがわかっ
O O
R1 R2
O
O OH
R1 R2
O R1
R2 OH
O R1
R2 OH
O O
R1 R2
O O
R1 R2 base
base
[2,3]
12 α α'
12α
12α'
[1,2]
[2,3]
[1,2]
13
16 15 14 R2 R1
OH
Scheme 3. Wittig rearrangement of allyl 3-furylmethyl ethers 12
O OH O O
R2 R1
O Me O
α R2
R1 R3
R3
R2 OH
R1
R3
R2 OH
R3 R1
R2 OH R1
R3
- tert-BuLi
sec-BuLi
67c -78°C
19
82 Temp.
(°C)
-78 to -20°C -78°C
20 α
CH2=C(CH3)- 54
52 E/Z
98/2 45
α'
-78°C -78 to -20°C 50
-78°C
-78 to -20°C 23c
tert-BuLi
23c
tert-BuLi 93
74 [2,3] product
19
-78 to -20°C 26
-78°C sec-BuLi
62
7
90 82 sec-BuLi -78°C Substrate
(G)
18 48
5 -78°C
-
91 7
-78°C
[1,2] product
54
13 -
(75/25)d -
17
- (73/27)d (66/34)d
56
14
10 15
- 63c
-78°C
-
-
sec-BuLi
[1,2] product
-
[2,3] product
-78°C
-
- Product Distribution b
- Z/E
98/2 α'
(10/90)d -
(10/90)d (9/91)d
2 -78 to -20°C
tert-BuLi sec-BuLi tert-BuLi
23 30c
39 - 31c
Base*
55
5 16 O
- n-BuLi
n-BuLi
n-BuLi CH2=CH-
(CH3)2C=CH- CH3CH=CH-
n-BuLi n-BuLi CH3CH=CH-
G
Table 3. Wittig rearrangement of 2-furylmethyl ethers 12a-e a
a Reactions were carried out with base in THF at -78°C. n-BuLi (10 equiv.) was employed and the reaction was allowed to warm to - 20°C. s-BuLi (3 equiv.) was employed. t-BuLi (5 equiv.) was employed. b Determined by 270 MHz NMR analysis of the crude products. c [2,3] Rearrnged products are equal to [1,2] rearranged products. d In parentheses: the ratio of the anti to the syn product.
12a-e 13a-e 14a-e 15a-e 16a-e
12a
12b
12c
12d
12e O
OH i O
O ii
O R
6 7 8 R=OH
9 R=OAc 10R=H
iii iv Scheme 2.Reagents and conditions: i, geranyl bromide, NaH, DMF, 70%; ii,s-BuLi, THF, -78°C, 82%;
iii, Ac2O, pyridine, 91%; iv, Li, EtNH2, 39%
O O
G O G +
O G
1b-i 2b-i 3b-i
Table 2. Wittig rearrangement of 3-furylmethyl ethers1b-ia
Substrate
Base Yield (%)
Product distribution (%)b [2,3] product2 [1,2] product3
n-BuLi 75
63 68
60 40
64 46
78 22
aReactions were carried out with base in THF at -78°C.n-BuLi (5 equiv.) was employed and the reaction was allowed to warm to 0°C.s-BuLi (5 equiv.) was employed.t-BuLi (4 equiv.) was employed. LDA (4 equiv.) was employed and the reaction was allowed to warm to 0°C.bDetermined by 270 MHz NMR analysis of the crude products.cStarting material was recovered.dReaction was sluggish.eIsolated as the corresponding methyl ester.fThe ratio of thethreoto theer yt hr oproduct is given in the parentheses.
gLDA (10 equiv.) was employed.
R1
R1 R2
R1
R2 OH
R2 OH
t-BuLi s-BuLi G
1b CH2=C(Me)- R1 R2
H H
n-BuLi 70
66 34c
<5 >95
21 79
24 76
t-BuLi s-BuLi
1c MeCH=CH- H H
(E/Z=82/18)
n-BuLi 48c
53
<5 >95
21 79
- -
t-BuLi s-BuLi
1d Me2C=CH- H H
n-BuLi 67
69c 46c
48 52
92 8
89 11
t-BuLi s-BuLi
1e HC≡CH- H H
n-BuLi 72
44c 64
18 82
7 93
64 36
t-BuLi s-BuLi
1f Ph H H
LDA 60
1g CO2H H H 100e 0
n-BuLi 48
56 60
11 89 (80/20)f
14 86 (70/30)f
16 84 (78/22)f
t-BuLi s-BuLi
1h CH2=CH- Me H
LDAg 52
1i CO2H H Me 49e 51e
-d 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Entry
18 19 20
た(eq. 2, 3)。 (E)-クロチルエーテル12cはTHF以外 の溶媒では選択性が反転してsyn-体を優先的に与えた。
(Z)-クロチルエーテル12dはhexane中ではsyn-体の みを与えた。
次に、 プロパルギルエーテル17a,bの転位反応を検 討した(Table 4)。 末端アルキン17aではs-BuLiとt- BuLiを用いたとき、 位での脱プロトン化が優先して 起こり、 1,2転位体19aを主生成物として与えた。 こ れは、 アセチリドの生成により、 位のプロトンが相対 的により酸性となり、 アニオンの転位も1,2転位が優 先したものと考えられる。 これに対して、 17bではエチ ニル基の電子求引性により脱プロトン化は’位で起こ り、 2,3転位体20bを主生成物として与えた。
化合物13c,dはオレフィン部の酸化的開裂反応により
それぞれ対応するプロピオン酸誘導体22c,dに導いた。
既に、 22cは抗生物質であるoudemansin AとPrelog- Djerassiラクトンへの変換が行われている(Scheme 4)。
2-フリルメチルエーテル類の2,3Wittig転位反応は 高い立体選択性をもって進行することが判明したので、
本転位反応における不斉転写を検討した(eq. 4,5)5)。 キ ラルな(E)-及び(Z)-クロチルエーテルを転位反応に付 すと、 100%の選択性で対応するanti-及びsyn-体を与
えた。 主生成物であるanti-及びsyn-体の水酸基の絶対 配置に関しては、 CD励起子キラリティー法によりRと 決定した。
続いて、 クロチル2-フリルメチルエーテル類の不斉 転位反応を検討した(eq. 6,7)。 キラル配位子として(-)-
sparteineを用いて検討したところ、 中程度ながら不斉
が誘起されることが明らかにされた。 なお、 (E)-及び (Z)-クロチルエーテルの両方から転位成績体としてsyn- 体が主生成物として得られた。
以上のように、 2-フリルメチルエーテル類のWittig 転位反応ではフラン環が安定化基となり、 ベンジル位に 相当する位置でアニオンを生じ、 これが立体選択的に 2,3転位することでフリルメタノール誘導体を与える ことが判明した。 本転位反応の特徴は、 (E)-及び(Z)- クロチルエーテルの2,3転位がベンジルエーテル系に 比べてより高い立体選択性をもって進行し、 基質のオレ フィン部の幾何異性を制御することでsyn-及びanti-体 が優先的に作り分けられる点である。 転位反応における 遷移状態は、 封筒形の立体配座で進行しているものと考 えられる(Scheme 5)。
O O
O OH tert-BuLi
-78°C O
OH +
O O
O OH tert-BuLi
-78°C O
OH + THF
Et2O toluene hexane
73 27
13 87
26 74
22 78
THF Et2O toluene hexane
90 10
94 6
92 8
>99 <1
eq. 2
eq. 3
O OH α O
O
O Me
Temp.
(°C)
O
-
OH
OH
OH O
9
R R
R R
R
α α'
14 -78 to -20°C
α'
tert-BuLi
[2,3] product
- - sec-BuLi -78°C Substrate
49 21
3
-78°C 9 9
[1,2] product
21 85
45 65
12
11 -78°C -
6
sec-BuLi
[1,2] product [2,3] product
-78°C
89 Product Distributionb
- 82 -78 to -20°C
tert-BuLi
-
70 Basea
R = H
R = Me n-BuLi -
n-BuLi
a Reactions were carried out with base in THF at -78°C. n-BuLi (10 equiv.) was employed and the reaction was allowed to warm to 0°C. s-BuLi (3 equiv.) was employed. t-BuLi (5 equiv.) was employed. b Determined by 270 MHz NMR analysis of the crude products.
Table 4. Wittig rearrangement of propargyl ethers 17 a,b
17 18 19 20 21
17a
17b
OMe
CO2Me OMe
O CO2Me H
O
Oudemansin A Prelog-Djerassi lactone (methyl ester) O
OH
O OTES
O CHO
OTES
O CO2Me
(59.3%) OH TESCl, iPr2EtN
H2O, CH2Cl2
NaClO2, NaH2PO4 dryCH2Cl2
1) OsO4, NMO (CH3)2CO:H2O=2:1
1) 2-Methyl-2-butene
2) MeI, NaHCO3 2) NaIO4
anti/syn=73/27
t-BuOH, H2O
(88.9%)
(46.8%)
O OH
O OTES
O CHO
OTES
O CO2Me
OH TESCl, iPr2EtN
H2O, CH2Cl2
NaClO2, NaH2PO4 dryCH2Cl2
1) OsO4, NMO (CH3)2CO:H2O=2:1
1) 2-Methyl-2-butene
2) MeI, NaHCO3 anti/syn=10/90
2) NaIO4 (86.6%)
t-BuOH, H2O
(64.9%) (54.0%)
Scheme 4. Synthetic transformation of syn- and anti-1-(2-furyl)-2-methyl-3-buten-1-ols into corresponding versatile propionates DMF
DMF 13c
13d
22c
22d
O O
O OH tert-BuLi
THF -78°C 87 % ee 60 %
(1R, 2S ) 87 % ee O
OH (1S, 2S ) +
93 7
(S)
O O
O OH tert-BuLi
THF -78°C
69 % 87 % ee
(1R, 2R ) 87 % ee O
OH (1S, 2R ) +
61 : 39
(E/Z=78/22) (S)
45 % ee :
eq.4
eq.5
O OH O
O O
OH
+
O O
O OH sec-BuLi (1.3eq)
(-)-sparteine (1.5eq) -78°C
25 % (1S, 2S ) 42 % ee
toluene
sec-BuLi (1.3eq) (-)-sparteine (1.5eq)
-78°C 28 % Et2O
(1S, 2R ) 28 % ee (1S, 2S )
92 : 8
eq. 6
eq. 7
O Me
Fr
O Me
Fr
H O Fr
Me H
Hb
Me O H
H Fr
Hb
Me O Fr
H H
Hb H
O H
Me Fr
Hb
HO Fr HO Fr
E
Z anti syn
Fr: 2-furyl
T1 T2
T3 T4
Scheme 5. Transition state for Wittig rearrangement of crotyl 2-furylmethyl ethers
4. フリルメチルエーテル類のWittig転位反応を用 いる天然物の合成研究
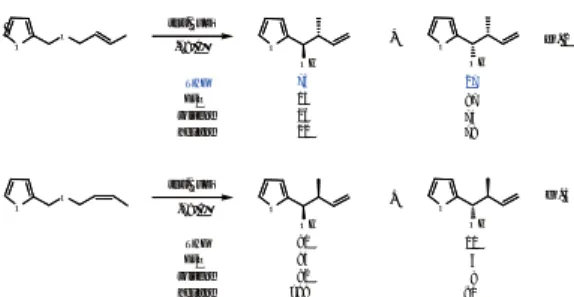
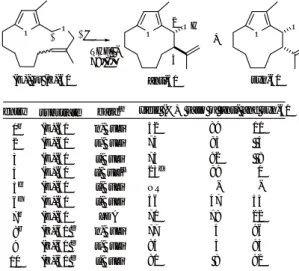
4.1 生理活性ステロイド側鎖の立体選択的構築法の開発 我々は、 ステロイド側鎖部にフリルメタノールをもつ -(pregnan-20-yl)-2-furanmethanol誘 導 体 を 利 用 す ることで抗腫瘍性を有するwithanolide類と植物生長ホ ルモンであるbrassinolide類の立体選択的な側鎖部の 合成に成功している6, 7)。 そこで、 2-フランメチルエー テ ル 類 のWittig転 位 反 応 の 有 用 性 を 示 す べ く 、 - (pregnan-20-yl)-2-furanmethanol誘導体の20及び22 位の4種の立体異性体の選択的構築法を検討した(Sche me 6)8)。
既知の17(20)-エチリデン-16-ヒドロキシステロイ ドより調製した16-フルフリルオキシステロイド23 及び24をTHF中-78℃でt-BuLiと処理すると、 (E)- 体23からは(20S, 22S)-アルコール25と(20S, 22R)- アルコール26をそれぞれ2.2:1の比で与え、 さらに、
1,2転位体27も得られた。 (Z)-体24からは低収率な がら(20R, 22S)-アルコール28を単一の化合物として 与えた。 一方、 16β-フルフリルオキシステロイド29 及び30の反応では、 (E)-体29からは(20S, 22R)-ア ルコール26、 (Z)-体30からは(20R, 22R)-アルコール 32が生成した。 いずれの反応においても、 対応する 1,2転位体31と33が少量得られた。
以 上 の よ う に 、 16-フ ル フ リ ル オ キ シ ス テ ロ イ ド 23,24及び29,30のWittig転位においては反応は立体 選択的に進行し、 対応する4種のアルコール25,28及 び26,32を主生成物として与えた。 (20S, 22S)-アルコー ル25は脱皮ホルモンであるecdysoneや抗腫瘍性を有 するwithanolideの重要合成中間体であり、 (20S, 22R)- アルコール26は植物成長ホルモンであるbrassinolide に変換可能である。 海洋天然物として(20R)-体の側鎖 を有するステロイドが発見されており、 28及び32は有 用な合成中間体となるものと考えられる。
4.2 チオフェンを利用するOSW-1誘導体の合成研究
OSW-1 (34) は指田・三巻等によってユリ科の植物
であるOrnithogalum Saundersiae 鱗茎から単離され た新規アシル化コレスタン配糖体であり、 各種悪性腫瘍 細胞に対して極めて強力な増殖抑制活性を有することが 見出されている。 OSW-1はアドリアマイシン、 カンプ トテシン耐性腫瘍を含む各種悪性腫瘍細胞に対して、 臨 床で使用されている既存の抗腫瘍薬であるマイトマイシ
ンC、 アドリアマイシン、 シスプラチン、 カンプトテシ
ンやタキソール等に比べても10から100倍以上もの細 胞増殖抑制作用を有することが報告されている9)。
OSW-1はその構造上の新規性と顕著な細胞毒性を有
することから、 合成研究も活発に展開され現在までに数 例の全合成とともに多くの誘導体合成が行われている。
これまでの構造活性相関の研究から、 ステロイド2量 体であるcephalostatinやritterazineで提案されてい る22位のオキソカルベニウムイオンが活性発現に関与 していることが示唆されている。 一方、 最近では23−
オキサあるいは22-メチレン体において同等の作用発現 も報告されていることから、 さらなる構造活性相関研究 も必要とされている。
そこで我々は、 ステロイド側鎖部に芳香環を有する新 規OSW-1誘導体35の合成を企画した(Scheme 8)10)。
芳香族化合物としてチオフェンやチアゾールを念頭に おいた。 チオフェンの場合、 脱硫によりOSW-1の合成 も可能となる。 芳香環の導入は、 17E(20)-ethylidene- 16-arylmethyloxy steroid 37のWittig転位を用い ることとした。
ま ず 、 モ デ ル 実 験 と し てallyl 2-thiophenemethyl ether類のWittig転位を検討した11)。 既に我々はフラ
Scheme 6. Synthetic plan for the construction of steroidal side chains
O R1
O R1
O
OH
R2
R2
R1=Me, R2=H R1=H, R2=Me
O O
O
R1
R1
R1=Me, R2=H R1=H, R2=Me
OH
R2
R2 O
O
R1=Me, R2=H O
R1=H, R2=Me OH
O
O OH R1=Me, R2=H
R1=H, R2=Me
ecdysone withanolide
brassinolide
Scheme 7. Wittig rearrangement of 16-furfuryloxy steroids O
OH
O O
OH
O
O O
OH
O tert-BuLi
THF, -78°C
O OH
tert-BuLi THF, -78°C
61% 28% 11%
25% as a sole product
+ + H
O
OH
O tert-BuLi O
THF, -78°C O
OH
31% 21%
+ H
O O
OH
tert-BuLi O THF, -78°C
60%
O OH17%
+ H
23
24
25 26 27
28
29
30
26
32
31
33
OH O
O AcO
OH O O HO HO
OR OSW-1 (34) A B
C D O
HO R=p-anisoyl
OH X S
O S OH X
O
O AcO
OH O O HO HO
OR
A B
C D O
HO
S X
X=CH, N
Scheme 8. Synthetic strategy for OSW-1
35 36 37
ンでのWittig転位に成功しているので2)、 同様の条件を 用いて反応を行ったところ、 予想通り転位が進行した。
本反応の特徴は、 (E)及び(Z)-crotyl etherのt-BuLi による転位が対応するbenzyl crotyl ether系に比べて 高い立体選択性を持つことが挙げられる(Entry 2, 3)。
すなわち、 基質のオレフィン部の幾何異性を制御するこ とでanti-及びsyn-体を作り分けることができる。
上記の知見を基に合成を開始した(Scheme 9)。 出発 原 料 と し て 市 販 の16,17-epoxy-5-pregnen-3β-ol-20-
one38 を用い、 3位水酸基をメトキシメチル(MOM)基
で保護した後、 epoxy ketone 39をWharton反応に付 す と E-3β-methoxymethyloxypregna-5,17(20)-dien- 16-ol 40が得られた。 次いで、 4-methyl-2-thenyl bromideとalcohol 40とのエーテル化により、 thenyl ether 41を得た。 Ether 41をWittig転位反応に付す と、 目的とする20Sの立体配置を有するalcohol 42が /β=78:22の比で得られた。
化合物42の22位水酸基の立体化学は新Mosher法 を用いてそれぞれ決定した(Figure 1)。 その結果、 主 生成物が22S配置を有する22-alcohol体であること が判明した。
続いて、 化合物42をDess-Martin酸化してβ,γ-不 飽和ketone 43とした後、 アルケン43をOsO4でジヒ ドロキシル化すると、 16,17-diol 44が得られた(Sc
heme10)。 16位の水酸基の立体化学を反転するために、
44をSwern酸化後、 得られるketone 45をNaBH4で 還元するとOSW-1のアグリコン部分に相当する16β, 17-diol 46が得られた。
次いで、 ステロイド受容体 46と既知物質であるD- xylとL-araからなる二糖の供与体47によるグリコシ ル化を行うと、 目的とするグリコシド18が得られた (Scheme 11)。 さらに、 保護基をすべて除去するとチ オフェン環を有するOSW-1の新規誘導体49が得られ た。 最後に、 Raney-Niによる脱硫反応によりOSW-1 (34)の合成を達成した。
さらに、 塩基性窒素を有する誘導体が未だ合成されて いないことに着目し、 チアゾール環をもつ誘導体の合成 を検討した12)。 即ち、 17E(20)- ethylidene-16-(2- thiazolylmethyl)oxy steroid のWittig転位によりステ ロイド側鎖を導入し、 16位のオレフィンを足場にtrans -16,17-ジオールに導き、 アグリコンに相当するステロ イドの合成に成功した。 現在、 ステロイド受容体とD-
xylとL-araからなる二糖の供与体によるグリコシル化
を検討中である。
4.3 [2,3] Wittig転位を基盤とするfuranoditerpene であるkallolide A及びpinnatin Aのβ-isopro penyl alcohol単位の立体選択的構築法の確立 カ リ ブ 海 の 八 放 サ ン ゴ の 一 種 で あ る Pseudopterogorgia sp.からは多彩な骨格を有するとと もに顕著な生理作用を持つpseudopterane, cembrane,
gersolane類等の多くのジテルペンが単離されている。
代表的な例として、 pseudopteraneの一種であり抗炎 症作用を有するkallolide A, furanocembraneの1つ であるbipinnatin J, さらに抗腫瘍性を有するとともに gersolane骨格を持つpinnatin A等が知られている。
これらの化合物に共通する構造上の特徴は、 butenolide
Yield (%) R1 = R2 = H R1 = CH3, R2 = H R1 = H, R2 = CH3 R1 = R2 = CH3
S O R1
R2
S OH
R1 R2
α α'
t-BuLi (5eq) -78°CTHF
S OH
R2
R1 S
R1 OH R2
S R2
R1 OH
+ + +
[2,3] α [1,2] α [2,3] α' [1,2] α'
Entry 1 2 3 4
84 88 82 82
Product Distribution (5)
44 - 25 31
68 (47/53)a 52 (100/0)a 76
- 10 22
10 8 30
4 - 20
Table 5. Wittig rearrangement of allyl 2-thiophenemethyl ethers
a In parentheses; the ratio of the syn to the anti product.
HO
O O
MOMO
O O MOMCl
iPr2NEt OH
Br S NaH, 18-crown-6
92%
O
t-BuLi, THF -78°C
OH 38
42 41
40 39
100%
NH2NH2•H2O KOH
70%
59% α/β=78:22
S S
Scheme 9. Synthesis of Key Intermediate 22-Hydroxy Thiophene Steroid
S Me H
Me
H H
OMTPA H
H
S Me H
Me
H H
H H OMTPA 0.000
+0.022
-0.091 -0.016
-0.052
+0.131
-0.849 -0.050
+0.061 -0.017 +0.038
-0.119 Figure1. ΔδR-S values obtained for the MTPA esters of (22R)- and (22S)- alcohols
OH
Dess-Martin oxid.
O
OsO4 pyridine
O
42 43 44
99% 90%
Swern oxid.
86%
O
45
S S S
S OH
O
OH OH
NaBH4 MeOH
O
46 82%
S OH
OH
Scheme10. Synthesis of Aglycone of OSW-1
48 R=p-anisoyl
OH O
AcO O OOTES O TESO TESO
OR O
MOMO
S
O O
O TESO
AcO OR TESO
TESO OC(NH)CCl3
TMSOTf, 4Å MS, CH2Cl2
Scheme 11. Synthesis of Thiophene-OSW-1 and OSW-1 O
46 S OH
OH
47
OH O
O AcO
OOH O HOHO
OR OSW-1 (34)
A B
C D O
HO R=p-anisoyl 72%
49 OH O
AcO O OH O O HO HO
OR O
HO
S
TMSBr, CH2Cl2 73%
H2, Raney-Ni, MeOH
79%
環とC2位と3位にみられるβ-isopropenyl alcoholを 有する12〜14員環の,’ -二置換 β-methylfuran骨 格が挙げられる。 Marshall等によりkallolide A の全 合成といくつかのグループによりbipinnatin Jの全合 成が報告されているものの、 pinnatin Aの合成はこれ まで達成されていない。
上述したように我々は、 アリルフリルメチルエーテル 類のWittig転位により2 -フリルメタノール誘導体が得 られることを見いだした。 本転位反応の特徴は、 BuLi により位置選択的に位が脱プロトン化され生じた- オキシカルボアニオンが2,3シグマトロピー転位を経 由して立体選択的に対応するホモアリルアルコールを与 えることが挙げられる。 Marshall等はアリルフルフリ ル エ ー テ ル を 含 む 中 員 環 フ ラ ン ジ エ ー テ ル の2,3
Wittig転位を検討しているが、 立体配座が混みあって
いるためか予想される転位成績体を得ることには成功し ていない。 そこで、 我々の開発したフリルエーテルの 2,3Wittig転位反応を2位と3位にβ-isopropenyl al- cohol 52を有する環状の,’ -二置換furanの合成法 に応用することを検討した(Scheme 12)13)。
モデル実験として環状フルフリルエーテル体37の 2,3Wittig転位反応を検討した。 (E)-37の合成法は以 下のように行った(Scheme 13)。 Rieke亜鉛より調製 された6-cyanohexylzinc bromideと既知のブロモフラ ン53とのPd触媒下でのクロスカップリング反応によ りシアノエステル54とし、 さらに水素化ジイソブチル アルミニウム(DIBAL)で部分還元してヒドロキシアル デ ヒ ド 55 に 導 い た 。 ア ル デ ヒ ド 55 と 2- (triphenylphosphoranylidene)propionate と の Wittig 反応により不安定なメタクリレートととした後、 これを シリルエーテル体(E)-56として保護した。 (E)-56の DIBAL 還 元 で ア リ ル ア ル コ ー ル (E)-57に 誘 導 し 、
Meyersの方法に準じてクロル化してアリルクロライド
(E)-58とした。 (E)-58のシリル基を除去して得られる フルフリルアルコール(E)-59をMarshallの方法で環
化することにより目的とする(E)-60を得た。
(Z)-環状フルフリルエーテル(Z)-37もアルデヒド 55から同様に合成を行った(Scheme 14)。 すなわち、
安藤法に従って2-(diphenylphosphono)propionateと 55とのHorner-Wadsworth-Emmons反応によりメタ クリレート(Z)-56を約10:1の比で主生成物として合 成した。 エステル(Z)-57から(Z)-環状フルフリルエー テル(Z)-60への変換は(E)-60と同様の調製法によりア リルアルコール(Z)-57及びアリルクロライド(Z)-58,(Z)- 59を経由して合成した。
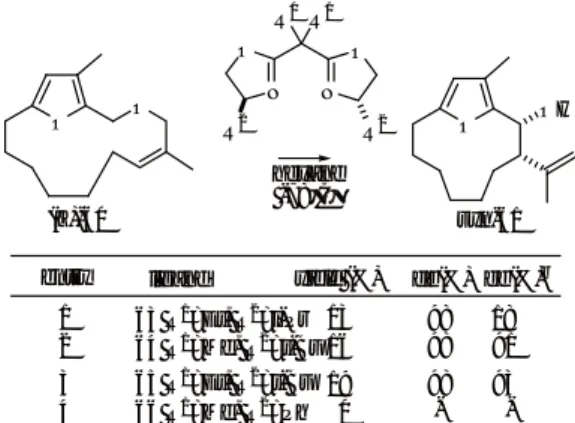
以上のように合成した環状フルフリルエーテル60を 用いて2,3Wittig転位反応を検討した(Table 6)。 鎖 状の系と同様に環状フルフリルエーテル60のTHF溶 液中に塩基としてBuLiあるいはLDAを過剰量用いて 反応を行ったところ、 脱プロトン化は位で進み対応す るオキシカルボアニオンの2,3シグマトロピー転位が 優先して進行することが観察された。 この事実は、 鎖状 の系では使用する塩基によって脱プロトン化の位置選択 性が異なることとは対照的であった。 おそらく環状フル フリルエーテルでは脱プロトン化により生成するオキシ カルボアニオンの2,3シグマトロピーが環状の立体配 座であることから反応点が近傍にあるため有利に進行す ることもその一因と考えられる。 (E)-60の転位反応に おいてはイソプロペニルアルコールanti-61が中程度か
O O
O
OH O OH
O OH
O O H
O O
Kallolide A Bipinnatin J Pinnatin A
2
3
O O
O OH
O O
base [2,3] Wittig *
*
Scheme 12. Synthetic Strategy for a β-Isopropenyl Alcohol Moiety of the Furanocyclic Diterpenes
50 51 52
O O
O OR1
R2
O OTBS
CO2Et
CHO
O OH
CN O CO2Me O CO2Me
Br
Scheme 13 Preparation of (E)-Cyclic Furfuryl Ether (E)-60a
a b c
d-f
(E)-57 R1=TBS, R2=OH (E)-58 R1=TBS, R2=Cl (E)-59 R1=H, R2=Cl
g
a (a) NC(CH2)6ZnBr, Pd(PPh3)4, THF (84%); (b) DIBAL,CH2Cl2, -78°C (80%);
(c) (i) Ph3P=C(CH3)CO2Et, CH3CN, (ii) TBSOTf, γ-collidine, CH2Cl2,-78°C (82%, two steps); (d) DIBAL, CH2Cl2, -78°C (89%); (e) MsCl, LiCl, 2,6-lutidine, DMF, -5°C (93%); (f) TBAF, THF (98%); (g) NaH, 18-crown-6, benzene, reflux (92%)
53
54 55
(E)-56 (E)-60
(Z)-60
55 O O
O OR1
R2 a-f
(Z)-56 R1=TBS, R2=CO2Et (Z)-57 R1=TBS, R2=CH2OH (Z)-58 R1=TBS, R2=CH2Cl (Z)-59 R1=H, R2=CH2Cl
g
a (a) (PhO)2P(O)CH(CH3)CO2Et, NaH, THF, -78°C (69%); (b) TBSOTf, γ- collidine, CH2Cl2, -78°C (87%); (c) DIBAL,CH2Cl2, -78°C (88%); (d) MsCl, LiCl, 2,6-lutidine, DMF, -5°C (94%); (e) TBAF, THF (93%); (g) NaH, 18- crown-6, benzene, reflux (81%)
Scheme 14 Preparation of (Z)-Cyclic Furfuryl Ether (Z)-60a