九州大学学術情報リポジトリ
Kyushu University Institutional Repository
On the pectic enzyme in naringinase
preparations
大村, 浩久
九州大学農学部
近野, 孝英
日本ビール株式会社
波多野, 昌二
九州大学農学部
山藤, 一雄
九州大学農学部
https://doi.org/10.15017/21632
出版情報:九州大學農學部學藝雜誌. 20 (4), pp.309-319, 1963-09. Faculty of Agriculture, Kyushu
University
バージョン:
権利関係:
ナリンギナーゼ
製 剤 の ペ ク チ ン分 解 酵 素
大
村
浩
久,近
野
孝
英*
波 多 野
昌
二,山
藤
一・ 雄
On the pectic enzyme in naringinase
preparations
H. Omura, T. Chikano, S. Hatano
and K. Yamafuji
前 報6)で 述 べ た よ うに 近 年 数種 の ナ リンギ ナ ー ゼ製 剤 が 調 製 され 夏 ミカ ンの苦 味 除 去 が 可能 にな り,こ れ に伴 つ て 夏 ミカ ンの加 工 面 へ の 利 用 の 増加 が大 き く期 待 され るよ うに なつ た.こ れ 等 の 酵 素製 剤 は 何 れ も Asp.niger,3)Asp.usamiimut.shisottsamii7・8)等 の 糸 状 菌 か ら 生 産 され る もの で あつ て 優 良 菌 株 の 分 離,培 養 及 び酵 素生 産 条 件 の 検 討,酵 素製 剤 の 調 製 法 の 改 良 等 か ら更 に は酵 素 化 学 的 諸性 質 や反 応 機 構 ∼)等 につ い て も詳 細 に研 究 され て い る. 他 方 これを 夏 ミカ ンの 加 工 に 利 用 す る実 用 上 の面 に つ い て も検 討 が 始 め られ た が現 状 で は尚 解 決 され な け れ ば な らな い 問題 点 も若 干残 つ て い る.そ の一 つ は我 々が入 予 し得 る酵 素剤 は試 作 され た 粗 標 品 で あ るの で 他 の 酵素 活 性 も含 み特 に 強 い ペ ク チ ン分解 酵素 が 共 存 して い る こと で あ る.こ れ は特 に ナ リンギ ナ ーゼ を 罐 詰 の 製 造 や 非透 明果 汁 の 生 産 に 利 用 す る場 合 果 肉 を 軟 化 して 品 質 を 低 下 させ,或 は果 汁 の 清 澄 化 を来 す 等 実 用 上 の大 きな 隆 路 と な つて い る.従 つ て特 殊 の場 合 を 除 き一 般 に ナ リンギ ナ ー ゼ標 品 と して は ペ ク チ ナー ゼ を 殆 ど含 ま な い こと が 望 ま しい ・ そ の た め に は(1) ペ ク チ ナー ゼ を 作 らず 強 力 な ナ リ ンギ ナ ーゼ だ け を生 産 す る優良 菌 株 の分 離 若 し くは 培養 を条 件 改 良 す る こ と.(2)酵 素 を精 製 して ペ クチ ナ ー ゼ と ナ リンギ ナ ー ゼ とを 完全 に分 離 す る こと.(3)ペ クチ ナ ー ゼ だ けを 失 活 又 は阻 害 す る適 切な処 理,添 加 剤 或 は 反応 条 件 等 を 見 出 す こと等 の 手段 が 考 え られ る.(1)に つ いて は ペ クチ ナ ー ゼを 殆 ど産 生 しな い優 良 菌 株 が 中林 氏2)に よ り報 告 され,こ れ か ら製 造 され た酵 素製 剤 も近 い 将 来 に市 販 され る もの と期 待 され るが我 々 の場 合 研 究 室 の現 状 では 菌 株 の 分 離 は勿 論 培 養 条 件 の 改良 等 に関 す る研 究 も難 か しい.(2)に つ い て の 可能 性 も勿 論 認 め *現 勤 務 先:日 本 ビ ー ル 株 式 会 社 られ 岡 田氏 等5)は ナ リン ギ ナー ゼ を 既 に結晶 にま で 精 製 して い る が,実 用 的 に は 酵素 製 剤 の 価 格 の上 昇 を招 くた め に望 ま しい もの と は考 え られ な い.こ れ に対 し て(3)の 方 法 は別 に甚 だ 強 力 な ペ ク チ ナー ゼ 製剤 が 現 在市 販 され て い るの で ナ リンギ ナ ー ゼ 中の ペ クチ ォ ー ゼ の回 収 は無 駄 で あ る点 か ら も先 ず検 討 す べ き もの で あ る と思 わ れ る.こ の 場 合 酵 素 は食 品 に処 理 され る の で阻害 剤 の 使用 は特 に慎 重 で な けれ ば な らな い し, 又 種 々の 処 理 も(2)の 場 合 と 同様 に 経済 性を 無 視 す る こ とは 許 され ない.こ の よ う に我 々の現 状 及 び実 用 上 の面 か ら研 究 に際 して は極 めて 多 くの制 約 が あ るの で 当 面 の問 題 と して は 次 善の もの と して ナ リンギ ナ ー ゼ に対 す るペ クチ ナ ー ゼの 相 対 的 な 活 性を 低 下 させ る こと を取 敢 ず の 目標 と しな けれ ば な らない.こ の よ う な 目 的で 研 究 を 進 め る に際 して は酵 素 製 剤 に 含 ま れて い る ペ クチ ン分 解 酵 素 の 性 質 を先 づ 知 る こと が必 要で あ り,ナ リンギ ナ ー ゼ との 比較 検 討 か ら初 め て解 決 の 手掛 りが得 られ る もので あ るが これ につ い て は全 く知 られ て い な い.従 つ て 種 々の方 法 を 検 討 す るに先 立 つ て標 品 中 の ペ ク チ ン分 解 酵素 の一 般 性 質 につ い て 試験 した. 実 験 酵 素 前 報6)に 用 い た と 同 じ ナ リンギ ナ ーゼ 製 剤 を 用 い た.即 ち1961年4月 試 製 したAsp.nigerか らの標 品Aと1962年1月Asp.usamiimut.shisousamiiか ら調 製 した標 品Bで あ るが試 料 の 関 係 で 試験 は主 と し てAに つ い て行 ない 重 要 な点 につ い て は 標 品Bで も比 較 した. 酵 素 液 も前 報 の もの と同様 に して 調 製 した.従 つ て 酵 素 濃 度 は 多 くの 不 溶物(濾 過 助 剤 等)を 含 む 酵 素 製 剤 の%濃 度 で あつ て 酵 素 だ けの 濃 度 は 実質 的 に は これよ り遙 か に低 い もの であ る. 基 質 ベ クチ ン:市 販 晶(柑 橘 ペ クチ ン)を その ま ま使 用 した.通 常1な い し2%に 水又 は0.1MMcIlvaine 緩 衝 液(pH4.0∼4.2)に 懸 濁 し 一 晩放 置 して 溶解 した. ペ クチ ン酸:朝 井 氏等nの 記 載 に 従 い次 の よ うに し て 調 製 した.市 販 ペ クチ ンを100倍 量 の0.1NNaOH に攪拌 加温(40∼50℃)し な が ら少 量 宛 加 えて 完 全 に 溶 か す.(こ の場 合 乳 鉢 で 少 量宛 磨 砕 しな が ら 溶 か す と比 較 的'に効率 が よ い が 必 ず しも 必 要 で は ない).次 にHC1で 酸 性 に す ると 白色 ゲ ル状 の ペ ク チ ン酸 が 沈 澱 す る.3,000r.p.m.で10分 間 遠 心 分離 して 沈 澱 を 集 め 更 に これ を吸 引濾 過 し最 後 に ア ル コー ル,エ ー テル の 順 に洗滌 しデ シケ ー ター中 で減 圧 下 に 乾燥 す る.得 られ た 白色 粉末 はペ ク チ ン同 様 に水 又 は 緩 衝 液 に溶 か して 基 質 溶 液 と した. 酵 素 活 性 の測 定 ペ クチ ン 分 解 酵 素 と して は ペ ク チ ンの1,4一 グ ル コ シ ド結 合 の 切 断 に 関 与す る ポ リガ ラ ク トウ ロナ ーゼ (PG,ペ クチ ナ ーゼ)及 び ペ ク チ ンの メチ ル エ ス テ ルを 水 解 す るペ ク チ ン メチ ル エ ス テ ラー ゼ(PE又 は PM,ペ クタ ー ゼ)に 大 別 され るが 詳 細 に つ いて は未 解 決 の 問題 が 多 い.こ こで は罐 詰 や 果 汁 製 造等 に利 用 す る立 場 か らPGだ け に限 定 した が これ は厳 密 に はペ ク チ ン酸 を 基質 とす る もの で あ る.し か し実 用 上 か ら は ペ ク チ ンを基 質 とす る活 性 を測 定 す る こと も必 要 で あ る と考 え られ る.た だ この 場合 酵 素 標 品 中 に はPE も共 存 し,PGの 作用 に先 行 して脱 メ チ ルが 行 わ れ る し,更 に ミカ ンの脱 嚢 に は酸 及 び ア ル カ リ処 理 を行 な うの で基 質 と して は ペ ク チ ン酸 だ け につ い て 行 なつ て も差支 え ない よ うで あ る.活 性 の 測定 法 と して は代 表 的 な 次 の2つ の 方 法 を用 い た.2) 粘度 法:ペ クチ ン或 はペ クチ ン酸溶 液 は非 常 に粘 稠 で あ るが その1,4結 合 が切 断 され ると これ に伴 つ て 粘 度 が 急激 に低 下 す る. 基 質 及 び緩 衝 液 混 液4mlをOstwald粘 度 計 に 入 れ 恒 温槽 に保 つ.所 定 の温 度 に達 した 後 同 じ温 度 に予 め 加 温 した酵 素 液1m1を 添加 して 反 応 させ る.一 定 時 間 後 の反 応 液 の 粘 度 の 減少 度 を測 定 し酵 素 力Aを 次 式 に よ り求 め た, T。:基 質4ml十 加 熱 酵 素1m1の 落 下 時 間,秒 (又 は反 応 時 間0の 落 下 時 間,秒) T・:基 質4m1十 活 性 酵 素1mlの 反 応 時 間t後 の 落下 時 間,秒 T"・:H20(又 は緩 衝 液)5mlの 落 下 時 間,秒 この 場 合Aは 基 質 の 分 解 率 を意 味 す る. この 粘 度 法 は実 用 上 の 意 義 を示 す もの と思 わ れ る が 顕 著 な 欠 点 が あ り幕 質 溶 液 の 粘 度 は酵 素 作 用 が な くて も低 下 す る.即 ち加 熱 酵 素液 又 は そ の代 り に水 を加 え た場 合 に も時 間 の経 過 と と もに反 応 液 の 粘 度 が低下 し 作 用 力を 求 め る 正L確な基 準T。 の値 を得 る こ とは 出来 ない.そ の た め 木実 験 で はT。 は加 熱 酵 素 を 添 加 して 5分 後 に 測定 した値 を 採 つ た.反 応 温 度,時間 等 につ い て は その 都 度 記 載す る. 還 元 基 測 定 法:粘 度 法 は特 に 多 数 の試 料 を 測 定 す る の に は適 しな い ので 還 元基 の 増加 を測 定 す る方 法 も屡 々利 用 され る.こ れ はペ ク チ ン又 は ペ ク ン チ酸 が 酵 素 に よ り分 解 され て生 じた生 成 物 の ア ル デ ヒ ド末 端 を 測 定 す る方 法 で あ つ てWillstatter-Schudelの 変 法 が用 い られ る. 我 々も これ に 従 い 次 の よ う に して 測定 した.基 質 (ペ ク チ ン酸 又 は ペ クチ ン)溶 液 及 び0.1MMcIlvaine 緩 衝 液 の混 液 に酵 素液 を 加 え 一 定 鍬 度 で反 応 させ る. 所 定 の時 間 後 に その5mlを 採 り1mllMNa2CO3 に添 加 して 反 応 を停 止 させ る.次 に0.1Nヨ ー ド ・ヨ ー ドカ リ溶 液5mlを 加 えて 混 合 しゴム 栓 で密 栓 して 正確 に20分 間 室 温 に放 置 した 後2MH2SO42mlを 加 え て酸 性 と し 残 存 す る ヨー ドを0.1MNa2S203で 滴 定 した.消 費 され た ヨー ドのmg当 量 は遊 離 の ガ ラ ク トウロ ン酸0.51mg当 量 に相 当す る.酵 素 液 な い し 基 質溶 液 に よつ て も ヨー ドは消 費 され るの で 盲 験 と し て 反応 開 始後 直 ちに そ の5m1を 採 り同 様 に ヨー ドの 量 を 測 定 しヨード 消 費 の基 準 と した.作 用 条 件 につ い て は 同 じ くその 都 度 記 載 す る. 結 果 酵 素 製 剤 中の べ ク チ ナ ー ゼ活 性 酵 素 標 品 に 含 まれ る概 略 の 活性 を 知 り実 験 に適 した 酵 素 濃 度 を求 め る ため に 粘 度法 及 び 還 元 法 を 試 み た. 粘 度 法:酵 素標品Aに つ い て の み測 定 した.酵 素を 1%及 びO.1%に な る よ うにpH4.2の0.1MMc-Ilvaine緩 衝 液 に溶 か し6,000r.P.m.で5分 間遠 心 分 離 しその 上 澄 を 酵 素液 と した.某 質 は2%ペ クチ ン又 は ペ ク チ ン酸 溶 液(pH4.2のMcllvaine緩 衝 液 に溶 かす)と しその4m1に 酵 素液1mlを 加 え30℃ の
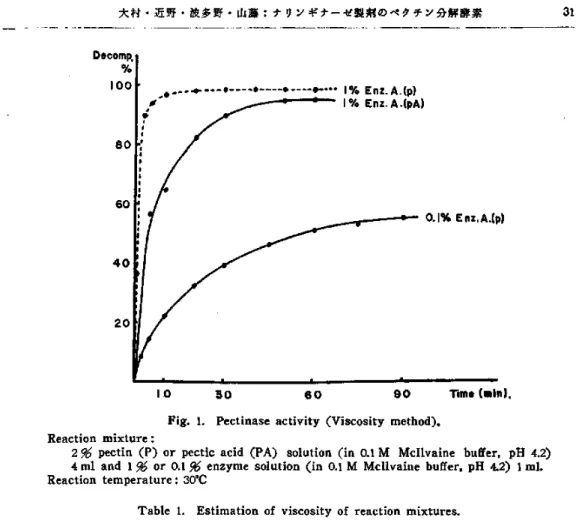
Fig. 1. Pectinase
activity (Viscosity method).
Reaction mixture :
2 % pectin (P) or pectic acid (PA) solution
(in 0.1 M Mcllvaine
buffer,
pH 4.2)
4 ml and 1 % or 0.1 % enzyme solution (in 0.1 M Mcllvaine
buffer, pH 4.2) 1 ml.
Reaction temperature
: 30°C
Table 1. Estimation of viscosity of reaction mixtures.
悔 温 槽中 で 反 応 させ 反応 液 の粘 度 を 経 時 的 に 測定 して 基 質 の 分 解 率 を 求 め 第1図 に示 した. 1%酵 素 液 を 使用 した場 合 は作 用 は 極 め て速 やか に 進 行 し粘 度 は急 激 に 低下 した.そ の 分 解 率 は特 に ペ ク チ ンを 基 質 と した場 合 に顕 著 で あ つ て酵 素 液 添 加 後2 分 で既 に約90%の 分解 が起 こ り10分 で は反 応 は概 ね 終 つ た.ペ ク チ ン酸 の 場合 で も5分 で50%,30分 で90 %の 分 解 が 認 め られ何 れ に して も酵素 作 用 の 測 定 に は や や 強 過 ぎる と思 わ れ た.こ の点0.1%酵 素 液 で は反 応 は 比 較 的 に温 和 に進 行 し使 用 量 と して は適 当 で あ る と思 わ れ る.唯 この 場 合基 質 の種 類 に よ つ て活 性 に非 常 に差 が あ る よ う に観 察 され るが 反 応 液 の粘 度 は ペ ク チ ンの場 合 ペ クチ ン酸 を 用 い た と きよ りも著 し く高 い に も拘 らず20分 後 に は ほ ぼ 同 じ 程 度 に ま で低 下 した こと は第1表 に示 す 通 りで あ る. 還 元基 測 定 法:1%ペ ク チ ン 又 は ペ ク チ ン 酸 溶 液 40m1と 酵 素 液10m1と を 混 合 し30℃ で作 用 させ 経 時 的 に5m1宛 採 り還 元基 の生 成 量 を求 め第2図 に示 した. ここで 還 元 基 測定 法 の場 合 に は0.1%酵 素 液 を使 用 して は 活 性 の測 定 には 十 分 で な く1%酵 素 液 を用 い る こ とが 望 ま しい と思 わ れ る.更 に酵 素 の 作用 は ペ ク チ ン酸 に対 して強 くペ クチ ンに対 して は若 干 の還 元 基 を 生 成 す るに過 ぎず1%酵 素液 で もペ クチ ン酸 に0.1% 酵 素 液 を作 用 させ た程 度 であ つ た.こ れ等 の 現 象 は全 く粘度 法 の 場 合 と逆 で あつ た.又 ペ クチ ン酸 に対 す る 酵 素 の活 性 は ナ リンギ ナ ーゼAに 於 てBの もの よ り も 強 い ことが 認 め られ た が ペ ク チ ンに対 す る作 用 は ほ ぼ 同 じ程 度 で あ つ た. 最 適pH
Fig. 2. Pectinase activity (Iodometry).
Reaction mixture :
1 % pectin (P) or pectic acid (PA)
40 ml and 1 9,1 or
0.1 % enzyme solution
10 ml.
Reaction temperature
: 30°C.
両 酵 素 標 品 と もにか な り強 い ペ ク チ ン分 解 力 を 持 つ こと が 明 らか にな つ た の で その 一般 的性 質 を 検討 す る こ とと し先ずpHの 影 響 を 試 験 した. 粘 度 法:前 項 同様 標 品Aに つ いて の み 試験 した。pHの 影 響 を試 験 す るた め 酵素 は 緩 衝 液 の代 り に水 で抽 出,同 じ く6,000r.p.m.で 5分 間 遠 心 分離 しその 上 澄 液 を用 い た.粘 度 法 で は第1図 に示 した よ うに ペ クチ ンを 基 質 と した と きは ペ ク チ ン酸 の 場 合 よ り粘 度 の 低 下 が 顕著 で あ るの で 前 者 に対 して は0.25%, 後者 に対 して は1%酵 素 液 を 使用 した.又 基 質溶 液 その もの の粘 度 もペ クチ ン溶 液 の 方 が 高 い の で,0.5%ペ ク チ ン 又 は1%ペ ク チ ン 酸 溶 液 を用 い る こと と し,そ れ ぞ れ1%又 は 2%水 溶 液2mlと 種 々のpHのMcllvaine 緩 衝 液2mlと を 混 合 して基 質 溶 液 と した. これ に酵 素 水 溶 液1m1を 加 え30℃ で5分 な い し15分 間 反 応 させ て 粘 度 の 低 下 を 測定 し分 解 率 を 求 め 第3図 に示 した.尚 この場 合 丁。 は加 熱 酵 素 を用 い た 反 応 系 に於 て 混合5 分 後 の値 を 採 つ た, 還 元 基 測 定 法=2%ペ クチ ン又 は ペ ク チ ン酸 水溶 液 を 種 々 のpHの Mcllvaine緩 衝 液 と 当量 宛 混 合 し 幕質 溶 液 と した.そ の40m1に 酵 素水 溶 液1Qm】 を 加 え て 反 応 させ 5m1宛 につ い て 還元 基 の 生 成 量 を 測定 した.酵 素標 品の 活 性 が 異 るの で 標 品Aで は0.5%,Bで は1%水 溶 液 を用 い30℃ で反 応 させ た.更 に 基 質 に よつ て 還 元基 の 生成 照二も異 な るの で標 品Aは2種 の基 質 につ い て 試験 した.こ の 場 合ペ ク チ ンに 対 して は90分,ペ ク チ ン酸 に対 して は 60分 作用 させ,一 方標 品Bは ペ ク チ ン酸 に 対 して の み40分 反 応 させ た・ これ 等 の 結 果 を第4図 に 示 した・ 第3,第4図 か ら 明 らか な よ う に反 応 の最 適pHは4.2付 近 に あ る こと が 粘 度法,還 元 基 測 定 法 の ど ち らで も認 め られ 又pH3以下 及 び pH6付 近 よ り ア ル カ リ側 で は作 用 力 は急 激 に低下 した.こ の よ うな反Fig. 3. Effect of pH (Viscosity
method).
Reaction mixture :
0.5% pectin (P) 4 ml and 0.25 06 enzyme 1 ml or
1 % pectic acid (PA) 4 ml and I% enzyme 1 ml
Reaction temperature
: 30°C
応 のpH特 性 は両 標 品 と もに 認 め ら れ るが ナ リンギ ナー ゼBの もの がA よ り もやや 広 い 作 用 域 を 示す よ うで あ る. 最 適 温 度 還 元 基 測 定 法 で の み 試 験 し た. 2%ペ クチ ン又 は ペ ク チ ン酸 溶 液4 mlとpH4のMcllvaine緩 衝 液 4mlと を混 合 して 甚 質 と し,同 じ く緩 衝 液 で 抽 出 した1%酵 素 液2 mlを 添 加 して 反 応 液 と し 直 ちに5 mlを 採 つ て 盲験 値 と した.残 りの 5mlに つ いて 種 々の 温 度 で 反応 さ せ た 後 還 元基 の生 成 量 を 測定 した. た び た び述 べ た よ う に基 質 に よつ て 還 元 基 の 生成 量 が異 るの で ペ ク チ ン に 対 し60分,ペ ク チ ン酸 に対 して は30分 反 応 させ た 結 果 を第5図 に 示 した. A酵 素 標 品の 場 合 ペ クチ ンに対 し て は35℃ で 最 も活 性 が 高 く温 度 の
Fig. 4. Effect of pH (Iodometry).
Reaction mixture:
2% pectin (P) or pectic acid (PA) 20 ml, 0.1 M Mcllvaine
buffer 20 ml and 0.5 % enzyme A or 1 % enzyme B 1C ml.
Reaction temperature:
30°C
Reaction time:
Enz. A (P) 90 min.; Enz. A (PA) 60 min.; Enz. B (PA) 40
min.
上 界又 は低下 に 伴 つ て還 元基 の 生成 量は徐 々に 減少 し た.ペ クチ ン酸 を 基 質 に した場 合に は40℃ に最 適温 度 が 認 め られ る が その 範 囲 は広 く35℃ 付 近 か ら500C 付 近 ま で は最 適 温 度 の もの に近 い 活 性 を示 し6り℃ で は急 激 に活 性 を 低下 した.こ れ に 対 して35℃ 以 下 の 低 温 側 で は 相 当 量の 還 元基 を生 成 した.一 方 標 品Bの 最 適 温 度 はAの もの よ り も高 くペ クチ ン に 対 し て は 50℃,ペ チ ク ン酸 に 対 して は60℃ で あつ た.更 に後 者 に対 して は70℃ で も顕 著 な 活 性 が 認 め られ ペ クチ に も勿 論か な りの 活 性 で 酵素 は 作用 した.尚 酵 素 液 或 は 基質 を除 い た 反 応 液 につ い て も同 様 に種 々の温 度 で 盲験 を行 なつ た が 還 元 力の 増 加 は 殆 ど認 め ら れ な か つ た.Fig. 5. Effect of reaction
temperature
(Iodometry),
Reaction mixture :
2 % pectin
(P)
or pectic acid (PA) 4 ml, 0.1 M
Mcllvaine buffer, pIl 4.0 4 ml and 1 % enzyme 2 ml,
Reaction time :
60 min, to pectin ; 30 min, to pectic acid.
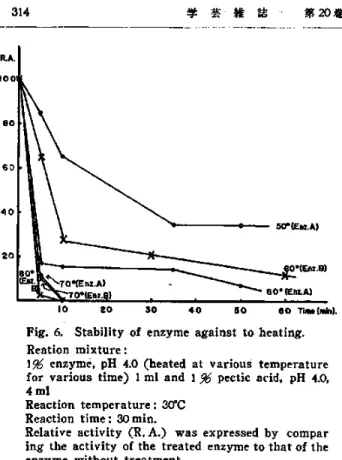
耐 熱 性 酵 素活 性 は勿 論 温 度 処 理 に よ り 活性 を失 う.1%酵 素液(pH4)を 種 々の 温度 の熱 水 に浸 漬 し経 時 的 に1mlを 採 り 出 し1%ペ クチ ン酸溶 液4m1に 加 え30℃30分 間 で生 成 す る還 元 基の 量 を 測定 した.尚 対 照 と して 温 度 処 理 を 行 わ ない 酵 素 液 に つ いて 同 一 条件 で 活 性 を 測定 して 比 較 の基 準 と した.こ の温 度 処 理 に よ る活 性 低 下 を第6図 に示 した. A標 品 に含 まれ るペ クチ ナ ー ゼ は温度 に対 して 抵 抗 性 は 弱 く70℃5分 で90%,10分 で は完 全 に 活性 を 失つ た.又60℃ で も10分 間 加 熱 で 約85%の 失 活 が起 つ たが30分 間処 理 して も尚 若if'の活 性 を 残 した.50℃ で も
Fig. 6. Stability
of enzyme against to heating.
Reation mixture :
1% enzyme, pH 4.0 (heated
at various
temperature
for various
time) 1 ml and 1 % pectic acid, pH 4.0,
4 ml
Reaction temperature
: 30°C
Reaction time : 30 min.
Relative activity
(R. A.) was expressed
by compar
ing the activity
of the treated
enzyme to that of the
enzyme without treatment.
多少 の活 性 低 下 が 認 め られ30分 で 力価 は半 減 した が更 に長時間 加 熱 して もそ れ以 上 に活 性 は低 下 しな か つ た.こ れ に 対 して反 応 最 適 温 度 の高 い 標 品Bの 酵 素 はA標 品 の ペ ク チ ナ ー ゼ よ り も強 い 温度 耐性 を 持 つ もの と推 定 さ れ たが70℃ で はA標 品 の 場 合 と殆 ど 同様 に 失 活 した.し か し60℃ で は若 干耐 性 が高 く 10分 加 熱 して 約70%,30分 で は80%の 活 性 を 失 つ た.従 つて 第5図 の反 応 温度 特 性 と 比 較 す る と き,高 温 部 で は 反応 の 初 期 に於 て も酵 素 の 活 性 は か な り低 下 す るに も拘 らず相 当 顕著 な 還 元 基 の 生 成 が 認 め られ て い るの で,ご く短 時 間 の反 応 で は 低温 域 で の活 性 に 対 す る高 温 域 の 活性 の比 は更 に高 い ことが 推 定 され る.こ の こ と は特 に 短 時 間 加熱 殺 菌 処 理 を 行 う罐 詰 製 造 に於 て 重 要 な 事 項 で あ る. pH耐 性 最 後 に種 々のpHで の 酵 素 の 安 定性 を試 験 した.A標品5%水 溶 液1m1に 種 々のpH のMcIlvaine緩 衝 液(NaOH又 はHCIで 所 定 のpH値 に 正 し く補 正)3mlを 加 え 室 温(15℃)に 一一晩 放 置 した.INNaOH又 はHC1でpHを4に 戻 した後pH4の 緩 衝 液 で10m1に した.こ の よ うに して 各pHで 処 理 した0.5%酵 素 液 が得 られ たの で そ の各 々1mlを1%ペ ク チ ン酸4mlに 加 え30℃ 60分 で 生 じた還 元基 の 量 を測 定 した.第7図 の 結果 は ナ リンギ ナ ー ゼ製 剤Aに 含 まれ て い るペ クチ ン分 解 酵 素 力 は概 略pH2.5な い し 6の 間 で安 定 で あ つ てpH1.5以 下 及 びpH 7以 上 で は相 当著 しい 失 活 が起 こつ た.特 に 中 性 以上 で酵 素 が 活 性 を 失 うこ とは 標 品Bの もの と1司様 で あ つ て30℃ に18時間 処 理 した 後Aの 場 合 と同 一 条件 で測 定 し同 じ く第7図 に示 した結 果 か ら も明 らか で あ る. これ は ナ リンギ ナ ー ゼ と異 る重 要 な特 性 で あつ て 最 適pH,最 適 温 度 及 び 耐 熱 性 は極 め て よ く似 て い るがpH8な い し9付 近 まで 安 定 で あ るナ リン ギ ナー ゼ の もの よ りもpH耐 性 は低 い.こ の こと は我 々の 研 究 目的 に極 め て 好 都 合 であ つ て ペ クチ ナ ーゼ を 回 収 利用 し ない 限 りに於 て このpH耐 性 の 差 を 利用 して ナ リンギ ナ ーゼ 標 品 巾 の ペ ク チナ ー ゼ 活性 を 除 去す る こ とは 可能 で あ る と思 わ れ る ので 更
Fig. 7. Stability
of enzyme at various pHs.
Treatment
of enzyme :
5 % enzyme 1 ml was mixed with 3 ml of 0.1 M
Mcllvaine
buffer
(at various
pH adjusted with
NaOH or HC1) and the mixtures
were kept at
room temperature
overnight
(Enz. A) or at 30°C
for 18 hrs (Enz. B . Then pH of the mixtures
was adjusted
to 4.0 with HC1 or NaOII
and
made up to JO ml of final volume with 0.1 M
Mcllvaine
buffer of pH 4.0.
Reaction mixture :
enzyme solution obtained as adove 1 ml and I 90
pectic acid 4 ml
Activity
was estimated
by iodometry
after 60 min.
a t 30°C,
に詳 細 に主 と して 標 品Aに つい て 検 討 した。 還 元 基 の生 成 量 はペ クチ ン酸 を基 質 と した 場 合 とペ クチ ンの 場 合 とで は か な り異 な るの で ア ル カ リ処 理 の 影 響 を 改 め て 試 験 し た. pH処理 は既 述 の 方 法 に 準 じ22℃ に20時 間 行 な い 活 性 は ペ ク チ ン酸 に 対 し60分,ペ クチ ン に対 して は90分 作 用 させ て 測定 した.第 8図 に示 す よ うにペ ク チ ン酸 に 対す る活 性 は pH7で 半 減,pH8で 約90%を 失つ た.こ れ に対 して ペ クチ ンを 基 質 と した場 合 中性 附 近 で も比 較 的 安定 で あ りpH8で も相 当量 の 活 性 が 残 つ た が これ を 越 す と急 激 に 活性 を 失 つ た.し か し還 元基 の 生 成量 は ペ クチ ン酸 の 場 合 よ り も著 し く低 く無 処 理 酵 素 で もペ ク チ ン酸 に対 す る もの の25%程 度 に 過 ぎ な い. 種 々のpHで の 酵素 の 安 定 性 は 温度 に も影 響 され る.上 記 の よ う に調 製 した各pHで の 酵 素 液 を それ ぞ れ の 温 度 に20時 間 放 置 し残 存 活性 を ペ クチ ン 酸 に対 し 測 定 した.第9 図 か ら酵 素 のpH耐 性 は 温 度 が 高 い程 低 い こ と が 明 らか に認 め られ る.即 ち5℃ で はpH 8迄 は変 化 な く8.5で35%,9.5で70%の
Fig. 8. Activity of enzyme treated at various pHs.
Treatment
of enzyme :
same as in Fig. 7 but at 22°C for 20 hrs.
Activity was estimated
by iodometry at 30°C for 60 min.
(PA) or 90 min. (P).
Fig. 9. Effect of temperature on pH stability of enzyme. Treatment of enzyme : same as in Fig. 7 but at various
perature indicated for 20 hrs.
Activity was estimated by the same procedure as in Fig. 8.
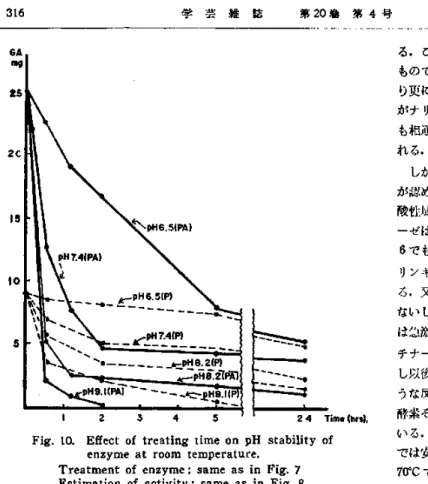
活 性 を 失 つ た.20℃ で はpH6迄 は安 定 で あ り7で は60%,8で は 95%の 失 活 が 起 つ た.こ れ に対 して 30℃ で はpH6で もか な り不 安定 で あつ て30%の 活 性 が 残 るに過 ぎず pH7で は10%以 下 に 低下 した. 勿 論 更 に 温 度 の 高 い37℃ で はpH 5で も60%,6で80%の 活性 低 下 が 認 め られ 中性 点 で は 殆 ど完 全 に活 性 を 失 つ た.し か し 何 れ に して も pH4で は 安定 で あつ て 活 性 の低 下 は殆 ど起 らな か つ た.酵 素 のpH耐 性 に影 響 す る他 の 因子 は勿 論 時 間 で あ るの で 室 温 で経 時的 に活 性 の変 化 を 追 及 し第10図 に 示 した.こ の場 合 活 性 は ペ ク チ ン酸 の ほ か ペ ク チ ン に対 して も測定 した.ペ クチ ン酸 に対 す る場 合一 般 に ア ル カ リ側 に な る程 失 活 現 象 が速 やか に起 る こと が 明 瞭で あ るが 中 性 よ りア ル カ リ
Fig. 10. Effect of treating time on pH stability of enzyme at room temperature.
Treatment of enzyme: same as in Fig. 7 Estimation of activity : same as in Fig. 8.
側 で は2時 間で 失 わ れ るべ き活 性 の大 部 分 が 消 失 しそ れ 以 後 は僅 か に 活性 低 下 が 進 行 ず る に 過 ぎな い 。pH 6.5は 酵 素 の 水 抽 出 液 で あ るが この 場 合 もか な りの 失 活 は 免 れ な かつ た.し か しそ の程 度 は勿 論 緩 慢 で あつ て 約70%を 失 つ た5時 間 迄 は時 間の 経 過 と と もに 活 性 が 低 下 した.何 れ に して も2時 間 ない し5時 間 で失 活 作 用 は終 了す る もの と考 え られ る.こ れ に対 して ペ ク チ ンに対 す る もの は何 れ のpHで も活 性 の 低 下度 が 低 い こ とは 既 に第8図 で も示 した が短 時 間の 場 合 で も 同様 で あ る.し か しその 低 下 度 は ペ ク チ ン酸 の 場 合 と 同様 に約2時 間 迄 は それ 以 後 の もの よ りも著 しい.何 れ に して も度 々述 べ た よ うに ペ クチ ン に対 す る活 性 そ の ものが ペ クチ ン酸 に対 す る もの よ り も極 めて 低 い の で酵 素 の 耐 性 が 高 い と いつ て も殆 ど 問題 で は ない. 考 察 本 報 か ら明 らか な よ うに試 験 した ナ リン ギ ナ ーゼ 標 品 は か な り強 い ペ クチ ン分 解 酵 素 を も含 ん で い る.し か も この酵 素 は ナ リン ギ ナー ゼ と 岡様 に最 適pH4.2, pH3.5な い しpH5の 酸 性 域 で か な り強 く作 用 し, 又50℃ を 中心 とす る 比 較 的 高 温 に 適 温 を 持 つ て い る.こ れ等 は両 酵 素 が か な り緊 密 な もの で あ る こ とを 示 唆 す るよ うで あ り更 に市 販 のペ クチ ン分 解 酵 素 製 剤 が ナ リン ギ ナー ゼ 活性 を含 む こ と に も相通 じる もの が あ るよ うに も思 わ れ る. しか し厳 密 に はか な り顕 著 な相 違 が 認 め られ る.反 応 は 確か に 同様 の 酸 性 域 で強 く行 なわ れ るが ペ ク チ ナ ー ゼ はpH3で は殆 ど作用 せ ず又pH 6で も 著:しく作 用 力を低 下 す るが ナ リンギ ナ ー ゼ 作 用 は 保 持 され て い ろ.又 ナ リン ギ ナー ゼ 作用 は50℃ な い し60℃ で強 く作 用 し70℃ で は 急激 に低 下 す るが 同 じ標 品の ペ ク チ ナ ー ゼ は70℃ まで 強 い 活 性 を 示 し以 後急 速 に反 応 力 を失 う.こ の よ うな反 応 特 性 に見 られ る差 異 以 上 に 酵 素 その もの の性 質 は 互 に異 なつ て い る.即 ち ナ リンギ ナ ー ゼ は50℃ で は 安定 で あ り60℃30分 で 半減, 70℃ で は 完 全 に 失 活す るが,ペ クチ ナ ー ゼ は更 に 不安 定 で あつ て50℃ で60%,60℃ で80%の 活性 を 失 い70℃ で は既 に 10分 で 完全 な 失活 が起 こる.又 種 々のpHで の安 定 性 に して も特 に ア ル カ リ側 で 弱 く中性 点 で もか な り顕著 な 活 性 の低下 が 認 め られ る.こ の よ うな事 実 は酵 素蛋白 特 に活 性 発 現 に 関 与す る部 分 が 明 瞭 に異 な る こ とを 示 す もの で あ つ て酵 素産 生 に於 て も両 者 は必 ず しも密 接 な関 係 を 持 つ もの と は考 え られ な い.中 林 氏4》は 既 に ペ ク チ ナー ゼ を含 まず ナ リンギ ナ ー ゼ だ けを 産 生 す る 優 良 な 菌 株 の 分離 に成 功 して い る.特 に ペ ク チ ナー ゼ の安 定 性 が ナ リンギ ナ ーゼ の もの よ り低 い こ と は実用 上 に も好 都 合 で あ つて,最 初 に述 べ た よ うに ナ リンギ ナ ー ゼ に対 す るペ クチ ナ ーゼ の 活性 を低 下 させ る可能 性 を 与 え る もの で あ る.即 ち50℃ 処理 又 は ア ル カ リ 耐性 の差 を 利 用 す れ ば この こ とを 達成 出来 る と思 わ れ る.こ の う ち前 者 は か な り危 険 も伴 い しか もペ クチ ナ ー ゼ を完 全 に失 活 させ る条 件 で もな い の で ア ル カ リ処 理 の方 が 望 ま しい よ うに考 え られ るが 詳細 な条 件 に つ い て は更 に検 討 しな けれ ば な らな い.酵 素 の ア ル カ リ 耐 性 に 関す る若 トの追 加実 験 か らナ リン ギ ナー ゼ の場 合 と 同様 に 安定 性 は温 度 に も支 配 され その 安定 な限 界 は温 度 が 高 い 程 狭 くな る 塵実 も認 め られ た.又 その 矢
活 もか な り急速 に進 行 し2時 間 な い し5時間 で 終 了す る こと もナ リンギ ナー ゼ と 同様 で あ るが 初 期 の 比較 的 安 定 な 部分 は全 く認 め られ な かつ た. 供 試 標 品A及 びBの ナ リンギ ナ ー ゼ につ い て は反 応 温 度 以 外 に は顕 著 な 差 異 は 殆 ど 認 め られ な か つ た が, これ は ペ ク チナ ー ゼ で も同様 で あつ た.標 品Bの ペ ク チ ン分 解 酵素 が 標 品Aの もの よ り も高 い 温 度 で 作用 し 得 る こと は策5図 よ り明 らか で あつ て この 点 に 関す る 限 りナ リンギ ナー ゼ の 場 合 と一 致 す る.し か し耐 熱 性, 或 は ア ル カ リ耐性 に関 して は ナ リンギ ナ ーゼ 以 上 に標 品A及 びBの ペ ク チ ナ ーゼ は互 によ く似 て い る こ とが 認 め られ た.ペ ク チ ナー ゼ が ナ リン ギ ナー ゼ製 剤 の 利 用 に 際 して 好 ま し くな い 影響 を 及 ぼ す の で酵 素 製 剤 と して は ペ クチ ナ ー ゼ 活性 の弱 い 方 が 望 ま しい の は 当 然 で あ る.こ の点 標 品A及 びBの ペ クチ ナ ー ゼ活 性 は そ れ ぞ れ の最 適 条 件 で は ほ ぼ 同 じ程 度 で あ るが,最 適 湿 度 が異 るの で 例 え ば40℃ で は 標 品Bの 活 性 がAの も の よ り も低 く,一 方60℃ で は逆 にAの ペ クチ ン分 解 力 はBの もの に比 べ て 著 し く弱 い 事 実 等 を考 慮 し酵 素 の使 用 条 件 に応 じて 取 捨選 択 しな け れ ば な らない. これ 等 ナ リンギ ナ ー ゼ製 剤 の ペ クチ ン分 解 酵 素 の 研 究 に関 連 し酵 素活 性 そ の もの の 測 定 に も若干 の 問題 点 が観 察 され た.粘 度 法 で 酵素 活 性 を 測定 す る に際 して はペ クチ ンを基 質 に した場 合は ペ クチ ン酸 を 用 い た 場 ・合 よ り も反 応 が 速 や か に起 こつ た.し か し この相 違 は 反 応 の ご く初 期 に起 こる もの で あ るが ペ ク チ ンの 粘 度 が ペ ク チ ン酸 の もの よ り も著 し く高 い こと も一 つ の 原 因 とな つ て い るか と も 考え られ る.他 方 基 質 溶 液 の粘 度 が時 間 と と もに 非 酵 素 的 に低 下 す る こと も何 等 か の 関連 を持 つ もの と思 わ れ るが更 に この こと は活 性 測 定 に於 け る粘 度低下 を 比 較す る正確 な 基 準 の 設定 を 困難 に し これ に伴 い 粘 度 法 の信 頼 性 を 誠 ず る.こ れ に対 し て還 元 基の 増 加 を 測定 す る活 性 測 定 法 は ペ クチ ン酸 を 基質 と した 場 合に ペ ク チ ン に対 す る場 合 よ りも強 く現 わ れ る.ペ クチ ン分 解 酵 素 の 研 究 が 殆 ど進 ん でい な い ので,こ れ 等 の 問題 点 は研 究 の進 展 と と も にい ず れ は 解 決 され る もの と思 わ れ るが,ペ クチ ンエ ス テ ラ ーゼ の 問題 もこれ に 関 係す る重 要な 事項 と推 定 され る.何 れ に して も粘 度 法 に よ る場 合 と還 元基定 量 法 に よ る場 合 と で望 ま しい 基 質 が異 な る事 実 は 実用 上 の 面か ら酵 素 を 検 討す る場 合測 定 法 及 び使 用 基 質 の選 択 に 礁 要な 問題 と なつ て くる.更 に酵 素 の ペ クチ ナ ーゼ 活 性 と果 汁 の 清 澄 化 力 と が必 ず しも平 行 しな い 事 実9)も 加 わ つ て ペ ク チ ナー ゼ そ の もの につ い て も 早急 に解 決 を 要 す る問 題点 が多 く残 つ て い る. 本 研 究 は 文 部省 試 験 研 究 費(代 表 者 野 村 男 次)で 行 なつ た もの で あ る.研 究 に際 し種 々御 助 言 を 頂 き又 貴 重 な 試 料 を頂 戴 した 山 口大 学農 学 部 野 村 男次 博士,静 岡 大 学農 学 部 中林 敏 郎 博士,三 共 株 式 会 社 石 橋 慶 次郎 博 上 に 心 か ら感 謝 中 し上 げ る. 総 括 2種 の ナ リン ギ ナー ゼ 試 作標 品 につ い て 特 に実 用 上 の立 場 か らペ クチ ン分 解 酵 素 活 性 に つ いて 検 討 した. (1)供 試 した2種 の ナ リンギ ナ ーゼ 製 剤 に は ペ ク チ ン分 解 酵素 力が 認 め られ た.活 性 の 測定 条 件 に つ い て 検 討 した が,粘 度 法 の 場 合 ペ ク チ ン,還 元 基定 量法 の場 合 には ペ クチ ン酸 を 基 質 と して 使 用 す る方 が他 を 基 質 とす るよ り も活 性 が 強 く現 われ た. (2)反 応 の最 適PHはpH4.0付 近 にあ りpH3.5 ない し5の間 でか な り強 く作用 した.し か しpH3以 下 で は殆 ど 作用 せ ずpH6以 上 で も反 応 は著 し く弱か つ た. (3)標 品Aの ペ ク チナ ー ゼ は40℃ を 中心 と し 30℃ な い し50℃ で 強 く作用 し60℃ で は 急 激 に低 下 した.一 方標品Bは50℃ な い し70℃ の よ り高 温 で 作 用 し70℃ を 越 す と速 や か に活 性 を 失 つ た. (4)酵 素 の耐 熱 性 は ナ リンギ ナ ーゼ よ り も低 く, 50℃30分 で40%,60℃10分 で20%に 低 下 し70℃ 10分 で 完 全 に 失活 した. (5)酵 素 はpH3な い し6で 安定 で あ り中性 付 近 で もか な り活性 を 低 下 した.特 に この アル カ リ性 で の 耐 性 は温 度 に よつ て もか な り影 響 され 温 度 が 高 い程 失 活率 も大 き く安定 域 も狭 くな つ た. (6)酵 素 の ア ル カ リに よ る失 活 もナ リンギ ナ ー ゼ 同様 に時 間 に よつ て影 響 され るが比 較 的 速 や か に起 り 2時 間 ない し5時 間で 完 了 した. 文 献 1)朝井 勇 宣,斉 藤 日 向,1952.農 化,26,381. 2)福 木 寿 一 郎,1956.酵 素 研 究 法II,P.163. 3)岸 清,1955.科 学 と 工 業,29,140. 4)中 林 敏 郎,1961.缶 詰 時 報,40(7),1. 5)岡 田 茂 孝,岸 清,福 本 寿 一 郎,1962.酵 素 化 学 シ ン ポ ジ ウ ム(福 岡)予 講 集,p.10. 6)大 村 浩 久,石 崎 勝 也,幾 島 豊,山 藤 一 雄, 1963,九 大 農 学 芸 誌,20,169. 7)滝 口 洋,1961.日 木 農 芸 化 学 会 関 東 支 部 第 212回 例 会 講 演. 8)滝 口 洋,1962.日 本 農 芸 化 学 会1962年 大 会 講 演 。 9)滝 口 洋,1962.私 信.