産業医科大学医学部第 1 内科学講座
特集免疫疾患の新たな分子標的治療
総 説
Jak 阻害薬の抗リウマチ薬としての可能性とその作用機序
山 岡 邦 宏,田 中 良 哉
Jak inhibitor ; possibility and mechanism as a new disease modifying anti-rheumatic drug
Kunihiro YAMAOKA, M.D., Ph.D., Yoshiya TANAKAM.D., Ph.D.
The First Department of Internal Medicine, School of Medicine, University of Occupational and Enviromental Heatlth, Japan, Kitakyushu, 8078555, Japan
(Received February 9, 2009) summary
Treatment of rheumatoid arthritis (RA) has developed dramatically by the appearance of biologics. However the development of a new anti-rheumatic drug is necessary because of its issue on route of administration and expense. Re-cently, inhibitors targeting tyrosine kinase known as Janus kinase (Jak) has shown prominent eŠect on RA. Jak family is comprised by Jak1, Jak2, Jak3 and Tyk2 which is necessary for signal transduction for in‰ammatory cytokines. INCB18424 targeting Jak1/2 and CP690,550 targeting Jak3 has been developed and is now on phase II clinical study for RA. Results from those clinical studies have proven that these inhibitors can be eŠective as biologics with few side eŠects. However, it has been reported that inhibitors are less speciˆc than it has been expect and that non-speciˆcity can be important for its eŠect. Therefore, we think that the mechanism of inhibitors cannot be explained by its inhibition of a single kinase. Herein, we describe IL10 overproduction by Jak3 and Stat6 deˆcient dendritic cell. We speculate that this is one possible mechanism of action for CP690,550 although as for its non-speciˆcity we need further investigation to predict not only its eŠect but also its side eŠect in a long term administration.
Key words―Jak inhibitor; rheumatoid arthritis; speciˆcity
抄 録
関節リウマチ(RA)の治療は生物学的製剤により飛躍的に進歩したが,投与経路や医療経済面の問題のため新 たな抗リウマチ薬の開発は必須である.最近,チロシンキナーゼである Jak を標的とした阻害薬の高い有効性が報 告されている.Jak ファミリーには Jak1, Jak2,Jak3 と Tyk2 が存在し炎症性サイトカインのシグナル伝達には必 須である.Jak1/2 を標的とした INCB18424 と Jak3 を標的とした CP690, 550 は RA を対象とした臨床試験が第 II 相まで進行している.2008 年のアメリカリウマチ学会において経口薬としては今までにない高い有効性を有し, 副作用が少ないことが明らかとなった.しかし,予測されている程の特異性を有さないことが指摘されていなが ら,一方ではその非特異性が少ない副作用に寄与している可能性も指摘されている.つまり,その作用機序は単純 な一分子阻害ではなく,予想外の作用機序を有する可能性が考えられる.我々は Jak3 とその下流で活性化される 転写因子 Stat6 の欠損マウス由来樹状細胞の解析を行い,IL10 過剰産生を見出し,Jak3 阻害薬の一作用機序と考 えている.しかし,阻害薬の特性からその作用機序は複数あると考えられ今後の作用機序解明は長期投与の際の副 作用予測にも欠かせないと考える. は じ め に 関節リウマチ(RA)の本態は滑膜炎,滑膜細胞 増殖とそれに伴う炎症性サイトカインの過剰産生に ある.炎症性サイトカインの中でも TNF と IL6 を標的とした生物学的製剤(抗 TNFa 抗体イン フリキシマブ,可溶性 TNF 受容体エタネルセプ ト,抗 IL6 受容体抗体トシリズマブ)の治療効 果は高く,RA に対する治療は飛躍的に進歩した. 今では寛解導入を目標として治療を開始し,将来的 には治癒を目指す段階へと進歩している.この様に 治癒を目指すリウマチ専門医のツールが増えつつあ るが,RA 症例の約 3 割は TNF 阻害療法(インフ リキシマブ,エタネルセプト)に抵抗性で,寛解導
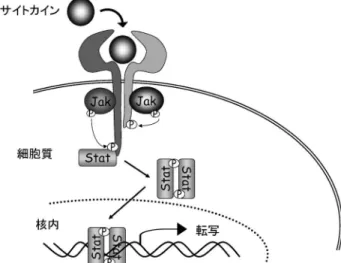
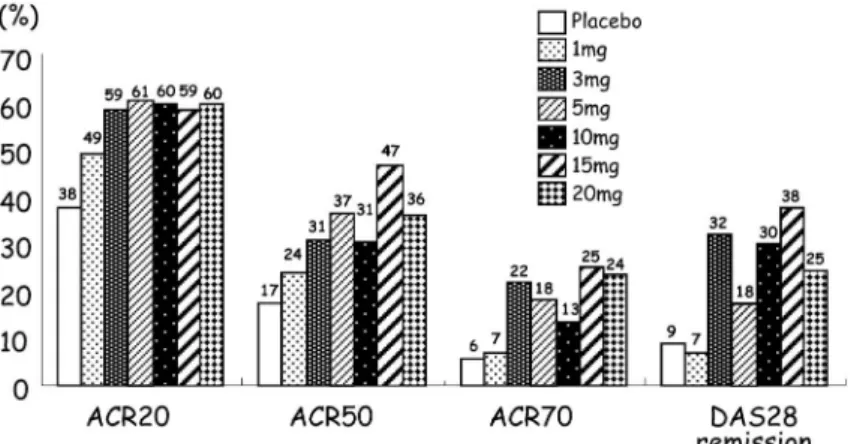
図 1 サイトカインシグナル伝達における Jak-Stat (Yamaoka K. et al. 200414)より改変引用) 図 2 MTX, TNF 阻害薬抵抗性 RA に対する CP690, 550 の効果投与 6 週目の ACR 反応到達率. (Kremer JM, et al. 200613)より改変引用) 入率は 3~5 割にすぎないことを考慮すると新規抗 リウマチ薬の開発は必須である.また,生物学的製 剤はその有効性から,導入症例は増加の一途をた どっているが,静脈投与もしくは皮下注射(自己注 射)が必要であることや経済的負担が大きいことか ら継続が困難な症例が少なからず存在する.その観 点からは,経口投与可能でかつ安価な抗リウマチ薬 の開発が待ち望まれている.その様な状況下におい て近年,サイトカインのシグナル伝達に重要なチロ シンキナーゼである Janus kinase ( Jak)を標的と した阻害薬が高い治療効果と共に副作用が少ないこ とが示されており注目されている.
Jak ファミリー( Jak1~3, Tyk2)は,サイトカ インがその生物活性を発揮するには必須のチロシン キナーゼである.Jak はサイトカインが受容体へ結 合後,細胞内で活性化されその下流において転写因 子 Stat を活性化する(図 1).Jak1 と Jak2 は生体 内において広範に発現しているが,Jak3 は発現が 血球系細胞に限局しているのが特徴である.そのた め,Jak1 と Jak2 欠損マウスは胎性致死または生直 後に死にいたる.一方,Jak3 の欠損はヒト,マウ ス何れにおいてもリンパ球系細胞の分化・増殖不全 を来たし重症複合型免疫不全症(Severe Combined Immunodeˆciency ; SCID)を呈する.そのため, Jak3 の阻害薬は副作用を最小限にとどめた新規免 疫抑制剤となることが発見当初より期待されていた. 2003 年に Jak3 特異的阻害薬 CP690, 550 がファイ ザー社により開発され,その際立った免疫抑制効果 に加えて副作用が最小限に抑えられることがカニク イザイルを用いた移植片対宿主病の実験で証明され た1).以後,関節リウマチにおける有効性が検討さ れ,2008 年のアメリカリウマチ学会では既存の抗 リウマチ薬もしくは生物学的製剤に抵抗性を示した 症例を対象にした臨床試験第 2 相の結果が発表され た(図 2)2).本邦においては,2008 年 1 月よりメ トトレキサート(MTX)に抵抗性の RA 症例を対 象に第 II 相試験が進行中であり,2009 年には第 III 相試験が開始される予定である.これら臨床試験の 結果より,現在複数の製薬企業により Jak ファミ リーに属する分子に対する阻害薬の開発が進んでい る(表 1).本稿では,臨床試験第 II 相にまで進行 している Jak3 阻害薬 CP690, 550 と Jak1/Jak2 阻 害薬 INCB18424 に関する最近の知見とその RA 治 療薬としての可能性につき概説する. 生体内における Jak の働き サイトカインは細胞表面上の受容体に結合後,受 容体に恒常的に結合している Jak をリン酸化し, 引き続き転写因子 Stat を介して標的遺伝子の転写 調節を行う(図 1).Jak は種々のホルモン,成長 因子,造血因子,炎症産生物質の作用を媒介する
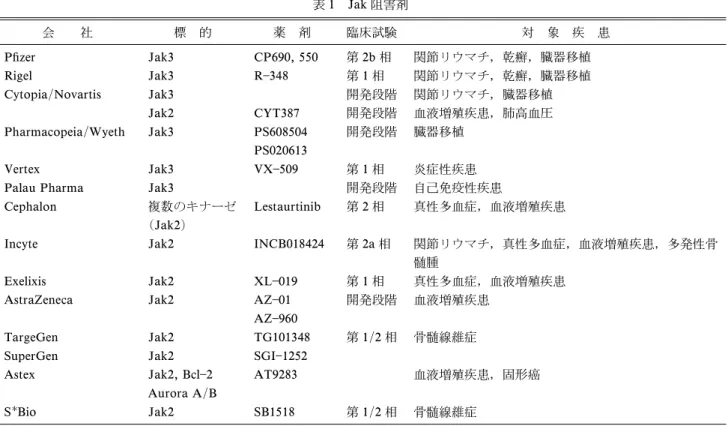
表 1 Jak 阻害剤 会 社 標 的 薬 剤 臨床試験 対 象 疾 患 Pˆzer Jak3 CP690, 550 第 2b 相 関節リウマチ,乾癬,臓器移植 Rigel Jak3 R348 第 1 相 関節リウマチ,乾癬,臓器移植 Cytopia/Novartis Jak3 開発段階 関節リウマチ,臓器移植 Jak2 CYT387 開発段階 血液増殖疾患,肺高血圧 Pharmacopeia/Wyeth Jak3 PS608504 PS020613 開発段階 臓器移植 Vertex Jak3 VX509 第 1 相 炎症性疾患
Palau Pharma Jak3 開発段階 自己免疫性疾患
Cephalon 複数のキナーゼ
(Jak2)
Lestaurtinib 第 2 相 真性多血症,血液増殖疾患
Incyte Jak2 INCB018424 第 2a 相 関節リウマチ,真性多血症,血液増殖疾患,多発性骨
髄腫
Exelixis Jak2 XL019 第 1 相 真性多血症,血液増殖疾患
AstraZeneca Jak2 AZ01
AZ960
開発段階 血液増殖疾患
TargeGen Jak2 TG101348 第 1/2 相 骨髄線維症
SuperGen Jak2 SGI1252
Astex Jak2, Bcl2 Aurora A/B AT9283 血液増殖疾患,固形癌 SBio Jak2 SB1518 第 1/2 相 骨髄線維症 (Pesu M. et al. 200810)より引用改変) が,一方,遺伝子変異や転座による機能亢進が血液 増殖性疾患発症と関与することが知られている. Jak1 と Jak2 は生体内において広範に発現してお りマウスにおける Jak1 欠損は神経細胞の分化異常, Jak2 欠損は種々の血球分化異常によりそれぞれの 欠損マウスは胎性致死となる.また,Jak2 の変異 による病的活性化は造血前駆細胞の悪性形質転換を きたす.特に,真性多血症患者では 90以上に特 有 の 変 異 を 来 た す こ と が 知 ら れ て い る . 一 方 , Jak3 はその発現が血球系細胞に限局しており,IL 2, 4, 7, 9, 15 21(gc サイトカイン)が受容体 として共有する g 鎖に恒常的に結合し,gc サイト カインが生物学的活性を発揮するには必須のチロシ ンキナーゼである.Jak3 の欠損や機能不全はリン パ球系細胞(T 細胞,B 細胞,NK 細胞)の分化・ 増殖不全を引き起こし,ひいては重症複合型免疫不 全症(Severe combined immunodeˆciency ; SCID) を来たすことが知られている.それ故,Jak3 機能 不全や欠損は Jak1, Jak2 とは異なり,無菌環境下 では出生,生存が可能であり,骨髄移植によるリン パ球系細胞の正常化により長期生存が可能である. このことから Jak3 特異的阻害剤は,副作用を最小 限に抑えた免疫抑制剤となることが発見当初より期 待された.また,最近では炎症性自己免疫疾患との 関係が注目されている IL17 を産生する Th17 の分 化に Jak3 を活性化する IL21 の関与も指摘されて いる3).しかし,単球系細胞における Jak3 の機能 についてはあまり知られていない.単球系細胞にお ける Jak3 の発現は刺激により誘導されるが,リン パ球系細胞と異なりその分化には関与していないこ とが知られている.筆者らは Jak3 欠損樹状細胞の 解析を行い,代表的抗炎症性サイトカインである IL10 が過剰に産生されることを見出し,Jak3 が IL10 の産生を負に制御している可能性を報告し た4). 関節リウマチと Jak JakStat の関節リウマチ病態への関わりは,Jak により活性化される転写因子 Stat の RA 患者滑膜 細胞における発現にはじまる5~7).その後,Walker らは活動性 RA,変形性関節症と脊椎関節症患者よ り滑膜組織を採取し,組織免疫染色により RA 滑膜 において Jak3, Stat1, Stat4 と Stat6 の発現が有意 に上昇していると報告した.さらに,その発現は CD1a 陽性樹状細胞に限局し,抗リウマチ薬による 加療にて発現が低下することから病因,または疾患
活動性との関連が示唆された8,9).しかし,これら
ではなく,RA の病因,病態との関連は更なる検討 を有する.筆者らの Jak3 欠損樹状細胞による IL 10 過剰産生の結果を考慮すると,樹状細胞におけ る Jak3 発現上昇は IL10 産生抑制につながり,炎 症の増強に関与していることが推測される. Jak 阻害薬とその特異性 ヒトゲノムプロジェクトによりヒトには 500 以上 のキナーゼが存在することが明らかとなった.これ らキナーゼの多くは,細胞機能に重要であり,酵素 としての活性に必須であるキナーゼドメインが類似 した構造を持つことから,細胞毒性が低く,特異性 の高いキナーゼ阻害薬の開発は疑問視されてきた. その中で,Incyte 社の INCB18424 は Jak1/Jak2 に, Pˆzer 社の CP690,550 は Jak3 に特異性の高い阻害 薬として臨床試験が行われている.INCB18424 は アメリカリウマチ学会において Jak3 を阻害する 1/ 20 の濃度で Jak1/Jak2 を阻害することが発表され た.一方 CP690, 550 は in vitro における低濃度で の Jak3 特異的阻害作用と動物実験においての免疫 抑制薬としての有用性が公表されている.この他に 表 1 に示すよう計 14 社により 17 種類の化合物が Jak ファミリーを標的として開発が急速に進められ ている10). Pˆzer 社の CP690, 550 はこれまでに Jak3 特異的 阻害薬として RA に対する有効性が発表されてきた が,2008 年のアメリカリウマチ学会では Jak1~3 を阻害する Jak 阻害薬として発表された.その背 景には,in vitro における個々のキナーゼに対する 阻害作用(in vitro kinase assay)は Jak3 に高い特 異性を有することに変わりはないものの,2 つの Jak が協調して転写因子 Stat を活性化するため,in vivo(細胞内)における Jak3 阻害は結果的に他の Jak をも阻害する可能性が考慮されたことが挙げら れる.加えて kinome を用いた阻害薬の網羅的な解 析により必ずしも Jak3 阻害のみにとどまらないこ ともあげられる11).この観点からは,Incyte 社の
INCB18424 も Jak1/Jak2 に特異性が高く,Jak3 阻 害の IC50 には治療量では到達しないことが公表さ れているが Jak3 をも阻害する可能性は否定できな い.特異性に関しては何れの化合物も個々のキナー ゼに対する特異性は高いものの,in vivo における 作用は結果的に汎 Jak 阻害剤として作用している 可能性を考慮すべきであり,特異性は in vitro にお ける結果を反映する程高くない可能性がある. RA に対する Jak 阻害薬の有効性 前述の如く,CP690, 550 と INCB18424 は Jak 阻 害薬として作用する可能性を有する低分子化合物で あるが,いずれも臨床試験中でありその高い有効性 が報告されている.低分子化合物であるため,経口 摂取可能であると共に,半減期が短く投与しやすい ことが大きな特徴である.加えて,生物学的製剤と 比較してその製造コストが低くて済むと考えられ, その有効性次第では前述の生物学的製剤が抱える投 与経路と薬価の問題を共に解決する可能性を有する 薬剤である. まず,CP690, 550 は MTX もしくは生物学的製 剤 に 抵 抗 性 を 示 し た RA 症 例 に 対 す る 有 効 性 が 2006 年 のア メ リカ リ ウマ チ 学会 に て発 表 され , 2008 年の同学会では MTX 抵抗性症例に対する用 量反応試験の結果が発表された(図 2,図 3).2006 年の発表では 264 例の既存の抗リウマチ薬または生 物学的製剤にて治療抵抗性または副作用により加療 困難であった RA 患者に CP690, 550 を 6 週間にわ たり投与した結果,高い有効性が認められた.プラ セボ,5 mg/body, 15 mg/body または 30 mg/body の 1 日 2 回投与が行われ,驚くべき事に最少量の 5 mg/body にても投与開始 6 週後に,ACR20 が 70 , 15 mg / body 投 与 で は ACR20 ; 81 , ACR50 ; 54, ACR70 ; 22と際立った有効性が示された (図 2)12).その一方で,副作用として最も多くみら れたのが頭痛と嘔気で,重篤なものとして好中球減 少と貧血が用量依存性に増加することも指摘され た.また,2008 年の発表では 509 例対する MTX 併用プラセボ対照用量反応試験において 28 関節を 基準とした RA 活動性評価である DAS28 での判定 において一日 3 mg, 10 mg, 15 mg の 2 回内服で驚 くべきことに 30以上が寛解に到達することが報 告された(図 3)2).現在,更なる安全性と有効性確 認のためアダリムマブとの比較試験が進行中であ る.本邦では平成 20 年 1 月より MTX に治療抵抗 性を示す RA 症例を対象に,プラセボ,CP690, 550 1 mg/body, 3 mg/body, 5 mg/body, 10 mg/body の 1 日 2 回投与を 12 週間行う臨床試験第 II 相とそれ に引き続く長期投与試験が進行中である.当科にお いても十数症例が参加中であるが,Kremer らの報 告同様,投与開始早期より治療効果を示す症例が多 くみられ,一部は寛解状態にある.本邦における第 II 相試験の結果が待たれるところであるが,おお
図 3 MTX 抵抗性 RA に対する CP690, 550 プラセボ対照容量反応性試験における投与 12 週目の ACR 反応到達率と DAS28 を 基準とした寛解率.n=509 (Kremer J. et al. 20082)より引用改変) 図 4 抗リウマチ薬抵抗性 RA に対する INCB18424 の投与 4 週目の ACR 反応到達率.(n=50) (Williams W. et al. 200817)より引用改変) 図 5 抗リウマチ薬抵抗性 RA に対する INCB18424 の投与 4 週目の DAS28 による評価.(n=50) (Williams W. et al. 200817)より引用改変) むね米国よりの報告と類似していることが予想され る.平成 21 年には第 3 相試験の開始が予定されて いる. 一方,Incyte 社により開発された INCB18424 は 2008 年アメリカリウマチ学会において臨床試験第 IIa 相の結果が発表された.抗リウマチ薬抵抗性症 例 50 例に対しプラセボ,5 mg/body, 15 mg/body, 25 mg/body, 50 mg/body を一日 2 回の投与を行い, 4 週間後に 15 mg/body で ACR20 の到達率が 80 を超える効果が見られている(図 4).また,特筆 すべきは,15 mg/body 以上の容量では 20~30が ACR70 を達成し,さらに 10強は ACR90,すな わち寛解状態に到達していることである.また,28 関節を対象に RA 活動性を評価する DAS28 におい ても,寛解の指標である<2.6 となる症例が 10~30 にみられている(図 5).副作用は腹痛,好中球 減少,血小板減少がそれぞれ一例ずつみられたのみ で,重篤な感染症は見られなかった13).しかし,症 例数が少なく,期間が短い上に限られた地域での試 験(北米,ポーランド)であったことから,その有 効性に加えて,安全性の観点から今後更なる試験進 行が期待される. CP690, 550 と INCB18424 は臨床試験においては 現在までの経口抗リウマチ薬では得られなかった高 い効果が投与開始後早期から見られている.今後は 単剤治療での効果と共に,他の経口抗リウマチ薬や
図 6 Jak3 欠 損 に よ る 樹 状 細 胞 よ り の サ イ ト カ イ ン 産 生 CpG : CpG oligo p<0.05, p<0.01(野生型と比較 して) (Yamaoka K et al. 20057)より改変引用) 生物学的製剤との併用による治療効果が期待される ところである.表 1 に示すように多数の製薬企業が 同様の化合物を開発中であることから今後,Jak フ ァミリーを標的とした複数の薬剤の効果が臨床試験 を通じて明らかになると考えられる.その多くが骨 髄増殖性疾患を対象としているが,MTX に代表さ れるようにこれまでの経口抗リウマチ薬が悪性疾患 を対象とした薬剤の応用により開発された経緯から, RA に対する治療効果が期待できると思われる.現 時点では,CP690, 550 と INCB18424 が今後新規経 口抗リウマチ薬となり,特に薬価のために生物学的 製剤の投与が困難となっている方々に福音を齎すこ とが期待される. Jak 阻害薬の作用機序 短期間の投与により高い有効性と少ない副作用を 示している CP690, 550 と INCB18424 であるが, 前述したように非特異性を有することからその作用 機序は明らかでない.現在までに CP690, 550 を用 いた実験結果の多くが公表されており,最近では臓 器移植後症例に同薬剤を投与した際の結果も発表さ れている14).ここでは,著者の行っている Jak3 Stat6 欠 損 マ ウ ス を 用 い た 実 験 結 果 も ふ ま え て CP690, 550 の作用機序につき述べる. CP690, 550 は Karaman MW らに より 非 特異 性 を指摘されたが,in vitro における Jak3 に対する 特異性は Jak2 に対するものの 20 倍と公表されて いる1).我々は RA 患者末梢血 CD4 陽性 T 細胞を 用いて CP690, 550 の作用を解析する目的で,Jak3 に 対 し て 同 等 の 特 異 性 を 有 す る PF956980 を in vitro において投与した15).RA 治療に用いられる 濃度を 10 nM,移植片対宿主病の治療濃度を 100 nM と設定して CD4 陽性 T 細胞の増殖とサイトカ イン産生につき検討を行った.100 nM では増殖は 完全に抑制され,IL17 と IFNg の産生は抑制さ れる傾向が見られたものの,10 nM ではいずれも 見られなかった(未発表データ).また,van Gurp らは腎臓移植を行った 9 症例に,現在行われている RA 対象臨床試験における最大投与量よりも更に 10 mg 多い 30 mg の一日 2 回投与を 29 日間行った. その結果,NK 細胞と CD4CD25 陽性調節性 T 細胞 の数は減少するものの,CD4 陽性,CD8 陽性 T 細 胞数に変化なく,CD19 陽性 B 細胞は投与前の 2 倍 に増加したと報告している14).加えて,末梢血単核 球からの IFNg 産生を抑制することが報告され, 高濃度における CD4 陽性 T 細胞に対する短期的な 作用については我々の実験結果と一致していると考 える. 我々は,Jak3 の単球系細胞における機能に着目 し Jak3 欠損マウス由来樹状細胞の解析を行った. Toll 様受容体刺激により Jak3 欠損マウスでは代表 的炎症性サイトカインである TNFa と IL6 の産 生レベルは野生型と同等であったが,IL10 の過剰 産生がみられた(図 6)4).更に,Jak3 がその下流 で活性化する転写因子 Stat6 の欠損マウス由来樹状 細胞においても同様の結果が得られている(未発表 データ).この結果より,Jak3 阻害薬はリンパ球系 細胞だけでなく単球系細胞である樹状細胞にも作用 し,代表的抗炎症性サイトカインである IL10 の 産生を増強することで RA に対する抗炎症作用を有 する可能性が考えられる. しかし,Jak3 欠損または機能不全による代表的 表現型がヒト,マウス何れにおいてもリンパ球系細 胞の分化増殖不全による SCID であるのに対して, ヒトに Jak3 阻害薬を高容量で投与しても必ずしも 同等の結果が見られていない14).このことは,単な る種差による違いだけでなく Jak3 単一分子の阻害 以外の作用機序が存在することを示唆していると考 える.最も考えられるのは Jak ファミリーに属す る分子の阻害と,Karaman らが指摘した非特異性 による他のキナーゼ阻害作用である.また,RA の 治療に用いる CP690, 550 は 5~15 mg の 1 日 2 回 投与と少量で,リンパ球減少等の血球減少を来たす ことなく早期より効果を発現していることは我々の in vitro の実験結果を反映しておりリンパ球以外の 細胞に対する効果を考慮しなくてはならない.ま た,樹状細胞に対する IL10 過剰産生誘導による 早期効果発現も考えにくく作用機序解明は今後の長
期投与における副作用予測にも重要な課題である. お わ り に Jak を標的とした経口投与可能な低分子化合物が RA に対して TNF 阻害療法と同等,またはそれ以 上の有効性を発揮する可能性があることが明らかと なり,サイトカインのシグナル伝達に関与する分子 を標的とした新規化合物の開発は加速するものと思 われる.今後は,抗リウマチ薬や生物学的製剤との 相互作用の探究,解明により RA 治療の更なる進歩 に寄与し,より多くの RA 患者の寛解導入が可能と なることが期待される.一方でこれまで考えられて いた程の特異性は必ずしも必要ではなく,適度な特 異性(非特異性)がかえって副作用が少なく,高い 効果を示すことが臨床試験を通じて明らかとなって いる.つまり,阻害剤投与時における生体内の現象 は一分子阻害による作用機序では説明できないと考 えられる.そのため,作用機序の解明と長期投与に よる影響については慎重に検討する必要がある. RA の診療は,診断をより早期に行い,可能な限 り関節破壊が始まる前に治療開始し,関節破壊を抑 制することを目標としている.つまり,今後の治療 対象はより若年化し,発症時に活動的な日常生活を 送っている患者が増加することが予想される.RA は疾患の特性上治療継続がきわめて重要である.そ の際に,効果が高く,副作用が最小限に抑えられる 経口薬が理想的である.現在,臨床試験が最も進ん でいる 2 つの Jak 阻害薬はその理想的な薬剤に最 も近いものであり今後の試験進行と後続する化合物 がより良いものであることを切望する. 文 献
1) Changelian PS, Flanagan ME, Ball DJ, et. al. : Prevention of organ allograft rejection by a speciˆc Janus kinase 3 inhibitor.Science. 302 : 875878, 2003.
2) Kremer J, Cohen S, Wilkinson B, et al. : The oral Jak inhibitor CP690, 550 (CP) in combi-nation with methotrexate (MTX) is e‹cacious, safe and well tolerated in patients with active rheumatoid arthritis (RA) with an inadequate response to methotrexate alone. [abstract] Arthritis Rheum. 58(suppl) : L13, 2008. 3) Korn T, Bettelli E, Gao W, et al. : IL21
initi-ates an alternative pathway to induce proin-‰ammatory T(H)17 cells. Nature. 448 : 484 487, 2007.
4) Yamaoka K, Min B, Zhou YJ, et al. : Jak3 negatively regulates dendritic cell cytokine production and survival. Blood. 106 : 3227 3233, 2005.
5) Krause A, Scaletta N, Ji JD, et al. : Rheuma-toid arthritis synoviocyte survival is dependent on Stat3.J Immunol. 169 : 66106616, 2002. 6) Frucht DM, Aringer M, Galon J, et al. : Stat4 is
expressed in activated peripheral blood mono-cytes, dendritic cells and macrophages at sites of Th1mediated in‰ammation. J Immunol. 164 : 46594664, 2000.
7) Muller-Lander U, Judex M, Ballhorn W, et al. : Activation of the IL4 STAT pathway in rheu-matoid synovium.J Immunol. 164 : 38943901, 2000.
8) Walker JG, Ahern MJ, Coleman M, et al. : Ex-pression of Jak3, STAT1, STAT4, and STAT6 in in‰ammatory arthritis : unique Jak3 and STAT4 expression in dendritic cells in seroposi-tive rheumatoid arthritis.Ann Rheum Dis. 65 : 149156, 2006
9) Walker JG, Ahern MJ, Coleman M, et al. : Changes in synovial tissue JakSTAT expres-sion in rheumatoid arthritis in response to suc-cessful DMARD treatment. Ann Rheum Dis. 65 : 15581564, 2006.
10) Pesu M., Laurence A., Kishore N., et al. : Therapeutic targeting of Janus kinases. Im-munol Rev. 223 : 132142, 2008.
11) Karaman MW, Herrgard S, Treiber KD, et al. : A quantitative analysis of kinase inhibitor selec-tivity.Nat Biotechnol. 26 : 127132, 2008. 12) Kremer JM, Bloom BJ, Breedveld FC, et. al. :
A randomized, double-blind, placebo-con-trolled trial of 3 dose levels of CP690, 550 versus placebo in the treatment of active rheu-matoid arthritis. [abstract] Arthritis Rheum. 54(suppl) ; S33, 2006.
13) Williams W, Scherle P, Shi J, et al. : A Randomized placebo-controlled study of INCB018424, a selective Janus kinase1 & 2 ( JAK1&2) inhibitor in rheumatoid arthritis (RA). [abstract] Arthritis Rheum. 58(suppl) ; S431, 2008.
14) van Gurp EA, Schoordijk-Verschoor W, Klep-per M, et al. : The eŠect of the JAK inhibitor CP690, 550 on peripheral immune parameters in stable kidney allograft patients. Transplanta-tion. 87 : 7986, 2009.
15) Changelian PS, Moshinsky D, Kuhn CF, et al. : The speciˆcity of JAK3 kinase inhibitors. Blood. 111 : 21552157, 2008.