平成
22 年度 ISO/TC212 国内検討委員会報告
Report of ISO/TC212 National Committee Activity in 2010
河合 忠 (JCCLS 顧問、ISO/TC212 国内検討委員会委員長、国際臨床病理センター所長) Tadashi Kawai (Advisor of JCCLS, Chairperson of ISO/TC212 National Committee, Director of International Clinical Pathology Center)
1.国内検討委員会構成メンバー (平成23 年 3 月現在)(敬称略・順不同) *WG代表, **WG 代表代行 【委員長】 河合 忠(JCCLS 顧問/自治医科大学名誉教授/国際臨床病理センター) 【副委員長】 小出 博文((社)日本臨床検査薬協会常務理事) 矢冨 裕(JCCLS 常任理事/東京大学大学院医学系研究科臨床病態検査医学教授) 【団体委員】 濱崎 直孝(JCCLS 会長 /長崎国際大学教授) 今井 秀孝(JCCLS顧問/(独)産業技術総合研究所顧問) 渡邊 清明(JCCLS 常任理事/東京臨床検査医学センター理事長) 菅野 剛史(JCCLS 顧問/浜松医科大学名誉教授) 森武 春男((財)日本規格協会) 宮澤 幸久(JCCLS 常任理事/日本臨床検査医学会理事長/帝京大学医学部臨床病理学教授) 細萱 茂実(JCCLS 常任理事/(社)日本臨床衛生検査技師会/香川県立保健医療大学教授) 箕輪 正和(JCCLS 監事/(社)日本衛生検査所協会専務理事) 菊地 博(JCCLS 副会長/(社)日本臨床検査薬協会副会長/極東製薬工業㈱社長) 林 健太郎((社)日本分析機器工業会専務理事) 青柳 邁((公財)日本適合性認定協会技術統括マネジャー) 【WG1担当委員】 *河合 忠(JCCLS 顧問/自治医科大学名誉教授/国際臨床病理センター) **宮地 勇人(東海大学医学部基盤診療学系臨床検査学教授) 渡邊 卓(日本臨床検査医学会/杏林大学医学部臨床検査医学教室教授) 勝野 浩(新小岩クリニック副院長)
篠原 克幸((社)日本臨床衛生検査技師会/福岡大学筑紫病院) 小張 憲治((社)日本衛生検査所協会/(株)ビーエムエル) 北川 隆((社)日本分析機器工業会/シスメックス(株)学術本部) 堀 友繁((財)バイオインダストリー協会事業推進部部長) 久保野 勝男(公財)日本適合性認定協会副認定センター長) 小林 隆((社)日本臨床検査薬協会/栄研化学㈱) 伊藤 哲((社)日本臨床検査薬協会/富士レビオ㈱) 大野 紘宇(㈱CGI) 小出 博文((社)日本臨床検査薬協会常務理事) 苅谷 文雄((社)日本臨床検査薬協会/積水メディカル㈱) 矢冨 裕(JCCLS 常任理事/東京大学大学院医学系研究科臨床病態検査医学教授) 【WG2担当委員】 *小出 博文((社)日本臨床検査薬協会常務理事) 千葉 光一(JCCLS 常任理事/(独)産業技術総合研究所計量標準研究部門副部門長) 桑 克彦(JCCLS 理事(独)産業技術総合研究所計量標準研究部門) 佐藤 尚武(日本臨床検査医学会/順天堂東京江東高齢者医療センター臨床検査科科長) 木村 一夫((社)日本衛生検査所協会/三菱化学メディエンス) 白上 篤((社)日本臨床検査薬協会/シスメックス(株)) 苅谷 文雄((社)日本臨床検査薬協会/積水メディカル㈱) 菅野 剛史(JCCLS 顧問/浜松医科大学名誉教授) 細萱 茂実(JCCLS 常任理事/(社)日本臨床衛生検査技師会/香川県立保健医療大学教授) 下田 勝二((公財)日本適合性認定協会認定センター部長補) 久保野 勝男(公財)日本適合性認定協会副認定センター長) 河合 忠(JCCLS 顧問/自治医科大学名誉教授/国際臨床病理センター) 【WG3担当委員】 *矢辺 良平(JCCLS 常任理事/(社)日本分析機器工業会/ (株)日立ハイテクノロジーズナノテクノロジー製品事業本部) 下田 勝二((公財)日本適合性認定協会認定センター部長補) 前川 雅男(JCCLS 理事/(社)日本臨床検査薬協会専務理事) 繁田 勝美((社)日本臨床検査薬協会/東ソー(株)) 金村 茂((社)日本衛生検査所協会/(株)エスアールエル) 山本 昭彦((社)日本分析機器工業会/ベックマン・コールター・バイオメディカル(株)) 山岸 和年((社)日本分析機器工業会/東芝メディカルシステムズ(株)) 種村 守親((株)旭ポリスライダー)
大野 紘宇(㈱CGI) 桑 克彦(JCCLS 理事/(独)産業技術総合研究所計量標準研究部門) 小出 博文((社)日本臨床検査薬協会常務理事) 河合 忠(JCCLS 顧問/自治医科大学名誉教授/国際臨床病理センター) 【WG4担当委員】 *河合 忠(JCCLS 顧問/自治医科大学名誉教授/国際臨床病理センター) 松本 哲哉(日本臨床検査医学会/東京医科大学微生物講座教授) 福地 邦彦(日本臨床検査医学会/昭和大学医学部臨床病理学教授) 賀来 満夫(日本臨床微生物学会/東北大学大学院医学系研究科検査診断学分野教授) 長沢 光章((社)日本臨床衛生検査技師会/日本臨床微生物学会/東北大学病院診療技術部 臨床検査技師長) 池戸 正成((社)日本臨床検査薬協会/栄研化学(株)生物化学研究所) 吉原 博明((社)日本臨床検査薬協会/日本ベクトン・ディッキンソン(株)) 三品 正俊(社)日本臨床検査薬協会/日水製薬(株)診断薬研究部) 岡沢 豊((社)日本臨床検査薬協会/極東製薬工業(株)研究開発部) 柳沢 英二((社)日本衛生検査所協会/(株)ミロクメディカルラボラトリー) 【オブザーバー】 宮地 大輔(厚生労働省医政局経済課医療関連サービス室) 鈴木 由香(医薬品医療機器総合機構 医療機器審査部部長) 中村 啓子(経産省産業技術環境局環境生活標準化推進室課長補佐) 横瀬 栄二(経産省産業技術環境局知的基盤課課長補佐) 門川 員浩(経産省製造産業局生物化学産業課標準化係長) 【事務局】 種村 守親(JCCLS 事務局長) 2.ISO/TC212 の概要
(ア) 名称:Clinical laboratory testing and in vitro diagnostic test systems (臨床検査及び体外診断検査システム)
(イ) 委員長:Dr. Donald Powers (USA)
(ウ) 事務局:幹事国,USA; ANSI/CLSI; Secretary, Mr. David Sterry (CLSI)
(エ) 日本国事務局:日本工業標準調査会(JISC)/日本臨床検査標準協議会(JCCLS) (オ) WG1:Quality and competence in the medical laboratory (臨床検査室におけ
(カ) WG2 : Reference systems ( 基 準 シ ス テ ム ) , Convener: Dr. Rene Dybkaer (Denmark)
(キ) WG3:In vitro diagnostic products (体外診断用製品),Convener: Ms. Kay Setzer (USA)
(ク) WG4:Antimicrobial susceptibility testing (抗菌薬感受性検査),Convener: Dr. James H. Jorgensen (USA)
3.加盟国
(ア) P-メンバー国 31カ国 (加盟国標準機関名・略称)
Argentine (IRAM), Australia (SA), Austria (ASI), Belgium (NBN), Brazil (ABNT), Canada (SCC), Chile (INN), China (SAC), Czech Republic (UNMZ), Denmark (DS), Finland (SFS), France (AFNOR), Germany (DIN), Iran(USIRI), Ireland (NSAI), Israel (SII), Italy (UNI), Jamaica (BSJ), Japan (JISC), Korea, Republic of (KATS), Malaysia (DSM), Netherlands (NEN), New Zealand (SNZ), Norway (SN), Portugal (IPQ), Singapore (SPRING SG), Spain (AENOR), Sweden (SIS), Turkey (TSE), United Kingdom (BSI), United States of America (ANSI)
(イ) O-メンバー国 20カ国
Bulgaria (BDS), Croatia (HZN), Cuba (NC), Cyprus (CYS), Egypt (EOS), Estonia (EVS), Hong Kong, China (ITCHJSAR), Hungary (MSZT), India (BIS), Luxembourg (SEE), Malta (MSA), Mexico (DGN), Mongolia (MASM), Romania (ASRO), Russian Federation (GOSTR), Saudi Arabia (SASO), Switzerland (SNV), Thailand (TISI), Trinidad and Tobago (TTBS), Uruguay (UNIT), Zimbabwe (SAZ)
4.連絡団体(Liaisons)
(ア) ISO/IEC 内委員会 6委員会:ISO/TC 48, TC 76, TC176, TC 210, TC 215; ISO/CASCO との連携強化
(イ) ISO 以外の国際団体 14団体:BIPM, EC4, EDMA, ELM, EUROM, GHTF, ICSH, IFBLS, IFCC, ILAC, IUPAC, OECD, WASPaLM, WHO
5.2010年度ISO/TC212 作業項目と進行状況(表1~4) (ア) ISO/TC212 が関与して現在まで発行された国際規格 24件(その内 1 件廃止) (イ) ISO/TC212 で審議中の国際規格案 7件
ISO/TC212 の審議済み及び審議項目
(2011-05-31 現在、Resolutions を含む) 表1 ISO/TC212/WG1 で審議済みまたは審議中の項目(2011-05-31 現在) 文書番号 英語規格名称 日本語規格名称* 審議状況 ISO 15189:2007 (Second edition) Medical laboratories – Particular requirements for quality and competence臨床検査室-品質と能力に
関する特定要求事項 2007-04-15 発行
ISO
15190:2003
Medical laboratories – Requirements for safety
臨床検査室-安全に関する
要求事項 2003-10-15 発行 ISO/TR
22869: 2005
Medical laboratories – Guidance on laboratory implementation of ISO 15189:2003 臨 床 検 査 室 - ISO15189:2003 の検査室導 入のための指導書 2005-02-17 発行 ISO 22870:2006
Point-of-care testing (POCT) – Requirements for quality and competence POC 検査-品質と能力に関 する要求事項 2006-02-03 発行 ISO/TS 22367: 2008
Medical laboratories – Reduction of error through risk management and continual improvement 臨床検査室-リスク・マネ ジメントと継続的改善によ る検査過誤の削減 2008-05-01 発行 SR 投票締切: 2011-09-15 ISO/DIS 15189 (Ed 3)
Medical laboratories –Particular requirements for quality and competence 臨床検査室-品質と能力に 関する特定要求事項 DIS 投票締切: 2011-06-06 ISO/WD 15190 (ISO 15190:2003 版 の改訂) Medical laboratories – Requirements for safety
臨床検査室―安全に関する
要求事項 廃止
ISO
22870:2006 改訂
Point-of-care testing (POCT) – Requirements for quality and competence POC 検査-品質と能力に関 する要求事項 SR 投票締切: 2009-06-15 一部修正/改訂 * ISO/TC212 国内検討委員会が推奨する日本語名称
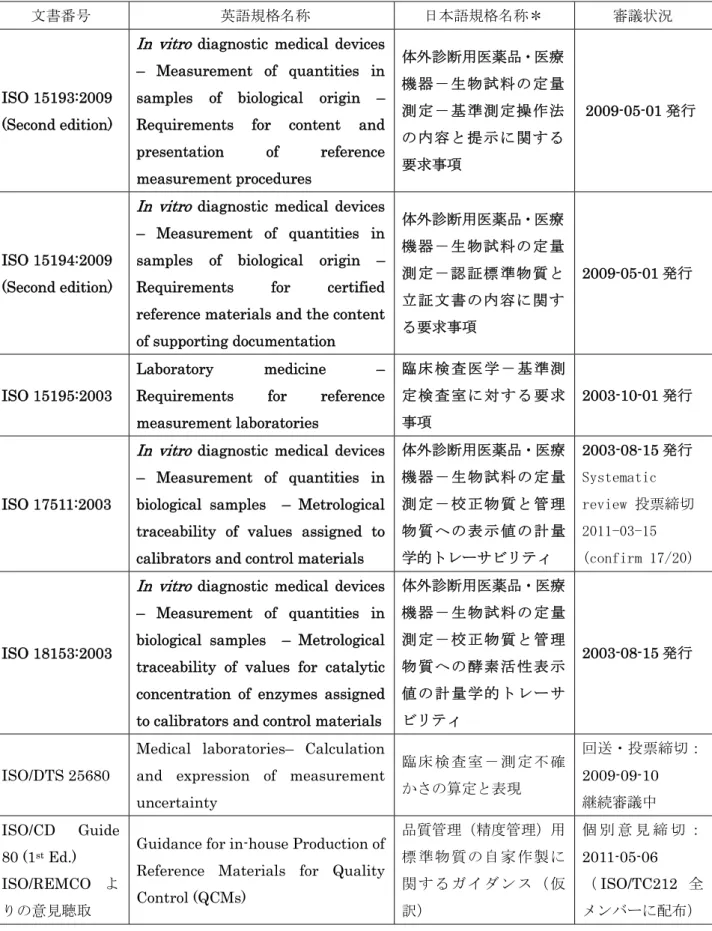
表2 ISO/TC212/WG2 で審議済または審議中の項目(2011-05-31 現在)
文書番号 英語規格名称 日本語規格名称* 審議状況
ISO 15193:2009 (Second edition)
In vitro diagnostic medical devices – Measurement of quantities in samples of biological origin – Requirements for content and presentation of reference measurement procedures 体外診断用医薬品・医療 機器-生物試料の定量 測定-基準測定操作法 の内容と提示に関する 要求事項 2009-05-01 発行 ISO 15194:2009 (Second edition)
In vitro diagnostic medical devices – Measurement of quantities in samples of biological origin – Requirements for certified reference materials and the content of supporting documentation 体外診断用医薬品・医療 機器-生物試料の定量 測定-認証標準物質と 立証文書の内容に関す る要求事項 2009-05-01 発行 ISO 15195:2003 Laboratory medicine – Requirements for reference measurement laboratories 臨 床 検 査 医学 - 基 準測 定 検 査 室 に対 す る 要求 事項 2003-10-01 発行 ISO 17511:2003
In vitro diagnostic medical devices – Measurement of quantities in biological samples – Metrological traceability of values assigned to calibrators and control materials
体外診断用医薬品・医療 機 器 - 生 物試 料 の 定量 測 定 - 校 正物 質 と 管理 物 質 へ の 表示 値 の 計量 学的トレーサビリティ 2003-08-15 発行 Systematic review 投票締切 2011-03-15 (confirm 17/20) ISO 18153:2003
In vitro diagnostic medical devices – Measurement of quantities in biological samples – Metrological traceability of values for catalytic concentration of enzymes assigned to calibrators and control materials
体外診断用医薬品・医療 機 器 - 生 物試 料 の 定量 測 定 - 校 正物 質 と 管理 物 質 へ の 酵素 活 性 表示 値 の 計 量 学的 ト レ ーサ ビリティ 2003-08-15 発行 ISO/DTS 25680
Medical laboratories– Calculation and expression of measurement uncertainty 臨 床 検 査 室- 測 定 不 確 かさの算定と表現 回送・投票締切: 2009-09-10 継続審議中 ISO/CD Guide 80 (1st Ed.) ISO/REMCO よ りの意見聴取
Guidance for in-house Production of Reference Materials for Quality Control (QCMs) 品質管理(精度管理)用 標 準 物 質 の自 家 作 製 に 関 す る ガ イダ ン ス ( 仮 訳) 個 別 意 見 締 切 : 2011-05-06 (ISO/TC212 全 メンバーに配布) * ISO/TC212 国内検討委員会が推奨する日本語名称
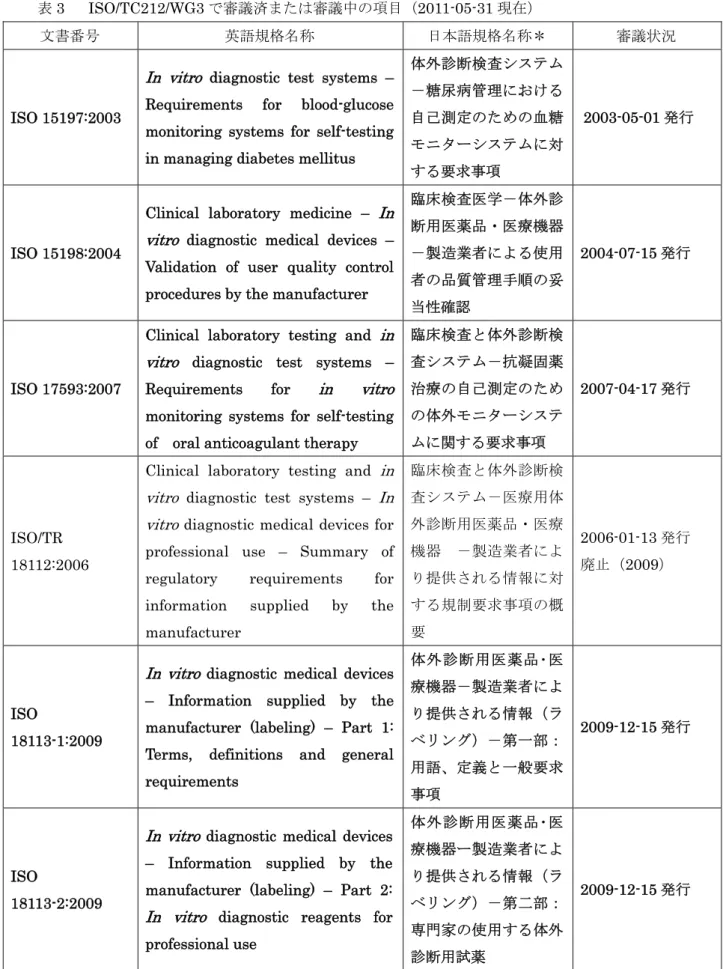
表3 ISO/TC212/WG3 で審議済または審議中の項目(2011-05-31 現在)
文書番号 英語規格名称 日本語規格名称* 審議状況
ISO 15197:2003
In vitro diagnostic test systems – Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus
体外診断検査システム -糖尿病管理における 自己測定のための血糖 モニターシステムに対 する要求事項 2003-05-01 発行 ISO 15198:2004
Clinical laboratory medicine – In vitro diagnostic medical devices – Validation of user quality control procedures by the manufacturer
臨床検査医学-体外診 断用医薬品・医療機器 -製造業者による使用 者の品質管理手順の妥 当性確認 2004-07-15 発行 ISO 17593:2007
Clinical laboratory testing and in vitro diagnostic test systems – Requirements for in vitro monitoring systems for self-testing of oral anticoagulant therapy
臨床検査と体外診断検 査システム-抗凝固薬 治療の自己測定のため の体外モニターシステ ムに関する要求事項 2007-04-17 発行 ISO/TR 18112:2006
Clinical laboratory testing and in vitro diagnostic test systems – In vitro diagnostic medical devices for professional use – Summary of regulatory requirements for information supplied by the manufacturer 臨床検査と体外診断検 査システム-医療用体 外診断用医薬品・医療 機器 -製造業者によ り提供される情報に対 する規制要求事項の概 要 2006-01-13 発行 廃止(2009) ISO 18113-1:2009
In vitro diagnostic medical devices – Information supplied by the manufacturer (labeling) – Part 1: Terms, definitions and general requirements 体外診断用医薬品・医 療機器-製造業者によ り提供される情報(ラ ベリング)-第一部: 用語、定義と一般要求 事項 2009-12-15 発行 ISO 18113-2:2009
In vitro diagnostic medical devices – Information supplied by the manufacturer (labeling) – Part 2: In vitro diagnostic reagents for professional use 体外診断用医薬品・医 療機器ー製造業者によ り提供される情報(ラ ベリング)-第二部: 専門家の使用する体外 診断用試薬 2009-12-15 発行
ISO
18113-3:2009
In vitro diagnostic medical devices – Information supplied by the manufacturer (labeling) – Part 3: In vitro diagnostic instruments for professional use 体外診断用医薬品・医 療機器ー製造業者によ り提供される情報(ラ ベリング)-第三部: 専門家の使用する体外 診断用装置 2009-12-15 発行 ISO 18113-4:2009
In vitro diagnostic medical devices – Information supplied by the manufacturer (labeling) – Part 4: In vitro diagnostic reagents for self-testing 体外診断用医薬品・医 療機器ー製造業者によ り提供される情報(ラ ベリング)-第四部: 自己測定用体外診断試 薬 2009-12-15 発行 ISO 18113-5:2009
In vitro diagnostic medical devices – Information supplied by the manufacturer (labeling) – Part 5 : In vitro diagnostic instruments for self-testing 体外診断用医薬品・医 療機器ー製造業者によ り提供される情報(ラ ベリング)-第五部: 自己測定用体外診断装 置 2009-12-15 発行 ISO 14971:2007, Annex H
Medical devices – Application of risk management to medical devices, Annex H: Guidance on risk analysis for in vitro diagnostic medical devices 医療機器―医療機器へ のリスクマネジメント の適用、付属書H:体 外診断用医療機器のた めのリスク分析に関す る指導書 2009-02-28 発行 ISO 19001:2002
In vitro diagnostic medical devices – Information supplied by the manufacturer with in vitro diagnostic reagents for staining in biology 体外診断用医薬品・医 療機器-生物学におけ る体外診断用染色試薬 に対して製造業者によ り提供される情報 2002-11-15 発行 ISO/DIS 23640
In vitro diagnostic medical devices – Evaluation of stability of in vitro diagnostic reagents 体外診断用医薬品・医 療機器-体外診断用試 薬の安定性の評価 審 議 中 (DIS vote 予定) ISO/DIS 19001 (Second edition)
In vitro diagnostic medical devices – Information supplied by the manufacturer with in vitro diagnostic reagents for staining in
体外診断用医薬品・医 療機器-生物学におけ る体外診断用染色試薬 に対して製造業者によ 2011-01-05 締 切:承認済み
biology り提供される情報
ISO/CD 15197 (Second edition)
In vitro diagnostic test systems – Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus
体外診断検査システム -糖尿病管理における 自己測定のための血糖 モニターシステムに対 する要求事項 審 議 中 (DIS vote 締切:2011-06-27) ISO 17593 (Second edition) 内容確認
Clinical laboratory testing and in vitro diagnostic test systems – Requirements for in vitro monitoring systems for self-testing of oral anticoagulant therapy
臨床検査と体外診断検 査システム-抗凝固薬 治療の自己測定のため の体外モニターシステ ムに関する要求事項 SR vote 締 切 : 2010-09-15 * ISO/TC212 国内検討委員会が推奨する日本語名称
表4 ISO/TC212/WG4 で審議中の項目(2011-05-31 現在)
文書番号 英語規格名称 日本語規格名称* 審議状況
ISO 20776 –1: 2006
Clinical laboratory testing and in vitro diagnostic test systems - Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices -- Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases
臨床検査と体外診断検査 システムー感染性病原体 の感受性検査及び抗菌薬 感受性検査機器の性能評 価 - 第一部:感染症 に関連する迅速発育好気 性細菌に対する抗菌薬の 体外活性検査の基準法 2006-11-15 発行 ISO 20776 –2: 2007
Clinical laboratory testing and in vitro diagnostic test systems - Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices -- Part 2: Evaluation of performance of antimicrobial susceptibility test devices 臨床検査と体外診断検査 システム-感染性病原体 の感受性検査及び抗菌薬 感受性検査機器の性能評 価 - 第二部:抗菌 薬感受性検査機器の性能 評価 2007-07-01 発行 ISO/WD
11764 Susceptibility testing of fungi
臨床検査-真菌の感受性
検査 審議中
ISO/CD 16256
Clinical laboratory testing and in vitro diagnostic test systems – Reference method for testing and in vitro activity of antimicrobial agents against yeast fungi involved in infectious diseases
臨床検査と体外診断検査 システム- 感染症に関 連する酵母様真菌に対す る抗菌薬の体外活性検査 の基準法 投 票 締 切 : 2011-02-03 ISO/NWIP (N251)
Criteria for acceptable lots of dehydrated Mueller-Hinton agar and broth for antimicrobial susceptibility testing 抗菌薬感受性検査のため の乾燥Mueller-Hinton 寒 天及び肉汁の利用可能な ロットに関する基準(仮 訳) 投 票 締 切 : 2011-02-03 * ISO/TC212 国内検討委員会が推奨する日本語名称
6.第16回全体会議(総会,WG1 会議,WG3 会議),2010-06-02 ~ 06-04、ソール 日本から国内検討委員長を含めて9名の委員が出席し,主な議決事項は以下の通りで ある.なお,総会後の活動結果を追加している. (ア) 14カ国から72名が参加. (イ) ISO/TC212 事務局,同 WG1, WG2, WG3, WG4 の年次活動報告を承認. (ウ) WG4 は抗真菌薬感受性検査に関して、異なる内容の2項目を含めた一つの規格を 作成する. (エ) WG1 会議の議論を踏まえて,ISO/CD 15189 については、2010 年 7 月 31 日まで に提出されたコメントを基に改訂した文書をDIS として投票のため回送すること を承認. (オ) ISO 15190:2003 を改定するという NWIP を取り下げる. (カ) ISO 23640 の名称と適用範囲の一部変更を承認し、新名称は「体外診断用医薬品・ 医療機器-体外診断用試薬の安定性試験」とし、その上でFDIS として投票のため 回送することを承認. (キ) ISO 15197 の適用範囲の一部変更を承認し、一部消費者間での誤解を解消するた め、「本規格は、厳密な血糖管理を必要とする入院患者、重症病棟の患者、及び新 生児低血糖の評価には適用しない。」を追加する.その上で、DIS として投票のた め回送する. (ク) ISO/TC212 の年次総会の時期・日程は、今後、その都度決定することとし, 20 11年度の総会は米国で9/10月に予定. (ケ) 生物学における染色に関する NWIP を回送することに賛成. (コ) ISO/TC212 内で規格作成のために使用する内部文書として、現在の規格から用語 集を委員長主導で作成する. (サ) すべての WG が総会に合わせて会議をもつよう努力する.委員長が次回総会まで に「ISO/TC212 の運用手順書案」を作成し, ISO/TC212 に提案する. (シ) 測定不確かさに関する ISO/DTS に関するタスクフォースを立ち上げ、ISO/FDIS 21748 と内容について比較、整合性を検討し、ISO/WG1 & WG2 に確認と意見聴 取のため2カ月以内に最終回送する.また、臨床検査医学における不確かさの推 定のための簡単な方策について2番目の文書を作成するNWIP を用意する.日本 から青柳邁委員がメンバーに加わる. 7.国内検討委員会の開催と活動状況 (ア) 国内検討委員会対面会議の開催:2回(2010-02-08, 2010-07-05) (イ) 経済産業省/日本工業標準調査会/日本規格協会への諸報告作成について JCCLS 事 務局への協力
を事務局で整備 8.今後の活動予定 (ア) ISO/TC212 全体会議(総会,WG1 会議,WG3 会議)及び各 WG 会議(未定)へ の参加 (イ) 国際規格作成事業への継続参加 (ウ) 国内検討委員会会議と各 WG 会議の開催と懸案事項の審議 (エ) JCCLS/JAB 臨床検査室認定プログラムへの参加と協力 (オ) その他の関連事業 (カ) 次回の国内検討委員会会議の開催日時:未定(2011 年8/9 月) 平成24-25年度のISO/TC212 国内検討委員会の委員長並びに 委員を決定する.JCCLS 新会長が選出された後,関連諸団体に委 員の推薦方を依頼する. 以上