a国立研究開発法人医薬基盤・健康・栄養研究所 国立
健康・栄養研究所,b昭和女子大学食安全マネジメント
学科
e-mail: tyschiba@nibiohn.go.jp
2019 The Pharmaceutical Society of Japan
―Regular Article―
がん患者の健康食品摂取に関連した有害事象の症例報告に関するシステマティックレビュー
小島彩子,a 佐藤陽子,a 西島千陽,a 梅垣敬三,b 千葉 剛,a
Systematic Review of Case Reports on the Adverse Events
Due to Health Food Intake by Cancer Patients
Ayako Kojima,aYoko Sato,aChiharu Nishijima,aKeizo Umegaki,b and Tsuyoshi Chiba,a
aNational Institute of Health and Nutrition, National Institutes of Biomedical Innovation, Health and Nutrition; 1231 Toyama, Shinjuku-ku, Tokyo 1628636, Japan: andbDepartment of Food Safety and Management,
Showa Women's University; 1757 Taishido, Setagaya-ku, Tokyo 1548533, Japan. (Received April 27, 2019; Accepted June 16, 2019)
Cancer patients use health foods (HFs) as complementary and alternative medicine, although the details of their adverse events(AEs) are unclear. We searched three databases [PubMed, ``Igaku Chuo Zasshi'', and Information Sys-tem on Safety and EŠectiveness for Health Foods website(https://hfnet.nibiohn.go.jp/)] for case reports on AEs relat-ed to HF intake in cancer patients publishrelat-ed before October 2018. Of the matchrelat-ed reports, 76 studies and 92 patients(31 in Japan, 61 overseas) that met the selection criteria were included in this review. Thus, the severity of AEs and out-comes were not related to either the concomitant use of HF with cancer chemotherapy or cancer stages of patients. AEs caused by HF intake itself accounted for 87%, while drug-HF interaction accounted for 11%. According to the Com-mon Terminology Criteria for Adverse Events(CTCAE) classiˆcation, 70% of patients whose grades were identiˆed had severe cases(grades 3 to 5). In Japanese patients, hepatic and respiratory disorders accounted for 52% of the severe cases. Cases were predominantly developed as a result of an allergic mechanism, and mushroom products were mostly used. Overseas, serious cases were induced by products that were already indicated for safety problems. Moreover, nota-ble AEs were recognized, such as hypercalcemia, which were caused by intake of HF containing calcium, vitamin D, and shark cartilage, and bacterial infection caused by probiotic products. Analyzing the details of AEs related to HF intake can help health professionals and cancer patients prevent health hazards.
Key words―health food; complementary and alternative medicine; cancer patient; adverse event; Common Ter-minology Criteria for Adverse Events
緒 言
「相補(補完)・代替医療(complementary and
al-ternative medicine; CAM)」とは,米国国立補完統
合衛生センターにおいて「一般的に従来の通常医療 と見なされていない,さまざまな医学・ヘルスケア システム,施術,生成物質など」と位置付けられて い る .1)CAMに は 様 々 な 種 類 と 分 類 方 法 が あ る が,厚生労働科学研究「統合医療の情報発信等の在 り方に関する調査研究」においては,「食や経口摂 取に関するもの(食事療法・サプリメント・断食療 法・ホメオパシー)」「伝統医学,民間療法(薬事承 認されていない漢方医学・中国伝統医学・アーユル ベーダ)」等のなんらかの物質を体外から摂取する 方法のほか,身体への物理的刺激を伴うもの・感覚 や環境を利用するもの・その他等に分類されてい る.1)日本国内ではがん患者の約 4554%,2,3)国外 では 4095%4)が CAM を利用しており,がん患者 における CAM の利用率は他の疾患の患者に比べて 高い.2,5)がん患者の CAM への期待として,腫瘍の 抑制や治療,がん治療の補助あるいは副作用の軽 減,精神的な安定,免疫系の刺激,QOL 改善など が挙げられる.2,6)CAM の利用率が高い患者の特性 としては,乳がん,肺がん,肝胆管がん,大腸がん の患者,化学療法による治療中又は治療歴のある患 者,がんが進行している又は緩和ケア病棟に入所し ている患者,併存疾患の病状が軽い患者等が挙げら れ,現在受けている診療に満足していない傾向にあ
る.2,68)現時点において,CAM 利用によりがん性 疼痛,9)疲労感,10)不安及びうつ症状11)を軽減する ことが報告されているが,いずれも確立した効果と は言えないことから,大規模かつ厳格な臨床研究が 求められる.また,CAM を利用したがん患者の遺 族の 64%は精神的な支えとしての効果を感じてお り,CAM 利用は患者だけでなく家族の心理面にも 影響 を 及ぼ す可 能 性が 示唆 さ れて いる こ とか ら も,3)CAMの適正な選択,利用が重要である. 日本のがん患者では,CAM のうち特に健康食 品・サプリメント等(以下,健康食品)に対する関 心が高く,がん患者が利用する CAM のうち健康食 品の占める割合は,米国 1850%,4,12)EU 28%,4) 香港 72%4)に対して,日本では 5496%2,3)と,がん 患者が利用する CAM の大半が健康食品であり,ま た特定の食事療法の利用者も一定数存在した.健康 食品を利用した国内のがん患者の 87%は,がん診 断をきっかけに利用を開始しており,2,5)平均利用期 間は 1 年 10 ヵ月で,10 年以上利用した事例もあ る.13)利用者の 24%が好ましい効果を感じていた が,好ましい効果を体感したと回答した全員がなん らかのがん標準治療(近代医療によるがん治療.手 術療法,放射線療法,化学療法,ホルモン療法,生 物学的療法等を含む)を受けており,両者の効果は 区別されていない.2) 現時点でがんの治療や進行抑制の効果がヒトにお いて確認されている健康食品はない14)にもかかわら ず,「がんに効く」と標榜した健康食品についての 情報が氾濫し,それががん患者や周囲の人々を誤認 させている.がん患者が健康食品について得ること ができる情報には偏りや誤りが多い.15)さらに利用 者の半数以上は十分な情報を得ないまま製品を利用 しており,2)健康被害についての認識率は非利用者 よりも低く,「食品だから安全である」「自分は大丈 夫」と楽観視する者が多い.5)健康食品を利用した がん患者の 61%は主治医に相談しておらず,その 理由は「医師から質問されない」「医師が利用に理 解がない」「医師に利用停止を薦められる」であっ た.2)治療にあたる腫瘍医の 82%は,「CAM 製品は がんに対して効果がない」と認識しており,主な理 由に「信頼できるエビデンスがない」ことを挙げて いる.16)他方で腫瘍医の 80%は「患者に CAM 製品 の利用について相談されても,推奨もしないが利用 中止を薦めることもできない」と回答している.16) このように,健康食品が安全で有効だと主張する情 報の提供者,がん患者,医療従事者,それぞれが健 康食品の情報の取り扱いに問題を抱えている. がん患者が書籍やインターネット等から入手可能 な情報の大部分において,健康食品の効果や安全性 が過度に強調されており,健康食品を実際に利用し た患者がどのような有害事象を受けたか,またその 利用状況についてはほとんど明らかにされていな い.日本のがん患者における健康食品の利用率が高 い現状を鑑み,健康食品利用に関連した有害事象の 症例を国内外から収集し,健康食品の安全性に関す る情報を正しく理解できるように医療従事者並びに 患者に提供することが急務と考える. そこで本研究では,がん患者が健康食品を利用し て発生した国内外の有害事象の症例報告を収集し, 利用状況や有害事象の詳細について解析した. 方 法 がん診断を受けた患者,あるいはがんの疑いで検 査を受けた者が,健康食品を利用して有害事象を受 けた症例報告について,国内外の 3 つのデータベー ス,PubMed,医中誌 Web,「『健康食品』の安全 性・有効性情報」17)(以後 HFNet)から学術論文及 び 抄 録 集 を 収 集 し た . PubMed で は , 検 索 語 「``Plant Preparations/adverse eŠects'' [Mesh] OR ``Plant Preparations/contraindications'' [Mesh] OR ``Plant Preparations/poisoning'' [Mesh] OR ``Plant Preparations/toxicity'' [Mesh] OR ``Dietary Supple-ments/administration and dosage'' [Mesh] OR ``Dietary Supplements/adverse eŠects'' [Mesh] OR
``Dietary Supplements/poisoning'' [Mesh] OR
``Phytotherapy / adverse eŠects'' [ Mesh ] OR
``Phytotherapy / contraindications'' [ Mesh ] OR ``Complementary Therapies/adverse eŠects'' [Mesh] AND ``Neoplasms'' [Mesh]」を用い,Article Type:
Case report, Species: Humanのフィルターを設定し
て検索した(検索日 2018 年 10 月 3 日).医中誌 Web では,検索語「((腫瘍/TH or がん/AL) and
(健康食品/TH or 健康食品/AL))」を用い検索した.
1 次スクリーニングとして,タイトル及びアブスト ラクトの内容から入手論文を決定した.HFNet で は「素材情報データベース」全ページの〈被害事例〉
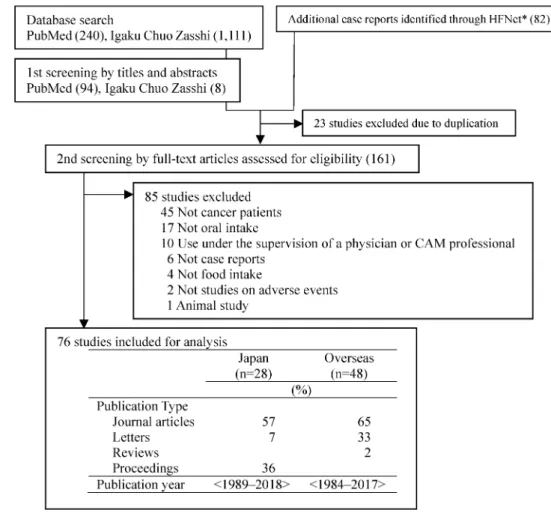
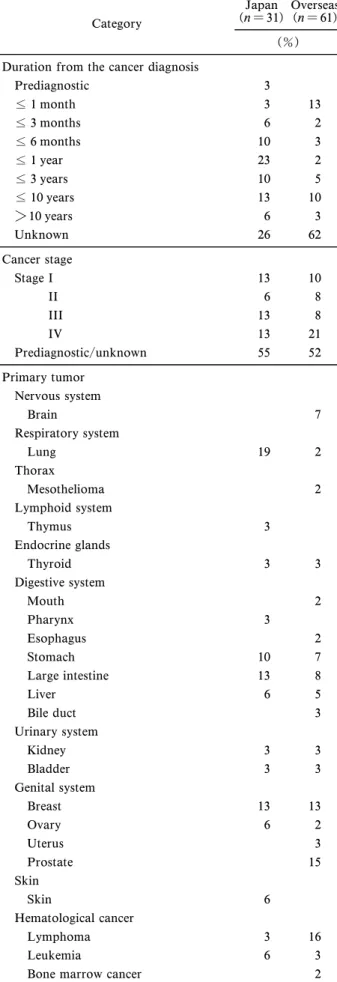
あるいは〈医薬品との相互作用〉(ヒト)の項目を, さらに「安全情報・被害関連情報」を参照した(最 終確認日 2018 年 9 月 28 日).2 次スクリーニング では,全文を精読し,(1) 健康食品の摂取とし,医 薬品の誤投与や,点滴・皮下注射・浣腸・外用など の経口以外の投与経路は除外した.明らかに食品と 認識されるもののほかに,特定成分が濃縮された錠 剤・カプセル・エキス等を含めた.(2) 患者本人又 は家族の意思に基づく摂取とし,医師及び CAM 専 門家(漢方医,自然療法家等を含む)の管理下にお ける CAM 療法の事例は除外した.(3) 対象はがん 患者とし,がんの疑いあるいは診断を受けた後に健 康食品を利用した事例に限定した.がん病識のない 時点から継続して利用している事例は除外した.(4) 有害 事 象に つい て の記 述 があ る症 例 報告 ( Case reports)とし,介入研究や調査研究は個別の患者 情報が少ないため除外した.会議録は健康食品の利 用状況や転帰などの詳細が記載されていないものも あるが,有益な情報であるため採用した. 各論文から患者属性,がん及び関連疾患に関する 情報,健康食品の利用状況,有害事象に関する詳細 を収集した.病期ステージについては,遠隔転移が ある 旨の 記 載が あっ た 場合 はス テ ージ 4 と し , TNM分類表記のあるものは国内の各がん学会が示 す「がん取り扱い規約」等に基づいて病期分類した. 前立腺がんで ABC 分類の記載があるものは IIV 期に読み替えた.脳腫瘍等は悪性度により分類され 病期ステージ分類に該当しないため病期ステージ不 明として取り扱った.有害事象については米国国立 がん研究所 Cancer Therapy Evaluation Program が 公表した「Common Terminology Criteria for Ad-verse Events v5.0」の日本臨床腫瘍研究グループに よる日本語訳(以後 CTCAE)18)を参照してグレー ド化した.CTCAE におけるグレード 5 は「有害事 象による死亡」,グレード 4 は「生命を脅かす.緊 急処置を要する」,グレード 3 は「重症または医学 的に重大であるが,ただちに生命を脅かすものでは ない.入院または入院期間の延長を要する.身の回 りの日常生活動作の制限」,グレード 2 は「中等症. 最小限/局所的/非侵襲的治療を要する.年齢相応の 身の回り以外の日常生活動作の制限」,グレード 1 は「軽症.症状がない,または軽度の症状がある. 臨床所見または検査所見のみ.治療を要さない」に 該当する.なお,本研究において収集した有害事象 のうち,CTCAE のグレード 1 に該当する有害事象 はグレード 1A,臨床検査値等の異常や変動があり 本質的にはグレード 1 に該当するが,該当カテゴリ 選択が困難なものについてはグレード 1B として取 り扱った.グレード 1B に分類した有害事象は,腫 瘍マーカー(血中 PSA, CA72-4, 5-S-CD)又は尿 中ヨウ素濃度の変動,PET-CT・MRI 画像撮影の アーチファクト等であった.統計解析ソフトウェア には IBMSPSSStatics V22.0 を使用し,国内及び 国外の差異についてカイ二乗検定又は Fisher の直 接確率検定を行った. 結 果 1. 論文の収集と抽出 論文の収集と抽出結果 を Fig. 1 に 示 し た . デ ー タ ベ ー ス 検 索 の 結 果 , PubMed 240報,医中誌 WEB 1111 報が該当し, 1 次スクリーニング後 94 報と 8 報を入手した. HFNetからは 82 報を入手した.重複を除去した 161 報について,2 次スクリーニングとして全文を 精読し,採択要件に該当しない 85 報を除去し,76 報 を 最 終 的 な 解 析 対 象 と し た ( Supplementary materials).報告国毎の論文数と報告年をみると, 約 30 年間に日本国内で 28 報,国外で 48 報が報告 されていた.論文の種類を比較すると,国内外とも 原著論文による報告が 6 割前後を占め,ついで国内 では会議録,国外ではレターによる報告が多数で あった. 2. 患者の基本属性及びがんの状態 患者の基 本属性を Table 1 に示した.国内患者 31 名,国外 では北米・アジア・ヨーロッパを中心に 61 名,合 計 92 名の事例であった.有害事象の発生時の年齢 はがん発症率の高い 5070 歳代で多く,国外では小 児から高齢者まで広い世代であった. 患者のがんの状態を Table 2 に示した.がん診断 からの期間は,診断直前(がんの疑いで検査)から 10年以上にわたり幅広く分布しており,中には寛 解期の患者も含まれていた.原発がんは,国内では 肺がん,大腸がん,乳がん,胃がんの順であり,国 外では悪性リンパ腫,前立腺がん,乳がんの順に多 かった. 3. 健康食品の利用状況 健康食品の利用状況 を Table 3 に示した.国内外とも利用期間が明らか
Fig. 1. Flow Diagram of Study Selection in This Review
HFNet: Information System on Safety and EŠectiveness for Health Foods website (https://hfnet.nibiohn.go.jp/), National Institute of Health and Nutrition.
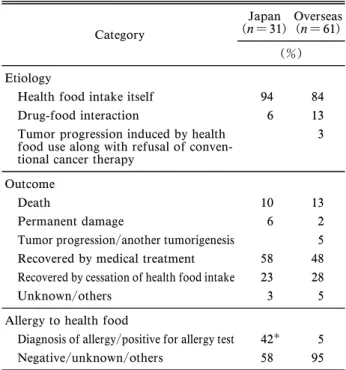
なもののうち 60%が 2 週間3 ヵ月間の利用期間に 有害事象を発生していた.化学療法の受療中に健康 食品を利用していた国内の患者は 45%であり,国 外に比較して多かった( p = 0.014).有害事象によ りがん標準治療の中断・延期・変更の措置が取られ ていた患者は国内外平均で 17%であった.がん治 療を拒否して健康食品のみを利用していた患者は国 内では確認できなかったが,国外で 11%みられ た.健康食品の利用目的についてみると,国内では 不明な患者が多かった.これは会議録が多く,利用 背景の詳細な記載がないためである.一方,国外で はがんに関連するなんらかの効果への期待が,利用 目的の明らかなケースの 70%を占めていた.ま た,確認できた情報は限定的であるが,健康食品利 用のアドバイスを提供した者は,国内では家族・友 人・知人,国外では小売店が最多であった. 4. 有害事象の原因,転帰及び薬物アレルギー 有害事象の原因,転帰,薬物アレルギーについて Table 4 に示した.有害事象の原因をみると健康食 品単独によるものが国内で 94%,国外で 84%を占 めており,医薬品との相互作用は国内 6%,国外 13% であり,がん標準治療を拒否して健康食品のみを選 択した事例が国外で 3%であった.転帰についてみ ると死亡は国内 10%,国外 13%,後遺症残遺は国 内 6%,国外 2%であった.また,国外でのみ既存 がんの進行及び新規腫瘍の報告があった.また,国 内外ともに,有害事象より回復した患者のうち約半 数が加療を要し,健康食品の摂取停止により回復し たものは 3 割未満であった.薬物アレルギーの診断 あるいはアレルギー関連の臨床検査が陽性であった 患者は,国内 42%であり,国外に対して多数で あった(p < 0.001). 5. 健康食品利用による有害事象の詳細 有害 事象の発生部位からみた CTCAE 分類による重症 度 の 頻 度 を Table 5 に 示 し た . 全 事 例 の 約 70 % (国内 21 例,国外 43 例)が重症(グレード 53)
Table 1. Basic Patient Information Category Japan (n = 31)Overseas(n = 61) (%) Region Japan 100
Asia other than Japan 25
Oceania 5 North America 44 South America 2 Middle East 2 Europe 21 Africa 2 Sex Female 45 38 Male 55 62 Age, years Below 10 3 10 s 3 2 20 s 3 30 s 3 5 40 s 6 16 50 s 19 26 60 s 29 25 70 s 29 16 80 s 6 2 Unknown 3 2
Table 2. Cancer Status of Patients
Category
Japan
(n = 31) Overseas(n = 61) (%) Duration from the cancer diagnosis
Prediagnostic 3 1 month 3 13 3 months 6 2 6 months 10 3 1 year 23 2 3 years 10 5 10 years 13 10 > 10 years 6 3 Unknown 26 62 Cancer stage Stage I 13 10 II 6 8 III 13 8 IV 13 21 Prediagnostic/unknown 55 52 Primary tumor Nervous system Brain 7 Respiratory system Lung 19 2 Thorax Mesothelioma 2 Lymphoid system Thymus 3 Endocrine glands Thyroid 3 3 Digestive system Mouth 2 Pharynx 3 Esophagus 2 Stomach 10 7 Large intestine 13 8 Liver 6 5 Bile duct 3 Urinary system Kidney 3 3 Bladder 3 3 Genital system Breast 13 13 Ovary 6 2 Uterus 3 Prostate 15 Skin Skin 6 Hematological cancer Lymphoma 3 16 Leukemia 6 3
Bone marrow cancer 2
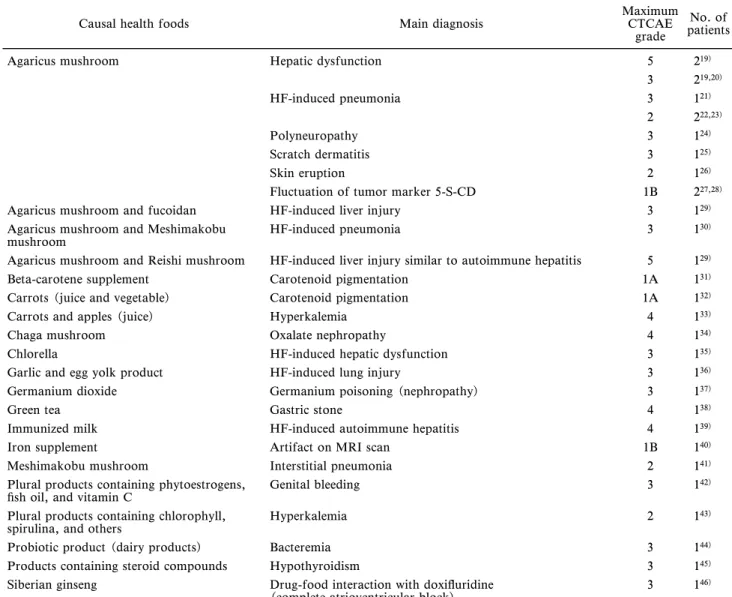
の有害事象に該当し,国内では肝障害(8 例)と呼 吸器障害(3 例)で 52%を占めていたが,国外では 電解質異常(10 例),中毒(7 例),血液凝固異常 (7 例),肝障害(6 例),感染症(4 例)の順であっ た.化学療法との併用あるいはがん病期ステージと 転帰・重症度の間に一定の傾向はみられなかった. 健康食品の種類から見た有害事象を Table 6(国 内)と Table 7(国外)に示した.国内ではキノコ 製品に関連した有害事象が多く,中でもアガリクス が最多であった.キノコ製品における薬物アレル ギーあるいは自己免疫疾患と診断された事例は症例 の 32%を占め,肝障害,薬剤性肺炎,多発性神経 障害,薬疹と様々であった(Table 6).国外におい て重症度の高い事例はアリストロキア(ウマノスズ クサ)属植物,コロイド銀,ジュウニヒトエ等によ る中毒の事例であり,出現頻度から注目されたの は,ビタミン D やカルシウムの過剰摂取による高 カルシウム血症,アミグダリン/アプリコットカー ネル等によるシアン化物中毒,セシウム中毒,免疫
Table 3. Health Food Intake Situation
Category
Japan
(n = 31) Overseas(n = 61) (%) Duration of health food intake until the onset of adverse events
Single ingestion 5 1 week 6 8 2 weeks 10 16 1 month 13 10 3 months 16 13 6 months 6 7 1 year 6 > 1 year 16 8 Unknown/others 26 33
Health food intake under medical treatment
Used 61 46
Not used/Unknown 39 54
Duration of concomitant use of health foods and medical treatment
Single ingestion 2 1 week 10 5 2 weeks 3 7 1 month 6 3 3 months 6 5 6 months 3 2 1 year 3 > 1 year 3 5 Unknown/others 65 72
Health food intake under cancer chemotherapy
Used 45 20
Not used/Unknown 55 80
In‰uences on conventional cancer therapy
Discontinued/postponed/changed 13 20
No eŠect/unknown 87 80
Refusal of conventional cancer therapy
Refused 11
Not refused/unknown 100 89
Expectations on health food intake
Anticancer eŠects 6 23
Alleviation of symptom accompanying cancer 5 Resistance to conventional cancer therapy 2 Alleviation of side eŠects caused by
conventional cancer therapy 2
Immunoactivating eŠects 3
Nutritional supplementation/
health maintenance 3 8
Other pharmacologic eŠects 7
Unknown 90 51
Provider of advice
Family member, friend, or acquaintance 13 5
Retail store 10 Website 7 Patients themselves 6 3 Door-to-door sale 3 TV program 2 Unknown 77 74
Signiˆcantly diŠerent from the proportion overseas ( p = 0.014).
Table 4. Etiology, Outcome, and Drug Allergy
Category
Japan
(n = 31) Overseas(n = 61) (%) Etiology
Health food intake itself 94 84
Drug-food interaction 6 13
Tumor progression induced by health food use along with refusal of conven-tional cancer therapy
3
Outcome
Death 10 13
Permanent damage 6 2
Tumor progression/another tumorigenesis 5
Recovered by medical treatment 58 48
Recovered by cessation of health food intake 23 28
Unknown/others 3 5
Allergy to health food
Diagnosis of allergy/positive for allergy test 42 5
Negative/unknown/others 58 95
Signiˆcantly diŠerent from the proportion overseas ( p < 0.001).
低下状態でのプロバイオティクス含有製品摂取によ る感染症,PC-SPES(コガネバナ,キクカ,レイ シ,タイセイ,カンゾウ,朝鮮ニンジン,エンメイ ソウ,ノコギリヤシの 8 種のハーブを含む製品)に よる血液凝固異常であった(Table 7).後遺症残遺 の 3 例はいずれも腎機能障害で,原因食品は二酸化 ゲルマニウムと高シュウ酸含有食品(チャーガ又は カシューナッツ)であった. 考 察 がん患者の健康食品摂取に関連した有害事象の全 体像をみると,治療中の健康食品利用が多数みられ た.特に国内では国外に比べて,化学療法中におけ る健康食品の使用割合が高く,不適切な健康食品利 用の実態が明らかとなった.しかし化学療法との併 用は転帰や重症度に関連がなく,抗悪性腫瘍薬との 相互作用よりも,むしろ健康食品自体による有害事 象が多数であった.健康食品自体による有害事象 は,国内ではアレルギーが関与した呼吸器・肝・皮 膚障害が多く,国外では既に安全性の問題が指摘さ れている食品による中毒等の事例が多数であった. 健康食品には薬の体内動態に影響するものがあ り,健康食品による薬の血中濃度の低下は治療効果 の減弱,逆に血中濃度の上昇は副作用を増強し治療
Tab le 5. M a in D iag n o sis a n d C TCA E G rad e for Ca ncer Pa tients W h o D evelop ed A d v erse Ev en ts Rela ted to H ea lth F oo ds In take No . o f p a tien ts Ja p a n O ve rse as Ma x im u m CT C A E g ra d e Gra d e 5 Gra d e 4 Gra d e 3 Gra d e 2 Gr ad e 1A Gra d e 1B Su btota l (%) Gra d e 5 Gr ad e 4 Gra d e 3 Gra d e 2 Gra d e 1A Gra d e 1B S ubto tal (% ) System Org an C la ss Ca ncer prog ression 12 3( 5%) Poison ing 1 1( 3%) 24 13 1 0( 16 %) Elec troly te im b al an ce 1 1 2( 6%) 36 12 1 2( 20 %) H ep a ti c d is or de r 3 1 4 8( 26 %) 12 3 6( 10 %) Rena l d isorder 1 1( 3%) 11 1 3( 5%) Respira tory d isord er 3 3 6( 19 %) Blood disorder 34 1 8( 13 %) Skin d isorder 1 1 2 4( 13 %) 11 2( 3%) Thyro id d isorder 1 1( 3%) 111 3( 5%) Reprod uctive sy stem a n d b reast d isorder 1 1( 3%) Im mu ne sy st em dis o rd er 11 ( 2%) In fe ct ion 1 1( 3%) 13 4( 7%) In ‰uences on di ag nosis or clini ca l ex am ina tion 3 3( 10 %) 17 8( 13 %) Oth ers 1 2 3( 10 %) 11 ( 2%) Total (%) 3 ( 10 %) 4 ( 13 %) 14 ( 45 %) 5 ( 16 %) 2 ( 6%) 3 ( 10 %) 31 ( 10 0%) 8 ( 13 %) 17 ( 28 %) 18 ( 30 %) 8 ( 13 %) 3 ( 5%) 7 ( 11 %) 61 ( 10 0%) Gr a de 1 A to 5 ind ica te the sev er it y o f the p a ti en t' s pl u ral sy mpt oms . T he cl ini cal de sc ri pt ions of ea ch ca te go ry a re a s fol lows : G ra de 5: De a th re la ted to a dv ers e ev ent . G ra de 4: Li fe -t hr ea te ni ng co ns equ enc es; ur g en t int er v en -ti o n in d ica te d. G ra d e 3 : S ev ere o r m ed ic a ll y sig n iˆc a n t b u t n o t im m ed ia tel y life -t h rea te n in g ; ho sp it a liz a tio n o r p ro lo ng a tio n o f ex ist in g h o sp it a liza tio n ind ic a te d . G ra de 2 : M o d era te ; m in im a l, lo ca l, o r n o n inv a siv e int erv en ti on in di ca te d . G ra d e 1 A : As y m pt oma tic or m il d sy mp to m s; cl in ica l o r d ia gn os ti c o bs er v a tio ns on ly ; int er v en ti o n n ot in d ica te d. Gr a d e 1 B : Eq ui v a len t to Gr ade 1 A, bu t n o t co rre sp on din g to the C T C A E ca tego ry ( suc h as th e ‰ u ctu-a tio n o f io d in e in u rine o r tu mo r m a rk er, fa lse p osi ti v e, o r a rt ifa ct s o f clin ica l ex a m ina tio n ) .
Table 6. Health Foods Associated with Adverse Event Onset in Japanese Cancer Patients
Causal health foods Main diagnosis MaximumCTCAE
grade
No. of patients
Agaricus mushroom Hepatic dysfunction 5 219)
3 219,20) HF-induced pneumonia 3 121) 2 222,23) Polyneuropathy 3 124) Scratch dermatitis 3 125) Skin eruption 2 126)
Fluctuation of tumor marker 5-S-CD 1B 227,28)
Agaricus mushroom and fucoidan HF-induced liver injury 3 129)
Agaricus mushroom and Meshimakobu
mushroom HF-induced pneumonia 3 1
30)
Agaricus mushroom and Reishi mushroom HF-induced liver injury similar to autoimmune hepatitis 5 129)
Beta-carotene supplement Carotenoid pigmentation 1A 131)
Carrots (juice and vegetable) Carotenoid pigmentation 1A 132)
Carrots and apples (juice) Hyperkalemia 4 133)
Chaga mushroom Oxalate nephropathy 4 134)
Chlorella HF-induced hepatic dysfunction 3 135)
Garlic and egg yolk product HF-induced lung injury 3 136)
Germanium dioxide Germanium poisoning (nephropathy) 3 137)
Green tea Gastric stone 4 138)
Immunized milk HF-induced autoimmune hepatitis 4 139)
Iron supplement Artifact on MRI scan 1B 140)
Meshimakobu mushroom Interstitial pneumonia 2 141)
Plural products containing phytoestrogens,
ˆsh oil, and vitamin C Genital bleeding 3 1
42)
Plural products containing chlorophyll,
spirulina, and others Hyperkalemia 2 1
43)
Probiotic product (dairy products) Bacteremia 3 144)
Products containing steroid compounds Hypothyroidism 3 145)
Siberian ginseng Drug-food interaction with doxi‰uridine
(complete atrioventricular block) 3 1
46)
Refer to the footnote of Table 5 for the details of CTCAE grade. HF, health foods.
継続を困難にするなど重大な影響を及ぼす.特に抗 悪性腫瘍薬は他の一般的な医薬品に比べて血中薬物 濃度の治療有効域が極めて狭く,薬理作用や薬物代 謝に影響する健康食品の利用は有害な相互作用につ ながるおそれがある.95)がん患者及び健常人を対象 とした臨床試験において,セントジョーンズ・ワー トはイリノテカン96)及びイマチニブ,97)グレープフ ルーツはエトポシド98)の血中濃度を低下させたこと が報告されている.国内の腫瘍専門医を対象にした 調査16)では,腫瘍医の 84%は CAM 製品と抗悪性 腫瘍薬の相互作用の可能性を考慮し,化学療法中の CAM 製品利用は避けるべきとの一致した見解を示 している.しかしながら,本研究で抗悪性腫瘍薬と の相互作用と診断されていた事例は少数であり,医 薬品との相互作用よりもむしろ健康食品自体に起因 する有害事象が多くまた重症であったことから,が ん患者においては健康食品自体が健康被害につな がっていることを示唆している.抗悪性腫瘍薬との 相互作用の事例が少数であった理由として,本研究 においては論文探索を症例報告に限定しており臨床 研究が含まれないこと,また抗悪性腫瘍薬との相互 作用の情報9698)が周知され臨床現場で併用が避けら れていた可能性が考えられた. 国内症例の特徴としては,肝障害と呼吸器障害が 重症患者の半数を占め,また患者の 42%が健康食 品による薬物アレルギーと診断されていた.近年健 康食品による薬物性肝障害が増加しており,99)その 発生機序はアレルギーによるものが半数に上るとさ
Table 7. Health Foods Associated with Adverse Event Onset in Overseas Cancer Patients
Causal health foods Main diagnosis MaximumCTCAE
grade
No. of patients
Ajuga nipponensis Renal failure 5 147)
Aloe vera Hypokalemia 4 148)
Gastric stone 3 149)
Amygdalin/apricot kernel Cyanide poisoning, seizure, liver injury, respiratory arrest 4 250,51)
2 252,53)
Aristolochia longa Aristolochic acid poisoning, renal failure 5 154)
Ayurveda product polluted by heavy metal Mercury poisoning, renal failure 4 155)
Calcium and vitamin D Hypercalcemia 5 256)
4 256)
3 156)
2 156)
Calcium, vitamin D, and shark cartilage Hypercalcemia 5 156)
2 156)
Catharanthus roseus Drug-food interaction with vinca alkaloids (bone marrow depression) 4 157)
Caraway seed Hypothyroidism 1A 158)
Cashew nut Oxalate nephropathy 3 159)
Cesium carbonate Cesium poisoning (hypokalemia, loss of consciousness, long QT syndrome) 3 160)
Cesium chloride Cesium poisoning (hypokalemia, loss of consciousness, long QT syndrome) 4 161)
Chinese medicine producta Development of new splenic cyst 1A 162)
Colloidal silver Silver poisoning (epilepticus and coma) 5 163)
Echinacea Drug-food interaction with etoposide (thrombocytopenia) 4 164)
Folates and vitamin B12 Drug-food interaction with chemotherapy (treatment-resistant PSA increase) 1B 165)
Fruits and vegetables Carotenoid pigmentation 1A 166)
Ginkgo biloba extract Erythematous maculopapular eruptions 3 167)
Grapefruit Drug-food interaction with tacrolimus (tacrolimus level increase) 2 168)
Green tea Drug-food interaction with sunitinib (decrease sunitinib bioavailability) 3 169)
Green tea extract HF-induced acute hepatitis 4 170)
Herbal tea Veno-occlusive liver disease 5 171)
Juice product HF-induced liver injury 3 172)
Licorice Hypokalemia, pseudo-hyperaldosteronism 4 173)
Maitake mushroom extract Drug-food interaction with warfarin (INR elevation) 2 174)
Noni Liver injury 3 175)
Panax ginseng Drug-food interaction with imatinib (imatinib-associated hepatotoxicity) 3 176)
PC-SPESb Hematoma, pulmonary embolus, and venous thrombus 3 37779)
Hypothyroidism 2 180)
Probiotic products (formulation) Bacteremia 4 181)
3 182)
Endocarditis infective 3 183)
Probiotic products (yogurt) Bacteremia 3 184)
Products containing the herb astragalus, dairy
colostrum, and whey Cancer progression (the patient refused conventional cancer therapy) 3 1
85)
Propolis Acute renal failure 4 186)
Reishi mushroom False positive of parasitic disease 2 187)
Fluctuation of serum tumor marker CA72-4 1B 588)
Rooibos Liver injury 4 189)
Royal jelly Drug-food interaction with warfarin (blood coagulation abnormality) 3 190)
Seaweed (Sargassum) Induction of thyroid neoplasm 3 191)
Selaginella doederleinii Pancytopenia 4 192)
Selenium supplement Artifact on CT scan 1B 193)
Shark cartilage Cancer progression (the patient refused conventional cancer therapy) 5 185)
Vitamin D Hypercalcemia 4 294)
Refer to the footnote of Table 5 for the details of CTCAE grade. HF, health foods.aChinese medicine product (Tian Xian Liquid, which contains Cordyceps
sinensis, Astragalus membranaceus, Ganoderma lucidum, Panax ginseng, Atractylodes macrocephala, Dioscorea batatas, Codonopsis pilosula, Pogostemon
cab-lin, Lycium barbarum, Pteria margaritifera, Ligustrum lucidum Ait, and Radix glycyrrhizae).bPC-SPES (patented mixture of eight herbs, Scutellaria
baicalen-sis, Dendranthema morifolium, Ganoderma lucidum, Isatis indigotica, Glycyrrhiza glabra, Panax ginseng or Panax pseudoginseng, Isodon rubescens, and Serenoa repens).
れている.100,101)本研究で収集したアレルギー症例 における健康食品の利用期間は 2 週間から 4 年に 渡って分布し,緩徐な経過で発生する事例もみられ たことから,短期に問題なく利用できたとしても長 期の安全性は担保されないことが示唆される.今回 アガリクス等のキノコ由来製品による有害事象報告 が多く,アレルギーと診断されていた事例が多数で あった.日本のがん患者が摂取する CAM はキノコ 由来製品が多く,2,5,14)本調査で示したキノコ由来製 品による有害事象の多さは,利用者数を反映してい ると考えられた. 国外症例の特徴としては,既に安全上の問題が指 摘されている原材料が関係した複数の有害事象で, 重篤で急激に全身状態が悪化した事例が多くみられ た.例えば死亡の報告があったアリストロキア(ウ マノスズクサ)属植物は「間質性腎繊維症及び尿路 がんを引き起こす」,102)コロイド銀は「腎障害,て んかん発作等の深刻な副作用を引き起こす可能性が ある」,103)複数事例があったアミグダリン/アプリ コットカーネル(杏仁)は「シアン化物中毒と類似 した症状をおこす」,104)塩化セシウムは「心毒性な どの重大なリスク及び死亡と関連する」,105) PC-SPES は「ホルモン薬と類似した副作用がある」104) 等と明示されている.他にゲルマニウム,106)サメ 軟骨103)等を含め,いずれの健康食品もがんに対す る効果や安全性は否定されているにもかかわらず, 現在も国内外でがんに効くなどとして販売されてい る実態がある.がん標準治療には侵襲や苦痛を伴う 治療が多いことから,苦痛から逃れるために抗がん 効果を期待して健康食品を利用していると考えられ る.このことから安全性に重大な問題を抱える健康 食品についての十分な情報提供の重要性が再確認で きた. またビタミン・ミネラルや,通常明らかに食品と 認識されるものの過剰摂取による複数の有害事象も みられた.がん患者に向けた情報には,ビタミン D,カルシウム,カルシウムを多く含むサメ軟骨, プロバイオティクスを含む乳製品や発酵食品,ある いはニンジンやトマトなどの野菜や果物の多量摂取 が,がん発症や再発・転移予防に有効だとする情報 があり,がん患者がこれらを積極的に摂取する一因 になっている.特に進行がん患者において悪性腫瘍 随伴性高カルシウム血症は予後不良因子となり,107) また高カリウム血症は重度の場合心室細動又は心停 止を発生させる可能性がある.多くの人が安全と認 識している食品や,ビタミン・ミネラルであって も,患者の健康状態や利用状況によっては安全とは 言えず,病態に応じた適切な対応が必要である. がん標準治療を拒否して健康食品のみを選択して いた患者が国外で 11%みられ,3%では著明な腫瘍 進行が報告されていた.これらの事例は健康食品が 有害事象の直接の原因になったというよりは,がん 標準治療を受けなかったために急激に腫瘍や随伴症 状が進行して死亡した,あるいは健康食品利用を断 念し当初の提案よりも強い処方のがん標準治療を選 択した94)というものであった.がん患者に向けた情 報には「がん標準治療は免疫力を低下させて寿命を 縮めるが,健康食品は自然治癒力を高めてがんを克 服できる」といった健康食品の安全性と有効性を過 度に強調したものがある.実際に進行性乳がん患者 を対象とした研究108)において,CAM 利用者の 12% が健康食品のみを選択してがん標準治療を中止して いた.しかしながら CAM のみを選択してがん標準 治療を受療しなかったがん患者では,がん標準治療 を受療した患者に比較して死亡リスクが増加してい たという報告8)があることからも,近代医療から離 れて有効性が確認されていないだけでなく,安全性 が不明瞭な健康食品のみを選択することは非常に危 険である.がん標準治療を選択しない場合,適切な 医療を受ける機会を逃すことの危険性について注意 喚起を行う必要性が示唆された. 健康食品利用のアドバイス提供者は,国内では 「家族・友人・知人」が最多であった.国内の調査 においてがん患者が健康食品を利用したきっかけ は,「家族や友人のすすめ」が「本人の選択」を上 回り,2)同様に「善意を断れない」「高価なものを心 配して買ってきてくれた」など人間関係を重視して の利用が多いことが報告されている.5)一般の人々 が入手する情報には偏りが多く,がんに対して健康 食品が万能でかつ安全であるような偏った情報が流 布していることからも,患者や医療従事者だけでな く,広く一般に向けて健康食品による有害事象につ いて周知する必要性が示唆された.一方で今回の調 査では除外したが,医師のほか自然療法家・代替治 療家といった CAM 専門家のアドバイスに従って健 康食品を利用したケースがあり,本調査で収集され
た症例と同様の有害事象が報告されていた.例えば アミグダリン/アプリコットカーネルによるシアン 化物中毒,109)塩化セシウムによるセシウム中毒,110) 有機ゲルマニウム(germanium lactate-citrate)に よる乳酸アシドーシス,111)PC-SPES によるエスト ロゲン作用,112)化学療法中のプロバイオティクス 摂取による感染症,113)ウコン及びクルクミンによ る柑皮症114)などであり,専門家と称する者のアド バイスに基づいた利用であっても,かならずしも科 学的根拠に基づいたものでなく,安全とは限らない ことが示された. 本研究の限界として,収集した情報が限定的であ る点が挙げられる.今回は学術論文による報告事例 を中心に収集しており,がん患者における実際の有 害事象の全体像を反映できていない.また,個々の 情報においても詳細が網羅されておらず,今回の解 析も限定的な部分が含まれている.その一方で,こ れまでに報告されているがん患者での健康食品利用 に関連した有害事象の発生確率は,国内の大規模調 査では 5%,2)国内外の複数の調査を対象としたレ ビューでは 39%6)とされており,主な症状は吐き 気,下痢,便秘,皮疹,肝機能異常,2)痛み,疲労 感6)等の比較的軽微なもので,重篤な事例について の記載はみられない.今回収集できた重篤な有害事 象は前述のような大規模調査では検出し難く,他の 疾病患者に比べて,がん患者の健康食品利用率が高 いことや,有害事象の重症度を考慮すると,症例報 告の蓄積及びその解析は重要である.本調査で重篤 な事例や発生件数の多い事例を明らかにし,注目す べき状況を明確にしたことは,今後の健康被害を未 然に防ぎ,臨床現場における対応に有用になると考 えられる. CAM として健康食品を利用する際の考え方につ いては厚生労働省「『統合医療』情報発信サイト」,1) 国立がん研究センター「がん情報サービス」,115)四 国がんセンター「がんの代替医療の科学的検証に関 する研究」116)等で示されている.HFNet17)の素材 情報データベースには健康食品の素材や原材料に関 する学術情報が収集されており,がん患者の事例も 継続的に収載している.また,患者の個別の相談窓 口として健康サポート薬局(平成 28 年 2 月 12 日薬 生発 0212 第 5 号)がある.健康サポート薬局では, 服薬情報の一元的な把握とそれに基づく薬学的管 理・指導などの,かかりつけ薬局としての基本的な 機能に加え,健康食品や食事・栄養摂取などを含む 健康の維持・増進に関する相談をも幅広く受け付け ており,がん治療中の健康食品の利用や薬との相互 作用についても,個々の患者の状況に沿った相談に 応じることが期待される.医療従事者は患者と健康 食品の利用状況について十分なコミュニケーション をとり,また患者自身も健康食品や偏った食事療法 に陥らないように,健康食品のメリット・デメリッ トを十分に理解して冷静に判断する必要がある. 謝辞 本研究は,厚生労働行政推進調査事業費 (食品の安全確保推進研究事業 H30-食品-指定-002) により実施したものである. 利益相反 開示すべき利益相反はない. Supplementary materials この論文のオンライ ンに Supplementary materials(電子付録)を含ん でいる. REFERENCES
1) Ministry of Health, Labour and Welfare. formation site for evidence-based Japanese In-tegrative Medicine (eJIM): 〈http://www. ejim.ncgg.go.jp/public/index.html〉, cited 12 April, 2019.
2) Hyodo I., Amano N., Eguchi K., Narabayashi M., Imanishi J., Hirai M., Nakano T., Takashima S., J. Clin. Oncol., 23, 26452654 (2005).
3) Suzuki K., Morita T., Tanaka K., Yo T., Azu-ma Y., Igarashi N., ShiAzu-ma Y., Miyashita M., Palliative Care Research, 12, 731737(2017). 4) Akpunar D., Bebis H., Yavan T.,Asian Pac.
J. Cancer Prev., 16, 78477852 (2015).
5) Kubota K., Oki H., Yamazaki K., Sugawara
M., Nishimura M., Iseki K., J. Jpn. Soc. Hosp. Pharm., 42, 927929 (2006).
6) Poonthananiwatkul B., Howard R. L.,
Wil-liamson E. M., Lim R. H., J. Ethnophar-macol., 175, 5866 (2015).
7) Gupta D., Lis C. G., Birdsall T. C., Grutsch J.
F., Support. Care Cancer, 13, 912919
8) Johnson S. B., Park H. S., Gross C. P., Yu J. B.,J. Natl. Cancer Inst., 110, 121124 (2018). 9) Bao Y., Kong X., Yang L., Liu R., Shi Z., Li W., Hua B., Hou W., Evid. Based Comple-ment. Alternat. Med., 170396 (2014). 10) Finnegan-John J., Molassiotis A., Richardson
A., Ream E., Integr. Cancer Ther., 12, 276 290(2013).
11) Bar-Sela G., Danos S., Visel B., Mashiach T., Mitnik I., Support. Care Cancer, 23, 1979 1985(2015).
12) Clarke T. C., Black L. I., Stussman B. J.,
Barnes P. M., Nahin R. L., Natl. Health Stat. Rep., No. 79, 116 (2015).
13) Narui H., Honma T., Miura H., Izawa M.,
Suita Y., Degai Y., Nakamura K., J. Aomori Univ. Health Welf., 7, 213222 (2006).
14) Mishima E., Okado H., Kato S., Kushihara
H., Kuroda J., Sakakibara T., Shudai M., Suzuki A., Matsuoka K., Miyasaka T., Watanabe N., Yokota M., Itakura Y., Suzuki T., Saitou H., Jpn. J. Pharm. Health Care Sci., 35, 403408 (2009).
15) Kishimoto K., Yoshino C., Fukushima N.,
Yakugaku Zasshi, 130, 10171027(2010).
16) Hyodo I., Eguchi K., Nishina T., Endo H.,
Tanimizu M., Mikami I., Takashima S., Imanishi J., Cancer, 97, 28612868(2003). 17) National Institutes of Biomedical Innovation
Health and Nutrition. ``Information system on safety and eŠectiveness for health foods.'': 〈 https: // hfnet.nibiohn.go.jp / 〉, cited 12
April, 2019.
18) National Cancer Institute, Cancer Therapy
Evaluation Program, ``Common Terminology Criteria for Adverse Events (CTCAE) Ver-sion 5.0'':〈http://www.jcog.jp/doctor/tool/
ctcaev5.html〉, Japan Clinical Oncology
Group Web, cited 12 April, 2019.
19) Mukai H., Watanabe T., Ando M.,
Katsuma-ta N., Jpn. J. Clin. Oncol., 36, 808810 (2006).
20) Kasuga T., Ubukata H., Motohashi G.,
Kata-no M., Ohzeki Y., Watanabe M., Liu G., Watanabe Y., Goto Y., Nakata I., Sato S., Tabuchi T., J. Jpn. Surg. Assoc., 64, 1802 (2003).
21) Honda Y., Okimoto N., Sakurai M., Kurihara
T., Asaoka N., Fujita K., Oba H., Nakamura
J., Jpn. J. Chest Dis., 62, 10271031(2003).
22) Tachibana H., Aoyama K., Matsushima H.,
Takahashi N., Iketani T., Murai K., Kawaba-ta Y., SugiKawaba-ta H., Hoshi E., Jpn. J. Lung Can-cer, 44, 524 (2004).
23) Murano H., Inoue S., Tokairin Y., Igarashi
A., Shibata Y., Kubota I., Annals of the
Japanese Respiratory Society, 6, 186189 (2017).
24) Fujikawa A., Sato N., Kamata T., Owada A.,
Akiyama N., Clinical Neurology, 46, 67 (2006).
25) Yamada E., Nakajima H., Practical
Der-matology, 26, 967970 (2004).
26) Kanazawa N., Inaba Y., Uenaka C.,
Furuka-wa F., J. Environ. Dermatol. Cutan. Aller-gol., 6, 277 (2012).
27) Konishi H., Yamanaka K., Mizutani H., J.
Dermatol., 37, 773775 (2010).
28) Yoshino K., Aoki M., Kawana S., Jpn. J.
Clin. Dermatol., 59, 10131015 (2005).
29) Hisamochi A., Kage M., Arinaga T., Ide T.,
Miyajima I., Ogata K., Kuwahara R., Koga Y., Kumashiro R., Sata M., Clin. J. Gastroen-terol., 6, 139144 (2013).
30) Chin K., Aoyama K., Matsushima H., Murai
K., Kawabata Y., Hoshi E., Jpn. J. Lung Can-cer, 44, 167171 (2004).
31) Mitsui S., Okazaki Y., Kawakami Y., Rinsho
derma (Tokyo), 58, 12831286 (2016).
32) Endo K., Akasaka T., Rinsho Derma
(Tokyo), 54, 10401041(2012).
33) Nagasaki A., Takamine W., Takasu N.,Clin.
Nutr., 24, 864865 (2005).
34) Kikuchi Y., Seta K., Ogawa Y., Takayama T., Nagata M., Taguchi T., Yahata K., Clinical Nephrol., 81, 440444 (2014).
35) Ishikawa K., Nadeyama I., Yamashiro N.,
Nishihara K., Tanaka Y., Kise M., Hisada T., J. Jpn. Diabetes Soc., 45, 371 (2002). 36) Suzuki S., Tanaka A., Kishino-Oki Y.,
Mura-ta Y., Kusumoto S., Ishida H., Ando K., Shirai T., Ohnishi T., Sagara H., Takimoto M., J. Jpn. Soc. Respir. Endoscopy, 38, 118 124 (2016).
37) Sanai T., Oochi N., Okuda S., Kobayashi K., Onoyama K., Fujishima M., J. Jpn. Soc. In-ternal Med., 78, 416417 (1989).
Shimokobe T., Hino Y.,J. Jpn. Surg. Assoc., 66, 18991902 (2005).
39) Kato K., Yamashita N., Ooho A., Kajiwara
E., Shimokama T., Kaneshiro M., Jpn. J. Clin. Exp. Med., 87, 16511652 (2010).
40) Ohashi M., J. Jpn. Assoc. Radiol.
Tech-nologists, 51, 908 (2004).
41) Takahashi T., Tsutsumi K., Udagawa S.,
Mine S., Ebara K., Hirata Y., Yokoyama T.,
Ueno M., Kinoshita Y., Matsuda M.,
Hashimoto M., Sawada H., Watanabe G., J. Jpn. Surg. Assoc., 66, 735 (2005).
42) Kawanishi K., Kouzai S.,Journal of Japanese Society of Psychosomatic Obstetrics and Gy-necology, 22, 170175 (2017).
43) Iwata Y., Watanabe M., Tanaka M.,
Proceed-ings of the 17th Congress of the Japanese Soci-ety for Palliative Medicine, Kobe, June 2012, p. 517.
44) Ishihara Y., Kanda J., Tanaka K., Nakano
H., Ugai T., Wada H., Yamasaki R., Kawamura K., Sakamoto K., Ashizawa M., Sato M., Terasako-Saito K., Kimura S., Kikuchi M., Nakasone H., Yamazaki R., Kako S., Nishida J., Watanabe K., Kanda Y., Int. J. Hematol., 100, 607610 (2014).
45) Unno M., Hayakawa S., Matsumoto T.,
Ishiwatari Y., Ono Y., Imamura S., Kato H., Suzuki A., Oda N., Ito M., Nippon Naibunpi Gakkai Zasshi, 80, 316 (2004).
46) Kijima M., Honda H., Hayakawa T., Suzuki
T., Matuda K., Shimooka Y., Shinzo, 43, 10961101(2011).
47) Liao S. C., Chiu T. F., Chen J. C., Lin C. C., Clin. Toxicol. (Phila.), 43, 583585 (2005). 48) Baretta Z., Ghiotto C., Marino D., Jirillo A.,
Ann. Oncol., 20, 14451446(2009).
49) Pinos N., Moreno-Merino S., Congregado
M., Int. J. Surg. Case Rep., 13, 3739 (2015).
50) O'Brien B., Quigg C., Leong T., Eur. J.
Emerg. Med., 12, 257258 (2005).
51) Bromley J., Hughes B. G., Leong D. C.,
Buckley N. A., Ann. Pharmacother., 39, 15661569 (2005).
52) Konstantatos A., Shiv Kumar M., Burrell A., Smith J., BMJ Case Rep., bcr-2017-220814 (2017).
53) Seghers L., Walenbergh-van Veen M., Salome
J., Hamberg P., Neth. J. Med., 71, 496498
(2013).
54) Tazi I., Naˆl H., Mahmal L., Arab J.
Nephrol. Transplant., 5, 54; discussion 55 (2012).
55) Gulia S., Gota V., Kumar S. D., Gupta S.,J. Cancer Res. Ther., 11, 10061008 (2015).
56) Lagman R., Walsh D.,Support. Care Cancer,
11, 232235(2003).
57) Wu M. L., Deng J. F., Wu J. C., Fan F. S.,
Yang C. F., J. Toxicol. Clin. Toxicol., 42, 667671(2004).
58) Naghibi S. M., Ramezani M., Ayati N., Zaka-vi S. R., Daru, 23, 5(2015).
59) Bernardino M., Parmar M. S., CMAJ, 189,
E405E408(2017).
60) Warsame M. O., Gamboa D., Nielsen E. W.,
Tidsskr Nor Laegeforen, 134, 18551857
(2014).
61) Dalal A. K., Harding J. D., Verdino R. J.,
Mayo Clin. Proc., 79, 10651069(2004). 62) Chaiyasit K., Wiwanitkit V., Indian J.
Can-cer, 51, 417 (2014).
63) Mirsattari S. M., Hammond R. R., Sharpe M.
D., Leung F. Y., Young G. B., Neurology, 62, 14081410(2004).
64) Bossaer J. B., Odle B. L., J. Diet. Suppl., 9, 9095(2012).
65) Tisman G., Garcia A.,J. Med. Case Rep., 5, 413 (2011).
66) Santos V. M., Camilo A. G., Souza L. A.,
Souza D. W., Marinho C. S., Monteiro L. M., Acta Medica Iranica, 51, 195198 (2013).
67) Metz D., Weston P., Barker D., BMJ Case
Rep., bcr0720080399 (2009).
68) Peynaud D., Charpiat B., Vial T., Gallavardin M., Ducerf C., Eur. J. Clin. Pharmacol., 63, 721722(2007).
69) Ge J., Tan B. X., Chen Y., Yang L., Peng X. C., Li H. Z., Lin H. J., Zhao Y., Wei M., Cheng K., Li L. H., Dong H., Gao F., He J. P., Wu Y., Qiu M., Zhao Y. L., Su J. M., Hou J. M., Liu J. Y., J. Mol. Med.(Berl.), 89, 595602 (2011).
70) Pillukat M. H., Bester C., Hensel A., Lechten-berg M., Petereit F., Beckebaum S., M äuller K. M., Schmidt H. H., J. Ethnopharmacol., 155, 165170(2014).
71) Feigen M., Aust. NZ J. Med., 14, 6162
72) Naing A., Aaron J., Kurzrock R., Am. J. Med., 123, e1e2 (2010).
73) Cheng C. J., Chen Y. H., Chau T., Lin S. H., Support. Care Cancer, 12, 810812 (2004). 74) Hanselin M. R., Vande Griend J. P., Linnebur
S. A., Ann. Pharmacother., 44, 223224
(2010).
75) Stadlbauer V., Weiss S., Payer F., Stauber R. E., Am. J. Gastroenterol., 103, 24062407 (2008).
76) Bilgi N., Bell K., Ananthakrishnan A. N.,
Atallah E., Ann. Pharmacother., 44, 926928 (2010).
77) Weinrobe M. C., Montgomery B.,New Engl.
J. Med., 345, 12131214 (2001).
78) SchiŠ J. D., Ziecheck W. S., Choi B., Urolo-gy, 59, 444 (2002).
79) Biers S. M., Brewster S. F., BJU Int., 92
(Suppl. 3), e28 (2003).
80) Viswanathan L., Vigersky R. A., Arch.
In-tern. Med., 172, 5860 (2012).
81) Avcin S. L., Pokorn M., Kitanovski L.,
Premru M. M., Jazbec J., Emerg. Infect. Dis., 21, 16741675 (2015).
82) Ledoux D., Labombardi V. J., Karter D.,Int. J. STD AIDS, 17, 280282 (2006).
83) Franko B., Vaillant M., Recule C., Vautrin
E., Brion J. P., Pavese P., Med. Mal. Infect., 43, 171173 (2013).
84) Mehta A., Rangarajan S., Borate U., Bone
Marrow Transplant, 48, 461462 (2013). 85) Coppes M. J., Anderson R. A., Egeler R. M.,
WolŠ J. E., New Engl. J. Med., 339, 846847 (1998).
86) Li Y. J., Lin J. L., Yang C. W., Yu C. C.,
Am. J. Kidney Dis., 46, e125e129 (2005).
87) Wanachiwanawin D., Piankijagum A.,
Chaiprasert A., Lertlaituan P., Tungtrong-chitr A., Chinabutr P., Southeast Asian J. Trop. Med. Public Health, 37, 10991102 (2006).
88) Yan B., Meng X., Shi J., Qin Z., Wei P., Lao L., Integr. Cancer Ther., 13, 161166 (2014). 89) Sinisalo M., Enkovaara A. L., Kivisto K. T., Eur. J. Clin. Pharmacol., 66, 427428(2010). 90) Lee N. J., Fermo J. D.,Pharmacotherapy, 26,
583586(2006).
91) Zhu G., Musumeci F., Byrne P., Curr.
Pharm. Biotechnol., 14, 859863 (2013).
92) Pan K. Y., Lin J. L., Chen J. S., J. Toxicol. Clin. Toxicol., 39, 637639 (2001).
93) Arum S. M., He X., Braverman L. E., New
Engl. J. Med., 360, 424426 (2009).
94) Lowe H., Cusano N. E., Binkley N., Blaner
W. S., Bilezikian J. P., J. Clin. Endocrinol. Metab., 96, 291295 (2011).
95) Goey A. K., Mooiman K. D., Beijnen J. H.,
Schellens J. H., Meijerman I., Cancer Treat. Rev., 39, 773783 (2013).
96) Mathijssen R. H., Verweij J., de Bruijn P., Loos W. J., Sparreboom A., J. Natl. Cancer Inst., 94, 12471249 (2002).
97) Frye R. F., Fitzgerald S. M., Lagattuta T. F., Hruska M. W., Egorin M. J., Clinical Phar-macol. Ther., 76, 323329 (2004).
98) Reif S., Nicolson M. C., Bisset D., Reid M., Kloft C., Jaehde U., McLeod H. L., Eur. J. Clin. Pharmacol., 58, 491494 (2002). 99) Arinaga T., Sata M.,J. Clin. Exp. Med., 248,
4146 (2014).
100) Onji M., Takigawa H., Murata Y., Kojima
Y., Hashimoto N., Hisamochi A., Sumita T.,
Omori S., Murata H., Watanabe M.,
Taniguthi H., Maeda N., Kumagi T., Kang J.-H., Ito T., Aono R., Ayada M., Acta Hepatologica Japonica, 46, 142148 (2005). 101) Koike M., Ohtsu F., Sakakibara J., Goto N.,
Jpn. J. Drug Inform., 14, 134143 (2013). 102) Debelle F. D., Vanherweghem J. L., Nortier J.
L., Kidney Int., 74, 158169 (2008).
103) National Center for Complementary and
In-tegrative Health. ``Colloidal Silver.'':〈https:// nccih.nih.gov/health/colloidalsilver〉, cited 12 April, 2019.
104) National Cancer Institute. ``Complementary and Alternative Medicine for Health Profes-sionals.'': 〈https://www.cancer.gov/about-cancer/treatment/cam/hp〉, cited 12 April, 2019.
105) U.S. Food and Drug Administration. ``Safety Risks Associated with Certain Bulk Drug Sub-stances Nominated for Use in Compound-ing.'':〈https://www.fda.gov/Drugs/Guidance ComplianceRegulatoryInformation/Pharmacy
Compounding /ucm502449.htm 〉, cited 12
April, 2019.
106) Memorial Sloan Kettering Cancer Center.
cancer-care / integrative-medicine / herbs / germanium〉, cited 12 April, 2019.
107) Mirrakhimov A. E.,North Am. J. Med Sci.,
7, 483493 (2015).
108) Helyer L. K., Chin S., Chui B. K., Fitzgerald B., Verma S., Rakovitch E., Dranitsaris G.,
Clemons M.,BMC Cancer, 6, 39 (2006).
109) Sauer H., Wollny C., Oster I., Tutdibi E., Gortner L., Gottschling S., Meyer S., Wien. Med. Wochenschr., 165, 185188 (2015). 110) Chan C. K., Chan M. H., Tse M. L., Chan I.
H., Cheung R. C., Lam C. W., Lau F. L., Clin. Toxicol. (Phila.), 47, 592594 (2009). 111) Krapf R., SchaŠner T., Iten P. X.,Nephron,
62, 351356 (1992).
112) Moyad M. A., Pienta K. J., Montie J. E.,
Urology, 54, 319324(1999).
113) Cesaro S., Chinello P., Rossi L., Zanesco L., Support. Care Cancer, 8, 504505(2000). 114) Horev L., Ramot Y., Klapholz L.,Drug Saf.
Case Rep., 2, 4 (2015).
115) National Cancer Center, Center for Cancer
Control and Information Services. Cancer In-formation Services: 〈 https: // ganjoho.jp / public/index.html〉, cited 12 April, 2019.
116) National Hospital Organization, Shikoku
Cancer Center. ``Gan no Daitai Iryou no Kagakuteki Kensyou ni Kansuru Kenkyu.'': 〈 http: / / www.shikoku-cc.go.jp / hospital / guide/useful/newest/cam/index.html〉, cited 12 April, 2019.